行政院國家科學委員會專題研究計畫 期中進度報告
在 YC-1 誘導含有脂質的 RAW 264.7 巨噬細胞脂質分解時 鈣離子所扮演的角色(1/2)
計畫類別: 個別型計畫
計畫編號: NSC94-2320-B-038-020-
執行期間: 94 年 08 月 01 日至 95 年 07 月 31 日 執行單位: 臺北醫學大學解剖學科
計畫主持人: 陳金山
報告類型: 精簡報告
處理方式: 本計畫可公開查詢
中 華 民 國 95 年 5 月 26 日
中文摘要
本研究在探討含有脂質的 RAW 264.7 巨噬細胞之脂質分解過程中鈣離子所 扮演的角色。以 BAPTA/AM 這種可與鈣離子結合的藥物先處理巨噬細胞無法 抑制 YC-1 所誘導的脂質分解,這可由 Nile red 染色和游離脂肪酸之釋放得 知。以 EGTA 移除細胞外的鈣離子無法壓抑 YC-1 所引起的脂質分解,這顯示 細胞外的鈣離子並不參與 YC-1 所誘導的脂質分解。然而,以 thapsigargin 這種 可穿透細胞並釋出細胞內鈣離子的藥物處理細胞卻可得到和 YC-1 相同的脂 質分解效果,這個結果假設細胞內的鈣離子濃度上升便足以刺激脂質分解。經 由以上的結果,鈣離子濃度之波動在 YC-1 所誘導的脂質分解過程究竟扮演何 種角色仍待進一步的釐清。
關鍵詞
巨噬細胞;脂質分解;YC-1;鈣離子
Abstract
The roles of calcium in lipolysis in lipid-laden RAW 264.7 macrophages are
investigated in this study. Pretreatment of lipid-laden macrophages with BAPTA/AM, a calcium-binding agent, failed to inhibit lipolysis induced by YC-1, as evidenced by Nile red staining and free fatty acid release. Chelating extracellular calcium by EGTA fails to prevent YC-1-induced lipolysis, indicating that extracellular calcium is not involved in lipolysis. In addition, lipolysis induced by YC-1 was not inhibited by blocking calcium release from intracellular store by TMB-8 or dantrolene.
However, treating cells with thapsigargin, a cell-permeable intracellular
Ca
2+
-releasing agent, mimics the lipolytic effect of YC-1, suggesting intracellular increase in [Ca2+
] is sufficient in stimulating lipolysis. Taken together, further studies are required to clarify the exact roles of [Ca2+
] fluctuation in YC-1-induced lipolysis.Keywords
Macrophages; lipolysis; YC-1; calcium
前言
早期粥狀動脈硬化的主要特徵之一為形成脂肪斑,這是含有脂肪的巨噬細胞和 淋巴細胞聚集在內膜所形成。粥狀動脈硬化被認為是一種發炎過程,血管的內皮 細胞在此過程會受到傷害,且單核球會滲入內皮下層而分化成巨噬細胞。這些細 胞會吞入氧化的低密度脂蛋白 (LDL) 而成為含有脂肪滴的泡沫細胞 (reviewed by Ross, 1993 & 1999)。是故,了解巨噬細胞如何形成泡沫細胞以及其內的脂肪
代謝對於認識粥狀動脈硬化的成因與找尋其治療之道就顯得相當重要。
YC-1 是一種 soluble guanylate cyclase (sGC) 的活化劑,其在血小板中可促進 cGMP 的形成而抑制血小板的凝集 (Ko et al., 1994),以及抑制血小板黏附到膠 原上 (Wu et al., 1997)。 但有越來越多的研究顯示 YC-1 在其它細胞亦可透過 cGMP-independent 的方式執行作用。舉例來說,YC-1 可在不影響 cGMP 的含 量下刺激內皮細胞生成一氧化氮 (NO) (Wohlfart et al., 1999)。 YC-1 亦可在不經 由 cGMP 的作用下抑制嗜中性球細胞的功能 (Hwang et al., 2003a),亦或增強肺 泡巨噬細胞表現腫瘤壞死因子-(TNF-) (Hwang et al., 2003b)。除了 cGMP 以 外,YC-1 以可能經由鈣離子的濃度波動而影響細胞的功能。在大白鼠的嗜中性 球中,YC-1 會抑制細胞外的鈣離子進入細胞內 (Wang et al., 2001),且在細胞外 鈣離子濃度下降時,YC-1 刺激內皮細胞生成 NO 的量亦會明顯減少 (Wohlfart et al., 1999)。以上的結果皆顯示,YC-1 亦可能改變鈣離子的濃度而影響細胞的 功能。
傳統上認為在脂肪細胞內造成脂質分解的機制為 cAMP 上升後引起 PKA 的 磷酸化,之後再活化 hormone-sensitive lipase (HSL) 而促進脂質分解 (Egan et al., 1992; Holm et al., 2000)。亦有證據顯示 HSL 會活化 mitogen-activated protein kinase (MAPK) (Greenberg et al., )。然而,在大鼠的腎上腺皮質細胞 (Wang et al.,2000) 和以油酸誘導形成脂肪滴的巨噬細胞中 (Chen et al., 2004),脂質的分解 卻與 cAMP 無關。這些結果暗示不同細胞的脂質分解可能透過不同的訊息傳導 路線所達成,甚或同一種細胞內可能有兩條以上的路線可以刺激脂質分解。支持 這種推測的證據來自最近發現 NO 可能是除了 cAMP 以外,另一個調控脂質分 解的次級訊使 (Andersson et al., 1992; Gaudiot et al., 1998 & 2000; Klatt et al., 2000)。另一個可能的候選者為鈣離子 (Ca
2+
),因為在人類的脂肪細胞中提高細 胞內的 [Ca2+
] 可以抑制 8-bromo-cAMP 所引起的脂質分解 (Xue et al., 2001)。另外在體外的模式中,加入 Ca
2+
亦可促進脂質之分解 (Zangenberg et al., 2001)。在 Manduca sexta 的脂肪體中,Ca
2+
和 cAMP 共同參與 adipokinetic hormone 所誘導的三酸甘油酯之分解 (Arrese et al., 1999)。最後,厚朴 (magnolol) 可經由 導致細胞內[Ca2+
]上升而誘導前脂肪細胞 (preadipocytes) 之脂質分解,而且這個 過程會被 calcium/calmodulin-dependent protein kinase (CaMK) 的抑制劑抵消掉 (Huang et al., 2004)。以上的結果皆證實 Ca2+
在脂質分解的過程中卻實扮演一定 的角色。在上一個計畫(NSC 93-2320-B-038- 038)的研究中,個人發現 YC-1 會促進 泡沫細胞的脂質分解;但令人意外的是,YC-1 在泡沫細胞中卻不會造成 cGMP 或 NO 含量的變化 (事實上,泡沫細胞內根本測不到 cGMP 的活性)。個人亦 嘗試探討 YC-1 是否會改變其它訊息傳遞途徑 (如 MAPK 或 tyrosine
kinase),但皆徒勞無功。有鑒於有報告指出 YC-1 會影響 [Ca
2+
],且後者又可能 參與之質分解之過程(見上述),再加上初步的結果顯示抑制 [Ca2+
] 可抵消 YC-1 所促進的脂質分解作用,故個人想在接下來的計畫中專注於研究 YC-1 是否以及如何透過 [Ca
2+
] 而刺激脂質分解。研究方法 A. 細胞培養
將購自 American Type Culture Ccollection (Rockville, MD) 的 RAW 264.7 巨 噬細胞培養在含有 10% 胎牛血清 (FBS)、100 units/ml penicillin、及 100g/ml of streptomycin 的 DMEM 中。在探討脂質分解時,首先將巨噬細胞培養在含有 70
g/ml 油酸的培養液中 16 小時,接著再以各種藥物處理。
B. Nile red 染色
欲觀察脂肪滴時,先以 10% 的福馬林 (in PBS) 將巨噬細胞固定 10 分鐘,
接著再以最終濃度為 10 g/ml 的 Nile red (Sigma) 染色 (Greenspan et al., 1985)。再以 PBS 清洗後,便將細胞蓋片以便觀察。
C. 測定脂肪酸的釋放
分析巨噬細胞釋放出脂肪酸的量可以確定細胞是否進行脂質分解。在藥物處理 後收集細胞外的培養液,接著以測定脂肪酸的分析試劑 (Roche, Mannheim, Germany) 根據廠商所提供的方法決定細胞外的游離脂肪酸。
D. 統計分析
統計結果的呈現方式為來自三次實驗的 meanSE,且用 Student’s t test 加以計 算。P 值小於 0.05 代表具有統計上的差異性。
結果與討論
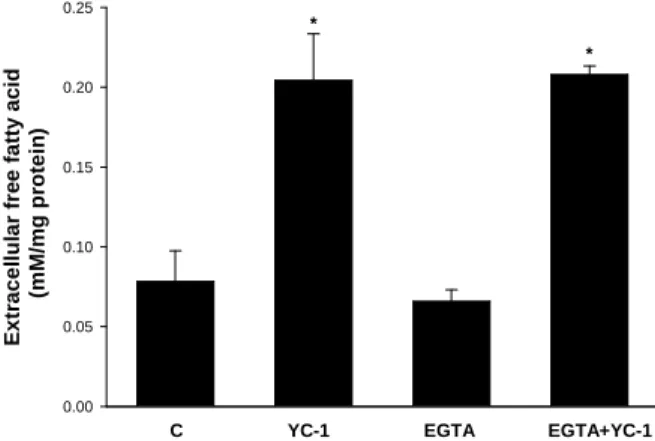
以 60M YC-1 處理含有脂肪滴的巨噬細胞 6 小時後,接著以 Nile red 作脂肪 滴的染色可發現絕大部份細胞內皆已無脂肪滴的存在,亦即細胞已進行脂質分解 (Fig. 1A)。為了確定 YC-1 是否透過升高鈣離子的濃度而造成脂質分解,所以我 們先以 60M BAPTA/AM 處理細胞,藉以螯合細胞內的鈣離子,之後再用 YC-1 誘導脂質分解。結果顯示,BAPTA/AM 並無法抑制 YC-1 所引起的脂質分解作用 (Fig. 1B)。在 60M YC-1 刺激 6 小時後的細胞中,其細胞外的游離脂肪酸含量 約為未經 YC-1 處理者的 7 倍 (Fig. 2),這顯示細胞經由 YC-1 處理後大量進行脂 質分解。但這種脂質分解作用並無法被 BAPTA/AM 所抑制 (Fig. 2)。以 1mM EGTA 螯合細胞外的鈣離子亦無法去除 YC-1 所誘導的脂肪滴分解作用 (Fig.
3),這個結果顯示細胞外的鈣離子並未參與 YC-1 所促進的脂質分解效應。另一 方面,我們利用 thapsigargin (20M) 這種可刺激鈣離子由細胞內的儲存所釋放 出來的藥物直接處理細胞,結果顯示其可以造成與 YC-1 單獨作用所產生的大量 脂質分解 (Fig. 4)。
綜合以上的結果,鈣離子在脂質分解中所扮演的角色仍未明朗。很多的證據皆
顯示鈣離子在脂質分解的過程中扮演一定的角色,但其對支職分解的作用卻呈現 不一致的結果。舉例而言, [Ca
2+
] 上升可抑制 8-bromo-cAMP 所引起的脂肪細 胞之脂質分解 (Xue et al., 2001)。但在另外一個體外模式中,加入 Ca2+
卻會促進 脂質之分解 (Zangenberg et al., 2001),且在 Manduca sexta 的脂肪體中,Ca2+
和 cAMP 共同參與 adipokinetic hormone 所誘導的三酸甘油酯之分解 (Arrese et al., 1999)。另一個支持鈣離子參與脂質分解的證據來自厚朴可經由導致細胞內[Ca2+
] 上升而誘導前脂肪細胞之脂質分解。至於在 YC-1 對鈣離子的影響方面,Wang 等人 (2001) 發現 YC-1 可抑制 fMLP 所刺激的細胞外鈣離子進入,而此作用可能可以抑制 fMLP 所誘導的 respiratory burst (Wang et al., 2002)。但在嗜中性球細胞中,YC-1 並不會影響 fMLP 所造成 的細胞內鈣離子上升,而指示加速細胞內的鈣離子回到細胞內的儲存所 (Hwang et al., 2003a)。看來,YC-1 對鈣離子濃度的影響或許有細胞的特異性。
以上的結果皆是經由鈣離子的抑制劑或促進劑來研究其在 YC-1 刺激脂質分解 的角色,但並未真正觀察到細胞經由 YC-1 處理後概離子濃度的波動是否產生變 化。在未來一年的研究中,我將利用 spectrophotometer 直接測量 YC-1 是否會造 成鈣離子的濃度改變。配合共軛焦距顯微鏡可實際觀測到細胞內的鈣離子波動狀 況,如此更能釐清上述的實驗結果。
參考文獻
Andersson, K., Gaudiot, N., Ribiere, C., Elizalde, M., Giudicelli Y., and Arner, P.
(1999). A nitric oxide-mediated mechanism regulates lipolysis in human adipose tissue in vivo. Br. J. Phamacol. 126: 1639-1645.
Arrese, EL., Flowers, MT., Gazard, JL., and Wells, MA. (1999) Calcium and cAMP are second messengers in the adipokinetic hormone-induced lipolysis of triacylglycerols in Manduca sexta fat body. J. Lipid Res. 40: 556-564.
Chen, JS., Chen, YL., Greenberg, AS., Chen,YJ., and Wang, SM. (2004) Magnolol stimulates lipolysis in lipid-laden RAW 264.7 macrophages. J. Cell. Biochem. (In press).
Egan, JJ., Greenberg, AS., Chang, MK., Wek, SA., Moos, MC Jr., and Londos, C.
(1992) Mechanism of hormone-stimulated lipolysis in adipocytes: translocation of hormone-sensitive lipase to the lipid storage droplet. Proc. Natl. Acad. Sci. USA.
89: 8573-8541.
Gaudiot, N., Jaubert, AM., Charbonnier, E., Sabourault, D., Lacasa, D., Giudicelli, Y., and Ribiere, C. (1998). Modulation of white adipose tissue lipolysis by nitric oxide. J. Biol. Chem. 273: 13475-13481.
Gaudiot, N., Ribiere, C., Jaubert, AM., and Giudicelli, Y. (2000). Endogenous nitric oxide is implicated in the regulation of lipolysis through antioxidant-related effect.
Am. J. Physiol. Cell Physiol. 279: C1603-C1610.
Greenberg, AS., Shen, WJ., Muliro, K., Patel, S., Souza, SC., Roth, RA., and Jraemer, FB. (2001). Stimulation of lipolysis and hormone-sensitive lipase via the extracellular signal- related kinase pathway. J. Biol. Chem. 30:45456-45461.
Holm, C., Österlund, T., Laurell, H., and Conteras, JA. (2000) Molecular
mechanisms regulating hormone-sensitive lipase and lipolysis. Annu. Rev. Nutr.
20: 365-393.
Huang, SH., Shen, WJ., Yeo, HL., and Wang, SM (2004) Signaling pathway of magnolol- stimulated lipolysis in sterol ester-loaded 3T3-L1 preadipocytes. J.
Cell. Biochem. 91: 1021-1029.
Hwang, TL., Hung, HW., Kao, SH., Teng, CM., Wu, CC., and Cheng, SJS. (2003a) Soluble guanylyl cyclase activator YC-1 inhibits human neutrophil functions through a cGMP- independent but cAMP-dependent pathway. Mol. Pharmacol.
64: 1419-1427.
Hwang, TL., Guh, JH, Wu, CC., and Teng, CM. (2003b) Potentiation of tumor necrosis factor-expression by YC-1 in alveolar macrophages through a cGMP-independent pathway. Biochem. Pharmacol. 66: 149-156.
Klatt, P., Cacho, J., Crespo, MD., Herrera, E., and Ramos, P. (2000). Nitric oxide inhibits isoproterenol-stimulated adipocyte lipolysis through oxidative inactivation oftheβ-agonist. Biochem. J. 351: 485-493.
Ko, FN., Wu, CC., Kuo, SC., Lee, FY., and Teng, CM. (1994). YC-1, a novel activator of platelet guanylate cyclase. Blood. 84: 4226-4233.
Ross, R. (1993) The pathogenesis of atherosclerosis: a perspective fro the 1990s.
Nature. 362: 801-809
Ross, R. (1999) Atherosclerosis—an inflammatory disease. New Eng. J. Med. 340:
115-126.
Wang, JP., Chang, LC., Huang, LI., and Kuo, SC. (2001) Inhibition of extracellular Ca
2+
entry by YC-1, an activator of soluble guanylyl cyclase, through a cyclic GMP- independent pathway in rat neutrophils. Biochem. Pharmacol. 62: 679-684.Wang, SM, Lee, LJ, Huang YT, Chen, JJ, and Chen YL. (2000). Magnolol stimulate steroidogenesis in rat adrenal cells. Br. J. Phamacol. 131: 1172-1178.
Wohlfart, P., Malinski, T., Ruetten, H., Schindler, U., Linz, W., Schoenafinger, K., Strobel, H., and Wiemer, G. (1999) Release of nitric oxide from endothelial cells stimulated by YC-1, an activator of soluble guanylyl cyclase. Br. J. Pharmacol.
128: 1316-1322.
Wu, CC., Ko, FN., and Teng, CM. (1997) Inhibition of platelet adhesion to collagen by cGMP-elevating agents. Biochem. Biophys. Res. Commun. 231: 412-416.
Xue, B., Greenberg, AG., Kraemer, FB, and Zemel, MB. (2001) Mechanism of intracellular calcium ([Ca
2+
]i
) inhibition of lipolysis in human adipocytes. FASEBJ. 15:2527-2529.
Zangenberg, NH., Müllertz, A., Kristensen, HG., and Hovgaard, L. (2001) A
dynamic in vitro lipolysis model. I. Controlling the rate of lipolysis by continuous addition of calcium. Eur. J. Pharm. Sci. 14: 115-122.
圖片及說明
Fig. 1. 顯示 BAPTA/AM 對 YC-1 刺激脂質分解的影響之 Nile red 染色結果。含 有脂肪的細胞在 (A) 沒有 或 (B) 有 60M BAPTA/AM 前處理 30 分鐘,接著 再用 60M YC-1 作用 6 小時以誘導脂質分解。處理後的細胞經過固定後便用 Nile red 加以染色。Bar = 20m。
C YC-1 YC-1 + BAPTA
Extracellularfreefattyacid(mM/mgprotein)
0.0 0.5 1.0 1.5 2.0 2.5
* *
Fig. 2. BAPTA/AM 對 YC-1 所誘導的脂質分解之影響。含有脂肪的細胞經過 YC-1 或 BAPTA/AM 加上 YC-1 作用後,收集培養液做為分析細胞外脂肪酸的含量。
C, control。有 BAPTA/AM 前處理的細胞其細胞外脂肪酸的含量與未加
BAPTA/AM 者並無顯著不同 (P>0.05)。* P<0.05 compared to control。
C YC-1 EGTA EGTA+YC-1
E x tr a c e ll u la r fr e e fa tt y a c id (m M /m g p ro te in )
0.00 0.05 0.10 0.15 0.20 0.25
*
*
Fig. 3. EGTA 對 YC-1 所誘導的脂質分解之影響。含有脂肪的細胞經過 YC-1 或 EGTA 加上 YC-1 作用後,收集培養液做為分析細胞外脂肪酸的含量。C, control。
有 EGTA 前處理的細胞其細胞外脂肪酸的含量與未加 BAPTA/AM 者相比並無顯 著不同 (P>0.05)。* P<0.05 compared to control。
C YC-1 thapsigargin
Extracellularfreefattyacid(mM/mgprotein)
0.0 0.5 1.0 1.5 2.0 2.5 3.0
*
*
Fig. 4. Thapsigargin 對脂質分解之影響。含有脂肪的細胞經過 20M thapsigargin 或 YC-1 作用 6 小時後,收集培養液做為分析細胞外脂肪酸的含量。C, control。
Thapsigargin 所誘導的脂質分解程度與 YC-1 所誘導者相近。* P<0.05 compared to control。