國 立 交 通 大 學
應 用 化 學 系
碩 士 論 文
唑啉/線性聚乙烯亞胺雙團聯共聚物製
備奈米基因載體之研究
聚
Novel gene delivery vectors based on diblock copolymers of
poly(2-ethyl-2-oxazoline) and linear polyethylenimine
學 生:姜厚任
指導教授:莊祚敏 博士
共同指導教授:薛敬和 博士
摘要
本研究是以具酸鹼應答性及親水性之雙團聯共聚物 poly(2-ethyl- 2-oxazoline)-block-poly(2-ethyl-2-oxazoline-co-ethylenimine)(PEOz-b- P(EOz-co-EI)) 作為基因載體。此雙團聯共聚物之 P(EOz-co-EI) 鏈段 為陽離子高分子,可與 DNA 經靜電作用結合成聚複合體(polyplex); PEOz 則提供酸鹼應答性及親水性,一方面藉由細胞內酸鹼值的變 化,使聚複合體解離進而釋放 DNA 至細胞中,另一方面提高聚複合 體的穩定性。在高分子之合成上首先以開環聚合得到末端帶有硫醇 (sulfhydryl)之 PEOz,再將 PEOz 水解後得到 P(EOz-co-EI),經由末端 官能基之間形成雙硫鍵(disufide) 使此二高分子結合為雙團聯共聚 物。同時利用不同分子量及水解比例之 P(EOz-co-EI) 來探討雙團聯 共聚物中 P(EOz-co-EI) 鏈段對雙團聯共聚物所造成的影響。並和未 導 入 PEOz 之 P(EOz-co-EI) 與 分 枝 聚 乙 烯 亞 胺 (branched polyethylenimine, B-PEI) 作一比較。 實驗結果顯示 B-PEI 的高分子/基因重量比例 (P/D) 在 1 倍以上 能將 DNA 完全包覆,P(EOz-co-EI) 則需 6 倍以上,而雙團聯共聚物 PEOz-b-P(EOz-co-EI) 在 P/D 比為 8 倍以上時能達到包覆效果。此外 若 P(EOz-co-EI) 之水解比例由 76% 提高為 89% 則 P(EOz-co-EI) 或 雙團聯共聚物包覆 DNA 所需要的 P/D 比可減少 2 倍。由粒徑分析得 知雙團聯共聚物所製備的聚複合體大小約為 200 nm,且不論是在純 水或 0.15M NaCl 水溶液中皆沒有凝集的現象,反之 B-PEI 與 P(EOz-co-EI) 聚複合體在 0.15M NaCl 的環境下會凝集成大顆粒。從 界面電位的分析中,得到 B-PEI 與 P(EOz-co-EI) 聚複合體之表面電 荷 會 因 P/D 比 的 增 加 而 從 陰 離 子 轉 變 為 陽 離 子 , 然 而PEOz-b-P(EOz-co-EI) 聚複合體在達到特定 P/D 比之後即維持電中 性。將 PEOz-b-P(EOz-co-EI) 聚複合體分別置於 pH 4.5 到 pH 7 的緩 衝溶液中測試其對酸鹼的應答性,經由電泳分析後得知 P(EOz-co-EI) 鏈段分子量為 5000 或 5700 之聚複合體在 pH 5.5 以下的酸性環境中 會解離並釋放 DNA,若 P(EOz-co-EI) 鏈段之分子量增加為 8600 或 9700,則在 pH 5.5 時聚複合體不會解離。 由細胞毒性的試驗中得知在高分子濃度為 10 mg/ml 時,B-PEI 與 P(EOz-co-EI) 之細胞存活率分別為 7% 和 30% ,雙團聯共聚物則 有 60% 的存活率,此外高分子中 P(EOz-co-EI) 鏈段之水解比例由 76% 提高為 89% 或分子量由 5700 增加為 9700,皆會降低約 10~20% 的細胞存活率。在細胞轉染上 B-PEI 及水解比例為 88% 或 89% 的 P(EOz-co-EI) 聚複合體皆能使細胞表現螢光基因,其發光強度約在 6000~8000 , 於 酸 鹼 應 答 性 試 驗 中 能 在 pH 5.5 下 解 離 的 PEOz-b-P(EOz-co-EI) 聚複合體有約 3000~6000 的發光強度,而相對 應之 P(EOz-co-EI) 聚複合體也約在 3000~6000,反之不會解離的聚複 合體之發光強度約為 2000~4000,但相對應之 P(EOz-co-EI) 則有 3000~7000 的發光強度。 綜合以上的實驗結果,雙團聯共聚物 PEOz-b-P(EOz-co-EI) 相較 於 P(EOz-co-EI),不僅細胞毒性更低,所形成的聚複合體較為穩定, 且在具酸鹼應答的特性下能保有與 P(EOz-co-EI) 相當的細胞轉染能 力,因此本研究所合成之雙團聯共聚物為優良的陽離子高分子基因載 體,故具有應用在基因治療的潛力。
Abstract
In this study, non-viral vectors based on pH-responsive and hydrophilic diblock copolymers poly(2-ethyl-2-oxazo-line)-block- poly(2-ethyl-2-oxa-zoline-co-ethylenimine) (PEOz-b-P(EOz-co-EI)) had been synthesized. P(EOz-co-EI) was a cationic polymer, it could form complexes called “polyplexes” after mixing with DNA; PEOz was a pH-responsive and hydrophilic polymer which not only made the polyplexes more stable, but also facilitated the DNA releasing from the polyplexes under the pH value variations in cells. The PEOz and the P(EOz-co-EI) with varying molecular weight and percentage hydrolysis was obtained by cationic ring-opening polymerization and hydrolysis of the PEOz, respectively. Diblock copolymers were prepared via coupling the two kinds of polymers with disulfide bond. Furthermore, The characteristics of the diblock copolymers and their polyplexes also compared with those of P(EOz-co-EI) or commercially available branched polyethylenimine (B-PEI).
From the result of gel retardation assay, the diblock copolymer could completely condense plasmid DNA at a polymer/DNA weight ratio (P/D) of above 8, whereas P/D ratios of above 2 and 6 were required to B-PEI and P(EOz-co-EI) for DNA condensation, respectively. By increasing the percentage hydrolysis of P(EOz-co-EI), the P/D ratios of the diblick copolymer and P(EOz-co-EI) needed to ensnare DNA were both decreased. After analyzing particle sizes and zeta potentials, polyplexes formed by the diblock copolymers had diameter around 200 nm. With raising the P/D ratios, the polyplexes from negatively charged would convert into neutral particles, and they were stable both in pure water and
physiological condition such as 0.15M NaCl solution. However, the polyplexes made with B-PEI or P(EOz-co-EI) and plasmid DNA could possess positive charge on their surface at high P/D ratio, but they also showed aggregation under 0.15M NaCl solution. To investigate whether the polyplexes of the diblock copolymers could response to pH variation, they were incubated in various buffer solutions and then analyzed using gel retardation assay. The result indicated that those polyplexes would dissociate when the pH value of buffer solution below 5.5, however, the extent of dissociation depends on the percentage hydrolysis and molecular weight of P(EOz-co-EI) segment.
The in vitro experiments were shown that the toxicity of diblock copolymer is relatively lower than B-PEI and P(EOz-co-EI), but when the percentage hydrolysis or molecular weight of P(EOz-co-EI) segment increased, it would reduce the viability of the cells. The transfection efficiency of B-PEI was the highest, and P(EOz-co-EI) with high percentage hydrolysis also showed high transfection efficiency. Diblock copolymers which could dissociate under acidic condition with transfection levels as high as the corresponding P(EOz-co-EI), but the other diblock copolymers mediated less efficient transfection.
In conclusion, the diblock copolymers were not only less toxic, but the polyplexes formed were also more stable compared to P(EOz-co-EI). Besides, they could dissociated under acidic environment to facilitate DNA releasing. Thus, the transfection efficiency was enhanced to a level as high as P(EOz-co-EI). Therefore, the diblock copolymer was a better candidate for gene delivery than other cationic polymers often used.
誌謝
承蒙指導教授薛敬和老師及莊祚敏老師無論是在實驗上遭遇的 各種問題或是實驗方式的規劃,皆提供了精闢的解答與建議,使本論 文得以順利完成。而在學業或研究上悉心的指導、思考能力的訓練與 待人處世上的教誨,讓我獲益匪淺、受用不盡,僅致上最深的謝意。 由衷感謝朱一民老師與劉英麟老師等口試委員在論文上的細心 指正,並給予諸多寶貴的建議與想法,使本研究能更為完整。此外也 感謝清大生科楊嘉鈴教授實驗室林樹熙學長在蟲螢光試劑的配製與 螢光判讀儀使用上所提供的協助,使實驗得以順利進行。 感謝劉席瑋學長在我剛進實驗室時所給予的指導與鼓勵,使我獲 益良多。此外特別感謝王朝輝學長對於本研究的啟蒙和教導,以及駱 俊良學長在實驗上提供的幫助,讓我能克服許多的困難,在此我由衷 的感謝。感謝朱立文、賴瑞陽、蔡協致、林哲平與張博荀學長在各方 面所給予的協助,以及王竣鴻、林克閩、游一成及鄭經豪等同學彼此 的相互關懷和激勵。感謝黃俊凱、林聖傑、余大全及施慶芳等學弟妹 為研究生活所平添的樂趣。 最後我要感謝父母的全力支持,在遭受挫折時能給予我鼓勵與勇 氣,讓我能順利完成學業。再次感謝這兩年求學過程中所認識的師 長、前輩及實驗室的大夥們,祝各位能擁有美好的未來。目 錄
聚 唑啉/線性聚乙烯亞胺雙團聯共聚物製備奈米基因載體
之研究
一、緒論………...…..…1 1-1 前言………..……….………..….….…….1 1-2 研究動機與目的………..………..3 二、文獻回顧………...….……....5 2-1 病毒載體………..….…..5 2-1-1 反轉錄病毒………....…5 2-1-2 腺病毒……….….…..7 2-1-3 腺相關病毒………...…7 2-2 非病毒載體………...……..9 2-2-1 非病毒載體的轉染過程..……….….9 2-2-2 微脂粒……….……….11 2-2-3 陽離子高分子………....…..14 2-3 聚乙烯亞胺………...17 2-3-1 分枝聚乙烯亞胺………....…..18 2-3-2 線性聚乙烯亞胺………..…....20 2-4 共聚合高分子……….……21 2-4-1 聚乙二醇共聚合高分子………...….21 三、實驗方法………24 3-1 實驗藥品與儀器………...25 3-1-1 實驗藥品………..…...….25 3-1-2 實驗儀器………..…...….263-2 高分子合成………...28 3-2-1 藥品純化………...….28 3-2-2 名詞縮寫………...…..….28 3-2-3 親水性高分子 Poly(2-ethyl-2-oxazoline)之合成……....28 3-2-4 P(EOz-co-EI)之合成……….……...29 3-2-5 PEOz-b-P(EOz-co-EI)雙團聯共聚物之合成……...….30 3-3 高分子結構鑑定與分析………...33 3-3-1 ¹H-NMR 分析……….33 3-3-2 元素分析………...….33 3-3-3 UV 光譜分析………...…...33 3-3-4 GPC 分析………...….33 3-4 聚複合體之基本性質………..………...34 3-4-1 菌株培養與 DNA 純化及聚複合體製備………34 3-4-2 膠體電泳………..………...34 3-4-3 粒徑與界面電位………...………...35 3-4-4 酸鹼應答………..….….…..35 3-5 高分子與聚複合體之生物性質……….……….….36 3-5-1 高分子之細胞毒性……….……….36 3-5-2 聚複合體細胞轉染………...36 四、結果與討論………...38 4-1 合成 PEOz-b-P(EOz-co-EI) 雙團聯共聚物………….…...38 4-1-1 ¹H-NMR 結構鑑定………...….40 4-1-2 元素分析結果………...…...44 4-1-3 UV 光譜分析結果………...…...45 4-1-4 GPC 分子量鑑定………...……46
4-2 基本性質分析……….………...49 4-2-1 質體 DNA 複製與萃取………....49 4-2-2 聚複合體膠體電泳分析………...…...50 4-2-3 聚複合體粒徑與界面電位分析……….…...…..55 4-2-4 聚複合體酸鹼應答性分析……….…….62 4-3 生物性質分析………..………....…..64 4-3-1 高分子細胞毒性分析結果………..64 4-3-2 聚複合體轉染效率分析………...…...68 五、結論………...……76 六、參考文獻………78
圖目錄
圖 1-1. 雙團聯共聚物與 DNA 形成聚複合體之示意圖……….4 圖 2-1. 反轉錄病毒載體感染細胞途徑………...6 圖 2-2. 非病毒載體遞送基因的過程……….10 圖 2-3. 各種脂質分子結構……….13 圖 2-4. 各種陽離子高分子結構……….14 圖 2-5. Chitosan 的化學結構………16 圖 2-6. 聚乙烯亞胺的各種形式與其所屬單體……….17 圖 2-7. 分枝聚乙烯亞胺的聚合機構……….18 圖 2-8. poly(2-ethyl-2-oxazoline)加酸水解為線性聚乙烯亞胺……….20 圖 2-9. 核殼結構示意圖……….22 圖 3-1. PEOz-SAc 之合成流程圖………31 圖 3-2. PEOz-Py 之合成流程圖………...31 圖 3-3. P(EOz-co-EI)之合成流程圖………32 圖 3-4. PEOz-b-P(EOz-co-EI)之合成流程圖………..32 圖 4-1. PEOz-SAc 寡聚合物之¹H-NMR 光譜圖……….42 圖 4-2. PEOz-Py 寡聚合物之¹H-NMR 光譜圖………42 圖 4-3. p(EOz-co-EI)寡聚合物之¹H-NMR 光譜圖……….43 圖 4-4. 高分子 P(EOz-co-EI)之¹H-NMR 光譜圖………43 圖 4-5. 雙團聯共聚物 PEOz-b-P(EOz-co-EI)之¹H-NMR 光譜圖...44 圖 4-6. PEOz-Sac 與 PEOz-Py 在甲醇溶液下之 UV 吸收光譜 (溶液濃 度為 1 mM)………...45 圖 4-7. P(EOz-co-EI)與雙團聯共聚物 PEOz-b-P(EOz-co-EI)在甲醇溶 液下之 UV 吸收光譜 (溶液濃度為 0.5 mM)……….46圖 4-8. LI-76 與 4kI-76 之凝膠滲透層析圖……….48 圖 4-9. 蟲螢光酶編碼質體 (luciferase encoding plasmid) pUHC-13-3 之圖譜………..49 圖 4-10. B-PEI 及 P(EOz-co-EI)聚複合體之膠體電泳分析 (圖中第一排 數字代表 P/D 比)...52 圖 4-11. 質 體 DNA 的 結 構 (a) 鬆 弛 (relaxed) (b) 超 螺 旋 (supercoiled)...53 圖 4-12. PEOz-b-P(EOz-co-EI)聚複合體之膠體電泳分析 (圖中第一排 數字代表 P/D 比)………..54 圖 4-13. B-PEI 聚複合體在不同溶液中之粒徑及界面電位…………..56 圖 4-14. LI-76 聚複合體在不同溶液中之粒徑及界面電位…………...57 圖 4-15. LI-89 聚複合體在不同溶液中之粒徑及界面電位…………...57 圖 4-16. LII-76 聚複合體在不同溶液中之粒徑及界面電位………….58 圖 4-17. LII-88 聚複合體在不同溶液中之粒徑及界面電位………….58 圖 4-18. 4kI-76 聚複合體在不同溶液中之粒徑及界面電位………….60 圖 4-19. 4kI-89 聚複合體在不同溶液中之粒徑及界面電位………….60 圖 4-20. 4kII-76 聚複合體在不同溶液中之粒徑及界面電位…………61 圖 4-21. 4kII-88 聚複合體在不同溶液中之粒徑及界面電位…………61 圖 4-22. LI-76 與 PEOz-b-P(EOz-co-EI)聚複合體在各種 pH 値之酸鹼應 答分析圖 (圖中第一排數字代表 pH 値)………63 圖 4-23. 活細胞中 MTT 的代謝反應……….64 圖 4-24. B-PEI 與 P(EOz-co-EI)在不同濃度下之 HeLa 細胞存活率 (n = 6)………...66 圖 4-25. LI-76 與 PEOz-b-P(EOz-co-EI)在不同濃度下之 HeLa 細胞存活 率 (n = 6)……… 67 圖 4-26. 螢火蟲螢光酵素與螢光素之發光反應………...68
圖 4-27. BSA 蛋白質濃度檢量線………70 圖 4-28. B-PEI 聚複合體之轉染效率及蛋白質產量 (n = 3)………….72 圖 4-29. P(EOz-co-EI) 聚複合體之轉染效率及蛋白質產量 (n = 3)...73 圖 4-30. PEOz-b-P(EOz-co-EI) 聚複合體之轉染效率及蛋白質產量 (n = 3)………74 圖 4-31. DNA、P(EOz-co-EI) 及 PEOz-b-P(EOz-co-EI) 聚複合體最佳 轉染效率與蛋白質產量之比較 (n = 3)……….75
表目錄
表 3-1. PEOz 之合成條件………..………29 表 3-2. P(EOz-co-EI)之合成條件……….………30 表 4-1. 各高分子之元素分析結果與理論值之比較…….………….44 表 4-2. PEOz 之數量平均分子量及分子量分佈………….…………47 表 4-3. P(EOz-co-EI)之水解率及分子量……….…………47 表 4-4. PEOz-b-P(EOz-co-EI)之組成與分子量……….………..47 表 4-5. 各種高分子包覆 DNA 所需要的最少 P/D 比例………59一、緒論
1-1. 前言
近代醫學發展讓人類對於疾病有深入的了解,並促進新藥的開 發,造福無以數計的病患。然而在眾多已知的疾病中,諸如血友病、 唐氏症、地中海型貧血等遺傳性疾病,目前並無藥物可根治。但隨人 類在分子生物學上的進展及對遺傳物質的了解日深,促使以基因作為 藥物的構想被提出,並用來對付遺傳性疾病或因後天性基因異常所導 致的疾病,為傳統療法無法醫治之疾病帶來希望,使得基因治療成為 深具潛力的新興醫學領域。 基因治療指的是將DNA或RNA送入基因異常細胞之細胞核中, 取代或修補不正常之基因,乃至於提供新的功能性基因,使細胞能自 行合成蛋白質或胜肽,以回復細胞正常生理功能而達到治療甚至預防 疾病的目的1。早期認為單獨的核酸無法直接進入細胞中,會因在體 內遭遇到血清中或細胞內的酵素分解,以及本身結構之負電性磷酸根 與 同 樣 帶 負 電 之 細 胞 膜 互 相 排 斥 。 近 年Budker 等 人 發 現 質 體 DNA(plasmid DNA)經由靜脈注射亦會有基因表現,卻容易累積在特 定器官中,無法送往標的部位2。因此治療性基因要進入目標細胞核, 需一有效的遞送系統或基因之載體 (vector),載體的特性將影響到最 終基因表現效果,是以載體之利用是基因治療中最重要的一環,因而 有學者稱之為基因治療的阿奇里斯腱 (Achilles heel)3。 目前被廣為研究的基因載體主要分為病毒性(viral vector)與非病 毒性(non-viral vector)兩類。病毒載體是將病毒的致病基因剔除後,再 把功能性基因置入病毒顆粒中,利用病毒本身具有之感染力把基因送 入標的細胞內來達到治療的目的。1990 年 9 月美國國家衛生院的Anderson與Blaese等人將正常的ADA(adenosine deaminase)基因殖入 病患的淋巴細胞中,使其免疫系統恢復正常,被視為成功的基因治療 首例4。病毒載體雖有較高的基因轉殖(transduce)效果,但卻容易引起 身體的免疫反應,另在病毒基因插入感染細胞的基因中時,可能造成 插入性突變,導致癌症產生之安全性問題。於 1999 年的實驗中,一 名 十 八 歲 患 有 鳥 胺 酸 氨 甲 基 移 轉 酵 素 缺 乏 症 (ornithine transcarbamylase)的男孩,以帶有正常基因之腺病毒進行治療,在 4 天後死亡,此事件使病毒載體於安全性上之顧慮限制了其運用價值。 一般用於基因轉染(transfection)的非病毒性方法有以下數種:(1) 磷酸鈣共沉澱(calcium phosphate);(2)顯微注射(microinjection);(3) 基因槍(gene gun);(4)超音波(ultrasound);(5)電穿孔(electroporation); (6)微脂粒(liposome);(7)陽離子高分子(cationic polymer)等。第一項技 術利用磷酸鈣在細胞膜外創造一化學環境,使DNA 能附著於細胞表 面進而被吞噬進細胞內;顯微注射及基因槍是分別將基因及包覆基因 的金微粒注射入細胞核或細胞中;超音波與電流可增加細胞膜的通透 性,增加DNA 進入細胞內進行表現的機會;陽離子高分子則透過和 DNA 之間產生靜電作用力包覆 DNA,不會受到核酸分解酶的破壞, 因此能在體內輸送至標的細胞中。目前非病毒載體以微脂粒與陽離子 高分子載體的研究為主流,由於此類載體結構可改變,又適用於體內 (in vivo)基因治療,為極具潛力的基因輸送系統。
1-2. 研究動機與目的
陽離子高分子為一種聚胺類,具有相當高的電荷密度,與DNA 所形成之聚複合體比和微脂粒及DNA形成之脂複合體有較緊密的結 構甚至較小的體積。在陽離子高分子中,分枝聚乙烯亞胺(branched polyethylenimine,B-PEI)為極具研究價值的聚合物型基因載體,有文獻 指出分枝聚乙烯亞胺比陽離子微脂粒有更好的基因遞送能力5。分枝 聚乙烯亞胺結構上包含有一級胺、二級胺與三級胺,氮原子的密度較 其他聚合物高,因此能有效的包覆DNA,同時具有相當高的轉染效 率。除了B-PEI之外,線性聚乙烯亞胺(linear polyethylenimine, L-PEI)
也同樣有相當高的基因傳輸效果,但其細胞毒性則比B-PEI低6。基於 線 性 聚 乙 烯 亞 胺 在 基 因 載 體上 的 應 用 潛 力 , 本 研 究 將 聚 唑 啉 poly(2-ethyl-2-oxazoline) 與 其 水 解 產 物 — 線 性 聚 乙 烯 亞 胺 (poly(2-ethyl-2-oxazoline-co-ethylenimine), P(EOz-co-EI))經由共價鍵 結為雙團聯共聚物PEOz-b-P(EOz-co-EI)作為基因載體。PEI本身具水 溶性,但與DNA結合為聚複合體(polyplex)後會變為疏水,容易產生 凝集(aggregation),因此利用親水性高分子PEOz來增加聚複合體的水 溶性,延長在體內的循環時間。 PEOz除了具親水性外,尚有良好的生物相容性。此外PEOz有酸 鹼應答的特性,可用於藥物制放的設計上,作為智慧型藥物載體,針 對細胞內酸鹼值的變化來達到藥物標的(targeting)效果7。另外文獻指 出,基因載體遞送基因至細胞內後,所包覆的核酸釋出與否是基因轉 染過程中重要的關鍵8。因此本研究希望藉由PEOz的酸鹼應答效應, 能有助於聚複合體在細胞中釋放DNA,進而增加轉染效率。 將 DNA 與雙團聯共聚物混合後,帶正電的 P(EOz-co-EI)鏈段經
由靜電作用與帶負電的DNA 結合在一起,並因電性中和後疏水性提
高而聚集為核心,親水性的PEOz 則圍繞在其外,構成所謂的核殼結
構(core-shell structure)如圖 1-1 所示。
二、文獻回顧
2-1. 病毒載體
病毒是在漫長自然演化過程中存活下來沒有細胞結構的最小、最 簡單之生命寄生形式。它們通常可以高效率地進入特定類型的細胞, 表達自身蛋白並產生新的病毒顆粒。1960-1970 年間,由於對一些產 生變性的病毒有了進一步的了解,科學家開始嘗試將病毒作為載體, 將外來基因送入一個特定的細胞內,因此,病毒是首先被改造的基因 治療載體。科學家刪除病毒中與致癌、致毒和複製相關的基因片段, 再加上外源基因,成為具治療效果的病毒載體。此經過遺傳修飾的病 毒可將外源治療基因帶入人體細胞,而不會使人致病。病毒由於是以 感染宿主的方式生存,因此一般皆有相當高的感染力,基因表現能力 也 較 強 , 使 各 種 病 毒 載 體 諸 如 腺 病 毒(adenovirus) 、 腺 相 關 病 毒 (adeno-associated virus)及反轉錄病毒(retrovirus)被廣泛地研究。然而 病毒載體要實際用於基因治療之前,仍存在著許多的困難待解決,如 可能重組成新病毒;引發宿主的發炎及免疫反應;導致癌症的產生; 所能攜帶的基因容量有限制,以及不易大量生產等。 2-1-1. 反轉錄病毒 反轉錄病毒為一帶有套膜(envelope)的小型RNA病毒,其含有兩 條單股RNA基因體,基因體上有三個與病毒複製、包裝有關的基因 (gag、pol、env),末端為長重複序列(long terminal repeat, LTR),LTR 可控制病毒基因體嵌入宿主染色體中,也具有表現病毒基因所需要的 啟動子(promoter)、加強子(enhancer)序列。反轉錄病毒感染的方式是2-1)9,使其能將所含的RNA釋出並進入細胞內,經由反轉錄酵素的作 用轉錄成雙股DNA,此雙股DNA會與核蛋白(nucleoprotein)結合形成 嵌入前複合體(preintegration complex, PIC),隨後此複合體會進入細胞 核內,將DNA隨機嵌入宿主染色體中,產生穩定且持續性的表現。 反轉錄病毒載體是將上述之三種基因移除,取代以外來DNA, 因所移除基因與複製有關,故病毒在進入宿主細胞後,已不能製造新 病毒。反轉錄病毒雖能將基因嵌入宿主染色體中,但其只有在細胞進 行有絲分裂,核膜分解時才能進入細胞核中,因此感染對象限於能分 裂的細胞,使其無法用於神經細胞及心肌細胞的基因治療。由於病毒 基因是隨機嵌入,有可能會阻隔或打斷正常基因序列,引發突變導致 細胞癌化或產生有複製能力的野生型病毒(replication competent virus, RCV)。此外反轉錄病毒在活體內非常脆弱,會被活化之補體系統去
活化。雖然有約60%已核准的臨床實驗使用反轉錄病毒,但在成為一
良好的基因載體之前,必須克服以上種種的不利因素10。
2-1-2. 腺病毒 腺病毒為一種不具套膜之DNA病毒,其內含長度約為 36Kb之線 性雙股DNA,由一個二十面體的capsid所包覆11。目前已知有 40 多種 血清型(serotype)的人類腺病毒,主要會造成人類呼吸道的感染。腺病 毒載體常用於原位(in situ)及體內的基因遞送,以治療癌症或纖維囊腫 (cystic fibrosis),而為了使病毒載體在細胞內無法複製產生新的腺病 毒,會剔除腺病毒基因體內與複製相關的E1 基因,同時移除與抑制 宿主免疫反應相關但非必要的E3 基因,增加容納外來基因的空間。 由於腺病毒本身結構大,能夠攜帶較大的外來DNA,此外,其感染 的細胞不僅限於分裂與否,皆具有極高的感染效率,宿主範圍相當廣 泛,因此可應用在許多不同的細胞上。 腺病毒無法如反轉錄病毒將基因嵌入染色體中,而是以episome 的形式存在染色體外,因無法進行複製,在經過細胞不斷分裂後,病 毒DNA可能因而消失,無法再表現,所以腺病毒載體僅有短暫性的 基因轉殖效果。腺病毒載體的另一嚴重缺點為病毒的蛋白與外殼會引 起強烈的發炎和免疫反應12,使被腺病毒載體感染的細胞在短期內就 被消滅掉,進而降低基因表現的效果。然而人類與自然存在的腺病毒 接觸以久,大多都已具有抗體,使腺病毒難以成為理想的基因載體。 2-1-3. 腺相關病毒 腺相關病毒是一小型無套膜的單股DNA病毒,為一種巴爾伐病 毒(parvovirus),雖名為腺相關病毒,但和腺病毒並不同,對人類並不 具致病能力13。腺相關病毒基因體的兩端為反轉錄終端重複序列
須保留在病毒載體內,而基因體中間部分有cap及rep兩種基因,可被 外來基因所取代。腺相關病毒一般需有其他病毒(如腺病毒或單純皰 疹病毒(herpes simplex viral))共同存在下,才能自行複製基因體,若在 缺少其他病毒的存在下,腺相關病毒便會將本身的基因體嵌入宿主細 胞的染色體中14。野生型(wild type)的腺相關病毒在感染宿主細胞後, 藉由DNA兩端的序列與其基因產物,可將自身的DNA嵌入人體第十 九對染色體上,而隨著宿主的DNA一起複製、增殖及表現,直到宿 主細胞被另一類病毒感染時才停止。 腺相關病毒除不具致病性外,不論細胞是否處於分裂的狀態下, 皆可利用它來感染標的細胞,因此宿主範圍相當廣泛。加上不會如腺 病毒引發宿主強烈的免疫反應,為目前最有發展潛力的病毒載體。然 而因生產腺相關病毒載體需耗費大量人力,所能攜帶的外來基因大小 又受到限制,如AAV 的基因體外加 DNA 長度最多僅有 4.5kb,因而 降低了其在基因治療上的價值。
2-2. 非病毒載體
雖病毒載體有優異的基因轉殖能力,但基於各種病毒自身的安全 及免疫問題,利用非病毒載體作為基因治療的工具有其必要性,因而 目前已發展出許多獨特的非病毒載體系統,其中以微脂粒與陽離子高 分子這兩種載體的研究最廣泛。在非病毒載體的研究中,所使用的核 酸 通 常 是 以 質 體DNA(plasmid DNA)為主,其上有一段報導基因 (reporter gene),報導基因經轉錄及轉譯後所產生的蛋白質可透過簡易 的方式量側,因此可作為評估轉染效率的依據。微脂粒包覆DNA所 形成之複合物稱脂複合體(lipoplex),陽離子高分子與DNA之複合物則 稱為聚複合體(polyplex)15。非病毒載體雖不如病毒的轉殖效率高,但 具有低毒性、低成本、穩定性佳、使用簡單、可大量製備、不會引起 免疫反應等諸多優勢,而透過利用病毒遞送基因的機制,改良非病毒 載體的結構以增加其轉染效果亦是可行的,因此在基因治療的應用上 具有無限的潛力。 2-2-1. 非病毒載體的轉染過程 非病毒載體要將基因自細胞外送至細胞核中進而表現出蛋白 質,牽涉到許多複雜的程序,包括: 1. 與細胞表面接觸 2. 內吞作用(internalization) 3. 進入核內體(endosome) 4. 自核內體脫離 5. 與載體分離 6. 進入細胞核如圖 2-2 所示16,當脂複合體或聚複合體經由擴散作用至細胞 外,通常會與細胞表面的物質作用,以進入細胞內。細胞膜上有許多 的膜蛋白(membrane proteins),包括醣蛋白(glycolproteins)和蛋白多醣 (proteoglycans),這些帶負電的蛋白質可調控物質的進出。因此若複 合體帶有正電,與細胞膜接觸時會和這些蛋白質產生靜電作用,有利 於複合體進入細胞中。 圖2-2. 非病毒載體傳輸基因的過程16 複合體與細胞膜接觸後,會經內吞作用進入細胞,依不同的表面 性質,其作用的方式有液相胞飲(fluid phase endocytosis)及吸附胞飲 (adsorption endocytosis)。一般物質可透過液相胞飲進入細胞,因此不 論是不帶電或帶正電的複合體皆能以此方式到達細胞內,但帶正電的 複合體也可與膜蛋白產生作用,再以吸附胞飲的方式進入細胞中。
複合體藉由胞飲作用進入細胞後被包裹在核內體內,接著酸鹼值 會逐漸下降至pH 5.5 左右再與溶小體(lysosome)融合(fusion),溶小體 內的酵素與酸性的環境會造成DNA 的分解,進而失去作用。因此複 合體要能成功的進行轉染,必須在核內體與溶小體融合前脫離,即使 非病毒載體具有保護DNA 不受外在環境影響的能力,還是需要逃出 溶小體才能達到轉染的目的。複合體進入細胞質後,要將所包覆的基 因釋出,被釋放的基因必須通過核孔(nuclear pore)進入細胞核中,經 過轉錄(transcription)與轉譯(translation)等程序最後產生標的蛋白質。 2-2-2. 微脂粒 微脂粒最初是在 1965 年,由 Bangham 等人將卵磷脂(lecithin)自 蛋黃中萃取出來,再使其分散於水中所發現。微脂粒為磷脂質分子所 組成的微小囊泡,此脂質為一兩性(amphiphiles)分子,即一端為親水 性的極性頭基,另一端為疏水性的長碳鏈,因此具有表面活性。兩性 脂質分子在水溶液中時,會因親疏水性產生規則排列,形成膠體粒 子,如微胞(micelle),在不同的條件下(如濃度、溫度、分子構造等), 其型態也各異。微脂粒具有中空的球型構造,是由一或數層脂質雙層 膜(lipid bilayer)所圍繞而成,此脂質雙層為兩磷脂質之疏水端向內聚 集,親水端裸露在外的層狀排列,與生物細胞膜類似,因此微脂粒可 作為細胞膜間作用與膜蛋白質的系統模式。 基於微脂粒的特殊結構,吸引科學家嘗試將其作為藥物載體,如 親水性藥物可被包覆在內部的水相環境中,油溶性藥物則負載於脂質 雙 層 中 , 再 加 上 微 脂 粒 為 天 然 的 物 質 , 具 有 良 好 的 生 物 相 容 性 (biocompatible)與生物可降解性(biodegradable),所以被廣泛地運用於 藥 物 制 放 系 統 。 在 基 因 載 體 的 應 用 上 ,Loke利用陰離子微脂粒
(anionic liposome)來遞送反義寡核酸(antisense oligonucleotide)而得到 不錯的體外(in vitro)轉染效果,但陰離子微脂粒需要鈣離子的輔助以 增加包覆DNA的效率。另一方面,脂複合體進入細胞的主要途徑為 胞飲作用,由於溶小體內的酵素具有分解脂複合體的能力,因此複合 體 必 須 在 溶 小 體 融 合 前 脫 離 。Litzinger 等 人 以 DOPE(dioleoyl phosphatidylethanolamine)為基材形成酸鹼敏感性(pH sensitive)的微脂 粒來遞送基因17,DOPE在酸性環境下能和核內體的脂質雙層膜融 合,進而將DNA釋放至細胞質中,達到基因轉染的目的。然而,酸 鹼敏感型微脂粒在血漿或是血清中的安定性不佳,且能釋出的DNA 僅佔約10%,大部分的DNA仍會留在核內體中並遭到分解18。 在1987 年 Felgner 利用陽離子脂質 DOTMA(N-[1-(2,3-dioleoyl-
oxy)propy1]-N,N,N-trimethyl ammonium chloride)所構成的微脂粒作為 基因載體,並對COS-7 等細胞株進行轉染,結果顯示陽離子微脂粒的
轉染能力優於其他的微脂粒19,因此目前微脂粒基因載體的研究皆以
陽離子微脂粒為基礎。陽離子脂質如DOTMA、DOTAP(1,2-dioleoyl-
20
3-trimethyl-ammonium propane) 、DOGS(diocta-decylamidoglycyl sper-
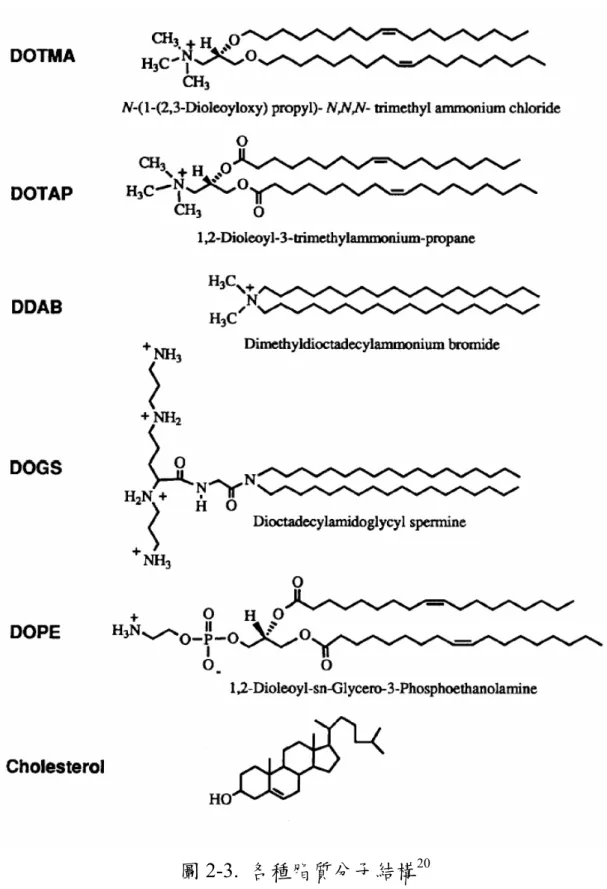
21、DOSPA(2,3-dioleyl-oxy-N-[2(spermine-carboxamido)ethyl]-N, mine) N-di-methyl-1-propanaminium trifluoroacetate)等皆具有良好的基因傳 輸能力 (圖 2-3),其中DPPE與DOSPA在單一分子上有多個胺基,因 而帶有較多的正電荷,對DNA的包覆力亦較好,對許多的哺乳動物 細胞有較高的轉染效率。但陽離子微脂粒在體外實驗中顯示出對細胞 有 很 強 的 毒 性 22 , 容 易 與 血 液 中 的 白 蛋 白 (albumin) 、 GAG(glycosaminoglycan)產生凝集,以及抑制免疫反應的調節等,為 陽離子微脂粒在應用上必須謹慎面對的問題。
2-2-3. 陽離子高分子 陽離子高分子通常是聚胺(polyamine)或是單體含有胺基(amino group)的高分子,在特定的環境下,如pH値低於胺之pKa的水溶液中, 氮原子會因質子化(protonation)而帶有正電荷,能與DNA結構中帶負 電的磷酸根經靜電作用而形成聚複合體。圖 2-4 為各種常見的陽離子 高分子23,隨著結構以及分子量的不同,各種陽離子高分子有相異的 轉染能力。然而,即使是同一種高分子,在製備聚複合體的條件有所 改變,如高分子和DNA混合的順序、比例、均勻程度,高分子與DNA 溶液的濃度、離子強度,以及聚複合體的大小、電性、表面特性等, 皆會影響到最終的轉染效率。 圖2-4. 各種陽離子高分子結構23
DEAE-dextran(diethylaminoethyl-dextran)是最早用於基因治療上 的陽離子高分子。dextran是具水溶性的葡萄聚醣,其結構上有許多的 羥基(hydroxyl group)可供改質(見圖 2-4)。由於dextran分子不具任何胺 基提供帶正電的能力,因此必須將dextran上的羥基以化學反應取代為 DEAE(diethylaminoethyl) group,由於DEAE上的三級胺會帶正電,因 此可與DNA形成聚複合體。DEAE-dextran除了本身可當基因載體外, 有研究顯示在DEAE-dextran的幫助下,可提高腺病毒基因載體進入細 胞的效率約 45 倍24。Yamaoka等人發現帶電官能基DEAE與dextran的 比 例 會 影 響 聚 複 合 體 在 基 因 轉 染 上 的 表 現 , 實 驗 結 果 顯 示 DEAE-dextran的細胞毒性隨著DEAE含量的減少而降低,轉染的效果 也跟著變差25。然而,DEAE-dextran的轉染效率低,細胞毒性高,以 及不具生物可分解性,使其在實際應用上倍受限制。 除了DEAE-dextran,另一種常用於基因載體的聚醣為chitosan。 chitosan是chitin去乙醯化(deacetylation)的產物,具有低毒性、良好的 生物相容性及生物可分解性,在食品及醫藥方面有廣泛的用途。 chitosan不同於dextran,其本身已具有一級胺的官能基(圖 2-5)26,因 此不需改質即可與DNA形成聚複合體。chitosan將DNA包覆住後,能 夠保護DNA不被核酸水解酵素(DNase)分解。文獻顯示27,chitosan的 分子量及帶正電的單體含量會影響聚複合體的性質。為了得到穩定的 聚複合體,帶電的單體必須佔有超過 65%的比率,而分子量在 30kDa 到170kDa之間,能得到最佳的轉染效果,若在 1.2kDa或分子量過大, 則 基 因 轉 染 表 現 不 佳 。 MacLaughlin 等 人 利 用 pH-sensitive endosomolytic peptide與聚複合體進行轉染,發現可增加基因的表現
28,顯示可能由於chitosan在pH5.5 下的緩衝能力(buffering capacity) 不
圖2-5. Chitosan的化學結構26 PLL(poly(L-lysine))為目前運用最廣泛的一種陽離子高分子載 體,從結構上可視為氨基酸lysine的聚合物,因此具有良好的生物可 降解性(biodegradable)。在pH 7.4 下,PLL側鏈上的一級胺會帶正電, 提供充足的能力去包覆DNA,研究顯示在許多不同濃度的鹽溶液 中,PLL皆能與DNA形成聚複合體29。但PLL和DNA作用之後,可能 由於電性中和,使聚複合體變為疏水性,所以有凝集的傾向,且容易 吸附血液中的蛋白質,進而被免疫系統辨識並清除。除了會產生凝集 外,PLL本身具有相當的細胞毒性。PLL與DNA所形成的複合體經胞 飲作用後,會被侷限在核內體甚至溶小體內,因此通常會利用添加 chloroquine幫助聚複合體脫離核內體,來增加PLL聚複合體的轉染效 率30。雖然作用機制還不是很清楚,推測可能是因chloroquine具有在 核內體酸化的過程中,緩衝pH値下降的能力,同時也能幫助基因脫 離載體。
2-3. 聚乙烯亞胺
聚乙烯亞胺為一種常見的聚胺高分子,用於紙張的生產過程中, 以及洗髮精的製造和水的純化,近年在基因載體的研究上顯示出良好
的 轉 染 效 果 。 依 不 同 的 聚 合 方 式 聚 乙 烯 亞 胺 有 分 枝(branched
polyethylenimine, B-PEI)及線性(linear polyethylenimine, L-PEI) 兩種
形式(圖 2-6)31。PEI的化學結構可視為兩碳原子與一氮原子所組成之 重複排列,即每三個原子就有一個氮原子,相較於其他陽離子高分 子,其氮原子密度最高,換句話說,電荷密度亦是最大的,因此能將 大型的DNA分子如數百奈米的質體DNA,濃縮(condense)成數十奈米 的聚複合體粒子32,同時能保護DNA不受核酸水解酵素的降解。高電 荷密度雖然有助於DNA的包覆,但也導致較強的毒性,不利於實際 上的應用。 圖2-6. 聚乙烯亞胺的各種形式與其所屬單體31
2-3-1. 分枝聚乙烯亞胺 B-PEI是以aziridine為單體進行陽離子開環聚合得到的高分子(圖 2-7)33,通常利用質子酸為起始劑,於聚合反應進行時,成長中的高 分子鏈會與另一條高分子鏈作用而形成分枝,若分子鏈末端發生back biting,則在末端會形成一圓環而終止聚合反應。 圖2-7. 分枝聚乙烯亞胺的聚合機構33 從結構上來看,B-PEI同時具有一級、二級和三級胺,各佔約 25%、 50%、25%,這些胺基在不同的pH値下會產生質子化,進而提供B-PEI 在酸性環境下極佳的緩衝能力。對於B-PEI在酸性溶液中的緩衝能
力,Behr等人提出著名的質子海綿理論(proton sponge hypothesis)34,
指出當聚胺類的聚複合體進入核內體後,可以緩衝核內體持續酸化的 環境使pH不易降低,造成氫離子不斷湧入,基於需保持電中性的緣 故,氯離子也隨之進入,造成核內體中氫離子與氯離子的濃度過高。 為了平衡濃度梯度,大量的水隨之進入,使核內體的體積不斷的膨脹 最終導致破裂,釋出內含物質。除此之外,氫離子的湧入也可能讓高 分子內質子化的胺基增加,使分子內的靜電斥力變大,以至聚複合體
的體積擴增,進而撐破核內體,進入細胞質中。因此一般認為有緩衝 能力的陽離子高分子皆具脫離核內體的特性,較其他非病毒型載體容 易進入細胞內,而有較高的基因轉染效率。Boussif等人證明B-PEI的 轉染效率和陽離子微脂粒DOGS相當,但比PLL高,然而在某些細胞 上甚至有優於DOGS的表現。Pollard等人則將多種不同的複合體注射 入細胞核或細胞質內,得到B-PEI不論是在細胞質或細胞核都有轉染 的能力,反之陽離子微脂粒DOGS與DOTAP幾乎沒有轉染效果5,突 顯出B-PEI在基因遞送上的高效率。
B-PEI 與 DNA 結合之聚複合體會隨著 B-PEI 和 DNA 的比例、濃 度、所用溶劑的離子強度、混合的順序的差異而形成不同的大小及形 狀。在適當的比例下,B-PEI 能將 DNA 完全包覆住,形成電中性的 聚複合體,但此電中性的複合體會凝集,不利於基因的遞送。因此通 常以較多的B-PEI 與 DNA 混合,來得到帶正電的複合體,不但可透 過靜電斥力使彼此分散,也有利於與負電性的細胞膜作用,增加進入 細胞的機會。若溶劑的離子強度和質體DNA 溶液的濃度較低時,可 得到大小在20-40 nm 之間的圓環狀(toroidal)聚複合體,但在高離子強 度或與生理環境相同的離子強度(0.15M NaCl)下,凝集亦會發生,形 成大小數百奈米的複合體顆粒。 B-PEI分子量對聚複合體也有影響。Godbey等人在體外實驗中發 現,分子量越大轉染效率也越好(70kDa>10kDa>1.8kDa),而分子量 小 於 1.2kDa 則 沒 有 轉 染 效 果35。Fisher 等 人 則 是 得 到 大 分 子 量 (1616kDa)較小分子量(11.9kDa)的PEI有較強的細胞毒性,同時轉染效 率 較 低36。而Abdallah等人從體內實驗分子量越小轉染效率越佳 (25kDa>50kDa>800kDa)37。顯示當分子量增加時,會提高轉染效率 以及細胞毒性,但細胞毒性過高時則使轉染效率降低。
2-3-2. 線性聚乙烯亞胺
L-PEI 可以利用將高分子 poly(2-substituted-2-ozaxoline)進行加酸 水解使側鏈丙醯基(propionyl group)斷裂來得到,如 poly(2-ethyl-2- oxazoline),如圖 2-8。 N H2 C C C H2 C H2 O H3C Acid Hydrolysis n N H H2 C C H2n 圖2-8. poly(2-ethyl-2-oxazoline)加酸水解為線性聚乙烯亞胺 L-PEI在結構上僅有二級胺,於pH 4.5 到pH 9 之間才具有緩衝作 用,因此在程度上不如B-PEI。目前在非病毒載體的研究上大多數皆 採用B-PEI,但文獻指出L-PEI不僅有較低的毒性,同時能達到和B-PEI 相同甚至更好的轉染效率38,39。如同B-PEI,L-PEI聚複合體在形成上, 溶劑的離子強度對粒徑大小也有相對的影響。文獻顯示在 5%的 glucose水溶液中,聚複合體的粒徑約在 100 nm左右,而隨著高分子 比例的增加,粒徑會逐漸縮小,但當溶劑為 0.15M NaCl時,粒徑增 大至 1μm,且不受高分子與DNA比例的影響40。Wightman等人也觀 察到類似的現象,當複合體製備於 75mM NaCl緩衝溶液中時,粒徑 會隨著時間而越來越大,最終達到數μm的大小,所以L-PEI相較於 B-PEI更易受離子強度的影響,造成聚複合體的不穩定。 L-PEI 的轉染效率及細胞毒性與水解比例有很大的關係,通常水 解比例越高,基因轉染的效果越好,但毒性也越強,且在高濃度的情 況下,仍會造成大量的細胞死亡。
2-4. 共聚合高分子
如前所述,電中性的聚複合體由於少了靜電排斥力而逐漸凝集, 除此之外也可能因電荷被中和的關係使疏水性大增,助長凝集的程度 進而沉澱,對於基因遞送而言是非常不利的因素。若增加陽離子高分 子對DNA的比例,使聚複合體帶有正電,雖可解決上述的凝集發生, 卻引發更高的細胞毒性,此外在體內傳輸時,會和血液中帶負電的蛋 白質或是補體(complement)系統的蛋白質彼此吸附,導致被吞噬細胞 (phagocyte)吞食或被內質網(reticuloendothelial systems)清除,以及和 紅血球作用而造成肺栓塞(pulmonary embolism)41。 共聚合高分子(copolymer)可以結合數種高分子的優點,因此透過 陽離子高分子與其他高分子形成共聚合高分子,可用以改善聚複合體 的許多缺點。將陽離子高分子與親水性高分子合成為共聚合高分子, 不但可增加聚複合體水溶性,延長在體內循環的時間,並能遮蔽 (shielding)表面的正電荷,以及形成立體障礙,防止蛋白質的貼附。 2-4-1. 聚乙二醇共聚合高分子 目 前 最 常 用 於 共 聚 合 高 分 子 的 親 水 性 高 分 子 為 聚 乙 二 醇 (poly(ethylene glycol), PEG)。PEG 是一種不帶電的聚醚(polyether)類 高分子,有良好的水溶性、生物相容性及生物可降解性,因此廣泛的 應用在醫藥及化妝品產業中。幾乎所有的陽離子高分子皆可與PEG結合為共聚合高分子,包括 PLL 、 PEI 和 pDMAEMA(Poly(2-(dimethylamino)ethyl methacrylate)) 等。當共聚和高分子與DNA混合後,會形成具核殼結構(core-shell structure)的聚複合體,如圖 2-9,其外層(殼)為親水性的PEG,內部(核)
則是陽離子高分子與DNA所組成,因此有外圍親水中心疏水的特 性,以及良好的結構穩定性42。 圖2-9. 核殼結構示意圖42 在共聚合高分子的合成上,可利用PEG為macroinitiator聚合陽離 子高分子的方式,得到雙團聯共聚物(diblock copolymer);或是以 coupling reaction將陽離子高分子與PEG接合在一起,形成雙團聯共聚 物或接枝共聚物(graft copolymer)。Kataoka等人以第一種方式得到 PEG-b-PLL雙團聯共聚物43,在包覆DNA後得到大小約 50 nm的聚複 合體粒子,而負的界面電位證實已形成核殼結構,並具有和PLL一樣 的DNA包覆力及抵抗核酸水解酶的能力。不同於PLL,溶劑的離子強 度對PEG-b-PLL聚複合體的大小沒有影響,顯示PEG確實有穩定聚複 合體的功效。此外Kim等人則利用coupling reaction得到PEG-g-PLL接 枝共聚物44。相較於PLL,PEG-g-PLL對DNA的包覆能力稍差,但轉 染效率卻有5-10 倍的增加,並大幅降低對細胞的毒性。 由於B-PEI具有優異的轉染效率,但過高的毒性使其在應用上備
受限制,因而有許多研究者將其與PEG接合成共聚物來改善此項缺 點。Choi等人合成具不同PEG/PEI比例的PEG-g-PEI接枝共聚物,並 探討其與DNA形成聚複合體後之水溶性、細胞毒性及轉染效率45。結 果顯示PEG-g-PEI聚複合體在水溶性上優於PEI聚複合體,細胞毒性則 明顯降低,且PEI接上越多PEG會使聚複合體越容易溶在水中,同時 對細胞的毒性也越低。在轉染效率方面,PEG-g-PEI聚複合體對細胞 的效率皆遠低於PEI聚複合體,推測是因PEG所形成的立體障礙降低 了聚複合體與細胞表面作用的機會,導致進入細胞的效果不佳。 Petersen 等 人 將 一 系 列 具 不 同 PEG 分 子 量 及 接 枝 程 度 的 PEG-g-PEI作為探討的對象46,在物理化學性質方面,發現除了PEG 分子量小於5kDa的共聚物之外,聚複合體粒徑在 0.15M NaCl的離子 強度下都相當安定,並能減少紅血球的凝集,而隨著PEG分子量與接 枝程度的增加,界面電位會逐漸下降。另外不同分子量的PEG對於PEI 的DNA包覆能力影響不大,但相較於未接枝PEG的PEI,PEG-g-PEI 需要較多的量以包覆DNA,顯示PEG會阻礙PEI與DNA的結合。在對 細胞的測試中,當PEG的接枝率增加,對細胞的毒性就越低,但同樣 也會使轉染效率下降。Frisch等人以PEG/L-PEI團聯共聚物作為基因載 體同樣得到水溶性上升、細胞毒性及轉染效率降低的結果47。 因此,利用親水性高分子 PEG 對陽離子高分子改質可以增加聚 複合體親水性,遮蔽陽離子高分子之正電荷達到穩定聚複合體的作 用,此外尚能降低陽離子高分子的細胞毒性。然而對於 PEI 而言, PEG/PEI 共聚物轉染效率不佳仍限制了其應用價值。
三、實驗方法
本研究在實驗的部分設計如下圖,詳細情形於下列各節描述之。高分子PEOz 合成 P(EOz-co-EI)合成 雙團聯共聚物PEOz-b-P(EOz-co-EI)合成 聚複合體製備 高分子結構鑑定與分析 基本性質 生物性質 膠體電泳分析 粒徑與表面電位 酸鹼應答 基因轉染 細胞毒性 質體DNA 1H-NMR、EA、UV、GPC
3-1. 實驗藥品與儀器
3-1-1. 實驗藥品(1). ethyl-2-oxazoline, EOz (ACROS) (2). Acetonitrile, ACN (TEDIA)
(3). Methyl p-toluenesulfonate (ALDRICH) (4). Potassium thioacetate, KSAc (ACROS) (5). 2,2'-dithiodipyridine (ACROS)
(6). Acetone (TEDIA)
(7). Ammonia in methanol solution, 7N (ACROS) (8). Dichloromethane, DCM (TEDIA)
(9). Hydrochloric acid, 35 % (聯工) (10). Sodium hydroxide (聯工) (11). Methanol (TEDIA)
(12). Ethanol, 99 % (NASA)
(13). Dulbecco’s modified Eagle’s medium, DMEM (GIBCO) (14). 3-(4,5-dimethylthyazol-2-yl)-2,5-diphenyl tetrazolium bromide,
MTT (ICN)
(15). Trypsin 0.25 % in EDTA (GIBCO) (16). Trypan blue stain 0.4 % (GIBCO) (17). Fetal bovine serum, FBS (GIBCO) (18). Terrific broth, TB (Scharlau)
(19). 含有質體 DNA—pUHC-13-3 之大腸桿菌為清華大學生命科學系 楊嘉鈴教授所提供。
(20). Agarose (Vegonia)
(22). Ethidium bromide, EtBr (GeneMark) (23). Ampicillin, Amp (Gerbu)
(24). 10 kb DNA ladder (Violet)
mega)
25000 (ALDRICH)
-1-2. 實驗儀器
) 旋轉蒸發器 (Rotary vaccum evaporator:EYELA)
rophotometer,
(3) romatography, GPC:
(4) sizer 3000HSa:Malvern
(5) 儀 (UV/Vis spectrophotometer, UV/Vis:Perkin
(6) bing, MWCO 6000-8000, 10000:Spectrum
(7) Reader:Awareness Stat Fax 2100)
(25). Loading dye 6X (Violet) (26). Protein assay (Bio-Rad) (27). Luciferase kit #E1531 (Pro
(28). Plasmid Maxiprep Kit (Lambda) (29). Branched poly(ethylenimine) ,Mw:
3
(1
(2) 核磁共振光譜儀 (Nuclear magnetic resonance spect NMR:Varian UnityInova 500 nmr) 凝膠滲透層析儀 (Gel permeation ch Machery-Nagel NUCLEOGEL) 粒徑分析儀與界面電位儀 (Zeta Instruments Ltd) 紫外光/可見光光譜 Elmer Lamda 2S) 透析膜 (Dialysis tu Medical Industries) 96 孔盤酵素判讀儀 (Elisa
(8) 迷你電泳槽 (Mini Electrophoresis Apparatus MP-100:Major Science)
紫外光箱
(9) (UV light box:Major Science)
odel 6100 CO2)
ild MPS 51S)
儀 (Luminometer:Wallac 1420 Multilabel Counter,
(17) bath:TKS)
-2. 高分子合成
3-2-1.藥品純化
(10) 無菌抽風櫥 (Laminar flow:海天) (11) 恆溫培養箱 (Incubator:NAPAC M
(12) 倒立式相位差顯微鏡 (Phase contrast microscopy:W (13) 離心機 (Centrifuge:KA-1000, KUBOTA) (14) 高壓滅菌鍋 (Autoclave:TM-329, Tomin) (15) 血球計數盤 (16) 螢光強度判讀 Perkin Elmer) 恆溫振盪水槽 (Shake
3
(1). EOz : 以 calcium hydride 除水,減壓蒸餾後使用。 (2). ACN : 以 calcium hydride 除水,蒸餾後使用。
3-2-2. 名詞縮寫
(1). PEOz-SAc:末端官能基為 thioacetate 之 poly(2-ethyl-2-oxazoline) (2). PEOz-Py:末端官能基為 2-pyridyldithio 之 poly(2-ethyl-2-oxazoline) (3). P(EOz-co-EI):Poly(2-ethyl-2-oxazoline-co-ethylenimine) (4). PEOz-b-P(EOz-co-EI):Poly(2-ethyl-2-oxazoline)-block-poly(2- ethyl-2-oxazoline-co-ethylenimine) 3-2-3. 親水性高分子 Poly(2-ethyl-2-oxazoline)之合成 (1). PEOz-SAc 之合成 高 分 子 合 成 流 程 如 圖 3-1 。 取 單 官 能 基 起 始 劑 Methyl p-toluenesulfonate(MeOTs)置入 250mL 雙頸圓底燒瓶內,其中一瓶口 以血清塞封住,另一瓶口裝設冷凝管並連至真空管線,經除氣三次後 導入無氧無水之乾燥氮氣,以乾淨玻璃針筒注入 3 倍單體體積的乙 腈 。 在 油 浴 下 升 溫 至 100℃ 迴 流 , 待 溫 度 穩 定 後 , 再 將 2-ethyl-2-oxazoline(EOz)加入瓶中反應,反應條件如表 3-1。反應完成 後,以冰浴冷卻至 0℃並在氮氣下加入 potassium thioacetate(KSAc)固 體,在室溫下均勻攪拌反應2-3 天,使其末端導入 thioacetate(SAc)官 能基。將產物用旋轉蒸發器濃縮後溶解於丙酮,流過矽膠層析管柱以 除去鹽類和雜質,反覆進行數次。最後,用乙醚進行再沉澱純化產物, 再以真空烘箱乾燥24 小時後得到棕色的固體產物,產率約 90 %。
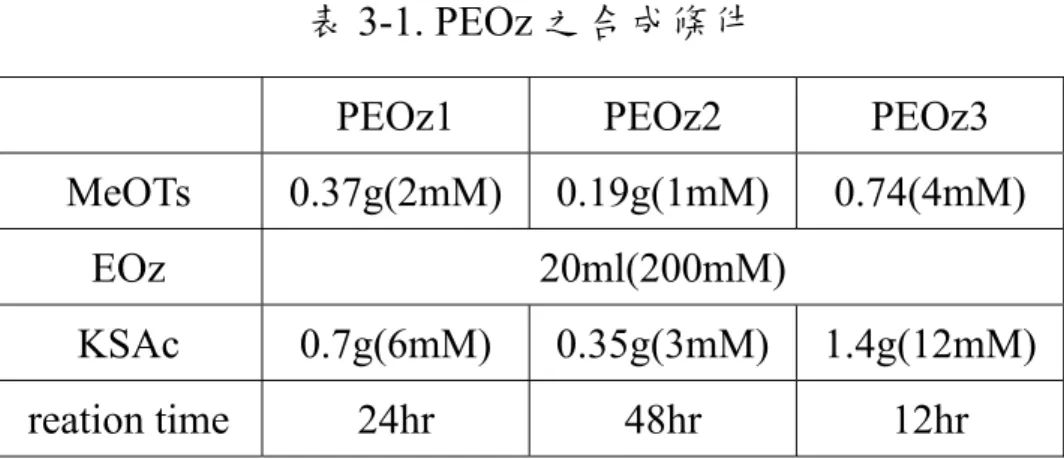
表 3-1. PEOz 之合成條件
PEOz1 PEOz2 PEOz3
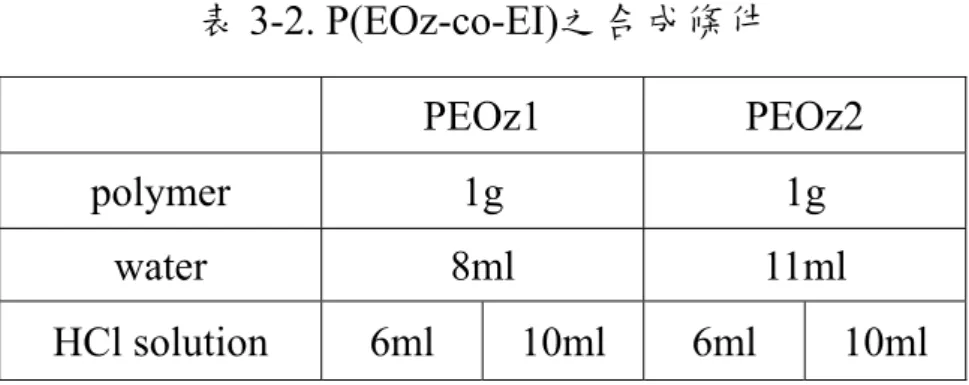
MeOTs 0.37g(2mM) 0.19g(1mM) 0.74(4mM) EOz 20ml(200mM) KSAc 0.7g(6mM) 0.35g(3mM) 1.4g(12mM) reation time 24hr 48hr 12hr (2). PEOz-Py 之合成 如圖3-2 所示,在雙頸圓底燒瓶中加入上述步驟得到的PEOz-SAc 與 5 倍莫耳數的 2,2'-dithiodipyridine,瓶口分別以血清塞封住及連通 真空管線,經除氣三次後導入無氧無水之乾燥氮氣,以乾淨玻璃針筒 注入含NH3的甲醇溶液,在室溫下均勻攪拌反應 1-2 天。將產物用旋 轉蒸發器濃縮後溶解於二氯甲烷,用乙醚進行再沉澱,反覆數次,最 後將得到的PEOz-Py以真空烘箱乾燥 24 小時,得到黃色的固體產物, 產率約85 %。 3-2-4. P(EOz-co-EI)之合成 陽離子高分子 P(EOz-co-EI)的合成如圖 3-3。此高分子的合成方 式為將 PEOz-Py 進行加酸水解,首先把上一步得到的 PEOz-Py 與純 水及HCl 溶液置於圓底燒瓶中,在 100℃下反應 3 小時,反應條件如 表3-2。反應結束後冷卻至室溫,用 NaOH 調整 pH 値在 9-10 之間, 再倒入分子量 3500 的透析膜中,以純水透析 3 天,將產物以旋轉蒸 發器濃縮後置於真空烘箱乾燥 24 小時,產物為黃色的膠狀物,產率 約70 %。
表 3-2. P(EOz-co-EI)之合成條件 PEOz1 PEOz2 polymer 1g 1g water 8ml 11ml HCl solution 6ml 10ml 6ml 10ml 3-2-5. PEOz-b-P(EOz-co-EI)雙團聯共聚物之合成 雙團聯共聚物之合成如圖3-4。將PEOz-SAc及 3 倍莫耳數的 P(EOz-co-EI)置於雙頸圓底燒瓶中,瓶口分別以血清塞封住及連通真 空管線,經除氣三次後導入無氧無水之乾燥氮氣,以乾淨玻璃針筒注 入含NH3的甲醇溶液,在室溫下均勻攪拌反應2-3 天。產物以適當分 子量(6000-8000 或 10000)的透析膜於純水中透析 3 天,最後以旋轉蒸 發器濃縮後置於真空烘箱乾燥24 小時,產物為黃色的膠狀物,存放 於-20℃冰箱中備用,產率約 75 %。
MeOTs/CH3CN 100℃ OTs 0℃ KSCOCH3 N n H3C S O Et C O CH3 N O Et n N H3C O Et N O Et 圖 3-1. PEOz-SAc 之合成流程圖 R.T. NH3/MeOH n N H3C S O Et S N S HN + n N H3C S O Et C O CH3 N S S N 圖 3-2. PEOz-Py 之合成流程圖
N H3C H N O Et S x S N HCl/H2O 100℃ n N H3C S O Et S N 1-x 圖3-3. P(EOz-co-EI)之合成流程圖 n N H3C S O Et C O CH3 R.T. NH3/MeOH N H3C H N O Et S x S N + 1-x n N H3C S O Et N CH3 H N O Et Sy x H N S + 1-x 圖3-4. PEOz-b-P(EOz-co-EI)之合成流程圖
3-3. 高分子結構鑑定與分析
3-3-1. 1H-NMR分析
在1H-NMR測定上,末端官能基要能夠明顯判別則高分子之聚合
度(degree of polymerization, DP)或分子量必須夠低,因此在PEOz-SAc 與PEOz-Py以及p(EOz-co-EI)的分析上皆採用低分子量的寡聚合物作 為分析的對象。 1H-NMR測定方式為將待測物溶解於CDCl 或D 3 2O中,以四甲基矽烷 (tetramethylsilane,TMS)為測量基準,經核磁共振光譜儀分析分子中氫 之化學位移來斷定分子結構。 3-3-2. 元素分析 將純化後之高分子以元素分析儀測量碳、氫、氮、硫四種元素所 佔的重量百分比,與理論推估之比例相互比較可用以判斷待測物結 構。 3-3-3. UV 光譜分析 將純化後之高分子溶於 methanol 中,倒入石英比色管中,以紫 外光/可見光光譜儀測量待測物溶液在波長 300-400nm 之間的吸收値 藉以分析待測物中是否含有pyridyl 官能基。 3-3-4. GPC 分析 將純化後之高分子以DMF配成溶液並以孔隙 0.22μm之過濾板過 濾後注入GPC中,可得重量平均分子量 (weight-average molecular
weight, Mw)、數目平均分子量 (number-average molecular weight, Mn)
(DMF),流速 1 mL/min (40℃),標準品為poly(methyl methacrylate) (PMMA) (Waters)。
3-4. 聚複合體之基本性質
3-4-1. 菌株培養與 DNA 純化及聚複合體製備 細菌培養基的製備方法為取47 g TB 加入純水至總體積 1 L,以 高壓滅菌鍋於 121℃下滅菌 30 分鐘,冷卻後加入 1 mL 抗生素 ampicillin(50 mg/mL),置於 4 ℃冷藏保存。 菌株培養時取 200 mL培養基加入 1 μL 含有pUHC-13-3 質體DNA 之大腸桿菌菌液,於37 ℃下培養 16-18 小時。質體DNA的萃取與純化則依照Plasmid Maxiprep Kit步驟進行。DNA溶液保存在-20 ℃。
DNA的濃度以UV/Vis測量波長 260 nm之吸收度,1 OD260 = 50 μg/mL。DNA的純度由OD260 /OD280判斷,一般值在 1.8-2.0。 聚複合體的製備方法為將質體DNA 稀釋為 0.04 mg/mL,另準備 不同濃度的高分子溶液,其濃度以高分子/DNA (P/D)的重量比例為基 準,如當P/D 為 5 時,高分子溶液的濃度即為 0.2 mg/mL。分別取 100 μL 的 DNA 與高分子溶液混合,混合均勻後於室溫下靜置 30 分鐘。 3-4-2. 膠體電泳
取0.2 g 洋菜膠體粉末(agarose gel)溶於 20 mL 1X TBE 緩衝溶液
製備1 % agarose 溶液,以微波加熱直到洋菜膠體粉末完全溶解,待
冷卻至55 ℃後倒入含有齒梳的模具,使膠體產生孔洞供置放樣品。
蓋過膠體孔洞。取1 μL 的 DNA 或聚複合體與 5 μL 的 6X 染劑均勻 混合,於每個孔洞加入5-12 μL 樣品。電泳電壓為 100 伏特,跑膠時 間依DNA 片段大小為準。接著將凝膠放進 0.5 μg/ mL 的 EtBr 染色 40 分鐘,置於紫外光箱觀察並以數位相機記錄影像。 3-4-3. 粒徑與界面電位 為了解生理環境對聚複合體是否有影響,分別用純水及 0.15M NaCl 溶液製備聚複合體,並稀釋至總體積 1 mL,以粒徑分析儀量測 粒徑的大小。另外將純水配製的聚複合體用界面電位儀來測定表面的 電荷量。 3-4-4. 酸鹼應答 首先製備pH 値分別為 7.0、6.5、6.0、5.5、5.0、4.5 的緩衝溶液, 其中pH 6.5 及 7.4 為磷酸鹽緩衝溶液(phosphate buffer),pH 6.0 以下 則為琥珀酸鹽緩衝溶液(succinate buffer)。取聚複合體 10mL 與 90mL 的各緩衝溶液混合,置於室溫下並於 1 小時後取出樣品,進行膠體電 泳分析。
3-5. 高分子與聚複合體之生物性質
3-5-1. 高分子之細胞毒性 將HeLa人類子宮頸癌細胞以DMEM培養基培養在 37 ℃,5 % CO2的恆溫培養箱中,以倒立式顯微鏡觀察其生長情形。等細胞長至 八分滿,以0.25 %trypsin-EDTA將培養皿中細胞打下,混合trypan blue,在顯微鏡下以細胞計數器計算細胞數目。於 96 孔培養盤中每 孔種植1×104個細胞。24 小時後,移除培養基以磷酸鹽緩衝溶液
(phosphate buffer saline, PBS)沖洗 1 次。並加入含有不同高分子濃度
之培養液。再過24 小時,更換新鮮培養基 90 μL並加入 10 μL MTT (5
mg/mL in PBS)反應 4 小時。移除培養基,加入 100 μL的DMSO/ EtOH(1:1)溶液溶解產生之結晶物,以 96 孔盤酵素判讀儀讀取波長 570 nm 之吸收,波長 630 nm 為背景扣除值。陽性控制組(positive control)
之培養基不加任何高分子。以常見的基因治療用高分子載體branched
polyethylenimine (B-PEI)作為陰性控制組(negative control)。實驗重複 6 次(n = 6),細胞存活率(cell viability)的計算方式為:
細胞存活率(%) = 吸收度sample/吸收度positive control 3-5-2. 聚複合體之細胞轉染 如同毒性分析所用之細胞及細胞計數方式,在6 孔培養盤中每孔 種植2 × 105個細胞。24 小時後,移除培養基以磷酸鹽緩衝溶液沖洗 1 次。每孔加入2 mL新鮮培養基與製備好之聚複合體溶液。在 37 ℃, 5 % CO2的恆溫培養箱中培養 2 天後移除培養基,以冰的PBS沖洗 1 次,每孔加入分解液(lysis buffer) 400 μL並以專用刮杓刮下細胞,收 集細胞溶液以Vortex均勻混合 15 秒,以 12,000 rpm離心 15 秒後保存 於冰浴中。在測量試管中加入20 μL細胞萃取液與 100 μL蟲螢光酶反
應試劑混合均勻後以冷光強度判讀儀量測冷光強度以計算轉染效率。 蛋白質含量分析方法為取100 μL 細胞萃取液以純水稀釋 1 倍, 再加入稀釋 5 倍後的蛋白質染劑 5 mL,混合均勻後室溫反應 10 分 鐘。以UV/Vis 測量波長 595 nm 之吸收度,對照蛋白質檢量線計算蛋 白質含量。
四、結果與討論
4-1. 合成 PEOz-b-P(EOz-co-EI)雙團聯共聚物
陽離子開環聚合為一種活性聚合(living polymerization)反應,其 特點為所得到的高分子分子量分佈較為均一,聚合度近似單體與起始
劑的莫耳比。此外陽離子開環聚合常用來將cyclic imino ether 經由開
環 聚 合 成 線 性 的 poly(N-acylalkylenimine) , 因 此 雜 環 分 子
2-substituted-2-oxazoline 亦藉此方式得到 poly(N-acyl-ethylenimine)。
一般用於聚合2-substituted-2-oxazoline 之起始劑可分為兩種,單官能
基起始劑如methyl iodide、MeOTs (methyl p-toluenesulfonate)等,在反
應 時 會 產 生 一 個 活 性 端(living end) , 即 高 分 子 末 端 的 碳 陽 離 子 (carbanium),分子鏈的成長只在單一方向。於反應終止時,由於離子 的活性不會消失,加入另一種單體反應仍會繼續進行,可得到雙團聯 共聚物。此外也可用親核性化合物(nucleophile)作為終止劑,在高分 子的末端導入官能基,與另一末端有官能基的高分子經由官能基之間 的反應形成共價鍵來合成雙團聯共聚物,這種反應稱為 coupling
reaction。而雙官能基起始劑像 bis(oxazolinium tosylate), 1,4-dibromo- 2-butene 等的分子則具有兩個活性端,因而高分子的兩末端能同時成 長,被利用來合成三團聯共聚物(triblock copolymer)。 本研究在雙團聯共聚物的合成上採用coupling reaction的方式並 透過雙硫鍵(disulfide bond)來連接兩高分子poly(2-ethyl-2-oxazoline) 及poly(2-ethyl-2-oxazoline-co-ethylenimine)。由於細胞內之glutathione 濃度為細胞外濃度的50~1000 倍,因此雙硫鍵在細胞內會被還原而斷 裂,但其在胞外環境中則相當安定48,49,不致影響到。一般coupling
reaction常以官能基羧酸(carboxylic group)與胺基(amino group)的反應 形成醯胺(amide)鍵,或羧酸與羥基(hydroxyl group)反應生成酯(ester) 鍵 作 為 共 價 鍵 結 , 但 若 使 用 此 類 的 鍵 結 方 式 於 本 研 究 上 , 因 P(EOz-co-EI) 在 分 子 主 鏈 上 有 二 級 胺 , 將 導 致 PEOz 不 僅 會 與
P(EOz-co-EI)的末端產生鍵結,也會接在主鏈上,形成接枝共聚物 (graft copolymer),並增加P(EOz-co-EI)與DNA之間的立體障礙,降低 包覆DNA的效率。由於硫醇基(sulfhydryl group)之反應具專一性,僅 會與碳雙鍵(double bond)、雙硫鍵等官能基反應,因此可利用在兩高 分子末端分別導入硫醇基與雙硫鍵來合成雙團聯共聚物。 基於要得到雙團聯共聚物,所以選擇單官能基起始劑 MeOTs 對 2-ethyl-2-oxazoline 進行聚合,為了在高分子末端引入官能基,需在氮 氣環境下進行聚合反應使高分子末端的碳陽離子能夠保持活性,並在
反應終止時加入 KSAc(protassium thioacetate)導入硫醇基,使 PEOz
末端帶有thioacetate 的官能基。由於硫醇基在空氣中容易因氧化反應
而產生偶合(dimerization),而 thioacetate 可視為被乙醯基(acetyl)保護
之硫醇基,因此thioacetate 常用於硫醇類化合物的製備。將 PEOz 於
酸 性 或 鹼 性 環 境 下 進 行 水 解 可 以 得 到 線 性 聚 乙 烯 亞 胺 , 為 使 thioacetate 在線性聚乙烯亞胺的合成中不被水解產生硫醇基進而造成
高分子偶合,同時提供雙硫鍵以與硫醇基反應,因此 PEOz 先以含氨
之甲醇溶液在氮氣下將保護基脫去,再與2,2'-dithiodipyridine 反應,
經 由 disulfide exchange 把 末 端 官 能 基 由 thioacetate 轉 換 為
2-pyridyldithio,之後於鹽酸溶液中進行水解使側鏈丙醯基(propionyl group)斷裂成為線性聚乙烯亞胺,即 P(EOz-co-EI)。最後將 PEOz 以
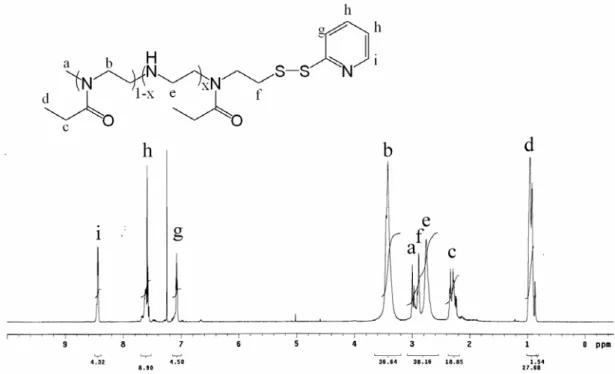
含氨之甲醇溶液使thioacetate 還原成硫醇基,與 P(EOz-co-EI)末端的 2-pyridyldithio 反 應 形 成 雙 硫 鍵 之 共 價 鍵 結 並 得 到 PEOz-b-P(EOz-co-EI)雙團聯共聚物。 4-1-1. 1H-NMR結構鑑定 本研究在官能基的鑑定上以另外合成之分子量約 600 的 PEOz 寡聚合物作為基準。
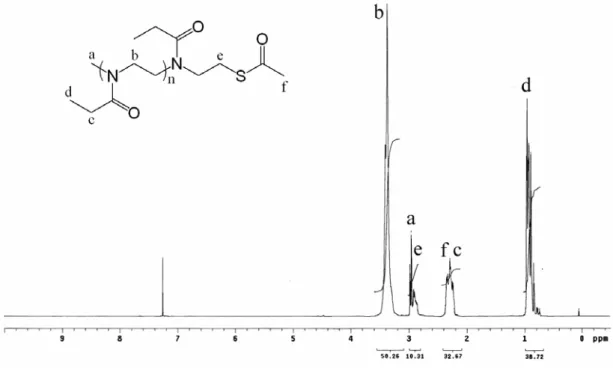
(1). PEOz-SAc 寡聚合物 將純化後末端帶有thioacetate官能基的PEOz寡聚合物溶於CDCl3 中,經1H-NMR測定後結果如圖 4-1。從圖中可看出高分子PEOz有三 個吸收峰,分別為:-N(COCH2CH3)-, δ=0.981 ppm;-N(COCH CH2 3)-, δ=2.353 ppm;-N(COCH2CH3)CH CH2 2-, δ=3.422 ppm,而末端甲基 則是在 2.995 ppm。由PEOz結構上三個吸收峰的積分面積可知, thioacetate上甲基的氫與PEOz側鏈上亞甲基的氫位置重疊,另外也可 看到thioacetate所造成主鏈末端位移至 2.915 ppm,顯示官能基確實鍵 結在高分子上。 (2). PEOz-Py 寡聚合物 圖 4-2 為純化後末端帶有 2-pyridyldithio官能基的PEOz寡聚合物 溶於CDCl3後經1H-NMR測定的結果。從圖中可知PEOz結構上三個吸 收峰的積分面積比例回復到結構中氫原子數之比例,而在 7.042 ppm、7.614 ppm、8.392 ppm三處出現pyridine環的吸收峰,代表 thioacetate與氨完全反應,生成硫醇基後與 2,2'-dithiodipyridine進行 disulfide exchange得到 2-pyridyldithio官能基,官能基之轉化率可由 pyridine環與高分子末端之甲基(a)積分面積比值求得,轉化率約 94%。 (3). P(EOz-co-EI) 寡聚合物 圖4-3 為純化後末端帶有 2-pyridyldithio官能基的P(EOz-co-EI)寡聚合 物溶於CDCl3後經1H-NMR測定的結果。PEOz經水解後在主鏈氮原子 上 的 乙 醯 基 會 脫 去 , 形 成 二 級 胺 結 構 , 所 以 在 圖 中 可 看 到 ethylenimine(-NHCH2CH2-)在 2.766 ppm處有吸收峰產生,此外在
7.094 ppm、7.601 ppm、8.41 ppm三處有pyridine環的吸收峰。
(4). P(EOz-co-EI)
將所合成之高分子PEOz經部分水解得到之P(EOz-co-EI)在純化
後溶於D2O測定1H-NMR,如圖 4-4。從圖中除了可看到PEOz結構上
的三個吸收峰,水解後產生的ethylenimine則是在 2.768 ppm處有吸 收 , 此 外 利 用 N-propionyl ethylenimine (a) 與 ethylenimine (d) 及 N-propionyl ethylenimine側鏈上甲基(c)的積分面積比值可以計算水解 比例,水解比例計算方式為:
1 c/3
(a+d)/4 _
(5). diblock copolymer PEOz-b-P(EOz-co-EI)
圖 4-5 為雙團聯共聚物經純化後溶於D2O所測定的1H-NMR圖
譜。從圖中可發現ethylenimine所佔的比例已減少,而經由計算反應 物PEOz與P(EOz-co-EI)之ethylenimine與N-propionyl ethylenimine重複
單元的比値與圖中 2.707 ppm及 3.413 ppm的積分面積比對照可證實
1
圖4-1. PEOz-SAc寡聚合物之 H-NMR光譜圖
1
圖4-3. P(EOz-co-EI)寡聚合物之1H-NMR光譜圖
1
圖 4-5. 雙團聯共聚物PEOz-b-P(EOz-co-EI)之1H-NMR光譜圖 4-1-2. 元素分析結果 將高分子以元素分析儀測量所含之碳、氫、氮、硫重量百分比, 並與理論值做一比較,結果如表4-1 所示。從表中可看出理論值與 分析結果十分接近,因此證實各高分子已成功的合成出來。 表 4-1. 各種高分子之元素分析結果與理論值之比較
polymer
C H N S 理論值 60.39 9.13 14.00 0.32 PEOz-Sac 分析結果 60.42 9.08 14.01 0.36 理論值 60.35 9.08 14.05 0.64 PEOz-Py 分析結果 60.36 9.01 14.09 0.68 理論值 57.47 10.46 24.35 1.10 P(EOz-co-EI) 分析結果 57.54 10.48 24.31 1.03 理論值 58.56 10.01 20.38 0.68 PEOz-b- P(EOz-co-EI) 分析結果 58.51 10.11 20.31 0.734-1-3. UV 光譜分析結果
由於 pyridyl 雜環在 UV 光譜下會有特定的吸收峰,所以可用來
鑑定高分子上是否具有 pyridyl 官能基。將 PEOz-SAc 與 PEOz-Py 分
別溶於甲醇溶液中,以 UV/Vis 測量其吸收値,結果如圖 4-6 所示。
由圖中可看出PEOz-Py 在 360 nm 處有一強烈吸收峰,顯示 PEOz 之
末端官能基已由thioacetate 轉變為 2-pyridyldithio。
將陽離子高分子P(EOz-co-EI)與雙團聯共聚物 PEOz-b-p(EOz-co-
EI)以甲醇溶解後測量其 UV 吸收光譜,結果如圖 4-7 所示。由於 p(EOz- co-EI)為 PEOz-Py 水解產物,所以末端仍保有官能基 2-pyridyldithio,
在波長 360 nm 時有吸收値,反之雙團聯共聚物由於經過 disulfide exchange 已沒有 pyridine 官能基,因此沒有吸收峰產生。 300 320 340 360 380 400 0.0 0.2 0.4 0.6 0.8 1.0 Absorbance Wavelength(nm) PEOz-Py PEOz-SAc 圖4-6. PEOz-Sac 與 PEOz-Py 在甲醇溶液下之 UV 吸收光譜 (溶液濃 度為 1 mM)
300 320 340 360 380 400 0.00 0.05 0.10 0.15 0.20 0.25 0.30 0.35 PEOz-b-P(EOz-co-EI) Absorbance Wavelength(nm) P(EOz-co-EI) 圖4-7. P(EOz-co-EI)與雙團聯共聚物 PEOz-b-P(EOz-co-EI)在甲醇溶 液下之 UV 吸收光譜 (溶液濃度為 0.5 mM) 4-1-4. GPC 分子量鑑定 GPC 為用來分析高分子分子量的層析技術。將所合成之 PEOz 以GPC 作分子量的測定,結果如表 4-2。從表中可看到 PEOz 都有狹 窄的分子量分布。 將PEOz 1 及PEOz 2 分別在兩種不同的酸性環境下水解,得到 P(EOz-co-EI)。如表 4-3 所示,PEOz 1 水解後之水解比例經1H-NMR 測 定後為76 % 及 89 %,分別命名LI-76 與LI-89,L代表線性的聚乙烯
亞胺,PEOz 2 之水解比例為 76 % 和 88 %,分別以LII-76 與LII-88 命名。P(EOz-co-EI)的分子量利用N-propionyl ethylenimine的分子量 (FW 99)及ethylenimine的分子量(FW 43)與水解比例經計算而得。以 LI-76 為例,水解前分子量為 10000,重複單元有 101 個,而水解比
例 為 76 % , 因 此 有 77 個 N-propionyl ethylenimine 與 24 個 ethylenimine,將各重複單元的數目乘上分子量相加後為 5700。
表4-4 為將 PEOz 3 與上述四種 P(EOz-co-EI)經 coupling reaction
後得到之雙團聯共聚物的分子量及 ethylenimine(EI)單體含量,因 PEOz 3 的分子量約 4kDa,故雙團聯共聚物命名如表中所示。 表4-2. PEOz 之數量平均分子量及分子量分佈 Polymer Mn. P.D.I. PEOz 1 10000 1.12 PEOz 2 17000 1.20 PEOz 3 3600 1.18 表4-3. P(EOz-co-EI)之水解率及分子量 polymer Hydrolysis (%) Mn. LI-76 76 5700 LI-89 89 5000 LII-76 76 9700 LII-88 88 8600 表4-4. PEOz-b-P(EOz-co-EI)之組成與分子量
copolymer PEOz Mn. EI content (%) Copolymer Mn.
4kI-76 3600 56 9300
4kI-89 3600 66 8600
4kII-76 3600 63 13300