第一章 前言
人類生存於自然界中,無時無刻都蒙受到各種可入侵人體之病原的威 脅,這些病原包括了細菌、黴菌、病毒等等。抗生素的發現是微生物學及 醫學發展史上相當重要的里程碑,挽救了難以計數的人們。抗生素的發展 史,可以說就是一部人類與微生物的戰爭史。在這個永無止境的戰爭中, 有時人類能佔得上風,有時則是微生物佔上風。抗生物質的發現,對於疾 病的治療是一項非常重大的突破,使得許多原本無藥可醫的疾病獲得了解 決,也因此有效的延長了人類的壽命。抗生物質的應用範圍很廣,還包括 了家畜的疾病治療、飼料添加、農作物以及植物病蟲害的防治等。到目前 為止,被發現的抗生物質超過了一萬種以上,其中被大量生產使用的約有 一百餘種。然而,近年來由於醫療行為與民眾用藥觀念的不正確,加上農、 牧、養殖業大量不當地使用抗生物質,造成許多抗藥性細菌的產生。根據 世界衛生組織發表的報告指出,包括急性化膿性扁桃腺炎、耳炎、瘧疾及 肺結核等原本可以治療的疾病,因為細菌抗藥性的問題而變得難以治療。 在這樣下去,人類很快地將面臨到無藥可醫的危機。因此,除了防止抗生 物質的濫用,以減少耐藥菌株產生的預防措施之外,更需加快新型抗生物 質的開發速度,以確保人類在與細菌的戰爭中能夠繼續保持有利的位置, 避免將來付出慘痛的傷亡代價。第一節 抗生物質之介紹
生物世界中,最殘酷也最平常的現象即是老病與死亡了,在大自然物 競天擇、適者生存的法則下,所有的生命在有限的資源下勢必得設法求存, 因此彼此間的競爭讓不同的生物練就了各項絕活。如土壤中的放線菌 (Actinomycetes
)是一類生長速度較於其他多數細菌要慢的族群,既然無 法仗著生長速度來競爭生存資源,放線菌只好藉由製造一些能抑制其他細 菌生長的物質來保障自身的生存(Copp,2003)。除了放線菌外,還有其他 許多細菌也是利用同樣的手段來搶得生存的優勢。 (一)抗生物質的定義 當二種微生物在同一培養基中繁殖時,其中一種微生物生長良好,而 由於此種微生物的生長影響到另一種微生物無法生長,或其生長受到抑 制,此種現象稱為微生物的拮抗現象(antagonism)。在微生物間的拮抗現 象稱為抗生(antibiosis)。抗生物質(antibiotics)為可抑制生長或殺 死細菌的化學物質,早期的發現都是由自然界中微生物所分泌分產而來, 例如人類最早發現的抗生素-青黴素(penicillin)就是由青黴菌所分泌生 產的。在 1942 年發現鏈黴素(streptomycin)的 Waksman 向美國細菌協會 提出抗生物質之定義,以便與其他化學藥物有所區別,Waksman 將其定義為:「由微生物所分泌生產,其極微量即可抑制其他微生物之生長、或破壞 其生理機能之物質,稱為抗生物質(antibiotics)」(蘇,1999)。 由於科學的進步,原本由微生物所生產之抗生物質,後來可透過化學 合成的方式來製造生產,如氯黴素(chloramphenicol)原本是由
Streptomyces venezuela
e 所生產分泌,然而,由於其結構較為簡單,可 以經由化學合成製造,或是以微生物所生產之抗生物質當做基質,透過化 學的方法來合成其衍生物,如半合成青黴素(semi-synthetic penicillin) (Boraet al
.,2004)。此外也在一些植物或動物的組織、器官中萃取出具 抗菌能力的物質。所以抗生物質的定義擴大修訂為:「生物,特別是由微生 物所分泌生產之化學物質,及該物質之完全或其相關衍生物以化學合成法 所生產者,在極微量的濃度下即可抑制其他微生物之細胞機能或活性者, 均稱為抗生物質」。 (二)抗生物質的種類 抗生物質有許多的分類方式,例如,按照其生產之菌源(黴菌的、細 菌的、放線菌的或是桿菌的)、抑菌圖譜(antibiotic spectrum)、化學結 構及作用機制等來分類。而一般依抗生物質的作用機制,可分為下列五種1. 阻礙細胞壁之合成 主要是抑制細菌細胞壁中 glycopeptide(murein;mucopeptide)之 合成;處於生長及產生新細胞壁階段之細菌,因細胞壁的合成受阻,導致 分裂後的細胞缺乏細胞壁的保護而變成裸細胞(protoplast),進而造成死 亡。而處於靜止期或已經形成細胞壁的細菌則不會受到此類抗生物質的抑 制。一方面,動物細胞中並無細胞壁的存在,因此屬於此類抗生物質具有 高度的選擇毒性(Françoise,2004)。 屬於此類的抗生物質主要有: i. 乙內醯胺類(β-lactam):青黴素(penicillin)、頭孢子類抗生物質 (cephalosporins)、fosfomycin、bacitracin 及 cycloserine 等 (Miller,2002)。
ii. Glycopeptides 類抗生物質:萬古黴素(vancomycin)及 teicoplani 等(Lundstrom and Sobel,2004)。
2. 破壞細胞膜之功能
主要是使細菌的細胞膜失去滲透性,導致細胞中的 purine、
pyrimidine、鹽類分子、胺基酸及蛋白質外漏,並使得有害物質能輕易地 進入細胞內,造成細胞的生理活性大亂而死亡。
屬於此類的抗生物質主要有:多黏桿菌素(polymyxin)、amphotericin B、
nystain、colistin 等(Hartsel and Bolard,1996)。
3. 抑制核酸之合成
如 Rifampin 會抑制細菌裡 DNA-dependent RNA polymerase 的活性, 因而干擾核酸的合成;而 Quinolone 類的抗生物質如 ciprofloxacin 會抑 制細菌 DNA gyrase 的活性,因而妨礙 DNA 的複製,產生抑菌的效果(Lester, 1972)。 4. 抑制蛋白質之合成 抗生物質與細菌的 ribosome 結合而抑制細菌之蛋白質的合成,使其無 法維持細胞的正常功能,因而產生抑菌的效果。這類的抗生物質很多,其 中廣效性抗生物質多屬於此類: i. 四環素(tetracyclines):會抑制 tRNA 與 30S 核醣體次單元結合而抑 制蛋白質的合成,其抑制的作用為可逆性,主要的缺點為其毒性會 引起肝中毒並使患者牙齒變黃棕色(Zhanel
et al.
,2004)。ii. 巨環黴素類(macrolides):如紅黴素(erythromycin),會與病源菌
制蛋白質的合成。可抑制黴漿菌(
mycoplasma
),且較無毒性(Cocitoet al
,1997)。iii. 胺基配醣體(aminoglycosides):如鏈黴素(streptomycin),會干擾
細菌 tRNA 與 30S 核醣體次單元結合而抑制蛋白質的合成,此過程 為不可逆性,屬於殺菌性之抗生物質(Cooperman,1977)。
5. 阻礙代謝之能力
葉酸為核酸合成所必須之前驅物質,磺胺劑(sulfonamides)為對胺 基苯甲酸(p-aminobenzoic acid,PABA)的類似物,由於 PABA 是葉酸的 一部份,因此磺胺會競爭拮抗 PABA,干擾細胞葉酸的合成而產生抑菌的效 果(Seydel,1968)。 (三)抗生物質的生產 抗生物質的生產方式一般可分為以下三種: 1. 生物合成法: 利用微生物在適當培養基中,經發酵培養、生長,其 代謝生成分子較為複雜的抗生物質。
2. 化學合成法:如 Quinolones 類之抗生物質皆來自 nalidixic acid
3. 半合成法:經由微生物發酵來大量生產抗生物質主要的官能結構分 子,再輔以化學合成修飾其支鏈分子。使得這些衍生物比原天然產物有 較廣的抗菌圖譜、克服胃酸及降低毒性等目的。 抗生物質中,除了氯黴素以及其他少數的抗生物質是由化學合成法製 造外,大多數仍是以生物合成法所生產,即經由微生物之培養來生產取得, 由文獻得知,目前發現之抗生物質中,約有 60%以上是由放線菌 (
Antinomycetes
)所生產,其中以Streptomyces
屬為最多,包括了四環 素、巨環黴素及胺基配醣體都是源自此菌屬;而其次有約 20%是以Penicillium
為主之真菌及 10%的Bacillus
屬等細菌所生產。抗生物質的 種類、性質及菌種來源整理於表 1(Vandamme,1984)。 從自然界中分離出的菌種很少能生產足以商業化的抗生物質濃度,透 過菌種的改良及適當的發酵培養條件,會大大提高抗生物質的產量。 各種培養條件中,培養基之組成影響抗生物質的生產甚大,是工業化 生產所要設計的第一要件,適當的培養基需具備有價格便宜、短時間內有 最大之回收率、副產物少使純化容易及不影響製程中通氣、攪拌、廢水處 理的特性。表1. 抗生物質的種類、性質及菌種來源
Chemical class Examples Biological source Spectrum Mode of action Beta-lactams Penicillin G,
Cephalothin
Penicillium notatum
and Cephalosporium species
G(+)bacteria Inhibits steps in cell wall (peptidoglycan) synthesis and murein
assembly Aminoglycosides Streptomycin Gentamicin Streptomyces griseus Micromonospora species G(+)and G(-)bacteria G(+)and G(-)bacteria esp. Pseudomonas Inhibit translation (protein synthesis) Inhibit translation (protein synthesis)
Glycopeptides Vancomycin Streptomyces
orientales
G(+)bacteria, esp.
Staphylococcus aureus
Inhibits steps in murein (peptidoglycan) biosynthesis and
assembly
Lincomycins Clindamycin Streptomyces
lincolnensis
G(+)and G(-)bacteria esp. anaerobic Bacteroides
Inhibits translation (protein synthesis)
Macrolides Erythromycin Streptomyces erythreus
G(+)bacteria and G(-)bacteria not enterics, Neisseria,
Legionella, Mycoplasma Inhibits translation (protein synthesis) Polypeptides Polymyxin Bacitracin Bacillus polymyxa Bacillus subtilis G(-)bacteria G(+)bacteria Damages cytoplasmic membranes
Inhibits steps in murein (peptidoglycan) biosynthesis and
assembly
Tetracyclines Tetracycline Streptomyces species G(+)and G(-)bacteria,
Rickettsias
Inhibit translation (protein synthesis)
一般培養基中的成份可分類成下列營養源:
i. 碳源(carbon source):是提供能量、構成菌體及生物合成主要基質;
常用澱粉及各式醣類。以青黴素生產為例,以乳糖(lactose)代
替葡萄糖及蔗糖,有較佳的抗生物質產率(Perlman,1979)。
ii. 氮源(nitrogen source):為合成菌體及酵素的主要物質;無機氮源 多採用胺鹽、硝酸鹽。而使用複合性的有機氮源能有助於產率之增 加,例如大豆、花生、棉花仔的碎粒及玉米浸液(corn steep liquor) 等。其中大豆碎粒適用於 streptomtcin 及其他放線菌屬生產抗生 物質(Aharonowitz,1980)。 iii. 輔因子(co-factors):為一些無機鹽類及微量物質(如:維生素、胺 基酸等)為菌種生長及酵素作用所不可缺少,但其需要量極微少。 磷及鎂為 ATP 能量傳遞反應時所必須,鈣、鉀、硫、鈉、鐵、鈷、 鋅及銅等,均為菌體合成所必須物質。 iv. 前驅物(precursor):為一些特殊化學物質,可加速生物合成作用或 引導生物合成途徑,如:氯四環素(chlortetracycline)生產時 加入氯化物,青黴素 G(benzyl penicillin)培養時加入苯醋酸
(penylacetic acid)或苯氧醋酸(phenoxy acetate),都會提高 抗生物質之產率(Schugerl and Guido,1998)。
(四)抗生物質的開發
由於抗生物質濫用的緣故,使得一些細菌產生了對抗生素的抗藥性 (drug resistance)。其中萬古黴素(vancomycin)一直被當作是對抗具 抗藥性細菌感染的最後一道防線。然而近年來已經陸續出現對萬古黴素具
抗藥性的金黃色葡萄球菌(vancomycin resistant
Staphylococcus
aureus
,VRSA)及腸球菌(vancomycin resistant enterococcus,VRE),使人類面臨到無藥可醫的窘境(Ge,1999)。因此,除了對抗生物質之使用有 所管制及嚴格的感染控制,來防止細菌產生抗藥性的情形擴增外,更要加 強對新型抗生物質開發。
許多製藥公司利用半合成的方式,修飾已存在之天然抗生物質結構,
試著來克服抗藥性等問題(Bush and Macielag,2000)。然而,這些結構及
抗菌機制相似的衍生物,面對細菌龐大複雜的耐藥機制,並無法長久有效 地來解決抗藥性的問題。甚至在利用此方式開發之抗生物質,有時在尚未
應用之前,就已存在了抗藥性(Breithaupt,1999)。如此一來,透過微生
耐藥性細菌感染的重要途徑。目前所發現之生產抗生物質的菌種多半集中 在少數幾種菌屬(Kingston,2000),例如:鏈黴菌屬(
Streptomyces
)、青 黴菌屬(Penicillium
)以及芽孢桿菌屬(Bacillus
)等。然而,在其他菌 群的代謝物中亦蘊藏著許多的抗生物質,值得來探討開發之。第二節 節桿菌屬(
Arthrobacter
)之介紹
(一)型態與特性Arthrobacter
菌屬廣泛存在於土壤中,其菌體直而細長,有時也略呈 彎曲狀,狀似棒球棍、火柴棒,不形成孢子或其他的休眠細胞,不具鞭毛、 不具運動性,無胞芽與莢膜構造,屬微異質群的細菌屬,具有相當的營養 多樣性,其適合生長的溫度範圍約在 25~30℃,適合生長的 pH 值範圍則為 5.0~8.5,而以中性為佳,此外,Arthrobacter
菌屬有強韌的生命力,對 乾燥與飢餓有很強的耐受力,可長期忍受飢餓達 80 天之久(Krieg and Holt,1989;William,1993)。 (二)生產抗生物質之情形Arthrobacter
菌屬中會生產抗生物質的情形是非常地罕見,在文獻 中,只有在 1996 年由日本人 Kamigiri 氏所發表之編號 YM-30059 菌是為會生產抗生物質之
Arthrobacter
菌屬(Kamigiriet al.
,1996),此抗生物 質的結構為 1-hydroxy-3-methyl-quinolone,如今被開發來抑制幽門螺旋 桿菌之藥物,主要用來治療消化性潰瘍(胃及十二指腸潰瘍)等疾病 (Masatoet al.
,2001)。第三節 論文研究目的
自從抗生物質的研究開發以來,許多的抗生物質陸續被發掘,而至今 在化學結構及作用機制上屬於新類型的抗生物質越來越少見,目前主要的 新型抗生物質,除了在原本的結構上進行些許的修飾,或是開發其衍生物, 已開始有不敷使用的壓力。因此從自然界中著手去尋找安全且有效的新型 抗生物質成為首要之務,在早期抗生物質的開發研究多屬於脂溶性物質, 易在體內的脂肪組織產生堆積,造成殘留、毒害等問題。很幸運的,本實 驗室自戶外土壤中,分離出一細菌株,編號為 AB-10,可分泌水溶性之抗 生物質,並在與現今文獻中有記載之抗生物質比較下,發現其應為一尚未 被開發之新型抗生物質。 本論文之研究目的著重在此抗生物質之最適生產條件以及如何進一步 有效地分離純化做探討,並對其菌學及經純化之抗生物質做相關性質的研 究,以期開創此抗生物質在植物病害、林業防護、養殖水產、畜牧病害、第二章 材料與方法
第一節 菌種篩選
在自然環境中採集各地之土壤,帶回實驗室後將各樣品分別秤取 1g, 置於試管中加入無菌水 10ml 並充分混合均勻後使其懸浮。靜置數分鐘後, 使大顆粒物質自然沉降至底部,取其上清液 1ml 加入 9ml 的無菌水,依照 此方法重複數次之連續稀釋後,均勻塗佈於 MY 固態培養基,再將此培養皿 置於 30℃之培養箱中培養,發現到在某菌落周圍有明顯的抑菌環產生。將 其獨立挑出移植於含 MY 固態培養基之培養皿中,命名為 AB-10 菌,並對其 進行相關之研究探討。第二節 分析方法
(一)菌數測定 菌的生長情形是透過測量培養液之光學密度(optical density,OD); 由分光光度計於波長 600nm 下所測得之吸光值,來視為相對之菌體濃度。 (二)抗菌活性分析 加熱溶解 50ml 之 MY 固態培養基,待溫度下降至約 40~50℃、尚未凝 固之前,加入 20µl 經 24 小時以液態 MY 培養基培養之Bacillus
菌液,混合均勻後取 10ml 倒入培養皿中。靜置約 20 分鐘,待其冷卻凝固後,在固 態培養基上打上直徑為 0.9 公分的圓洞,並加入近似圓洞體積之 50μl 待 測物質。再將此培養皿置於 30℃之培養箱中靜置培養約 10 小時後,測量 觀察其圓洞外之抑制圈大小,藉此評估該待測物質的抗菌能力。本實驗所 量測之抑制圈大小是以圓洞外圍至抑菌圈外環間之距離來計算,以公厘(mm) 表示。 抑菌圈大小 (mm) x 液體之總體積 (ml) 活性定義 = --- 測試抑菌環之液體體積 (µl) (三)薄膜色層分析(TLC) 將各階段純化下之產物進行薄膜色層分析,以觀察比較抗生物質純化 的情況,TLC 系統為:在 Silica gel 60 下,展開液比例為 Ethyl Acetate: Methanol= 8:2。展開後以 25%硫酸溶液噴濕處理後,於烘箱中以 120℃、 5 分鐘來進行顯色。
(四)高效能液相層析(high performance liquid chromatography) 將經純化之抗生物質進行高效能液相層析,透過 HPLC 所測得之層峰圖
來評估抗生物質之純化情形,HPLC 系統為:在 C18 column(3.9 x 150 mm)
第三節 培養基探討
在實驗初期,即將 AB-10 菌培養在 1% Glucose、0.5% Peptone、0.3 % Malt extract、0.3% Yeast extract 及 1.5% Agar 的 MY 固態培養基 上,其生長情況良好且能生產抗生物質,於是決定以 MY 液態培養基作為基 礎來進行最適培養基之探討。
(一)碳源及其濃度的影響
將 1%不同碳源分別加入液態基礎培養基(Malt extract 0.3%、Yeast extract 0.3%、Peptone 0.5%)中,每 50ml 液態培養基中加入一個接種 環量之新鮮 AB-10 菌,進行 30℃、轉速 150rpm、12 小時培養,而後測量 其菌體濃度及抗生物質之活性強度。來探討不同碳源對抗生物質之生成的 影響,並以此最佳之碳源成份來做不同濃度的添加,以找出最適之添加百 分比。 (二)氮源及其濃度的影響 於最適碳源之液態基礎培養基中,分別添加 1%之不同氮源,每 50ml 液態培養基中加入一個接種環量之新鮮 AB-10 菌,進行 30℃、轉速 150rpm、 12 小時培養,而後測量其菌體濃度及抗生物質之活性強度。來探討不同氮 源對抗生物質之生成的影響,並以此最佳之氮源成份來做不同濃度的添 加,以找出最適之添加百分比。
(三)無機鹽類及其濃度的影響
分別添加 0.01 至 0.05%不同的無機鹽類於含有 1.0% Glycerol、0.5 % Malt extract 及 0.7% Yeast extract 之液態培養基中,每 50ml 液態 培養基中加入一個接種環量之新鮮 AB-10 菌,進行 30℃、轉速 150rpm、12 小時培養,而後測量其菌體濃度及抗生物質之活性強度,來探討不同無機 鹽類及其濃度對抗生物質生成的影響。 (四)生長曲線 於最適之液態培養基中加入一個接種環量之新鮮 AB-10 菌,每隔一小 時取樣測量菌體濃度(OD600)、抑菌圈大小及培養基之 pH 值,直到抑菌活 性達到高峰往下降為止。
第四節 生產方式
種菌培養: 於 MY 固態培養基接種 AB-10 菌,在 30℃下培養 24 小時。 生產: 取一個接種環量之 AB-10 種菌,接種到裝有 50ml 已滅菌之 AB-10 最適生產培養基(1.0% Glycerol、0.5% Malt extract、0.7% Yeastextract、0.06% MgSO4)之 250ml 凹底錐型瓶內,進行 30℃、轉速 150rpm、
第五節 抗生物質之純化
(一)丙酮沉澱 收集經 12 小時培養之菌液,於 4℃、轉速 10000rpm 下離心 30 分鐘後, 取其上清液。 再將此上清液置於冰浴中,均勻攪拌並緩緩加入冰丙酮至丙酮濃度達 總體積的 40%,持續攪拌一小時使其充分作用,於 4℃下靜置隔夜後,經 4℃、轉速 10000rpm 下離心 30 分鐘後取其上清液,再透過減壓濃縮處理藉 以除去丙酮。 (二)第一次活性碳抽濾 以矽藻土混合 1.5 倍體積之活性碳,充填於抽氣漏斗中,以二次水沖 洗平衡;取前一步驟所得產物通過此一充填物後,先以 300ml 二次水沖洗 後,接著以 30% Ethanol 持續沖洗 500ml(每 100ml 個別收集),檢測其 活性後,收集其具活性區段後,再以減壓濃縮去掉 Ethanol。 抽氣漏斗尺 寸為 4 × 6 ㎝。 (三)第二次活性碳抽濾 取前一步驟所得產物,再次經過活性碳抽濾處理;同樣以矽藻土混合 1.5 倍體積之活性碳,充填於抽氣漏斗中,以二次水沖洗平衡。將產物通過此一充填物後,先以 300ml 二次水沖洗後,接著以 30% Ethanol 持續沖 洗 500ml(每 100ml 個別收集),檢測其活性後,收集其具活性區段後,以 減壓濃縮去掉 Ethanol。 抽氣漏斗尺寸為 4 × 6 ㎝。 (四)Sephadex G-15 管柱層析 將前一步驟所得產物通入已平衡好之 Sephadex G-15 管柱,再以二次 水沖洗後(每 3 ml 個別收集),檢測其活性後,收集其具活性區段。管柱 大小:2.7 × 120 ㎝,操作流速:0.2 ml/min。
第六節 純化各步驟之回收率
將各步驟之純化產物分別稀釋至有效濃度後,做抗菌活性實驗分析, 測量其抑制圈大小,乘上稀釋倍數及體積做為抗菌物質之含量定義;在將 初培養液定為 100%下與之比較後,以此計算出各步驟在純化過程中的回 收率。第七節 抗生物質之純度
以 Silica gel 60 薄膜色層分析,決定抗生物質的純度。所使用之展 開液配方:Ethyl Acetate:Methanol= 8:2,展開後以 25%硫酸溶液噴濕處理後,於烘箱中以 120℃、5 分鐘來進行顯色。同時配合將未經硫酸溶 液噴濕處理之 TLC 片貼於含
Bacillus
之 MY 固態培養基(加熱溶解 50ml 之 MY 固態培養基,待溫度下降至約 40~50℃、尚未凝固之前,加入 20µl 經 24 小時以液態 MY 培養基培養之Bacillus
菌液,混合均勻後取 10ml 倒入 培養皿中,靜置約 20 分鐘待其冷卻凝固。)上,再將此培養皿置於 30℃ 之培養箱中培養約 10 小時後,觀察其抑制圈出現之相對位置,來証明其活 性。第八節 抗生物質之性質
(一)溫度穩定性 取 0.5 ml 的抗生物質,以不同水溫(20~100℃)水浴 30 分鐘後,測 量其抗菌活性,藉以了解抗生物質對不同溫度下的穩定情況。 (二)有機溶劑穩定性 各取 0.5 ml 的抗生物質,分別加入等體積之不同有機溶劑,經震盪處 理後靜置半小時,分別測試水層、有機層之抗菌活性,藉以了解抗生物質 對於不同有機溶劑的穩定性。(三)最小抑制濃度(MIC)測定 各取 95µl 經 2 倍連續稀釋成不同濃度之抗生物質:1 倍、1/2 倍、1/4 倍、1/8 倍……至 1/2048 倍,分別加入 5µl 經 24 小時培養之
Bacillus
菌 液與 900µlMY 培養液,於 30℃下培養 12 小時後,測其 OD600吸光值,觀察 經純化之抗生物質對Bacillus
之抑制情形。
(四)抗菌圖譜(Spectrum) 將待測菌種加入合適之液態培養基中經 24 小時培養,加熱溶解 50ml 合適之固態培養基,待溫度下降至約 40~50℃、尚未凝固之前,加入 20µl 經 24 小時培養之待測菌種,混合均勻後取 10ml 倒入培養皿中。靜置約 20 分鐘,待其冷卻凝固後,在固態培養基上打上直徑為 0.9 公分的圓洞,並 加入近似圓洞體積 50μl 待測物質。再將此培養皿置於 30℃之培養箱中培 養約 10 小時後,測量其個別的抑制圈大小,來比較抗生物質對不同菌種的 抑制效果。 (五)抑菌效應 接種Bacillus
至 MY 培養液中,於 30℃下培養 24 小時後,取 5µl 至 900µlMY 培養液中,並加入 95µl 經純化之抗生物質,對照組使用無 菌水取代抗生物質,於 30℃下培養,每隔 3 小時取樣,測其吸光值;12 小時後,在 4℃下經轉速 10000rpm 離心 10 分鐘後,去除上清液加入 1000µl 無菌水,震盪後再次於 4℃下經轉速 10000rpm 離心 10 分鐘後,去除上清 液加入 MY 培養液 1000µl,於 30℃下進行培養,每隔 3 小時取樣測定吸光 值。
第九節 材料
(一)化學試劑 1. 以下試藥購自 Sigma 公司:葡萄糖(glucose)、麥芽糖(maltose)、乳糖(lactose)、果糖
(fructose)、大豆粉(soybean flour)、氯化鋅(zinc chloride)、氯化
銅(cupric chloride dihydrate)、氯化鐵(ferric chloride
hexahydrate)、硫酸鎂(magnesium sulfate)
2. 以下試藥購自 Merck 公司:
甘油(glycerol)、蔗糖(sucrose)、澱粉(soluble starch)、尿素
(urea)、硫酸銨(ammonium sulfate)、丙酮(acetone)、甲醇(methanol)、
乙醇(ethanol)、異丙酮(2-propanol)、正己烷(n-hexane)、乙酸乙酯
(chloroform)、氯化鈣(calcium chloride)、氯化鉀(potassium
chloride)、氯化鈉(sodium chloride)、氯化鋇(barium chloride)、硫
酸鋅(zinc sulfate)
3. 以下試藥購自 Difco 公司:
麥芽抽出物(malt extract)、酵母抽出物(yeast extract)、牛肉抽
出物(beef extract)、洋菜膠(agar)、蛋白萃取物 (peptone)、營養培
養液
(二)管柱及其材料
1. 活性碳 購自味丹企業有限公司 2. 矽藻土 購自島久藥品株式會社
3. Sephadex G-15 購自 Pharmacia Biotech 4. Silica gel 60 TLC 購自 Merck
(三)菌種
1. AB-10 菌為本實驗室從土壤中篩選之菌株,保存於 MY 平面培養基。
3.
Vibrio alginolytics
及Vibrio harveyi
由國立台灣大學動物系提供。 4.Candida albicans
由台北榮總醫院皮膚科提供。 5.Staphylococcus sp.
ATCC 29123 6. E. Coli
ATCC 7928 (四)培養基 1. 菌種保存用培養基(MY medium) Glucose 1% Yeast extract 0.3% Malt extract 0.3% Peptone 0.5% Agar 1.5% 2. AB-10 生產用培養基 Glycerol 1% Yeast extract 0.7% Malt extract 0.5% MgSO4.7H2O 0.06%3. NAM 培養基 Nutrient Broth 0.8% NaCl 0.5%
第十節 儀器
(一) 分光光度計 BECKMAN COULTER DU 640 (二) pH METER HORIBA F-52 (三) 電子天平 METTLER TOLEDO B303-S(四) 震盪混合器 FISHER SCIENTIFIC VOTEX GENIE 2 (五) 減壓濃縮機 HEIDOLPH CABOROTA 4000
(六) 迴旋震盪培養箱 HOTECH INSTRUMENTS CORP. (七) 離心機 HITACH HIMAC CR 22G
(八) 微量離心機 PANTECH UFO 2100
(九) 抽真空濃縮機 UNIEQUIP UNIVAPO 100H
(十) 超純水製造系統 JIUH HSING INSTRUMENT UPW 100IVS (十一) 製冰機 JIUH HSING INSTRUMENT BREMA ICEMAKERS (十二) 分液收集器 AMERSHAM FRAC-920
(十三) 幫浦 GAST DOA-P704-AA (十四) 生物無菌安全操作台 (十五) 滅菌釜 HIRAYAMA HA-300P (十六) 微波爐 NATIONAL NE-C30B (十七) 乾燥箱 RISEN RHD452 (十八) 烘箱 CHANNEL
(十九) 冷凍乾燥機 VIRTIS FREEZEMOBILE 25ES (二十) 高效能液相層析儀 SPECTRA SERIES P100
第三章 結果與討論
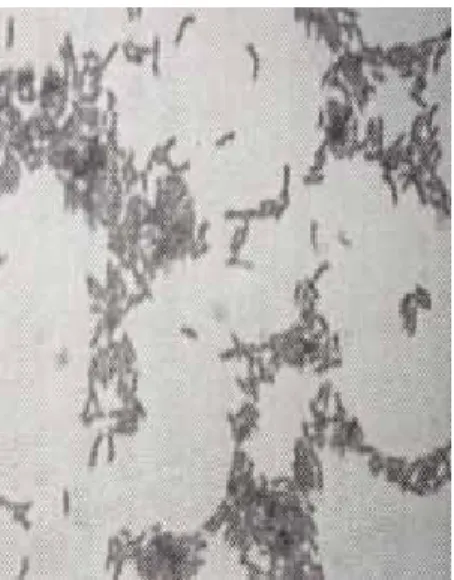
第一節 菌學性質
AB-10 菌在 MY 培養基上的生長,在起初 1 天時的菌落外觀為乳白色, 之後會漸漸轉為乳黃色型態。在經由新竹食品工業研究所的鑑定報告中, AB-10 菌為革蘭氏陽性桿菌,在顯微鏡下的模樣,如圖 1 所示,其不具運 動性,具 catalase,於好氧下會生長、厭氧下則不會生長,不會生產內孢 子,細胞內 DNA 之 G + C 含量為 67%,細胞壁的脂肪酸組成為 15:0 anteiso 及 Biolog 醣類發酵等結果,依據 Bergey´s Manual of DeterminativeBacteriology 第九版的敘述,判斷 AB-10 菌為節桿菌(
Arthrobacter
)屬。第二節 抑菌活性分析
(一)抑菌活性分析
擴散法(diffusion method)為抗生物質在已接入試驗菌種之固態培 養基上經滲透、擴散進而抑制試驗菌種之生長,從抑制圈大小來評估抗生 物質其抑菌活性的強弱。本實驗初期以紙錠擴散(paper disk diffusion) 作測試,為求觀察上更為明顯,考慮紙錠會吸附並束縛住抗生物質,限制
了抗生物質的擴散範圍,遂在含待測菌的固態培養基上打上直徑 0.9mm 的 圓洞,注入待測物質,以減少擴散時紙錠的吸附力。 實驗結果發現,如圖 2 所示,以圓洞擴散法取代紙錠擴散法時,會有 較明顯的抑制圈大小,因此決定採用圓洞擴散法來評估抗生物質其抑菌活 性之強弱。 (二)薄膜色層分析(TLC) 將純化產物經薄膜色層分析,在 Silica gel 60 下,展開液比例為: Ethyl Acetate:Methanol=8:2。如圖 3 所示,發現 AB-10 菌生產之抗生
物質在 UV254吸光下會有淡黃色螢光的表現。可以此淡黃色螢光做為抗生
物質所在的指標。
(三)高效能液相層析(high performance liquid chromatography)
將純化產物經 HPLC 分析,在 C18 column(3.9 x 150 mm)下,展開液
比例為 H2O:Acetonitrile=8:2。分別收集不同層峰區段來做抑菌活性及
(A) (B) 圖 2. 抑菌活性分析法比較 (A)圓洞擴散法 (B)紙錠擴散法 加熱溶解 50ml 之 MY 固態培養基,待溫度下降至約 40℃,加入 20µl 經 24 小時以液態 MY 培養基培養之
Bacillus
菌液,混合均勻後取 10ml 倒入培養 皿中。待其冷卻凝固後,分別加入 50μl 之 AB-10 抗生物質。置於 30℃培 養箱中靜置培養約 10 小時後,測量觀察其抑制圈大小。(A) (B) 圖 3. AB-10 抗生物質於 Silica 60 TLC 上之表現 (A). 於可見光下 (B). 於 UV254nm 光下 展開系統:Ethyl Acetate:Methanol=8:2
第三節 培養基探討
(一) 碳源及其濃度的影響 由表 2 可知,所使用的碳源皆能促進抗生物質的生產,即使在沒有碳 源的條件下,仍有抗生物質的生產。其中碳源成分以添加 Glycerol 之效果 最為顯著,其抑制圈半徑可達 5mm。抗生物質的生產情況隨著 Glycerol 的 添加濃度增加而上升,其最適的 Glycerol 濃度以添加 1%為最佳;當超過 1% Glycerol 濃度時,活性則會發生降低的現象,如表 3 所示。 (二) 氮源及其濃度的影響 決定了碳源及其濃度之後,接著進行氮源的探討,在含 1% Glycerol 之液態基礎培養基下,添加 1%不同之氮源成份,由表 4 可知:與基礎培 養基相比,其他氮源成份的添加並沒有促進抗生物質生產的效果。因此, 進一步來比較基礎培養基中之氮源成份(Peptone、Malt extract 及 Yeast extract)對抗生物質之生產的影響情形;以不同的組合(分為單一、兩種 及三種成分)添加,由表 5 顯示:Peptone 的添加是不必要的,但 Malt extract 及 Yeast extract 的存在則是必需的。接著來探討 Malt extract 及 Yeast extract 此兩種氮源之添加情形對 抗生物質生產的影響;在含 1% Glycerol 及 0.3% Malt extract 之液態 基礎培養基下,添加不同濃度的 Yeast extract,由表 6 可知,當添加 0.7
表 2. 不同碳源對 AB-10 抗生物質生成的影響 碳 源 抗菌活性/ 抑制圈大小 (mm) Control 2.0 Lactose 3.0 Sucrose 3.0 Glucose 3.5 Fructose 3.5 Maltose 4.0 Starch 4.5 Glycerol 5.0
基礎培養基:0.5% peptone , 0.3% malt extract 及 0.3% yeast extract 培養條件:於 30℃、150rpm 下,培養 12 小時
表3. 不同濃度之 glycerol 對 AB-10 抗生物質生成的影響 glycerol 濃度(%) 抗菌活性/ 抑制圈大小(mm) 0 2.0 0.2 3.0 0.4 3.0 0.6 3.5 0.8 4.0 1.0 5.0 1.2 5.0 1.4 4.5 1.6 4.5 1.8 4.0 2.0 4.0
基礎培養基:0.5% peptone , 0.3% malt extract 及 0.3% yeast extract 培養條件:於 30℃、150rpm 下,培養 12 小時
表 4. 不同氮源對 AB-10 抗生物質生成的影響 氮 源 (1%) 抗菌活性/ 抑制圈大小(mm) Ammonium sulfate 3.0 Casamino acid 3.0 Soybean 4.0 Beef extract 4.5 Urea 5.0 Control 5.0
基礎培養基:1.0% glycerol, 0.5% peptone, 0.3% malt extract 及 0.3% yeast extract
表 5. 氮源成份(Peptone、Malt extract 及 Yeast extract)對 AB-10 抗生物質生產的影響 1 2 3 4 5 6 7 8 Malt extract - + - - + + - + (0.3%) Yeast extract - - + - + - + + (0.3%) Peptone - - - + - + + + (0.5%) Clear zone 1.0 2.0 3.0 - 5.0 4.0 4.0 5.0 (mm) 基礎培養基:1.0% glycerol 培養條件:於 30℃、150rpm 下,培養 12 小時
表 6. 不同濃度之 yeast extract 對 AB-10 抗生物質生成的影響
yeast extract 濃度(%) Antibiotic activity/ Clear zone (mm)
0 0 0.1 5.5 0.3 6.0 0.5 6.5 0.7 7.5 0.9 6.5
基礎培養基:1.0% glycerol 及 0.3% malt extract 培養條件:於 30℃、150rpm 下,培養 12 小時
% Yeast extract 時有最佳的抑菌效果,其抑菌圈半徑可達 7mm。 再者, 在以含 1% Glycerol 及 0.7% Yeast extract 之液態基處培養基下,添加 不同濃度之 Malt extract,由表 7 可知,當添加 0.5% Malt extract 時 有最佳之抑菌效果,其抑制圈半徑可達 7.5mm。
至此,由上述結果可得知 AB-10 菌之較適抗生物質生產培養基組成 為:1% Glycerol、0.7% Yeast extract 及 0.5% Malt extract。
(三)無機鹽類及其濃度的影響
在含 1% Glycerol、0.7% Yeast extract 及 0.5% Malt extract 之 液態基礎培養基下,添加 0.01% 至 0.05% 不同種類之無機鹽類,由表 8 可知,與不添加相比,添加 0.05% MgSO4對抗生物質之生產有明顯的促進 效果。而最佳 MgSO4的添加濃度為 0.06%,如表 9 所示,其抑制圈半徑可 達到 9.0mm。與最初之生產培養基下所得的抑菌活性相比(抑制圈半徑 2.0mm),探討出之最適生產培養基下所得的抑菌活性(抑制圈半徑 9.0mm), 增加了約四倍半。 綜合以上實驗結果:AB-10 菌生產抗生物質之最適生產培養基組成為: 1% Glycerol、0.7% Yeast extract、0.5% Malt extract 及 0.06% MgSO4。
表 7. 不同濃度之 malt extract 對 AB-10 抗生物質生成的影響 malt extract 濃度 (%) 抗菌活性/ 抑制圈大小(mm) 0 2.0 0.1 5.0 0.3 7.0 0.5 7.5 0.7 6.5 0.9 6.5 1.1 6.0 1.3 6.0 1.5 6.0 1.7 6.0 1.9 6.0
基礎培養基:1.0% glycerol 及 0.3% yest extract 培養條件:於 30℃、150rpm 下,培養 12 小時
表 8. 不同無機鹽類對 AB-10 抗生物質生成的影響 無機鹽類 抗菌活性/ 抑制圈大小(mm) None 7.5 0.05%MgSO4 8.0 0.05%K2HPO4 5.5 0.05% (MgSO4+K2HPO4) 6.0 0.03%CaCl2 5.5 0.01%CuCl2 - 0.01%FeCl3 - 0.01%ZnSO4 -
基礎培養基:1.0% glycerol, 0.5% malt extract 及 0.7% yeast extract 培養條件:於 30℃、150rpm 下,培養 12 小時
表 9. 不同濃度之MgSO4對 AB-10 抗生物質生成的影響 MgSO4 濃度 (%) 抗菌活性/ 抑制圈大小(mm) 0 7.5 0.02 7.5 0.04 8.0 0.06 9.0 0.08 7.5 0.1 4.5
基礎培養基:1.0% glycerol, 0.5% malt extract 及 0.7% yeast extract 培養條件:於 30℃、150rpm 下,培養 12 小時
(四)生長曲線 圖 4 為 AB-10 菌之生長及抗生物質之生產曲線圖,其培養液的 pH 值變 化不大(約為 6.8),而抗生物質約從培養後第 6 小時起開始生產,在第 12 小時左右達到最大值,抑菌半徑可達 9.0 ㎜;但隨後即趨於下降。此外, 此 AB-10 抗生物質之生產是屬於與生長相關(growth-associated)之一級 代謝物(primary metabolite),與一般常見之抗生物質之生產,為屬於與 生長不相關之二級代謝物(secondary metabolite),有很大的不同,值得 進一步來探討研究。
第四節 抗生物質之純化
經反覆檢討此抗生物質純化之條件,得到最為理想之純化流程為: 粗培養液先經由丙酮沉澱以去除大部分蛋白質,再經過二次活性碳的過 濾,利用不同物質極性上的差異來達到脫色、去雜質的目的,續進行 Sephadex G-15 管柱層析,依不同物質分子大小的差異來收集所要的抗生 物質區段。 (一)丙酮沉澱 以 250ml 之三角錐形瓶裝入 50ml 最適生產培養基共 12 瓶,滅菌後接 入 AB-10 菌於 30℃下培養 12 小時後,離心除去菌體及大分子雜質即得粗Number of bacterium (OD 600 nm ) ---▼ -圖 4. AB-10 菌之生長曲線 於 MY 固態培養基接種 AB-10 菌,在 30℃下培養 24 小時作為種菌。 取一 個接種環量之 AB-10 種菌,接種到裝有 50ml 已滅菌之 AB-10 最適生產培養 基(1.0% Glycerol、0.5% Malt extract、0.7% Yeast extract、0.06
% MgSO4)之 250ml 凹底錐型瓶內,進行 30℃、轉速 150rpm 培養。
每小時測量其 OD600nm 吸光值做為菌數指標,以及抑制圈活性測試做為其
培養液。由 600ml 生產培養基所得之粗培養液的總抗菌活性為 9600mm,加 入丙酮將大部份蛋白質沉澱下來,離心後取上清液經減壓濃縮除去丙酮, 其抗菌活性測得為 8000mm,回收率約為 83.3%。 (二)第一次活性碳抽濾 經過丙酮沉澱後之產物,再利用活性碳抽濾處理後,確實去除了部分 雜質。如圖 5 所示,抽濾後收集之活性部分,其外觀顏色已由原來的褐色 轉變為淡黃色可獲得證實。經此步驟後,抗生物質的回收率約為 62.5%。 (三)第二次活性碳抽濾 將前步驟所得產物再一次經過活性碳抽濾的處理,如圖 5 所示,從洗 出的具活性區段,可發現其外觀顏色由淡黃色更趨於近乎無色透明,顯示 第二次的活性碳抽濾亦很有效地去除了部分雜質。經此步驟後,抗生物質 的回收率約為 45.8%。 (四)Sephadex G-15 管柱層析 比較經二次活性碳抽濾下及再經過 Sephadex G-15 管柱層析之產物的 HPLC 層峰圖(圖 6 與圖 7),可明顯地看出,經過 Sephadex G-15 管柱層
(A) (B) (C) 圖 5. AB-10 粗培養液經兩次活性碳抽濾處理之比較 (A)經丙酮沉澱處理 (B)經一次活性碳抽濾處理 (C)經二次活性碳抽濾處理
圖 6. AB-10 抗生物質於二次活性碳抽濾處理下之 HPLC 層峰圖
展開系統:C18 管柱(3.9 x 150 mm)
圖 7. AB-10 抗生物質續經 Sephadex G-15 管柱層析處理之 HPLC 層峰圖
展開系統:C18 管柱(3.9 x 150 mm)
析的處理能再進一步的去除部分雜質。經此步驟後,抗生物質的回收率約 為 32.5%,整理於表 10。
第五節 抗生物質之純度
經以上各步驟純化之抗生物質,以 Silica 60 TLC 片和 Ethyl Acetate: Methanol= 8:2 的展開液進行分析。展開後再以 25%硫酸溶液顯色。實 驗結果如圖 8、9 所見,顯示此時除了抗生物質外尚有另一雜質的存在。展 開後未經處理之 TLC 片經由抗菌檢測後,有一明顯抑菌圈產生,此為抗生 物質之位置所在。此外,在實驗中發現一特殊現象;薄膜色層分析時,如 果展開前: (一)以涼風吹拂 1 分鐘時: 展開後,發現抗生物質及雜質均會被展開液帶離原點,雜質出現位置 緊鄰於抗生物質下方。 (二)以熱風吹拂 1 分鐘時: 展開後,發現抗生物質同樣會被展開液帶離原點,但雜質則是停留在 原點處。
表 10. AB-10 抗生物質於各純化步驟下之回收率 純化步驟 體積(ml) 總活性(mm) 回收率(%) 粗培養液 600 9600 100 經丙酮沉澱 500 8000 83.3 經一次活性碳抽濾 300 6000 62.5 經二次活性碳抽濾 300 4400 45.8 經 Sephadex G-15 管柱層析 120 3120 32.5 將各步驟之純化產物分別稀釋至有效濃度後,做抗菌活性實驗分析,測量 其抑制圈大小,乘上稀釋倍數及體積做為抗菌物質之含量定義;在將初培 養液定為 100%下與之比較後,以此計算出各步驟在純化過程中的回收率。
(A) (B) (C) 圖 8. AB-10 抗生物質於 TLC 上之表現 (A)以涼風吹拂 1 分鐘 (B)以熱風吹拂 1 分鐘 (C)以熱風吹拂 2 分鐘 展開系統:Silica gel 60 TLC Ethyl Acetate:Methanol=8:2
(A) (B) 圖 9. AB-10 抗生物質之純度表現及相對應之抑制圈位置 (A)TLC 片未經 25%硫酸溶液顯色 (B)TLC 片經 25%硫酸溶液顯色 展開系統:Silica gel 60 TLC Ethyl Acetate:Methanol=8:2
(三)以熱風吹拂 2 分鐘時: 展開後,發現抗生物質將不會被展開液帶開;雜質與抗生物質均會停 留在原點的位置。 此雜質在以冷風處理下,展開後不但緊鄰在抗生物質的下方,在 UV254nm 光照下,更與抗生物質有著非常雷同的淡黃色螢光表現,經反覆 推敲下,認為:此雜質與抗生物質之間極有可能是 isoform 的關係,此現 象在生物體內非常的常見(如:人體內的酒精脫氫酶)。 在薄膜色層分析時,分別以冷、熱風經不同時間的吹拂下,有不同的 展開結果。這可能是由於 isoform 物質在結構上有著若干些許差異,造成 其對溫度或乾燥上的耐受性亦有所不同。 從實驗結果得知,此抗生物質與 雜質均會受到高溫、乾燥或是其他因素的影響,導致其結構和極性上發生 變化,進而影響在 TLC 上展開後的表現。比較之下,雜質似乎對溫度或乾 燥的耐受力較低,一旦以熱風吹拂,便無法再被展開液帶離原點;而抗生 物質則是在以熱風吹拂超過 2 分鐘以上時,才會出現停滯在原點的情況。 再者,進一步推測此抗生物質可能有著 epoxide 結構(Bierl,1971), 如圖 10 所示,隨著 epoxide 環狀結構的破壞,其極性關係將由非極性變為 極性,如此一來,就會與 TLC 片上極性的 silica gel 結合,而不被展開液
(A)
(B)
所帶離原點,這與實驗的結果相符合,另一方面,epoxide 上所接之官能 基的不同會影響其環狀結構打開的難易度,這可能也就是抗生物質與雜質 結構上的差異所在。 此外,也可能由於此雜質與抗生物質是 isoform 的關係,彼此的物化 性質非常雷同,導致在分離上的如影相隨,大大增加了純化上的困難,有 待後繼研究者來加以突破。
第六節 抗生物質之性質
(一)溫度穩定性 如圖 11 所示,純化之抗生物質於 60℃下處理 30 分鐘,保有 90%以上 之活性,即使在 80℃下仍有 75%左右之抗菌活性,然而當加熱溫度超過 90℃時,其抗菌活性將大幅下降至 30%左右。 (二)有機溶劑穩定性如表 11 所示,以非極性溶劑(Butanol、CHCl3、Ethyl Acetate、Hexane、
Isooctane)皆無法將純化之抗生物質萃取至有機層,活性仍保留在水層 中,說明其為極性較高之物質,而在丙酮進行沉澱分割時,活性保留在上 清液中,判斷此抗生物質為一小分子物質。
0 1 2 3 4 5 6 7 8 9 10 0 20 40 60 80 100 12 Temperature(℃ ) C lea r zo n e size (m m ) 0 圖 11. AB-10 抗生物質之溫度耐受性 分別將經純化之抗生物質以不同溫度(20~100℃) 水浴 30 分鐘後,測量其抗菌活性變化
表 11. AB-10 抗生物質之有機溶劑穩定性 抗菌活性/ 抑制圈大小 (mm) 有機溶劑 有機層 水層 Ethyl acetate - 8 Hexane - 8 Isooctane - 8 Chloroform - 8 Butanol 2 10 - : 無抑制效果
(三)最小抑制濃度(MIC)測定 在含
Bacillus
菌液之液態 MY 培養基中逐步提高抗生物質的含 量,如圖 12 所示,於抗生物質稀釋 16 倍時,其 OD600值開始有上昇的趨 勢,表示此時抗生物質對於Bacillus
開始不具抑制效果,而在稀釋 128 倍 後Bacillus
的生長漸趨於平緩,故此抗生物質的最小抑制濃度落在稀釋 16 倍時的抗生物質活性濃度。 (四)抗菌圖譜(Spectrum) 如表 12 所示,由 AB-10 菌生產之抗生物質,對革蘭氏陽性菌如Bacillus
sp.
屬有明顯之抑制效果,但對Staphylococcus sp.
的抑制效果則較差; 而對革蘭氏陰性菌如E. coli
有不錯的抑菌效果,特別是對由養殖魚蝦貝養殖場所分離的腸炎弧菌:
Vibrio alginolyticus
及Vibrio harveyi
有極佳的抑制效果。然而,對酵母菌如
Candida albican
則沒有抑制效果。 值得一提的是:由 AB-10 菌生產之抗生物質對自己本身(Arthrobacter
) 亦有抑制效果。 (五)抑菌之可逆性 為了解此抗生物質之特性是使其生長停滯(static)或是完全殺死性 (cidal),本實驗利用回復性方式來進行探討,如圖 13 所示,在相同條件0
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0.8
1/
10
24
1/
51
2
1/
25
6
1/
12
8
1/
64
1/
32
1/
16
1/
8
1/
4
1/
2
1
Dilution of Antibiotics
OD
600
圖 12. AB-10 抗生物質對
Bacillus
之最小抑制濃度(MIC)測定取 95µl 經 2 倍連續稀釋成不同濃度之 AB-10 抗生物質,各別加入 5µl 經
24 小時培養之
Bacillus
菌液及 900µl MY 培養液,於 30℃下培養 12 小時後,觀測其 OD600吸光值之變化。
表 12. AB-10 抗生物質之抗菌圖譜 菌 種 抗菌活性/ 抑制圈大小(mm) E. coli ATCC 25922 6.0 Vibro harveyi 8.5 Vibrio alginolyticus 8.5 Staphylococcus sp. ATCC 29123 3.0 Bacillus sp. 8.5 Arthrobacter sp. 5.0 Candida albican CRCC 26512 - -:無抑制效果
0 0.2 0.4 0.6 0.8 1 1.2 1.4 0 3 6 9 12 15 18 21 24 27 Time (h) O D 600 圖 13. AB-10 抗生物質對
Bacillus
之抑制效應▲:加入經純化之 AB-10 抗生物質 ■ :沒有加入經純化之 AB-10 抗生物質
Bacillus
於 MY 培養液中,培養 24 小時後,取 5µl 至 900µl MY 培養液中, 並加入 95µl 經純化之抗生物質,對照組使用無菌水取代抗生物質,於 30℃ 下培養,每隔 3 小時取樣,測其吸光值;12 小時後,以無菌水洗滌數次以 移除殘留之抗生物質後,再添加新鮮之 MY 培養液 1000µl,於 30℃下進行 培養 12 小時,每隔 3 小時取樣測定吸光值。下培養 12 小時,未添加抗生物質之對照組,可見此抗生物質確實有效抑制
Bacillus cereus
之生長,而在 12 小時以無菌水沖洗數次來除去抗生物質後,菌體便又會開始生長,因此可推測 AB-10 生產之抗生物質對於
Bacillus
cereus
的抑制效果是屬於生長停滯性的,並非完全殺死性的。第七節 綜合比較
AB-10 菌經鑑定為
Arthrobacter
屬,就已知文獻中探尋,Arthrobacter
屬中會生產抗生物質是非常的罕見,僅在西元 1996 年由日本人 Kamigiri
氏發表-編號 YM-30059 亦為
Arthrobacter
屬,能生產一新型 quinolone 的抗生物質。 然而,比較 AB-10 與 YM-30059 兩菌株在生產及抗生物質的部 分性質上均有迥然不同的差異,如表 13 所示,
Arthrobacter
YM-30059 與 AB-10 的最適抗生物質生產培養基有很大的不同,在生產的時間上亦差很 多(3 天對 12 小時);而在抗生物質的性質部份,AB-10 菌生產之抗生物質 無法以非極性溶劑萃取,顯示其為一高極性之物質,與 YM-30059 菌生產之 低極性抗生物質是不一樣的。表 13. AB-10 抗生物質與 YM-30059 抗生物質相關性質之比較 性 質 AB-10 YM-30059 菌屬 Arthrobacter Arthrobacter 生產時間 12 小時 3 天 極性關係 親水性 疏水性 結構 尚未知 Quinolone 抗菌圖譜 E. coli G(+)and G(-) Vibro harveyi Vibrio alginolyticus Bacillus sp. Arthrobacter sp. Staphylococcus sp. 最適之抗生物質生產培養基比較: AB-10:
1% glycerol, 0.7% yeast extract, 0.5% malt extract 及 0.06% MgSO4
YM-30059:
1% glucose, 2% potato starch, 0.5% yeast extract, 0.5% polypeptone 及 0.4% CaCO3
第四章 結論與展望
自戶外土壤中分離出一特別之細菌株,編號為 AB-10,可分泌抗生物
質,經菌種鑑定為
Arthrobacter
屬。研究初期,為了提高抗生物質之產量,以利後續生產純化之進行,遂 進行抗生物質之最適生產培養基的探討。實驗結果為:1% Glycerol、0.7
% yeast extract、0.5% malt extract 及 0.06% MgSO4,於 30℃、經轉
速 150rpm 培養 12 小時,有最佳之產率,抑制圈半徑可達 9.0mm。由生長 曲線得知 AB-10 菌生產之抗生物質,是屬於與生長相關之一級代謝物,與 大部分抗生物質屬於二級代謝物不同,具有較低之毒性。 純化上,粗培養液經離心去除菌體及大分子物質後,先以丙酮沉澱除 去大部分蛋白質,續經兩次的活性碳抽濾和 Sephadex G-15 管柱層析後, 已能除去大部分雜質成份,收得透明澄清之純化產物。經薄膜色層分析及 硫酸顯色處理,發現除了抗生物質外尚有另一雜質的存在。 經純化之抗生物質,無法以非極性溶劑萃取至有機層,活性仍保留在水 層中,而以丙酮進行沉澱分割時,活性保留在上清液中,顯示此抗生物質 為一較罕見之極性高的小分子物質。於 60℃下處理 30 分鐘,保有 90%以
上之活性,即使在 80℃下仍有 75%左右之抗菌活性,然而當加熱溫度超過 90℃時,其抗菌活性則開始大幅下降至 30%。 從抗菌圖譜得知,AB-10 菌生產之抗生物質,對革蘭氏陽性菌(如:
Bacillus
)有明顯之抑菌效果,對金黃色葡萄球菌則較差,而對於革蘭氏 陰性菌(如:E. coli
及弧菌)也有不錯的抑菌效果,但對酵母菌(如:Candida albicans
)則沒有抑制效果,特別的是,該抗生物質對於本身Arthrobacter
亦會產生抑制。至於此抗生物質的抑制效果是屬於生長停滯 性的,並非完全殺死性的。 綜合以上性質特點及生產菌株,判斷應為一從未見於文獻之新型抗生 物質,極具學術研究及應用價值,期待開創此抗生物質在植物病害、林業 防護、養殖水產、畜牧病害、甚至於人類之臨床感染病之防衛上有所貢獻。第五章 參考文獻
蘇遠志(1999)抗生素之定義及分類,In 應用微生物學 , pp.797-802, 華香園出版社
Aharonowitz, Y.(1980)Nitrongen metabolite regulation of antibiotic biosynthesis, Annu. Rev. Microbiol. 34, 209-233.
Bierl, B.A., Beroza, M. and Aldridge, M.H. (1971) Determination of epoxide position and configuration at the microgram level and recognition of epoxides by reaction thin-layer chromatography. Analytical Chemistry. 43, 636-641 Bora, O., Kyunggon, K., Jungeun, P., Jongchul, Y., Dohyun, H. and Youngsoo,
K.(2004)Modifying the substrate specificity of penicillin G acylase to cephalosporin acylase by mutating active-site residues. Biochemical and
Biophysical Research Communications. 319, 486-492.
Breithaupt, H.(1999)The new antibiotics:Can novel antibacterial treatments combat the rising tide of drug-resistant infection. Nature Biotechnology. 17, 1165-1169.
Bush, K. and Macielag, M.(2000)New approaches in the treatment of bacterial infections. Current Opinion in Chemical Biology. 4, 433-439.
Christian, J.S.(1996)The quinolone antibiotics. Infectious Diseases Update. 3, 87-92.
Cocito, C., Giambattista, M., Nyssen, E., Vannuffel, P.(1997)Inhibition of protein synthesis by streptogramins and related antibiotics. The Journal of
Cooperman, B.S.(1977)Identification of binding sites on the E. coli ribosome by affinity labeling. Advences in Experimental Medicine and Biology. 86, 595-809.
Copp, B.R.(2003)Antimycobacterial natural products. Natural Product Report . 6, 535-557.
Françoise, V. B.(2004)Glycopeptides in clinical development: pharmacological profile and clinical perspectives. Current Opinion in Pharmacology. 4,
471-478.
Ge, M.(1999)Vancomycin derivatives that inhibit peptidoglycan biosynthesis without binding D-Ala-D-Ala. Science. 284, 507-511.
Greenwood, D.(1996)Modes of action, In Antibiotic and chemotherapy:
anti-infective agents and their use in therapy (O’Grady, F.), pp.10-22,
Churchill Livingstone.
Hammond, S.M. and Lambert, P.A.(1978)Antibiotics as chemotherapeutic. In
Antibiotics and antimicrobial action(Hammond, S.M. and Lambert, P.A.),
pp.4-7, Camelot Press Led.
Hartsel, S. and Bolard, J.(1996)Amphotericin B: new life for an old drug.
Trends in Pharmacology Sciences. 17, 445-449.
Joshi, S. (2002) HPLC separation of antibiotics present in formulated and unformulated samples. Journal of Pharmaceutical and Biomedical Analysis. 28, 795-809.
Kamigiri, K., Tokunaga, T., Shibazaki, M., Setiawan, B., Rantiatmodjo, R. M., Morioka, M. and Suzaki, K. (1996) YM-30059, a novel quinolone antibiotic
produced by Arthobacter sp. The Journal of Antibiotics. 49, 823-825.
Kingston, W.(2000)Antibiotics, invention and innovation. Research Policy. 29, 679-710.
Krieg, N.R. and Holt, J.G.(1989)Bergey’s Manual of Systematic Bacteriology. 2, pp.1288-1295.
Lancini, G., Parenti, F. and Gall, G.G.(1995)The activity of Antibiotics, In
Antibiotic: a multidisciplinary approach (Lancini, G.), pp.15-83, Plenum
Press.
Lester, W.(1972)Rifampin: a semisynthetic derivative of rifamycin--a prototype for the future. Annu Review of Microbiology. 26, 85-102.
Lundstrom, T.S. and Sobel, J.D.(2004)Antibiotics for gram-positive bacterial infections: vancomycin, quinupristin-dalfopristin, linezolid, and daptomycin.
Infectious Disease Clinics of North America. 18, 651-668.
Masato, W., Kouichi, T., Masayuki, K. and Murni, R.R. (2001)
Anti-helicobacter pylori pharmaceutical composition. esp@cenet database. US6184230.
Miller, E.L.(2002)The penicillins: a review and update. The Journal of
Midwifery Womens Health. 47, 426-434.
Perlman, D.(1979)Microbial production of antibiotics, In Microbial technology
microbial processes 2nd(Peppler, H.J. and D. Perlman), pp.254-261,
Academic Press.
high-performance liquid chromatography. Journal of Chromatography. 812, 179-189.
Seydel, J.K.(1968)Sulfonamides, structure-activity relationship, and mode of action. Structural problems of the antibacterial action of 4-aminobenzoic acid (PABA) antagonists. Journal of Pharmaceutical Sciences. 57, 1455-1478. Vandamme, E.J.(1984) Antibiotics search and production: an overview, In
Biotechnology of industrial antibiotics(Vandamme, E.J), pp. 6-15, Marcel
Dekker, ING..
William, R.H.(1993)Bergey’s Manual of Determinative Bacteriology. pp.571-582.
Zhanel, G.G., Homenuik, K., Nichol, K., Noreddin, A., Vercaigne, L., Embil, J., Gin, A., Karlowsky, J.A. and Hoban, D.J.(2004)The glycylcyclines: a comparative review with the tetracyclines. Drugs. 64, 63-88.