國立台灣大學藥學系暨研究所 博士論文
Graduate Institute of Pharmaceutical Sciences College of Medicine
National Taiwan University Doctoral Thesis
探討前列腺癌骨轉移作用分子及其臨床應用 Study of the Molecular in Bone Metastasis of Prostate
Cancer and the Clinical Application
黃織芬 Chih-Fen Huang 指導教授: 林慧玲 博士
林淑華 博士 Advisor: Fe-Lin Lin Wu Ph.D.
Sue-Hwa Lin Ph.D.
中華民國 102 年 1 月
Jan, 2013
I
II
誌 謝
論文付梓前最難完成的就是這一頁,難不在於它的內容,而是久久無法平復 心情,寫下我想感謝的話語。
五年多前選擇修讀博士學位,或許有一些傻勁,但也開啟了我更寬廣的視野。
這一篇論文的完成,首先要感謝我的指導教授林淑華博士及林慧玲博士,四年多 前因為林慧玲老師的鼓勵與堅持,讓我有勇氣帶著三個孩子赴美進修,更感謝林 淑華教授的寬容,讓我得已進入她在M.D. Anderson Cancer Center 的研究室,一窺 分子生物與癌症研究的殿堂。感謝林淑華教授對我悉心的指導與信任,從最基礎 的蛋白分子研究、細胞培養、研究設計,一直到論文的邏輯思考與撰寫,一次次 耐心的帶領,讓我得以在最短的時間參與多項研究,並有具體的成果。
林慧玲老師對於專業的堅持,是我永遠的學習典範,在我課業學習、研究及 工作,總是以過來者很體貼的為我著想,諄諄提醒,讓我有許多發揮的空間與學 習的機會。
同時也要感謝亦師亦友的沈麗娟副教授,雖然是我的學妹,但不論處事或研 究總是比我有定見,今天能順利畢業,她是幕後最重要的「監造」。此外還要感謝 顧記華主任、許麗卿副教授及簡伯武教授對此論文的指導與匡正。
在研究的路上,感謝Yu-Chen 無私的協助與指導,Christina, Koi 及 Asim 在研 究上的協助,讓我能有效率的學習並完成多項研究。謝謝麗華,在論文排版上給 我許多的幫忙。
最後要感謝志城及三個孩子,還有默默關心與支持我的父親,你們是我的最 佳後盾與前進的動力,這分論文在你們不斷的體諒與陪伴下完成,這是我們共同 寫下的紀錄與榮耀。
博士學位的完成,是另一個起點的開始,感謝一路陪伴我的師長與家人,我 會在未來更寬廣的路上繼續加油與努力。
黃織芬謹誌 2013 年 1 月
III
中文摘要
前列腺癌 (prostate cancer, PCa) 特別傾向於轉移至骨骼,且骨轉移為其死亡 的相關主要原因,主導前列腺癌細胞與成骨細胞 (osteoblast) 間交互作用的黏附分 子 (adhesion molecular) 可能扮演了重要角色。Cadherin-11,又稱為 OB-cadherin,
即為黏附分子之一,且在前列腺癌細胞株上有高度的表現。
Cadherin-11 已被證實在前列腺癌骨轉移扮演重要角色,但其藉由何種機轉而 在此癌細胞轉移的過程中作用則尚不清楚。本研究利用未表現有cadherin-11 的 C4-2B4 細胞株使其表面表現 cadherin-11,可促使其細胞擴展作用 (spreading) 並 嵌入 (intercalation) 成骨細胞層,並刺激 C4-2B4 細胞的移行 (migration) 及侵襲 (invasion) 現象。對於已表現有 cadherin-11 之 PC3 細胞株進行 cadherin-11 負調控 (downregulation) 則減少其細胞的活動及侵襲作用。更進一步證實,cadherin-11 胞 質區域尾端的juxtamembrane 及-catenin 結合區域皆為細胞移行與侵襲作用所必 需。這些結果顯示,cadherin-11 不僅提供前列腺癌細胞與成骨細胞間的連結,也 透過其細胞質區域的訊息傳遞增加細胞活動及侵襲作用,且可能促使前列腺癌細 胞骨轉移後的移生 (colonization)。
本研究也同時發現cadherin-11 的黏附基序 (adhesion motif) 在其同類親合性 (homophilic) 的細胞間黏附扮演重要角色,透過抑制此基序可干擾 cadherin-11 介 導的前列腺癌細胞與成骨細胞黏附作用,並避免或減緩前列腺癌細胞發生骨轉 移。
Cadherin 介導的細胞黏附作用為鈣離子依賴性,本研究發現 cadherin-11 的黏 附基序主要在其細胞外區域的第三區塊 (EC3)。針對 cadherin-11 細胞外區域製備 21 株單株抗體,其中 mAb 2C7 與 1A5 主要結合至 EC3,並可抑制細胞與細胞間 的聚集作用,當2C7 在 EC3 的抗原決定位 (epitope) 發生突變時,cadherin-11 促 使的細胞黏附作用則大幅降低。
在前列腺癌細胞中,cadherin-11 的異常表達提高了其在體外成骨細胞的黏附 作用,且在活體試驗也增加發生骨轉移的機率。過去對於阻擋此黏附作用是否會
IV
抑制前列腺癌細胞的骨轉移並不清楚,但透過癌細胞轉移的實驗模式,將前列腺 癌細胞直接注入老鼠心臟, mAb 2C7 全身性給藥可顯著的減少擴散的前列腺癌細 胞株PC3-mm2 發生骨轉移的機率。綜合以上結果,透過干擾 cadherin-11 介導的黏 附作用,可預防前列腺癌或其它癌細胞發生骨轉移。
關鍵詞:前列腺癌、癌症轉移、鈣黏蛋白-11、黏附、移行、侵襲、單株抗體
V
Abstract
Prostate cancer (PCa) has propensity to metastasize to bone and bone metastasis is the major cause of PCa related mortality. Cell adhesion molecules that mediate the interactions between metastatic PCa cells and osteoblasts, a major cell type in bone, may play a role in the metastasis of PCa cells to bone. Cadherin-11, also known as OB-cadherin, is one such adhesion molecule and highly expressed in a PCa cell line.
Cadherin-11 has been shown to play a role in the metastasis of PCa cells to bone but the mechanism by which cadherin-11 is involved in this process is not known. In this study, we show that expression of cadherin-11 in cadherin-11-negative C4-2B4 cells increases their spreading and intercalation into an osteoblast layer, and stimulates C4-2B4 cell migration and invasiveness. Downregulation of cadherin-11 in cadherin-11-expressing metastatic PC3 cells decreases cell motility and invasiveness.
Further, both the juxtamembrane and -catenin binding domains in the cytoplasmic tail of cadherin-11 are required for cell migration and invasion. These observations suggest that cadherin-11 not only provides a physical link between PCa cells and osteoblasts but also increases PCa cell motility and invasiveness through its cytoplasmic domain that may facilitate the metastatic colonization of PCa cells in bone.
We also identify a novel adhesion motif that mediates cadherin-11 homophilic cell-cell adhesion. We show that interfering cadherin-11-mediated PCa cell and osteoblast adhesion through inhibition of this motif may be developed for preventing or delaying prostate cancer bone metastasis.
The cadherin family of cell adhesion molecules mediates Ca2+-dependent cell-cell adhesion. We identified a novel adhesion motif in the EC3 domain in cadherin-11. We
VI
generated 21 monoclonal antibodies against cadherin-11 EC domains. Among them, mAb 2C7 and 1A5 were found to inhibit cadherin-11-mediated cell aggregation.
Mutation of the mAb 2C7 epitope in the EC3 domain abolished cadherin-11-mediated adhesion.
In PCa cells, the aberrant expression of cadherin-11 increases their adhesion to osteoblasts in vitro and metastasis to bone in vivo. Whether blocking this adhesion will inhibit PCa metastasis to bone was previously unknown. Using an experimental metastasis model by injecting PCa cells intracardially, we showed that systemic delivery of mAb 2C7 significantly reduced the metastasis of disseminated PC3-mm2 to bone.
Our studies suggest that perturbing cadherin-11-mediated adhesion may prevent bone metastasis from prostate or other cancers.
Keywords:prostate cancer, metastasis, cadherin-11, adhesion, migration, invasion, monoclonal antibody
VII
目錄
中文摘要 ... III ABSTRACT ... V
第 1 章 文獻探討 ... 1
第 2 章 研究目的 ... 5
第 3 章 實驗方法與材料 ... 6
3.1 細胞株 ... 6
3.2 細胞培養 ... 6
3.3CADHERIN-11-FC製備 ... 7
3.4 西方墨點法 (WESTERN BLOT)分析 ... 7
3.5 製備表現有CADHERIN-11 的 L-CELL及C4-2B4 前列腺癌細胞株 ... 8
3.6 製備抑制 (KNOCKDOWN) CADHERIN-11 表現的 PC3-MM2 細胞 ... 8
3.7 細胞擴展(SPREADING)分析 ... 9
3.8C4-2B4 前列腺癌細胞與成骨細胞的共培養 ... 9
3.9 免疫細胞化學 (IMMUNOCYTOCHEMISTRY) 染色分析... 9
3.10 細胞移行 (MIGRATION) 分析 ... 10
3.11 細胞侵襲 (INVASION) 分析 ... 10
3.12 免疫沉澱法 (IMMUNOPRECIPITATION) 分析 ... 10
3.13 微陣列 (MICROARRAY) 基因分析 ... 11
3.14FACS(FLUORESCENCE-ACTIVATED CELL SORTING)分析 ... 11
3.15 細胞增殖、存活與DOCETAXEL敏感性分析 ... 11
3.16 非附著依賴性生長 (ANCHORAGE-INDEPENDENT GROWTH) 分析 ... 12
3.17 細胞聚合 (AGGREGATION) 分析 ... 12
3.18CADHERIN-11-HIS7重組蛋白及ANTI-CADHERIN-11 單株抗體製備 ... 12
3.19 製備用於單株抗體結合位置分析之CADHERIN-11 細胞外結構區域 ... 13
3.20 製備表達突變CADHERIN-11 序列的 L-CELL細胞株 ... 13
3.21 老鼠心臟內注射法及其生物光學 (BIOLUMINESCENCE) 測量分析 ... 14
VIII
3.22 統計分析 ... 14
第 4 章 第一部分 ... 15
4.1 結果 ... 16
4.1.1 表現有CADHERIN-11 的前列腺癌細胞可促使其在CADHERIN-11-FC塗層培養 板的細胞擴展作用。 ... 16
4.1.2CADHERIN-11 促使前列腺癌細胞與成骨細胞間黏附作用 ... 17
4.1.3CADHERIN-11 促使前列腺癌細胞嵌入 (INTERCALATION) 成骨細胞 ... 17
4.1.4CADHERIN-11 在前列腺癌細胞移行 (MIGRATION) 作用之影響 ... 18
4.1.5CADHERIN-11 在前列腺癌細胞侵襲 (INVASION) 作用上之影響 ... 19
4.1.6CADHERIN-11 對於前列腺癌細胞的增殖、存活、DOCETAXEL治療敏感性,以 及非附著依賴性生長的影響 ... 19
4.1.7CADHERIN-11 介導的前列腺癌細胞移行與侵襲作用與其細胞內區域 (CYTOPLASMIC DOMAIN) 相關 ... 19
4.1.8CADHERIN-11 對於 C4-2B4 細胞基因表現的影響 ... 21
4.2 討論 ... 22
第 5 章 第二部分 ... 24
5.1 結果 ... 25
5.1.1CADHERIN-11 促成的細胞聚集 (AGGREGATION) 作用可被抗體抑制 ... 25
5.1.2ANTI-CADHERIN-11 單株抗體篩選 ... 25
5.1.3ANTI-CADHERIN-11 單株抗體MAB 2C7 與 1A5 之親和性及專一性 ... 26
5.1.4 鑑別MAB 2C7 在CADHERIN-11 的結合區域 ... 26
5.1.5 MAB 2C7 之抗原決定位參與CADHERIN-11 促使的細胞黏附作用 ... 27
5.1.6 MAB 2C7 抑制 PC3-MM2 與 MC3T3-E1 成骨細胞間的聚集作用 ... 29
5.1.7 在老鼠骨轉移的實驗模式MAB 2C7 可減少前列腺癌細胞轉移機率 ... 29
5.2 討論 ... 31
第 6 章 總結 ... 35
第 7 章 參考文獻 ... 36
IX
圖目錄
圖 1. CADHERIN‐11 對於細胞擴展作用之影響 ... 45
圖 2. CADHERIN‐11 在各種成骨細胞株上的表現及對細胞吸附作用之影響... 46
圖 3. CADHERIN‐11 促使前列腺癌細胞吸附於成骨細胞並改變細胞的形狀表現... 47
圖 4. CADHERIN‐11 介導前列腺癌細胞與成骨細胞間的吸附作用... 48
圖 5. CADHERIN‐11 促使前列腺癌細胞嵌入成骨細胞層... 49
圖 6. CADHERIN‐11 對於細胞移行 (MIGRATION) 及侵襲 (INVASION)作用之影響 ... 50
圖 8.表現完整CADHERIN‐11 及其突變序列之 C4‐2B4 細胞鑑別分析 ... 52
圖 9. CADHERIN‐11 細胞內區域對細胞擴展 (SPREADING) 作用之影響 ... 53
圖 10. CADHERIN‐11 細胞內區域對細胞移行 (MIGRATION) 及侵襲 (INVASION) 作用之影 響 ... 54
圖 11. CADHERIN‐11 的表現對 C4‐2B4 細胞侵襲 (INVASION) 作用相關基因表現之影響 ... 55
圖 12. CADHERIN‐11 的表現對 C4‐2B4 細胞移行 (MIGRATION) 作用相關基因表現之影響 ... 56
圖 13. CADHERIN‐11 及其多株抗體對細胞聚集 (AGGREGATION) 作用之影響 ... 57
圖 14. ANTI‐CADHERIN‐11 單株抗體對於細胞聚集作用之影響 ... 58
圖 15. ANTI‐CADHERIN‐11 單株抗體 2C7 及 1A5 之 FACS 分析 ... 59
圖 16. ANTI‐CADHERIN‐11 單株抗體 2C7 與 1A5 之親和性及專一性 ... 60
圖 17.單株抗體 1A5 及 2C7 結合區域確認 ... 61
圖 18.單株抗體 1A5 及 2C7 抗體決定位 (EPITOPE) 確認 ... 62
圖 19. CADHERIN‐11 突變體及其抗體辨識分析 ... 63
圖 20. FACS 分析 CADHERIN‐11 野生型及突變體之抗體作用活性 ... 64
圖 21. 2C7 之抗原決定位突變將抑制細胞聚集作用 ... 65
圖 22. MAB 2C7 可阻斷 PC3‐MM2 與 MC3T3‐E1 間的細胞聚集作用 ... 66
圖 23. 在老鼠骨轉移的試驗模式MAB 2C7 可降低前列腺癌細胞骨轉移機率 ... 68
X
表目錄
表 1. 細胞株清單 ... 69
表 2.CADHERIN-11 抗體試驗使用之OLIGONUCLEOTIDE 序列清單 ... 70
表 3.ANTI-CADHERIN-11 抗體篩選結果... 72
附圖目錄
附圖 1. 表現CADHERIN-11-FC 之293FT 細胞製備、篩選及鑑別 ...73附圖 2.CADHERIN-11 核甘酸及胺基酸序列-1 ...74
附圖 3.CADHERIN-11 核甘酸及胺基酸序列-2 ...75
附圖 4.CADHERIN-11 核甘酸及胺基酸序列-3 ...76
附圖 5.CADHERIN-11 核甘酸及胺基酸序列-4 ...77
附圖 6.4B6 抗體選擇性辨識人類CADHERIN-11 ...78
1
第 1 章 文獻探討
癌症已連續數年居國人死因第一位,前列腺癌為歐、美國國家癌症盛行率第 一位,也是造成癌症相關死亡原因的第二位[1],在國內依國民健康局 2008 年統計 資料亦為癌症盛行率第五位。
前列腺癌在臨床上有複雜的分期及治療策略,以藥物或手術合併或不合併抗 男性荷爾蒙藥物,以降低病人體內男性荷爾蒙 (androgen) 濃度,藉以達到抑制或 控制前列腺癌腫瘤細胞生長之目的,此即為後期前列腺癌(advanced prostate cancer) 最主要的男性荷爾蒙剝奪療法 (androgen deprivation therapy)。但臨床發現,當前 列腺癌治療發生賀爾蒙抗藥反應 (resistance) 時,多數已發生骨轉移[2] ,且後續 治療的預後不佳。但其引起骨轉移的分子及細胞機轉尚未清楚,且缺乏良好的治 療或預防策略。
前列腺癌發生骨轉移與其相關併發症及死亡率有相當的關聯性[3]。Jacobs 等 人透過屍體解剖 (autopsy) 的研究[4],80%前列腺癌死亡的病人有骨轉移。Shah 等 人[5]同樣在前列腺癌死亡個案的快速解剖 (rapid-autopsy) 的研究也證實,骨骼為 最好發的轉移部位,占約83%。同時也觀察到 androgen receptor 在正常前列腺細胞 或初期前列腺癌細胞均有一定的表現量,但在末期轉移的前列腺癌病人身上則缺 少一致性,且觀察到多數為減少 (down-regulation) 現象。Lee 等人[6]的研究也發 現,發生雄性激素剝奪治療無效 (androgen castration-resistant) 的前列腺癌通常同 時會發展為骨轉移,且在組織切片免疫染色的觀察,該情況下的前列腺癌細胞高 度表現cadherin-11。
荷爾蒙治療無效的後期前列腺癌傾向於骨轉移的機轉尚不清楚,癌細胞要發 生骨轉移包含了複雜的過程,從原生部位移出 (escape from primary organ)、滲入 血管 (intravasation)、在血液循環中存活 (survival in circulation)、著附於轉移的目 標器官 (chemoattraction and extravasation),並且在轉移部位存活與生長等[7]。就 前列腺癌細胞轉移至骨骼的專一性,其在骨環境中能存留並生長是主要的關鍵,
而這之間必然有一些分子分子間的交互作用。
2
血液循環中的癌細胞如何轉移至特定器官並不清楚,目前有許多研究對前列 腺癌細胞轉移至骨骼有相關的研究,Tantivejkul[7]等人的研究即指出,integrin 吸 附分子可促使前列腺癌細胞吸附於骨組織的表皮細胞。而癌細胞吸附後必須移行 (migration)穿過表皮細胞層,並在骨骼環境中生長[8, 9]。Sikes 等人的研究更指出 [9],以 LNCaP 及 C4-2 細胞株所作的研究,前列腺癌細胞要能在骨環境中移生 (colonization),不完全決定於其附著在成骨細胞或骨髓上皮細胞的能力,前列腺癌 細胞的侵襲 (invasive) 能力以及前列腺癌細胞與骨環境的分泌物質及細胞間的交 互作用,是前列腺癌細胞能否成功發生骨轉移的重要關鍵。
Taichman 等人[10]的研究指出,透過 CXCR4/SDF-1 的 chemoattrctant 途徑,
在前列腺癌的骨轉移扮演一定的角色,前列腺癌細胞表面的 CXCR4 (C-X-C chemokine receptor type 4)為 內 皮 細 胞 、 成 骨 細 胞 及 基 底 細 胞 分 泌 細 胞 激 素 SDF-1(stromal-derived-factor-1, 也稱為 CXCL 12) 的接受體,透過此機轉使得癌細 胞吸附於骨頭環境並與週遭細胞發生交互作用,進而促進骨轉移。據此可以推論,
應該還有其他類似機轉的途徑使得前列腺癌細胞發生骨轉移。
前 列 腺 癌 可 分 為 腺 泡 細 胞 癌(acinar carcinoma) 及 腺 管 細 胞 癌 (ductal carcinoma),腺泡細胞癌傾向於轉移置骨頭,而腺管細胞癌則傾向於轉移至骨頭以 外的其它器官,二者在基因陣列 (gene array)的分析研究發現,二者的基因表現不 同,腺泡細胞癌有許多與成骨細胞相關的基因,包括cadherin-11、collagen type I 及type II、osteoblast-specific factor-1、osteonectin 等。這與前列腺癌細胞骨轉移具 有擬成骨細胞化 (osteomimetic) 的理論相符合[11]。其中特別是 cadherin-11,又稱 之為OB-cadherin,是一個成骨細胞專屬的膜蛋白,為重要的吸附分子,且在上皮 細胞不存在[12],綜合上述觀察,cadherin-11 可能是前列腺癌細胞轉移至骨環境的 重要分子。
Cadherin 是一系列的跨膜蛋白 (transmembrane protein),並具有鈣離子依賴性 (Ca2+-dependent)細胞與細胞間交互作用。Cadherin 在不同組織會有不同的表現,第 一型 cadherin 包括上皮細胞 E-cadherin,神經細胞上的 N-cadherin,胎盤上的 P-cadherin 及視神經上的 R-cadherin。第二型 cadherin 則包括腎臟細胞上的
3
K-cadherin 及成骨細胞上的 OB-cadherin,又稱之為 cadherin-11。
Cadherin 為細胞與細胞間黏附分子,其在各類的組織形成過程都扮演重要角 色,包括細胞移動、分類及組織與器官中複雜結構之形成等[13, 14]。E-cadherin 及 N-cadherin 特別與多種癌症的病理機轉有關[15],E-cadherin 的消失與 N-cadherin 的正調控,也就是所謂的 cadherin 轉換 (switching),已在多種癌症被觀察到,其 中也包括前列腺癌[16, 17]。基於 cadherin 在細胞與細胞間的交互作用所具有的獨 特功能,推測cadherin 在癌細胞轉移至特有器官也扮演一定的角色[17]。
前列腺癌偏好轉移至骨骼,且骨轉移也是造成前列腺癌相關死亡率的主要成 因 [3, 18]。導致前列腺癌細胞高比例轉移至骨骼的機制尚未清楚。假設負責介導 前列腺癌細胞與骨骼中主要細胞類型的成骨細胞之間互動的細胞黏附分子,在前 列腺癌細胞轉移至骨骼可能扮演重要角色。我們過去的實驗已證實 cadherin-11,
也就是OB-cadherin 為該類黏附分子的一種[19]。Cadherin-11 最初在老鼠成骨細胞 中被發現,其透過同種細胞間黏附功能,影響骨組織的發展[20]。我們也發現 cadherin-11 在骨轉移的前列腺癌細胞衍生出的 PC3 細胞株內有很高表達性。在臨 床標本中,發現 cadherin-11 的表現程度隨著前列腺癌前期到後期發生轉移的組織 逐漸增加,特別是在骨轉移的標本有非常高的表現性。在老鼠的癌症轉移實驗模 式中,藉由心臟內注射 PC3 細胞株而導致 PC3 細胞轉移至骨骼。此現象則因 cadherin-11 專一性的基因 shRNA 抑制 (gene-specific short-hairpin RNA knockdown) 而大幅降低骨轉移的機率[19]。近期 Tamura 等人的研究[21] 也指出,骨轉移的乳 癌 細 胞 MDA-MB-231 (MDA-MB-231-BO) 比 起 腦 轉 移 的 MDA-MB-231 (MDA-MB-231-BR) 細胞有更顯著的 cadherin-11 表現量,此結果與我們過去的實 驗觀察具有一致性。 此外,Tamura 等人也證實如果在 MDA-MB-231-BR 細胞中 增加cadherin-11 的表現量,可提高其轉移至骨骼的機率[21]。綜合以上的觀察,確 認了cadherin-11 在前列腺癌與乳癌細胞的骨轉移有關鍵性的作用。
正常骨組織的發展為蝕骨作用 (osteolytic) 與成骨作用(osteoblastic) 的平 衡,當受到癌細胞侵入時,破壞其正常生理狀態下的平衡,且因癌細胞來源的不 同,有些造成成骨細胞較為活化,則表現為成骨現象,有些則因蝕骨細胞較為活
4
化而呈現蝕骨現象[22]。目前臨床治療,包括 bisphosphonates 及 denosumab 在蝕 骨性骨轉移有相當好的治療效果,但對於成骨性骨轉移之療效仍不理想,在惡性 的骨轉移仍無法有效控制。Ortiz 等人的研究指出,成骨性骨轉移及蝕骨性骨轉移 臨床表現並不相同,且治療策略也應有所差異[22]。
轉移的前列腺癌細胞與骨骼內的細胞建構了讓癌細胞移生的條件,骨骼中最 主要的細胞為成骨細胞,且前列腺癌骨轉移多數為成骨細胞型態 (osteoblastic phenotype)[23],因此推論前列腺癌細胞與成骨細胞有相當專一的交互作用,且此 專一的交互作用是透過某個尚未被充分研究的分子來運作。
Cadherin-11 如何參與骨轉移的機轉尚未清楚。Cadherin-11 是ㄧ個單一跨膜蛋 白,具有五個重覆的細胞膜外區塊 (EC1~EC5) 及一個細胞質區塊[12]。Cadherin 已被證實在癌細胞的活性及發展中具有調節作用,E-cadherin 可抑制癌細胞的侵襲 性 (invasion) [24],而間葉細胞型 (mesenchymal ) cadherin,如 N-cadherin 的表現 則促使癌細胞的生存、轉移與侵襲[25]。Cadherin-11 為間葉細胞型 cadherin 的一 種,然而 cadherin-11 是否為前列腺癌細胞與成骨細胞間交互作用的中介分子,而 導致前列腺癌細胞的移行、侵襲、生長或存活,進而促使其發生轉移,值得進一 步研究。
在過去研究指出,細胞癌化過程中異常吸附分子的表現為許多惡性腫瘤的共 通現象[26]。傳統癌症化學治療或放射線治療雖然可抑制腫瘤細胞生長,但也對正 常細胞造成極大傷害,而該類吸附分子,通常具有癌細胞專一性,可作為癌症治 療的標的[26],其抗體或具抑制作用的小分子可以有效抑制腫瘤生長及器官轉移 [17],是未來重要的發展方向。
Cadherin-11 若為前列腺癌細胞轉移過程細胞間交互作用的重要分子,其主要 吸附位置的拮抗抗體或具抑制作用的小分子,對於骨轉移的抑制應該有一定的角 色。研究顯示cadherin 黏附區域主要位於膜外遠端的第一結構區域(EC1)[27, 28]。
其他的方法研究結果顯示,cadherin 細胞膜外其他位置也參與其同類親合性黏附 (homophilic adhesion) 的調節作用[29-31]。倘能對於病理狀態下,cadherin-11 的異 常表現及其細胞間黏附作用能有進一步的了解,將有助於後續治療策略的研究。
5
第 2 章 研究目的
癌症已是國人死因第一位,前列腺癌亦為男性死亡的重要原因。在發生賀爾 蒙抗藥反應的前列腺癌,特別偏好發生骨轉移,且後續治療預後不佳。過去的理 論推測,前列腺癌細胞在治療過程中發生轉變,並促使它與骨組織中的細胞發生 交互作用,而加速骨轉移的發生,這之間應該有重要分子的存在,倘若能研究得 知,對於後續前列腺癌骨轉移的預防及治療將有相當的突破。
Cadherin 是一系列的跨膜蛋白,並具有鈣離子依賴性的細胞與細胞間交互作 用,各種不同型態的cadherin 存在於各種組織,在正常的前列腺細胞,表現的為 E-cadherin,骨轉移的前列腺癌細胞則主要表現 cadherin-11,而 cadherin-11 也主要 表現在成骨細胞,因此高度推測轉移性前列腺癌細胞具有擬骨化 (osteomimetic) 特性,cadherin-11 在其骨轉移過程扮演重要的角色。
在初步研究證實,cadherin-11 參與前列腺癌細胞骨轉移活動。首先在人類標 本,cadherin-11 未表現於正常前列腺細胞,但隨著其癌化、淋巴轉移及骨轉移而 漸次的增加。其次在前列腺癌細胞株實驗,源自於骨轉移的細胞株PC3-mm2 高度 表現cadherin-11,且賦予細胞親和性黏附作用。在心臟內注射癌細胞的動物試驗 模式,當抑制性調控PC3-mm2 細胞株 cadherin-11 表現量,明顯降低其在骨組織的 移生機率。在人體標本及前列腺癌細胞株試驗,剝奪或抑制雄性激素的作用,導 致cadherin-11 表現量的增加,進而促使骨轉移的發生。因此我們假設,cadherin-11 在前列腺癌細胞異常的表現,將促使前列腺癌細胞的骨轉移。
為證實前述假設,本研究目的包含兩大部分:
一、探討cadherin-11 促使前列腺癌骨轉移的機轉,以控制 cadherin-11 表現與否的 前列腺癌細胞株,觀察其與成骨細胞株的交互作用,以及對各種細胞活動性 的影響,同時利用cadherin-11 細胞內區域突變,觀察其對對細胞活動性的影 響,以了解前列腺癌骨轉移的相關機轉及可能的訊息傳遞途徑。
二、探討cadherin-11 單株抗體對於前列腺癌細胞骨轉移的影響及其可能的臨床應 用。藉由單株抗體的製備、篩選,取得具專一性單株抗體,確認其黏附基序、
對細胞間黏附作用之影響,並藉由心臟內注射癌細胞的骨轉移動物試驗模 式,評估單株抗體對骨轉移的抑制作用。
6
第 3 章 實驗方法與材料
為探討前列腺癌骨轉移之相關機轉,本研究將以多種細胞株 (表 1),利用轉 染技術模擬大量表現cadherin-11 的前列腺癌細胞,或利用已表現有 cadherin-11 的 細胞株進行cadherin-11 表現量的負調控,以建立試驗及對照組研究,並以多種細 胞株證實相關假設之一致性。
另利用成骨細胞株或cadherin-11 細胞膜外片段蛋白的製備,模擬前列腺癌細 胞與骨細胞間的交互作用,觀察cadherin-11 對各種癌細胞轉移相關的細胞活動 性,如細胞黏附、擴展、移行或侵襲作用等之影響。
為探討單株抗體對cadherin-11 之抑制作用,利用基因工程技術製備各種 cadherin-11 細胞膜外區域片段,及突變序列,以篩選具潛力之單株抗體,並確認 其作用之黏附基序。另以免疫缺陷小鼠及經心臟內注射癌細胞的骨轉移動物試驗 模式,以觀察單株抗體對骨轉移之影響。
各種實驗方法及相關材料,分別說明如下。
3.1 細胞株
UMR106、MC3T3-E1、ROS17/2.8、Saos-2、L-cell (CCL1.3)、293FT 和 C2C12 細胞是由American Type Culture Collection (Manassas, VA) 採購而來,而由 LNCaP 細胞產出之亞系C4-2B4[32]是由達拉威大學(University of Delaware ) Robert Sikes 博士提供。表現有cadherin-11 的前列腺癌 PC3 及 PC3-mm2 細胞株則是由 M. D.
Anderson 癌症中心的 I. J. Fidler 博士提供。載有 cadherin-11 突變體 cad11-JMD 與 cad11-CBS 的 pCEP4 載體則是由哈佛大學 Brigham and Woman Hospital, Harvard University 的 Michael Brenner 博士提供。
3.2 細胞培養
L-cell 、 293FT 、 UMR106 、 ROS17/2.8 、 Saos-2 、 C2C12 培 養 於 DMEM (Dulbecco's Modified Eagle Medium) medium,C4-2B4、PC3、PC3-mm2 細胞培養
7
於RPMI-1640 (Roswell Park Memorial Institute-1640) medium,MC3T3-E1 細胞培養 於-MEM (-Minimum Essential Media) medium,培養液均加入 10% fetal bovine serum (v/v) 、 100 unit/mL penicillin 、 0.1 mg/mL streptomycin 、 0.25 g/mL amphotericin B,培養箱控制溫度 37℃,二氧化碳濃度 5%。
3.3 Cadherin-11-Fc 製備
利用 bicistronic pBMN-I-GFP反轉錄病毒載體 (Dr. Gary Nolan提供, Stanford University),將human cadherin-11 (OB-cadherin) 的細胞外區域與人類IgG1之Fc片 段接合。首先以BamHI- Fc-F 及 NotI-Fc-R引子 ( primers) 進行PCR放大, 利用 GoTaq polymerase (Promega, Madison, WI) 並以 94 °C 5 min (1 個循環)、94 °C 30 s、 53 °C 30 s、72 °C 30 s (30個循環),及 72 °C 10 min (1個循環)進行反應,再 以BamHI and NotI 限制酶完成pBMN-Fc-I-GFP製備。另利用BgIII and BamHI 限制 酶將cadherin-11細胞外區域之DNA嵌入pBMN-Fc-I-GFP,完成
pBMN-(OB-CAD-Fc)-I-GFP置備[33]。
再利用Fugene 6 (Roche Diagnostics, Indianapolis, IN) 將
pBMN-(OB-CAD-Fc)-I-GFP轉染至Phoenix 細胞,細胞培養48小時後,取得含病毒 之上清液再與Polybrene (hexadimethrine bromide H9268; Sigma– Aldrich, St. Louis, MO) 混合後加入293FT 細胞培養液中,並於32 °C下培養72小時,最後利用轉染成 功之細胞同時表現的GFP綠色螢光,以FACS進行細胞挑選 (附圖1)。
表現OB-CAD-Fc (Cad-11-Fc) 之293FT細胞培養於DMEM medium中,至細胞 長滿約80-90%時,改以不含protein的CD293 medium (Invitrogen)培養,收集上清液 濃縮後,以Protein A-agarose beads (Pierce) 進行管柱層析 (chromatography) 純化 [33]。
3.4 西方墨點法 (Western blot)分析
細胞以含有蛋白酶抑制劑的裂解緩衝液 (0.3% NP-40, 25 mM Tris, 0.15 M NaCl, 2 mM EDTA, pH7.4) 進行細胞溶解,離心後取其上清液,並加入sample buffer (0.075 M Tris–HCl [pH 6.8], 1.5% SDS, 15% glycerol) 隔水煮沸5分鐘後,取適量樣 本以4–12% gradient NuPage gels (Novex/Invetrogen, San Diego, CA)進行分析,分析
8
液為 GelCode Blue Stain Reagent (Pierce, Rockford, IL) ,並以Tris-glycine-methanol transfer 緩衝液 (25 mM Tris base, 192 mM glycine, 20% methanol v/v)將蛋白轉印 至 nitrocellulose membrane (Bio-Rad Laboratories, Hercules, CA) 上。轉印膜先以1%
Ponceau S (Sigma, St. Louis, MO) 確認蛋白量後,以泡製於TBS-T溶液 (50 mM Tris–HCl [pH 8.0], 138 mM NaCl, 27 mM KCl, 0.1% Triton X-100) 的4% 脫脂牛奶 (Bio-Rad) 浸泡後 ,與一級抗體於4℃下進行隔夜反應後,再以TBS-T溶液於室溫 下清洗5次,加入1:5000稀釋的 peroxidase labeled donkey anti-goat IgG (Santa Cruz Biotechnology, Santa Cruz, CA)二級抗體於室溫下反應1小時,並以SuperSignal West Pico (Pierce) 試劑進行偵測。
3.5 製備表現有 cadherin-11 的 L-cell 及 C4-2B4 前列腺癌細胞株
同2.3 載體置備方式,並以 NotI/ XhoIC4-2B4 將完整 cadherin-11 序列轉載於 pBMN-I-GFP 載體上,再以 retrovirus 轉染至 L-cell 或 C4-2B4 細胞,製備 L-cell/cad-11 及C4-2B4/cad-11 細胞。C4-2B4/ΔJMD 及 C4-2B4/ΔCBS 細胞則是利用由哈佛大 學Brigham and Woman Hospital, Harvard University 的 Michael Brenner 博士提供載 有cad11-ΔJMD 與 cad11-ΔCBS 之 pCEP4 載體,以 HindIII 與 BamHI 限制酶剪 取,其插入序列則複製至 pBluescriptII 中,再以 XhoI 與 NotI 限制酶將其複製至 pBMN-I-GFP 中。pBMN-I-GFP 載體含有完整與截短型態的 cadherin-11,並以 2.3 所 述 方 式 來 產 出 反 轉 錄 病 毒 並 轉 染 產 出 C4-2B4/cad11 、 C4-2B4/ΔJMD 及 C4-2B4/ΔCBS 細 胞 株 。 對 照 組 L-cell/vector 及 C4-2B4/vector 細 胞 則 是 以 pBMN-I-GFP 載體產出的轉錄病毒來備製。
3.6 製備抑制 (knockdown) cadherin-11 表現的 PC3-mm2 細胞
PC3-mm2 是從 PC3 發展出的細胞株,其本身即已表現有 cadherin-11,本實驗 利 用 Fugene 6 (Roche) 轉 染 試 劑 , 將 載 有 cadherin-11 shRNA (pLKO34, Sigma-Aldrich) 及 non-target shRNA (Sigma-Aldrich) 的 lentivirus 與 ViraPower DNA (Invitrogen),在 293FT 細胞內共轉染病毒載體。293FT 細胞經培養 48 小時後,取 其上清培養液, PC3-mm2 細胞在 32°C 環境中,加入此上清液並於 8 µg/mL 聚凝
9
胺 (polybrene)下進行 24 小時重組反轉錄病毒轉換,並在 8 µg/mL 的 puromycin 下 進行7 天的細胞篩選。
3.7 細胞擴展(spreading)分析
將玻璃蓋玻片經滅菌處理後,放置於 12 孔細胞培養皿中,並以不同濃度
cadherin-11-Fc 或 Fc 加以覆蓋,並置於 4℃的環境下 16 小時,使蓋玻片表面黏附 cadherin-11-Fc 或 Fc。接著加入 1% BSA (in PBS)置放 1 小時,以將蓋玻片表面作 阻隔。每ㄧ孔培養皿均放入 105個細胞,然後在 37℃的細胞培養環境下,依不同 細胞株分別放置1 至 6 小時。最後以 2%的三聚甲醛 (paraformaldehyde) 作細胞固 定,並以PBS 清洗後轉置於載玻片上進行觀察。
3.8 C4-2B4 前列腺癌細胞與成骨細胞的共培養
將玻璃蓋玻片經滅菌處理後,放置於12 孔細胞培養皿中,在每個細胞培養皿 孔洞內先置入MC3T3-E1 成骨細胞,經培養長滿後,植入 50,000 個 C4-2B4 前列 腺癌細胞,並在37℃的環境下培養 24 小時,蓋玻片則進行下列免疫細胞化學處理。
3.9 免疫細胞化學 (immunocytochemistry) 染色分析
在蓋玻片上生長的細胞以-20℃ 100%的甲醇固定 10 分鐘,在 C4-2B4 與 MC3T3-E1 共培養實驗中,細胞以 PBS 清洗後再以 3.5%的多聚甲醛固定,然後以 0.1% Triton X-100 (in PBS) 進行穿透,並以 5%的驢血清液進行阻斷 (block)。以老 鼠抗人體cadherin-11 單株抗體 4B6 (附圖 6)以 1:25 比例稀釋於含有 0.5%驢血清 及0.01% BSA 的 PBS 溶液中作為ㄧ級抗體,老鼠 IgG (Santa Cruz Biotechologies) 則 作為對照。細胞與主要抗體於 4℃環境中進行隔夜靜置,接著以 Cy3-conjugated donkey anti-mouse 抗體 (Jackson Immuno Research) 作為二級抗體。載玻片固定於 Vectashield mounting medium , 並 以 Olympus 顯 微 鏡 或 共 軛 顯 微 鏡 (Leica Microsystems Inc., Exton, PA) 進行觀察。
10
3.10 細胞移行 (migration) 分析
以Falcon HTS FluoroBlok Inserts (Becton Dickinson Labware, Franklin Lakes, NJ) 在 24 孔細胞培養皿進行實驗,migration inserts 先以 10 g/ mL cadherin11-Fc 或 Fc 在 4℃靜置隔夜。將多餘的 cadherin11-Fc 或 Fc 溶液移除後,每ㄧ insert 植 入3×104個前列腺癌細胞於不含 serum 的 RPMI 培養液,下層培養皿中則置入 0.5 mL 含有 10% FBS 的 RPMI 培養液,以作為趨化劑 (chemoattractant)。在 37℃環境 中培養24 小時後,將 insert 轉置於含 1M calcein AM 之 HBSS 溶液 1 小時進行標 記後,於顯微鏡下進行觀察,於 100 倍視野下取 3 個區域計數移行之細胞數,並 取其平均值。
3.11 細胞侵襲 (invasion) 分析
以BioCoat Matrigel coated invasion chamber (8 m pore size, BD Bioscience, Bedford, MA)在 24 孔細胞培養皿進行實驗,每ㄧ chamber 先以 serum free RPMI 培 養液靜置隔夜。實驗用之前列腺癌細胞培養液改以含250 g/mL BSA 之 RPMI 培 養液後於培養箱放置隔夜,每ㄧchamber 植入 105個前列腺癌細胞於不含serum 的 RPMI 培養液,下層培養皿中則置入 0.5 mL 含有 10% FBS 的 RPMI 培養液,以作 為趨化劑 (chemoattractant)。在 37℃環境中培養 24 小時後,將 chamber 上方的細 胞移除,並將穿過 Matrigel 於 chamber 下方的細胞以-20℃甲醇固定,再以 DAPI 染色後於顯微鏡下觀察計算數量。於 100 倍視野下取 3 個區域計數細胞數,並取 其平均值。
3.12 免疫沉澱法 (immunoprecipitation) 分析
C4-2B4 細胞以含有蛋白酶抑制劑的裂解緩衝液 (0.3% NP-40, 25 mM Tris, 0.15 M NaCl, 2 mM EDTA pH7.4) 進行細胞溶解。細胞裂解上清液與山羊抗人體 cadherin-11 多株抗體 (R&D Systems, Minneapolis, MN) 進行免疫沉澱,並以西方 墨點法檢驗,再以老鼠抗人體cadherin-11 多株抗體 (Zymed)、老鼠抗 p-120 catenin (BD Bioscience) 或兔子抗 β-catenin (受贈於 M D Anderson 癌症中心的 Pierre
11
McCrea 博士)。信號則以 SuperSignal West Pico (Pierce)套組進行偵測。
3.13 微陣列 (microarray) 基因分析
由各種待分析細胞萃取取得 500 ng RNA 進行 cDNA 合成,並進行 aRNA (antisense-RNA) 放大反應 (amplification)及 biotin 標記 (Illumina Inc.),biotynlated aRNA (1.5 g) 再與 Illumina HumanHT-12 Beadchip v.3 微陣列晶片進行雜交反應 (hybridization),之後再加入染劑 cyanine 3- streptavidine (GE Healthcare) 與雜交於 探針上aRNA 的 biotin 官能基作用,清洗後以 Illumina BeadArray Reader confocal scanner (Beadstation 500GXDW) 進行掃瞄。掃描後的資料以 Bead Studio 3.6 (Illumina) 擷取,並利用 Linear Models for Microarray Data (LIMMA) 進行 quantile normalization。每一基因的表現量則轉換為以 2 為底取 log 值 (log2 base) 作分析。
各群組間以 t-test 進行統計分析。
3.14 FACS (fluorescence-activated cell sorting)分析
以2 mM EDTA 將細胞從培養皿釋放,並懸浮於 PBS 溶液,取 106個細胞,
並以 1% BSA 於 4℃下 30 分鐘進行非特定性阻斷,之後再與一級抗體 (如 4B6 mouse anti-human-cadherin 單株抗體) 於 4℃下作用 1 小時,細胞經清洗後,重新 懸浮於0.5 mL 0.01% BSA,並與 Alexa-647-conjugated anti-mouse IgG (Invitrogen) 作用,螢光強度則以FACScan analyzer (Becton-Dickison, Mountain View, CA)進行 偵測。
3.15 細胞增殖、存活與 docetaxel 敏感性分析
以luciferase 標記的 5×104個C4-2B4 細胞培養於長滿 MC3T3-E1 細胞或空的 培養皿中,經隔夜讓細胞貼附於培養皿起計算,分別於第 1、2、 3、 4 天以 Passive Lysis buffer (Promega)溶解細胞,並量測 luciferase 活性,作為細胞數量的對應值。
同時以5×104個C4-2B4 細胞隔夜培養後的數值作對照,以二者 luciferase 活性倍數 作為細胞增值數值。
12
細胞存活分析則於隔夜培養後將培養以液換成serum free,並於第 4 天以前述 方式量測luciferase 活性值。
Docetaxel 敏感性分析則將細胞於隔夜培養後將培養液換成含 0、1、2、4 nM docetaxel,2 天後以前述方式量測 luciferase 活性值,並以 5×104個C4-2B4 細胞隔 夜培養後的數值作對照。
3.16 非附著依賴性生長 (anchorage-independent growth) 分析
於6 孔細胞培養皿,以 1.5 mL 0.5 % agar 加入等體積 RPMI 細胞培養液及 10%
FBS,作為培養基層,另以 2 mL 0.35% agarose 加入 RPMI 細胞培養液及 10%
FBS,並與 3000 個 C4-2B4 於 40℃下混合,再均勻分布於培養基層上,培養 9-12 天,最後以0.5 mL 0.005% Crystal Violet 染色後,計算細胞群落 (colony) 數量。
3.17 細胞聚合 (aggregation) 分析
將對照細胞L-cell/vector 及轉染 cadherin-11 載體之 L-cell/cad11 以 Cellstripper
(Cellgro, Mediatech, Inc Manassas, VA)將其由培養皿在 37°C 下 10-12 分鐘以釋 出細胞。釋出的細胞重新懸浮於含10% FBS 的 DMEM 細胞培養液。本實驗利用 搖臂混合,並使用血球技術儀計算數目。包含 3 個或更多細胞的細胞團即被認定 為聚合。在 PC3-mm3/MC3T3E-E1 混合聚合實驗中, PC3-mm2 細胞與 MC3T3-E1 分別以DiO 與 DiI 螢光染劑標記。標記後的細胞在含 10 mM CaCl2條件下以trypsin 使細胞從培養皿釋出,並重新懸浮於含有1% BSA、100 units/mL DNase 及含或不 含1 mM CaCl2,並加入20 g/mL 的 IgG 或 mAb 2C7 觀察其對細胞聚合作用之影 響。
3.18 Cadherin-11-his
7重組蛋白及 Anti-cadherin-11 單株抗體製備如同2.3 用於製作 Cadherin-11-Fc (OB-CAD-Fc)的
pBMN-(OB-CAD-Fc)-I-GFP 載體,以 BamHI 與 NotI 限制酶來移除 Fc 的 DNA 片 段。接著再與含有互補序列的7 個 histidine 胺基酸、1 個中止密碼及分別在在 5'
13
與 3'末端的 BamHI 和 NotI 限制位置的寡核苷酸(表 2)進行連接,置備之 pBMN-(Cad11-his7)-I-GFP 如 2.3 所述以反轉錄病毒轉載於 293FT 細胞株,收集其 培養液並以 Amicon Ultra-15 離心式過濾器(Millipore, Billerica, MA)進行 10 倍 濃縮後,以Ni-NTA agarose 純化[34]。
抗cadherin-11 單株抗體的製備則提供 cadherin-11-Fc 蛋白委由台灣 Abnova 公 司製備,並以Cad11-his7-coated 96 孔板進行酶聯免疫吸附實驗(ELISA)之單株抗 體篩選。
3.19 製備用於單株抗體結合位置分析之 cadherin-11 細胞外結構區域
分別對應cadherin-11的 1-159、1-268、1-383及1-486胺基酸序列的細胞外EC1、EC1-2、EC1-3與EC1-4結構區域片段的DNA片段,以聚合酶連鎖反應(PCR)進行 選殖。經由DNA序列分析進行確認後,DNA片段轉載至 pGEX-4T-1載體。藉由 pGEX-4T-1載體上之GST序列與cadherin-11片段接合,接合後之載體則利用大腸桿 菌大量產生基因工程蛋白,如GST-EC1, GST-EC1-2, GST-EC1-3, GST-EC1-4,以 lysis buffer (50 mM Tris pH 7.5 , 150 mM NaCl, 0.05% NP-40)及超音波震盪將大腸 桿菌打破,經離心後取其上清液,與glutathione-agarose beads結合,經Elution Buffer (50 mM Tris pH 8.0) 清洗後,離心取得beads,再將beads與含10 mM glutathione的 elution buffer隔夜作用,離心後取得純化後GST結合蛋白。
類似的步驟也用於製備C 末端移除特定數目胺基酸之 EC1-3,以應用於檢測 抗體抗原決定位的突變對其作用之影響。
3.20 製備表達突變 cadherin-11 序列的 L-cell 細胞株
利用overlap extension polymerase chain reaction (OE-PCR) 技術,將 mAb 2C7 抗原決定位位置343-348 胺基酸序列 YSLKVE 以丙氨酸 (analine)取代,製備 6 個 胺基酸的突變體cadherin-11 cDNA (Cad11-6A),或在 cadherin-11 第 2 及第 4 位置 的色氨酸 (tryptophan)以丙氨酸取代,置備 Cad11-W2A 突變體,前述 OE-PCR 使 用之oligonucleotides 序列詳如表 2。Cad11-6A 及 Cad11-W2A 突變體 cDNA 選殖入 pBMN-I-neo 載體。轉載有 Cad11-6A 及 Cad11-W2A 之 pBMN-I-neo 載體以 2.3 所
14
述方法轉染至293 細胞內,並於 48 小時後收取其細胞培養上清液,此上清液與 L-cell 共同培養後置備穩定轉染細胞株,並加入 G418 (geneticin, aminoglycoside 類 抗生素)於細胞培養液,進行轉染成功細胞篩選。
3.21 老鼠心臟內注射法及其生物光學 (bioluminescence) 測量分析
經左心室心臟注射癌細胞,經由血液循環至轉移部位,以模擬癌症惡化轉移 的過程。取5-6 週大的免疫缺陷小鼠 (SCID mice),以 isoflurane gas 麻醉並預先將 每隻老鼠依分組先注射30 g IgG 或 mAb 2C7,每隻白鼠再由左心室打入分別已與 30 g IgG 及 mAb 2C7 預先混合 30 分鐘後之 106 個 PC3-mm2-Luc 細胞[19],之後 以 bioluminescence imaging 方式確認癌細胞是否如預期隨血液循環至全身,並每 週追蹤後續轉移部位及腫瘤成長情形,持續追蹤三週。影像以 IVIS 系統(Xenogen, Alameda, CA)處理分析。在研究結束時採集股骨與脛骨,並使用 Tissue and Blood DNA kit(Invitrogen, CA)製備 DNA,以人類 Alu 序列專一性寡核苷酸(表 2)進 行PCR 定量。
3.22 統計分析
數據的統計分析利用student’s t test (two-tailed, paired)進行。p 值低於 0.05 則 視為有意義之差異, 數據則以平均值± SD (標準差)呈現。
15
第 4 章 第一部分
探討前列腺癌骨轉移分子及其在癌細胞與成骨細胞間之交互 作用
Study of the Molecular in Bone Metastasis of Prostate Cancer and
it’s Role in the Interaction between PCa Cells and Osteoblasts.
16
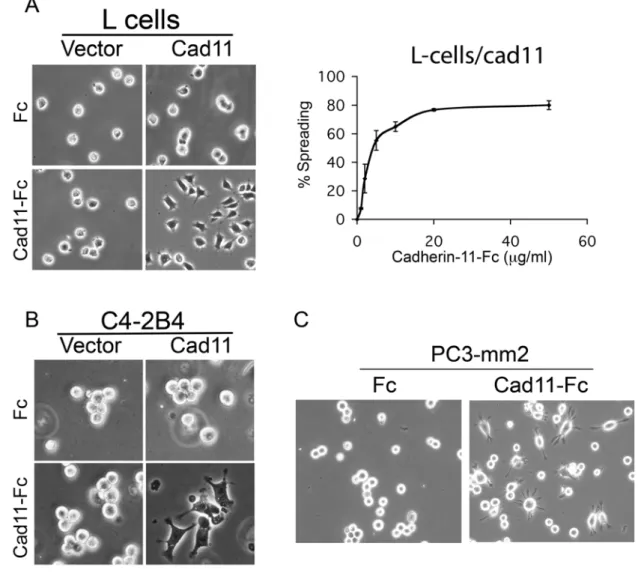
4.1 結果
4.1.1 表現有 cadherin-11 的前列腺癌細胞可促使其在 cadherin-11- Fc 塗層培養板的細胞擴展作用。
為確認cadherin-11 對前列腺癌細胞的黏附 (adhesion) 作用的影響,我們以細 胞擴展實驗確認當細胞表現有 cadherin-11 時,是否會促進其細胞擴展作用。利用 沒有表達任何 cadherin 的 L 細胞,將其轉染 cadherin-11 expression vector 成為 L-cell/cad11 細胞, 或轉染 control vector 成為 L-cell/vector 細胞,以同時提供實 驗及對照組。並利用 cadherin-11-Fc 覆蓋的玻片作為培養板,並以 Fc 覆蓋的玻片 作對照。未表現有cadherin-11 的 L-cell/vector 細胞,不論在 cadherin-11-Fc 覆蓋或 Fc 覆蓋的培養板上均呈現圓形形狀(1A 圖)。 相比之下,表現有 cadherin-11 的 L-cell/ cad11 細胞則在 cadherin-11-Fc 覆蓋的培養板上則因與 cadherin-11-Fc 的結合 而呈現細胞擴展,具類似片狀/絲狀偽足 (lamellipodia/filopodia-like) 的扁平型態,
但在Fc 覆蓋的培養板上則呈現圓形形狀(1A 圖)。且其細胞擴展的表現與覆蓋在 培養板上的cadherin-11-Fc 濃度具有劑量依賴性關係,當 cadherin-11-Fc 濃度為 20
g/mL 時觀察到的最大擴展作用,當 cadherin-11-Fc 濃度為 3 g/mL 時可達最大作 用的一半,故後續實驗cadherin-11-Fc 的濃度均設定在 10 g/mL。
為了確認cadherin-11 介導的細胞擴展是否也發生於前列腺癌細胞中,我們將 一種來自LNCaP 前列腺癌細胞亞系,且沒有 cadherin-11 表達性的 C4-2B4 細胞轉 染為具cadherin-11 的表現[32]。單獨與載體轉染的 C4-2B4 細胞被用來當做對照。
與L-cell/cad11 觀察到的結果類似,C4-2B4/cadherin-11 和 cadherin11-Fc 的結合使 得這些細胞出現片狀/絲狀偽足投射的扁平型態的變化(1B 圖),這些細胞在覆蓋 Fc 的培養板上則維持圓形形狀。C4-2B4/vector 在 Fc 或 cadherin-11-Fc 覆蓋的培養 板上則皆未出現型態的改變(1B 圖)。我們更進一步同時檢驗了本身已表現有 cadherin-11 的 PC3-mm2 細胞。在 cadherin-11-Fc 覆蓋的培養板上,PC3-mm2 細胞 展現廣泛的片狀/絲狀偽足投射的扁平型態,而在 Fc 覆蓋的培養板上則未出現此現 象。這些觀察顯示 cadherin-11 是藉由同類親合性互動 (homophilic interaction) 誘 發細胞擴展。
17
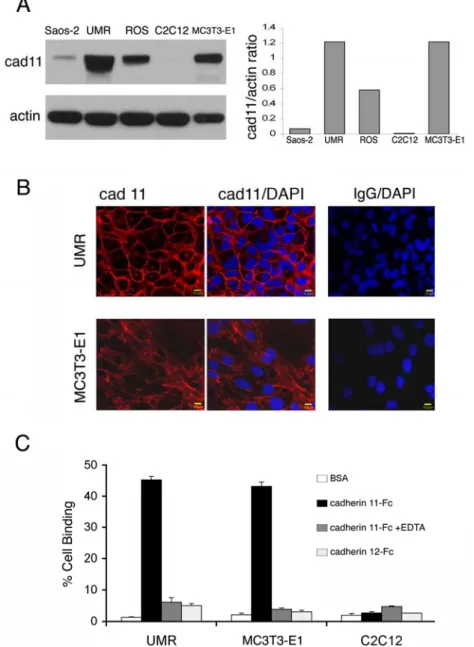
4.1.2 Cadherin-11 促使前列腺癌細胞與成骨細胞間黏附作用
為了研究具cadherin-11 表達性的前列腺癌細胞與成骨細胞間的互動,首先檢 測了多種成骨細胞株中 cadherin-11 的表達性;包括 MC3T3-E1、UMR106、
ROS17/2.8 與 Saos2 細胞株。經西方墨點法分析顯示具有高分化性的 UMR106 與 ROS17/2.8 老鼠成骨細胞株 [35, 36]具有高度的 cadherin-11 表現(2A 圖)。
MC3T3-E1 是由老鼠頭蓋骨取得的前驅成骨細胞株[37],也表達出相對高度的 cadherin-11。 Saos2 是一種已確立、具有多種成骨細胞特性[38] 的人類骨肉瘤細 胞株,則表現中度cadherin-11。而在未誘發的 C2C12 細胞中則未出現 cadherin-11
(2A 圖)。 然而利用 BMP-2 (bone morphogenetic protein 2) 誘發分化成骨細胞[39]
後,C2C12 細胞則表達高度的 cadherin-11。免疫組織化學染色顯示 cadherin-11 位 於成骨細胞間的接合處(2B 圖)。在細胞與物質黏附分析中,以重組cadherin-11-Fc 與這些細胞株結合,其黏附程度與這些細胞株中的 cadherin-11 表達程度具有相關 性。另外,成骨細胞與cadherin-11 的結合則因加入 EDTA 而受到破壞(2C 圖),
代表cadherin-11 同類親合性互動需要鈣離子的輔助。再者, UMR106 與 MC3T3-E1 細胞無法與不同的cadherin(如 cadherin-12-Fc)結合。這些結果顯示,cadherin-11 以鈣離子依賴同類親合性黏附細胞分子呈現於成骨細胞株。
4.1.3 Cadherin-11 促使前列腺癌細胞嵌入 (intercalation) 成骨細胞
為了研究具cadherin-11 表達性的前列腺癌細胞與成骨細胞間的互動,我們以 紅 色 (Tomato) 或 綠 色 ( GFP ) 螢 光 蛋 白 為 視 覺 記 號 轉 染 C4-2B4/vector 及 C4-2B4/cadherin-11 細胞,以觀察前列腺癌細胞與 MC3T3-E1 成骨細胞間互動的型 態。
在 C4-2B4 細胞與 MC3T3-E1 細胞以 2:1 細胞數混合後共同培養,在 C4-2B4/vector 與 MC3T3-E1 細胞共同培養的實驗,可以發現因 C4-2B4/vector 未表 現cadherin-11 而缺少與成骨細胞 MC3T3-E1 的互動,二種細胞各別吸附至培養皿 上,且 C4-2B4/vector 細胞多數呈現圓形形狀 (3A 圖)。在 C4-2B4/cad-11 與 MC3T3-E1 細胞共同培養的實驗,C4-2B4/cadherin-11 則因 cadherin-11 的作用,與
18
MC3T3-E1 有良好的互動,多數吸附於 MC3T3-E1 細胞上 (3B 圖),且細胞呈現扁 平擴展的形狀,此現象與C4-2B4/cadherin-11 吸附至 cadherin-11-Fc 塗層的培養板 上有相同的表現(1B 圖)。
另外也利用將 C4-2B4 培養於生長滿 MC3T3-E1 細胞的培養皿中,藉以觀察 表現 cadherin-11 與否對於前列腺癌細胞與成骨細胞間的互動作用之影響。分布於 MC3T3-E1 細胞上層的對照 C4-2B4/vector 細胞仍為圓形細胞(4A 圖)。相反地,
C4-2B4/cadherin-11 在與下層成骨細胞互動時則展現延伸/擴展型態(4A 圖)。此延 伸/擴展型態表示 C4-2B4 細胞可能侵入成骨細胞間。為進一步了解這個可能性,
我們製備僅會辨認人類 cadherin-11 而非老鼠 cadherin-11 的單株抗體 4B6 (附圖 6),並在 C4-2B4/cadherin-11/MC3T3-E1 共培養進行免疫染色細胞。在這個共培養 系統中,較小的前列腺癌細胞圓形細胞核可以在DAPI 染色後由較大的橢圓形成骨 細胞細胞核中區分出來(4B 圖)。C4-2B4/cadherin-11 細胞在被抗人類 cadherin-11
抗體染色,滲透至骨細胞層時被發現擴展與延伸為多種片狀/絲狀偽足,但
C4-2B4/cadherin-11 細胞核仍位在成骨細胞層之上(4B 圖)。此外在共軛顯微鏡下,
以 Z 軸方向多階層觀察(5A 圖),可清楚觀察到 C4-2B4/cadherin-11 細胞嵌入 MC3T3-E1 細胞層中,在較下層已清晰可見 MC3T3-E1 細胞核,仍可觀察到 C4-2B4/cadherin-11 細胞偽足狀的侵入 (5B 圖),但在 C4-2B4/vector 與 MC3T3-E1 細胞共培養試驗,則未見任何抗人類 cadherin-11 抗體染色訊息。綜合這些觀察表 示cadherin-11 的表現,促使前列腺癌細胞與成骨細胞的互動。
4.1.4 Cadherin-11 在前列腺癌細胞移行 (migration) 作用之影響
在細胞擴展分析中觀察到的前列腺癌細胞與cadherin-11 結合時的改變,顯示 與cadherin-11 的結合可能誘發前列腺癌細胞的活動。為確認此是否屬實, 以 Falcon HTS FluoroBlok Inserts 進行實驗,以檢視 cadherin-11 對細胞移行作用的影響。細 胞被放置於事先覆蓋有cadherin11-Fc 或 Fc 的 insert 上方,並觀察其可移行至 insert 下方的細胞數量(6A 圖)。 C4-2B4/cadherin-11 細胞在事先覆蓋有 cadherin-11-Fc 的insert 上方,其移行作用相對在事先僅覆蓋 Fc 的 insert 者高出許多(6A 圖)。同 樣地,在另一本身即表現有cadherin-11 的 PC3-mm2 細胞,利用 cadherin-11 小髮
19
夾型核醣核酸 (shRNA)製備 PC3-mm2-shcad11 細胞,以觀察減少 cadherin-11 內生程度時的移行作用(6A 圖),然後以不規則 shRNA 序列轉染的 PC3-mm2 細 胞 (PC3-mm2-shcontrol)則作為對照(6A 圖)。於事先覆蓋有cadherin-11-Fc 的 insert 上方的PC3-mm2-shcontrol 相較在事先覆蓋 Fc 的 insert 上方的移行率高出許多(6A 圖)。相反地,抑制PC3–mm2 細胞內 cadherin-11 的表現則會大幅減少細胞移行活 動(6A 圖)。這些結果顯示 cadherin-11 介導的黏附作用會增進前列腺癌細胞的移 行作用。
4.1.5 Cadherin-11 在前列腺癌細胞侵襲 (invasion) 作用上之影響
為了檢驗cadherin-11 的表達是否導致細胞侵襲活動的增加,本實驗利用塗有 Matrigel 的 Boyden chamber 進行檢測與觀察。C4-2B4/cadherin-11 細胞能穿過 Matrigel 的細胞數高於 C4-2B4/vector 對照細胞的 10 倍(6B 圖)。相同地,抑制 PC3-mm2 細胞中 cadherin-11 的表現相較於 PC3/shcontrol 對照細胞, PC3-mm2 細 胞的侵襲作用明顯受到抑制(6B 圖)。結果顯示 cadherin-11 的表達,導致前列腺 癌細胞侵襲活動的增加。
4.1.6 Cadherin-11 對於前列腺癌細胞的增殖、存活、docetaxel 治療
敏感性,以及非附著依賴性生長的影響我們檢驗了cadherin-11 介導前列腺癌細胞與成骨細胞間的互動,是會否影響 前列腺癌細胞的增殖、存活、或非附著依賴性生長。我們發現C4-2B4/cad11 與對 照 C4-2B4/vector 在細胞的增殖有類似的模式,無論這些細胞是在一般組織培養皿 (7A 圖左欄) 或 MC3T3-E1 成骨細胞層中生長 (7A 圖右欄) 均無顯著差異。
在無血清飢餓處理 (serum starvation) 與 docetaxel 給藥的存活測試中,
C4-2B4/ cadh11 不會因表現有 cadherin-11 而有任何存活優勢(7B, 7C 圖)。我們也 發現 cadherin-11 的表達性也不會影響非附著依賴性生長 (anchorage-independent growth) 細胞 (7D 圖)。
4.1.7 Cadherin-11 介導的前列腺癌細胞移行與侵襲作用與其細胞內
20
區域 (cytoplasmic domain) 相關
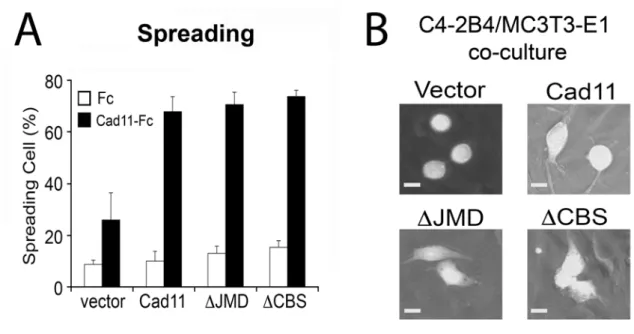
Cadherin-11 增進前列腺癌細胞的移行與侵襲作用,顯示 cadherin-11 的功能不 僅止提供前列腺癌細胞與成骨細胞間的黏附作用,應該有其他更進一步的功能。
隨著同類親合性黏附作用,cadherin-11 可能與細胞內蛋白分子互動而促進細胞移 行與侵襲作用的增加。在E-cadherin 的研究上已確認 p120-catenin 及-catenin 分別 會與細胞外靠膜區域 (juxtamembrane domain , JMD) [40, 41]及 E-cadherin 的 C 末端 [42, 43]結合。為驗證這些細胞內的區域是否為 cadherin-11 介導細胞移行與侵襲的 重 要 因 素 。 本 實 驗 利 用 細 胞 外 靠 膜 區 域 中 帶 有 缺 陷 的 cadherin-11 突 變 體 (cad11-JMD) 或 C 末端 catenin 結合位置突變 (cad11-CBS) (8A 圖) 進行 C4-2B4 細胞轉染。以西方墨點法檢視顯示這些 cadherin-11 的缺陷突變體均表現有 cadherin-11,但相較於原生型,有較小的分子量 (8B 圖左側圖)。此外,抗 cadherin-11 陽性蛋白與其對應的較小分子質量可能因蛋白質水解的關係,在原生 cadherin-11 與表現突變的cadherin-11 中皆被發現。以抗人類 cadherin-11 4B6 抗體進行二級抗 體染色的C4-2B4/cadherin-11、C4-2B/JMD 與 C4-2B4/CBS 細胞在螢光活性細 胞分析儀 (FACS) 分析中,比起僅用二級抗體染色的細胞有更顯著的螢光表現,
顯 示 C4-2B/JMD 與 C4-2B4/CBS 二種突變細胞皆於細胞表面上表現有 cadherin-11 (8C 圖)。同時利用免疫沉澱分析法與西方墨點法檢驗 p120-catenin 及
-catenin 與突變的 cadherin-11 蛋白的結合,原生型 cadherin-11 同時與 p120-catenin 及-catenin 結合,Cad11-JMD 會喪失與 p120-catenin 結合能力,而 Cad11-CBS 則喪失與-catenin 結合的能力(8B 右側圖)。這些結果顯示 p120-catenin 及-catenin 為 cadherin-11 細胞質區域的結合蛋白,並傳遞後續的分子信號,且可能成為前列 腺癌細胞內cadherin-11 介導細胞功能的重要分子。
我們檢驗了JMD 與 CBS 區域在 cadherin-11 介導的包含細胞擴展、移行與侵 襲功能上的影響。表達JMD 或 CBS 突變的 C4-2B4 細胞比起表達完整 cadherin-11 的細胞,在預覆蓋cadherin-11-Fc 培養板上有相似的細胞擴展作用 (9A 圖),這顯 示cadherin-11 介導的擴展活性並不依賴其細胞質內 JMD 或 CBS 區域。當有 GFP 標記的 cadherin-11 突變表現的 C4-2B4 細胞生長於 MC3T3-E1 成骨細胞層時,
C4-2B/JMD 與 C4-2B4/CBS 細胞同時在與成骨細胞層的互動中表現出延伸擴
21
展型態,而對照C4-2B4/vector 細胞則維持圓形 (9B 圖)。與 4B6 cadherin-11 抗體 免疫組化染色的共培養細胞共軛顯微鏡多層次分析結果顯示 C4-2B/JMD 與 C4-2B4/CBS 細胞可以嵌入至 MC3T3-E1 成骨細胞層中。這些結果顯示 JMD 與 CBS 區域皆不是 cadherin-11 介導的細胞擴展或嵌入作用所需的。相反地,在檢驗 C4-2B/JMD 與 C4-2B4/CBS 細胞之移行或侵襲作用時,我們發現抑制 JMD 或CBS 區域的表現,將會遏止 cadherin-11 介導的細胞移行 (10A 圖) 及侵襲 (10B 圖)。這些結果表示 JMD 和 CBS 區域皆與導致前列腺癌細胞移行與侵襲的訊息傳 遞相關。
4.1.8 Cadherin-11 對於 C4-2B4 細胞基因表現的影響
Cadherin-11 對於細胞移行及侵襲活動的影響與其細胞內區塊所能結合的訊息 傳遞分子相關,同樣地推測,Cadherin-11 可能影響 C4-2B4 的基因表現,進而改變 其訊息傳遞分子及細胞活性。以基因陣列分析,比較C4-2B/vector、C4-2B/cad-11、
C4-2B/JMD 與 C4-2B4/CBS 的基因表現,分析結果顯示有一群獨特的基因因 為 cadherin-11 的表現而特別增加或減少,當針對與細胞侵襲作用相關基因 (invasion-related genes)作分析時,IGF-1, MMP7, Rac1, CD9, integrin beta2, MMP15 及junction plakoglobin 為最主要的基因表現 (圖 11) ,當以細胞移行作用相關基因 (migration-related genes)作分析時,myeloid differentiation primary response gene (Myd88) 及 Notch1 為最主要的基因表現 (圖 12)。以上結果顯示,前列腺癌細胞 cadherin-11 的表現導致許多細胞移行及侵襲相關基因的表現特別的增加。
22
4.2 討論
我們先前的研究已在動物實驗中確立cadherin-11 會增加前列腺癌細胞在骨骼 中的移生[19]。本研究將進一步闡明前列腺癌細胞中 cadherin-11 介導的細胞活動。
我們證明在前列腺癌細胞中 cadherin-11 的表達性能促使細胞擴展、移行與侵襲,
使得前列腺癌細胞片狀/絲狀偽足侵入至成骨細胞層中。另外,cadherin-11 的細胞 質區域在前列腺癌細胞移行與侵襲活動中成為關鍵因素,顯示 cadherin-11 可能開 啟促進細胞活動的信息傳遞。基於上述觀察,我們提出 cadherin-11 不僅提供前列 腺癌細胞與成骨細胞間的實體連結,也誘發了可以增強前列腺癌細胞移行與侵襲 至骨組織中的信號傳遞。總結來說,cadherin-11 介導的細胞活動增進了前列腺癌 細胞在骨骼內的移生。
Cadherin-11 是一種主要存於成骨細胞與滑膜細胞內的間葉型 (mesenchymal ) cadherin,另在肺、睪丸與大腦組織中則存有少量。cadherin-11 在組織發展過程中 也與頭部、體節等的間葉型態轉變有關[44]。cadherin-11 也與關節滑液囊細胞表層 組織層化發展有關[45]。缺乏功能性 cadherin-11 的老鼠表現出骨骼密度的下降 [20]。cadherin-11 的異於常態的表現可在多種源於上皮的癌症包含乳癌[46]、胃癌 [47]及前列腺癌[19]中被觀察到。正常的前列腺上皮細胞多數表現有 E-cadherin,
而 轉 移 至 淋 巴 腺[16] 和骨骼[19] 的前列腺癌細胞則轉為表現有 cadherin-11 。 cadherin-11 的異常表達很可能與癌細胞的上皮-間葉轉換 (epithelial-mesenchymal transition) 有關連性[48]。重要的是,我們的研究顯示 cadherin-11 的表現導致前列 腺癌細胞的細胞活動與侵襲作用的增加,代表 cadherin-11 為前列腺癌細胞成為具 侵入型態的表現。
Cadherin-11 促使細胞移行的現象也在其他細胞種類中被提出。cadherin-11 展現在調節血管平滑肌細胞的移行作用[49]。在神經系統中,受到 cadherin-11-Fc 固化所產生的 cadherin-11 活化促使脊髓外植體的軸突延伸[50]。轉染 L 細胞中 cadherin-11 的過度表達也增進了細胞運動 [51]。在乳癌細胞中, BT-20 細胞內 cadherin-11 的過度表達促進了與 N-cadherin 相似模式的上皮細胞運動[52]。因此,
cadherin-11 促使正常情況下間葉細胞之轉移以及源於上皮的細胞組織在病理情況
23
下之轉移活動增加。
由於cadherin-11 中介的細胞移行與侵襲需依賴其細胞質區域,這些細胞活動 可能藉由細胞內的信息傳遞。大多數關於 cadherin 信息傳遞的研究皆專注於 E-cadherin 上。E-cadherin 的群聚是藉由他們的細胞質區域所介導的,也就是結合
-catenin 及 p120-catenin。與 E-cadherin 相似的是,我們發現 cadherin-11 透過它的 JMD 區域與 p120-catenin 結合[40, 41, 53, 54],以及透過 C 末端 CBS 區域與
-catenin 結合。此外,JMD 與 CBS 區域同時為介導細胞移行及細胞侵襲所需,但 僅結合-catenin 及 p120-catenin 蛋白並不足以主導這些細胞活動。
儘 管 E-cadherin 與 cadherin-11 結 合 兩 種 相 似 的 信 息 分 子-catenin 及 p120-catenin;但他們的功能仍有本質上的不同。E-cadherin 會抑制腫瘤細胞的入侵 (12, 36, 37),而 cadherin-11 則與入侵的表現型態有關[24, 55, 56]。E-cadherin 與 cadherin-11 的細胞質區域相似度僅有 49%,其間極有可能存在某ㄧ專一性的蛋白 分子而導致不同的信息傳遞及細胞表現。除-catenin 與 p120-catenin 外,E-cadherin 的細胞質區域也與控制E-cadherin 穩定性的早衰蛋白 (presenilin)作用[57],以及控 制E-cadherin 組合內噬的 Hakai 分子進行互動[58, 59]。另外,cadherin-11 的細胞 外區域被發現與FGS 受體互動而誘發神經軸突的生長 [50]。這些觀察顯示 cadherin 可 與 細 胞 內 與 細 胞 外 蛋 白 互 動 以 控 制 細 胞 活 動 。 雖 仍 待 證 實 , 但 我 們 認 為 cadherin-11 可能與獨有的蛋白組合互動,以調節並促使前列腺癌細胞的侵入型態 轉變。
癌細胞轉移是一種多階段活動,而轉移至骨骼是前列腺癌的致命發展。本研 究闡明cadherin-11 為骨轉移早期階段,如移生至骨骼的擴展、移行與侵襲活動等,
扮演了關鍵角色。本研究可確認 cadherin-11 在病理情況下的非典型表現開啟了新 的信息傳遞,並促使前列腺癌細胞發生骨轉移。然而 cadherin-11 是否與獨特的蛋 白互動以及 cadherin-11 如何建立增進前列腺癌細胞內的移行與侵襲則仍有待更進 一步研究。
24
第 5 章 第二部分
探討 Cadherin-11 單株抗體對於前列腺癌骨轉移之抑制作用
Cadherin-11 monoclonal antibodies inhibit prostate cancer bone
metastasis
25
5.1 結果
5.1.1 Cadherin-11 促成的細胞聚集 (aggregation) 作用可被抗體抑
制以L-cell 建立 cadherin-11 介導的細胞與細胞間聚集作用的實驗模式,以轉染 對照載體的L-cell(L-vector)為對照組,以及轉染 cadherin-11 cDNA 的細胞(L- Cad11)為實驗組,並以檢測細胞聚集作用後單胞的數量改變為量測結果。如圖 13A 所示,在3 個小時後,表現有 cadherin-11 的 L-cad11 因細胞間的聚集作用而導致 單細胞數減少約70%。相反地,在 3 個小時的實驗,L- vector 因無 cadherin-11 介導的黏附作用,單細胞數量則僅減少約10%(圖 13A)。
為檢測抗體是否可用於限制 cadherin-11 所促成的黏附作用,利用對抗 cadherin-11 細胞外結構區域的多株抗體進行實驗,以檢測驗它對 cadherin-11 所促 成的細胞聚集作用之影響。抗cadherin-11 多株抗體在 20 µg/mL 的濃度下呈現時間 依賴(圖13B)與劑量依賴(圖 13C)的黏附抑制作用,與此同時以 IgG 作對照,
IgG 對於細胞聚集作用的抑制並無影響。當提高抗體濃度至 50 µg/mL 時並無法進 一步抑制細胞聚集作用,因而多株抗cadherin-11 抗體最多約能達到 50%的抑制效 果(圖13C)。儘管可能僅有一小部分的多株抗體能夠遏阻聚合,但這些觀察已顯 示具有抑制 cadherin-11 所促成的細胞與細胞間聚合作用之抗體可用來檢測其對於 骨轉移抑制的效果。
5.1.2 Anti-cadherin-11 單株抗體篩選
本實驗製備cadherin-11 細胞外區域片段與 IgG Fc 片段或 7 個 histidine 胺基酸 融合蛋白cadherin-11-Fc 及 cadherin-His7,並利用cadherin-11-Fc 打入老鼠體內產生 免疫反應製備單株抗體,再以cadherin-His7進行篩選,共產出21 株單株抗體 (mAb),經以西方墨點法、細胞聚集作用,及、PC3-mm2 及 MC3T3-E1 免疫染色 FACS 分析等檢測,各株抗體之作用略有不同,其中 1A1, 1A5, 1H1, 2C7 及 4C1 有 較好的西方墨點檢測訊號 (表 3),1A5, 及 2C7 對於細胞聚集作用的抑制可達 80%
(圖 14),1H1 及 3C9 則為人類 cadherin-11 專一性抗體(表 3)。
26
5.1.3 Anti-cadherin-11 單株抗體 mAb 2C7 與 1A5 之親和性及專一性
在螢光流式細胞分選儀(FACS)分析中使用 L-cad11 細胞,以 mAb 2C7 及 mAb 1A5 為一級抗體及 Alexa 647 為二級抗體進行免疫螢光染色,並進行 FACS 分 析。mAb 2C7 相較於 mAb 1A5 與 cadherin-11 的結合高出將近兩倍(圖 15)。
mAb 2C7 在西方墨點法分析中比起 mAb 1A5 展現更強烈信號(圖 16A)。因 此我們後續的分析將專注於mAb 2C7。另外也檢驗 mAb 2C7 對前列腺癌細胞內各 類cadherin 表達的專一性。C4-2B4 表現有 E-cadherin(圖 16B)。以西方墨點法分 析,mAb 2C7 並未與 E-cadherin 形成交互作用。在 PC3 前列腺癌細胞與其子系 PC3-mm2 細胞,抗 N-cadherin 抗體於 130 kDa 分子量的蛋白質產生作用,而 mAb 2C7 則與 100 kDa 的蛋白質產生交互作用(圖 16B),表示 PC3-mm2 同時表達 N-cadherin 與 cadherin-11,但 mAb 2C7 未與 N-cadherin 產生交互作用,以上結果 顯示mAb 2C7 具有良好的專一性。
在FACS 分析中,mAb 2C7 與 C4-2B4-cad11 產生結合,但未與 C4-2B4-vector 細胞產生作用(圖16C)。同樣地,mAb 2C7 與 PC3-mm2 細胞產生強烈的作用(圖 16C)。利用 shRNA 以降低 cadherin-11 表現的 PC3-mm2/shCad11 細胞則大量減低 了mAb 2C7 的結合(圖 16C)。整體而言,以上結果顯示mAb 2C7 與 1A5 對於 PC3 細胞內生性cadherin-11,及 C4-2B4 細胞外加過度表現的 cadherin-11 具有相同的辨 識度。
5.1.4 鑑別 mAb 2C7 在 cadherin-11 的結合區域
mAb 2C7 可以與 cadherin-11 結合而抑制 cadherin-11 促使的細胞與細胞間的聚 合作用。先前的研究顯示 cadherin 細胞外第一區域(EC1)是導致 E-cadherin、
P-cadherin 與 N-cadherin 黏附作用主因[60]。除了 EC1 之外的其他區域也曾被研究 指出與cadherin 促使的黏附作用相關[29-31, 61]。因此 mAb 2C7 可能藉由與黏附基 序 (motif) 結合或藉由立體障礙干擾 cadherin-11 分子間多聚化來抑制 cadherin-11 促使的黏附作用。