國立台中教育大學科學應用與推廣學系
科學教育碩士學位碩士論文
指導教授:陳錦章 教授
合成奈米級鎢酸鉍觸媒暨過硫酸鹽高
級氧化程序降解三苯甲烷類染料的效
率和機構探討
Synthesis and properties of nano Bi
2WO
6photocatalysts
and peroxymonosulfate advanced oxidation processes
degradation with triphenylmethane dyes about efficiency
and mechanisms
摘要
本研究選擇高級氧化程序之光觸媒催化程序來降解難以分解染料,本研究內容 分為兩個主題。
第一部份為均相催化反應,即使用高級氧化過程來降解難分解之染料,利用一 種過氧硫酸鉀三聚鹽(peroxymonosulfate, PMS 即 oxone)所生成之高氧化電位的自
由基(•OH 和 SO4–•)對三苯基甲烷染料酸性藍(Acid Blue 1,AB1)進行降解並探討其
降解情形及影響催化的因子。近年來以硫酸根自由基為基礎的高級氧化技術在處 理染料廢水中已成功應用,已成為國內外研究的熱點課題。本研究,發現染料 AB1 在使用極少量之氧化劑的 Co2+/PMS 系統當中的降解速率是非常快速的,並 且會因為染料及氧化劑(PMS)濃度不同而有所差異。酸性藍(AB1)染料可作為紡織 工業中染料廢水的典型代表探討其降解情形及影響催化的因子。為探討中間產物 鑑定及可能降解路徑之研究,利用 HPLC-PDA-ESI-MS 來分離、鑑定 AB1 染料 降解中間物,成功鑑別在 Co2+ /PMS 系統中 AB1 降解反應之中間產物。根據本研 究中之液相層析圖譜及總離子層析圖,在 35-50 分鐘此段時間內均無紫外光吸 收,此中間產物可能為分子更進一步碰撞之自由基(R• or ROO•)產生的巨大分 子。1-5 分鐘為磺酸化產物,極性高,最先被沖堤出來。其它與 SO4–•、SO3–•及•OH 自由基反應之產物,分佈在 5-35 分鐘之間。本研究討論並提出可能的降解途徑。 第二個主題非均相催化反應,旨為以水熱製程合成鎢酸鉍 Bi2WO6光觸媒, 起始物使用 Bi(NO3)3‧5H2O 及 H2WO4。前置步驟先將起始物和蒸餾水或溶劑混 合後,調整適度的 pH 值等參數,將前置樣品密封放入玻璃材質的錐形瓶中,以 加熱迴流裝置以及微波消化系統中進行反應。樣品經 XRD、FESEM-EDS、XPS 等材料分析儀器測量其特性。再以紫外光或可見光照射,觀察並比較不同合成方 法的 Bi2WO6光觸媒其光催化降解三苯甲烷類染料(AB1、CV 等)的活性,並探討 Bi2WO6光觸媒的物理化學性質與其關聯性;其中探討不同染料、染料初始濃度、 催化劑添加的量和溶液初始的 pH 值等影響因子,並利用 HPLC-PDA-ESI-MS 技 術分離、鑑定降解中間物,推測及討論其降解的路徑,提供以光觸媒處理染料應 用的基礎。 關鍵字:均相催化、非均相催化、高級氧化程序、Co2+ /PMS 系統、鎢酸鉍、三 苯甲烷類染料、HPLC-PDA-ESI-MS
Abstract
Two topics were discussed in this study, including homogeneous and heterogeneous reactions in the degradation of dyes.
In the first part, the sulfate radical-based advanced oxidation technology was shown significant potential for environmental remediation to treat dye wastewater. The AOPs proceeded by Cobalt (Ⅱ) activation of peroxymonosulfate (PMS), i.e. Oxone for the Acid Blue 1 (AB1) dye, was studied in this work. It was observed that the degradation of AB1 in the Co2+/PMS system proceeded very fast and just required small amount of
oxidant. It was found that the reaction rate of AB1 was influenced by the concentration of dye and the oxidant PMS. In order to obtain a better understanding of the mechanistic details of AB1 dye degradation reaction in the Co2+/PMS system, the
intermediates were separated, identified and characterized by HPLC-PDA-ESI-MS technique. According to the following chromatogram and spectrum of TIC, at the 35-50minutes, there was no UV-absorption and the intermediates might be a definite opportunity to further collide with another radical intermediate (R• or ROO•) to yield a macro-molecule. Probable degradation pathways were proposed and discussed.
Second, Bi(NO3)3‧5H2O and H2WO4 were prepared as the starting materials, and
the reaction mixture were kept at 160℃ for 24h, 48h and 72h for hydrothermal and autoclave hydrothermal methods. The Microwave hydrothermal method was also treated at 160℃ but for 15min, 30min, 1h and 1.5h. The as-prepared samples were characterized by field emission scanning electron microscopy- energy dispersive X-ray spectrometer (FESEM-EDS), X-ray diffraction technique (XRD), and High resolution X-ray photoelectron spectroscopy (HRXPS). Sheet-like flowers, square-plates,
irregular nanoplates, and nanopowders bismuth tungsten oxide photocatalyst, Bi2WO6,
was successfully synthesized by different hydrothermal methods, including autoclave hydrothermal (AH), microwave hydrothermal (MH), and hydrothermal (H) respectively. The characteristic binding energy value of 159.0 eV for Bi 4f7/2 revealed
a trivalent oxidation state for bismuth. The binding energy shift of 156.4 eV for Bi 4f7/2
was clearly observed, suggesting the Bi(+3-x) formal oxidation state being attributed to the substoichiometric forms of Bi within the Bi2O2 layer for sheet-like flowers and
square-plates structures. The photocatalytic activities of the as-synthesized samples were evaluated by the photodegradation of crystal violet (CV) dye under UV-light irradiation (365 nm). Both the hydrothermal reaction temperature and time affected the crystallinity and morphology of the prepared catalysts, which in turn affected their degradation efficiency. A large number of the photodegradation intermediates were separated and characterized by HPLC-PDA-ESI-MS techniques. Based on these products, the probable degradation pathways were proposed and discussed. In this study, the topic is to compare the difference of photocatalytic efficiency and mechanisms of CV with these three different Synthesis methods.
目錄
摘要...I Abstract... III 目錄... V 表目錄... VII 圖目錄... IX 第一章 序論 ... 1 1-1 研究背景...1 1-2 研究動機與目的...2 第二章 文獻回顧...5 2-1 染料及染整廢水之特性與危害...5 2-1-1 染料之特性...5 2-1-2 三苯甲烷類染料...5 2-1-3 染整廢水特性...6 2-2 染料廢水處理技術...9 2-2-1 高級氧化程序(AOPs) ...11 2-2-2 過硫酸鹽氧化技術...13 2-3 光觸媒降解有機污染物...15 2-4 鎢酸鉍光觸媒...16 2-5 水熱法...18 2-5-1 Autoclave 水熱法...19 2-5-2 微波水熱法...19 2-5-3 傳統水熱法...20 第三章 實驗材料與方法...21 3-1 研究流程...21 3-2 實驗材料與設備...22 3-2-1 染料...22 3-3 實驗藥品...24 3-3-1 測試過硫酸鹽高級氧化程序藥品...24 3-4 實驗設備...25 3-5 實驗步驟...26 3-5-1 過硫酸鹽高級氧化程序(實驗一) ...26 3-5-2 合成 Bi2WO6 光觸媒(實驗二) ...27 3-6 照光程序...28 3-7 儀器與分析方法...29 3-7-1 分離與鑑定...293-7-2 表面特性分析...30 第四章 結果與討論...31 4-1 實驗一: 過硫酸鹽高級氧化程序降解三苯甲烷類染料的效率和機構 探討...31 4-1-1 Acid Blue1 之降解效率...31 4-1-2 Acid Blue1 之反應機構...36 4-2 實驗二:Bi2WO6 光觸媒及降解三苯甲烷類染料的效率之探討...49 4-2-1 材料特性分析...49 4-2-1-1 掃描式電子顯微鏡(FE-SEM)與 X 光能量散譜儀(EDS) ...49
4-2-1-2 比表面積(B.E.T surface area) ...65
4-2-1-3 粉末 X 光繞射儀分析(XRPD) ...67 4-2-1-4 X 光光電子能譜儀(HRXPS) ...71 4-2-2 光化學實驗...81 4-2-2-1 光降解 CV 染料的效率探討...81 4-2-2-2 化學需氧量(COD)及生化需氧量(BOD)去除效率...96 4-2-2-3 光降解過程中 CV 染料溶液的 UV-Vis 光譜變化...100 4-2-2-4 中間產物的分離與鑑定...105 第五章 結論與建議...146 5-1 結論...146 5-2 未來方向與建議...149 參考文獻...150
圖目錄
Fig.2-1. 三苯甲烷母體結構... 6
Fig.2-2. 典型之染整業製程... 8
Fig.2-3. Mechanism for the SO4−• chain reaction ...14
Fig.2-4. Bi2WO6的結構示意圖...17 Fig 2-5. 水熱法應用的四個領域...19 Fig. 3-1. 照光設備...25 Fig.4-1. Co2+/PMS 系統中,固定 Co2+濃度(0.01M),不同濃度之 PMS 對 AB1 染料(50mgL-1)之降解效率 ...32 Fig.4-2. Co2+/PMS 系統中,固定 PMS 濃度(0.04M),不同濃度之 Co2+對AB1 染料(50mgL-1)之降解效率 ...33 Fig 4-3. Co2+/PMS 系統中,不同染料濃度之降解效率 ...34
Fig.4-4. Co2+/PMS 系統中,AB1 染料之降解之 COD 分佈圖 ...35
Fig.4-5. Co2+/PMS 系統中,AB1 染料之降解之 BOD 分佈圖 ...35
Fig.4-6. AB1 染料(50 mgL-1)在 Co2+/PMS 系統降解的中間產物之 HPLC 層析圖...38 Fig.4-7. AB1 染料(50 mgL-1)在 Co2+/PMS 系統降解的中間產物之總離子 層析圖...39 Fig.4-8. AB1 染料(50 mgL-1)在 Co2+/PMS 系統降解的中間產物可能之反應途 徑圖...48 Fig.4-9. Bi2WO6 (CH 24)之 FE-SEM-EDS 影像...51 Fig.4-10. Bi2WO6 (CH 48)之 FE-SEM-EDS 影像...52 Fig.4-11. Bi2WO6 (CH 72)之 FE-SEM-EDS 影像...53 Fig.4-12. Bi2WO6 (MH 0.25)之 FE-SEM-EDS 影像...55 Fig.4-13. Bi2WO6 (MH 0.5 )之 FE-SEM-EDS 影像 ...56 Fig.4-14. Bi2WO6 (MH 1)之 FE-SEM-EDS 影像...57 Fig.4-15. Bi2WO6 (MH 1.5 )之 FE-SEM-EDS 影像...58 Fig.4-16. Bi2WO6之生成過程圖 ...59
Fig.4-17.Bi2WO6 (AH 24 )之 FE-SEM-EDS 影像 ...61
Fig.4-18. Bi2WO6 (AH 48 )之 FE-SEM-EDS 影像 ...62
Fig.4-19.Bi2WO6 (AH 48 )之 FE-SEM-EDS 影像 ...63
Fig.4-20.不同水熱時間合成的 Bi2WO6之XRD 圖譜 ...69
Fig.4-21.不同水熱時間合成的 Bi2WO6 (CH)之 XPS 圖譜 ...73
Fig.4-22.不同水熱時間合成的 Bi2WO6 (MH)之 XPS 圖譜 ...75
Fig.4-24. UV/ Bi2WO6 (CH)降解 CV 染料受 pH 值影響之光降解效率圖....82
Fig.4-25.UV/ Bi2WO6 (CH)降解 CV 染料之反應速率常數 k (h-1)與 pH 關係85 Fig.4-26. UV/ Bi2WO6 (MH)降解 CV 染料受 pH 值影響之光降解效率圖...86
Fig.4-27. UV/ Bi2WO6 (MH)降解 CV 染料之反應速率常數 k (h-1)與 pH 關係90 Fig.4-28. UV/ Bi2WO6 (AH) 降解 CV 染料受 pH 值影響之光降解效率圖 91 Fig.4-29.UV/ Bi2WO6 (AH)降解 CV 染料之反應速率常數 k (h-1)與 pH 關係94 Fig.4-30.不同水熱合成方法在 UV 光下降解 CV 染料受 pH 值影響之光降解 效率...95 Fig.4-31.UV/BWO 降解 CV 染料之 COD 去除效率圖 ...98 Fig.4-32.UV/BWO 降解 CV 染料之 BOD 去除效率圖 ...99
Fig.4-33. UV/ Bi2WO6 (CH)條件下,CV 染料隨著光照時間變化之 UV–vis 光譜圖...101
Fig.4-34.UV/ Bi2WO6 (MH)條件下,CV 染料隨著光照時間變化之 UV–vis 光譜圖...103
Fig.4-35. UV/ Bi2WO6 (AH)條件下,CV 染料隨著光照時間變化之 UV–vis 光譜圖...104 Fig.4-36.UV/Bi2WO6(CH)光催化 CV 染料之中間產物 HPLC 層析圖 ...108 Fig.4-37.UV/Bi2WO6(CH)光催化 CV 染料之總離子層析圖譜 ... 111 Fig.4-38.UV/Bi2WO6(CH)/CV 之中間產物層析圖(藍位移)... 112 Fig.4-39.UV/Bi2WO6(CH)/CV 之中間產物分佈圖 ... 113 Fig.4-40.UV/Bi2WO6/CV 之反應機構圖... 116 Fig.4-41.UV/Bi2WO6(MH)光催化 CV 染料之中間產物 HPLC 層析圖 ...124 Fig.4-42.UV/Bi2WO6(MH)光催化 CV 染料之總離子層析圖譜...127 Fig.4-43. UV/Bi2WO6(MH)/CV 之中間產物層析圖(藍位移)...128 Fig.4-44. UV/Bi2WO6(MH)/CV 之中間產物分佈圖 ...129
Fig.4-45. UV/Bi2WO6(AH)/CV 之中間產物分佈圖 ...138
表目錄
Table 2-1. 染料分類表 ... 8 Table 2-2. 常用的高級氧化程序 ...12 Table 3-1. TPM 染料之基本物化性質 ...23 Table 3-2. 過硫酸鹽高級氧化程序操作參數與範圍 ...26 Table 3-3. 各項實驗參數 ...28 Table 3-4. HPLC 分離過程中各時間的溶劑比例...29 Table 4-1. 50 mgL-1 AB1 染料,在 Co2+/PMS 系統降解的中間產物 ...41 Table 4-2. 50 mgL-1 AB1,在 Co2+/PMS 系統降解的中間產物之質譜圖與 UV 吸收圖 ...44 Table 4-3.不同水熱合成方法之 Bi2WO6樣品的EDS 元素組成分析彙總表 64 Table 4-4.不同水熱合成方法之 Bi2WO6樣品的比表面積與孔隙率彙總表.66 Table 4-5.不同水熱合成方法之 BWO 樣品的 XPS 束縛能彙總表 ...79 Table 4-6.不同水熱合成方法之 Bi2WO6樣品的XPS 元素組成分析彙總表 80 Table4-7.染整業放流水標準 ...97 Table.4-8.UV/Bi2WO6(CH)/CV 之中間產物質譜圖 ... 118 Table.4-9.UV/Bi2WO6(MH)/CV 之中間產物質譜圖 ...132Table 4-10. CV 染料經 HPLC-PDA-ESI/MS 分離鑑定後 N-de-akylation 類型中間產物的相關資訊...136 Table 4-11.不同水熱合成方法之 BWO 樣品光催化降解 CV 染料之主要產物 最大濃度與反應時間彙總表...142 Table 4-12.光催化降解 CV 之主要反應機制與差異...145
第一章 序論
1-1 研究背景
人類文明快速的進步與發展始於十八世紀歐洲的工業革命,大量的機器 代替人力,並開啟了科學技術爆發的時代。然而,人類享受科學技術進步 提昇生活水準與便利,伴隨而來的是地球環境的負累─諸如各樣污染的產 生、能源不斷的浪費、自然生態的衝擊,更甚的是環境和氣候上的劇烈變 化等等,對人類生存的環境帶來了莫大的威脅與挑戰。這樣的覺醒使得人 們開始急切地關心環境保護的議題。 染料廣泛使用於各領域之中,而開發中國家以染整紡工業為發展經濟之 首要產業,每年約有10 ~ 20 %的染料排放至廢水中[1],染整製程的染料 更是大量造成環境危害的帶色有機污染源。傳統的處理染料廢水方法包括 生物、吸附、凝結/絮凝、薄膜分離等技術,但因其具高成本及低去除效率 而限制其應用[2]。近年來,高級氧化法(Advanced Oxidation Processes; AOPs) 在廢水處理及其他應用上備受矚目,AOPs 係利用氫氧自由基和高反應性 氧化物種來促進分解染料的效果,顯示其極具有降解不易分解之危害性染料 的 潛 力 。 以 AOPs 分 解 有 機 污 染 物 的 技 術 包 含 : 電 化 學 氧 化 法
(Electrochemical oxidation, EAOPs)、臭氧處理(Ozonation)、臭氧/過氧化氫 程序(Peroxone)、非熱電漿法(Non-thermal plasma)、費頓法(Fenton)、光費
頓法(Photo-Fenton)、過硫酸鹽反應(PMS)、紫外光/臭氧法(UV/O3)、紫外
光/過氧化氫法(UV/H2O2)、紫外光/二氧化鈦(UV/TiO2)、紫外光/氧化鋅
(UV/ZnO)、濕式空氣氧化法(Wet air oxidation; WAO)及觸媒濕式空氣氧化 法(catalytic wet air oxidation; CWAO);在使用時會針對廢水的性質及水量 狀況來選擇適用的處理方法,以有效的改善廢水的水質[3-5]。 研究中所使用的三苯甲烷類染料 Triphenylmethane(TPM)常應用於各種 技術上,在紡織工業中廣泛的使用在絲綢、羊毛、棉花的染色及油墨、蠟、 亮光漆、塑膠製品的染色。此外,除了紙、皮革、化妝品及食物加工業之 外,生化應用中的細菌和組織病理的著色劑也應用了各種不同的三苯甲烷 類染料[5]。由於其結構類似芳香環,所以被視為致癌物質之ㄧ[6]。
1-2 研究動機與目的
本研究是利用均相催化(Co2+/PMS)及非均相催化(UV/Bi2WO6)兩種程序 處理三苯甲烷類(triphenylmethyl)染料,並探討不同操作變因對催化降解染 料之影響情形,其中包含光觸媒之晶相、反應物之濃度、pH 值等。 本研究除了探討光催化效率及最佳化條件,亦同時以高效液相層析電 灑質譜(HPLC-ESI-MS)分離及鑑定光催化降解三苯甲烷類染料之中間產 物,並探討其中的反應機構與差異。 未來將有助於更有效率的利用可見光處理有污染廢水;亦可做為反應槽之設計參數;並且回收其中可再生之中間物,以提高染整廢水之處理效率 並節省製程成本,減少廢水污染對環境衝擊,以發展綠色化學為目標,使 地球得以永續發展。
第二章 文獻回顧
2-1 染料及染整廢水之特性與危害
2-1-1 染料之特性
染料係指吸收波長400~800 nm 的可見光而顯示出顏色,且可溶於水中, 並能使一定顏色附著於纖維上的物質;合成染料的歷史始於1856 年 Perkin 利用化學合成有機及無機染料,至今約一百五十年,染料已成為化學工業 中的重要一環。染料主要結構為芳香族與雜環化合物,其中帶有顯色基團 (-C=C-、-N=N-、-N=O);極性基團(-SO3Na、-OH、-NH2); 部份親水基團(-SO3H、-COOH)等官能基[7] ,並可依染色之性質或以 化學構造加以分類,其分類如表2-1[8, 9]。2-1-2 三苯甲烷類染料
三苯甲烷類(triphenylmethyl)染料,是以三苯甲烷為母體的染料,如 Fig.2-1。三苯甲烷的次甲基受到三個苯基的影響,有很高的化學活性;色 澤非常鮮艷,著色力高,色譜的範圍很廣;缺點是耐曬性及耐水性不佳。 依其染色物件和方法的不同又可分為兩類:一為酸性三苯甲烷染料, 分子含有兩個或兩個以上的酸性基團,主要用於羊毛、蠶絲、皮革等染色,也可用於墨水和橡膠等的著色。如實驗中所使用的Acid Blue 1;二為鹼性 三苯甲烷染料,主要用於棉、蠶絲、紙張的染色,也用於醫療上作為消毒 劑或是染色劑。如實驗中所用的結晶紫(Crystal Violet)。 Fig.2-1 三苯甲烷母體結構 三苯甲烷類染料已被證實對於生物及人體具有細胞毒性,甚至具有致 癌性(carcinogenicity)及遺傳毒性(genotoxicity),如Malachite Green (孔雀石 綠)不僅會抑制海藻的生長,對魚類有致命的毒性,也會對人體口腔產生毒 性;而結晶紫(Crystal Violet) 則會對人體造成噁心、腸胃炎、黏膜潰瘍等 傷害[10-13],因此使三苯基甲烷類染料有效率的由環境中完全移除有其研 究的必要性。
2-1-3 染整廢水特性
染整廢水是由染整工廠製程中,所排放之混合廢水,一般典型之染整 業製成流程,其中包括前處理程序所排放的退漿、煉精、漂白、絲光廢水; 染色過程排放的染色廢水;印染階段排放的印花廢水、助劑、皂洗及水洗 廢水等[14]。而依據國內環保署公告之染整業的製程廢水概分為三類,包括(一)印花、梭織布染整者(二)筒紗、絞紗染色、針織布及不織布染整者(三) 整理、紙印花、刷毛、剪毛、磨毛及非屬前二類者。其染整廢水之常見特 性如下 [15, 16]: 1. 水質變化大:因訂單會隨市場需求,造成使用的原料、產品與助劑 種類繁多,且製程過程中,可能殘留部分之原料與染料異構體等, 故排放水質組成複雜,多為毒性物質與不易分解之化合物。 2. 高酸、鹼、鹽度及泡沫:由於製程中所使用之染色助劑,主要有酸 類、鹼類、鹽類及界面活性劑等種類,當作用時亦會產生高濃度之 懸浮值(SS)。 3. 高溫度:因高溫能提升染料及助劑之固著能力,故使製程廢水之排 放溫度較高。 4. 高色度:一般染料的色度頗高,因殘留染料使廢水呈現高色度的特 性。Wiff 發色基團學說指出染料分子的發色體中不飽和的共軛雙 鏈與含有提供電子基或吸收電子基的基團相連,另一端與電性相反 的基團相連。化合物分子吸收了一定波長光量子的能量後,發生極 化反應並產生偶極矩,使價電子在不同能級間躍遷而形成不同的顏 色。染料分子結構中共軛鏈越長,共軛雙鍵數增加以及苯環數增 加,分子量增大皆會加深染料的顏色。 5. 高化學需氧量(COD):製程中使用大量之染料與助劑,因而造成
COD值偏高的現象。 Fig.2-2. 典型之染整業製程[17] Table 2-1 染料分類表 染料類型 特性 應用範圍 酸 性 染 料 (Acid dyes) 多含有磺酸基或羧酸基之鈉鹽, 溶解性佳,酸性會使羊毛等纖維 上之─NH2形─NH3+,易與染料結 合,增進酸性染料上色速率。 偶氮型、蒽醌型、三苯甲烷 型等。一般應用於尼龍、蠶 絲與食品工業等之染色。 鹽 基 性 染 料 (Basic dyes) 因含有氨基及取代氨基,當溶於 水會解離成陽離子,又稱為陽離 子性染料(Cationic dyes)。 主要為三苯甲烷類、二苯甲 烷 類 、 偶 氮 類 或 氧 雜 蒽 (C13H10O)類等。一般作為紡 織原料。 直 接 染 料 (Direct dyes) 可以將纖維素在中性鹽染浴中直 接染色之陰離子染料。 可應用於人造纖維、尼龍。 分 散 性 染 料 (Disperse dyes) 主要含有非離子之極性基團(如 羥氨、氨基、羥烷氨基與氰烷氨 基等),微溶於水、吸收率低、不 易分解與氧化。 常做聚酯纖維、尼龍與奧龍 之吸附性染色。 偶 氮 染 料 (Azoic dyes) 主要具有偶氮雙鍵(-N=N-)的 芳香族化合物,其中常與一個或 多個芳香環系統,所相連構成之 共軛體系。 廣泛地應用於纖維的染色。 反 應 性 染 料 此染料分子能與纖維素纖維及蛋 白質纖維中的羥氨與氨基發生共 應用於棉、蠶絲、纖維與羊
染料。 金 屬 複 合 染 料 (Metal complexes) 一般含有鉻,其目的為提升染色 時之上色性、均染性與染色堅度 等。 適用於羊毛、真絲、尼龍與 纖維之染色。 鉻 媒 染 料 (Chrome dyes) 由於本身固著性較弱,必須藉助 媒染劑鉻來增加染色能力,其含 有黃酸與羧酸之官能基。 常 應 用 於 羊 毛 及 皮 革 染 色 用。 還 原 染 料 (Vat dyes) 常見有靛類、蔥醌與蔥酮等形態 之染料,其分子不具有黃酸與羧 酸之官能基,因此水溶性差與不 能直接染色之特性,需經還原劑 (保險粉)還原後,成可溶性隱色 體,才能溶於鹼性液中,而被纖 維吸收而染著,且固著性佳, 常使用於棉及纖維。 硫 化 染 料 (Sulfur dyes) 由於不溶於水,染色時須以硫化 鈉或其他還原劑,使其還原及溶 解,然後經棉類纖維吸收,再氧 化顯色恢復為不溶解狀,而固著 於纖維上。 常使用於棉、人造棉與造紙 之上色。
2-2 染料廢水處理技術
目前染料廢水處理的常用技術主要分三類:物理吸附技術、化學氧化技 術及生物處理技術。 處理染整廢水之物理方法包含吸附、混凝、絮凝、沉澱、浮選、泡沫、 分離、高分子、絮凝劑、反滲透/超濾、電離、輻射、焚燒等方法。最常 見之吸附技術則是利用具有大表面積、化學穩定性較好及可以抵抗微生物 分解的物質作為吸附劑,如活性碳、瓷土、矽礦石、氧化鋁、紅泥或灰燼 等,使染料廢水色度降低[18-21]。吸附的特色在於可以有效的將染料由廢 水中移除,但只是將所吸附的染料轉移到別的地方,並沒有達到真正去除染料的結果。 生物處理技術主要是利用細菌、酵素或微生物使染料降解脫色[22], 處理方法包括潟湖中和池、曝氣、生物濾池、活性污泥、厭氧消化、生物 強化。但此技術較適用於生物易分解或濃度較低的染料廢水。而在實際的 狀況下,可能會因為染料廢水毒性太高或是濃度太高,抑制生物的生長, 而無法有效的展現其染料分解的成效;此外,此技術所需要花費的時間較 長,對於應用上有一定的限制。 化學氧化技術係藉由強烈的氧化作用來破壞廢水中的有機物,進而達到 較徹底地去色、去毒、去味和脫臭的作用,亦是目前處理染整廢水的主要 研究重點之一。其中含有有加氯氧化、臭氧氧化、濕式空氣氧化、燃燒、 硝酸空氣氧化以及高級氧化程序(AOPs) (例如:Fenton法、光化學氧化、光 催化氧化、電解氧化、超音波處理) 等方法。化學氧化技術正解決物理吸 附及生物處理的缺點,其不僅可以在短時間內分解染料有機污染物,亦可 同時處理大量、高濃度的染料廢水。 但上述方法,大部分難以將含有芳香族、脂肪族、重金屬等之污染物 確實破壞或去除。Azmi et al. (1998)提出單純利用常見的物理及化學程序, 雖能有效處理紡織及染整工業廢水,但亦會產生大量污泥及增加成本等問 題[12]。此外,Robinson et al. (2001)亦提出利用生物處理或結合生物之技 術,則是較具有可行性的處理方法,但缺點為操作不易,且需要較長的處
理時間[23]。目前工業界常用的方法有絮凝沉澱 、吸附、生物降解、電化 學及化學氧化等。
2-2-1高級氧化程序(AOPs)
高級氧化程序(AOPs)係利用氫氧自由基(‧OH )和高反應性物種(HO2•、 H •、O2– •與O3– •)為主要的氧化劑,與有機污染物反應,而反應中所產生的 有機自由基可以繼續與氫氧自由基(‧ OH )發生氧化分解反應,從而達到染 料分解、礦化的效果,主要應用於毒性高、生物難分解的物質。而反應中 的主要氧化劑氫氧自由基(‧ OH )其高氧化電位(2.80eV) 僅次於氟(F2),並 高於其他常見的強氧化劑(如臭氧、氯氣、過氧化氫、過錳酸鉀等),因此 氫氧自由基(‧ OH )之強氧化力具極佳氧化分解有機污染物的效果。 氫氧自由基的另一特色為其為選擇性很小的氧化劑,即當水中存在多種 污染物質時,不會有某種特定的物質可以分解,而另一種物質卻不受影響 的情況。相較於一般的化學氧化法,AOPs的反應速度很快,因為氫氧自由 基具有很高的反應速率(約為108~1010 M-1s-1),即使在自由基濃度低的情形 下也可以有效地達到降低汙染物降之總有機碳數(TOC)和化學需氧量 (COD)[24]。AOPs常被應用於低污染程度的最終處理程序,係因為其除了 能有效處理難分解物質,並能將污染物完全氧化成CO2及H2O,且對環境 是友善的(environmental-friendly)。高級氧化處理並發展出結合各種方式以提升分解有機污染物的效率,例
如結合不同的催化劑(如:UV/H2O2/O3、UV/H2O2/Fe2+)[25, 26];結合UV /
光觸媒(TiO2以及ZnO)/微波(microwave)和超音波(Ultrasound)/UV光/光觸媒
(TiO2及ZnO)等,旨在增加氫氧自由基(.OH )及觸媒表面與OH基的鍵結,
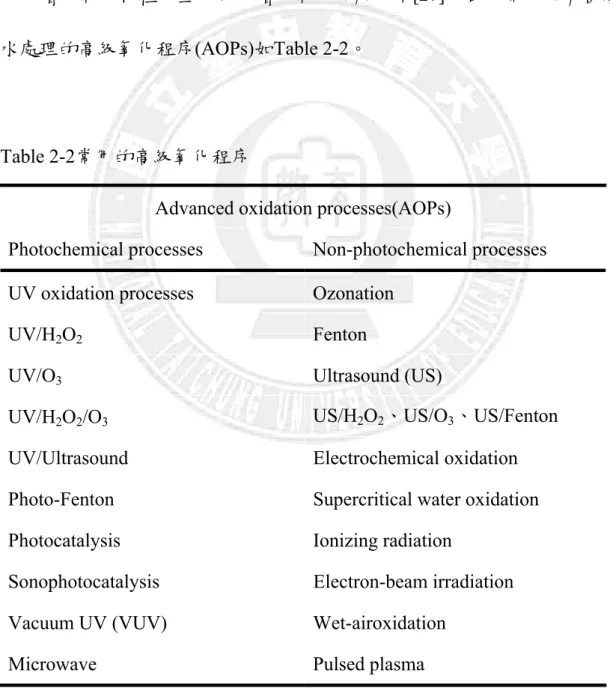
並增加光觸媒的表面積、溶液和光觸媒表面之間化學物種的質量傳輸速度 以及增加氧化物種的生成來以增加氧化降解效率[27]。目前常用於有機廢 水處理的高級氧化程序(AOPs)如Table 2-2。
Table 2-2常用的高級氧化程序
Advanced oxidation processes(AOPs)
Photochemical processes Non-photochemical processes
UV oxidation processes Ozonation
UV/H2O2 Fenton
UV/O3 Ultrasound (US)
UV/H2O2/O3 US/H2O2、US/O3、US/Fenton
UV/Ultrasound Electrochemical oxidation
Photo-Fenton Supercritical water oxidation
Photocatalysis Ionizing radiation
Sonophotocatalysis Electron-beam irradiation
Vacuum UV (VUV) Wet-airoxidation
2-2-2 過硫酸鹽氧化技術
近年來,應用反應系統簡單,且不需要外加熱源和光源的過渡金屬催化 過硫酸鹽強氧化劑(E0 = 2.05 V)産生硫酸根自由基的方式極受到關注[28]。 在工業界也已廣泛地應用過硫酸鹽,例如作為石化工業的潤滑油或起始 物、乳化聚合反應的起始劑、游泳池清潔劑、毛髮漂白、銅印刷電路板的 微蝕刻、以及 TOC 分析氧化劑以及在土壤處理及地下水污染。常見的過 硫酸鹽類型包含K2S2O8、Na2S2O8、(NH4)2S2O8[29, 30]。Ball 和 Edwards 兩位學者於 1956 年首度發表以鈷離子(Co2+)為介質,分
解過硫酸氫鉀複合鹽(KHSO5,PMS)的研究,此系統反應條件溫和,生成
自由基的速率高,此後陸續有許多動力學機制及此高氧化系統(Co2+/PMS)
的機構探討的研究倍出[31, 32]。
過硫酸氫鉀複合鹽(KHSO5,PMS),是 Oxone(2KHSO5.KHSO4-K2SO4)
的活性成分,其氧化位能是源自於高酸化學性質,它是單過硫酸也稱之為 Caro’s 酸中的第一個中式鹽。 近年來,化學氧化反應著重使用 Co2+/PMS 的化學氧化技術取代 Fenton 法,原因在於其產生的 SO4–•的氧化電位(1.82V)高於應用 Fenton 法所使用 的H2O2產生的•OH(1.76V);此外,Fenton 法,反應侷於 pH<4 的酸性條件 之下,因在鹼性條件下,Fe3+會生成 Fe(OH)3(s)沉澱。PMS 是由一個 SO
3-取代HOOH 的不對稱的過氧化物,自身的獨特結構也使其本身很容易被激 發和活化[28],因此 Co2+/PMS 化學氧化技術最大的優勢則在於可應用的 pH 範圍較廣,其在酸性到鹼性的範圍下均會反應生成 HSO5−•、SO4−•、•OH 等自由基,來氧化廢水中難分解的有機物[33, 34]。 l995 年,Kim 和 Edwards 兩位學者提出以 SO4−•為主要氧化劑的自由基 鏈反應機構,在此鏈反應中,在Co2+催化之下,使PMS 生成 SO4−•及Co3+, Co3+亦被PMS 還原為 Co2+,形成一個催化循環反應,直至PMS 被反應耗 盡為止[35]。
Fig.2-3. Mechanism for the SO4−• chain reaction[35].
均相 Co2+/PMS 系統具有催化效率高,氧化能力強等優點,但同時也存 在著侷限性,比如催化劑不易回收再利用等,而最大的侷限性就是Co2+容 易對環境造成污染,儘管均相催化需要的Co2+的量不是很多,但是仍然可 以造成潛在的二次污染和生物毒性。如果能夠將鈷離子固定化,而又不會 使其失去活性,那麼以上的缺點就可以得到克服。非均相催化正是基於這 一點而產生的[32]。
2-3 光觸媒降解有機污染物
催化主要有兩個途徑:當光觸媒表面主要吸附為OH-或H2O 時,它們俘 獲電洞產生‧ OH,此為間接氧化途徑;當光觸媒表面吸附有機物時,電洞 即直接氧化有機物。吸附於觸媒上的氧及水合懸浮液中的OH-及H2O 均可 產生‧ OH,而‧ OH 自由基為光催化反應中主要之活性物質,活性高的氧化 物種可促進產生更多氧化還原的連鎖反應,分解空氣或水中有機物質,以 分解目標污染物。其中,氫氧自由基由於具有高的氧化電位,被認為是導 致光催化降解反應進行最主要的機制。光催化降解染料的過程如反應式 1-10 所示: TiO2 + hν → TiO2 (hvb+ + ecb−) (1) ZnO+ hν → ZnO(hvb+ + ecb−) (2)hvb+ + dye+ → dye+• → oxidation of the dye (3)
hvb+ + H2O → •OH + H+ (4) hvb+ + OH− → •OH (5) ecb− + O2 → O2−• (6) O2−• + dye+ → dye-OO• (7) O2−• + H2O• + H+ → H2O2 + O2 (8) H2O2+ ecb− → •OH + OH− (9)
研究指出,這些被降解的汙染物,會逐步礦化成二氧化碳、水、及礦 酸(mineral acid,如硝酸) [36],如反應式 11: (11)
2-4 鎢酸鉍光觸媒
隨著工業迅速的發展,環境污染日益嚴重,全球無不致力於擬定各環保 的政策以解決環境污染的問題,利用光催化技術處理環境中的有機污染物 成為目前最活躍的研究領域之一,尋找高效率的光觸媒更是其首要任務。 傳統光觸媒之應用,以TiO2 最為廣泛,但 TiO2觸媒雖具其化學性質比較 穩定、易製備、無毒性、催化效率高且無二次 污染等優點,但因其能間 隙(Energy band gap, Eg)約在 3.2 eV,因此僅能吸收紫外光(λ<385 nm)範圍之波長,因而限制其實用之可行性。例如銳鈦礦型(Anatase)的 TiO2 的能間 隙為3.12eV,僅能利用波長小於 387nm 的紫外光,只能利用 5%左右太陽 光能量[37, 38],因此,發展能應用於可見光之新型光觸媒勢在必行。 Aurivillius 結構是由一維的鈣鈦礦層和(Bi2O2)2+層有規則地相互交替排 列而成,其化學通式為(Bi2O2)2+ (A m-1B mO3m+1) 2- [39],此處 A 為適合於 12 配位的+1、+2、+3、+4 價離子或由它們組成的複合離子,B 為適合於八面 體配位的離子或由它們組成的複合離子,m 為一整數,對應鈣鈦礦層(A m-1B mO3m+1) 2-內的八面體層數,其值可為1-5。Aurivillius 結構的層間距一般為
奈米級,可作為是一種二維的奈米材料,因而是一種極具發展潛能的奈米 光觸媒材料。而 Bi2WO6係最簡單的 Aurivillius 型氧化物,是由八面體的 WO6 層和(Bi2O2)2+離子層堆疊而來的層狀結構,如 Fig.2-4 所示。此外 Bi2WO6的價帶由Bi6s和O2p軌域混成而成,具有較高的氧化活性和電荷流 動性,因此,Bi2WO6半導體光催化劑的研究發展為可見光催化降解開闢了 條新的途徑。 Fig.2-4. Bi2WO6的結構示意圖[39]。 Bi2WO6 被視為一種新型的可見光光催化劑,能間隙為 2.7 eV 左右 [40-42]。Kudo et al (1999)[43]首次發表利用 Bi2WO6成功於硝酸銀水溶液系 統中光解水產生O2。其後Tang et al [44]亦發現 Bi2WO6在可見光下可有效 降解氯仿和乙醛等有害物質。近年來,Bi2WO6的研究更著重於形態的調控 上,透過改變合成方法及添加表面活性劑來調控 Bi2WO6 的形態,進而達 到改善其光催化性能的目的[45-47]。本研究係比較用不同的水熱合成方式 合成出Bi2WO6的形貌,並探討其降解CV 染料的效率及可能的反應機構。
為進一步探討中間產物的可能之反應路徑,在合成 Bi2WO6的過程中可能
涉及之化學反應如以下(式 12-16)[48]:
Bi(NO3)3 + OH- → BiONO3↓+ 2NO3 (12)
Bi3+ +3OH- → Bi(OH)3↓ (13)
H+ + OH- → H2O (14)
2 Bi3+ + H2WO4 + 2H2O → Bi2WO6↓ + 4 H+ (15)
2 BiONO3 + H2WO4 → Bi2WO6↓+ 2HNO3 (16)
首先 Bi(NO3)3溶於H2O 會形成無定形 BiONO3之沉澱(式 12),而 Bi(NO3)3
並產生水解,H2O 並會電離為 H+與 OH-,OH-並與Bi3+反應形成鹼式鹽如 式 15。加入硝酸銨調整 pH 至 9,而 Bi3+即與溶液中之 OH-產生 Bi(OH)3 沉澱,而H2WO4並分別與Bi3+及BiONO 反應,生成產物 Bi2WO6之沉澱。
2-5 水熱法
水熱法早在 1953 年以前,礦物學即使用水熱法進行相關之研究以模擬 地球礦物和岩石在地殼內之高溫環境下所形成的過程,G.W. Morey並提出使用水熱法成功合成約有 80 種礦物的研究報告[49]。而水熱 法製備奈米粉末的特色和成熟技術,已經廣泛應用於奈米金屬、氧化物、 非金屬氧化物粉末的大量化生產。Fig.2-5. 水熱法應用的四個領域 (改編自[50])
本研究係使用不同水熱合成方法合成Bi2WO6觸媒,其中包含Autoclave
水熱法(AH)、微波水熱法(MH)以及傳統水熱法(CH)。
2-5-1 Autoclave 水熱法(Autoclave hydrothermal method;簡稱 AH)
係指於特製之密閉容器高壓釜(Autoclave)中進行反應,反應物(水溶
液或溶劑等)在高溫高壓的環境產生熱分解或氧化等化學反應, 在此環境 中能加速溶液中離子反應及促進水解反應,使溶質的溶解度提高,系統之 擴散係數及反應性也隨之增加。
2-5-2 微波水熱法(Microwave hydrothermal method;簡稱 MH)
結晶質氧化物,微波水熱法是把傳統的水熱合成法與微波場結合起來的一 種新方法。其基本原理是:利用微波場作為加熱源,反應介質在特製的能 通過微波場的耐壓鐵弗龍管中進行反應,在微波加熱之下成為一高溫高壓 之反應環境,使通常難溶或者不溶的物質溶解並且再結晶,再經過分離和 熱處理得到產物。由於在高溫高壓條件下,介質水處於臨界狀態,反應物 在水中的物性和化學反應性能都有很大改變,因此製備反應是在非理想、 非平衡狀態下進行的,其反應過程和機理也與常態下反應有很大的差異, 反應的活性得到大大提高。在微波加熱條件下,瞬間可使整個反應體系溫 度達到結晶化溫度,加速了合成與晶化的速度。而微波水熱法係以輻射方 式傳遞,故可直接對反應物進行加熱,進而提升其效率。其優點是極快速 運動引起結晶化、迅速的加熱加溫處理以及可能形成新的介穩相。
2-5-3 傳統水熱法(Conventional hydrothermal method;簡稱 CH)
傳統水熱法是架設迴流裝置,熱能係利用傳導的方式經容器傳遞到溶液
中,再藉由對流的方式讓熱均勻分佈,使溶液溫度升高,即為高溫常壓之
第三章、 實驗材料與方法
3-1 研究流程
vis/Bi2WO6/CV 合成奈米級鎢酸鉍觸媒暨過硫酸鹽高級氧化程序降解三苯甲烷類染料 的效率和機構探討 合成奈米級鎢酸鉍觸媒 過硫酸鹽高級氧化程序降解 相關文獻收集 相關文獻收集 Bi2WO6光化學程序 Co2+/PMS 系統非光化學程序 UV/Bi2WO6/CV 探討反應機構 分離與鑑定反應中間產物 推測可能之反應路徑 去除效率 影響因子 最佳操作條件 Bi2WO6材料的表 面特性分析 結果與討論 結論與建議 高效能液相層析電灑質譜儀(HPLC-ESI-MS) 光電二極管紫外光/可見光光譜儀(PDA UV/Vis) 場發射式掃描式電子顯微鏡(FESEM) X 射線繞射儀(XRD) 高解析電子能譜儀(HRXPS) 化學需氧量測定儀(COD Analyzer) 生物需氧量測定儀(BOD Analyzer) 高效能液相層析電灑質譜儀 (HPLC-ESI-MS) 光電二極管紫外光/可見光光譜儀 (PDA UV/Vis) 化學需氧量測定儀(COD Analyzer) 生物需氧量測定儀(BOD Analyzer)3-2 實驗材料與設備
3-2-1 染料
實驗一以酸性藍1(Acid Blue 1,簡稱 AB1),作為目標污染物,由 Tokyo
Kasei Kogyo Co 公司提供(為試藥級,純度 99.9%)。AB1 屬於三苯基甲烷 類之陽離子性染料,結構主要藉由中心碳鍵結三個苯環,其在各個苯環上 對位位置含有胺基團(其上還有 N, N-二甲基或乙基等取代基團)。主要應用 於染整工業,包括尼龍、毛織品、棉與蠶絲,以及商業上的油漆、塑膠、 衣服、化妝品與食物色素之染色等等。
實驗二以結晶紫(Crystal Violet,簡稱 CV),作為目標污染物,由 Tokyo Kasei Kogyo Co 公司提供(為試藥級,純度 99.9%)。CV 是屬於三苯基甲 烷類之陽離子性染料,結構主要藉由中心碳鍵結三個苯環,其在各個苯環 上含有 N,N-二甲基胺基團。主要應用於染整工業,包括尼龍、毛織品、 棉與蠶絲,以及商業上的油漆、塑膠、衣服、化妝品與食物色素之染色等。
Table 3-1 TPM 染料之基本物化性質 (1) AB1
Dye Acid Blue1
Abbreviation AB1
Molecular formula C27H32N2O6S2
Molecular weight (mole/g) 544.68
Absorption maximum (nm) 640 Structural formula N N SO3H SO3H (2) CV
Dye Crystal Violet
Abbreviation CV
Molecular formula C25H30ClN3
Molecular weight (mole/g) 407.98
Absorption maximum (nm) 588 Structural formula N N N H3C CH3 CH3 CH3 H3C CH3 Cl -
3-3 實驗藥品
3-3-1 測試過硫酸鹽高級氧化程序藥品
(1) 過氧硫酸鉀三聚鹽(2KHSO5‧KHSO4‧K2SO4):純度>99%,
SIGMA-ALDRICH
(2) 六水合硝酸鈷(II) ((Co(NO3)2‧6H2O):純度>99%,ACROS
3-3-2 測試染料廢水藥品
(1) 酸性藍 1(Acid Blue 1):純度>99%,Tokyo Kasei Kogyo Co. (2) 結晶紫(Crystal Violet):純度>99%,Tokyo Kasei Kogyo Co. (3) 氫氧化鈉(NaOH):Merck Co.
(4) 硝酸(HNO3):Merck Co.
3-3-3 合成奈米級鎢酸鉍觸媒 (1) 硝酸鉍(Bi(NO3)3.5H2O):純度>99%,Aldrich (2) 鎢酸銨(NH4)10W12O41.5H2O):純度>99%,Aldrich (3) 乙二醇(CH2OHCH2OH):Panreac (4) 氫氧化銨(NH4OH):島久藥品 3-3-4 高效液相層析電灑質譜(HPLC-ESI-MS)分析藥品
(1) 醋酸銨(CH3COONH4):Merck Co.
(2) HPLC 級甲醇(CH3OH):J. T. Baker Co.
3-4 實驗設備
(1) 迴流設備:循環水溫度:25±1℃。 (2) 照光設備:使用 Chromato-VueR 之 C-75 型照光箱,內有兩組 UV-365nm 紫外光燈管(15W)來進行照光實驗,如 Fig.3-1[51]。 Fig.3-1. 照光設備:(1) Chromato-Vue C-75 型照光箱、(2) UV 燈管 15W(365nm)、(3)磁石攪拌器,(4)磁石,(5) 100mL 定量瓶。 (3) 數位式多功能離心機:CN-2060 (4) 抽氣過濾裝置 (5) 熱風循環烘箱、高溫爐3-5 實驗步驟
3-5-1 過硫酸鹽高級氧化程序(實驗一)
本實驗以 AB1 染料作為目標污染物, (1) 取 0.1 g AB1 溶於 100 mL 之去離子水,配置成 1000 mgL-1 貯存液 (可保留 6-12 個月)。 (2) 取適當的體積,以去離子水稀釋至 50 mg/L,其體積約為 95 mL。 (3) 分別調整 pH 值至 3 至 9,定量至 100 mL,使其濃度為 50 mgL-1。 (4) 測試不同莫耳濃度比 Co2+:PMS,其操作參數與範圍列於 Table 3-7。 (5) 本實驗主要以中性環境下進行氧化還原反應,每隔 5 分鐘,取 1 mL 樣 品。 (6) 反應最終產物以 HPLC-ESI-MS 分析。 Table 3-2. 過硫酸鹽高級氧化程序操作參數與範圍 操作參數 操作範圍 Co2+(mM) 0.25-1 PMS (mM) 0.25-1 pH 值 3-9 溫度 (℃) 室溫3-5-2 合成 Bi
2WO
6光觸媒(實驗二)
(1) 水熱法合成奈米鎢酸鉍
1. Bi(NO3)3.5H2O (4 mmol;1.94 g)加入 H2WO4 (0.17 mmol;0.042 g)。
2.加入 Ethylene glycol 20ml 及 D.I. water 70ml 。 3.將溶液置入三角錐型瓶內,並裝置迴流設備。 4.以水熱法(200℃)分別加熱迴流 24 h、48 h、及 72 h。 5.冷卻後,將濾液以 0.45 μm 過濾。 6.以 85℃烘乾 72h。 7.將粉末以研缽研磨備用。 (2) 微波水熱法合成奈米鎢酸鉍
1. Bi(NO3)3.5H2O (4 mmol;1.94 g)加入 H2WO4 (2.04 mmol;0.51g)。
2.加入 Ethylene glycol 20ml 及 D.I. water 70ml。 3.將溶液置入鐵氟龍管內,每管 30 ml 。
4.以微波水熱溫度 160℃維持 0.25 h、0.5 h、1 h 及 1.5 h 。 5.冷卻後,將濾液以 0.45 μm 過濾。
6.以 85℃烘乾。
3-6 照光程序
實驗項目裡,每次依條件配製染料溶液濃度和調整pH值,再定量至100 ml,取5 ml是為C0,將製備好的Bi2WO6光觸媒取0.05 g加入CV染料中,反 應溶液置於可見光或紫外光照光箱或暗箱中,於開放系統下內進行催化反 應。遮光攪拌30分鐘後,取0小時(5 ml),每8小時定時取樣5ml,光催化實 驗於每次取5 ml後離心(轉速:3000 rpm,離心至少30分鐘)。 Table 3-3. 各項實驗參數 實驗二 (1) 使用染料 CV (2) 使用觸媒 Bi2WO6 (3) 反應溶液pH值 3, 5, 7, 9 (5) 觸媒克數 (gL-1) 0.05 (6) 染料濃度(gL-1) 0.01 (8) 照光光源類型 UV /Dark3-7儀器與分析方法
3-7-1分離與鑑定實驗一與二使用HPLC-ESI-MS:Waters W3100 LC/MS系統,裝備有一 個二進制泵浦、光電二極管列陣偵測器(Photo-Diode-Array; PDA)、自動採樣 器和微質量偵測器,用於分離與鑑定使用。並於實驗一和二中使用PDA
UV-Vis光譜儀:Scinco S-3100系統。測定Co2+/PMS和Bi2WO6降解AB1及CV
染料樣品溶液的殘留量。每次取樣後,由PDA UV-Vis光譜儀測定其樣品紫 外光/可見光吸收值,以測定其樣品中染料的殘留量;或由HPLC(Waters 2998)
分離測定染料的殘留量。沖提液則為Solvent A-25 mM醋酸銨(CH3COONH4,
pH = 6.9)緩衝溶液0.1 M (pH 4.66)和Solvent B-甲醇;流速為1 mL min-1其中,
分離管柱使用Atlantis TM dC18 column (250 mm × 4.6 mm i.d., dp = 5 μm)。分
離條件如Table 3-4。
Table 3-4. HPLC 分離過程中各時間的溶劑比例
梯度時間 CH3COONH4 (ml min-1) CH3OH (ml min-1)
t = 0 min 0.95 0.05
t = 20 min 0.50 0.50
t = 40 min 0.10 0.90
t = 48 min 0.05 0.95
3-7-2 表面特性分析
實驗二研究以SEM/EDS、XRD、XPS來觀察以水熱法及微波水熱法合成
的奈米晶體Bi2WO6之表面型態、結構組成及結晶構造、粒徑大小。使用的
儀器如下所述:
(1) 場 發 射 槍 掃 描 式 電 子 顯 微 鏡 (Field Emission Scanning Electron Microscopy, FE-SEM):JEOL JSM-7401F,JEOL, JSM-6330F。
(2) X射線粉末繞射儀 (X-ray Powder Diffractometer, XRPD):MAC Sience, MXP18 X-ray diffractometer with Cu Κα radiation (λ=1.54178 A), 使用 WAG廣角繞射(20-80度),其工作電壓與電流為40 kV和80 mA,掃描速 度為每分鐘4度。
(3) 電子能譜儀:高解析電子能譜儀(High resolution X-ray Photoelectron Spectrometer, HRXPS):ULVAC-PHI XPS, PHI Quantera SXM。化學分析 電子光譜儀(Electron Spectroscopy for Chemical Analysis, ESCA):Fison (VG) ESCA 210。
3-7-3 需氧量測定設備
(1) 化 學 需 氧 量 測 定 儀 (Chemical Oxygen Demand, COD Analyzer) : ROCKER/LOCAL
第四章、 結果與討論
4-1 實驗一:過硫酸鹽高級氧化程序降解三苯甲烷類染
料的效率和機構探討
Ling et al 於 2010 年即提出以 Co2+/PMS 系統處理染料的相關研究,受限 於分析儀器之不足,尚未能分離並鑑定其中間產物[52];而本研究旨探討於 Co2+/PMS 系統中降解染料之效率,並以 HPLC-ESI-MS 分離並鑑定中間產 物,並提出可能之反應路徑。4-1-1 Acid Blue1 之降解效率
均相催化(Co2+/PMS)能有效產生強氧化自由基來處理染料廢水,因此實驗 係探討Co2+/PMS 之不同莫耳濃度的添加比例,對 AB1 染料去除效率的影響。 (1) 固定Co2+濃度,改變PMS 濃度 Fig.4-1 顯示在 AB1 染料濃度為 50mgL-1下,固定Co2+濃度(0.01M),改變 PMS 濃度(0.01~0.1M),由結果發現顯示 Co2+/PMS 的均相催化系統中有極好 的效果,在Co2+:PMS 的莫耳比為 0.01 M:0.05 M 時,此反應在 1 分鐘內, 其降解率可達99 %。此反應速率並隨著 PMS 劑量增加而變快。在 PMS 濃度高於0.05 M 時,在 1 分鐘以內即降解完畢,由於反應速率過於快速,因 此取PMS 濃度為 0.04M 為改變 Co2+濃度之實驗控制變因。 Fig.4-1. Co2+/PMS 系統中,固定 Co2+濃度(0.01M),不同濃度之 PMS 對AB1 染料(50 mgL-1)之降解效率。 (2) 固定PMS 濃度,改變 Co2+濃度 控制PMS 濃度為 0.04M,改變 Co2+濃度(0.001~0.05 M) 對濃度為 50 mgL-1 的 AB1 染料其降解效率的影響,Fig.4-2 則顯示 Co2+莫耳濃度高於 0.02M 時,此反應在 8 分鐘內,其降解率可達 99 %。此反應速率亦隨著 Co2+莫耳濃度增加而變快。
Fig.4-2. Co2+/PMS 系統中,固定 PMS 濃度(0.04 M),不同濃度之 Co2+對AB1 染料(50 mgL-1)之降解效率。 (3) 不同濃度AB1 染料的降解效率 染料濃度的影響關乎處理系統的處理效率,Fig.4-3 顯示不同濃度之 AB1 染料在 Co2+/PMS 的均相催化系統中之降解效率,AB1 染料濃度在 50 mgL-1時,反應在3 分鐘以內降解效率即可達到 98%,並可在 10 分鐘 內完全反應,相對於100 mgL-1以上,AB1 染料仍無法完全降解,但效率 仍達82%。
Fig.4-3. Co2+/PMS 系統中,不同染料濃度之降解效率 (莫耳比 Co2+:PMS =0.05 M:0.04 M)。 (4) 化學需氧量COD 及生物需氧量 BOD 之去除效率 以Co2+/PMS 系統降解 AB1 染料,在 10 分鐘內即可達到完整去色,如 Fig .4-4,而 BOD 亦可達到 70 %之去除效率,在反應達 60 分鐘之後則可達 到80 %以上之去除效果(Fig.4-5)。
Fig.4-4. Co2+/PMS 系統中,AB1 染料之降解之 COD 分佈圖
(莫耳比 Co2+:PMS =0.05 M:0.04 M)。
Fig.4-5. Co2+/PMS 系統中,AB1 染料之降解之 BOD 分佈圖
4-1-2 Acid Blue1 之反應機構
本研究發現AB1 染料在使用 Co2+為催化劑及PMS 為氧化劑的系統中降解
速率非常快,在 10 分鐘染料即可達到明顯的去色效果,反應的速率亦會與
染料及氧化劑的濃度不同而有所差異。
AB1 染料溶液(AB1=50ppm, [PMS]/[Co2+]=4 ),經過 HPLC-PDA-ESI-MS
分析得到Fig.4-6 的層析圖分別紀錄於 635 nm、350 nm 和 300 nm 及 Fig.4-7 總離子層析圖,我們在50 分鐘的層析時間內成功找到 9 個中間產物,Table 4-1 顯示各中間產物之可能之化學結構。根據本實驗及文獻指出以下一系列 為AB1 染料在 Co2+/PMS 系統可能的氧化途徑(式(1)-(3))[32, 53-56]: Co2 + + HSO5 − or HSO4− → Co3 + + (HO− + SO4•− or SO3•−) or (HO• + SO42 •− or SO32 −) (1) Organic + HO• + SO 4•− or SO3•− → [radical intermediates(R•)] (2) 近十年來科學家廣泛研究亞硫酸氫根離子氧化降解的自氧化過程,包含以 下反應的過程均屬於游離基誘發的鏈反應,光和熱能及微量的金屬離子或過 氧化物加速此類反應的進行。 R• + (HSO
5− or HSO4 −)/O2 → organics → CO2 + H2O (3)
以下為可能的副反應及 Co2 +循環(式(14)-(16))。氧氣的分解促進了 PMS 活
可進一步分裂為其它的自由基中間產物(R•或ROO•)進而產生巨大有機物[55,
57]。
HSO5− or HSO4 − + (SO4•− or SO3•− or HO•)
→ SO5 •− or SO4 •− + (SO42 − or SO32 − or HO−) + H+ (4) Co3 + + HSO5− or HSO4 − → Co2 + + SO5•− or SO4•− + H+ (5) R• + O 2 → ROO• 3 Co oxygenated products → Co2 + + •OH (6)
Fig.4-6. AB1 染料(50 mgL-1)在 Co2+/PMS 系統降解的中間產物之 HPLC 層析 圖 (a)635 nm (b)350 nm (c)300 nm
(a)
(b)
Fig.4-7. AB1 染料(50 mgL-1)在 Co2+/PMS 系統降解的中間產物之總離子層析 圖。 Fig.4-7 顯示在總離子層析圖中編號 1-8 的位置,相對於其 HPLC 層析圖, 其並無任何紫外光吸收,表示其無雙鍵、極性又小,由此可判斷此可能為長 鏈結構的巨大有機分子。反觀滯留時間在編號19-20 位置的化合物,表示其 極性大;其質譜圖亦顯示斷裂碎片均為高分子量,且並無UV 吸收,判斷可 能為磺酸化烷烴類的中間產物(式 13);此化合物在 330 nm 有 UV 吸收,表 示其仍存在苯環結構,此可能為磺酸化芳香類的中間產物(式 14) RH + SO3 •− → R- SO3H 3 SO SO 3 SO 3 Sulfonation of alkyl intermediates (13) Ar-H + SO3•− 3 SO R- SO 3H
經過質譜分析結果,證實編號A 之化合物(m/z = 545.2)為原 AB1 染料分
子,其他化合物的荷質比和UV 吸收波長可見於 Table 4-1~4-2,經過這些數
Table 4-1 .50 mgL-1 AB1 染料,在 Co2+/PMS 系統降解的中間產物。
intermediates Reaction time
(min) [M + H+]/ [M-H+] (m/z)a Characteristic absorption (nm) 10 29.980 545.2/543.2 648.6,419.3,318.7 11 28.311 517.5/ 515.5 622.8,402.4,310.3 17 16.460 561.2 / 559.2 423.0,269.9 1 24.487 561.2 / 559.2 648.6,419.3,318.7 14 25.461 561.2 / 559.2 260.4 9 31.623 561.2 / 559.2 665.7,436.3,323.4 16 21.487 430.1 / 428.1 355.8 SO3 N HO H N N SO3 SO3 N NH SO3 SO3 H SO3H SO3H N N HO SO3H SO3H N N HO SO3H SO3H N NH OH SO3 SO3 N N OH
12 26.288 492.2 / 490.2 456.9 13 27.839 492.2 / 490.2 441.1,290.1 SO3H SO3H N OH SO3H SO3H N OH
Table 4-2. 50 mgL-1 AB1,在 Co2+/PMS 系統降解的中間產物之質譜圖與 UV 吸收圖。
MS spectrum UV absorption.
1
45.043 Peak 1 - W3100 1: MS Scan 1: 150.00-2000.00 ES+, Centroid, CV=30
182.3 312.6 381.6 426.7 498.8575.6 591.8 1304.71371.1 1397.0 1448.8 1533.7 1578.7 1712.9 1781.4 1954.3 In te n s ity 0.0 2.0x105 4.0x105 6.0x105 8.0x105 1.0x106 m/z 200.00 400.00 600.00 800.00 1000.00 1200.00 1400.00 1600.00 1800.00 2000.00 No UV absorption. 2
43.217 Peak 1 - W3100 1: MS Scan 1: 150.00-2000.00 ES+, Centroid, CV=30
570.5 571.7 682.0 959.7 1269.1 1432.91493.1 1509.4 1615.1 1628.6 1741.2 1754.8 In te n s it y 0 200000 400000 600000 800000 m/z 200.00 400.00 600.00 800.00 1000.00 1200.00 1400.00 1600.00 1800.00 2000.00 No UV absorption. 3
42.711 Peak 1 - W3100 1: MS Scan 1: 150.00-2000.00 ES+, Centroid, CV=30
227.3 371.2 426.6 570.7 576.7 1358.61414.8 1441.9 1463.0 1588.4 1659.5 1785.9 1852.2 1966.4 In te n s ity 0.0 2.0x105 4.0x105 6.0x105 8.0x105 1.0x106 m/z 200.00 400.00 600.00 800.00 1000.00 1200.00 1400.00 1600.00 1800.00 2000.00 No UV absorption. 4
42.530 Peak 1 - W3100 1: MS Scan 1: 150.00-2000.00 ES+, Centroid, CV=30
179.2 427.6 440.7 498.6 503.4576.7 681.9 1317.11396.8 1446.0 1462.31597.5 1657.5 1753.8 1791.9 1924.7 In te n s ity 0 200000 400000 600000 800000 m/z 200.00 400.00 600.00 800.00 1000.00 1200.00 1400.00 1600.00 1800.00 2000.00 No UV absorption.
5
41.001 Peak 1 - W3100 1: MS Scan 1: 150.00-2000.00 ES+, Centroid, CV=30
167.2 187.1 426.5 431.5575.3576.4 1242.4 1334.2 1368.5 1530.5 1558.3 1588.2 1636.2 1700.9 1779.71887.6 In te n s ity 0.0 5.0x105 1.0x106 m/z 200.00 400.00 600.00 800.00 1000.00 1200.00 1400.00 1600.00 1800.00 2000.00 No UV absorption. 6
40.201 Peak 1 - W3100 1: MS Scan 1: 150.00-2000.00 ES+, Centroid, CV=30 181.3 205.3 301.4 302.5 499.5 512.9 705.8 1151.91176.0 1340.7 1488.4 1529.8 1604.91697.8 1846.0 1860.4 1909.3 In te n s ity 0 100000 200000 300000 m/z 200.00 400.00 600.00 800.00 1000.00 1200.00 1400.00 1600.00 1800.00 2000.00 No UV absorption. 7
36.899 Peak 1 - W3100 2: MS Scan 2: 150.00-2000.00 ES-, Centroid, CV=30
217.3 255.4 329.7 375.9 480.2 555.7 663.9 702.8 759.4 990.1 1103.51119.7 1146.11166.5 1374.2 1532.9 1664.7 1685.5 1771.6 In te n s ity 0.0 20000.0 40000.0 60000.0 80000.0 100000.0 m/z 200.00 400.00 600.00 800.00 1000.00 1200.00 1400.00 1600.00 1800.00 2000.00 No UV absorption. 8
35.565 Peak 1 - W3100 2: MS Scan 2: 150.00-2000.00 ES-, Centroid, CV=30
217.1 227.2 292.3 391.8 481.5 646.1 671.5 726.5 869.4 980.3 1080.51156.3 1247.4 1280.6 1401.5 1423.61502.0 1662.01705.11860.3 1991.1 In te n s ity 0.0 20000.0 40000.0 60000.0 80000.0 m/z 200.00 400.00 600.00 800.00 1000.00 1200.00 1400.00 1600.00 1800.00 2000.00 No UV absorption.
9 665.7 nm 10 636.3 nm 11 439.9 nm 12 493.4 nm
13 452.0 nm 14 260.4 nm 15 648.6nm 16 355.8 nm
17 423.0 nm 18 252.1 nm 19 303.2 nm 20 330.6 nm
N SO3 N O3S 10 (AB1) N-deethylation OH N SO3 N SO3 OH 9 pathway Ⅰ N SO3 N H SO3 further degradation -CH3CHO OH N N OH O O O2 Cleavage of chromosphere structure N SO3 N O3S OH O3HS SO3 N O SO3 SO3 R1 R2 16 : R1 = OH , R2 = H 18 : R1 = H , R2 = OH OH pathway Ⅱ pathway Ⅲ N SO3 N SO3 HO N SO3 N SO3 HO attac k benz ene r ing further degradation mineralization products or 15 17 SO4 pathway Ⅳ N SO3 N SO3 SO3 Sulfated intermediates19 , 20 SO3 C2H5SO3H H × n Macromolecular organics 1-8 C2H5 +
4-2 實驗二:Bi
2WO
6光觸媒及降解三苯甲烷類染料的效率之
探討
本節重點為利用三種不同水熱合成方法,分別為 Autoclave 水熱法(AH)、微波水 熱法(MH)及傳統水熱法(CH)合成 Bi2WO6觸媒,並分別探討其材料特性及對將降解 效率之影響。Autoclave 水熱法係參考 Chen et al 於 2010 年之實驗結果,此三種合成 方法之前驅物皆使用 Bi(NO3)3.5H2O 及 H2WO4,合成之溶劑為乙二醇(Ethyleneglycol; EG) 和 D.I. water。詳細合成步驟請參閱 3-5-2。並將逐各探討其材料特性分 析,其中包括:掃描式電子顯微鏡分析(FE-SEM)、X 光能量散譜儀(EDS)、比表面 積(B.E.T surface area)、X 光粉膜繞射儀(XPRD)與化學分析電子光譜儀(ESCA)、傅 利葉紅外線光譜儀(FT-IR)等儀器分析觸媒的物理性質,並依特性對後續的光催化實 驗作個別探討之依據;光化學實驗係利用UV/Bi2O6光催化降解CV 染料並分離與鑑 定反應之中間產物,並比較不同合成方法所形成之 Bi2WO6對光降解 CV 染料之差 異。
4-2-1 材料特性分析
4-2-1-1 掃描式電子顯微鏡(FE-SEM)與 X 光能量散譜儀(EDS) 以傳統水熱法(CH)製備 Bi2WO6的詳細步驟列於3-5-2 節之(1),並以 FE-SEM-EDS 分析以本方法合成之樣品的表面特性,Fig.4-9~11 顯示依反應時間之不同分別為 24 小時、48 小時及 72 小時之 FE-SEM-EDS 影像,放大倍率為三萬倍、五萬倍及十萬倍。由圖中觀測到 Bi2WO6光觸媒外觀呈現周圍不規則大小的粉狀顆粒結構,平
均顆粒大小約9 在 80-200 nm 左右,厚度約為 40 nm,這種結構鬆散並且分佈較不
均勻,可能由於合成起始物之濃度較低(Bi(NO3)3.5H2O 0.17 mmol 及 H2WO4 4.0
mmol),由 EDS 更可進一步確認此合成物主要由 W、Bi、O、C 化學元素所組成如 Table 4-4,顯示 Bi/W 原子比例為 9.56-12.8,多餘的 C 及 O 元素可能來自於有機物 的污染[59]。
3 Fig.4-9. Bi2WO6 (CH 24)之 FE-SEM-EDS 影像
Fig.4-10. Bi2WO6 (CH 48)之 FE-SEM-EDS 影像
Fig.4-11. Bi2WO6 (CH 72)之 FE-SEM-EDS 影像
而以微波水熱方法(MH)合成之樣品依反應時間之不同分別為 0.25 小時、0.5 小 時、1 小時及 1.5 小時(實驗步驟詳於 3-5-2 節之(2))。 Fig.4-12 顯示以微波水熱法反應 0.25 小時合成之 Bi2WO6,其 FE-SEM-EDS 影 像,其平均顆粒大小約為25-40 nm,並呈現六角形的片狀結構,並且有團聚的現象; 而反應0.5 小時合成之 Bi2WO6其 FE-SEM-EDS 影像(Fig.4-13)即呈四方平板狀 (square-plate)結構,平均顆粒大小為約 25-40 nm。隨著反應時間的增加到 1 至 1.5 小時(Fig.4-14~15),結構即由四方平板狀轉變為薄片類似花瓣狀的結構,每個薄片 狀的厚度約在15 nm 左右,但在反應時間 1 小時時夾雜片狀結構並且分佈不均勻, 反應時間達1.5 小時,薄片類似花瓣狀的結構更加顯著並且分佈狀況較為均勻。推 測可能由於在反應物水溶液的水熱反應在高溫高壓的條件下,溶質的溶解度提高, 並增加了系統的溶解度及反應係數,易產生呈現介穩態 (metastable state)的氧化 物。Fig.4-16 為模擬 Bi2WO6多晶的flake-ball 粒子生成的過程的示意圖,顯示 Bi2WO6 晶體形成是一個典型的Ostwald 水熱熟化過程。即在過飽和的條下由超細的無定型 粒子做為前趨物,然後水熱晶化生長[60]。Table 4-4 確認此合成物主要亦由 W、Bi、 O、C 化學元素所組成,並依此計算 Bi2WO6之Bi /W 的原子比例, MH 0.25 、MH 1 及 MH 1.5 則在 2.86-4.98m。
Fig.4-13. Bi WO (MH 0.5 )之 FE-SEM-EDS 影像
Fig.4-14. Bi2WO6 (MH 1)之 FE-SEM-EDS 影像
Fig.4-16. Bi2WO6之生成過程圖。
以Autoclave 水熱法(AH)合成之 Bi2WO6樣品不論在顆粒大小或是結合的形態都大
不相同,其含有奈米板狀(nanoplates)、薄片狀(nanosheets)以及由數百個厚度約 5-10 nm 之側向大小所堆疊而成的薄片花瓣狀結構(sheet-like flower shape)。Fig.4-18 顯示
合成反應時間達48 小時可發現不規則形狀大小的薄片狀結構逐漸晶體團聚的現 象;在72 小時(Fig.4-19)則顯示片狀進一步組成類似花瓣狀的結構,厚度約為 5-10 nm,而每個層狀結果亦是由無數個結構完整的奈米四方平板相互疊加,每個薄片之 平均顆粒大小為約10-40 nm,厚度約在 5-10 nm 符合奈米級尺寸。Wang et al 亦曾發 表關於由薄片聚集合成的層次結構的Bi2WO6之研究[60, 61],Amano 團隊亦曾發表 薄片花瓣狀結構之Bi2WO6其相關研究[45]。薄片花瓣狀是經由四方平板因循晶體平 面選擇性生長而聚集而來,添加劑之選擇性吸附在特定的位置上導致的各向異性晶 體生長並抑制各同向性晶體的生長,強鹼溶液及過量的Bi 前驅物及乙二醇為形成薄 片花瓣狀的必要條件,並可能導致低結晶性的Bi2WO6 晶核呈現各向異性生長。而 AH 24 樣品(Fig.4-17)的結晶性較差可能由於合成起始物之濃度較低(Bi(NO3)3.5H2O
0.17 mmol 及 H2WO4 4.0 mmol),而反應達 48 小時,許多奈米薄片結晶逐漸生成並
產生團聚的Ostwald 水熱熟化過程,根據 Gibbs-Thomson effect,因其高溶解度及再
度形成較大顆粒而會致使較小之顆粒消失,隨反應時間增加至96 小時,結晶性亦
往上遞增,此時因過飽和而限制晶體生長使呈現多面體的單晶薄片。而以 EDS 測量
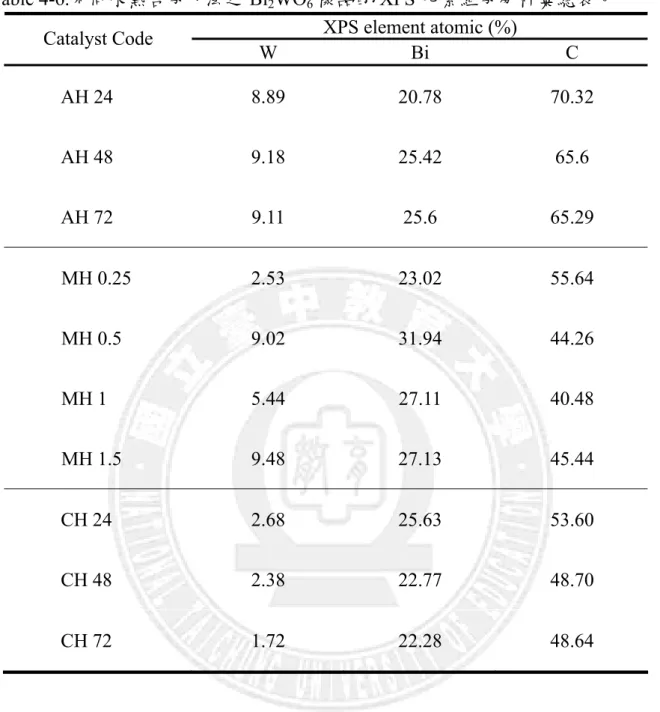
Bi2WO6光觸媒化學組成,如Table 4-3,確認 AH 系列之樣品主要均由 W、Bi、O、
C 化學元素所組成,計算 Bi2WO6的製備中調整 Bi/W 的原子比例,AH 為 2.23 - 2.81
Table 4-3.不同水熱合成方法之 Bi2WO6樣品的EDS 元素組成分析彙總表。
EDS element atomic (atomic %) Catalyst Code W Bi O/C AH 24 1.62 11.17 87.22 AH 48 4.08 9.63 86.29 AH 72 4.23 9.43 86.34 MH 0.25 5.07 11.69 83.24 MH 0.5 6.11 15.14 78.75 MH 1 0.85 16.29 82.86 MH 1.5 5.07 11.69 83.24 CH 24 0.30 13.9 85.8 CH 48 0.18 12.25 87.57 CH 72 0.35 8.03 91.62
4-2-1-2 比表面積(B.E.T surface area) BET 係利用氮氣吸附脫附,氣體在材料中飽和的量來計算其比表面積與孔隙體 積。Table 4-4 顯示傳統水熱法之樣品 CH 24 為 3.3711 m2/g、CH 48 為 1.3999 m2/g 及CH 72 (4.0970 m2/g) ;以微波水熱法合成之樣品的比表面積 MH 0.25 ( 14.1823 m2/g)、MH 0.5 ( 12.5650 m2/g)、MH 1 ( 32.1023 m2/g)及 MH 1.5 ( 23.2437 m2/g);而 AH 24、AH 48 及 AH 78 之比表面積分別為 50.1481m2/g、35.1687m2/g 和 34.9436 m2/g。 結果可證明利用Autoclave 水熱合成方法可製備出顆粒細小並具有比表面積較大 的Bi2WO6奈米晶體,比表面積增加,表面的反應面積相對增大,則會影響反應速 率。
Table 4-4.不同水熱合成方法之 Bi2WO6樣品的比表面積與孔隙率彙總表。
LCatalyst Code Specific surface Area (m2/g) Pore Volume (cm3/g)
AH 24 50.1481 11.4803 AH 48 35.1687 12.3079 AH 72 34.9436 12.4111 MH 0.25 14.1823 9.7572 MH 0.5 12.5650 10.7491 MH 1 32.1023 11.5577 MH 1.5 23.2437 11.5626 CH 24 3.3711 9.3385 CH 48 1.3999 16.2375 CH 72 4.0970 6.1578
4-2-1-3 粉末 X 光繞射儀分析(XRPD)
以 X 光粉末繞射儀分析儀(XRPD)測得表面晶體形態及純度,XRD 繞射
圖譜如 Fig.4-20(a)-(c),經粉末繞射資料庫(JCPDS card No.79-2381)的比對,顯示
在 2θ 等於 28.3°,32.7°,47.1°,55.8°,58.5°,68.7°,75.9°及 78.3°附近出現 繞射峰,這些繞射峰分別歸類為(1 3 1),(0 0 2),(2 0 2),(1 3 3),(2 6 2), (0 0 4),(3 9 1)和(2 0 4)平面層狀晶體的晶面繞射,利用傳統水熱法反應時間 在 48 小時和 72 小時之 Bi2WO6樣品具有類似的特徵峰,強度並隨反應時間增長 而增加,顯示結晶度趨於成熟,如 Fig.4-20 (a);Fig.4-20 (b)顯示 MH 0.5、 MH 1 及 MH 1.5 亦於上述位置出現相同繞射峰,MH 0.5 和 MH 1 之 Bi2WO6 具有類似的特徵峰及強度,但反應時間增長至1.5 小時,繞射峰的強度即減弱, 但仍保持一定的結晶性,推測可能為 Bi2WO6結晶狀態改變的臨界狀態,與 SEM 結果相吻合。以 Autoclave 水熱法在 48 及 72 小時之下亦可以合成出具相同 特徵峰且良好結晶性之Bi2WO6。 Fig.4-20 (a)中之 CH 24 樣品之特徵峰明顯有別於樣品 CH48 和 CH72,在 2θ 等 於 23.9°,25.6°,28.3°,31.5°,31.8°,33.3°,34.7°,39.6°,41.3°,45.6°, 46.4°,47.7°,54.7°,56.5°,58.4°,69.9 及 76.9°附近出現繞射峰,推測其可 能為Bi2O3 (JCPDS card no. 89-6666)與 Bi14WO24 (JCPDS card no. 76-0147)之混和晶
相,而並與以EDS 測得之 W/Bi 原子比例 0.04-0.021,即與化學劑量比(W : Bi = 1:14)
相符。另一方面,以EDS 測得 AH 24 樣品之 Bi/W 原子比例為 6.90,在 XRD 圖譜
79-2381) 及 Bi2WO6所組成。而MH 0.25 之 XRD 圖譜僅於 2θ 等於 25.3 處出現單
(a)
(c)
Fig.4-20.不同水熱時間合成的 Bi2WO6之XRD 圖譜 (a) 傳統水熱
4-2-1-4 X 光光電子能譜儀(HRXPS) 本研究係以X 光光電子能譜儀(HRXPS)來分析 Bi2WO6表面元素的化學鍵 結情形,以探討不同合成方法之Bi2WO6的差異。傳統水熱法合成之CH 系 列樣品之全譜圖如Fig.4-21 即顯示 Bi2WO6樣品的Bi 4f ,W 4f ,O 1s 的鍵 結能量(binding energy;BE),在 BE (W 4f5/2)=37.3 eV 及 BE (W 4f7/2)=35.1 eV 係來自於W6+ 氧化態。在BE 為 159.0 eV 處則顯示 Bi 的三價氧化態的特性 峰,而在Bi2WO6皆可發現在BE (Bi 4f7/2)=156.4 eV 處出現另一自旋軌域的 雙吸收峯。推測此可能為部份的Bi 存在(+3-x)的價態導致,由 Fig.4-21 (c) 顯示本合成方法之Bi2WO6樣品中以Bi3+ 之特性吸收峰的強度較Bi (+3-x)高, 表示層狀結構並不明顯,而與FE-SEM 影像正呈現此系列之 Bi2WO6樣品皆 呈現周圍不規則大小的粉狀顆粒結構,結構鬆散並且分佈較不均勻。文獻曾 指出反應中使用的乙二醇(Ethylene glycol)除了被用來當作反應的溶劑之 外,亦為此反應的還原劑。
(a)
(c)
(d)
Fig.4-21.不同水熱時間合成的 Bi2WO6 (CH)之 XPS 圖譜(a)Total survey
檢視Fig.4-22 (b),W6+ 氧化態之特性峰出現於BE (W 4f5/2)=37.3 eV 及 BE (W 4f7/2)=35.1 eV,BE 於 28 eV 處則為 O 2s 的吸收峰。Fig.4-22 (c) 顯示微 波反應0.25 小時,Bi3+的特性峰明顯高於Bi(+3-x)之吸收峰,而反應時間延長 至0.5 小時至 1.5 小時,則以 Bi(+3-x) 為主,顯示此時 Bi 存在的化學環境多 為Bi2O2 layer 的層狀結構,由 SEM 圖亦可觀察到由四方平板狀轉變為薄片 層狀堆疊類似花瓣狀的結構。Fig.4-22 (d)顯示 O1s 的區帶由兩種化學組態組
成,即metal-O(530.2 eV)及 metal-OH(531.0 eV)[38]。
以微波水熱合成之Bi2WO6樣品其XPS 之 Bi 4f 圖譜可觀察到 Bi(+3-x)之特
性吸收峰強度隨時間遞增,晶體生長並朝層狀結構發展至堆疊成花瓣狀,微
(a)
(b)
(c)
(d)
(a)