國立宜蘭大學生物機電工程學系 碩士論文
Department of Biomechatronic Engineering National Ilan University
Master Thesis
應用聚乳酸/聚甘醇酸共聚物薄膜控制秋水仙素與 太平洋紫杉醇釋放速率之研究
Controlled Release of Colchicine and Paclitaxel From Poly(Lactide-co-Glycolide) Films
指導教授:楊屹沛博士
Yih-Pey Yang, Ph. D.
研究生:歐哲宇 Che-Yu Ou
中華民國九十七年六月
致 謝
本論文承蒙恩師楊屹沛教授的細心指導,得以順利完成。在研究所期 間,恩師細心教導、不時的討論並指點我正確的研究方向和謙和的待人處 事態度,使我受益良多,僅致上無限的感激之意。
感謝陽明大學蔡瑞瑩老師在論文研究上給予許多寶貴意見與幫助,同 時感謝許多系上師長兩年來的指導,吳剛智系主任,程安邦老師、蔡孟利 老師、邱奕志學務長,因為有您們的指導及幫忙,使得本論文能夠更完整 而嚴謹。
在研究所兩年多個日子裡,特別感謝嘉琦、美湘學姐們不厭其煩地指 出我研究中的缺失,且總能在我迷惘時為我解惑。實驗室的鍵寬、敬暉、
書宏學弟們,詩螢、彥之、佩萱學妹們當然也不能忘記,你/妳們的幫忙我 銘感在心。以及感謝我的好朋友沛家、奕捷、義龍、俊雄、建嘉同學、慕 德與聖傑學弟、雅慧學妹在課業與精神上的支持。
最後要感謝從小就栽培我的奶奶、父母、妹妹宜蓁、弟弟展毓與女友 韋華有他們的支持與鼓勵,特別是已經在天上的爺爺默默支持我,才讓我 得以專心完成學業。另外還有很多曾經幫助過我的朋友,因為有大家的幫 助,我才能有今天的成果。
摘要
本研究係以不同共聚比與不同分子量之 PLGA 高分子包覆親疏水性 藥物,製備藥物控制釋放系統之薄膜,探討其體外控制釋放速率。實驗使 用 HPLC 檢測自高分子薄膜釋放至 PBS 緩衝液之藥物含量。結果顯示,
在包覆不同親疏水性的藥物時,親水性藥物秋水仙素的釋放量遠高於疏水 性藥物太平洋紫杉醇。在 53 天的藥物控制釋放中,不同共聚比高分子薄 膜的控制釋放趨勢不同,但也都呈現爆發釋放期與兩個不同釋放速率階段。
而親水性 PGA 含量越高,越容易水解,使藥物連同高分子降解行為釋放 出來,因此在第一階段快速釋放期,PLGA 50:50 薄膜的藥物釋放皆大於 PLGA 75:25 薄膜。不同分子量也會造成藥物釋放速率的不同,分子量低的 高分子薄膜降解速率較分子量高的快,所以藥物釋放速率也較高。
Abstract
In vitro release of hydrophilic colchicine and hydrophobic paclitaxel from biodegradable poly(lactide-co-glycolide) (PLGA) copolymer films were studied by applying the high-performance liquid chromatography. The results showed that the release rates of hydrophilic colchicine from various PLGA films are faster than the release rates of hydrophobic paclitaxel. The release profiles within 53 days exhibited two kinds as a consequence of two molar ratio copolymers, PLGA 50:50 and PLGA 75:25. All these profiles contain a burst release and two-stage release involving the faster and slower release rates. In the first stage, prior to day 25, the releases of colchicine and paclitaxel from PLGA 50:50 were more than PLGA 75:25 since the hydrophilic PGA content is higher in PLGA 50:50 films. Moreover, the lower molecular weight polymer degraded rapidly will facilitate the release rates of colchicine and paclitaxel.
目 錄
致謝 ... Ⅰ 摘要 ... Ⅱ Abstract ... Ⅲ 目錄 ... Ⅳ 圖目錄 ... Ⅶ 表目錄 ... Ⅷ
第一章 緒論 ... 1
前言 ... 1
第一節 簡介 ... 2
第二節 聚乳酸 ... 5
第三節 聚甘醇酸 ... 8
第四節 聚乳酸/聚甘醇酸共聚物 ... 9
第五節 秋水仙素 ... 12
第六節 太平洋紫杉醇 ... 14
第七節 研究目的 ... 17
第二章 實驗材料與實驗儀器
... 18第一節 實驗藥品與器材 ... 18
第二節 實驗儀器 ... 20
第三章 實驗方法
... 23第一節 藥物定量分析 ... 23
第二節 製備含藥物高分子薄膜 ... 23
第三節 含藥高分子薄膜的降解 ... 24
第四節 藥物包覆率計算 ... 25
3.4.1 含藥高分子薄膜的製備藥量 ... 25
3.4.2 包覆於高分子薄膜中的藥物總含量 ... 26
3.4.3 藥物平均包覆率 ... 26
第四章 結果與討論
... 29第一節 Colchicine 於 PLGA 薄膜之控制釋放分析 ... 29
4.1.1 Colchicine 之迴歸分析 ... 29
4.1.2 含 Colchicine 高分子薄膜的降解 ... 29
第二節 Paclitaxel 於 PLGA 薄膜之控制釋放分析 ... 39
4.2.1 Paclitaxel 之迴歸分析 ... 39
4.2.2 含 Paclitaxel 高分子薄膜的降解 ... 39
第五章 結論
... 47參考文獻
... 48附錄一
... 56附錄二
... 58圖目錄
圖 1-1. PLA 之開環聚合反應式 ... 5
圖 1-2. PGA 之開環聚合反應式 ... 8
圖 1-3. PLGA 高分子之結構式 ... 9
圖 1-4. 秋水仙素之結構式 ... 12
圖 1-5. Paclitaxel 之結構式 ... 15
圖 4-1. 含 Colchicine 高分子薄膜之平均釋放速率圖 ... 30
圖 4-2. 含 Colchicine PLGA 75:25 高分子薄膜之平均釋放速率圖 ... 31
圖 4-3. 含 Colchicine PLGA 50: 50 高分子薄膜之平均釋放速率圖 ... 32
圖 4-4. 含 Colchicine 高分子薄膜之平均釋放速率圖(y 軸取對數) ... 34
圖 4-5. 含 Colchicine 高分子薄膜之累積釋放率圖 ... 35
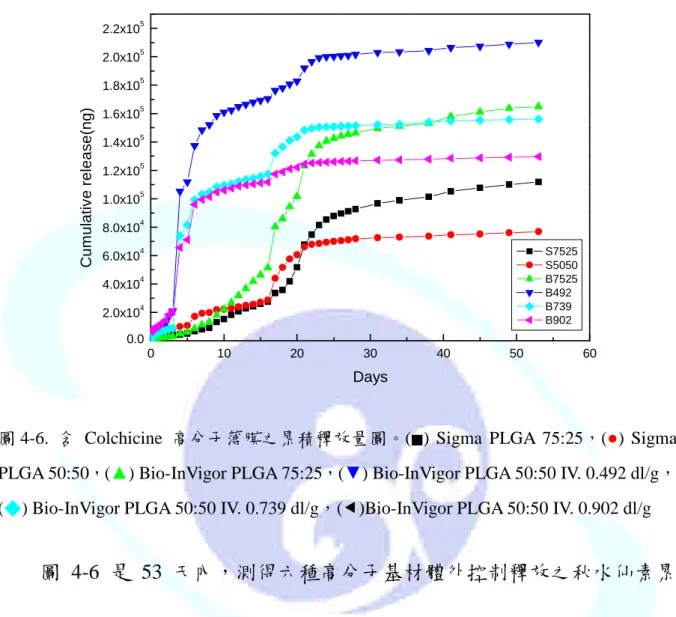
圖 4-6. 含 Colchicine 高分子薄膜之累積釋放量圖 ... 37
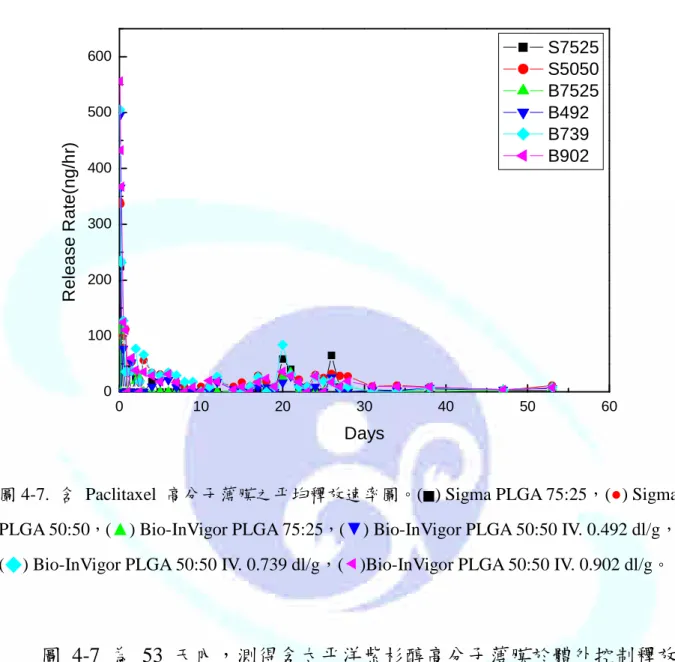
圖 4-7. 含 Paclitaxel 高分子薄膜之平均釋放速率圖 ... 40
圖 4-8. 含 Paclitaxel PLGA 75:25 高分子薄膜之平均釋放速率圖 ... 41
圖 4-9. 含 Paclitaxel PLGA 50: 50 高分子薄膜之平均釋放速率圖 ... 42
圖 4-10. 含 Paclitaxel 高分子薄膜之累積釋放率圖 ... 43
圖 4-11. 含 Paclitaxel 高分子薄膜之累積釋放量圖 ... 45
表目錄
表 3-1. 含 Colchicine 高分子薄膜之包覆率 ... 27 表 3-2. 含 Paclitaxel 高分子薄膜之包覆率 ... 28
第一章 緒 論
前言
生物可降解性 (Biodegradable) 材料已經廣泛使用於藥物控制釋放與 延長藥效之研究。所謂控制釋放是利用基材 (通常是高分子物質) 裝載藥 物於生理環境中以預定之速率釋放,這樣的給藥方式可以達到適時、適地、
適量的目標,增強局部療效,並降低全身性副作用的發生。控制釋放系統 的設計可為微膠囊 (Microcapsules)、微粒 (Microspheres)、薄膜 (Film)、薄 片 (Wafer)、植入物 (Implant) 等各類形式。以血管支架為例,為了要抑制 血管內膜過度增生,目前有許多研究都朝向發展新型的藥物釋放型血管支 架 (Drug-eluting stent)。藥物釋放型血管支架就是將藥物、高分子與血管支 架搭配使用,讓具有抑制內膜增生的藥物經由高分子包覆塗佈在支架上,
在血管狹窄處持續釋放,使其有效地降低經血管擴張手術後再狹窄的發生 率。(Nakayama et al., 2001)
秋水仙素 (Colchicine) 與太平洋紫杉醇 (Paclitaxel) 經研究證實均有 抑制細胞分裂增生的功效,同樣作用於細胞微管系統上,只是作用機制不 同,目前均有許多研究將其應用在對抗癌症與抑制血管內膜增生的用途上。
秋水仙素為親水性藥物,而太平洋紫杉醇為疏水性,因此,本研究希望藉 由分析兩者由聚乳酸/聚甘醇酸共聚物 (Poly(lactide-co-glycolides), PLGA)
薄膜釋放出來的快慢,瞭解藥物與高分子基材間的作用關係在藥物控制釋 放系統中所扮演的角色。
第一節 簡介
在生物科技的研究發展中,藥物輸送是一個很重要的研究主題,在藥 物控制釋放的研究領域中,又以藥物控制釋放載體是被視為最有潛力發展 的醫藥產品之一。藥物控制釋放技術具有下列幾項優點:(1)可以免除多次 外科手術,(2)藥效可以維持一段特定的時間,(3)藥效穩定,不會產生毒害 或是無法達到藥效的問題。
近年來又以可降解性高分子最被重視。因為生物可分解的高分子材料 可被人體吸收,並且可免除將藥物釋放裝置從人體內取出的外科手術,故 被廣泛應用於生物醫學技術和醫學治療上,例如藥物輸送系統 (Heller, 1984)、外科手術使用之可吸收線材 (Chu, 1985)、血管支架 (Agrawal et al., 1992) 和組織重生的植入物 (Cima et al., 1991)、癌症的局部治療 (Brem et al., 1993)、疫苗的開發 (Alonso et al., 1993) 等。
在過去三、四十年裡,許多生物能分解的天然和人工合成高分子材料 已經廣泛地應用於生物醫學的研究領域中,由於人工合成的高分子製造上
很方便且純度高,因此近代生化科技逐漸以人工合成之生物能分解的高分 子材料應用於藥物控制釋放的研究。利用於侵蝕釋放 (Erosion release) 系統 的 高 分 子 , 即 為 可 降 解 性 高 分 子 , 這 類 高 分 子 物 質 通 常 具 有 可 水 解 (Hydrolysis) 之鍵結,如酯基、醯胺基、尿素基等。所有高分子都會降解,
以降解發生所需時間之長短可區分為長時間才會降解之「非降解性高分子 (Non-degradable polymer)」與短時間內可降解之「降解性高分子 (Degradable polymer)」。高分子降解可由諸多形式促成,如:光裂解、熱裂解、機械性 裂解、化學性裂解等 (Gopferich, 1997)。所謂生物可降解性高分子,則是可 在生物體內經由水解或由生物環境中的因子如鹽離子、酵素等催化水解。
許多學者曾針對高分子「降解 (Degradation)」和「侵蝕 (Erosion)」提出不 同定義,一般而言,「降解」指的是高分子骨幹鍵結被切斷形成寡聚物 (Oligomer),經一連串水解斷鍵最後產生單體 (Monomer) 的連續過程,而
「侵蝕」是指經由高分子斷裂成之寡聚物或單體被釋出而致原高分子減少 質量之結果 (Tamada and Langer, 1993)。高分子在生物體內降解的過程包含 三步驟:一開始水滲入高分子主體,也可能伴隨發生高分子膨脹的現象,
接著高分子水解產生寡聚體或單體等水溶性產物,進而使高分子微結構改 變並形成許多孔洞使產物分子釋放至周遭環境中以致高分子質量減少 (Mathiowitz et al., 1993)。尤其是聚酯類高分子,其水解是一種自我催化 (Autocatalysis) 的降解機制,由於其降解產物造成高分子主體內部 pH 值改
變而調控了降解的速率 (Li and McCarthy, 1999)。一些可降解性高分子其組 成 成 分 為 生 物 體 內 可 自 然 代 謝 之 分 子 如 乳 酸 (Lactic acid) 和 甘 醇 酸 (Glycolic acid) 等,故以此高分子之各種植入物的形式置於生物體內,可藉 由其在生物體內的降解並依體內自然代謝機制排出體外,而不致造成體內 代謝上的障礙 (Vert et al., 1981),因此這些高分子一般具有良好之生物相容 性,也省去植入後再經外科手術取出之麻煩。
目前使用最廣泛的生醫高分子基材主要為脂肪族聚酯類,如聚乳酸 (Poly(lactic acid), PLA),聚甘醇酸 (Poly(glycolic acid), PGA),與其聚乳酸/
聚甘醇酸共聚物 (PLGA),因其具有高度的生物相容性,良好的力學性質,
也是生物可降解性的高分子之一,而且容易加工成各種形狀,主要降解機 制均是侵蝕釋放。
第二節 聚乳酸
聚乳酸 Polylactic acid 或 Polylactide (PLA) 為生物可降解高分子之其 中一種,屬於合成直鏈脂肪族聚酯。早期的聚乳酸其實是分子量只有數千 的寡聚合物,一直到 1966 年 Kulkarni 將 L 型聚乳酸運用在骨頭組織的 修復上(骨板和骨螺絲),之後聚乳酸便常應用在外科臨床與生物醫學的領域 上,而現在也常廣泛應用於一些常見的物品,如:包裝袋、紡織纖維。聚 乳酸是由乳酸為單體經縮合聚合反應或熱催化開環聚合而成之高分子,其 反應式如圖 1-1,為具有生物可降解、熱塑性之脂肪族聚酯類聚合物。若是 直接縮合聚合反應的聚乳酸其分子量較低 (MW < 20000),但是用在於生醫 材料的高分子通常需要較高的分子量 (MW < 40000),所以目前聚乳酸大部 分都採用開環聚合反應來製造 (Kricheldorf and Serra, 1985)。
圖 1-1. PLA 之開環聚合反應式。
雖然聚乳酸是可以完全分解的高分子聚合物,但在一般的大氣環境中 並不會進行快速分解,只有在下列的幾種環境下才會進行快速的分解反應:
(1) 充足的水氣 (相對濕度90%以上)。(2) 適當的溫度 (58~70℃)。(3) 充足 的氧氣 (非密閉環境中)。聚乳酸水解的特性會受到構形 (Conformation) 的 影響,也會受到分子量的大小及分佈所影響。聚乳酸具有四種不同的構形,
根據製程大致可分為 L 型聚乳酸、D 型聚乳酸、外消旋 DL 型聚乳酸及 內消旋 meso 型聚乳酸。前兩種聚乳酸具有高規則性的分子鏈,故較容易 出現結晶排列,是半結晶性 (Semicrystalline) 的聚合物;後兩者因具有不規 則排列的分子鏈,所以是呈現無定形 (Amorphous) 的聚合物,為了要使藥 物能較均勻分布於高分子材料中,DL 及 meso 型聚乳酸會較適合用於藥 物控制釋放的選擇。已有許多學者進行此高分子降解特性之研究 (Vert et al., 1991; Therin et al., 1992; Grizzi et al., 1995),也因此常被用為藥物控制釋 放系統的基材。PLA 在 37℃、pH=7.4 的環境中之降解機制為:一開始位 於表面水溶性的寡聚體產物先行擴散並溶於介質中,而降解後表面形成之 羧基 (Carboxylic end group) 則被緩衝液中和,最後結果是表面降解慢於內 部降解 (Li and McCarthy, 1999)。相對於其他可降解性高分子,PLA 的降解 速率較慢,尤其在 PLA 分子量極大時要降解並不容易,必須在 15000 g/mol 以下才會有明顯的降解發生 (Pitt et al., 1981),此時高分子的滲透性 和親水性也隨之增加 (Lamprecht et al., 2000)。由於其為聚酯化合物易受酸 或鹼催化水解,故酸性藥物包埋於此基材會增強酯鍵水解而加速其降解速 率 (Vert et al., 1991; Tarvainen et al., 2006);而鹼性藥物包埋於此基材中,
則可能因為鹼催化酯鍵水解而加速降解 (Maulding et al., 1986; Tarvainen et al., 2006),也可能因為鹼中和了高分子末端的羧酸根而抑制降解 (Bodmeier and Chen, 1989; Mauduit et al., 1993);至於中性藥物,親水性藥物增強其 降解,而疏水性藥物則抑制其降解 (Vert et al., 1991)。沒有添加塑化劑的 PLA 薄膜 (MW 250000) 其玻璃轉移溫度 (Glass transition temperature) Tg 為 43.5℃,低於此溫度時高分子是玻璃相,不具彈性不易延展,抗壓性 亦差 (Kranz et al., 2000),若要以此高分子為基材做為生物體植入物則可能 不夠柔軟適用。
第三節 聚甘醇酸
聚甘醇酸 Polyglycolide 或 Polyglycolic acid (PGA) 是一個簡單的線 性聚酯類高分子,是由甘醇酸為單體經熱催化開環聚合而成,其反應式如 圖 1-2,也是生物可降解、熱塑性之脂肪族聚酯聚合物,其熔點約在 224~227
℃,玻璃轉移溫度 Tg 為 37℃ 左右。
圖 1-2. PGA 之開環聚合反應式。
聚甘醇酸本身為結晶構造,具有優良的生物相容性、生物可分解性、
適當的材料物化性質和難溶於有機溶劑的特性。在 1970 年代聚甘醇酸便 製備成可吸收手術縫線運用在醫療方面,主要是減低手術縫線的機械性質,
使縫線在植入人體 2~4 周便產生降解。不過,因為可溶解 PGA 的溶劑有 限,少有單獨以此高分子做為控制釋放基材,但可將之與它種高分子共聚 以改變其降解釋放特性,如 PLGA。
第四節 聚乳酸/聚甘醇酸共聚物
PLGA 是常被用來做為控制釋放基材的高分子 (Brannon-Peppas, 1995;
Athanasiou et al., 1996),它是由乳酸和甘醇酸兩種單體經由不規則的開環 加成反應形成之共聚聚合物,其結構如下圖 1-3。
圖 1-3. PLGA 高分子之結構式。
PLGA 的降解機制也是經由酯鍵的水解,釋放出的單體為乳酸和甘醇 酸,具有生物可降解性及生物相容性 (Biocompatibility),在生物體中水解 的速率是由乳酸與甘醇酸的共聚比、分子量、結晶性以及環境如 pH 值、
酵素和溫度等所影響。PLGA 的物理化學性質並不是與乳酸與甘醇酸的比 例呈線性等比關係,PGA 具有高度結晶性,但是與 PLA 共聚後,其結晶 性卻會大幅下降。PLGA 高分子之 Tg 值同 PLA 會隨分子量減少而降低,
甚至會隨乳酸比例下降而降低 (Engelberg and Kohn, 1991; Omelczuk and McGinity, 1992),推測 PLA 是較為疏水性 (Hydrophobic) 之分子,而 PGA 較為親水 (Hydrophilic),所以共聚成之 PLGA 若甘醇酸含量提高則親水性 較明顯,降解速率也快於 PLA (Kranz et al., 2000)。用於控制釋放系統之 PLGA 可藉由其乳酸和甘醇酸的比例調整其物理特性,再者其與分子量同
為影響降解速率之重要因子,故可同時調控藥物釋放之速率 (Park, 1994)。
並非每一種高分子物質或藥物都可設計成理想的藥物控制釋放系統,亦即 無法達成穩定的零級 (Zero-order kinetics) 釋放速率,因此在設計藥物控制 釋放系統時必須考量高分子本身特性及影響其降解的諸多因素。
諸多影響控制釋放系統高分子降解速率及藥物釋放速率的因素如下:(1) 鍵 的 種 類 : 高 分 子 骨 幹 (Backbone) 上 鍵 結 的 形 式 決 定 水 解 的 速 率 (Gopferich, 1996)。(2) pH 值:pH 值的改變會催化高分子水解,特別是以 酯鍵聚合而成之高分子,可經由酸或鹼催化分解 (Gopferich, 1996)。(3) 溫 度:在高於高分子玻璃轉移溫度 Tg 值之上的溫度下,其降解速率也會增 加 (Li and McCarthy, 1999)。(4) 高分子共聚物的組成成分:共聚高分子物 質因其共聚比例之不同 ,可能有不同的物理性質如玻璃轉移溫度 Tg (Gopferich, 1996) 或 親 疏 水 性 程 度 不 同 , 因 而 也 造 成 降 解 速 率 之 差 異 (Wang et al., 2004)。(5) 高分子的親水性程度:愈是親水性高分子在含水的 環境中攝水量較多,也提升高分子的降解速率 (Ron et al., 1993)。(6) 高分 子的分子量:在許多研究中指出,高分子分子量減少時,攝水量增加更加 速高分子的降解。(7) 高分子系統的形狀及大小:高分子被設計成不同的植 入物形狀如薄膜或是微粒其降解速率也呈現不同結果 (Witt and Kissel, 2001)。(8) 藥物融入高分子的濃度:藥物比例愈高,Burst effect 的量愈多 (Wang et al., 2004)。(9) 包埋的藥物或物質和高分子間之交互作用力:藥物
的親疏水性、酸鹼性、極性等,和選用的高分子是否產生強的交互作用,
在降解過程是否會破壞藥物活性,若是包埋蛋白質類的物質時更須注意在 降解過程中是否因此造成蛋白質變性 (Denaturation)、凝結 (Aggregation) 或降解等。
綜合許多以可降解性高分子為基材的控制釋放研究報告,諸如高分子 的組成成分、高分子微結構、分子量、親疏水性、共聚物的單體比例和單 體在聚合時的排列方式、高分子和藥物的交互作用、pH 值、鹽的濃度、製 成的植入物形狀、植入之部位、高分子吸附環境中的物質如水、脂質、離 子的特性,和高分子因水或酵素催化降解之機制等因素都會影響藥物自高 分子中釋放的速率 (Hutchinson and Furr, 1990; Bayomi, 1994;Miyajima et al., 1998; Sung et al., 1998; Li and McCarthy, 1999; Rothen-Weinhold et al., 1999; Vogelhuger et al., 2001; Witt and Kissel, 2001; Tarvainen et al., 2006),
此外,研究也顯示控制釋放系統添加的藥量也會左右釋放的速率 (Tarvainen et al., 2006)。因此利用適合於生理條件下適度降解以達藥物穩定釋放速率之 高分子,將可成為藥物輸送之良好媒介。
第五節 秋水仙素
秋 水 仙 素 (Colchicine ; N–[(7S) –5,6,7,9, –tetrahydro –1,2,3,10 – tetramethoxy –9–oxobenzo [a] heptalen–7–yl]acetamide) 是一種取自秋水仙 (Colchicum autumnale) 等 百 合 科 植 物 (Liliaceae) 球 莖 或 種 子 的 生 物 鹼 (Alkaloids),外觀為淡黃色針狀結晶,食用進入體內經由肝、腎代謝,具有 毒性,攝入過量會引起發燒、噁心、嘔吐、呼吸困難、血尿、腹瀉、腹痛,
更嚴重時則會引發多重器官衰竭致死,目前對於秋水仙素中毒並無特效藥 可治療 (Sauder et al., 1983; Folpini and Furfori, 1995; Dehon et al., 1999;
Deveaux et al., 2004)。自 1763 年,秋水仙素被用作為治療風濕類疾病,特 別是痛風 (Gout) 的藥物,在短時間內可以消除患者的疼痛 (Nadius et al., 1977)。有時也因其能引發嘔吐腹瀉之故,臨床醫學上引用為瀉藥和催吐劑。
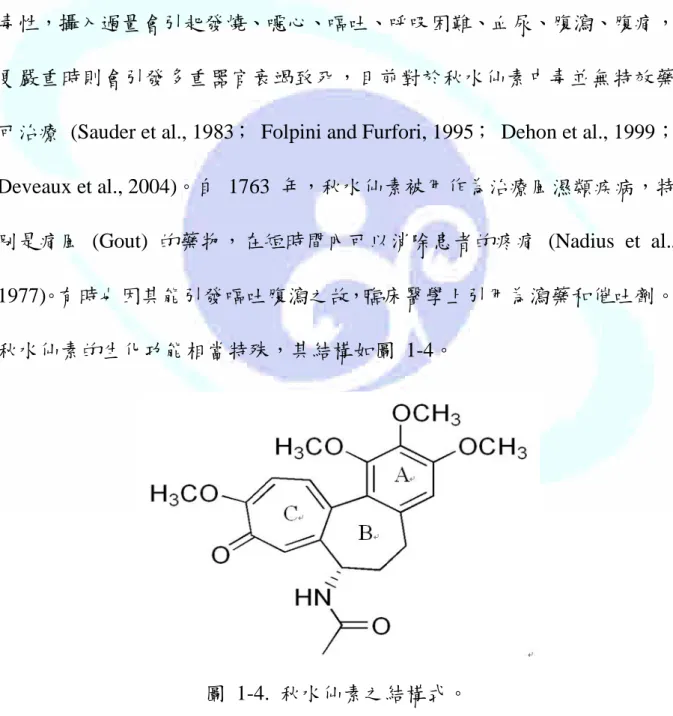
秋水仙素的生化功能相當特殊,其結構如圖 1-4。
圖 1-4. 秋水仙素之結構式。
秋水 仙素是一 種具有 三環結構 的分子 ,其中 A環上有三 個甲氧 基 (Trimethoxyphenyl) , B 環 上 有 一 個 乙 醯 基 (Acetyl) , C 環 則 為 托 酚 酮 (Phenyltropolone),其中 A 環和 C 環具有和 Tubulin 結合之活性,可防止 Tubuline 的聚合 (Polymerization) 而抑制 Microtubule 生成,因而將有絲分 裂 (Mitosis) 停頓於間期 (Metaphase),也會抑制嗜中性球 (Neutrophil) 的 運動與活性,而有抗發炎的效用 (Hastie and Rava, 1989; Banerjee et al., 1997; Andreu et al., 1998)。由於秋水素具有抑制有絲分裂的功能,因此可 能具有抗腫瘤的功用。現在有許多學者將秋水仙素或其衍生物應用於治療 癌症的研究 (Staretz and Hastie, 1993; Helms et al., 1995; Berg et al., 1997;
Bagnato et al., 2004; Bombuwala et al., 2006),目的是想藉由秋水仙素停頓 有絲分裂的特性抑制癌細胞的增生。
第六節 太平洋紫杉醇
太平洋紫杉醇亦稱做紅豆杉醇或紫杉醇,是從太平洋紫杉的樹皮、葉 片或是枝幹中萃取出來的 (Georg et al., 1995)。1960 年代美國的「國家癌症 研究中心」所進行的大型抗癌物質篩選計畫中,Monroe E. Wall 發現從生長 在美國西部的太平洋紫杉 (學名: Taxus brevifolia Nutt.) 的樹皮中萃取出 之粗萃取物,為複雜的植物生物鹼且具有細胞毒性,但對多種動物的癌細 胞有抑制的作用 (Grever et al., 1992),實驗證實它具有對抗 P388 鼠白血病 細胞株的活性。在 1967 年,Monroe E. Wall 和 Mansukh C. Wani 等人,
並將其命名為 Taxol (商品名為汰癌勝),而 Bristol-Myers Squibb (BMS) 獲 得命名的權益將之命名為 Paclitaxel。
起初 Paclitaxel 的臨床研究面臨許多困難,首先藥品原料的供應就是 一大問題,因紫杉醇源自太平洋紫杉的樹皮,而此樹種十分稀少且生長緩 慢,也是保育類植物,因為該樹種成長耗時,可能需要三十到一百年的時 間,估計平均需要二到六顆樹才能提供一位病人治癒疾病所需的藥量。其 次由於紫杉醇的高度疏水性 (小於1 μg/ml),在水中的溶解度極差,直到以 氫化蓖麻油聚氧乙烯 Polyoxyethylated castor oil (Cremophor EL) 做為助溶 劑搭配脫水酒精 (比例為 50:50) 才克服此問題,但此溶劑組合也造成另外 一個麻煩---嚴重的過敏反應,過敏反應的發生與 Cremophor EL 有關
(Tsavaris et al., 1998; Weiss
的過敏反應,大多數的臨床研究多建議 則顯示,只要給予化療前適當的預防用藥
24 小時之靜脈注射,其產生過敏反應的機會差不多 仍在尋找更好使用紫杉醇藥物來治療癌症的方法
用 紫 杉 醇 及 其 他 抗 癌 藥 物 可 以 有 效 的 治 療 淋 巴 結 乳 癌 node-positive breast cancer
(Lung cancer) 上,甚至是 AIDS
胃部、頭頸或膀胱癌的研究仍在觀察中 對紫杉醇具有抗藥性的方法
1999; Schondorf et al., 2001; Simoes
圖
太平洋紫杉醇具有一個含有
Weiss et al., 1990)。為了避免太平洋紫杉醇產生嚴重 大多數的臨床研究多建議 24 小時靜脈注射。但最近的研究 只要給予化療前適當的預防用藥,使用 3 小時之靜脈注射與使用 其產生過敏反應的機會差不多。最近的臨床實驗研究 仍在尋找更好使用紫杉醇藥物來治療癌症的方法,由臨床實驗初步發現使 用 紫 杉 醇 及 其 他 抗 癌 藥 物 可 以 有 效 的 治 療 淋 巴 結 乳 癌
positive breast cancer)、移轉性乳癌 (Metastatic breast cancer)
AIDS 病人病發的卡波西式肉瘤。其他對淋巴癌 頭頸或膀胱癌的研究仍在觀察中。除此之外也有研究克服某些癌症 對紫杉醇具有抗藥性的方法 (Crommentuyn et al., 1998; Walsh and Goodman, 1999; Schondorf et al., 2001; Simoes-Wust et al., 2002)。
1-5. Paclitaxel 之結構式。
太平洋紫杉醇具有一個含有 20 個碳的軸形成三個相連環
為了避免太平洋紫杉醇產生嚴重 但最近的研究 小時之靜脈注射與使用 最近的臨床實驗研究 由臨床實驗初步發現使 用 紫 杉 醇 及 其 他 抗 癌 藥 物 可 以 有 效 的 治 療 淋 巴 結 乳 癌 (Lymph etastatic breast cancer) 和肺癌 其他對淋巴癌、
除此之外也有研究克服某些癌症 Crommentuyn et al., 1998; Walsh and Goodman,
個碳的軸形成三個相連環,側邊有
一個帶氧的酯鏈,是構造複雜的 Taxane ring 家族成員,非常難溶於水。
太平洋紫杉醇對於細胞中的微管作用而使得微管系統趨於穩定,所以太 平洋紫杉醇主要之作用機制在於影響細胞內的微管系統 (Nicolaou et al., 1994)。細胞在產生有絲分裂時,會產生大量的微管構造,而當染色體分 佈至兩端後,這微管系統便進行分解,而完成細胞分裂。當微管的一端 聚合,另一端變分解,以達到動態平衡。太平洋紫杉醇會促成微管蛋白 二聚體組成微管,主要結合在 Tubulin 的 β-subunit 第 31 個胺基酸 N- 端上,並保護組成的微管不會再次分解,使細胞內累積許多沒有功能的 微管,干擾細胞的分裂、發育及功能 (Rowinsky et al., 1995),故可以固 定微管系統,抑制微管系統的分解過程,使細胞無法完成分裂的過程而 死亡。因此太平洋紫杉醇作用係一有絲分裂的抑制劑,阻斷細胞分裂於 細胞周期之 G2 與 M 期,使得放射治療的成功率增加 (Nappi et al., 1996)。以此而言,Paclitaxel 與其他作用在微管系統的抗癌藥劑如秋水仙 素、Vinca alkaloids 的作用機制剛好相反 (Rowinsky et al., 1989; Miles et al., 1995)。
第七節 研究目的
降解性高分子是一種良好之藥物輸送基材,其中又以 PLGA 最為廣泛 被使用,其兼具生物相容性與可降解之特性,能助使藥物送入體內特定部 位,本研究以乳酸和甘醇酸之共聚比、PLGA 之分子量大小、及藥物與 PLGA 高分子間之相互作用等因子為主要探討方向。
目前被研究的抗癌藥物種類繁多,其中抗癌機制各有不同,而秋水仙 素經研究證實會與 Tubulin 結合以抑制細胞分裂,故有潛力成為新的抗癌 藥物之一。太平洋紫杉醇則早已被證實具有抗癌藥效,同時也使用於臨床 治療。本研究選用秋水仙素與太平洋紫杉醇作為控制釋放技術之標的,因 兩者親疏水性完全不同,藉此實驗研究高分子基材與親疏水性藥物之交互 作用是否影響藥物的釋放速率,探討以高分子控制釋放不同藥物的設計參 數之可行性。
第二章 實驗材料與實驗儀器
第一節 實驗藥品與器材
(1)秋水仙素:Colchicine 廠牌:Sigma
分子量: 399.44 m.p.:150℃
(2)太平洋紫杉醇:Paclitaxel 廠牌:ScinoPharm Taiwan 平均分子量: 853.92
(3)PLGA 75:25 廠牌:Sigma
平均分子量: 66000107000 (4) PLGA 50:50
廠牌:Sigma
平均分子量: 4000075000
(5)PLGA 75:25
廠牌:興技生物科技公司 Bio-InVigor 平均分子量: 65000130000
I.V.:0.500.79 dl/g Tg:4247℃
(6)PLGA 50:50
廠牌:興技生物科技公司 Bio-InVigor 平均分子量: 3500065000
I.V.:0.300.49 dl/g Tg:3944℃
(7)PLGA 50:50
廠牌:興技生物科技公司 Bio-InVigor 平均分子量: 65000130000
I.V.:0.500.79 dl/g Tg:4045℃
(8)PLGA 50:50
廠牌:興技生物科技公司 Bio-InVigor 平均分子量: 130000240000
I.V.:0.801.19 dl/g Tg:4146℃
(9)二氯甲烷 Dichloromethane,2.5L 裝,試藥級 廠牌:Acros organics Lot no.:A014940801 密度:1.325 g/m 分子量: 84.93
(10)PBS 緩衝液:Phosphate buffered saline 10× concentrate 廠牌:Sigma Lot no.:016K6081
成分:10 mM sodium phosphate,pH7.4 and 0.9% NaCl
(11)丙酮 Aceton
廠牌:Mallinckrodt chemicals Lot no.:Y45B00
(12)乙腈 Acetonitrile
廠牌:U. T. Baker Lot no.:C38805 分子量:41.05
(13) 軟墊 Septa, Teflon/Silicone
廠牌:National Scientific Lot no.:00062088
(14)離心管
(15)燒杯:20ml,no.1000 ,Pyrex
(16)錐形瓶:1000ml,Tai Fong
(17)玻璃瓶:20ml
(18)三次水
第二節 實驗儀器
高效液相層析法 (High performance liquid chromatography, HPLC) 是分 離技術中相當重要的一種方法,適用於半揮發性和非揮發性化合物或遇熱 易被裂解的待測物。應用此方法進行分析的先決條件是待測物必須溶於作 為移動相的溶劑中,移動相的溶劑在加壓的狀況下輸送,其作用原理係藉
移動相通過靜相達到分離的效果,混合物中的各成份在靜相和移動相之間 的分配係數不相同(即親和力不同),使其在管柱中的滯留時間 (Retention time) 不相同而得以分離出來,若化合物與靜相親和力較強,則沖提較慢(即 滯留時間長),而化合物與移動相的親和力較強,則沖提較快(即滯留時間短)。
待測物之分子量適用範圍由數十至數十萬,使用分析型管柱之測定極限可 至 pg。光電二極體陣列檢測器 (Photo diode array detector, PDA) 與紫外光
-可見光 (UV-VIS) 檢測器的原理非常相似,都是利用光波來測量析出物 (Elution) 的光吸收度 (Absorbance),有別於 UV-VIS 只能偵測某一特定波 長的吸收度,PDA 檢測器可測得析出物之全光譜。因此,HPLC-PDA 除 了傳統的二維層析譜之外,還能同時提供光譜資料,得到三維資料,即滯 留時間、吸收度、與吸收光波長三種數據。此外,HPLC-PDA 除了具備 HPLC 分離與純化物質的功能外,更可由析出峰做純度的檢定,以判斷是 否有共析物 (Coelution) 的存在,經由比對析出物的光譜,亦能鑑別其成分,
對於成分複雜的天然物之分離及分析有特別顯著之效果。
(1)HPLC 實驗儀器設備
高效能液相層析儀 (HPLC-PDA)
光電二極體陣列檢測器 Waters 2996 PDA,Waters 溶劑輸送梯度幫浦 Waters 600E,Waters
控制暨積分軟體 Empower,Waters
C18層析管柱 Thermo 4.6×150mm ODS HyperSil Lot no.8160 手動微量注射器 Rheodyne 7725i
線上脫氣幫浦 In-Line Degasser AF,Waters
(2)抽真空幫浦 Commercial Motors G8GCX,Ge
(3)超音波震盪器 Ultrasonic cleaner D150
(4)微量滴管 Witopet digital,Witeg
(5)微量注射器 702SNR 25L SYR,Hamilton
(6)微量天平 AB54-S Max:51g Min:10mg ,Mettler Toledo
(7)游標分厘卡尺 Mitutoyo M110-25
第三章 實 驗 方 法
第一節 藥物定量分析
將 Colchicine 溶於 PBS 溶液中,配製成濃度 0.5 μg/μL三瓶標準溶 液,在室溫下分別將三瓶標準溶液稀釋為 0.10.0001 μg/μL,分別為 0.1、
0.05、0.01、0.005、0.001、0.0001 μg/μL 等 6 種不同樣本溶液,再分別取 20 μL注入 HPLC 偵測,以 254 nm 進行迴歸分析,建立其量化模型。
而 Paclitaxel 則溶於 Acetonitrile 與水等比例混合的溶液中,配製成濃 度 0.5 μg/μL三瓶標準溶液,在室溫下分別將三瓶標準溶液稀釋為 0.1 0.0001 μg/μL,分別為 0.1、0.05、0.01、0.005、0.001、0.0001 μg/μL 共 6 種 不同樣本溶液,再分別取 20 μL注入 HPLC 偵測,以 228 nm 的析出峰 面積與藥物含量進行迴歸分析。
第二節 製備含藥物高分子薄膜
分別秤取 11.1 mg 的 Colchicine 與 Paclitaxel 以及 0.1 g 的各類高 分子,加入 1.5 mL Aceton,依高分子種類分別配製成各 6 瓶含兩種不同 藥物的溶液 (Sigma PLGA 75:25; Sigma PLGA 50:50; Bio-InVigor PLGA 75:25; Bio-InVigor PLGA 50:50 IV. 0.492 dl/g; Bio-InVigor PLGA 50:50 IV.
0.739 dl/g; Bio-InVigor PLGA 50:50 IV. 0.902 dl/g),稍微搖晃待其完全溶解後,
再靜置 24 小時,使用微量針筒取 80 μl滴於直徑 1 cm 的鐵氟龍圓墊片 上,剛好會佈滿整個墊片而不至於溢出,每瓶約可製作 20 片高分子薄膜。
靜置 30 分鐘後,會在鐵氟龍圓墊片上形成薄膜,連同鐵氟龍圓墊片放入 真空乾燥器內 3 天,每日抽氣二次使溶劑完全揮發。
揮發完全的高分子薄膜可以很輕易的從鐵氟龍圓墊片上剝離,直徑約 0.92 cm,厚度大約在 75 μm。
第三節 含藥高分子薄膜的降解(體外控制釋放)
將含藥物高分子薄膜放入離心管後,加入 PBS 緩衝液 (pH = 7.4) 1.7 ml,使含藥高分子薄膜完全浸泡於 PBS 緩衝液中,置於室溫下,10 分鐘 後取出含藥高分子薄膜,再自此浸泡液中取 20 μL注入 HPLC 進行分析,
由此得的藥物釋放量設定為藥物殘留於表面所釋放出的藥量,不列入高分 子薄膜降解的計算當中。將浸泡過含 Colchicine 高分子薄膜之溶液取 20 μl 注入 HPLC 測量 Colchicine 的釋放量所採用的方法是等位沖提 (Isocratic elution);其動相設定為 Acetonitrile 25%:Water 75%;沖提速率為 2 ml/min。
而浸泡過含 Paclitaxel 高分子薄膜之溶液先經超音波震盪約 10 秒鐘後取 0.25 ml 置入離心管,再加入 0.25 ml Acetonitrile,使溶液中的 Paclitaxel 完
全溶解,搖晃均勻,置放約 24 小時後再取 20 μl注入 HPLC 測量其釋放 量,使用方法也是等位沖提;動相則為 Acetonitrile 50%:Water 50%;沖提 速率也是 2 ml/min。以上偵測範圍皆為 210 nm400 nm。依上述步驟分別 測量浸泡 PBS (pH = 7.4) 緩衝液 2 小時、4 小時、6 小時、12 小時、18 小 時、24 小時、36 小時、48 小時、60 小時、72 小時,之後間隔 24 小時 持續至 28 天,再拉長實驗時間間隔 3 到 4 天直至 53 天。每次取出含 藥高分子薄膜時,即更換新的 PBS 緩衝液,以確保薄膜釋放出的藥物不會 在 PBS 緩衝液中達到飽和。
第四節 藥物包覆率計算
3.4.1 含藥高分子薄膜的製備藥量
將製備好的高分子薄膜從墊片上輕輕剝離取下後,將含 Colchicine 高 分子薄膜溶於 2 ml 的 DCM,而含 Paclitaxel 之高分子薄膜則溶於 1 ml 的 Acetonitrile。待高分子薄膜完全溶解後,取 20 μl注入 HPLC 偵測每片 高分子薄膜所含的藥量,墊片則置入 1.7 ml 的 PBS 溶液 24 小時後,取 20 μl注入 HPLC 偵測,將高分子薄膜所含的藥量加上墊片上所含的殘餘 藥量視為每片高分子薄膜製備時的藥物總量,隨機取出 3 片高分子薄膜做 三重複試驗,三重複後再做平均。
每次製備薄膜的藥物總含量 = (高分子薄膜所含藥量 + 墊片上殘餘藥量)
3.4.2 包覆於高分子薄膜中的藥物總含量
藥物控制釋放 53 天後,將剩餘的含 Colchicine 高分子薄膜溶於 2 ml 的 DCM,而含 Paclitaxel 之高分子薄膜則溶於 1 ml 的 Acetonitrile,經過 24 小時後,取 20 μl注入 HPLC 去偵測剩餘高分子薄膜所含的藥量。
高分子薄膜內的藥物含量 = 53 天累計釋放量(不含首次浸泡 10 分鐘之釋 放量) + 剩餘高分子薄膜所含的藥量。
3.4.3 藥物平均包覆率
包覆率 = × 100%
高分子薄膜內的藥物含量 每次製備薄膜的藥物總含量
含 Colchicine 高分子薄膜 高 分 子 薄 膜 內 的 藥 物 含 量 (ng)
每 次 製 備 薄 膜 的 藥 物 總 含量 (ng)
藥 物 平 均 包 覆率
Sigma PLGA 75:25 403722.5 454771 88.77%
Sigma PLGA 50:50 292263 476616.6 61.32%
Bio-InVigor PLGA 75:25 379613 505945.8 75.03%
Bio-InVigor PLGA 50:50 IV.:0.492 dl/g
401174.4 544716.7 73.65%
Bio-InVigor PLGA 50:50 IV.:0.739 dl/g
480049.5 505645.8 94.94%
Bio-InVigor PLGA 50:50 IV.:0.902 dl/g
321067.3 519736.9 61.78%
表 3-1. 含 Colchicine 高分子薄膜之包覆率。
含 Paclitaxel 高分子薄膜 高 分 子 薄 膜 內 的 藥 物 含 量 (ng)
每 次 製 備 薄 膜 的 藥 物 總 含量 (ng)
藥 物 平 均 包 覆率
Sigma PLGA 75:25 402730.1 416017.4 96.80%
Sigma PLGA 50:50 377491.9 455826.8 82.81%
Bio-InVigor PLGA 75:25 377538.9 434549.3 86.88%
Bio-InVigor PLGA 50:50 IV.:0.492 dl/g
369194.4 440232.2 83.86%
Bio-InVigor PLGA 50:50 IV.:0.739 dl/g
377986.6 442540.3 85.41%
Bio-InVigor PLGA 50:50 IV.:0.902 dl/g
378481.4 429408.5 88.14%
表 3-2. 含 Paclitaxel 高分子薄膜之包覆率。
第四章 結 果 與 討 論
第一節 Colchicine 於 PLGA 薄膜之控制釋放分析
4.1.1 Colchicine 之迴歸分析
將秋水仙素溶於 PBS 溶液中,配製成濃度 0.5 μg/μL 三瓶標準溶液,
在室溫下分別將三瓶標準溶液稀釋為 0.10.0001 μg/μL,分別為 0.1、0.05、
0.01、0.005、0.001、0.0001 μg/μL 等 6 種不同樣本溶液,再分別取 20 μL 注入 HPLC 偵測,以 254 nm 進行迴歸分析。針對實驗中不同濃度之秋水 仙素溶液進行線性分析,由附錄一結果顯示,秋水仙素溶液之濃度範圍在 0.10.0001 μg/μl,其含量 (X) 與析出峰面積 (Y) 呈線性關係。
2
3 1.83 10
10 12
.
2
X
Y
R2 = 0.999982
4.1.2 含 Colchicine 高分子薄膜的降解(體外控制釋放)
含有秋水仙素的高分子薄膜體外控制釋放實驗的方式是將製備好的高 分子薄膜加入 PBS 緩衝液 (pH=7.4) 1.7 ml 依預定時間浸泡,之後取出含 藥高分子薄膜並取 20 μl注入 HPLC 測量秋水仙素的釋放量 (利用秋水 仙素迴歸分析所得之面積對質量之校正曲線)。而首次 10 分鐘的藥物釋放 視為殘留在高分子薄膜表面秋水仙素含量,不列入後續控制釋放計算。之
後依時間持續控制釋放至 53 天。
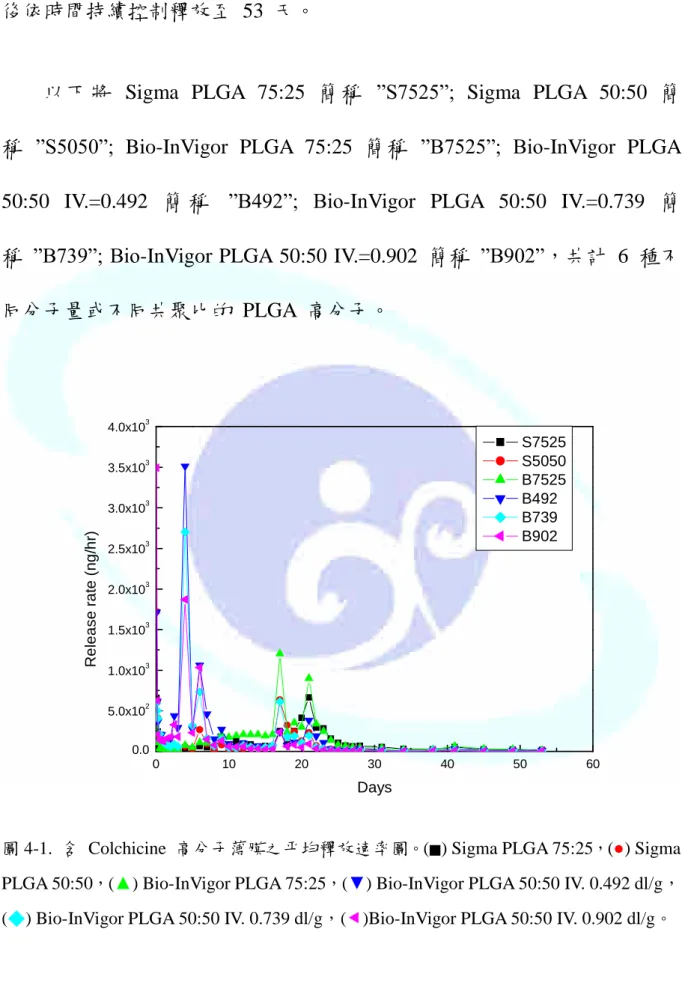
以 下將 Sigma PLGA 75:25 簡稱 ”S7525”;Sigma PLGA 50:50 簡 稱 ”S5050”;Bio-InVigor PLGA 75:25 簡稱 ”B7525”; Bio-InVigor PLGA 50:50 IV.=0.492 簡 稱 ”B492”; Bio-InVigor PLGA 50:50 IV.=0.739 簡 稱 ”B739”;Bio-InVigor PLGA 50:50 IV.=0.902 簡稱 ”B902”,共計 6 種不 同分子量或不同共聚比的 PLGA 高分子。
0 10 20 30 40 50 60
0.0 5.0x102 1.0x103 1.5x103 2.0x103 2.5x103 3.0x103 3.5x103 4.0x103
Releaserate(ng/hr)
Days
S7525 S5050 B7525 B492 B739 B902
圖 4-1. 含 Colchicine 高分子薄膜之平均釋放速率圖。(■) Sigma PLGA 75:25,(●) Sigma PLGA 50:50,(▲) Bio-InVigor PLGA 75:25,(▼) Bio-InVigor PLGA 50:50 IV. 0.492 dl/g,
(◆) Bio-InVigor PLGA 50:50 IV. 0.739 dl/g,()Bio-InVigor PLGA 50:50 IV. 0.902 dl/g。
圖 4-1 為 53 天內,測得含秋水仙素高分子薄膜於體外控制釋放實驗 所得秋水仙素之平均釋放速率的變化圖,結果顯示,在釋放的初始階段,
會有一較大的釋放速率,一般皆將其視為爆發釋放。圖中也顯示,在 3 ~ 10 天與 17 ~ 21 天有兩次的較大釋放速率出現。我們將不同共聚比的高分子 薄膜控制釋放結果分別呈現於圖 4-2 與 4-3。
0 10 20 30 40 50 60
0 1x102 2x102 3x102 4x102 5x102 6x102 7x102 8x102 9x102 1x103 1x103 1x103 1x103
Releaserate(ng/hr)
Days
S7525 B7525
圖 4-2. 含 Colchicine PLGA 75:25 高分子薄膜之平均釋放速率圖。(■) Sigma PLGA 75:25,(●) Bio-InVigor PLGA 75:25。
圖 4-2 為 53 天內,測得含秋水仙素且共聚比 75:25 高分子薄膜於體 外控制釋放實驗所得秋水仙素之平均釋放速率的變化圖。PLGA 75:25 在一 開始有較高的釋放速率後,於 24 小時後就趨於緩和,之後就持續加速釋
放,在第 9 ~ 10天出現稍大的加速釋放現象,然後在第 17 天至第 21 天 會有最高的釋放速率,之後再慢慢趨於緩和,但還是有持續釋放的跡象。
根據實驗結果推測,一開始可能是高分子薄膜表面附著的藥物釋放現象,
之後水浸入高分子薄膜,形成擴散通道 (Water channels),高分子薄膜內的 藥物溶於水後,藉由擴散方式釋放出來。同時,高分子薄膜也因為水解造 成降解,形成更多、更大的孔洞,一方面增加了擴散通道使得秋水仙素的 擴散更為迅速,另一方面,秋水仙素藉由高分子的解離使得其更容易從高 分子溶於水中,而增加其釋放量;推測這些是秋水仙素在持續釋放過程中,
造成釋放速率突然升高的主要原因。
0 10 20 30 40 50 60
0.0 5.0x102 1.0x103 1.5x103 2.0x103 2.5x103 3.0x103 3.5x103 4.0x103
Releaserate(ng/hr)
Days
S5050 B492 B739 B902
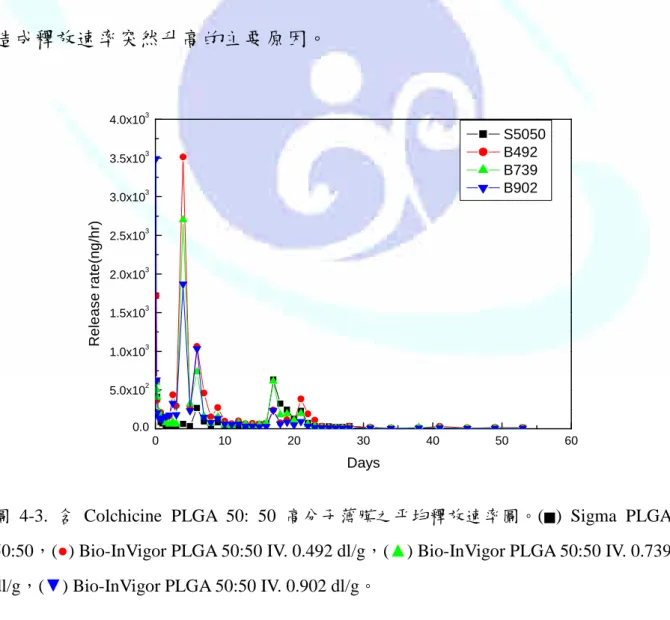
圖 4-3. 含 Colchicine PLGA 50: 50 高分子薄膜之平均釋放速率圖。(■) Sigma PLGA 50:50,(●) Bio-InVigor PLGA 50:50 IV. 0.492 dl/g,(▲) Bio-InVigor PLGA 50:50 IV. 0.739 dl/g,(▼) Bio-InVigor PLGA 50:50 IV. 0.902 dl/g。
圖 4-3 為 53 天內,測得含秋水仙素且共聚比 50:50 高分子薄膜於體 外控制釋放實驗所得秋水仙素之平均釋放速率的變化圖。PLGA 50:50 在 24 小時前也是同樣的情況,高分子表面的藥物脫附後,藥物釋放速率就趨 於緩和,Sigma 的 PLGA 50:50 在第 6 天有突然稍高的釋放,而興技的 PLGA 50:50 則是在第 4 天至第 6 天有明顯較高的釋放速率,推測可能是 高分子薄膜內的孔洞充滿了水,同時高分子開始降解,致使藥物大量的釋 放出來。而在第 17 ~ 25 天也有如共聚比 75:25 一樣有較快的釋放速率出 現,應該也是高分子內部又有一次新的降解促使藥物快速的脫離高分子,
加速釋放出來。
比較 PLGA 在 PLA 與 PGA 不同共聚比的情況下,最明顯的分別是 在浸泡 3 至 5 天所出現一個較大的藥物釋放,因 PLGA 50:50 的親水性 PGA 含量較高,所以在浸泡初期所釋放的藥量都大於 PLGA 75:25。初期 降解發生於 PLGA 薄膜內與水接觸的表面分子,此時影響藥物釋放速率的 因素可能單純為高分子的降解使得其所含的藥物被釋出,因而 PGA 含量 多的 PLGA 50:50 之藥物釋放速率較 PLGA 75:25 大;且分子量越小的 PLGA 50:50 也會有越大的釋放速率,如圖 4-3 所示,證明分子量越小的 高分子越容易降解。
0 10 20 30 40 50 60 100
101 102 103
Releaserate
Days
S7525 S5050 B7525 B492 B739 B902
圖4-4. 含 Colchicine 高分子薄膜之平均釋放速率圖(y 軸取對數)。(■) Sigma PLGA 75:25,(●) Sigma PLGA 50:50,(▲) Bio-InVigor PLGA 75:25,(▼) Bio-InVigor PLGA 50:50 IV. 0.492 dl/g,(◆) Bio-InVigor PLGA 50:50 IV. 0.739 dl/g,()Bio-InVigor PLGA 50:50 IV.
0.902 dl/g。
由圖 4-4 可觀察到,所有含 Colchicine 高分子薄膜在初期均有明顯較 快速的釋放,而且以 25 天為分水嶺,呈現二階段不同的釋放速率,25 天 前的釋放速率明顯高於 25 天之後,以 PGA 含量較高的 PLGA 50:50 薄 膜尤其明顯。當高分子薄膜接觸到緩衝液時,附著在薄膜表面的藥物首先 迅速脫離釋出,造成了爆發釋放現象;接著水浸入薄膜內部孔洞,這些內 部結構與水接觸的界面上,藥物脫附釋出,因此呈現了第一階段的快速釋 放期;而 25 天後,包埋在高分子薄膜內部結構的藥物必須等待與水接觸 的界面上高分子降解後,才能緩慢釋出,其釋放速率受降解速率控制。
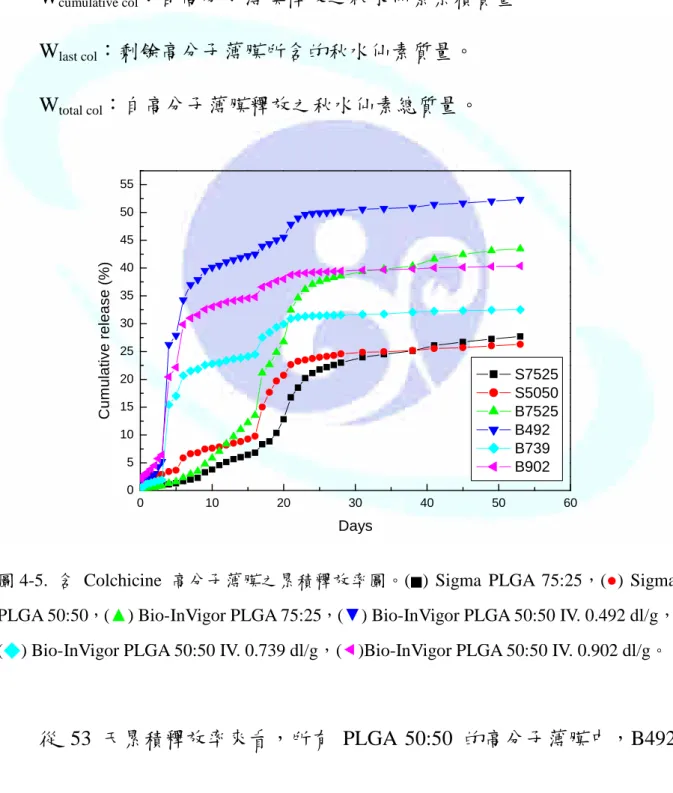
圖 4-5 為 53 天內,測得六種高分子基材體外控制釋放之秋水仙素累 積釋放率的變化圖。高分子薄膜之秋水仙素累積釋放率 (%) 是依下列公式 計算:
累積釋放率 (%) = [ Wcumulative col/ (Wlast+ Wtotal col)] × 100%
Wcumulative col:自高分子薄膜釋放之秋水仙素累積質量。
Wlast col:剩餘高分子薄膜所含的秋水仙素質量。
Wtotal col:自高分子薄膜釋放之秋水仙素總質量。
0 10 20 30 40 50 60
0 5 10 15 20 25 30 35 40 45 50 55
Cumulativerelease(%)
Days
S7525 S5050 B7525 B492 B739 B902
圖 4-5. 含 Colchicine 高分子薄膜之累積釋放率圖。(■) Sigma PLGA 75:25,(●) Sigma PLGA 50:50,(▲) Bio-InVigor PLGA 75:25,(▼) Bio-InVigor PLGA 50:50 IV. 0.492 dl/g,
(◆) Bio-InVigor PLGA 50:50 IV. 0.739 dl/g,()Bio-InVigor PLGA 50:50 IV. 0.902 dl/g。
從 53 天累積釋放率來看,所有 PLGA 50:50 的高分子薄膜中,B492
有最高的釋放率,可以達到 52.36%,B902 次之,有 40.37%,B739 則有 32.52% 的釋放率,Sigma PLGA 50:50 釋放量則最低,僅有 26.28% 的釋 放率。而 PLGA 75:25 的高分子薄膜,興技產品可以達到 43.46%,Sigma 只 有 27.69% 的釋放率。
不論是那一家公司的產品或分子量的不同,共聚比 PLGA 50:50 的高 分子薄膜都會在第 3 ~ 5 天有快速釋放的特性,之後直到第 17 ~ 21 天又 有一較高的釋放量,整個累積釋放率的圖形趨勢都很相似。而共聚比 75:25 兩家不同公司的產品也有相當大的相似性。據此,我們認為,共聚比在研 發藥物控制釋放系統中是一相當重要的設計參數,其影響性在其他變數干 擾下如分子量、製程不同等,仍具有相當明顯的效應。
0 10 20 30 40 50 60 0.0
2.0x104 4.0x104 6.0x104 8.0x104 1.0x105 1.2x105 1.4x105 1.6x105 1.8x105 2.0x105 2.2x105
Cumulativerelease(ng)
Days
S7525 S5050 B7525 B492 B739 B902
圖 4-6. 含 Colchicine 高分子薄膜之累積釋放量圖。(■) Sigma PLGA 75:25,(●) Sigma PLGA 50:50,(▲) Bio-InVigor PLGA 75:25,(▼) Bio-InVigor PLGA 50:50 IV. 0.492 dl/g,
(◆) Bio-InVigor PLGA 50:50 IV. 0.739 dl/g,()Bio-InVigor PLGA 50:50 IV. 0.902 dl/g
圖 4-6 是 53 天內,測得六種高分子基材體外控制釋放之秋水仙素累 積釋放量的變化圖。與累積釋放率相比,整個釋放趨勢蠻類似的,比較有 趣的是,B739 與 B902 的曲線交換了,從 53 天的累積釋放量來觀察,
B739 總共釋放了 156088 ng,B902 釋放了 129614 ng,但因為 B739 剩 餘的藥量相當高,是 B902 的 1.69 倍,所以才會造成 B739 累積釋放率 降低。也因為這情形,我們可以推測,高分子薄膜所包含的藥物不會因藥 物含量的高低,而影響他的釋放總量,最主要的原因還是因為高分子分子 量的高低而有所影響。在相同製程下,不同共聚比的 PLGA 之藥物包覆率
並不一致,與共聚比沒有明顯的相關性,因此包覆率對於藥物釋放量並沒 有明顯的影響。
但是不同廠牌的高分子,以 PLGA 75:25 來看,興技的高分子分子量 雖稍大於 Sigma,但其藥物釋放量明顯高於 Sigma;以 PLGA 50:50 而言,
雖然 Sigma 的高分子分子量只有 6 萬左右,與興技的 B492 高分子接近,
但 是 藥 物 釋 放 量 差 異 相 當 大 , 甚 至 釋 放 量 比 B902 高 分 子 ( 分 子 量 : 130000240000) 還低。雖說整體的釋放曲線是由共聚比來決定,釋放速率 取決於高分子分子量的大小,然而不同的公司配製產品對於藥物釋放量仍 有很大的影響。
最後,雖然共聚比 50:50 的 PLGA 高分子薄膜比起 PLGA 75:25 有 較高的藥物釋放速率,但在經過 30 天的體外釋放後,PLGA 75:25 比起 PLGA 50:50 似乎有比較明顯的持續釋放趨勢。
第二節 Paclitaxel 於 PLGA 薄膜之控制釋放分析
4.2.1 Paclitaxel 之迴歸分析
如同秋水仙素的做法,但我們是將太平洋紫杉醇溶於 Acetonitrile 與水 等比例混合的溶液中,配製成濃度 0.5 μg/μL三瓶標準溶液,在室溫下分 別將三瓶標準溶液稀釋為 0.10.0001 μg/μL,分別為 0.1、0.05、0.01、0.005、
0.001、0.0001 μg/μL 共 6 種不同樣本溶液,再分別取 20 μL注入 HPLC 偵測,以 228 nm 進行迴歸分析。在實驗中的不同濃度之太平洋紫杉醇溶 液範圍內 (0.10.0001 μg/μl),太平洋紫杉醇之含量 (X) 與析出峰面積 (Y) 呈線性關係。(附錄二)
3
3 3.70 10
10 12
.
1
X
Y
R2=0.999769
4.2.2 含 Paclitaxel 高分子薄膜的降解(體外控制釋放)
含有太平洋紫杉醇的高分子薄膜體外控制釋放實驗的方式是將製備好 的高分子薄膜加入 PBS 緩衝液 (pH=7.4) 1.7 ml 依預定時間浸泡,之後取 出含藥高分子薄膜,取 0.25 ml 浸泡溶液與 0.25 ml Acetonitrile 混合均勻 並取 20 μl注入 HPLC 測量太平洋紫杉醇的釋放量(利用太平洋紫杉醇迴 歸分析所得的面積對質量之校正曲線)。而首次 10 分鐘的藥物釋放視為殘 留在高分子薄膜表面太平洋紫杉醇含量,不列入後續控制釋放計算。之後
依時間持續控制釋放至 53 天。
0 10 20 30 40 50 60
0 100 200 300 400 500 600
ReleaseRate(ng/hr)
Days
S7525 S5050 B7525 B492 B739 B902
圖 4-7. 含 Paclitaxel 高分子薄膜之平均釋放速率圖。(■) Sigma PLGA 75:25,(●) Sigma PLGA 50:50,(▲) Bio-InVigor PLGA 75:25,(▼) Bio-InVigor PLGA 50:50 IV. 0.492 dl/g,
(◆) Bio-InVigor PLGA 50:50 IV. 0.739 dl/g,()Bio-InVigor PLGA 50:50 IV. 0.902 dl/g。
圖 4-7 為 53 天內,測得含太平洋紫杉醇高分子薄膜於體外控制釋放 實驗所得太平洋紫杉醇之平均釋放速率的變化圖。由於太平洋紫杉醇非常 難溶於水,所以初期高分子薄膜的爆發釋放都很低。結果顯示,PLGA 75:25 的高分子在表面的藥物釋放完後,就偵測不到太平洋紫杉醇的釋放,一直 到浸泡超過 17 天,才繼續偵測到少量的藥物釋放,推測也是高分子薄膜 內部出現較大的孔洞,才致使藥物釋放出來,而且在 30 天後,整體的釋
放速率均趨於緩和,沒有產生較高的釋放速率,但仍有持續少量釋放的趨 勢。
0 10 20 30 40 50 60
0 100 200
ReleaseRate(ng/hr)
Days
S7525 B7525
圖 4-8. 含 Paclitaxel PLGA 75:25 高分子薄膜之平均釋放速率圖。(■) Sigma PLGA 75:25,
(●) Bio-InVigor PLGA 75:25。
圖 4-8 為 53 天內,測得含太平洋紫杉醇且共聚比 75:25 高分子薄膜 於體外控制釋放實驗所得太平洋紫杉醇之平均釋放速率的變化圖。圖中清 楚的顯示,PLGA 75:25 在初期與第 16 ~ 27 天才偵測到太平洋紫杉醇的釋 放量,第 5 ~ 15 天均因藥物釋放量過低而無法偵測。雖然其釋放速率遠小 於親水性的秋水仙素,但其趨勢與圖 4-2 仍有若干相符之處,推論藥物的 親疏水性對於 PLGA 75:25 高分子薄膜的控制釋放主要影響在於其釋放速
率的大小,而非釋放機制之不同。
0 10 20 30 40 50 60
0 100 200 300 400 500 600
ReleaseRate(ng/hr)
Days
S5050 B492 B739 B902
圖 4-9. 含 Paclitaxel PLGA 50: 50 高分子薄膜之平均釋放速率圖。(■) Sigma PLGA 50:50,
(●) Bio-InVigor PLGA 50:50 IV. 0.492 dl/g,(▲) Bio-InVigor PLGA 50:50 IV. 0.739 dl/g,(▼) Bio-InVigor PLGA 50:50 IV. 0.902 dl/g。
圖 4-9 的 PLGA 50:50 高分子也是類似情況,初期所有高分子薄膜的 藥物都自薄膜表面持續釋放,約在 6 天後所有薄膜的釋放量都減少,一直 到 17 天以後才有較大量的釋放情況。30天後也是少量釋放的情況
0 10 20 30 40 50 60 0
1 2 3 4 5 6
CumulativeRelease(%)
Days S7525
S5050 B7525 B492 B739 B902
圖 4-10. 含 Paclitaxel 高分子薄膜之累積釋放率圖。(■) Sigma PLGA 75:25,(●) Sigma PLGA 50:50,(▲) Bio-InVigor PLGA 75:25,(▼) Bio-InVigor PLGA 50:50 IV. 0.492 dl/g,
(◆) Bio-InVigor PLGA 50:50 IV. 0.739 dl/g,()Bio-InVigor PLGA 50:50 IV. 0.902 dl/g。
圖 4-10 是利用 PLGA 75:25 (Sigma 與興技)、PLGA 50:50 (興技 IV. = 0.492、0.739、0.902 dl/g) 和 PLGA 50:50 (sigma) 六種高分子基材體外控制 釋放之太平洋紫杉醇累積釋放率。高分子薄膜之太平洋紫杉醇累積釋放率 (%) 是依下列公式計算:
累積釋放率 (%) =[Wcumulative taxol/(Wlast+ Wtotal taxol)] × 100%
Wcumulative taxol:自高分子薄膜釋放之太平洋紫杉醇累積質量
Wlast taxol:剩餘高分子薄膜所含的太平洋紫杉醇質量
Wtotal taxol:自高分子薄膜釋放之太平洋紫杉醇總質量
從 53 天累積釋放率 (%) 來看,所有 PLGA 50:50 的高分子薄膜中,
S5050 有最高的釋放率,可以達到 5.71%,B739 次之,有 5.08%,B902 則有 4.95% 的釋放率,S5050 釋放量則最低,僅有 1.89% 的釋放率。而 PLGA 75:25 的高分子薄膜,釋放率均較 PLGA 50:50 高分子來的低,大約 只有 1.9% 左右的釋放率。以 PLGA 50:50 高分子薄膜而言,B492 的分子 量最低,應較容易在緩衝液中水解,而且分子量低也較容易使水進入高分 子內部,但是釋放率卻只有其餘高分子薄膜的一半。
如圖 4-11 所示,以太平洋紫杉醇的累積釋放量來看,與累積釋放率是 相似的情況。PLGA 50:50 B492 一樣較其他 PLGA 50:50 的釋放量來得低,
經過 53 天的控制釋放,只釋放出 10334 ng,其餘 PLGA 50:50 高分子薄 膜均有其 2 倍左右的釋放量。而 PLGA 75:25 的高分子只有 7300 ng 左右 的釋放量。
為了使藥物在高分子薄膜內分佈均勻,本實驗所採用的高分子均為 DL 型 PLGA 高分子,因 DL 型 PLGA 高分子具有不規則排列之分子鏈,為 無定形的高分子聚合物,故較其他 L 型或 D 型高分子聚合物更適合包覆 藥物。
0 10 20 30 40 50 60 0.0
5.0x103 1.0x104 1.5x104 2.0x104 2.5x104
CumulativeRelease(ng)
Days S7525
S5050 B7525 B492 B739 B902
圖 4-11. 含 Paclitaxel 高分子薄膜之累積釋放量圖。(■) Sigma PLGA 75:25,(●) Sigma PLGA 50:50,(▲) Bio-InVigor PLGA 75:25,(▼) Bio-InVigor PLGA 50:50 IV. 0.492 dl/g,
(◆) Bio-InVigor PLGA 50:50 IV. 0.739 dl/g,()Bio-InVigor PLGA 50:50 IV. 0.902 dl/g。
以 PLGA 不同聚合比而言,在 53 天以內,不管所包覆的藥物是親水 性的秋水仙素或者是疏水性的太平洋紫杉醇,PLGA 50:50 的高分子在藥物 釋放量均較 PLGA 75:25的釋放量來得高,主要的因素可能為 PLA 有較高 的疏水性,PGA 有較高的親水性,因而使得含親水性 PGA 成份較高之 PLGA 50:50 易使水滲入高分子,所以 PLGA 50:50 相較於含疏水性 PLA 成份較高的 PLGA 75:25 有較快的降解速率。
包覆不同藥物也會造成不同的釋放結果,以累積釋放率而言,親水性
的秋水仙素在 25 天前已經大量的釋放出來,釋放速率最慢的 S7525 也有 21.7% 的釋放率,釋放速率最高的 B492 有高達 50% 的釋放率;相較於 包覆疏水性太平洋紫杉醇的 S7525 卻只有 1.9% 的釋放率,B739 有最高 的釋放率,但也只有 5.7% 而已,所以親水性藥物在高分子薄膜內,經由 PBS 緩衝液浸泡,會經由擴散釋放機制大量的釋放出來;疏水性藥物雖然 在高分子薄膜內也會有 PBS 緩衝液的浸潤,但因太平洋紫杉醇極為疏水性,
不利於藥物擴散釋放機制,只能經由高分子薄膜降解機制連同高分子水解 後產物一起釋出。
PLGA 高分子薄膜均有同一個特性,不管是分子量的大小或者是共聚 比的不同,甚至所包覆的藥物親疏水性,除了初期高分子薄膜表面的爆發 釋放,均會在 17 到 22 天出現較大的釋放速率,推測是高分子內部的孔 洞表面結構產生了降解,致使藥物大量的釋放出來。
太平洋紫杉醇的包覆率很明顯地均比秋水仙素的包覆率高,其中,藥 物的親疏水性影響是最主要的,因為在起始的 10 分鐘釋放量雖不列入藥 物控制釋放的計算中,但計算包覆率的高分子薄膜製備時所含藥量有將其 計入,而一般秋水仙素在此 10 分鐘內的釋放量極大於太平洋紫杉醇的釋 放量,故而太平洋紫杉醇的包覆率才會普遍較秋水仙素高。
第五章 結 論
1. 親疏水性藥物對於體外釋放量的影響最明顯,太平洋紫杉醇的釋放量遠 低於秋水仙素的釋放量。
2. 包覆相同藥物的情況中,不同共聚比在 25 天前的釋放量以 PGA 含量 高的 PLGA 50:50 薄膜的釋放量較為快速,但在 25 天後,PLGA 75:25 薄膜的釋放量要稍高於 PLGA 50:50 薄膜。
3. 對不同分子量同樣配製方法的興技 PLGA 50:50 薄膜而言,分子量較低 的 B492 薄膜釋放速率最高,B739 薄膜次之,B902 薄膜的釋放速率最 慢。但 B492 薄膜包覆太平洋紫杉醇時,釋放速率卻均低於 B739 與 B902 薄膜。
4. 對不同配製方法的 PLGA 薄膜,以相近分子量薄膜做為比較,Sigma PLGA 50:50 薄膜在控制釋放秋水仙素時,釋放量比興技 PLGA 50:50 B492 薄膜低,Sigma PLGA 75:25 薄膜釋放量也是稍低於興技 PLGA 75:25 薄膜低;包覆太平洋紫杉醇時,興技 PLGA 50:50 B492 的釋放量 雖比 Sigma PLGA 50:50 薄膜低,但 Sigma PLGA 50:50 薄膜釋放量卻 與興技 PLGA 50:50 B739 和 B902 接近,而 Sigma PLGA 75:25 薄膜的 太平洋紫杉醇釋放量也是稍低於興技 PLGA 75:25 薄膜。
參考文獻
Agrawal, C. M., Haas, K. F., Leopold, D. A. and Clark, H. G., Evaluation of poly(L-lactic acid) as a material for intravascular polymeric stents.
Biomaterials 13, 176-182 (1992).
Alonso, M. J., Cohen, S., Park, T. G., Gupta, R., Siber, G. and Langer, R., Determinants of release rate of tetanus vaccine from polyester microspheres. Pharmaceut Res .10, 945-953 (1993).
Andreu, J. M., Perez-Ramirez, B., Gorbunoff, M. J. and Ayala, D., Role of the colchicine ring A and its methoxy groups in the binding to tubuline and microtubule inhibition. Biochemistry 37, 8356-8368 (1998).
Athanasiou, K. A., Niederauer, G. G. and Agrawal, C. M., Sterilization, toxicity, biocompatibility and clinical applications of polylactic acid/polyglycolic acid copolymers. Biomaterials 17, 93-102 (1996).
Bagnato, J. D., Eilers, A. L., Horton, R. A. and Grissom, C. B., Synthesis and characterization of a cobalamin-colchicine conjugate as a novel tumor-targeted cytotoxin. J. Org. Chem. 69, 8987-8996 (2004).
Banerjee, S., Chakrabarti, G. and Bhattacharyya, B., Colchicine binding to tubulin monomers: a mechanistic study. Biochemistry 36, 5600-5606 (1997).
Bayomi,M. A., Geometric approach for zero-order release of drugs dispersed in an inert matrix. Pharm. Res. 11(6), 914-916 (1994).
Berg, U., Bladh, H., Hoff, M. and Svensson, C., Stereochemical variations on the colchicine motif. Part 2. Unexpected tetracyclic isoxazole derivatives. J.
Chem. Soc. Perkin Trans. 2, 1697-1704 (1997).
Bodmeier, R. and Chen, H., Evaluation of biodegradable poly(lactide) pellets prepared by direct compression. J. Pharm. Sci. 78, 819-822 (1989).
Bombuwala, K., Kinstle, T., Popik, V., Uppal, S., Olesen, J. B., Vina, J. and Heckman, C. A., Colchitaxel, a coupled compound made from microtubule inhibitors colchicine and paclitaxel. Beistein J. Org. Chem. Jun 30 ; 2-13 (2006).
Brannon-Peppas, L., Recent advances on the use of biodegradable microparticles and nanoparticles in controlled drug delivery. Int. J. Pharm.
116, 1-9 (1995).
Brem, H., Walter, K. and Langer, R., Polymers as controlled drug delivery devices for the treatment of malignant brain tumors. Em. J. Pharmacol.
Biopharmacol. 39, 2-7 (1993).
Chu, C. C., The degradation and biocompatibility of suture materials. CRC Crit.
Rev. Biocompatibil. 1, 261-322 (1985).
Cima, L. G., Ingber, D. E., Vacanti, J. P. and Langer, R., Design of textile scaffolds for tissue engineering : the use of biodegradable yarns. Biotechnol.
Bioeng. 38, 145-158 (1991).
Crommentuyn, K. M., Schellens, J. H., van den Berg, J. D. and Beijnen, J. H., In-vitro metabolism of anti-cancer drugs, methods and applications:
paclitaxel, docetaxel, tamoxifen and ifosfamide. Cancer Treat Rev. 24(5), 345-366 (1998).
Dehon, B., Chagnon, J. L., Vinner, E., Pommery, J., Mathieu, D. and Lhermitte, M., Colchicine poisoning: report of a fatal case with body fluid and post-mortem tissue analysis by HPLC. Biomed. Chromatogr. 13, 235-238 (1999).