磷光有機發光二極體:材料及元件的研究
83
0
0
全文
(2) 磷光有機發光二極體:材料及元件的研究 Electrophosphorescent Organic Light-Emitting Diodes: Materials and Devices. 研 究 生:施秉彝. Student: Ping-I Shih. 指導教授:許慶豐 博士. Advisor: Dr. Ching-Fong Shu. 國立交通大學 應用化學研究所 碩士論文. A Thesis Submitted to Department of Applied Chemistry College of Science National Chiao-Tung University in Partial Fulfillment of the Requirements for the Degree of Master in Applied Chemistry June 2005 Hsinchu, Taiwan, Republic of China. 中華民國 九十四 年 六月.
(3) 磷光有機發光二極體:材料及元件的研究. 研究生:施 秉 彝. 指導教授:許 慶 豐. 博士. 國立交通大學應用化學研究所. 摘. 要. 本論文分為兩部分,A 部分針對非離子型 Ru 金屬紅色磷光材料 之 PLED 元件性質做討論,B 部份針對藍色磷光主發光體材料的合 成、性質與元件做討論。 在 A 部分中,嘗試以一新型中性的 Ru 紅光材料摻雜進 PVK 和 PF 中,製成 PLED 元件來比較其元件的結果,希望此中性分子在後 者的元件表現上能有重要的改善。此外,為了進一步改善元件內電荷 的傳輸平衡,進一步將電荷傳輸官能團導入主發光體系統中,以提升 元件發光效率及亮度。 在 B 部分中,以 carbazole 為主體,在其兩側的 3,6 位置上以非 共軛的方式各導入一個剛硬 fluorene 基團,希望得到具有電洞傳輸特 性且高熱穩定性的藍色磷光主發光體材料。. i.
(4) Electrophosphorescent Organic Light -Emitting Diodes: Materials and Devices. Student: Ping-I Shih. Advisor: Dr. Ching-Fong Shu. Department of Applied Chemistry National Chiao-Tung University. Abstract This thesis is divided into two parts. In part A, we apply a neutral red phosphorescent ruthenium complex in PLED devices. In part B, We report the synthesis and characterization of two new host materials that can be used in blue phosphorescent OLED devices. We also report the fabrication and performance of the devices based on these materials. In part A, we doped a new neutral red Ru complex into either PVK or PF host and fabricated PLED devices based on these blends. We found that this Ru material performs pretty well in both PVK and PF systems. Furthermore, we introduced charge-transport materials/groups into PVK and PF system to improve the device efficiency and brightness. In part B, we have synthesized and characterized two novel host materials with rigid fluorene groups attached at the 3,6 position of a carbazole molecule. The fluorene groups can improve the thermal stability of carbazole while retain the higher T1 (lowest triplet excited state) energy. ii.
(5) 謝誌 研究所兩年一下子就過去了,在這期間很感謝週遭的人對我的幫 助。首先,特別感謝我的指導教授許慶豐老師兩年來的指導,在老師 嚴謹的教導下讓我獲益良多;在實驗室方面特別感謝學長姐(芳奕、 惠真、康哥、桂如、阿慶)不管是實驗上或是生活上的協助,讓我度 過許多難關;而同學(哈比人、雅嫻、月杏、俊竹、俊宏、巨人、立 民..等)與學弟妹(冷翰、阿川、阿魯咪、小七、阿坤、苓君...如果 有漏網之魚請原諒我)也為我的研究生涯增添了許多樂趣;千言萬語 盡在不言中,總之...謝謝大家兩年來對我的幫助與容忍(我承認我有 時候很 XX...哈哈)。. iii.
(6) 目. 錄. 中文摘要............................................................................................................................ i 英文摘要........................................................................................................................... ii 謝誌.................................................................................................................................. iii 目錄.................................................................................................................................. iv 圖目錄.............................................................................................................................. vi 表目錄.............................................................................................................................. ix 附圖目錄........................................................................................................................... x. A部分 第一章. 序論............................................................................................................. 1. 1.1 前言 ................................................................................................................ 1 1.1.1 有機小分子發光元件(OLED) .................................................................... 1 1.1.2 有機高分子發光元件(PLED)..................................................................... 3 1.1.3 有機電激發光元件的發光效率 ................................................................. 4 1.2 研究動機 ........................................................................................................ 7 第二章 2.1. 實驗............................................................................................................. 9 藥品............................................................................................................... 9. 2.2 使用儀器 ..................................................................................................... 10 2.3 元件結構(scheme 1).................................................................................... 11 第三章. 結果與討論............................................................................................... 12. 3.1. 導論............................................................................................................. 12. 3.2. PVK系統..................................................................................................... 14. 3.3. PF系統 ........................................................................................................ 18 iv.
(7) 3.4. PVK-PBD系統............................................................................................ 23. 3.5. PF-OXD系統 .............................................................................................. 25. 3.6. PF-TPA-OXD系統 ..................................................................................... 28. 第四章. 結論........................................................................................................... 33. 參考文獻......................................................................................................................... 34. B部分 第一章. 序論........................................................................................................... 36. 1.1 前言 .............................................................................................................. 36 1.2 研究動機 ...................................................................................................... 38 第二章. 實驗........................................................................................................... 39. 2.1. 藥品............................................................................................................. 39. 2.2. 使用儀器..................................................................................................... 39. 2.3. 性質量測..................................................................................................... 41. 2.4. 合成部份..................................................................................................... 43. 第三章. 結果與討論............................................................................................... 46. 3.1. 合成部份..................................................................................................... 46. 3.2. 熱性質-DSC和TGA測量 ............................................................................ 48. 3.3. 光學性質..................................................................................................... 51 3.3.1. 常溫-吸收/放射光譜 ........................................................................ 51. 3.3.2. 低溫磷光放射光譜........................................................................... 54. 3.4. 電化學性質................................................................................................. 56. 3.5. 元件電激發光性質..................................................................................... 59. 第四章. 結論........................................................................................................... 62. 參考文獻......................................................................................................................... 63. v.
(8) 圖. 目. 錄. 圖 A-1 OLED放光機制.................................................................................................. 2 圖 A-2 三層結構的OLED元件...................................................................................... 3 圖 A-3 主客發光體間的能量傳遞機制......................................................................... 6 圖 A-4 離子型Ru錯合物................................................................................................ 7 圖 A-5 Ru-1的吸收/放射光譜與PVK、PF的放射光譜 ............................................. 12 圖 A-6 各主發光體系統關係圖................................................................................... 13 圖 A-7 以0.1、0.5、1 mol%的Ru-1化合物摻雜在PVK中的PL圖譜 ....................... 15 圖 A-8 以0.1、0.5、1 mol%的Ru-1化合物摻雜在PVK中的EL圖譜 ....................... 15 圖 A-9 以PVK為主發光體的能階示意圖................................................................... 16 圖 A-10 以0.1、0.5、1 mol%的Ru-1化合物摻雜在PVK中的電流密度對操作電壓 作圖................................................................................................................... 16 圖 A-11 以0.1、0.5、1 mol%的Ru-1化合物摻雜在PVK中的電流密度對亮度 作圖. ............................................................................................................. 17. 圖 A-12 以0.1、2、4 mol%的Ru-1化合物摻雜在PF中的PL圖譜............................ 19 圖 A-13 以0.1、2、4 mol%的Ru-1化合物摻雜在PF中的EL圖譜 ........................... 19 圖 A-14 以PF為主發光體的能階示意圖.................................................................... 20 圖 A-15 以0.1、2、4 mol%的Ru-1化合物摻雜在PF中的電流密度對操作電 壓作圖(I-V) .................................................................................................... 21 圖 A-16 以0.1、2、4 mol%的Ru-1化合物摻雜在PF中的亮度對操作電壓作 圖(L-V) ........................................................................................................... 21 圖 A-17 以1 mol%的Ru-1化合物摻雜在PVK-PBD中的PL與EL圖譜 ..................... 23 圖 A-18 以1 mol%的Ru-1化合物摻雜在PVK-PBD中的電流密度與亮度對 操作電壓作圖(I-V-L) ................................................................................... 24 圖 A-19 以PF-OXD為主發光體的能階示意圖.......................................................... 26 vi.
(9) 圖 A-20 以2 mol%的Ru-1化合物摻雜在PF-OXD中的PL與EL圖譜圖.................... 26 圖 A-21 以2 mol%的Ru-1化合物摻雜在PF-OXD中的電流密度與亮度對操作 電壓作圖(I-V-L) ........................................................................................... 27 圖 A-22 以PF-TPA-OXD為主發光體的能階示意圖 ................................................. 29 圖 A-23 以2 mol%的Ru-1化合物摻雜在PF-TPA-OXD中的PL與EL圖譜............... 29 圖 A-24 以10 mol%的Ru-1化合物摻雜在PF-TPA-OXD中的PL與EL圖譜............. 30 圖 A-25 以2 mol%的Ru-1化合物摻雜在PF-TPA-OXD中的電流密度與亮度 對操作電壓作圖............................................................................................. 31 圖 A-26 以10 mol%的Ru-1化合物摻雜在PF-TPA-OXD中的電流密度與亮 度對操作電壓作圖......................................................................................... 31 圖 A-27. Ru-1化合物摻雜在PF系統主發光體(PF、PF-OXD、PF-TPA-OXD)中達 飽和紅光時的外部量子效率對電流密度作圖........................................... 32. 圖 B-1 CBP之結構 ....................................................................................................... 37 圖 B-2 FIrPic之結構..................................................................................................... 37 圖 B-3 能階比較圖....................................................................................................... 37 圖 B-4 mCP之結構....................................................................................................... 38 圖 B-5 UGH2之結構.................................................................................................... 38 圖 B-6 FIr6之結構........................................................................................................ 38 圖 B-7 IFC之TGA圖 .................................................................................................... 49 圖 B-8 PFC之TGA圖 ................................................................................................... 49 圖 B-9 IFC之DSC圖..................................................................................................... 50 圖 B-10 PFC之DSC圖................................................................................................... 50 圖 B-11 9-Phenyl -carbazole(PC)在THF溶液的UV-vis吸收/放射光譜 ..................... 52 圖 B-12 Isopropyl - carbazole(IC)在THF溶液的UV-vis吸收/放射光譜 .................... 52 圖 B-13 PFC在THF溶液UV-vis吸收/放射光譜.......................................................... 53 圖 B-14 IFC在THF溶液UV-vis吸收/放射光譜........................................................... 53 圖 B-15 IFC在2-methyltetrahydrofuran溶液的磷光放射光譜 .................................... 54 vii.
(10) 圖 B-16 PFC在2-methyltetrahydrofuran溶液的磷光放射光譜 ................................... 55 圖 B-17 IFC與isopropylcarbazole溶液態之CV圖 ....................................................... 57 圖 B-18 PFC與9-phenylcarbazole溶液態之CV圖 ....................................................... 58 圖 B-19 元件結構圖..................................................................................................... 59 圖 B-20 分別以mCP、IFC或PFC當作主發光體所製成元件的EL圖譜 .................. 60 圖 B-21 分別以mCP、IFC或PFC當作主發光體所製成元件的外部量子效率 與亮度對電流密度作圖................................................................................. 61. viii.
(11) 表. 目. 錄. 表 A-1 元件效率總整理................................................................................................32 表 B-1 PFC、IFC之熱性質 ......................................................................................... 48 表 B-2 IC、PC、IFC與PFC之UV-vis吸收與PL放射量測表.................................... 51 表 B-3 IFC、PFC、isopropylcarbazole與9-phenylcarbazole的溶液態氧化電 位起始值及HOMO、LUMO........................................................................... 57 表 B-4 元件效率總整理............................................................................................... 61. ix.
(12) 附. 圖. 目. 錄. 附圖 1. 9-isopropylcarbazole,化合物IC的1H-NMR光譜圖 .......................................65 附圖 2. 9-isopropyl-3,6-bis(9-phenyl-9H-fluoren-9-yl)-9H-carbazole , 化 合 物 IFC的1H-NMR光譜圖.......................................................................................66 附圖 3. 9-isopropyl-3,6-bis(9-phenyl-9H-fluoren-9-yl)-9H-carbazole,化合物 IFC的13C-NMR光譜圖......................................................................................67 附圖 4. 9-isopropyl-3,6-bis(9-phenyl-9H-fluoren-9-yl)-9H-carbazole , 化 合 物 IFC的MASS圖 ..................................................................................................68 附圖 5. 9-phenyl-3,6-bis(9-phenyl-9H-fluoren-9-yl)-9H-carbazole , 化 合 物 PFC的1H-NMR光譜圖......................................................................................69 附圖 6. 9-phenyl-3,6-bis(9-phenyl-9H-fluoren-9-yl)-9H-carbazole , 化 合 物 PFC的13C -NMR光譜圖....................................................................................70 附圖 7. 9-phenyl-3,6-bis(9-phenyl-9H-fluoren-9-yl)-9H-carbazole , 化 合 物 PFC的MASS圖..................................................................................................71. x.
(13) A 部分 紅色 Ru 磷光材料在 PLED 上的應用. 第一章. 序論. 1-1. 前言 進入二十一世紀的資訊時代,顯示器在人類的視覺感官與電子機械所 扮演的功能越顯的重要,傳統的陰極射線管(CRT)顯示技術以無法滿足市場 的要求,輕、薄、省電、高畫質的平面顯示器將成為本世紀的主流,有機 電激發光(Organic Electro Luminescence)顯示技術,被認為是下一世代的平 面顯示器主流技術;有機電激發光技術結合 LCD 與 LED 兩種技術的特性, 可應用於顯示器與照明光源兩方面;一般而言有機電激發光技術可分為兩 大 類 , 分 別 是 OLED(Organic Light-Emitting Diode) 與 PLED(Polymer Light-Emitting Diode),OLED 是以小分子有機材料為主的元件,PLED 則是 以高分子材料為主的元件,製程與元件表現各有其優缺點;關於驅動電路 模組方面;分為主動式與被動式。以下針對 OEL 相關技術與發展做一簡單 介紹。 1-1-1. 有機小分子發光元件(OLED) 小分子有機電激發光顯示技術起源於 1963 年 Pope 等人將高壓電流外加 anthracene 分子之單晶所產生之發光現象。到了 1987 年,Kodak 實驗室採 用蒸鍍方式,製作出含電子電洞傳遞層之有機薄膜元件,該元件具有 1%的 1.
(14) 外部量子效率(亮度為 1000cd/m),在特性獲得大幅改善的情形下而備受矚 目。小分子系統目前仍是以美國 Kodak 公司為首。 一般 OLED 有機電激發光的原理如圖 A-1 所示,當對元件施加一正向 電壓時,電洞由陽極注入,電子由陰極注入,分別經過電洞傳輸層(hole transport material)與電子傳輸層(electron transport material)後在兩層的介面 再結合,行成光激子(exciton),光激子是一種具有高能量且不穩定的粒子, 會迅速由激發態回到激態,並將其落差能量以光或熱的形式釋放出來,而 達到發光的功能。. 圖 A-1 OLED 放光機制 而隨著 OLED 技術的成熟與進步,最常見的元件結構則是在電洞傳輸 層(hole transport material)與電子傳輸層(electron transport material)之間加入 一層發光層,如圖 A-2 所示,使得電子與電洞在發光層再結合,藉此來調 控元件的光色。. 2.
(15) 圖 A-2 三層結構的 OLED 元件 自 90 年代以來,OLED 已引起包括學術界及產業界的矚目,嚴然已將 它視為未來顯示器的代名詞。而近年來,由於在元件製作、封裝技術及材 料的研發各方面長足的發展,使得國內外各研發機構和哥家大廠陸續投入 這方面的研究開發與生產,在在皆證明了其在顯示器市場上的競爭能力和 潛力,尤其是自 1997 年後日本 Pioneer 先將 OLED 應用於汽車音響面板上, 隨後再將 Motorola 合作將產品應用於手機面板上,證明其應用於可攜式電 子資訊產品的可行性。 1-1-2. 有機高分子發光元件(PLED) 高分子 OEL 元件,或稱為 PLED(Polymer Light Emitting Diodes),是以 共軛性高分子(Conjugated Polymer)為材料之發光元件。PLED 與 OLED 最大 的差異在於 PLED 的發光層是由高分子所構成;而高分子發光二極體 3.
(16) (polymer light emitting diode,PLED)的發展可追朔至 1990 年英國劍橋大學 Cavendish 實驗室的 J. H. Burroughes 等人發現 PPV 共軛高分子(conjugated polymer)也俱備電激發光的特性,也因此使 PLED 元件也被廣為研究;在 製程方面 PLED 因為高分子之成膜性佳可以採用傳統的旋轉塗佈成膜 (spin-coating)適合大面積的基材。日前也成功的發展出噴墨(ink-jet printing) 技術製作全彩的顯示器,新材料的陸續研發,單色及多彩量產技術漸趨成 熟,目前則朝向 LTPS(low temperature poly-silicon)TFT 驅動全彩 PLED 技 術開發,相信不久即將會有全彩 PLED 商品問世。一般而言 PLED 具有下 列特性:(1)低溫製程,可製作在任何基板如 ITO,可橈式基板、(2)自發光且 可設計發出各種顏色的光、(3)薄膜元件,適合大面積的基板上、(4)高應答 速度(<us)、(5)RGB 元件皆可製作、(6)低操作電壓(<10V)、(7)高流明效率 (>10lm/W)、高亮度、自發光、廣視角、(8)製程簡單、具有低成本。目前國 內有翰立光電、錸寶光電投入生產高分子發光元件。. 1-1-3. 有機電激發光(Organic Electro Luminescence) 元件的發光效率 當分子吸收可見光或紫外光形式的輻射能,其過程前後的能量差值主 要將以螢光和磷光兩種不同的能量形式釋出。螢光是激發單重態經輻射躍 遷失活至基態所放出的能量,磷光是激發三重態經輻射躍遷失活至基態所 放出的能量。由於自旋禁阻(spin-forbidden)的限制,在螢光電激發光元件中, 被電子、電洞再結合而激發的激發三重態都以非輻射的方式失活,所以元 4.
(17) 件的內部效率理論上最大值為 25 % ,這大大的限制了元件的外部發光量子 效率( < 5 %),因此如果能充份利用激發三重態(佔激發總數的 75 %)發光, 減少非輻射躍遷的機率,將會有很好的效果。磷光材料發光過程是由發光 分子的激發單重態經系間跨越(intersystem crossing)到激發三重態,當它們回 到基態時放出相對應的輻射光波,所以對 25 %內量子效率的限制不再存 在,理論上可使內部量子效率提高至接近 100 %。 整體來說,磷光電激發光充分利用了激發三重態的能量,可以有效的 提高有機電激發光元件的外部量子效率,是很有競爭力的發光材料,有著 廣闊的應用前景。但是磷光有機電激發光材料仍有其不足之處,首先是在 室溫下磷光材料較少,材料的選擇範圍比螢光材料小很多;再者,磷光三 重激發態生命期較長且磷光染料在高電流密度下由於存在三重態—三重態 驟熄(triplet – triplet annihilation)而使發光飽和,導致元件的效率下降;最 後,值得注意的是環境氧對三重態的驟熄作用,因為基態氧也是三重態, 它對激發三重態有強烈的驟熄能力,不加以保護就會影響元件的發光強度 和壽命。近幾年來,科學家們發現經由將高效率的磷光染料掺雜在主體材 料中,通過激發子將能量從主體傳遞到染料中心使染料發光,可以得到高 效率的電激發光元件(圖 A-3)。最好的掺雜物(dopant)是含重原子的磷光染 料,由於重原子的存在使得電子自旋—軌道耦合作用(spin-orbital coupling) 加強,可以有效地混合單重態和三重態,並增加 S1→T1 系間穿越(intersystem crossing)的機率和增強磷光放出,這個現象稱為”重原子效應”。除此之外, 5.
(18) 相對於原本的磷光染料,重原子的加入也顯著地減低了三重激發態生命期。. 圖 A-3 主客發光體間的能量傳遞機制. 在一般螢光的 OLED 系統中,因為其本身量子力學上的關係,使得僅 能利用到 25%單重激發態能階來放光 1,為了進一步利用剩餘未放光的三重 激發態,近年來一些具有重金屬原子化合物的磷光分子有相當大的發展, 因為此類具有重金屬原子中心(例如 Ir、Pt、Os、Re)的磷光化合物. 2~7. 能充. 分利用單重與三重激發態的全部能量 8,其中又以 Iridium 化合物的發展最 佳,目前 Iridium 化合物在 RGB 三原色的發展上都已得到長足的進步。雖 然在元件的效率與光色上 Ir 化合物的表現極佳,但 Iridium 此金屬本身極 為昂貴,因此在商業化的過程中,需付出較高的材料成本;而 Ruthenium 相對之下較便宜,因此如果在元件上能得到不錯的光色與效率,在商業化 的過程中會較具有競爭力,也比較可行。. 6.
(19) Ru 錯合物被用來製備固態放光電化學電池(solid state light emitting electrochemical cells, LECs)9~14 已有一段時間;而在電激發光的領域,一些 離子型的 Ruthenium 錯合物(圖 A-4)也已被應用於 PLED 的元件 15~18。. N. N. +2 N Ru. N N. N. ClO4+2. [Ru(4,7-Ph2-phen)3]. 2. (ClO4-)2. 圖 A-4 離子型 Ru 錯合物 PLED 與 OLED 的最大的差異在於 OLED 需要用真空蒸鍍製備元件, 而 PLED 可在室溫及常壓利用旋轉塗佈(spin-coating)或是噴墨印刷(in-jet printing)來製備元件,因此在製程上較簡單也較便宜,且在大尺寸面板的製 造上較具發展潛力。. 1-2. 研究動機 目前應用於 PLED 的 Ru 化合物皆為離子性的錯合物,且還無法得到一 飽和的紅光;離子性的錯合物在以往的文獻中因為主客發光體的相容性問 題,所以僅能摻雜在主鏈非共軛的 poly(vinylcarbazole)(PVK)中才能得到較 好的元件效率,一旦摻雜進主鏈共軛的 polyfluorene(PF)或是其衍生物,則 會使元件效率大幅降低;這可能因為 PF 和離子性 Ru 錯合物的化學相容性 相差甚大,使得兩者相混合後無法得到一均勻分散的薄膜,導致元件性能 不佳。. 7.
(20) 因此,在本論文中嘗試以一新型中性的 Ru 紅光材料摻雜進 PVK 和 PF 中,製成 PLED 元件來比較其元件的結果,希望此中性分子在 PF 中的元件 表現能有重要改善。此外,為了改善元件內電荷的傳輸平衡,進一步將電 荷傳輸官能團導入主發光體系統中,以提升元件發光效率及亮度。. 8.
(21) 第二章 實驗 2-1. 藥品 PEDOT. 購自 台灣拜耳. PBD. 購自 TCI. PVK. 購自 Aldrich. TPBI. 得自本實驗室. PF. 得自本實驗室. PF-OXD. 得自本實驗室. PF-TPA-OXD. 得自本實驗室. Ru-1. 得自季昀老師實驗室. ITO glass. 購自 默克. 9.
(22) 2-2. 使用儀器 2-2-1. 螢光儀 (Fluroescence Spectroscopy) 使用 Hitachi F-4500 的螢光儀。 2-2-2. 曝光機 型號:US101,燈管功率為 1000 瓦,七貿股份有限公司。 2-2-3. 高真空蒸鍍機 型號:Auto 168(Junsun Tech co., LTD)。 2-2-4. 元件測量 使用 Keithley 2400 Souce meter 與 Newport 公司所生產的 818ST silicon photodiode 搭 配 2835C Optical meter , 而 其 量 測 之 基 本 原 理 為 silicon photodiode 會偵測元件所放出的所有光能並將光能轉換成電能,因此可由電 能的大小得知元件所放出的光能或是亮度。. 10.
(23) 2-3. 元件結構(scheme1) 1000nm 30nm. F 3C. P. N. N. N Ru. 35nm. N. N N. P. CF3. Ru(iq-CF3-pz)2(PPh2Me)2. Ru-1. N. N. N. N. N. O N N. N. PBD. TPBI * O. S. Host:PVK、PVK-PBD、PF、. * n. O. n. SO3H. PEDOT. PF-OXD、PF-TPA-OXD. PSSA. n N. C8H17. C8H17. n. PF. PVK t-Bu. t-Bu n-Bu. O. N N. O. N. N. N. n-Bu. N. n-Bu. n-Bu. X C8H17. C8H17. X=n, Y=n PF-TPA-OXD X=n, Y=0 PF-OXD 11. Y C8H17. C8H17.
(24) 第三章 結果與討論 3-1. 導論 本篇論文以一非離子型的 Ru-1 化合物(如 scheme1 所示)作為客發光 體,此 Ru-1 化合物的吸收光譜與 PVK 或 PF 放射光譜都有不錯的重疊性(圖 A-5),所以理論上應該都會有不錯的能量轉移機制存在。 大致上,可以將本實驗的主發光體分為兩大系統(圖 A-6),一個是以 PVK 為首的系統,另一個則為以 PF 為首的系統。將此 Ru-1 化合物摻雜進 五種主發光體中,比較其元件的結果;並藉由比較、研究其光激發與電激 發的發光行為,來了解元件磷光的產生機制。. Ru PVK PF. 1.0. 0.8. 0.8. 0.6. 0.6. 0.4. 0.4. 0.2. 0.2. 0.0. 0.0. 300. 400. 500. 600. 700. 800. Wavelength (nm). 圖 A-5. Ru-1 的吸收/放射光譜與 PVK、PF 的放射光譜. 12. PL Intensity (a.u.). Absorption (OD). 1.0.
(25) 圖 A-6 各主發光體系統關係圖. 一開始,分別以 PVK 和 PF 為主發光體去製作元件,發現此 Ru-1 化合 物在 PF 中的效率表現並不遜於在 PVK 的系統中,兩者之間的效率差異很 小,這樣的結果證明此中性的 Ru-1 化合物不僅在 PVK 系統中適用,在 PF 為主發光體的系統中也適用。 為了進一步改善元件的發光效率,在以 PVK 為主發光體的系統中, 加入了 2-(4-biphenylyl)-5-(4-tert-butylphenyl)-1,3,4-oxadiazole (PBD)來彌補 其電子傳輸能力的不足;而在 PF 系統中,將主發光體改成側鏈具有電子傳 輸官能團 oxadiazole(OXD)的 PF-OXD19 或進一步導入 triphenyl-amine(TPA) 側鏈來得到兼具電子與電洞傳輸能力的 PF-TPA-OXD20(如 scheme1 所示); 希望這些官能團的導入能提升整體元件的電荷再結合效率,進而提高元件 的電激發光特性。 13.
(26) 3-2.. PVK 系統 以 1mol% (相對於 PVK 主鏈的重複單元)的 Ru-1 化合物摻雜在 PVK 中. 時,在 PL 圖譜(圖 A-7)上仍可見到主發光體(PVK)的放光,然而此濃度的 EL 圖譜(圖 A-8)卻已經看不到任何 PVK 的放光,此時主要放光都是來自 於客發光體的飽和紅光。這可能是因為在電場作用下,電荷能直接被捕捉 在客發光體上,並與相反電性的載子再結合形成激發激子(exciton)後放 光,即電荷捕捉(charge trapping)效應。21-23 參照主、客發光體的能階圖(圖 A-9)後可發現 PVK 的 HOMO 能階 (highest occupied molecular orbital)(5.8 eV)較 Ru-1 化合物的 HOMO 能階 (5.0 eV)來的低,所以當電洞從陽極注入後,有可能會被客發光體所捕捉侷 限在其 HOMO 能階上,待與電子結合形成激發激子(exciton)而放光。因此 藉由能量轉移與電荷捕捉機制加成的結果,最後在 EL 上看不到 PVK 的放 光,進而得到一飽和的紅光。. 14.
(27) 0.1 mol% 0.5 mol% 1 mol% 1.0. PL Intensity (a.u.). 0.8. 0.6. 0.4. 0.2. 0.0. 300. 400. 500. 600. 700. 800. Wavelength(nm). 圖 A-7. 以 0.1、0.5、1 mol%的 Ru-1 化合物摻雜在 PVK 中的 PL 圖譜. 13v. 0.1 mol% 0.5 mol% 1 mol%. 1.0. EL Intensity (a.u.). 0.8. 0.6. 0.4. 0.2. 0.0. 300. 400. 500. 600. 700. 800. Wavelength(nm). 圖 A-8. 以 0.1、0.5、1 mol%的 Ru-1 化合物摻雜在 PVK 中的 EL 圖譜. 15.
(28) 圖 A-9 以 PVK 為主發光體的能階示意圖. 0.1 mol% 0.5 mol% 1 mol%. 2. Current Density (mA/cm ). 50. 40. 30. 20. 10. 0. 6. 8. 10. 12. 14. 16. 18. 20. 22. 24. Voltage (V). 圖 A-10 以 0.1、0.5、1 mol%的 Ru-1 化合物摻雜在 PVK 中的電流密度對操 作電壓作圖. 16.
(29) 0.1 mol% 0.5 mol% 1 mol%. 2. Luminescence (cd/m ). 1500. 1000. 500. 0 6. 8. 10. 12. 14. 16. 18. 20. 22. 24. Voltage (V). 圖 A-11 以 0.1、0.5、1 mol%的 Ru-1 化合物摻雜在 PVK 中的亮 度對操作電壓作圖 從電流密度對操作電壓的作圖中(圖 A-10)發現,隨著客發光體濃度的 增加,驅動電壓會有明顯的提升,這是因為被侷限在客發光體的電洞能在 發光層內產生正電場,此正電場會抑制電洞從陽極注入,因此需要較高的 操作電壓才能使電洞繼續進入發光層。 在元件效率方面,客發光體濃度為 1 mol%時可得到一飽和紅光,其 C.I.E 座標為(0.66 , 0.33),最大亮度可達 1153 (cd/m2) 左右(圖 A-11),而外 部量子效率則隨者客發光體的濃度增加而上升,在 1 mol%時可達到 3.20 %。. 17.
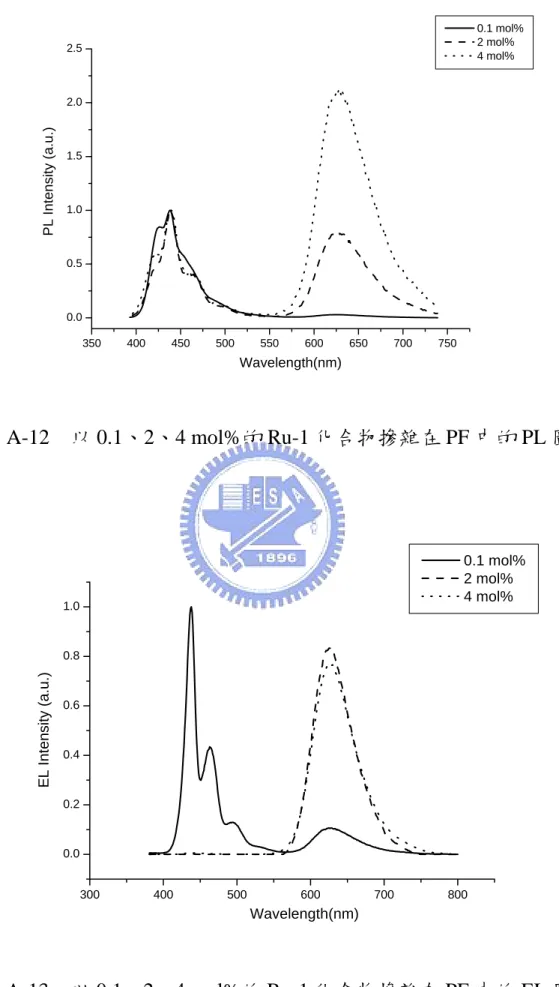
(30) 3-3.. PF 系統. 以 polyfluorene(PF)為主發光體,客發光體濃度 2 mol%時,在 PL 的圖 譜(圖 A-12)上,主發光體(PF)的貢獻仍然高於客發光體(Ru-1),即使客發光 體濃度增加到 4 mol%,主發光體的放光仍很明顯,這樣的結果與 PVK 系統 (圖 A-7)相較之下,顯示 Ru-1 在 PF 系統中的能量轉移是較差的,這可能是 因為 PF 其激發態的生命週期(life time)比 PVK 的激發態生命周週期短,使 得能量轉移的機率較低,造成較差的能量轉移效率。 雖然非離子型 Ru-1 化合物在 PF 中的能量轉移效率比在 PVK 差,但是 與文獻上離子型 Ru 化合物摻雜在 PF 中的能量轉移效率相比. 15~18. ,已有很. 顯著的改善;從文獻圖中可發現 15,即使在 PF 中摻雜很高濃度的客發光體, 但在 PL 上的放射光仍以 PF 為主;相比之下,從本篇論文的實驗結果可發 現,在 PF 系統的 PL 圖譜中,隨著客發光體濃度增加,由客發光體 Ru-1 所貢獻的紅光強度有明顯的增加 (圖 A-12) ,顯示 Ru-1 與 PF 的相容性的 確有顯著的提升。. 18.
(31) 0.1 mol% 2 mol% 4 mol%. 2.5. PL Intensity (a.u.). 2.0. 1.5. 1.0. 0.5. 0.0 350. 400. 450. 500. 550. 600. 650. 700. 750. Wavelength(nm). 圖 A-12. 以 0.1、2、4 mol%的 Ru-1 化合物摻雜在 PF 中的 PL 圖譜. 0.1 mol% 2 mol% 4 mol%. 1.0. EL Intensity (a.u.). 0.8. 0.6. 0.4. 0.2. 0.0. 300. 400. 500. 600. 700. 800. Wavelength(nm). 圖 A-13. 以 0.1、2、4 mol%的 Ru-1 化合物摻雜在 PF 中的 EL 圖譜. 19.
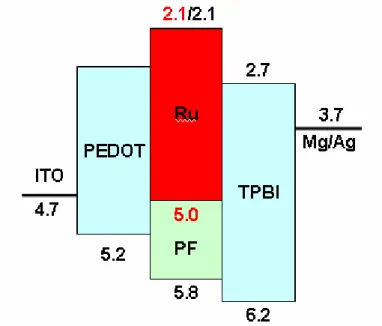
(32) 圖 A-14 以 PF 為主發光體的能階示意圖. 從 PL 與 EL 圖譜(圖 A-12、13)的比較中可發現,以 PF 為主發光體,Ru-1 濃度為 2 mol%時,在 PL 上能量轉移上並不完全,仍可發現主發光體 PF 的 放光,然而在 EL 圖譜上已得到全部來自客發光體的飽和紅光,這種差異主 要是由電荷捕捉效應所造成;因為 PF 的 HOMO 能階與 PVK 的 HOMO 的 能階相似(5.8 eV),且都比 Ru-1 化合物(5.0 eV)低了 0.8 eV,因此理論上跟 PVK 會有相似的電荷捕捉現象發生。(圖 A-14). 20.
(33) 0.1 mol% 2 mol% 4 mol%. 2. Current Density (mA/cm ). 80. 60. 40. 20. 0 6. 8. 10. 12. 14. 16. 18. 20. Voltage (V). 圖 A-15 以 0.1、2、4 mol%的 Ru-1 化合物摻雜在 PF 中的電流密度對操作 電壓作圖(I-V). 0.1 mol% 2 mol% 4 mol%. 1200. 2. Luminescence (cd/m ). 1000. 800. 600. 400. 200. 0 6. 8. 10. 12. 14. 16. Voltage (V). 圖 A-16 以 0.1、2、4 mol%的 Ru-1 化合物摻雜在 PF 中的亮度對操作電壓 作圖(L-V) 21.
(34) 分別比較以 PVK 和 PF 為主發光體時的效率(圖 A-16),發現當 EL 上得 到一完全來自於客發光體的飽和紅光時,兩個系統的最大亮度與外部量子 效率相近(Ru-1 在 PVK 中 1 mol%時為 1148 cd/m2 與 3.2%;Ru-1 在 PF 中 2 mol%時為 1002 cd/m2 與 3.7 %),這樣的結果跟過去的文獻相比較已經獲得 相當大的改善,因為過去以離子性 Ru-1 錯合物為客發光體摻雜進 PF 中時, 元件的效率都極差,這可能是因為主客發光體間的相容性不佳,導致相分 離,而使元件效率變差;如今以此新型中性的 Ru-1 化合物作為客發光體, 已經使這個問題獲得相當大的改善。 除此之外,當比較在兩個主發光體(PVK、PF)中能量完全轉移時,其元 件的電流密度對操作電壓(I-V)做圖後(圖 A-10、15)發現,以 PF 當作主發光 體的驅動電壓會比以 PVK 當作主發光體來的低,這可能是因為 PF 本身是 一個共軛高分子,而 PVK 只是非共軛高分子,因此 PF 的導電性較佳,也 使得所需的驅動電壓較低,這對於元件來說是一個較佳的現象。. 22.
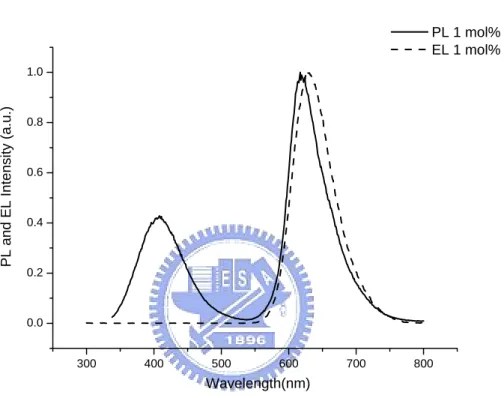
(35) 3-4.. PVK-PBD 系統 因為 PBD 本身為一個電子傳輸的材料,因此加入 PBD 到主發光體. 中,會幫助電子的注入,使電洞與電子的再結合效率提升,進而提高整體 元件的效率。. PL 1 mol% EL 1 mol%. PL and EL Intensity (a.u.). 1.0. 0.8. 0.6. 0.4. 0.2. 0.0. 300. 400. 500. 600. 700. 800. Wavelength(nm). 圖 A-17. 以 1 mol%的 Ru-1 化合物摻雜在 PVK-PBD 中的 PL 與 EL 圖譜. 加入 PBD 後 PL(圖 A-14)與 EL(圖 A-17)圖譜的形狀與相對位置並未受 到影響,其相互間的變化與未加入 PBD 時差不多,但是其元件亮度及效率 卻增加了近兩倍。此元件的最大亮度可達 2216 cd/m2 左右(圖 A-18),而外 部量子效率從未加 PBD 時的 3.20%提升到 5.16%。,可見加入 PBD 此一電 子傳輸材料確實彌補了 PVK 電子傳輸能力不足的缺點,增加電子注入發光 層,也使得電荷結合較平衡,因而最後得到較佳的元件效率。 23.
(36) 80. 1500. 60. 1000. 40. 500. 20. 2. 2000. Current Density (mA/cm ). 100. 2. Brightness (cd/m ). 2500. 0. 0 0. 2. 4. 6. 8. 10. 12. 14. 16. 18. 20. 22. 24. 26. Voltage (V). 圖 A-18 以 1 mol%的 Ru-1 化合物摻雜在 PVK-PBD 中的電流密度與亮度對 操作電壓作圖(I-V-L). 24.
(37) 3-5.. PF-OXD 系統 PF-OXD 此高分子是以非共軛的方式導入 oxadiazole(OXD)官能團於. PF 的側鏈上。因為 oxadiazole 本身為電子傳遞的材料,因此能幫助電子的 注入與傳遞,使得元件中的電荷結合較平衡,進而提高整個元件的效率; 而將 OXD 以化學性鍵結在高分子鏈上,能夠避免以物理性摻混所導致的相 分離現象,進而提升元件操作的穩定性。 從元件結果中可以發現,客發光體濃度為 2 mol%時,在 EL(圖 A-20) 光譜中就已見不到 PF-OXD 的放光,然而在 PL 光譜(圖 A-20)中仍有明顯主 發光體的放光,其能量轉移效率與 Ru-1(2 mol%)在 PF 中的情況相似;因為 導入 OXD 並未改變主發光體的 HOMO 能階(圖 A-19),因此造成以 PF-OXD 為主發光體時也會有電荷捕捉的現象發生。 與 Ru-1 在 PF 系統時相比較,Ru-1 在 PF-OXD 系統的元件效率(圖 A-21)有很大的改善;以此帶有 OXD 官能團的 PF-OXD 做為主發光體,元 件的亮度與外部量子效率可達到 1652 cd/m2、4.93 %,與 PF 系統比較已明 顯有所提升,可見此電子傳輸基團的導入確實對整個元件效率有正面的幫 助。. 25.
(38) 圖 A-19 以 PF-OXD 為主發光體的能階示意圖. PL-2 mol% EL-2 mol%. PL and EL Intensity (a.u.). 1.0. 0.8. 0.6. 0.4. 0.2. 0.0. 250. 300. 350. 400. 450. 500. 550. 600. 650. 700. 750. 800. 850. Wavelength(nm). 圖 A-20 以 2 mol%的 Ru-1 化合物摻雜在 PF-OXD 中的 PL 與 EL 圖譜. 26.
(39) 1600. 70 2. 80. 1400. 60. 2. Brightness (cd/m ). Current Density (mA/cm ). 1800. 1200 50 1000 40 800 30 600 20. 400. 10. 200. 0. 0 0. 2. 4. 6. 8. 10. 12. 14. 16. 18. 20. Voltage (V). 圖 A-21 以 2 mol%的 Ru-1 化合物摻雜在 PF-OXD 中的電流密度與亮度對操 作電壓作圖(I-V-L). 27.
(40) 3-6.. PF-TPA-OXD 系統 PF-TPA-OXD 此高分子除了導入 OXD(oxadiazole)作為側鏈幫助電子注. 入,還導入 TPA(triphenyl-amine)作為側鏈幫助電洞的傳輸,期望使整個元 件的電荷傳輸較平衡,並提高元件的電流密度與亮度。 比較 PL 的圖譜(圖 A-12、23)後發現,將 Ru-1 以 2 mol%摻雜在 PF-TPA-OXD 中的 PL 圖譜與摻雜在 PF 中差異不大,但是在 EL 的圖譜(圖 A-13、24)上卻有極大的差異;以 2 mol%的 Ru-1 摻雜在 PF-TPA-OXD 中所 得到的 EL 光譜,仍可看見明顯主發光體的放光,然而以 PF 為主發光體時, Ru-1 的濃度僅需 2 mol%,在 EL 上(圖 A-13)即可完全由客發光體放光。 以 PF-TPA-OXD 為主發光體時,客發光體濃度需要增加到 10 mol%, 在 EL 上(圖 A-24)才會完全是客發光體放光;這主要是因為導入 TPA 使整 個高分子材料的 HOMO(5.3 eV)提高(圖 A-22),這樣的結果會直接影響元件 中主、客發光體的電荷捕捉效應;PF-TPA-OXD 的 HOMO 與 Ru-1 化合物 的 HOMO 只有相差 0.3 eV,這個值明顯小於其他幾個高分子主發光體(ex: PVK、PF、PF-OXD)與 Ru-1 化合物之間的 HOMO 差(0.8 eV),因此當電洞 進入到客發光體後要克服能障跳出來主發光體的機率會比較高;換句話 說,使用 PF-TPA-OXD 為主發光體時,電荷捕捉的效應應該會比其他幾個 高分子差,這樣的結果造成需要摻雜比較高濃度的客發光體(10 mol%)才能 使能量轉移完全,進而得到飽和的紅光。 能階的差異所造成的影響,還可以在相同濃度下的驅動電壓比較中發 28.
(41) 現:分別比較以 2 mol%的 Ru-1 化合物摻雜在 PF-OXD 與 PF-TPA-OXD 中 的電流密度對電壓(I-V)圖(圖 A-21、25)可發現,PF-TPA-OXD 的驅動電壓 較 PF-OXD 低,這顯示相同濃度下的 Ru-1 在 PF-TPA-OXD 中的電荷捕捉效 應較小,這樣的結果與之前所提到的能階關係相符。. 圖 A-22 以 PF-TPA-OXD 為主發光體的能階示意圖. PL-2 mol% EL-2 mol%. 1.6. PL or EL Intensity (a.u.). 1.4 1.2 1.0 0.8 0.6 0.4 0.2 0.0 -0.2 300. 400. 500. 600. 700. 800. Wavelength(nm). 圖 A-23. 以 2 mol%的 Ru-1 化合物摻雜在 PF-TPA-OXD 中的 PL 與 EL 圖譜. 29.
(42) PL-10 mol% EL-10 mol%. PL or EL Intensity (a.u.). 1.0. 0.8. 0.6. 0.4. 0.2. 0.0. 300. 400. 500. 600. 700. 800. Wavelength(nm). 圖 A-24. 以 10 mol%的 Ru-1 化合物摻雜在 PF-TPA-OXD 中的 PL 與 EL 圖 譜. 從整體結果來看,在 PF 上導入 TPA 官能團雖然需要較高的摻雜濃度 才能在元件 EL 上獲得一來自於客發光體 Ru-1 的飽和紅光,但是在最後的 元件效率中(圖 A-26),因為整體元件的電荷較平衡,電流密度較大,因而 使效率提升。 分別比較 Ru-1 化合物在 PF、PF-OXD、PF-TPA-OXD 三個主發光體中 的效率可發現(表 A-1,圖 A-27 ),隨著在主發光體上導入電子或(與)電洞傳 輸官能團,確實會使最後整體的元件效率提高,也達到預期的效果。. 30.
(43) 3000. 2. 200. 2. Brightness (cd/m ). 2500. Current Density (mA/cm ). 250. 2000 150 1500 100 1000. 50. 500. 0. 0 0. 2. 4. 6. 8. 10. 12. 14. 16. 18. 20. Voltage (V). 圖 A-25 以 2 mol%的 Ru-1 化合物摻雜在 PF-TPA-OXD 中的電流密度與亮 度對操作電壓作圖. 80 2000. 2. Current Density (mA/cm ). 70. 2. Brightness (cd/m ). 60 1500 50 40 1000 30 20. 500. 10 0. 0 4. 6. 8. 10. 12. 14. 16. 18. 20. 22. 24. Voltage (V). 圖 A-26 以 10 mol%的 Ru-1 化合物摻雜在 PF-TPA-OXD 中的電流密度與亮 度對操作電壓作圖 31.
(44) PF 2 mol% PF-OXD 2 mol% PF-TPA-OXD 10 mol%. External Quantum Efficiency (%). 7. 6. 5. 4. 3. 2. 1. 0 0. 5. 10. 15. 20. 25. 30. 35. 40. 45. 50. 55. 60. 2. Current Density (mA/cm ). 圖 A-27. Ru-1 化合物摻雜在 PF 系統主發光體(PF、PF-OXD、PF-TPA-OXD) 中達飽和紅光時的外部量子效率對電流密度作圖. 表 A-1 元件效率總整理. 1 mol% in PVK 1 mol% in PVK-PBD 2 mol% in PF 2 mol% in PF-OXD 2 mol% in PF-TPA-OXD 10 mol% in PF-TPA-OXD. Turn-on. Max brightness. Max E.Q.E.. Max L.E.. λmax. C.I.E. voltage(V). (cd/m2). (%). (cd/A).. (nm). (x , y). 14.8. 1148(@25v). 3.20. 3.33. 632. 0.66 , 0.33. 8.86. 2216(@23v). 5.16. 5.44. 630. 0.67 , 0.33. 8.24. 1002(@14v). 3.67. 4.51. 628. 0.67 , 0.33. 8.99. 1652(@17v). 4.93. 5.33. 630. 0.66 , 0.33. 6.88. 2720(@15.5v). 3.42. 3.88. 630. 0.57 , 0.33. 7.99. 2065(@22v). 6.55. 7.03. 632. 0.66 , 0.33. Max E.Q.E:maximum external quantum efficiency (%) Max L.E.:maximum luminance efficiency (cd/m2). 32.
(45) 第四章 結論 本論文中所選用的 Ru-1 化合物為一中性的客發光體材料,除了以 PVK 為主發光體外,也嘗試以 PF 與其衍生物為主發光體去製備 PLED 元件;從 結果中可以發現此中性的 Ru-1 化合物不僅可用 PVK 當作主發光體,在以 PF 和其衍生物為主發光體的系統中亦有不錯的效率表現,此一結果已改善 了過去文獻中以離子型 Ru 錯合物作為客發光體時所遇到的問題,因此,此 中性的材料可能在 PVK 或 PF 的系統中都有不錯的化學相容性。 接著針對主發光體去做修飾,在以 PVK 為主發光體的系統中混摻了 PBD,使得電子較易注入,來提高發光效率;而在以 PF 為主發光體的系統 中,分別以 PF-OXD 和 PF-TPA-OXD 為主發光體,希望增加電荷的注入與 傳輸,並提升電子與與電洞的再結合率,進而提高元件效率;從元件結果 來看,也確實得到了高效率的紅光元件。 在本實驗中,成功整合了 PLED 與磷光材料的優點得到了一高效率、 低成本、飽和且應用性較寬廣的 Ru 紅光 PLED 元件。. 33.
(46) 參考文獻 1. Klessinger, M.; Michl, J. Excited States and Photochemistry of Organic Molecules; VCH: New York, 1995. 2. Baldo, M. A.; Lamansky, S.; Burrows, P. E.; Thomson, M. E.; Forrest, S. R. Appl. Phys. Lett. 1999, 75, 4. 3. Adachi, C.; Baldo, M. A.; Forrest, S. R.; Lamansky, S.; A.; Thompson, M. E.; Kwong, R. C. Appl. Phys. Lett. 2001, 78, 1622. 4. Mcgehee, M. D.; Bergstedt, T.; Zhang, C.; Saab, A. P.; O’Regan, M. B.; Bazan, G. C.; Srdanov, V. I.; Heeger, A. J. Adv. Mater. 1999, 11, 1349. 5. Lee, C. L.; Lee, K. B.; Kim, J. J. Appl. Phys. Lett. 2000, 77, 2280. 6. Yang, M.-J.; Tsutsui, T. Jpn. J. Appl. Phys. 2000, 39, L828. 7. Gong, X.; Robinson, M. R.; Ostrowski, J. C.; Moses, D.; Bazan, G. C.; Heeger, A. J. Adv. Mater. 2002, 14, 581. 8. Adachi, C.; Baldo, M. A.; Thompson, M. E.; Forrest, S. R. J. Appl. Phys. 2001, 90, 5048. 9. Kalyuzhny, G.; Buda, M.; McNeill, J.; Barbara, P.; Bard, A. J. J. Am. Chem. Soc. 2003, 125, 6272. 10. Rudmann, H.; Shimada, S.; Rubner, M. F. J. Appl. Phys. 2003, 94, 115. 11. Liu, C.-Y.; Bard, A. J. J. Am. Chem. Soc. 2002, 124, 4190. 12. Rudmann, H.; Shimada, S.; Rubner, M. F.; Oblas, D. W.; Whitten, J. E. J. Appl. Phys. 2002, 92, 1576. 13. Rudmann, H.; Shimada, S.; Rubner, M. F. J. Am. Chem. Soc. 2002, 124, 4918. 14. Rudmann, H.; Rubner, M. F. J. Appl. Phy. 2001, 90, 4338. 15. Xia, H.; Zhang, C.; Liu, X.; Qiu, S.; Lu, P.; Shen, F.; Zhang, J.; Ma, Y. J. 34.
(47) Phys. Chem. B, 2004, 108, 3185. 16. Xia, H.; Zhang, C.; Qiu, S.; Lu, P.; Zhang, J.; Ma, Y. Appl. Phys. Lett. 2004, 84, 290. 17. Yang, J.; Gordon, K. C. Chem. Phys. Lett. 2003, 372, 577. 18. Yang, J.; Gordon, K. C. Chem. Phys. Lett. 2004, 385, 481. 19. Wu, F.-I.; Reddy, D. S.; Shu, C.-F.; Liu, M. S.; Jen, A. K.-Y. Chem. Mater. 2003, 15, 269. 20. Shu, C.-F.; Dodda, R.; Wu, F.-I; Liu, M. S.; Jen, A. K.-Y. Macromolecules, 2003, 36, 6698. 21. Lane, P. A.; Palilis, L. C.; O’Brien, D. F.; Giebeler, C.; Cadby, A. J.; Lidzey, D. G.; Campbell, A. J.; Blau, W.; Bradley, D. D. C. Phys. Rev. B 2001, 63, 235206. 22. Yang, X. H.; Neher, D.; Scherf, U.; Bagnich, S. A.; Bässler, H. J. Appl. Phys. 2003, 93, 4413. 23. Gong, X.; Ostrowski, J. C.; Moses, D.; Bazan, G. C.; Heeger, A. J. Adv. Funct. Mater. 2003, 13, 439.. 35.
(48) B 部分 藍色有機磷光主發光體材料研究. 第一章. 序論. 1-1. 前言 有機磷光發光材料(Organic phosphorophores )近來已經成為有機發光 二極體(Organic Light-Emitting Diode;OLED)發展中相當重要的一環,原因 在於一般螢光材料因為量子力學先天上的限制,使其僅能利用到單重激發 態 25%的能量,1 然而在磷光材料中卻能利用到三重態 75%的能量,如果再 加上中心金屬重原子所產生的效應(spin-orbit coupling),不僅能利用到三重 態也能利用到單重激發態的能量,使其元件內部量子效率幾乎可以達到 100 %。2~8 目前在磷光材料的發展中,主要還是以銥金屬錯合物為主;該金屬發 光體在綠光與紅光的部分已得到相當大的進展,然而在藍光的部分,除了 客發光體本身發展有限外,主發光體材料的開發也是一個很大的瓶頸。 在文獻中已被證明,磷光材料中,主客發光體三重激發態能階的相互 關係會對元件效率有相當大的影響;9-13一般而言,在綠光與紅光的元件中, 最 常 用 到 的 主 發 光 體 材 料 為 4,4’-bis(9-carbazolyl)-2,2’-biphenyl(CBP)( 圖 B-1),然而此材料無法應用於藍色磷光的OLED元件,主因在於CBP的T1(最 低三重激發態)比綠光或紅光客發光體材料的T1高,但是卻比藍色磷光材料 36.
(49) iridium(III)bis[(4,6-difluorophenyl)-pyridinato-N,C2’]picolinate(FIrPic)9,12,14,16 (圖B-2)的T1低,因此如果拿CBP當作藍色磷光材料的主發光體時,能量會 容易回傳到CBP的T1能階,並經由非輻射緩解釋放能量,而使發光效率下降 (圖B-3)。. N. Ir F. N. O. N F. 圖 B-1. CBP 之結構. N O. 2. 圖 B-2. FIrPic 之結構. 圖 B-3. 能階比較圖 為 了 解 決 在 CBP 上 所 發 生 的 問 題 , M. E. Thompson 等 人 用 1,3-bis(9-carbazolyl)benzene(mCP)12,13(圖 B-4)來取代 CBP;該化合物具有比 FIrPic 高的最低三重激發態能階(T1=2.9 ev),因此能量較不會回傳到 mCP 上,使得最後藍光元件效率獲得提升。 37.
(50) N. N. 圖 B-4. mCP 之結構 除了mCP以外,一些以矽(Si)為中心的化合物也開始被應用於磷光的主 發光體,p-bis(triphenylsilyly)benzene (UGH2)10,15(圖B-5)即是一個很典型的 例子,這類化合物具有極大的能隙(energy gap),很適合應用在像是FIr6(圖 B-6)這種發光波長更短的藍色磷光材料。. 圖 B-5. UGH2 之結構. 圖 B-6. FIr6 之結構. 1-2. 研究動機 目前應用於藍色磷光元件主發光體的材料中,不論是 mCP 或是 UHG 系列的化合物,都有一個共通的缺點,即熱穩定性不佳,mCP 的玻璃轉移 溫度(Tg)為 55℃,UGH 系列的化合物也都不到 60℃,因此在本論文中希望 能合成出具有較佳熱穩定性的化合物來應用於藍色磷光 OLED 元件。 在本篇論文中,以 carbazole 為主體,在其兩側的 3,6 位置上以非共軛 的方式各導入一個剛硬 fluorene 基團,希望得到具有電洞傳輸特性且高熱穩 定性的藍色磷光主發光體材料。 38.
(51) 第二章 實驗 2-1. 藥品 9-Phenylcarbazole. 購自 Aldrich. Trifluoromethanesulfonic acid. 購自 Lancaster. 2-Bomopropane. 購自 Aldrich. Carbazole. 購自 Aldrich. 1,4-Dioxane. 購自 Aldrich. Potassium hydroxide. 購自 SHOWA. 上述所列藥品,不純化直接使用。tetrabutylammonium hexafluorophosphate (TBAPF6) 經過乙酸乙酯再結晶,並在 60 ℃ 的真空下烘乾。其餘皆購自於 Merck、Aldrich、Mallickrodt、Fisher Scientific、聯工等公司。. 2-2. 使用儀器 2-2-1. 核磁共振光譜儀 (NMR) 使用 Varian Unity Yinavo 500 MHz 核磁共振光譜儀、Bruker-DRX-300 MHz 核磁共振光譜儀。 2-2-2. 質譜儀(Mass Spectroscopy) 與元素分析儀 (Elemental Analysis) 使用交大貴儀的 T-200 GC-Mass,以 EI 或 FAB 為游離方法。以清華大 學及成功大學貴儀中心的 JEOL JMS-HX 110 Mass Spectrometer (高效能質 譜儀)。元素分析儀 ( EA )為交大的 HERAEUS CHN-OS RAPID。 2-2-3. 薄層色層分析法 (TLC) 使用 Merck 製造的 5554 DC Silica Gel 60 F254 型鋁製薄片。. 39.
(52) 2-2-4. 管柱層析法 使用 Merck 製造的 7734 Kieselgel 60 (60~230 mesh ASTM) 型矽膠。 2-2-5. 微差掃描卡計(Differential Scanning Calorimetry,. DSC). 使用 SEIKO EXSTAR 6000DSC 及 Computer/Thermal Analyzer。 2-2-6. 熱重量分析儀(Thermogravimetric Analysis,. TGA). 使用 Du Pont Instrument TGA 2950 儀器。 2-2-7. 吸收光譜儀 (UV/vis) 使用 HP-8453 光譜分析儀。 2-2-8. 螢光儀 (Fluroescence Spectroscopy) 使用 Hitachi F-4500 的螢光儀。 2-2-9. 循環伏特安培計 (CV) 使用美國 Bioanalytical Systems Inc. 電化學分析儀,型號 100B,序號 930。 2-2-10. 昇華設備 使用 HTF-30SJ 高溫爐。 2-2-11. 曝光機 型號:US101,燈管功率為 1000 瓦,七貿股份有限公司。 2-2-12. 高真空蒸鍍機 型號:Auto 168(Junsun Tech co., LTD)。 2-2-13. 元件測量 使用 Keithley 2400 Soouce meter 與 Newport 公司所生產的 818ST silicon photodiode 搭 配 2835C Optical meter , 而 其 量 測 之 基 本 原 理 為 silicon photodiode 會偵測元件所放出的所有光能並將光能轉換成電能,因此可由電 能的大小得知元件所放出的光能或是亮度。. 40.
(53) 2-3. 性質測量 2-3-1. TGA 測量 取 5~10 毫克的樣品裝入鉑製的 cell 中,在通入氮氣流速為 60 mL/min 的條件下,以 10 ℃/min 的升溫速度,從 30. ℃升溫至 900. ℃來觀察裂解. 情形。 2-3-2. DSC 測量 取 5~10 毫克的樣品裝入鉑製的 cell 中,在通入氮氣流速為 50 mL/min 的條件下,做四階段式升溫 DSC 測試: 1.升溫速率 20 ℃/min,範圍為 30~380 ℃,固定 5min 2.升溫速率-40 ℃/min,範圍為 380~30 ℃,固定 5min 3.升溫速率 20 ℃/min,範圍為 30~380 ℃,固定 5min 4.升溫速率 -40 ℃/min,範圍為 380~30 ℃,固定 5min。 2-3-3. 光學性質測量 Solution:利用逐步稀釋法配置樣品濃度在個別溶液中,使其 UV-vis 的最大 吸收值介於 0.05 左右。溶液的螢光放射光譜使用最大吸收峰的波 長為激發光源。 2-3-4. 電化學性質--氧化還原電位測量 在此使用循環伏安法(cyclic voltammetry,簡稱 CV ),當外加電位達到 待測物的反應電位時,氧化或還原反應隨即發生,此時電流將隨著電位的 變化而改變。而電流的大小是由物質到電極表面的擴散速率所控制,所以 當擴散速率遠小於外加電位的變化速率當電極表面的反應已趨完全時,此 41.
(54) 時電流即衰減下來。 <溶液態> 在氧化電位的測量中,在定量瓶中配置 10-3 M 的樣品及 0.1 M 的 tetrabutylammonium hexafluorophosphate (TBAPF6) 之 CH2Cl2 為電解液 10 mL,通入氮氣 10 分鐘,而在還原電位的測量中,以無水的 THF 配製同樣 濃度的樣品與電解質。以 Ag/Ag+為參考電極,並以 ferrocene/ferrocenium (Fc/Fc+)為內參考電位,白金絲為導電電極,氧化時以白金電極為工作電極, 還原時以鍍在金(Au)上的汞電極為工作電極,掃瞄速率為 50 mV/S,範圍 0 ~ 2000 mV 與 0 ~ -2500 mV。 2-3-5. 低溫磷光光譜測量 由交通大學應用化學所刁維光老師實驗室學長代為測量。 2-3-6. OLED 元件製作 委託中研院陳錦地博士實驗室製作成元件。. 42.
(55) 2-4. 合成部份 1.. 9-isopropylcarbazole 化合物 IC. 在氮氣下,將 carbazole(2.00 g, 12.0 mmol )、KOH(3.35 g, 60.0 mmol). 和 THF (20.0 ml )加入雙頸瓶中,注入 2-bromopropane(7.37 g, 60.5 mmol), 加熱迴流八小時後,倒入蒸餾水(500 ml)中,攪拌八小時後過濾烘乾,得棕 色固體。以乙酸乙酯:正己烷為 1:20 進行管柱層析分離,得白色固體產 物 1.82 g,產率 73.0 %。. N. IC 1. H NMR. (300 MHz, CDCl3): δ 1.70(d, 6 H, J = 7.0 Hz), 4.97(septet, 1 H, J =. 7.0 Hz), 7.20(dd, 2 H, J = 7.2, 7.6 Hz), 7.42(dd, 2 H, J = 7.1, 8.2 Hz), 7.51(d, 2 H, J = 8.3 Hz), 8.09(d, 2 H, J = 7.8 Hz) (附圖 1). 2.. 9-isopropyl-3,6-bis(9-phenyl-9H-fluoren-9-yl)-9H-carbazole 化合物. IFC. 在氮氣下,將 IC (1.40 g, 6.70 mmol )、9-phenyl-9H-fluoren-9-ol (3.63 g, 14.1 mmol)和 1,4-dioxane (70.0 mL )加入雙頸瓶中,滴入 CF3SO3H (2.59 g, 17.3. mmol),加熱至 70 ℃反應 20 分鐘後,以 NaHCO3 水溶液中和,加入. CH2Cl2 萃取後取有機層,移去溶劑得白色固體。以 300 ℃昇華後,得白色 固體產物 3.70 g,產率 80.3 %。 43.
(56) N. IFC 1. H NMR. (300 MHz, CDCl3): δ 1.58(d, 6 H, J = 7.0 Hz), 4.83(septet, 1 H, J =. 7.0 Hz), 7.13-7.25(m, 17 H), 7.28-7.35(m, 8 H), 7.40-7.43(m, 4 H), 7.74- 7.77(m, 4 H)(附圖 2) 13. C NMR. (75 MHz, CDCl3): δ 20.8, 46.6, 65.5, 109.6, 119.8, 120.1, 123.0,. 126.0, 126.3, 126.5, 127.3, 127.6, 128.12, 128.14, 135.8, 138.6, 140.0, 146.7, 152.0 (附圖 3) MS (m/z) calad. for C53H39N 689, found 690. (附圖 4) Anal. Calcd. for C53H39N: C, 92.27; H, 5.70; N, 2.03. Found: C, 92.17; H, 5.81; N, 2.31 .. 3.. 9-phenyl-3,6-bis(9-phenyl-9H-fluoren-9-yl)-9H-carbazole 化合物 PFC. 在 氮 氣 下 , 將 9-phenylcarbazole (2.00 g, 8.23 mmol ) 、. 9-phenyl-9H-fluoren-9-ol (4.46 g, 17.3 mmol)和 1,4-dioxane (100 mL )加入雙 頸瓶中,滴入 CF3SO3H (3.70 g, 24.7 mmol),加熱至 70 ℃反應 20 分鐘後, 以 NaHCO3 水溶液中和,加入 CH2Cl2 萃取後取有機層,移去溶劑得白色固 體。以 300 ℃昇華後,得白色固體產物 4.81 g,產率 80.8 %。. 44.
(57) N. PFC 1. H NMR. (300 MHz, CDCl3): δ 7.13-7.25(m, 18 H), 7.30-7.39(m, 5 H),. 7.41-7.52(m, 8 H), 7.74-7.77(m, 4 H), 7.80-7.81(m, 2 H) (附圖 5) 13. C NMR. (75 MHz, CDCl3): δ 65.5, 109.4, 119.7, 120.1, 123.1, 126.3, 126.5,. 126.6, 126.8, 127.2, 127.3, 127.7, 128.1, 128.2, 129.7, 137.3, 137.5, 140.0, 146.7, 151.8 (附圖 6) MS (m/z) calad. for C56H37N 723, found 725. (附圖 7) Anal. Calcd. for C56H37N: C, 92.91; H, 5.15; N, 1.93. Found: C, 93.17; H, 5.36; N, 1.79 .. 45.
(58) 第三章 結果與討論 3-1. 合成部份 3-1-1. 新型磷光主發光體之合成 反應流程如 Scheme 1、2 所示,先合成在 carbazole 的九號氮上具有 isopropyl 的化合物,再以此為主架構接上兩個剛硬的 fluorene 取代基來增加 整個化合物的熱穩定性與立體結構;而另外一個在 carbazole 九號氮上具有 phenyl 的化合物,也分別在其兩邊接上兩個剛硬的 fluorene 取代基。在接上 fluorene 取代基的反應中,反應時間很短,約二十分鐘即反應完畢,不宜反 應過久,且 9-phenyl-9H-fluoren-9-ol 不能加入太過量,否則會有其他次反應 物出現。因為此反應在適當的條件下反應相當完整,因此萃取後移去溶劑 即可得具有相當純度的白色固體,直接進行昇華,因為分子量的差異即可 輕易移去未反應完的起始物,進而得到相當純的白色固體。. 46.
(59) Scheme 1. THF. N. N. +. Br. KOH. IC. N HO N. CF3SO3H. +. IC. 1,4-dioxane. 9-phenyl-9H-fluoren-9-ol. IFC. Scheme 2. N HO N +. PC. 1,4-dioxane CF3SO3H. 9-phenyl-9H-fluoren-9-ol. PFC. 47.
(60) 3-2. 熱性質 DSC 和 TGA 測量 DSC 和 TGA 主要是用來觀察分子的熱性質,TGA 可測量出重量隨溫 度的變化以判斷分子的熱穩定性,並藉此決定該分子所適合的昇華溫度與 測量 DSC 時的極限值;DSC 則可測量到該分子的玻璃轉移溫度(Tg)與熔融 溫度(Tm)。 在熱性質的量測上可發現,化合物 IFC 與 PFC 因為在 carbazole 兩側 導入了剛硬的 fluorene 基團,因而使其熱穩定性有顯著的提升。由 TGA 的 測量結果可知(表 B-1, 圖 B-7、8)IFC 的 5 %重量損失溫度為 399 ℃,10 % 重量損失溫度為 414 ℃,而 PFC 的 5 %與 10 %重量損失溫度更高達 429 與 445 ℃;另外在 DSC 的測量中(表 B-1,圖 B-9、10),化合物 IFC 的 Tg 與 Tm 分別位於 166 ℃與 354 ℃,而在 PFC 中其 Tg 與 Tm 分別位於 171 ℃與 328 ℃;相較於目前最常被使用為藍色磷光材料主發光體的 mCP(Tg 為 55 ℃, Tm 為 171 ℃),化合物 IFC 與 PFC 具有優於 mCP 的熱穩定性,所以較不 容易產生結晶,在元件上應該也會有較佳的穩定性。. 表 B-1. PFC、IFC 之熱性質 Tg(℃). Tc(℃). Tm(℃). PFC. 171. a. 328. 429. 445. IFC. 166. a. 354. 399. 414. a 由 DSC 無法明顯判斷 Tc。. 48. Td(-5%)(℃) Td(-10%)(℃).
(61) IFC. 1. N. weight loss(%). -Td(5%)=399℃ -Td(10%)=414℃. 0 0. 200. 400. 600. 800. 1000. temperature. 圖 B-7. IFC 之 TGA 圖. PFC. N. -Td(5%)=429℃ -Td(10%)=445℃. weight loss(%). 1. 0 0. 200. 400. 600. temperature. 圖 B-8. PFC 之 TGA 圖 49. 800. 1000.
(62) Tm Tg. N. 166 ℃. Endothermic. Second. First. 354 ℃. 0. 50. 100. 150. 200. 250. 300. 350. 400. Temperature (℃ ). 圖 B-9. IFC 之 DSC 圖. Tm Tg. 171 ℃. N. Endothermic. Second. First. 328 ℃. 0. 50. 100. 150. 200. 250. 300. Temperature (℃ ). 圖 B-10. PFC 之 DSC 圖 50. 350. 400.
(63) 3-3. 光學性質 3-3-1. 常溫-吸收/放射光譜 從下頁圖中四個化合物(IC、PC、IFC、PFC) 在 THF 中的吸收/放射光 譜(圖 B-11~14)發現,在 carbazole 的兩側未接上取代基之前,9-Phenyl -carbazole (PC)的放射光譜(圖 B-11)分別為 351(nm)、363(nm)兩個峰;而在 9-Phenyl -carbazole 兩側各接上一個剛硬 fluorene 基團後的化合物 PFC,其 放射光譜(圖 B-13)則分別位於 363(nm)、378(nm)兩個峰,與原來相較只紅 位移了約 15 nm 。 比較 IC 與 IFC 這兩個化合物的放射光譜(圖 B-12、14) 時也可發現 IFC 只比 IC 的放射光譜紅位移了約 17 nm;因此加入這兩個剛 硬 fluorene 基團並不會對化合物的放射光譜有極明顯的影響。. 表 B-2 IC、PC、IFC 與 PFC 之 UV-vis 吸收與 PL 放射量測表 IC PC IFC PFC. UV-vis λmax (nm) 331, 346 328, 340 343, 357 338, 351. 溶劑:tetrahydrofuran. 51. PL λmax (nm) 351, 367 351,363 369, 384 363, 378.
(64) uv pl. 351. Abs./Emission Intensity(a.u.). 1.0. 363. 340 328. 0.8 N. 0.6. 0.4. 0.2. 0.0. 300. 350. 400. 450. 500. 550. 600. Wavelength(nm). 圖 B-11. 9-Phenyl -carbazole(PC)在 THF 溶液的 UV-vis 吸收/放射光譜. UV PL 346 351. Abs./Emission Intensity(a.u.). 1.0. 367. 331 0.8. N. 0.6. 0.4. 0.2. 0.0. 300. 350. 400. 450. 500. 550. 600. Wavelength(nm). 圖 B-12. Isopropyl - carbazole(IC)在 THF 溶液的 UV-vis 吸收/放射光譜 52.
(65) UV PL. 351 338. 1.0. 363. Abs./Emission Intensity(a.u.). 378 0.8 N. 0.6. 0.4. 0.2. 0.0. 300. 350. 400. 450. 500. 550. 600. Wavelength(nm). 圖 B-13. PFC 在 THF 溶液的 UV-vis 吸收/放射光譜. 357 343. UV PL. 369 384. Abs./Emission Intensity(a.u.). 1.0. 0.8. N. 0.6. 0.4. 0.2. 0.0. 300. 350. 400. 450. 500. 550. 600. 650. 700. 750. Wavelength(nm). 圖 B-14. IFC 在 THF 溶液的 UV-vis 吸收/放射光譜 53.
(66) 3-3-2. 低溫磷光放射光譜 從低溫的 PL 圖譜(圖 B-15、16)中可發現,隨著溫度降低到 77 K 時, 在波長 400 nm 以後的位置會出現原來在室溫所見不到的磷光放射光譜;不 論是 IFC 或是 PFC 在溫度降到 77 K 後,皆可發現 432 nm、462 nm 兩支放 射峰。 根據文獻,12,14 以最短波長的磷光放射峰代入公式,得到 IFC 與 PFC 的 T1(最低三重激發態)為 2.87 eV。 藉由低溫磷光放射光譜所推斷出來的最低三態激發態能階(T1)顯示(表 B-3、圖 B-15、16),IFC 與 PFC 的 T1 皆位於 2.87 eV 左右,已比 CBP(2.56 eV)高上許多,且比 FIrpic(2.63 eV)高,因此能作為藍色磷光材料的客發光 體。. IFC 295K 100K 77K. 366. 1.0. Emission Intensity(a.u.). 384 0.8. 0.6. 0.4. 432. 462. 0.2. 0.0. 300. 350. 400. 450. 500. 550. 600. Wavelength(nm). 圖 B-15. IFC 在 2-methyltetrahydrofuran 溶液的放射光譜 54.
(67) PFC 1.0. Emission Intensity(a.u.). 295K 100K 77K. 362 379. 0.8. 0.6. 432 462. 0.4. 0.2. 0.0. 300. 350. 400. 450. 500. 550. 600. Wavelength(nm). 圖 B-16. PFC 在 2-methyltetrahydrofuran 溶液的放射光譜. 55.
(68) 3-4. 電化學性質--氧化還原電位測量 為了探討用於元件的有機材料,先建立能階圖,來得知選用的材料特 性,預測電子與電洞結合的位置及能量轉移的效果。 利用下列公式來計算 HOMO 值,17 其中氧化起始電位(E oxonset )採用伏特 為單位(vs. Fc/Fc+),常數 4.8 為 ferrocene 相對於真空能階。 HOMO = 4.8 + E oxonset IFC、PFC 的 E oxonset 經過 ferrocene 校正之後分別為 0.75 V、0.82 V,利用 上述公式求得該兩化合物的 HOMO 分別為 5.55、5.62 eV。 但測量此兩個化合物還原電位時,並無法得到有效的值,因此利用吸 收光譜來計算其 LUMO 位置。 當 分 別 比 較 IFC 與 IC (isopropylcarbazole) 或 是 PFC 與 PC (9-phenylcarbazole)的氧化電位圖譜(圖 B-17、18)時可發現,導入 fluorene 基團並不會對化合物的 HOMO、LUMO 或是能階差造成很大的影響;導入 fluorene 所造成的最大差異在於 IFC 與 PFC 的氧化電位都是可逆的,但 IC 與 PC 則為不可逆的,會造成這樣的差異,主要是因為 IFC 與 PFC 在其 carbazole 的 3,6 位置上導入了 fluorene 基團,將這兩個位置保護起來;在文 獻也已證明,在 carbazole 的 3,6,9 號位置以取代基保護住,可使該化合物的 氧化還原電位為可逆的 18。. 56.
(69) 表 B-3. IFC、PFC、isopropylcarbazole 與 9-phenylcarbazole 的溶液態氧化 電位起始值及 HOMO、LUMO. IFC isopropylcarbazole PFC 9-phenylcarbazole a. 相對於 Fc/Fc+的電位.. b. HOMO = 4.8 + E ox onset .. E ox onset ,. HOMO,. LUMO,. (V) a. (eV)b. (eV)c. 0.75 0.76 0.82 0.84. 5.55 5.56 5.62 5.64. 2.20 2.06 2.20 2.10. E elg , (eV)d. 3.35 3.50 3.42 3.54. triplet energy, (eV)d. 2.87 2.87. c. LUMO energy was derived from the relation, band gap = HOMO-LUMO(where the band gap was derived from the observed optical edge) d. e. 電化學能隙(Electrochemical bandgap): E elg = HOMO - LUMO. 三重態能隙=1240/λmax,λmax 為低溫磷光放射光譜中磷光波長中,最強能量放射峰的. 波長.. IFC isopropylcarbazole. 2.5 2.0. 0.78. 1.5. Current(uA). 1.0 0.5. 0.75 0.87. 0.0 -0.5. 0.76. -1.0 -1.5. 0.84. -2.0 -0.5. 0.0. 0.5. 1.0. Potential(V vs.Fc/Fc+). 圖 B-17.IFC 與 isopropylcarbazole 溶液態之 CV 圖 57.
(70) PFC 9-phenylcarbazole 2.0 1.5. 0.86. Current(uA). 1.0. 0.82. 0.5. 0.94. 0.0. 0.84. -0.5. 0.96. -1.0 -1.5 -0.5. 0.0. 0.5. 1.0. Potential(V vs.Fc/Fc+). 圖 B-18. PFC 與 9-phenylcarbazole 溶液態之 CV 圖. 58.
(71) 3-5. 元件電激發光性質 為了研究 IFC 與 PFC 的電激發光性質,委託中研院陳錦地博士實驗室 將 IFC 與 PFC 製成元件,並與目前常用的藍色磷光主發光體 mCP 相比較。 在元件中,以 NPB 作為電洞傳輸層,FIrpic 作為藍光客發光體,分別以 mCP、 IFC、PFC 作為主發光體,TPBI 作為電子傳輸層,元件結構如下:. N. N. N. N. N. N. TPBI. 圖 B-19. 元件結構圖. N. Ir F. N N. O. F. N. O. N. NPB. mCP. 2. N. N. N. IFC. PFC. 59.
(72) 分別以 mCP、IFC、PFC 作為主發光體,FIrpic 作為客發光體所製成的 藍色磷光 OLED 元件,由圖 B-20 可發現,三組元件的的 EL 圖譜表現差異 不大,皆為一發藍光的元件。 在元件效率表現上(表 B-4,圖 B-21),以 mCP 當作主發光體時,元件 的最大外部量子效率與亮度分別為 12.3 %、36272 cd/m2;以 IFC 當作主發 光體時,元件的最大外部量子效率與亮度為 13.4 %、33374 cd/m2;以 PFC 當作主發光體時,元件的最大外部量子效率與亮度為 11.3 %、39110 cd/m2。 當比較不同主發光體的元件結果後發現,在效率上,三組元件的表現相似, 以 IFC 與 PFC 為主發光體的元件中,並不會產生以 CBP 為主發光體時所造 成的缺點 4,6,可見 IFC 與 PFC 確實適合作為藍色磷光元件的主發光體。 而 IFC 與 PFC 因為具有比 mCP 佳的熱穩定性,因此在元件的操作壽命 上應會比 mCP 的表現好,目前元件穩定性與壽命的實驗正在進行中。. mCP as host IFC as host PFC as host. 1.0. EL Intensity(a.u.). 0.8. 0.6. 0.4. 0.2. 0.0. 300. 400. 500. 600. 700. 800. Wavelength(nm). 圖 B-20 分別以 mCP、IFC 或 PFC 當作主發光體所製成元件的 EL 圖譜 60.
(73) 表 B-4 元件效率總整理 (X)% FIrpic in Host. voltage(V). 7 % in mCP. Max E.Q.E.. Max L.E.. λmax. C.I.E. (cd/m ). (%). (cd/A).. (nm). (x , y). 4.5. 36272(@15v). 12.3. 20.67. 474. 0.15 , 0.28. 14 % in IFC. 4.25. 33347(@15v). 13.4. 25.45. 474. 0.14 , 0.32. 21 % in PFC. 5. 39110(@15v). 11.3. 21.17. 474. 0.14 , 0.32. Turn-on. Max brightness 2. Max E.Q.E:maximum external quantum efficiency (%) Max L.E.:maximum luminance efficiency (cd/m2). 40000 35000. 12. 10. 25000. mCP PFC IFC. 8. 20000 15000. 6. 2. 30000. Brightness (cd/m ). External Quantum Efficiency (%). 14. 10000 4. 5000 0. 2 0. 100. 200. 300. 400. 500. 600. 700. 2. Current Density (mA/cm ). 圖 B-21. 分別以 mCP、IFC 或 PFC 當作主發光體所製成元件的外部量子效 率與亮度對電流密度作圖. 61.
(74) 第四章 結論 在本論文中成功合成出 IFC 與 PFC 兩個化合物,藉由在 carbazole 兩側 上各導入一個剛硬的 fluorene 基團,大幅提升化合物的熱穩定性,改善了 mCP 玻璃轉移溫度低,易結晶的缺點;剛硬 fluorene 基團的導入,並不會 使該化物的 T1(最低三重激發態)產生嚴重下滑;且在以 FIrpic 為客發光體的 元件結果中,以 IFC 與 PFC 作為主發光體的效率表現不比 mCP 差,其元件 最大外部量子效率可達 13.4 %,所以很適合當作藍色磷光 OLED 元件的主 發光體;另外這兩個化合物在合成上兼具了易合成、高產率且容易昇華的 優點,這在商業化上會較具有競爭力。. 62.
(75) 參考文獻 1. Klessinger, M.; Michl, J. Excited States and Photochemistry of Organic Molecules; VCH: New York, 1995. 2. Adachi, C.; Baldo, M. A.; Thompson, M. E.; Forrest, S. R. J. Appl. Phys. 2001, 90, 5048. 3. Baldo, M. A.; Lamansky, S.; Burrows, P. E.; Thomson, M. E.; Forrest, S. R. Appl. Phys. Lett. 1999, 75, 4. 4. Adachi, C.; Baldo, M. A.; Forrest, S. R.; Lamansky, S. A.; Thompson, M. E.; Kwong, R. C. Appl. Phys. Lett. 2001, 78, 1622. 5. Mcgehee, M. D.; Bergstedt, T.; Zhang, C.; Saab, A. P.; O’Regan, M. B.; Bazan, G. C.; Srdanov, V. I.; Heeger, A. J. Adv. Mater. 1999, 11, 1349. 6. Lee, C. L.; Lee, K. B.; Kim, J. J. Appl. Phys. Lett. 2000, 77, 2280. 7. Yang, M.-J.; Tsutsui, T. Jpn. J. Appl. Phys. 2000, 39, L828. 8. Gong, X.; Robinson, M. R.; Ostrowski, J. C.; Moses, D.; Bazan, G. C.; Heeger, A. J. Adv. Mater. 2002, 14, 581. 9. Tokito, S.; Iijima, T.; Suzuri, Y.; Kita, H.; Tsuzuki, T.; sato, F. Appl. Phys. Lett. 2003, 83, 569 10. Holmes, R. J.; DAndrade, B. W.; Forrest, S. R.; Ren, X.; Li, J.; Thompson, M. E. Appl. Phys. Lett. 2003, 83, 3818 11. Asamovich, V.; Cordero, S. R.; Djurovich, P. I.; Tamayo, A.; Thompson, M. E.; D’Andrade, B. W.; Forrest, S. R. Org. Electron. 2003, 4, 77. 12. Holmes, R. J.; Forrest, S. R.; Tung, Y.-J.; Kwong, R. C.; Brown, J. J.; Garon, S.; Thompson, M. E. Appl. Phys. Lett. 2003, 82, 2422. 13. Asamovich, V.; Broods, J.; Tamayo, A.; Alexander, A. M.; Djurovich, P. I.; D’Andrade, B. W.; Adachi, C.; Forrest, S. R.; Thompson, M. E.; New J. Chem. 2002, 26, 1171 63.
(76) 14. Adachi, C.; Kwong, R. C.; Djurovich, P. I.; Asamovich, V.; Baldo, M. A.; Thompson, M. E.; Forrest, S. R. Appl. Phys. Lett. 2001, 79, 2082. 15. Ren, X.; Li, J.; Holmes, R. J.; Djurovich, P. I.; Forrest, S. R.; Thompson, M. E. Chem. Mater. 2004, 16, 4743. 16. Lamansky, S.; Djurovich, P.; Murphy, D.; Abdel-Razzaq, F.; Kwong, R. C.; Tsyba, I.; Bortz, M.; Mui, B.; Bau, R.; Thompson, M. E. Inorg. Chem. 2001, 40, 1704 . 17. Lee, Y. Z.; Chen, X.; Chen, S. A.; Wei, P. K.; Fann, W. S. J. Am. Chem. Soc. 2001, 123, 2296. 18. Brunner, K.; Dijken, A. V.; Borner, H.; Bastiaansen, J. J. A. M.; Kiggen, N. M. M.; Langeveld, B. M. W. J. Am. Chem. Soc. 2004, 126, 6035.. 64.
(77) 65. 附圖 1. 9-isopropylcarbazole,化合物 IC 的 1H-NMR 光譜圖.
(78) 66. 附圖 2. 9-isopropyl-3,6-bis(9-phenyl-9H-fluoren-9-yl)-9H-carbazole,化合物 IFC 的 1H-NMR 光譜圖.
(79) 67. 附圖 3. 9-isopropyl-3,6-bis(9-phenyl-9H-fluoren-9-yl)-9H-carbazole,化合物 IFC 的 13C-NMR 光譜圖.
(80) 68. 附圖 4. 9-isopropyl-3,6-bis(9-phenyl-9H-fluoren-9-yl)-9H-carbazole,化合物 IFC 的 MASS 圖.
(81) 69. 附圖 5. 9-phenyl-3,6-bis(9-phenyl-9H-fluoren-9-yl)-9H-carbazole ,化合物 PFC 的 1H-NMR 光譜圖.
(82) 70. 附圖 6. 9-phenyl-3,6-bis(9-phenyl-9H-fluoren-9-yl)-9H-carbazole ,化合物 PFC 的 13C-NMR 光譜圖.
(83) 71. 附圖 7. 9-phenyl-3,6-bis(9-phenyl-9H-fluoren-9-yl)-9H-carbazole ,化合物 PFC 的 MASS 光譜圖.
(84)
數據




+7
Outline
相關文件
如圖所示,將馬達、發光二極體、光電 二極體組合成光遮斷器。當馬達運轉時,安
圖畫在書中所佔比例較多,文字扮演從旁輔助 的角色。繪本中的線條、造型、色彩、光影,除
交流(小訊號)計算:.
水的沸點會遠高於其他同族元素是因為氧原子與其他 元素相比較之下,有較大的陰電性質,致使 O─H 鍵較 其他 S─H、Se─H,及
紅外線發光二極體的發射強度因發射方向而異
1.提高接收資料的速度 2.降低資料傳輸速度 接收端RX接收資料的速度低於發.
在直流馬達控制系統中,為了減少流經馬達繞線電流及降低功率消耗等 目的,常常使用脈波寬度調變信號 (PWM)
• 後段工程是從由矽晶圓切割成一個一個的晶片 入手,進行裝片、固定、接合連接、注模成 形、引出接腳、按印檢查等工序,完成作為元