探討銀杏萃取物對血管收縮素所誘發血管平滑肌細胞增生的作用; Study the effects of Ginkgo biloba extract on angiotensin II–induced vascular smooth muscle cell proliferation
全文
(2)
(3) 致. 謝. 人生本是一段未知的旅程,其中最美好的、最難忘卻的就是在校 園中度過的時光,這段研究生生涯對我而言是重要的,因為這是我生 命中最可貴的一部分。我心中充滿感激-感激那些出現在我生命中, 曾經鼓勵、啟發我的每一個人,對此表達最深的感謝。首先感謝本篇 論文的口試委員,台北醫學大學臨床醫學所劉如濟老師、中國醫藥大 學鄭志鴻老師以及洪宏杰老師。我也要感謝生科系辦秋鳳姐對我的關 懷以及生科師長們給我的教導,特別再次感謝我的指導教授鄭志鴻老 師及共同指導教授洪宏杰老師對此論文的指導及寶貴的建議,且無論 是教學的豐富、學問的高深,抑或是對學生的熱忱,都令我印象深刻, 相信這也都將成為我最珍貴的經驗與回憶。也感激在中國醫生科一起 經歷過所有點點滴滴的碩班同學們:俊賢、聖峯、佳妮、雪婷、阿邦、 雅柔、佳真、宜靜、宜君、家君、長霖以及建宇,感謝他們真摯的友 誼以及無私的幫助,並感謝曾經幫助過我的朋友們。 最後感謝我最親愛的爸媽及我的妹妹,由於他們大力的支持和貢 獻,在這樣的環境之下,我真的成長了,也真的從中學到了很多。由 衷地謝謝您們,祝福您們!. 游力譿謹致於 中國醫藥大學生物科技學碩士班 中華民國九十八年六月.
(4) 中文摘要 近年來研究證明,血管平滑肌細胞(vascular smooth muscle cells, VSMCs)的不正常增生會導致動脈硬化及心血管等相關疾病。於血管 平滑肌細胞增生作用中,第二型血管收縮素 (angiotensin, Ang II)為重 要的誘發因子,其與細胞內活性氧分子(reactive oxygen species, ROS) 的增加、細胞外信號調節激酶(extracellular signal-regulated kinase, ERK)之磷酸化以及第一型內皮素(endothelin-1, ET-1)表現之訊息路徑 有很大的關係。銀杏萃取物(Ginkgo biloba extract, GBE)為一種血管活 化劑,對於自由基的氧化損害亦有保護作用。已有不少文獻指出銀杏 萃取物中主要的黃酮苷類(flavonoid glycosides)對於抗氧化及抑制細 胞增生有很好的功效。不過,GBE在Ang II所誘發引起的血管平滑肌 細胞增生作用之影響目前還不確定。在這項研究過程中,我們研究 GBE在Ang II所誘發引起的VSMCs增生作用與細胞內訊息傳遞路徑 關係。以老鼠主動脈平滑肌細胞(A7r5)進行實驗,並藉由MTT assay 分析細胞增生作用,以西方墨點來確定ERK有無被磷酸化,最後以 RT-PCR來測量ET-1之表現量。細胞內的活性氧分子則藉由流式細胞 儀來測量。從結果中我們發現GBE於100µg/ml能最有效地抑制Ang II 所誘發的VSMCs增生作用,而銀杏萃取物於200µg/ml對VSMCs則有 毒殺性。值得注意的是經由Ang II誘發過後上升的ROS產量、ERK phosphorylation 及ET-1之表現量,於GBE處理過後皆下降了。我們的 實驗結果證明銀杏萃取物可以有效抑制Ang II所誘導之血管平滑肌細 胞增生作用以及抗氧化的效應,並且支持了銀杏對於與血管平滑肌細 胞增生相關的血管疾病之治療潛能。 關鍵字: 血管平滑肌細胞、血管收縮素第二型、活性氧分子、細胞外 信號調節激酶、第一型內皮素、銀杏萃取物 I.
(5) Abstract Recent studies evidence that abnormal proliferation of vascular smooth muscle cells (VSMCs) could induce atherosclerosis and cardiovascular disease. Angiotensin II (Ang II), a potent vasoconstrictor, has been studied extensively for its role in stimulating proliferation of VSMCs. Ang II-mediated signal events likely to be important in VSMCs are the increase of cellular reactive oxygen species (ROS), the following phosphorylation of extracellular signal-regulated kinases (ERK) and expression of endothelin-1 (ET-1). As widely studies, the Ginkgo biloba extract (GBE) contains flavonoid glycosides which are efficient to resist oxidation. However, the mechanism of GBE still remains unclear under the treatment of Ang II in VSMCs. In this study, we investigated GBE on Ang II–induced VSMCs proliferation and delineated its signal pathway. Rat aortic smooth muscle cells (A7r5) were incubated with Ang II in the different concentrations of GBE. Intracellular ROS levels were measured by flow cytomertic analysis. Cell proliferation was analyzed by MTT assay, ERK phosphorylation was determined by western blot and ET-1 expression was measured by RT-PCR. From the results, we found that 100 µg/ml of GBE had the most ability to inhibit Ang II-induced proliferation of VSMCs. Notably, Ang II-mediated signal transduction increased intracellular ROS levels, ERK phosphorylation and the expression of ET-1, all of which decreased in the treatments of GBE. Our results implicated the antioxidation of GBE on Ang II-induced VSMCs proliferation and showed the therapeutic potential of GBE in the treatment of cell proliferation-related vascular diseases. Keywords: vascular smooth muscle cells, angiotensin II, reactive oxygen species, extracellular signal-regulated kinases, endothelin-1, Ginkgo biloba extract II.
(6) 目. 錄. 中 文 摘 要 .............................................................................................. I Abstract ...................................................................................................... II 錄 ................................................................................................III . 目. 圖目錄........................................................................................................V 第一章、前言 ............................................................................................1 第一節、研究背景 .................................................................................................... 1 1. . 腦、心血管疾病 ........................................................................................... 1 . 2. . 動脈粥狀硬化生成及血管平滑肌細胞訊息傳導路徑 ............................... 1 . 3. . 活性氧分子 ................................................................................................... 5 . 4. . 銀杏及其他抗氧化劑 ................................................................................... 6 . 第二節、研究目的 .................................................................................................. 23 . 第二章、研究方法 ..................................................................................24 實驗流程 .................................................................................................................. 24 第一節、研究材料 .................................................................................................. 25 第二節、實驗儀器 .................................................................................................. 28 第三節、研究設計 .................................................................................................. 30 A. 細胞培養 ........................................................................................................ 30 B. HE stain 染劑法 ............................................................................................... 31 C. 西方墨漬法 Western blot ............................................................................... 32 D. MTT cell proliferation assy ............................................................................. 37 E. Flow cytometry ................................................................................................ 39 F. RNA Extraction ................................................................................................ 40 . 第三章、研究結果 ..................................................................................44 第一節、Angiotensin II 誘導鼠血管平滑肌細胞增生之時間反應 ...................... 44 第二節、銀杏萃取物對鼠血管平滑肌細胞之劑量反應 ...................................... 44 III.
(7) 第三節、銀杏萃取物於對於 angiotensin II 所誘發之鼠血管平滑肌細胞增生之 影響 .......................................................................................................................... 44 第四節、銀杏萃取物對於以 angiotensin II 所誘導之鼠血管平滑肌細胞增生中 活性氧分子含量之影響 .......................................................................................... 45 第五節、銀杏萃取物對於以 angiotensin II 誘導鼠血管平滑肌細胞增生中 extracellular signal-regulated kinase 磷酸化表現量之影響 ................................... 45 第六節、銀杏萃取物對於以 angiotensin II 誘導鼠血管平滑肌細胞增生中 endothelin-1 表現量之影響 ..................................................................................... 46 . 第四章、討論 ..........................................................................................47 第一節、結果討論 .................................................................................................. 47 第二節、其他相關性討論 ...................................................................................... 48 1. . 其他因子對於血管平滑肌細胞增生之作用 ............................................. 48 . 2. . 銀杏萃取物對於其他細胞之影響 ............................................................. 49 . 第五章、結論與研究未來發展 ..............................................................50 第一節、結論 .......................................................................................................... 51 第二節、研究未來發展 .......................................................................................... 51 . 參考文獻...................................................................................................52 圖表...........................................................................................................61 . IV.
(8) 圖目錄 圖 1-1、在各個不同年齡層中,其因為心血管疾病及癌症疾病之死亡 人數計量圖。 ..........................................................................................10 圖 1-2、造成心血管疾病的危險因子。 ................................................11 圖 1-3、動脈粥狀硬化發生的過程。 ....................................................12 圖 1-4、腎素-血管收縮素系統。 ........................................................13 圖 1-5、Ang II 與 AT1 受體所調控的生理機制。 ...............................14 圖 1-6、以血管收縮素所誘發之血管平滑肌細胞增生訊息路徑。 ....15 圖 1-7、活性氧分子之電子傳遞關係。 ................................................16 圖 1-8、NAD(P)H 氧化酶複合體之催化系統。 ..................................17 圖 1-9、ROS 於細胞組織中的調控作用。 ...........................................18 圖 1-10、銀杏葉之外觀構造。 ..............................................................19 圖 1-11、銀杏葉內所含的松烯內酯之化學結構。 ..............................20 圖 1-12、銀杏葉內所含的黃酮類配糖體之化學結構。 ......................21 圖 1-13、NAC 與 DPI 化學結構圖。 ....................................................22 圖 3-1、以 Ang II 所誘發之鼠血管平滑肌細胞增生於 1、6、12、24 小時之細胞生長狀況。 ..........................................................................61 圖 3-2、以 MTT assay 觀測 Ang II 所誘導之鼠血管平滑肌細胞增生百 分比。.......................................................................................................62 圖 3-3、以 MTT assay 觀測不同 GBE 處理後之正常鼠血管平滑肌細 胞表現量。...............................................................................................63 圖 3-4、在不同濃度的銀杏萃取物(GBE)處理後,以 MTT assay 測量 Ang II 誘發增生之鼠血管平滑肌細胞(VSMCs)的表現量。 ...............64 . V.
(9) 圖 3-5、在不同銀杏萃取物的濃度下,以流式細胞儀測量 Ang II 誘發 增生之鼠血管平滑肌細胞的活性氧分子之含量。 ..............................65 圖 3-6、在不同銀杏萃取物的濃度下 ROS 表現量之量化圖。 ..........66 圖 3-7、不同濃度之銀杏萃取物對於 ERK 磷酸化之影響。 ..............67 圖 3-8、不同濃度之銀杏萃取物對於 ET-1 表現量之影響。..............68 圖 3-9、以 Ang II 所誘發之鼠血管平滑肌細胞增生的訊息路徑可藉由 GBE 以及 NAC、DPI 之抗氧化劑所抑制。 ........................................69 . VI.
(10) 第一章、前言 第一節、研究背景. 1. 腦、心血管疾病 「心血管疾病」(cardiovascular disease, CVD)即是心臟病與血管疾 病的總稱,近年來心血管疾病、腦血管疾病和高血壓性疾病對人類健 康的威脅日趨顯著,且有愈來愈年輕化的趨勢。其中腦、心血管疾病 即是包括了腦中風、阿滋海默症、心肌梗塞、血管阻塞、心絞痛、冠 狀動脈疾病、高血脂症和高血壓等[1-5]。由圖 1-1 顯示 2004 年美國 因心血管疾病或癌症依年齡分類的死亡人數計量圖[6],可得知患有 心血管疾病的總死亡率已比癌症來得高出許多[6-9]。由圖 1-2 所顯示 人體的肥胖、糖尿病、抽菸、不良飲食和生活習慣、高血壓、高血脂 症、動脈粥狀硬化及血管發炎對於誘發腦、心血管疾病皆是危險因子 [2, 3, 5, 10-14]。. 2. 動脈粥狀硬化生成及血管平滑肌細胞訊息傳導路徑 血管平滑肌細胞(vascular smooth muscle cells, VSMCs)的增生在 動脈粥狀硬化(atherosclerosis)以及相關的心血管疾病裡扮演重要的角 色。正常的血管內壁沒有突出腫塊且管道暢通。動脈粥狀硬化指的是 1.
(11) 動脈管壁上生成腫塊,其是由血管平滑肌細胞、血纖維蛋白、細胞殘 渣、脂肪所構成,並會出現壞死、鈣化等現象,且粥狀硬化所造成的 腫塊周圍常會形成血栓。血管壁會因粥狀硬化而粗糙不平、管徑變窄, 血流阻力變大、血流量縮減,而後細胞組織獲氧量與養分供應減少。 若血管壁承受壓力過大,則容易受傷,而易生成血栓,最後使血管阻 塞的情況變得更為惡化。. 動脈粥狀硬化其所併發的心血管疾病對於全世界人類來說具有 相當嚴重的威脅性,尤其是在西方國家,其至病率與死亡率幾乎都位 居首位[15]。造成動脈粥狀硬化的原因為血中低密度脂蛋白 Low Density Lipoprotein (LDL)氧化所引起,並進一步促使血管壁病變和發 炎反應。在發展的一開始,血中過量的 LDL 會聚集在血管內壁上並 發生氧化,接著刺激內皮細胞分泌黏性分子並增加內皮細胞的通透性, 吸引 T 細胞和單核球細胞黏著(adhesion)並侵入血管內膜,而在血管 內膜上,單核球分化成為常駐的巨噬細胞,產生許多發炎物質。接著 白血球、血管平滑肌細胞、細胞激素、血管活動胜肽和生長因子因此 被活化,促進血管壁內膜發炎得更加嚴重,血管壁內膜變得更易滲透。 此時巨噬細胞會內吞大量的氧化 LDL,形成脂肪堆積的泡沫細胞 (foam cells),聚集成脂肪條紋(fatty streaks)而這些脂肪條紋會緩慢地 形成纖維斑塊(fibrous plaque)。斑塊會以脂肪為中心逐漸增大,是被 2.
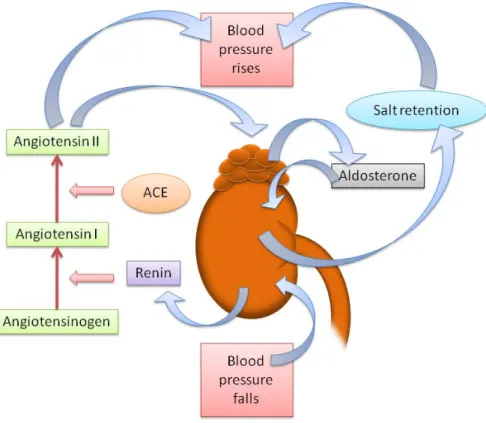
(12) 平滑肌細胞從血管中層移入血管內層所包圍,慢慢地平滑肌細胞會形 成纖維狀硬殼,隔離了腫塊與血流。此時泡沫細胞分泌多種發炎物質, 破壞周圍的肌肉細胞與纖維狀硬殼,導致腫塊破裂而無法修復,結果 大量的脂質取代了原本位置上的正常的細胞與細胞間質,形成了一個 以脂質為核心,外為包圍著巨噬細胞的粥狀瘤塊(atheroma)。損傷的 管壁組織釋出的成分會促進血小板凝集,並易於凝結成血塊或血栓, 當血塊過大就會阻塞了血流,發生於腦血管即是中風;發生於心臟血 管則是心肌梗塞,最後心肌因此缺氧而壞死,造成不可回復的心血管 傷害,為動脈粥狀硬化發生的過程如圖 1-3[16]:. 對於動脈粥狀硬化中的平滑肌細胞內所發生的訊息傳導路徑中, 起初最主要參與的角色為第二型血管收縮素(angiotensin II, Ang II)。 腎素-血管收縮素系統(renin–angiotensin system)是人類體裡一個重 要的水分、血壓調控系統[17, 18]。其中腎素(renin)可以將血管收縮素 原(angiotensinogen)轉換成血管收縮素 I (angiotensin I ),接著藉由血 管收縮素轉化酵素(angiotensin converting enzyme, ACE)轉化成血管 收 縮 素 II , 而 血 管 收 縮 素 II 能 進 一 步 地 刺 激 腎 上 腺 皮 質 固 醇 (aldosterone)調節體內礦物質鹽類與水分。整個系統大致可畫成圖 1-4。. 3.
(13) 調控第二型血管收縮素的受體主要為 AT1 或 AT2,其中 AT1 受 體與 Ang II 結合後會使血管收縮、血壓上升、細胞增生、血管增厚、 細胞內鈣離子濃度增加[19, 20]。而 AT2 對 AT1 有結抗的作用,包括 促進細胞分化、促進細胞凋亡、促進神經細胞再生、抑制細胞生長、 抑制血管新生、促進血壓下降及情緒穩定等[21-23]。然而 Ang II 對 AT1 的結合親和力比與 AT2 結合來得大上好幾倍,且 AT2 在許多細 胞組織上的含量較 AT1 來得稀少[24, 25]。研究報告顯示,第二型血 管收縮素為促進血管平滑肌細胞增生的重要生長因子[26],與心肌梗 塞、心臟衰竭、高血壓病患所產生的心臟肥大有關[27-29],具其作用 主要透過 AT1 受體而來。於文獻中整理出了 Ang II 與 AT1 受體所調 控的功能,如圖 1-5[20]:. 第二型血管收縮素起初會刺激血管平滑肌細胞中的菸鹼醯胺腺 嘌呤二核苷酸(磷酸)氧化酶 (nicotinamide adenine dinucleotide oxidase, NAD(P)H oxidase) 並 產 生 活 性 氧 分 子 (reactive oxygen species, ROS)[30]。活性氧分子是啟動 Ras/Raf/extracellular signal-regulated kinase (ERK)訊息路徑的上游[31, 32],而 ERK 的磷酸化之後的訊息傳 遞對於啟動活化蛋白-1(activator protein-1, AP-1)的轉錄作用有直接的 關係[33]。AP-1 此轉錄因子會促使第一型內皮素(endothelin-1, ET-1) 被合成並進一步地造成細胞的增生[34, 35]。第一型內皮素的作用與 4.
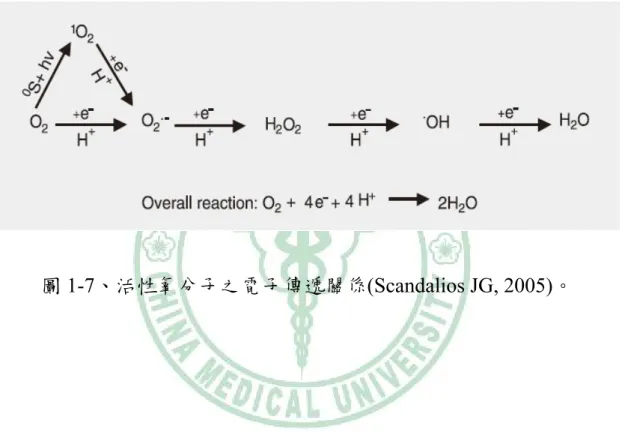
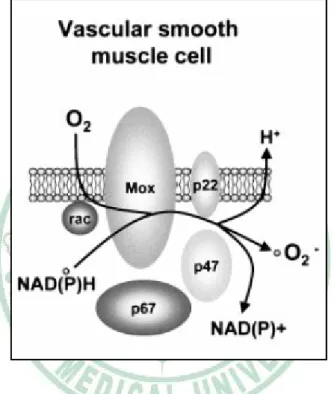
(14) 第二型血管收縮素類似,亦為血管收縮因子,其在血管平滑肌細胞中 被製造出來會被釋放出細胞外,並與細胞上的 ETA 受體結合後更進一 步地刺激細胞增生[36],對於心血管疾病還有血管重造是很重要的一 員。故過量的活性氧分子將引發血管硬化、造成有絲分裂因子的增加 並使得血管平滑肌細胞過度地增生。以上述的訊息傳遞如圖 1-6 所顯 示。. 3. 活性氧分子. 在人體內存在了許多自由基物種,其中最被廣泛的討論莫過於活 性氧分子(Reactive oxygen species, ROS)。所謂的 ROS 為任何帶有一 個或更多不成對電子卻獨立存在的含氧原子或分子,其主要可分為化 學性相當活潑的單一氧分子(O2)、臭氧(O3)、氫氧自由基(OH-)、過氧 化氫(H2O2)、氫過氧化自由基(HO2-)、超氧化物自由基(O2-)、過氧化 脂質(LOPs)、氮氧化物(NOx)等[37]。活性氧分子之電子傳遞關係如圖 1-7 所顯示。. 於細胞組織上的氧化壓力最主要就是來自於活性氧分子,這些氧 自由基具有高度氧化力,可在體內引發連鎖反應,進而攻擊人體細胞 組織。ROS 在細胞內的來源為從 NAD(P)H 氧化酶複合體之催化作用, 其反應系統為圖 1-8[38]: 5.
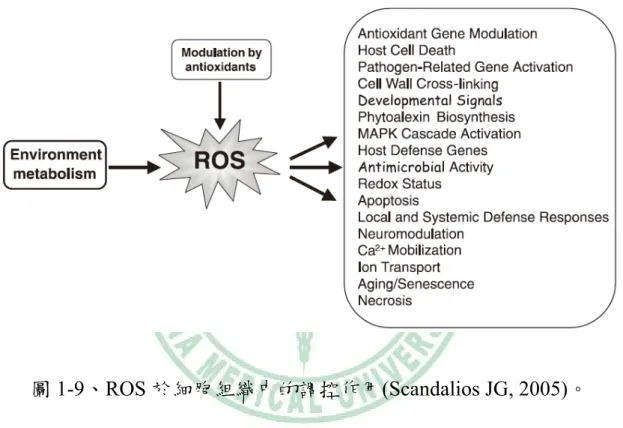
(15) 當細胞長期曝露於過量 ROS 時會造成 DNA、蛋白質和細胞膜脂 質氧化傷害,此與癌症、老化、免疫系統及病及心血管疾病生成有很 重大的關連性。圖 1-9 為 ROS 於細胞組織中的調控作用[37]:. 4. 銀杏及其他抗氧化劑. 銀杏(ginkgo biloba)存在於地球上至少有兩億年之久,成為具有重 要科學價值的活化石[39]。因其生長緩慢,若於祖父輩種植,則至子 孫輩才開花結果,故又別名為「公孫樹」。其在人類使用上已超過兩 千年的歷史,最主要的生長分佈在中國、日本以及韓國成分包含有類 萜(terpenoids)、多酚(polyphenols)、烷基苯酚類(alkylphenols)、有機 酸、碳水化合物、脂肪酸、無機鹽、胺基酸等,然而其最具有藥理活 性 的 成 分 為 葉 內 的 松 烯 內 酯 (terpene lactones) 以 及 黃 酮 類 配 糖 體 (flavonol glycosides),而松烯內酯包含銀杏內酯(ginkgolides A、B、C、 J、M、K、L)、白果內酯(bilobalide);黃酮類配糖體則有山奈黃素 (kaempferol) 、 槲 皮 酮 (quercetin) 、 芹 菜 素 (Apigenin) 、 異 鼠 李 素 (Isorhamnetin)、木犀草素(Luteolin)、楊梅素(myricetin)[40]。這些黃 酮類配糖體皆為現今文獻上熟知的抗氧化、抗自由基、抗發炎、抗凝 血以及抑制細胞生長等成分[41-45]。而銀杏萃取物對調控細胞死亡、 心智腦力、糖尿病及胰島素代謝、心血管疾病亦有改善的功能[46-49]。 6.
(16) 圖 1-10 至 12 為銀杏葉以及松烯內酯、黃酮類配糖體化合物結構[40]。. 銀杏萃取物在臨床用藥上已有頗為廣泛的效益,其對於末梢血管 循環障礙的臨床用量每天約為 17.5mg,對中度及較嚴重的情形每天 為 5ml I.V.或者 I.M.的注射,而對於嚴重且慢性的場合及糖尿病的血 流障礙為每天 50ml 加於 500ml 之點滴液中實行點滴。目前已知銀杏 萃取物具有抑制血小板凝集因子作用,同時可防止抗原─抗體之發炎 反應、抗氧化作用、抗動脈粥狀硬化、預防腦中風[50]。. 由於銀杏萃取物的主要功能為促進全身血液循環,因此可增加新 陳代謝的效率、增加腦部含氧量、調節神經傳導因子,故對於腦部活 化有相當的益處,例如增強學習記憶、加速反應時間及促進精神清楚 敏銳、預防記憶喪失、抗憂鬱、預防以及治療老年癡呆症和腦部不充 分症、精神分裂症輔助療法,改善聽力衰退、耳鳴、暈眩症、梅尼埃 病、阿滋海默症等。其對於改善糖尿病及胰島素代謝作用、癌症之輔 助療法、治療幅射線污染傷害及其他自由基之傷害、高山缺氧症也有 相當的功效[51-68]。. 除了擁有抗氧化能力的銀杏萃取物之外,一般實驗熟知的抗氧化 劑為乙酰半胱氨酸(N-acetyl cysteine, NAC)和二聯苯碘(diphenylene iodonium, DPI)[69]。NAC 是一個著名的抗氧化劑,其氧化還原能力 7.
(17) 可以清除細胞中過多的氧化自由基,使細胞免於氧化自由基造成的傷 害[70];而 DPI 為 NAD(P)H 氧化酶的抑制劑,即能直接阻止掉細胞 內 NAD(P)H 對於活性氧自由基分子的產生[71]。此兩種抗氧化劑將 在此研究中與銀杏萃取物做為比較。銀杏萃取物在臨床用藥上已有頗 為廣泛的效益,其對於末梢血管循環障礙的臨床用量每天約為 17.5mg,對中度及較嚴重的情形每天為 5ml I.V.或者 I.M.的注射,而 對於嚴重且慢性的場合及糖尿病的血流障礙為每天 50ml 加於 500ml 之點滴液中實行點滴。目前已知銀杏萃取物具有抑制血小板凝集因子 作用,同時可防止抗原─抗體之發炎反應、抗氧化作用、抗動脈粥狀 硬化、預防腦中風[50]。. 由於銀杏萃取物的主要功能為促進全身血液循環,因此可增加新 陳代謝的效率、增加腦部含氧量、調節神經傳導因子,故對於腦部活 化有相當的益處,例如增強學習記憶、加速反應時間及促進精神清楚 敏銳、預防記憶喪失、抗憂鬱、預防以及治療老年癡呆症和腦部不充 分症、精神分裂症輔助療法,改善聽力衰退、耳鳴、暈眩症、梅尼埃 病、阿滋海默症等。其對於改善糖尿病及胰島素代謝作用、癌症之輔 助療法、治療幅射線污染傷害及其他自由基之傷害、高山缺氧症也有 相當的功效[51-68]。. 8.
(18) 除了擁有抗氧化能力的銀杏萃取物之外,一般實驗熟知的抗氧化 劑為乙酰半胱氨酸(N-acetyl cysteine, NAC)和二聯苯碘(diphenylene iodonium, DPI)[69]。NAC 是一個著名的抗氧化劑,其氧化還原能力 可以清除細胞中過多的氧化自由基,使細胞免於氧化自由基造成的傷 害[70];而 DPI 為 NAD(P)H 氧化酶的抑制劑,即能直接阻止掉細胞 內 NAD(P)H 對於活性氧自由基分子的產生[71]。此兩種抗氧化劑將 在此研究中與銀杏萃取物做為比較。圖 1-13 為 NAC 與 DPI 化學結構 圖。. 9.
(19) 圖 1-1、在各個不同年齡層中,其因為心血管疾病及癌症疾病之死亡 人數計量圖 (Rosamond W, et al., 2008)。. 10.
(20) 圖 1-2、造成心血管疾病的危險因子(Clark LT, 2002)。. 11.
(21) 圖 1-3、動脈粥狀硬化發生的過程(Dzau VJ, et al., 2002)。 12.
(22) 圖 1-4、腎素-血管收縮素系統。. 13.
(23) 圖 1-5、Ang II 與 AT1 受體所調控的生理機制(Mehta PK, et al., 2007)。. 14.
(24) 圖 1-6、以血管收縮素所誘發之血管平滑肌細胞增生訊息路徑。. 15.
(25) 圖 1-7、活性氧分子之電子傳遞關係(Scandalios JG, 2005)。. 16.
(26) 圖 1-8、NAD(P)H 氧化酶複合體之催化系統(Griendling KK,2000)。. 17.
(27) 圖 1-9、ROS 於細胞組織中的調控作用(Scandalios JG, 2005)。. 18.
(28) 圖 1-10、銀杏葉之外觀構造(Singh B, et al., 2008)。. 19.
(29) 圖 1-11、銀杏葉內所含的松烯內酯之化學結構(Singh B, et al., 2008)。. 20.
(30) 圖 1-12、銀杏葉內所含的黃酮類配糖體之化學結構(Singh B, et al., 2008)。. 21.
(31) NAC. DPI. 圖 1-13、NAC 與 DPI 化學結構圖。. 22.
(32) 第二節、研究目的. 在第二型血管收縮素所引發的訊息傳遞路徑中,以抑制活性氧分 子來達到減少細胞不正常增生的研究已有提出[72-74]。然而我們已知 銀杏萃取物(ginkgo biloba extract, GBE)對於抗氧化有很好的功效,其 為一種血管活化劑,對於自由基的氧化損害亦有良好的保護作用,且 已有文獻指出其對於血管平滑肌細胞增生所形成的粥狀動脈硬化有 關[75-77]。目前已有不少文獻指出銀杏萃取物中主要含有的黃酮苷類 (flavonoid glycosides)對於抗氧化及抑制細胞增生有很好的效果。但銀 杏萃取物對於上述訊息傳導路徑整體上的影響尚未瞭解,故我們以銀 杏萃取物對於第二型血管收縮素所誘發的鼠主動脈血管平滑肌細胞 (A7r5)的增生作用之影響做一研究探討。本研究主要是以經過銀杏萃 取物的加入,觀察細胞內活性氧自由基分子在細胞內的含量、細胞外 信號調節激酶之磷酸化表現量、第一型內皮素表現量以及細胞數目在 上述訊息傳遞路徑中的相關性,最後探討銀杏萃取物對於個別因子的 影響。. 23.
(33) 第二章、研究方法. 實驗流程. 24.
(34) 第一節、研究材料 (一) 培養老鼠動脈平滑肌細胞藥品 1. DMEM(Dulbecco's modified Eagle's medium, GIBCO, USA) 2. PBS(Dulbecco’s Phosphate-Buffered Saline, GIBCO, USA) 3. NaHCO3 (Sigma, USA) 4. penicillin-streptomycin (Invitrogen, USA) 5. Trypsin (Invitrogen, USA) 6. FBS(Invitrogen, USA) (二) 藥品 1. Ginkgo biloba extract (Equivalent to 0.84mg ginkgoflavonglycosides calculated as quercetin, kaempferol and isorhamnetin) (CHI SHENG, 台灣) 2. DPI(diphenyl iodonium, Sigma, USA) 3. NAC(N-acetyl-cysteine, Sigma, USA) 4. Angiotensin II, Human (CALBIOCHEM, USA) (三) HE stain for paraffin sections 1. Gill’s Hematoxylin solution (Invitrogen, USA) 2. Eosin Y solution (Invitrogen, USA) 3. Ammonium water (Sigma, USA) 4. Xylene (J.T.Baker1330-20-7, USA) 5. 95% 及100% ethanol (東華化工原料儀器行) 6. PBS (Gibco, 21600-010, USA) 25.
(35) (四) 蛋白質定量試劑 Lowry protein assay 1. Na-K tartate (Potassium Sodium Tartate, Sigma, P-0165, USA) 2. CuSO4.5H2O(Copper [Ⅱ] Sulfate pentahydrate, 和光, 030-04425, 台灣) 3. Na2CO3 (Sodium Carbonate, 和光, 199-01585, 台灣) 4. NaOH (Sigma, S-5881, USA) 5. Folin-Ciocalteu phenol reagent (和光, 279-08895, 台灣) (五) 西方墨(漬)點 Wesrern blotting 1. Tris-base (USB, T8600, USA) 2. NaCl (Sigma, S-7653, USA) 3. β-mercaptoethanol (Pharmacia Bioetch, 17-1317-01, Sweden) 4. Glycerol (Angus, 07-52305, USA) 5. NP40 (Sigma, I-3021, USA) 6. Protease inhibitor cocktail tablet (Roche, D68298, Switzerland) Wesrern Buffer 7. 40% Acryamide/ Bis Solutiom 29:1 (MDBio, 903039, USA) 8. Tris-base (pH 8.8) (USB, T8600, USA) 9. SDS (Sodium dodecyl sulfate, Sigma, S-5761, USA) 10. Tris-base (pH 6.8) (USB, T8600, USA) 11. odium dodecyl sulfate (SDS, Sigma, S-5761, USA) 12. Ammonium persulfate (APS, Amresco, 0486-25G, USA) 13. TEMED (tetramethylenediamine platinum Plus [CPG], P-E90051) 14. Glycine (USB, G-8165, USA) 26.
(36) 15. Glycerol (Angus, 07-52305, USA) 16. Methanol (台灣聯工, 940103, 台灣) 17. Tween 20 (Pharmacia Biotech, 17-1316-01, USA) 18. NaCl (Sodium chloride Sigma, S-7659, USA) 19. Ponceau S solution (Sigma, P-7170, USA) 20. Blocking buffer (安佳脫脂奶粉, Anchor New Zealand Milk, 台灣) Antibody 1. β-tubulin (Santa Cruz Biotechnology) 2. ERK. (Santa Cruz Biotechnology). 3. ERK. phosphorylation (Santa Cruz Biotechnology). (六) MTT assy 1. MTT cell proliferation assy kit (Invitrogen, USA) 2. PBS (Gibco, 21600-010, USA) 3. Isopropanol (Sigma, I-9516, USA) (七) Flow 1. CM-H2DCFDA (Invitrogen, USA) 2. PBS (Gibco, 21600-010, USA) 3. DMSO (Sigma, USA) (八) RNA Extraction 1.. 75 % ethanol (東華化工原料儀器行). 2.. 0.1 % DEPC (高階的) (Sigma, USA). 3.. Ul traspec(Invitrogen, USA). 4.. Chloroform (Sigma, C-243, USA) 27.
(37) 5.. Isopropanol (Sigma, I-9516, USA ). (九) RT-PCR 1.. RT-PCR Kit Components (Invitrogen, USA). Component: (1) RT Enzyme Mix(includes SuperScriptTM III RT and RNaseOUTTM) (2) 2X RT Reaction Mix(includes oligo(dT)20 (2.5µM), random hexamers (2.5ng/µl), 10mM MgCl2 , and dNTPS) (3) E. coli RNase H 2.. primer 合成(Invitrogen, USA). (1) rat GAPDH primer (forward)5'AgACA gCCgC ATCTT CTTgT (2) rat GAPDH primer (reverse)5'TACTC AgCAC CAgCA TCACC (3) rat ET-1 primer (forward) 5'gAAAC AgCTg TCTTg ggAgC (4) rat ET-1 primer (reverse) 5'CTgTT CCCTT ggTCT gTggT 3. 跑電泳 (1) Agarose LE (MDBio, Inc) (2) TBE buffer (Invitrogen, USA). 第二節、實驗儀器 名稱. 廠牌. 核醣核酸分析系統. BIO-RAD. 聚合酶連鎖反應器(基因擴增儀). TECHNE. 28.
(38) 冷光螢光儀LA-300. FUJIFILM. 電源供應器. MAJOR SCIEIVCE. 蛋白質轉漬電泳套組. Hoefer. SDS-PAGE電泳槽套組. Hoefer. 水浴加熱器. FIRSTEK SCIENTRIC. 高壓殺菌釜. Tomin TM322. 水浴加熱器. TKS WB201. 核酸雜交烘箱. OH-800HYBRIPIZATI. 微量天平. OHAUS. 天平. OHAUS. PH meter. Microcomputer pH/mV/TEMP METER 617. 去離子水製造機(Millipore). Nalgene. 離心機(Centrifuge). Kubota-1720. 分光光度計(Spectrophotometer). Hitachi U-2001. 電泳照相組合Bio Doc-It 2UV. UVP. 顯微鏡. OLYMPLS. 乾浴器. PANTECH. 37℃ 5% CO2培養箱. REVCO. 29.
(39) 第三節、研究設計 A. 細胞培養. 本細胞實驗所用之細胞為(A7r5)老鼠動脈平滑肌細胞,培養在含有 penicillin (100 U/ml) and streptomycin (100 µg/ml)、10% fetal calf serum 及NaHCO3的 DMEM medium 中,並置於含5%CO2的37℃培養箱中 培養,大約每隔二~三天更換一次培養基。當細胞長到約七~八分滿時 需要進行分盤。 (一)解凍細胞: 從液態氮筒中取出冷凍管,以 37℃水域槽迅速回溫 2 分鐘,在無菌 操台上操作,以 10 ml pipette 吸置於 15ml 離心管中抽吸幾下,再進 行離心。轉速 1600 rpm,3 分鐘。抽出上清液,再加入新鮮的 10 ml medium 沖細胞抽吸幾下,再轉置於 10cm dish 隔天需要換 medium。 (二)換 medium: 使用前先將 10%DMEM medium 及 1x PBS 置於 37℃水域槽回溫 30 分鐘。在無菌操作台上抽掉舊的 medium,加入 3ml PBS buffer 清洗, 重複洗 2 次之後抽掉 PBS buffer 再加入 10ml 新的 medium 大約 2~3 天換一次 medium。 (三)細胞分盤: 30.
(40) 使用前先將 10%DMEM medium、0.5% Trypsin 及 1x PBS 置於 37℃ 水域槽回溫 30 分鐘。無菌操作台先以 9 吋玻璃管接抽氣幫浦將舊的 medium 抽掉。再使用 10 ml pipette,將每個 plate 加入 3 ml PBS buffer 做 wash,重複洗 2 次,洗完後同樣將 PBS buffer 抽乾淨。接著加入 1 ml trypsin 於每一個 plate 中,稍微搖動 plate 協助 trypsin 作用。取新 的 plate,標示清楚。更換新的 10 ml pipette,並在新的 plate 各加入 7 ml 新 medium。再取約 9~10 ml 新 medium 加到舊的 plate 中,以抽 吸方式將細胞打散。最後加入 3 ml 含細胞 medium 於每個新 plate 中, 共 10ml 即達到稀釋效果,將新的 plate 上下左右搖動使細胞能均勻分 布於新 plate 中。顯微鏡觀查稀釋情形後將細胞在放置於培養箱進行 培養。將餘液抽乾,reagent 收回,最後收拾操作台。. B. HE stain 染劑法 (一)試劑配製: 1.. Gill’s Hematoxylin solution: 直接使用,每三周更換一次. 2.. Eosin Y solution: 180ml 0.5% Eosin Y 加 2ml 冰醋酸(新鮮配置). 3.. Ammonium water: 180ml ddH2O 加0.3 ml 30% NH4OH(新鮮配 置). 31.
(41) 4.. Xylene、95% 及100% ethanol: 每次更新. 5. PBS buffer (二)加藥處理完後先用 PBS buffer 洗兩次,Warm xylene 2 min (63℃ 預熱 10 min)緩慢加入,100% ethanol 1 min、95% ethanol 30 sec、PBS buffer 30 sec、Hematoxylin 35 sec、PBS buffer 30 sec、Ammonium water 30 sec、PBS buffer 30 sec、95% ethanol 30 sec、Eosin35 sec、最後 95% 及 100% ethanol 1 min(各別兩次),xylene 反應 5 min 後抽掉加入 PBS buffer,電子顯微鏡下觀察。. C. 西方墨漬法 Western blot (一)細胞萃蛋白 萃蛋白前先做加藥處理,當細胞養到 8 分滿時,換 serum-free medium (使細胞處於飢餓狀態)。 serum-free(12hrs)→銀杏、NAC 4 µM、DPI 10 µM (30min) →Ang II 0.1 µM (5min)→收細胞。 銀杏萃取液 (0.84 mg/ml = 840 µg/ml) control. 12.5. 25. 50. 100. 0µl. 40µl. 30µl. 20µl. 10µl. 抗氧化劑. 32.
(42) NAC 4 µM DPI 10 µM 100µl. 50µl. 將舊的 medium 抽掉,以 PBS buffer 做 wash,重複洗 2 次之後加入 serum-free medium,並置於 37℃培養箱 12hrs。 (二)加藥處理 銀杏萃取液(0.84 mg/ml = 840 µg/ml)預配成(12.5、25、50、100 µg/ml stock),所以加入銀杏萃取液分別是(0、168、337、675、1351µl )、 NAC 4 µM(100µl)、DPI 10 µM(50µl),並置於 37℃培養箱 30 min。再 於每個 plate 中加入 Ang II 0.1µM (10µl) 再置於 37℃培養箱 5min 。 接著取出 plate,並將 plate 放置於冰上,將 medium 倒掉於廢液瓶中。 加 PBS buffer wash 2 次,同樣將 PBS buffer 倒掉,再用 pipette 將邊 緣的餘液儘量吸乾,加入大約 200ul 的 lysis buffer 到 plate 中。將欲 分裝蛋白的 eppendrof 標示好。用刮棒將 plate 上細胞刮下(先將刮棒 上酒精擦乾,刮的方式可先刮外面一圈,再刮 plate 中間部分,最後 將細胞集中在邊緣處)。將刮下的細胞分裝到新的 eppendrof。將 eppendrof 放到冰上後震盪,並且每隔 5 分鐘後震盪一次共 30 min, 之後再用 12000rpm,4℃,離心 20min。最後取上清液,分裝到新的 eppendrof,保存於-80 ℃。 (三)蛋白質濃度測定( Lowry protein assay ) 蛋白質的定量採用Lowry protein assay,其原理為蛋白質胜肽先與鹼 33.
(43) 性 溶 液 中 的 銅 離 子 作 用 , 蛋 白 質 中 tyrosine 及 tryptophan 再 還 原 phosphomolubdate 而形成有顏色之複合物。 本方法過程為當鹼性銅離子試劑與蛋白質中少數胜肽腱(peptide bond)反應,產生低層次之biuret顏色,其次當folin-Ciocalteu phenol reagent 試劑加入後,與蛋白質中的tyrosine 及tryptophan 反應後產生 藍綠色之複合物。. 1. 首先配製 standard: BSA 的濃度為 0.5mg/ml µg/µl. 0. 0.1. 0.2. 0.3. 0.4. 0.5. ddH20. 50µl. 40µl. 30µl. 20µl. 10µl. 0µl. BSA. 0µl. 10µl. 20µl. 30µl. 40µl. 50µl. 2. 配製 sample: 10X ddH20(PBS) 45µl sample. 5µl. 同時以BSA (Bovine Serium Albumin)當作對照組,首先配製standard (0,0.1,0.2,0.3,0.4,0.5 mg/ml,用來當作標準曲線,接著將樣 品稀釋為10倍(總體積為200 μ l),步驟為二重複。 1. 各取50ul 的 standard 及 sample. 34.
(44) 2. 加入 250ul 的三種溶液均勻混合為一(Na-K:CuSO4:Na2CO3=1: 1:98 之比例混合,需現配先加 Na2CO3,再加 Na-K,最後加 CuSO4 後 vortex 一下),於室溫下作用 10 分鐘。 3. 加入 25ul Folin reagent,混合並於室溫下 30 分鐘。 4. 取 200ul 到 96-well plate 上。以 750nm 吸光值波長測 ELISA 吸光 值。 SDS-聚丙烯胺板膠電泳之上層膠體為 12% Stacking gel,下層膠體為 12% Separating gel。先配 separating buffer 為 separating gel,加入水將 separating gel 壓平,約等 30 分鐘待凝,接著將水倒掉。接著再先配 stacking buffer 為 Stacking gel,且於 stacking gel 插上 comb,待凝, 等要加入蛋白樣品溶液再將 comb 拔起來。取樣品蛋白 30 mg 與 5X Loading dye 混合均勻 protein denature 120℃,5 分鐘。再進行 SDS聚丙烯胺板膠電泳分析,將做好之板膠固定到電泳裝置上,並將電泳 緩衝液(running buffer)注滿電泳槽,然後將處理過的蛋白樣品溶液 加入板膠上所形成的 U 型槽中,以 90 伏特(依所需時間進行調整)進 行電泳。電泳結束後配製 transfer buffer 進行蛋白轉移,將膠體取出, 預先用甲醇浸濕的 PVDF membrane。順序由下而上(由黑至白)置入: 菜瓜布→濾紙→膜→膠→濾紙→菜瓜布,扣上後放入 transfer system 內含有 transfer buffer。於 4℃下進行 100 伏特電壓轉移,電轉移 1 個 35.
(45) 半小時之後,取出 PVDF membrane 浸入含 5 %(w/v)脫脂牛奶 (Blocking buffer)/(TBS-non-fat milk powder)於室溫下搖動反應一小時。 將 PVDF membrane 置於 4℃冰箱中與一級抗體反應隔夜,之後以 Washing buffer(1XTBS)清洗三次,每一次 10 分鐘,最後再清洗一次 到掉即可。再以二級抗體 (2μl/ml /1X TBS buffer)於 4℃下反應 1 小時, 同樣以 TBS 清洗 PVDF membrane wash 3 次,每次 10min,加在 membrane 上加入混合體積 1:1=A:B 液,進行冷光螢光儀反應。 Separating: 2M Tris-base(PH8.8). 75ml. 10%SDS. 4ml. ddH2O. 21ml. stacking: 1M Tris-base(PH6.8). 50ml. 10%SDS. 4ml. ddH2O. 46ml. Separating gel(12%)三片量: ddH2O. 9.9ml. 40%Acyl-Bis. 6.75ml. Separating. 5.625ml. 10%APS. 180μl. TEMED. 30μl. stacking gel(12%)三片量:. 36.
(46) ddH2O. 6.5625ml. 40%Acyl-Bis. 937μl. stacking. 2.5ml. 10%APS. 80μl. TEMED. 20μl. Running buffer: Tris-base. 0.75g. Glycine. 3.675g. 10%SDS. 5ml. ddH2O. 加到 250ml. Transfer buffer: Tris-base. 3.033g. Glycine. 14.4g. Methanol. 200ml. ddH2O. 加到 1L. 5% Blocking buffer: 奶粉. 5g. 1XTBS. 100ml. D. MTT cell proliferation assy (一) Ang II time course 加藥處理 將細胞分到 24-well plate 進行培養,每一個 well 都種 104 個細胞。將 舊的 medium 抽掉,加入 serum-free medium,並置於 37℃培養箱 2~4 37.
(47) hrs。之後進行 Ang II time course 加藥處理,每一個 well 加入 Ang II 0.1 µM(10µl),反應時間各別為(0、1、6、12、24hrs)。再將有加藥處理 的 serum-free medium 抽掉,準備 12mM 的 MTT 保存溶液(stock solution ),加入 1ml 的無菌 PBS 到裝有 5mg 的 MTT 的瓶子裡,用震 盪器震盪讓它完全溶解。現配 1X MTT(10 X MTT : serum-free medium =1:9),每 well 加入 200µl MTT,於 37℃培養箱反應 3hrs 後將 MTT 抽掉。每 well 加入 300µl Isopropanol 後搖晃 10 分鐘。取 200µl 置於 96-well plate,以 540nm 吸光值波長測 ELISA 吸光值。 (二) 加藥處理 將細胞分到 24-well plate 進行培養,每一個 well 都種 104 個細胞。將 舊的 medium 抽掉,加入 serum-free medium,並置於 37℃培養箱 2~4 hrs。之後先加入銀杏萃取液(0、16.8、33.7、67.5、135.1µl ) 、NAC 4 µM(10µl)、DPI 10 µM(5µl)加藥處理置於 37℃培養箱反應 30 分鐘, 之後在於每一個 well 加入 Ang II 0.1 µM(1µl),再將有加藥處理的 serum-free medium 抽掉,準備 12mM 的 MTT 保存容易(stock solution ), 加入 1mL 的無菌 PBS 到裝有 5mg 的 MTT 的瓶子裡,用震盪器震盪 讓它完全溶解。現配 1X MTT(10 X MTT : serum-free medium =1:9), 每 well 加入 200µl MTT。於 37℃培養箱反應 3hrs 後將 MTT 抽掉, 每 well 加入 300µl Isopropanol 後搖晃 10 分鐘。取 200µl 置於 96-well 38.
(48) plate,以 540nm 吸光值波長測 ELISA 吸光值。. E. Flow cytometry 將細胞種植於 6-well plate 進行培養,每一個 well 都種 2 x 105 個細胞。 將舊的 medium 抽掉,加入 serum-free medium,並置於 37℃培養箱 2~4 hrs。之後先加入銀杏萃取液(0、16.8、33.7、67.5、135.1µl ) 、 NAC 4 µM(10µl)、DPI 10 µM(5µl)加藥處理置於 37℃培養箱反應 30 分鐘,之後在於每一個 well 加入 Ang II 0.1 µM(1µl) 置於 37℃培養箱 反應 12hrs,再將有加藥處理的 serum-free medium 抽掉,以 PBS buffer 做 wash,再將 PBS buffer 抽乾淨。每一個 well 加入 200µl trypsin 反 應 3~4 分鐘,再加入 800µl 新的 medium 以抽吸方式將細胞打散並收 到 tube,於 4℃下以 1500rpm 轉速離心 5 分鐘,再以 PBS buffer 做 wash 於 4℃下以 1500rpm 轉速離心 5 分鐘重複 2 次。Wash 第 2 次離 心 後 用 500µl PBS buffer 回 溶 , 配 染 劑 CM-H2DCFDA 50µg→10nm(final)→10µm(stock)。取一管染劑需避光並且加入 86µl DMSO 混合均勻,加染劑於每 tube 5µl 注意避光在於 37℃水域槽反 應 30 分鐘,於 4℃下以 1500 rpm 轉速離心 5 分鐘後,再抽掉上清液 並且加入 500µl PBS buffer 回溶,transfer 至 FACS 管中,以流式細胞 儀進行樣品分析。 39.
(49) F. RNA Extraction (一)藥品的配置: 1. 75 % ethanol (以 0.1 % DEPC 水稀釋)配 50 ml,(取 37.5 ml 100 % ethanol+12.5 ml 0.1 % DEPC 2. 0.1 % DEPC (1 ml DEPC 加入 ddH2O 至 1L)(取 1000 ml ddH2O,抽 出 1 ml ddH2O 後,再加入 1 ml DEPC )用力搖盪,放置 overnigt 拿 去滅菌 細胞加藥處理完後,細胞先用 2 ml PBS(外用)洗兩次再加入 1 ml Ul traspec(Ul traspec 因有結晶,所以使用前要先在 37℃水浴槽內回溫 10 min,之後馬上插入冰上。且加入細胞前要用力搖勻)再把細胞刮下 來放於冰上 4℃均質 5 min,均質過程中會產熱故需降溫,避免 RNA Degradation。接著.加入 0.2 ml Chloroform (Ultraspec: Chloroform=1: 0.2),上下混和均可-目的要將 RNA 與 Protein 去除,而得到較純的 RNA。靜置冰上 5 min,12000 rpm,4℃,15 min,取出澄清液(透明 層,不要抽到下層乳白物;一般量約為 0.5~0.6ml)放入新的 eppendrof。 加入等量的 Isopropanol(約 0.5~0.6ml),上下輕輕搖均(15 下)- -此步 驟非常重要,若做不好得不到 RNA。靜置冰上 eppendrof 或是放在 -20℃,等到下次要翻 RT 在繼續做。以 12000 rpm,4℃,30 min 後 倒掉上清液 eppendrof 底部出現微量乳白色 RNA 沉澱物 40.
(50) 加入 1 ml (75 % ethanol 75 ml+以高階的 0.1% DEPC 25ml),wash 沉澱 物,兩次(不要讓沉澱物掉下來)。用 tip 把上輕易盡量吸乾,之後將 eppendrof 到至於擦手紙上晾乾(或是在烘箱,37 ℃)使沉澱物變透明狀 即可,不需完全乾燥。目的:使酒精完全消失,避免殘留的酒精會影 響 RNA 的 OD 值。加入 20~40µ l 0.1% DEPC,使 RNA 溶解。要 mix 均勻,抽吸溶解。於水浴 56 ℃10 min。測 OD 值,接著做 PT-PCR 最 好。取 2µ l sample 稀釋成 200 µl(ddH2O:198 ul )抽 180µ l 稀釋好至 石英管中測定。 (二)測 OD 值: 打開電源,按 RNA/DNA 鍵,接著按 select 鍵,選擇 RNA 在按 Enter 設定基本值為 OD=260,取石英管先以 ddH2O 洗 3 次再以 75 % ethanol 洗 3 次甩乾石英管內的水一開始先測 blank(180µl),擦拭乾淨 石英管測 OD 值得側面,用拭鏡紙擦,放入凹槽方向為上到下偵測。 按 Read blank 值為 0,再按 select 鍵接著繼續測 sample 按 Read sample ,記錄結果數值。 (三) RT-PCR. 2X RT Reaction Mix. 5µl. RT Enzyme Mix. 1µl. 41.
(51) RNA(up to 1µl ). Xµl. DEPC. 補到 10µl. 另外配置. Mix sample (DEPC 水加RNA),先incubate tube 25℃10 min,再 50℃30min 接著85℃ 5 min 後取出放於冰上, 接著加入1µl E. coli RNase H 再incubate 37℃20 min,最後將sample放置於-20℃。 (四) PCR PCR Super mix. 22.5µl. rat GAPDH primer (forward) 200nM. 0.25µl. rat GAPDH primer (reverse) 200nM. 0.25µl. cDNA. 2µl. Total. 25µl. PCR Super mix. 22.5µl. rat ET-1 primer (forward) 200nM. 0.25µl. rat ET-1 primer (reverse) 200nM. 0.25µl. cDNA. 2µl. Total. 25µl. Denature 94℃ 30 s Anneal 55℃ 30 s Extend 72℃ 1 min per kb (五)跑電泳. 42.
(52) 配膠取 1g Agarose LE +1X TBE buffer 100 ml ,配 Sample 10 µl + dye 2 µl、mark 5µl,100V 負極往到正極跑,Agarose gel 於 Etbr 10 min 後拍片。. 43.
(53) 第三章、研究結果 第一節、Ang II 誘導鼠血管平滑肌細胞增生之時間反應 鼠血管平滑肌細胞(VSMCs)在加入 Ang II 0.1µM 培養後,Ang II 在 1、6、12、24 小時後拍照,如圖 3-1,可得知平滑肌細胞隨時間而 增加,MTT assay 如圖 3-2 所顯示 Ang II 所誘導第 1 和第 6 小時就血 管平滑肌細胞增生效果,其在第 12 和 24 小時 Ang II 所誘導之鼠血管 平滑肌細胞更為明顯地增生,而在第 24 小時的時候細胞則有大量增 生的情況。此部分實驗證明了 Ang II 確實可以造成鼠血管平滑肌細胞 的增生。. 第二節、銀杏萃取物(GBE)對鼠血管平滑肌細胞之劑量反應 由圖 3-3 觀察出單純以 GBE 12.5~100µg/ml 對鼠血管平滑肌細胞 明顯降低並沒有顯著影響,而 GBE 200µg/ml 時細胞數量明顯降。依 此推測當 GBE 濃度為 200µg/ml 時對細胞有毒殺作用。因此下列實驗 作用的 GBE 劑量為 12.5~100µg/ml。. 第三節、GBE 於對於 Ang II 所誘發之鼠血管平滑肌細胞增生之影響 由圖 3-4 可知,Ang II 0.1µM 可明顯增加血管平滑肌細胞數量, 而此上升被 GBE 所抑制,且其 GBE 為低濃度就有抑制效果,並且其 44.
(54) 抑制效果會隨劑量增加而上升,NAC 及 DPI 為已知之抗氧化劑。從 圖 3-4 結果顯示當完全沒有加入 GBE 時細胞數量大增,而在其於濃 度反應後之 GBE 及 NAC、DPI 皆具有抑制細胞增生的作用,故證明 了 GBE 在整個細胞層級上的確可以抑制細胞增生的作用。. 第四節、GBE 對於以 Ang II 所誘導之鼠血管平滑肌細胞增生中活性 氧分子含量之影響 由圖 3-5 可得知流式細胞儀測量細胞中的活性氧分子(ROS)含量 之實驗結果,Ang II 0.1µM 可以看出 ROS 的含量明顯地增加。隨著 GBE 濃度愈高所抑制的 ROS 之含量就愈多。而其 GBE 濃度為 100µg/ml 所以抑制 ROS 之含量效果相當於此抗氧化劑。DPI 10 µM 所能抑制的 ROS 含量也比 NAC 4 µM 來得多。從圖 3-6 之量化圖可 以看出 ROS 的量隨著 GBE 濃度增加而減少,此實驗確實地證明了 GBE 具有減少 ROS 在細胞中含量的功能。. 第 五 節 、 GBE 對 於 以 Ang II 誘 導 鼠 血 管 平 滑 肌 細 胞 增 生 中 extracellular signal-regulated kinase phosphorylation 表現量 之影響 從圖 3-7 之 western blot 實驗結果看出 ERK phosphorylation 的表. 45.
(55) 現量,Ang II 0.1µM 刺激 ERK 有大量被磷酸化的現象,在 GBE 濃度 為 25 µg/ml 下,可以顯著地抑制較多的 ERK 被磷酸化。在此實驗結 果中顯示 ERK phosphorylation 的表現量並非有愈高濃度的 GBE 就能 抑制愈多的 ERK 被磷酸化,而從 NAC 及 DPI 兩組實驗上亦可看出 DPI 10 µM 抑制 ERK 被磷酸化效果比 NAC 4 µM 稍差些。在此實驗 結果中雖說沒有愈高的 GBE 濃度即能抑制愈多的 ERK 被磷酸化,但 相對照於有 Ang II 所誘導的細胞增生中,GBE 確實可以減少 ERK phosphorylation,尤其是在 GBE 濃度為 25 µg/ml 就有明顯的表現量 減少。. 第 六 節 、 GBE 對 於 以 Ang II 誘 導 鼠 血 管 平 滑 肌 細 胞 增 生 中 endothelin-1 表現量之影響 在圖 3- 8 中看出以 Ang II 所誘發的細胞增生中,從實驗結果就可 以很明顯地可以看出第一型內皮素 endothelin-1(ET-1)的含量在完全 沒有任何抗氧化劑下有大量的表現。而其表現量依加入的 GBE 濃度 增加呈現一梯度的降低,且在 GBE 濃度為 25 µg/ml 下則有顯著的抑 制效果。NAC 以及 DPI 亦可抑制其表現量並達到差不多的效果。對 於此實驗結果可得知於 GBE 及其他抗氧化劑的鼠血管平滑肌細胞中 ET-1 其含量能有明顯地減少。 46.
(56) 第四章、討論 本研究最主要是觀察 GBE 在以第二型血管收縮素刺激誘發鼠血 管平滑肌細胞增生中的影響,對於細胞內將造成細胞增生的訊息傳導 路徑上各個有興趣的因子做實驗觀察後進行討論。其主要是以 GBE 對於 ROS、ERK phosphorylation 及 ET-1 個別表現量做探討,最後歸 納出 GBE 對於整體之影響。. 第一節、結果討論 從結果顯示出,以 MTT assay 實驗出的 Ang II time-course 隨著時 間增長而使鼠血管平滑肌細胞持續增生,故可以知道在此實驗中 Ang II 確實可以使細胞增生(圖 3-1, 3-2),然而在第 24 小時則有大量的細 胞增生。在不加入 Ang II 只單純加入 GBE 於濃度 100 µg/ml 以下時, 而 GBE 在濃度 200 µg/ml 時,細胞數量明顯減少了,顯示出了在此 濃度下 GBE 具有細胞毒殺性(圖 3-3)。為了瞭解 GBE 對於 Ang II 所 造成的鼠血管平滑肌細胞增生作用的影響,各個不同 GBE 的濃度將 加入經過增生作用過後的細胞,而從結果可看出有愈高濃度的 GBE 則能抑制愈多的細胞增生(圖 3-4)。接著為了測量 ROS 在不正常增生 的細胞中的含量,我們以流式細胞儀量測出的結果顯示,在加入 25µg/ml 的 GBE 時就明顯地使 ROS 減少(圖 3-5),而有愈高濃度的 47.
(57) GBE 對於 ROS 就有愈大的抗氧化能力,其中原本就是抗氧化劑的 DPI 有最大的抗氧化能力。在磷酸化的 ERK 的結果中可以看出,加 入 GBE 能夠降低其表現程度,可以推知 GBE 可以經由抑制 ROS 而 使訊息無法傳遞到下游並使 ERK 無法被磷酸化或者是 ERK 的磷酸化 直接有被 GBE 給影響。但似乎並非抑制了愈多的 ROS 就愈能讓 ERK 不被磷酸化,因為從結果顯示,ERK 的磷酸化並無依抗氧化劑濃度 的增加而減少,這可以在 GBE 於 100 µg/ml 時以及 DPI 對於抑制 ROS(圖 3-6)以及 ERK phosphorylation 的結果(圖 3-7)看出。對於此結 果的推論可以歸咎於 GBE 內含有之 quercetin 對於細胞內 ERK phosphorylation 有降低的作用[78],而或許還有其他途徑會造成 ERK phosphorylation 表現量的改變。在此研究中的訊息路徑裡最後所關心 的 ET-1 表現量將由 RT-PCR 實驗來觀察,結果顯示出 ET-1 的基因表 現量在 GBE 的濃度增加之下降低,在 GBE 25 µg/ml 時顯著地使 ET-1 的表現量降低。. 第二節、其他相關性討論. 1. 其他因子對於血管平滑肌細胞增生之作用 對於除了以 Ang II 促使血管平滑肌細胞增生的研究之外,以 ET-1 促進血管平滑肌細胞增生的討論亦有不少研究發表[79-81]。由於 48.
(58) ET-1 所誘發的細胞增生也跟細胞內 ROS 增加並傳導 MAPKs 的訊息 路徑有關,故其扮演的角色與 Ang II 相當[82]。除了 ET-1 會促進血 管平滑肌細胞增生之外,血管內皮生長因子(VEGF)亦可以刺激血管 平滑肌細胞。此生長因子據文獻可知其可由血管平滑肌細胞產生,並 又可與細胞上的 VEGF 的受體結合誘發 NF-κB 訊息路徑而造成細胞 增生並遷移[83]。另有研究指出血小板衍生生長因子(PDGF)、轉型生 長因子-β(TGF-β)、單核細胞趨化蛋白-1(MCP-1)也可以刺激細胞並經 由 ERK 訊息路徑造成血管平滑肌細胞增生以及遷移[84-88]。事實上 血管平滑肌細胞增生的相關研究除了對於心血管疾病之外,其對於癌 症細胞之研究來說亦是一大主角[89, 90]。因為在腫瘤形成的過程中, 血管的增生對於提供腫瘤細胞的養分是最重要的事件之一,但本研究 只把焦點放在心血管疾病上是因為其好發於國人並較具有威脅性。 2. GBE 對於其他細胞之影響 GBE 對於血管保護、抗氧化、減少高血壓形成、抗發炎、抑制血 清中的血管收縮素轉換酶以及抑制細胞增生的作用已被廣泛地研究 [91]。且除了在鼠主動脈血管平滑肌細胞增生的研究之外,在鼠主動 脈血管內皮細胞、人類主動脈血管平滑肌細胞、胃癌細胞、胰癌細胞、 肝癌細胞、肺癌細胞等皆有在抑制細胞增生之作用上被研究[92-98]。 可見得 GBE 對於體內不正常細胞增生的抑制作用是相當具功效的。 49.
(59) 第五章、結論與研究未來發展 第一節、結論. 以第二型血管收縮素對於鼠血管平滑肌細胞所造成的細胞增生 作用在我們的實驗中很明顯地看得出來隨著時間的增加,細胞也跟著 增生。而在測量活性氧分子含量的實驗結果中顯示銀杏萃取物發揮了 其抗氧化的能力,有愈高的濃度的銀杏萃取物則就能抑制愈多量的活 性氧分子。然而對於細胞外信號調節激酶的磷酸化的表現,銀杏萃取 物的濃度卻跟其磷酸化的降低量無線性關係的存在。在我們所感興趣 的訊息傳導路徑上最後一個因子,第一型內皮素的表現量就如銀杏萃 取物對於鼠血管平滑肌細胞增生的抑制量,可以知道 AP-1 此轉錄因 子的啟動對於兩者表現量的貢獻是相當的。綜合以上的實驗結果,我 們發現了在銀杏萃取物於 25 µg/ml 對於各個所探討的因子剛好都能 有顯著的抑制效果。而就推論銀杏萃取物是先發揮其對於活性氧分子 的抗氧化能力而使得訊息無法傳遞給下游,最後抑制了血管平滑肌細 胞的增生(圖 3-9)。這些實驗結果支持了銀杏對於與血管平滑肌細胞 增生相關的血管疾病之治療潛能。. 50.
(60) 第二節、研究未來發展. 由於銀杏萃取物在鼠血管平滑肌細胞增生作用上已有不錯的抑 制效果,故我們可以進一步地朝動物實驗或者是人體實驗,從複雜的 腎素-血管收縮素循環系統中觀察銀杏萃取物的反應,期待或許銀杏 萃取物能對此循環系統上的哪一關鍵點能有效用,進而改善心血管疾 病的發生情況。銀杏萃取物中含有黃酮苷類 quercetin、kaempferol、 isorhamnetin 之衍生物,而目前對於這些化合物已被廣泛地研究中, 或許吾人可先藉由高壓管柱層析來將此實驗中所用的銀杏萃取物中 各個成分分離,再來研究其每個成分對於細胞的作用為何,何者所能 抗氧化的程度最高、何者會影響 ERK 磷酸化路徑造成其他作用、何 者可能為影響細胞增生的最主要角色,以及何者可能為扮演細胞毒殺 作用的最主要角色。依此再從類似此些天然化合物的結構上改良或發 現有新的化合物能比銀杏萃取物中的成分還要有效的分子,則勢必可 以對此一疾病的治療或抗氧化的功效有更顯眼的進步。. 51.
(61) 參考文獻 [1]. [2] [3] [4]. [5]. [6]. [7]. [8]. Bruandet A, Richard F, Bombois S, Maurage CA, Deramecourt V, Lebert F, et al. Alzheimer disease with cerebrovascular disease and vascular dementia: clinical features and course compared with Alzheimer disease. J Neurol Neurosurg Psychiatry 2009;80:133-139. Cechetto DF, Hachinski V, Whitehead SN. Vascular risk factors and Alzheimer's disease. Expert Rev Neurother 2008;8:743-750. Deedwania P, Srikanth S. Diabetes and vascular disease. Expert Rev Cardiovasc Ther 2008;6:127-138. Corenblum MJ, Wise VE, Georgi K, Hammock BD, Doris PA, Fornage M. Altered soluble epoxide hydrolase gene expression and function and vascular disease risk in the stroke-prone spontaneously hypertensive rat. Hypertension 2008;51:567-573. Kanda T, Nakamura E, Moritani T, Yamori Y. Arterial pulse wave velocity and risk factors for peripheral vascular disease. Eur J Appl Physiol 2000;82:1-7. Rosamond W, Flegal K, Furie K, Go A, Greenlund K, Haase N, et al. Heart disease and stroke statistics--2008 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Circulation 2008;117:e25-146. Manuel DG, Leung M, Nguyen K, Tanuseputro P, Johansen H. Burden of cardiovascular disease in Canada. Can J Cardiol 2003;19:997-1004. Tiffen R, Gittins R. How Australia compares. Cambridge: Cambridge University Press, 2004.. [9]. Juel K, Sorensen J, Bronnum-Hansen H. Risk factors and public health in Denmark. Scand J Public Health 2008;36 Suppl 1:11-227. [10] Schulte H, Cullen P, Assmann G. Obesity, mortality and cardiovascular disease in the Munster Heart Study (PROCAM). Atherosclerosis 1999;144:199-209. [11] Rosengren A, Wilhelmsen L. Respiratory symptoms and long-term risk of death from cardiovascular disease, cancer and other causes in Swedish men. Int J Epidemiol 1998;27:962-969. [12] Menotti A, Giampaoli S. A single risk factor measurement predicts 35-year mortality from cardiovascular disease. G Ital Cardiol 52.
(62) [13] [14] [15] [16]. [17]. [18] [19]. [20]. [21]. [22]. [23]. [24] [25]. [26]. 1998;28:1354-1362. Glass CK, Witztum JL. Atherosclerosis. the road ahead. Cell 2001;104:503-516. Ross R. Atherosclerosis--an inflammatory disease. N Engl J Med 1999;340:115-126. Lusis AJ. Atherosclerosis. Nature 2000;407:233-241. Dzau VJ, Braun-Dullaeus RC, Sedding DG. Vascular proliferation and atherosclerosis: new perspectives and therapeutic strategies. Nat Med 2002;8:1249-1256. Hammoud RA, Vaccari CS, Nagamia SH, Khan BV. Regulation of the renin-angiotensin system in coronary atherosclerosis: a review of the literature. Vasc Health Risk Manag 2007;3:937-945. von Bohlen und Halbach O, Albrecht D. The CNS renin-angiotensin system. Cell Tissue Res 2006;326:599-616. Wu M, Yu H, Yang C, Bens M, Huang C, Ko Y, et al. Cyclosporine and tacrolimus alter renin-angiotesin system in mouse medullary-thick ascending limb cultured cells. Transplant Proc 2001;33:1078-1079. Mehta PK, Griendling KK. Angiotensin II cell signaling: physiological and pathological effects in the cardiovascular system. Am J Physiol Cell Physiol 2007;292:C82-97. Carey RM, Wang ZQ, Siragy HM. Role of the angiotensin type 2 receptor in the regulation of blood pressure and renal function. Hypertension 2000;35:155-163. Meffert S, Stoll M, Steckelings UM, Bottari SP, Unger T. The angiotensin II AT2 receptor inhibits proliferation and promotes differentiation in PC12W cells. Mol Cell Endocrinol 1996;122:59-67. Stoll M, Steckelings UM, Paul M, Bottari SP, Metzger R, Unger T. The angiotensin AT2-receptor mediates inhibition of cell proliferation in coronary endothelial cells. J Clin Invest 1995;95:651-657. Guthrie GP, Jr. Angiotensin receptors: physiology and pharmacology. Clin Cardiol 1995;18:III 29-34. Cook VI, Grove KL, McMenamin KM, Carter MR, Harding JW, Speth RC. The AT2 angiotensin receptor subtype predominates in the 18 day gestation fetal rat brain. Brain Res 1991;560:334-336. Inagami T, Eguchi S. Angiotensin II-mediated vascular smooth 53.
(63) [27]. [28]. [29]. [30]. [31]. [32]. [33]. [34]. [35]. muscle cell growth signaling. Braz J Med Biol Res 2000;33:619-624. Hanatani A, Yoshiyama M, Kim S, Omura T, Toda I, Akioka K, et al. Inhibition by angiotensin II type 1 receptor antagonist of cardiac phenotypic modulation after myocardial infarction. J Mol Cell Cardiol 1995;27:1905-1914. Weber KT, Brilla CG, Janicki JS. Myocardial fibrosis: functional significance and regulatory factors. Cardiovasc Res 1993;27:341-348. Brilla CG, Pick R, Tan LB, Janicki JS, Weber KT. Remodeling of the rat right and left ventricles in experimental hypertension. Circ Res 1990;67:1355-1364. Ichiki T, Takeda K, Tokunou T, Funakoshi Y, Ito K, Iino N, et al. Reactive oxygen species-mediated homologous downregulation of angiotensin II type 1 receptor mRNA by angiotensin II. Hypertension 2001;37:535-540. Susa S, Wakabayashi I. Extracellular alkalosis activates ERK mitogen-activated protein kinase of vascular smooth muscle cells through NADPH-mediated formation of reactive oxygen species. Febs Letters 2003;554:399-402. Cheng TH, Shih NL, Chen SY, Loh SH, Cheng PY, Tsai CS, et al. Reactive oxygen species mediate cyclic strain-induced endothelin-1 gene expression via Ras/Raf/extracellular signal-regulated kinase pathway in endothelial cells. J Mol Cell Cardiol 2001;33:1805-1814. Cheng CM, Hong HJ, Liu JC, Shih NL, Juan SH, Loh SH, et al. Crucial role of extracellular signal-regulated kinase pathway in reactive oxygen species-mediated endothelin-1 gene expression induced by endothelin-1 in rat cardiac fibroblasts. Mol Pharmacol 2003;63:1002-1011. Kyaw M, Yoshizumi M, Tsuchiya K, Kirima K, Suzaki Y, Abe S, et al. Antioxidants inhibit endothelin-1 (1-31)-induced proliferation of vascular smooth muscle cells via the inhibition of mitogen-activated protein (MAP) kinase and activator protein-1 (AP-1). Biochem Pharmacol 2002;64:1521-1531. Sutcliffe AM, Clarke DL, Bradbury DA, Corbett LM, Patel JA, Knox AJ. Transcriptional regulation of monocyte chemotactic protein-1 release by endothelin-1 in human airway smooth muscle 54.
(64) [36]. [37]. [38]. [39] [40] [41]. [42]. [43]. [44]. [45]. [46]. [47]. cells involves NF-kappaB and AP-1. Br J Pharmacol 2009. Woods M, Mitchell JA, Wood EG, Barker S, Walcot NR, Rees GM, et al. Endothelin-1 is induced by cytokines in human vascular smooth muscle cells: Evidence for intracellular endothelin-converting enzyme. Molecular Pharmacology 1999;55:902-909. Scandalios JG. Oxidative stress: molecular perception and transduction of signals triggering antioxidant gene defenses. Braz J Med Biol Res 2005;38:995-1014. Griendling KK, Sorescu D, Ushio-Fukai M. NAD(P)H oxidase: role in cardiovascular biology and disease. Circ Res 2000;86:494-501. Jacobs BP, Browner WS. Ginkgo biloba: a living fossil. Am J Med 2000;108:341-342. Singh B, Kaur P, Singh GRD, Ahuja PS. Biology and chemistry of Ginkgo biloba. Fitoterapia 2008;79:401-418. Fang J, Zhou Q, Shi XL, Jiang BH. Luteolin inhibits insulin-like growth factor 1 receptor signaling in prostate cancer cells. Carcinogenesis 2007;28:713-723. Hou L, Zhou B, Yang L, Liu ZL. Inhibition of human low density lipoprotein oxidation by flavonols and their glycosides. Chem Phys Lipids 2004;129:209-219. Wang SP, Huang KJ. Determination of flavonoids by high-performance liquid chromatography and capillary electrophoresis. J Chromatogr A 2004;1032:273-279. Lee HJ, Lee EO, Ko SG, Bae HS, Kim CH, Ahn KS, et al. Mitochondria-cytochrome C-caspase-9 cascade mediates isorhamnetin-induced apoptosis. Cancer Lett 2008;270:342-353. Lu J, Papp LV, Fang J, Rodriguez-Nieto S, Zhivotovsky B, Holmgren A. Inhibition of Mammalian thioredoxin reductase by some flavonoids: implications for myricetin and quercetin anticancer activity. Cancer Res 2006;66:4410-4418. Wu YZ, Li SQ, Zu XG, Du J, Wang FF. Ginkgo biloba extract improves coronary artery circulation in patients with coronary artery disease: Contribution of plasma nitric oxide and endothelin-1. Phytotherapy Research 2008;22:734-739. Altiok N, Ersoz M, Karpuz V, Koyuturk M. Ginkgo biloba extract regulates differentially the cell death induced by hydrogen 55.
(65) [48]. [49]. [50] [51]. [52]. [53]. peroxide and simvastatin. Neurotoxicology 2006;27:158-163. Huang SY, Jeng C, Kao SC, Yu JJ, Liu DZ. Improved haemorrheological properties by Ginkgo biloba extract (Egb 761) in type 2 diabetes mellitus complicated with retinopathy. Clin Nutr 2004;23:615-621. Naik SR, Pilgaonkar VW, Panda VS. Evaluation of antioxidant activity of Ginkgo biloba phytosomes in rat brain. Phytother Res 2006;20:1013-1016. Zeng XR, Liu M, Yang YS, Li Y, Asplund K. Ginkgo biloba for acute ischemic stroke. Stroke 2006;37:574-575. Pietri S, Seguin JR, d'Arbigny P, Drieu K, Culcasi M. Ginkgo biloba extract (EGb 761) pretreatment limits free radical-induced oxidative stress in patients undergoing coronary bypass surgery. Cardiovasc Drugs Ther 1997;11:121-131. Christen Y, Maixent JM. What is Ginkgo biloba extract EGb 761? An overview--from molecular biology to clinical medicine. Cell Mol Biol (Noisy-le-grand) 2002;48:601-611. Gardner CD, Zehnder JL, Rigby AJ, Nicholus JR, Farquhar JW. Effect of Ginkgo biloba (EGb 761) and aspirin on platelet aggregation and platelet function analysis among older adults at risk of cardiovascular disease: a randomized clinical trial. Blood Coagul Fibrinolysis 2007;18:787-793.. [54] Physicians' desk reference 59 ed. Oradell, N.J.: Medical Economics Co., 2005. [55] Russo V, Stella A, Appezzati L, Barone A, Stagni E, Roszkowska A, et al. Clinical efficacy of a Ginkgo biloba extract in the topical treatment of allergic conjunctivitis. Eur J Ophthalmol 2009;19:331-336. [56] Napryeyenko O, Borzenko I. Ginkgo biloba special extract in dementia with neuropsychiatric features. A randomised, placebo-controlled, double-blind clinical trial. Arzneimittelforschung 2007;57:4-11. [57] Wang GX, Cao FL, Chen J. Progress in researches on the pharmaceutical mechanism and clinical application of Ginkgo Biloba extract on various kinds of diseases. Chin J Integr Med 2006;12:234-239. [58] Zhou W, Chai H, Lin PH, Lumsden AB, Yao Q, Chen C. Clinical use and molecular mechanisms of action of extract of Ginkgo biloba leaves in cardiovascular diseases. Cardiovasc Drug Rev 56.
(66) [59]. [60]. [61]. [62]. [63] [64] [65]. [66]. [67] [68]. [69]. [70]. [71]. 2004;22:309-319. McKenna DJ, Jones K, Hughes K. Efficacy, safety, and use of ginkgo biloba in clinical and preclinical applications. Altern Ther Health Med 2001;7:70-86, 88-90. DeFeudis FV, Drieu K. Ginkgo biloba extract (EGb 761) and CNS functions: basic studies and clinical applications. Curr Drug Targets 2000;1:25-58. Soholm B. Clinical improvement of memory and other cognitive functions by Ginkgo biloba: review of relevant literature. Adv Ther 1998;15:54-65. Maurer K, Ihl R, Dierks T, Frolich L. Clinical efficacy of Ginkgo biloba special extract EGb 761 in dementia of the Alzheimer type. J Psychiatr Res 1997;31:645-655. Schneider LS. Ginkgo biloba extract and preventing Alzheimer disease. JAMA 2008;300:2306-2308. Liu J. The use of Ginkgo biloba extract in acute ischemic stroke. Explore (NY) 2006;2:262-263. Moulton PL, Boyko LN, Fitzpatrick JL, Petros TV. The effect of Ginkgo biloba on memory in healthy male volunteers. Physiol Behav 2001;73:659-665. Lin CC, Cheng WL, Hsu SH, Chang CM. The effects of Ginkgo biloba extracts on the memory and motor functions of rats with chronic cerebral insufficiency. Neuropsychobiology 2003;47:47-51. Kleijnen J, Knipschild P. Ginkgo biloba for cerebral insufficiency. Br J Clin Pharmacol 1992;34:352-358. Wesnes KA, Ward T, McGinty A, Petrini O. The memory enhancing effects of a Ginkgo biloba/Panax ginseng combination in healthy middle-aged volunteers. Psychopharmacology (Berl) 2000;152:353-361. Ko CH, Shen SC, Yang LY, Lin CW, Chen YC. Gossypol reduction of tumor growth through ROS-dependent mitochondria pathway in human colorectal carcinoma cells. Int J Cancer 2007;121:1670-1679. Lee SL, Wang WW, Finlay GA, Fanburg BL. Serotonin stimulates mitogen-activated protein kinase activity through the formation of superoxide anion. Am J Physiol 1999;277:L282-291. Cross AR, Jones OT. The effect of the inhibitor diphenylene 57.
(67) [72]. [73]. [74]. [75]. [76]. [77]. [78]. [79]. iodonium on the superoxide-generating system of neutrophils. Specific labelling of a component polypeptide of the oxidase. Biochem J 1986;237:111-116. Kocic G, Djordjevic V, Vlahovic P, Kocic R, Pavlovic D, Jevtovic T. Antioxidants modulate adenosine metabolism in rat mesangial cells cultured under high glucose conditions. Ren Fail 2002;24:691-701. Sun JJ, Kim HJ, Seo HG, Lee JH, Yun-Choi HS, Chang KC. YS 49, 1-(alpha-naphtylmethyl)-6,7-dihydroxy-1,2,3,4-tetrahydroisoquinol ine, regulates angiotensin II-stimulated ROS production, JNK phosphorylation and vascular smooth muscle cell proliferation via the induction of heme oxygenase-1. Life Sci 2008;82:600-607. Hong HJ, Chan P, Liu JC, Juan SH, Huang MT, Lin JG, et al. Angiotensin II induces endothelin-1 gene expression via extracellular signal-regulated kinase pathway in rat aortic smooth muscle cells. Cardiovasc Res 2004;61:159-168. Lin FY, Chen YH, Chen YL, Wu TC, Li CY, Chen JW, et al. Ginkgo biloba extract inhibits endotoxin-induced human aortic smooth muscle cell proliferation via suppression of toll-like receptor 4 expression and NADPH oxidase activation. J Agric Food Chem 2007;55:1977-1984. Lin SJ, Yang TH, Chen YH, Chen JW, Kwok CF, Shiao MS, et al. Effects of Ginkgo biloba extract on the proliferation of vascular smooth muscle cells in vitro and on intimal thickening and interleukin-1beta expression after balloon injury in cholesterol-fed rabbits in vivo. J Cell Biochem 2002;85:572-582. Siegel G, Schafer P, Winkler K, Malmsten M. Ginkgo biloba (EGb 761) in arteriosclerosis prophylaxis. Wien Med Wochenschr 2007;157:288-294. Nguyen TT, Tran E, Nguyen TH, Do PT, Huynh TH, Huynh H. The role of activated MEK-ERK pathway in quercetin-induced growth inhibition and apoptosis in A549 lung cancer cells. Carcinogenesis 2004;25:647-659. Yogi A, Callera GE, Montezano AC, Aranha AB, Tostes RC, Schiffrin EL, et al. Endothelin-1, but not Ang II, activates MAP kinases through c-Src independent Ras-Raf dependent pathways in vascular smooth muscle cells. Arterioscler Thromb Vasc Biol 58.
(68) [80]. [81]. [82]. [83]. [84]. [85]. [86]. [87]. [88]. [89]. 2007;27:1960-1967. Nagata N, Niwa Y, Nakaya Y. A novel 31-amino-acid-length endothelin, ET-1(1-31), can act as a biologically active peptide for vascular smooth muscle cells. Biochem Biophys Res Commun 2000;275:595-600. Bouallegue A, Daou GB, Srivastava AK. Endothelin-1-induced signaling pathways in vascular smooth muscle cells. Curr Vasc Pharmacol 2007;5:45-52. Fei J, Viedt C, Soto U, Elsing C, Jahn L, Kreuzer J. Endothelin-1 and smooth muscle cells: induction of jun amino-terminal kinase through an oxygen radical-sensitive mechanism. Arterioscler Thromb Vasc Biol 2000;20:1244-1249. Wang Z, Castresana MR, Newman WH. Reactive oxygen and NF-kappaB in VEGF-induced migration of human vascular smooth muscle cells. Biochem Biophys Res Commun 2001;285:669-674. Engel L, Ryan U. TGF-beta 1 reverses PDGF-stimulated migration of human aortic smooth muscle cells in vitro. In Vitro Cell Dev Biol Anim 1997;33:443-451. Ma J, Wang Q, Fei T, Han JD, Chen YG. MCP-1 mediates TGF-beta-induced angiogenesis by stimulating vascular smooth muscle cell migration. Blood 2007;109:987-994. Pan D, Yang J, Lu F, Xu D, Zhou L, Shi A, et al. Platelet-derived growth factor BB modulates PCNA protein synthesis partially through the transforming growth factor beta signalling pathway in vascular smooth muscle cells. Biochem Cell Biol 2007;85:606-615. Yoshimura H, Nariai Y, Terashima M, Mitani T, Tanigawa Y. Taurine suppresses platelet-derived growth factor (PDGF) BB-induced PDGF-beta receptor phosphorylation by protein tyrosine phosphatase-mediated dephosphorylation in vascular smooth muscle cells. Biochim Biophys Acta 2005;1745:350-360. Ebisui O, Dilley RJ, Li H, Funder JW, Liu JP. Growth factors and extracellular signal-regulated kinase in vascular smooth muscle cells of normotensive and spontaneously hypertensive rats. J Hypertens 1999;17:1535-1541. Banerjee S, Sengupta K, Dhar K, Mehta S, D'Amore PA, Dhar G, et al. Breast cancer cells secreted platelet-derived growth factor-induced motility of vascular smooth muscle cells is 59.
數據


相關文件
Persons with a phenotype mediated by one of these MC1R genetic variants are at greater risk of UV-induced skin cancers, because pheomelanin not only provides less effective
stained negative for a-smooth muscle actin because the main body of the tumor consisted of epithelioid or epithe- lial cells that contained few positive smooth muscle cells.. We
The predicted expression profiles of 24 chemokines and immunosuppressive biomarkers for SCC4, SCC15, and SCC25 were used in a decision tree format to sort cell lines into those
No risk factor for necrosis could be identified except the realization of dental extraction before treat- ment initiation (P = .025) (Table 2): at 36 months, the incidence of
KUAICHANKANG (Scutellaria baicalensis georgi extract, Codonopsis pilosula extract, Large-headed atractylodes extract and Licorice
抽筋又稱痙鑾。當肌肉受到神經組織的刺激致引起肌肉收縮或血管受 到刺激而逐漸關閉,使血液循環不良
Laser Capture Microdissection Microdissection of Fluorescently of Fluorescently Labeled Embryonic Cranial Neural Crest Cells Labeled Embryonic Cranial Neural Crest Cells..
Huangzhi extract (Coptidis Rhizoma extract, Scutellariae Radix extract, Gardeniae Fructus extract, Andrographitis Herba extract, Pulsatillae Radix extract, Glycytthizae Radix