國 立 交 通 大 學
應 用 化 學 研 究 所
碩 士 論 文
A). Synthesis and Charaterization of Two Novel Distyrylanthracene
Derivatives: High Efficiency Non-doped Blue Light-Emitters
非摻雜型高效率藍光之蒽衍生物發光材料
B). Design & Synthesis of Efficient White Light-Emitting Polymer and its
Application in PLEDs
高效率之白光高分子發光二極體
研究生:莊莒瑛
指導教授:許慶豐 博士
非摻雜型高效率藍光之蒽衍生物發光材料
A). Synthesis and Charaterization of Two Novel
Distyrylanthracene Derivatives: High Efficiency Non-doped Blue
Light-Emitters
高效率之白光高分子發光二極體
B). Design & Synthesis of Efficient White Light-Emitting Polymer
and its Application in PLEDs
研究生:莊莒瑛 Student:Chu-Ying Chuang 指導教授:許慶豐 博士 Advisor:Dr. Ching-Fong Shu
國立交通大學 應用化學研究所
碩士論文 A Thesis
Submitted to Department of Applied Chemistry College of Science
National Chiao-Tung University In Partial Fulfillment Requirements
of the Degree of Master in
Applied Chemistry June 2006
Hsinchu, Taiwan, Republic China
非摻雜型高效率藍光之蒽衍生物發光材料
研究生:莊莒瑛 指導教授:許慶豐 博士 國立交通大學應用化學研究所 摘要 我們使用 diphenylanthracene(DPA)作為核心部份,分別在其 9,10-的 位置上導入兩個剛硬的取代基:diphenylvinyl 或 triphenylvinyl。此兩個 末端取代基可與 DPA 相互扭曲,使其有較佳之熱穩定性,且在薄膜態 可避免堆疊,導致光色更趨近飽和藍光;因其具有上述之特性,在元件 發光層上可使用非摻雜之製程;當元件結構為:ITO/電洞傳輸層/發光層 /TPBI/Mg:Ag,可呈現極佳之效率:最大外部量子效率為 4.11 %、最 大發光效率為 4.44 cd/A,光色為飽和藍光其 CIE 座標為 (0.14, 0.11)。高效率之白光高分子發光二極體
研究生:莊莒瑛 指導教授:許慶豐 博士
國立交通大學應用化學研究所
摘要
本論文中合成了一系列以 PF-TPA- OXD (TOF) 作為藍光發光團兼 主發光體之白光高分子,因 TOF 為一高效率的藍光高分子,且本身具傳 電 子 、 電 洞 的 能 力 , 可 幫 助 電 子 、 電 洞 的 平 衡 ; 此 外 , 選 用 2,1,3-benzothiadiazole (BT) 及 4,7-di-2-thienyl-2,1,3-benzothia- diazole (TBT) 分別作為綠光及紅光的客發光體。藉由微調客發光體之含量,使 高分子呈現三波段之白光。當元件結構為:ITO/ PEDOT/白光高分子 /TPBI/Mg : Ag,可達到良好之效率,其最大外部量子效率為 2.24 %、最 大發光效率為 4.61 cd/A,且光色已與標準白光的 CIE 色度座標相同, CIE 座標為 (0.33, 0.33)。
Synthesis and Charaterization of Two Novel
Distyrylanthracene Derivatives: High Efficiency Non-doped
Blue Light-Emitters
Student:Chu Ying Chuang Advisor:Prof. Ching-Fong Shu
Department of Applied Chemistry National Chiao-Tung University
Abstract
ANDP ANTP
We have synthesized two novel distyryl-9,10-diphenylanthracene derivatives having 2-tert-butyl-9,10-diphenylanthracene molecule at the center which was substituted at both the side by a rigid and bulky 2,2-diphenylvinyl units (for ANDP) and by 1,2,2-triphenylvinyl units (for ANTP). Due to their non-coplanar orientation, they display an excellent thermal stability (Tg: 114 o
C and 153 oC for ANDP and ANTP, respectively), and color purity. These new distyryldiphenylanthracene derivatives are promising as non-doped, blue-light-emitting materials for application in OLEDs. We fabricated the devices based on the general architecture: ITO (30 nm)/hole transporting layer(30 nm)/emitting layer (40 nm)/ TPBI (40 nm)/ Mg:Ag (100 nm); here different type of devices fabricated by changing the composition of hole
transporting layer as well as by using ANDP or ANTP as emitting layer. The devices having ANDP and ANTP as emitting layer have shown a high luminance efficiency as well as a high color purity for the blue; ANDP- and ANTP-based devices have shown luminance efficiency of 4.57 cd/A and 4.44 cd/A, respectively and CIE color coordinates of (0.14 and 0.13) and (0.14, 0.11), respectively.
Design & Synthesis of Efficient White Light-Emitting Polymer
and its Application in PLEDs
Student:Chu Ying Chuang Advisor:Prof. Ching-Fong Shu
Department of Applied Chemistry National Chiao-Tung University
Abstract N SN S S N SN O N N N N O N N n-Bu n-Bu n-Bu n-Bu * * (50-x-y)/2 (50-x-y)/2
A chemically doped, efficient pure white light emitting polymer containing three individual emitting species – PF-TPA-OXD (TOF) as a blue host and back-bone of the polymer, 2,1,3-benzothiadiazole units as a green dopant and, 4,7-di-2-thienyl-2,1,3-benzothiadiazole units as a red dopant – have been designed and synthesized. The resulting polymer is found to have highly efficient white electroluminescence by simultaneous emission of blue (λmax = 425 nm/444 nm), green (λmax = 517 nm) and red (λmax = 610 nm)
from the corresponding components of the polymers. The polymer based white polymeric light-emitting device (PLED) has been fabricated with following architecture: ITO/ PEDOT : PSS/POLYMER/TPBI/Mg : Ag. This device exhibited an intense white light emission having CIE coordinate (0.33, 0.33), a high external quantum efficiency of 2.24 % (4.61 cd/A), and a maximum brightness of 4788 cd/m2.
謝誌
在碩士的兩年時間中,最感謝的是我的指導老師許慶豐教授,雖然 老師有時候很嚴,也有點兇,可是讓我成長很多。有時候在想,如果今 天沒有老師的指導,或許也不會成長這麼多,謝謝老師。再來要感謝的 實驗室的各位同伴,芳奕學長、大秉、哈比人、學姐、冷翰、阿川、阿 爆、吟諺、阿昆、小七、學弟,還有其他實驗室的同學:淑媺、淑慧學 姊、JC、培真、杏嵐、世宗、鈺評、霆琪...,還有之前畢業的學長姐們。 系辦美麗大方的小姐們:小阿姨、葵汶、淑鈖,協助我一些會計及行政 的事務,還有 NMR 的張小姐、MASS 的李小姐及材料系 TGA 的蔡小姐, 謝謝曾經幫助過我及陪我走過辛苦及快樂的所有人,我愛你們。目錄
中文摘要... I 英文摘要... III 謝誌...VII 目錄...IX 圖目錄...XII 表目錄... XIV 附圖目錄... XV 有機發光二極體簡介 第一章 緒論………1 1-1. 有機電激發光原理………..11-2. Organic Light Emitting Diode (OLED)的起源與發展……….……2
1-3. OLED螢光發光材料之簡述……….…3
1-4. Polymer Light Emitting Diode (PLED)的特性與起源……….4
1-5. 目前常用的高分子材料………...6 第二章結論………...…8 參考文獻………...…9 A 部分 第一章 緒論………11 1-1. 前言……….……….…11 1-2. 研究動機……….……….……15 第二章 實驗……….……….…………..17 2-1. 藥品(PartA、B)……….……….……….…………17 2-2. 使用儀器(PartA、B) ……….……….………….…………18 2-3. 性質測量……….……….………….………...……19
2-4. 合成部份……….……….………….………...21 第三章 結果與討論………..…….……….………….………...27 3-1. 合成部份……….……….………….………...27 3-2. 物理性質……….……….………….………...29 3-2-1. DSC 及 TGA 測量……….……….………...29 3-3. 光學性質……….……….………….………...32 3-3-1. UV/vis 吸收光譜與 PL 放射光譜……….………...32
3-3-2. ANDP 及 ANTP 量子效率的測量(Quantum yield) ……….……...34
3-4. 電化學性質-氧化還原電位測量……….………….………...…...35 3-5. 元件電激發光性質………….……….………….………...37 第四章 結論………….……….………….………...43 參考文獻………….……….………….………..…...44 B 部分 第一章 緒論………46 1-1. OLED 全彩化發展……….……….……….…46 1-2. 白光 OLED 之演進……….……….……47 1-3. 白光高分子應用之近況……….……….……49 1-4. 研究動機……….……….……50 第二章 實驗……….……….…………..52 第三章 結果與討論………..…….……….………….………...64 3-1. 合成部份……….……….………….………...64 3-2. 物理性質……….……….………….………...67 3-2-1. GPC 測量……….……….……..………...67 3-2-2. DSC 及 TGA 測量……….……….………...67 3-2-3. 溶解度測試……….……….……..………..73 3-3. 光學性質……….……….………….………...74
3-3-1. UV/vis 吸收光譜與 PL 放射光譜……….………...75
3-3-2. 綠光、紅光部分與 Host polymer--TOF 間的能量轉移………....76
3-3-3. WPLED 系列量子效率的測量(Quantum yield)……….……...80
3-4. 電化學性質-氧化還原電位測量……...………….……….…...81
3-5. 元件電激發光性質………….……….………….………...82
第四章 結論………….……….………….………...88
圖 目 錄
圖 3A-2-1. ANDP 之 DSC………30
圖 3A-2-2. ANTP 之 DSC………30
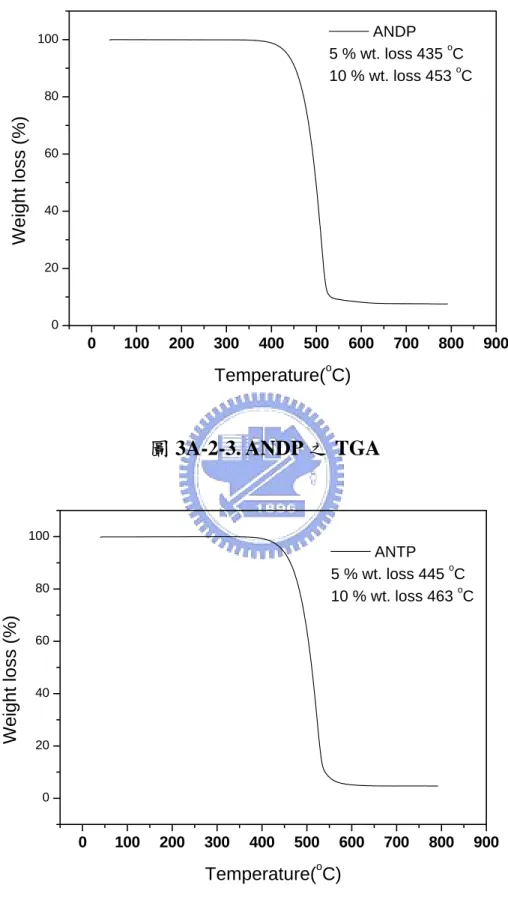
圖 3A-2-3. ANDP 之 TGA………31
圖 3A-2-4. ANTP 之 TGA………31
圖 3A-3-1. DPA、ANDP 及 ANTP 在 THF 吸收/放射光譜……….…………33
圖 3A-3-2. ANDP 及 ANTP 在薄膜態吸收/放射光譜……….………...33
圖 3-4-1. ANDP 溶液態之 CV 圖……….……36 圖 3-4-2. ANTP 溶液態之 CV 圖……….……36 圖 3A-5-1. 元件 I、II、III、IV 之 EL 圖譜……….……..39 圖 3A-5-2. 元件 I、II、III、IV 之色度座標圖……….……39 圖 3A-5-3. 元件 I、II、III、IV 之外部量子效率與亮度對電流密度作圖……….41 圖 3A-5-4. 元件 I、II、III、IV 之發光效率對電流密度作圖……….41 圖 3B-2-1. G0.32 之 DSC 圖………69 圖 3B-2-2. G0.40 之 DSC 圖………69 圖 3B-2-3. G0.43 之 DSC 圖………70 圖 3B-2-4. G0.46 之 DSC 圖………70 圖 3B-2-5. G0.32 之 TGA 圖………71 圖 3B-2-6. G0.40 之 TGA 圖………71 圖 3B-2-7. G0.43 之 TGA 圖………72 圖 3B-2-8. G0.46 之 TGA 圖………72 圖 3B-3-1. WPLED及POF-G0.40 高分子在CHCl3的吸收/放射光譜………76 圖 3B-3-2. G0.32 高分子在薄膜態的吸收/放射/激發光譜………...77 圖 3B-3-3. G0.40 高分子在薄膜態的吸收/放射/激發光譜………...77 圖 3B-3-4. G0.43 高分子在薄膜態的吸收/放射/激發光譜………...78
圖 3B-3-5. G0.46 高分子在薄膜態的吸收/放射/激發光譜………...78 圖 3B-3-6. POF-G0.40 高分子在薄膜態的吸收/放射/激發光譜………...79 圖 3B-3-7. MG、MR、與 TOF 薄膜態的吸收/放射光譜………...79 圖 3B-5-1. 白光高分子電激發光之能階圖………...84 圖 3B-5-2. POF-G0.40 電激發光之能階圖………..………...84 圖 3B-5-3. Device I、II、III、IV 之 EL 圖譜………...85 圖 3B-5-4. POF-G0.40 之 PL 與 EL 圖譜………...85 圖 3B-5-5. Device I、II、III、IV 之色度座標圖……….86 圖 3B-5-6. DeviceII 之外部亮子效率與亮度對電流密度作圖………..86 圖 3B-5-7. Device II 之發光效率對電流密度作圖……….87
表 目 錄
表 3A-1. ANDP 及 ANTP 之熱性質比較………29
表 3A-2. ANDP 及 ANTP 之 UV-vis 吸收與 PL 放射量測表………32
表 3A-3. ANDP 及 ANTP 之量子效率……….34
表 3A-4. ANDP 及 ANTP 溶液態的氧化電位起始值及 HOMO、LUMO…….…..35
表 3A-5. ANDP 及 ANTP 元件特性比較……….42
表 1. 白光小分子元件性質………...48 表 2. 白光高分子元件性質………48 表 3B-1. 白光高分子之分子量………..67 表 3B-2.白光高分子之 DSC 與 TGA 的數據分析表………68 表 3B-3. 白光高分子之溶解度測試………..73 表 3B-4. 白光高分子、TOF、MG、MR 與 POF-G0.40 之吸收/放射光譜位置比較 ………..74 表 3B-5. 白光高分子之量子效率………..80 表 3B-6. MG、MR 的薄膜態之 HOMO、LUMO 及能隙………81
附 圖 目 錄
附圖 1. 2-tert-Butyl-9,10-bis(4-bromophenyl)anthracene 化合物A1. 的1 H NMR 光譜圖………93 附圖 2. 2,2-diphenylvinylboronic acid化合物A2.的1 H NMR 光譜圖………94 附圖 3. 1,2,2-triphenylvinylboronic acid化合物A3. 的1 H NMR 光譜圖………..95 附圖 4. 1,2,2-triphenylvinylboronic acid化合物A3. 的13 C NMR 光譜圖……….96 附圖 5. ANDP的1 H NMR 光譜圖………97 附圖 6. ANDP的13 C NMR 光譜圖………...98 附圖 7. ANTP的1 H NMR 光譜圖………99 附圖 8. ANTP的13 C NMR 光譜圖……….100 附圖 9. 4,7-di-2-thienyl-2,1,3-benzothiadiazole 化合物B1. 的1 H NMR 光譜 圖……...101 附圖 10. 4,7-bis(5-bromo-2-thienyl)-2,1,3- benzothiadiazole 單體B2. 的1 H NMR 光譜圖………..102 附圖 11. 4,7-dibromo-2,1,3-benzothiadiazole 單體B3. 的1 H NMR 光譜圖…...103 附圖 12. 2-(1,3,2-dihexyl -2-yl)-4,4,5,5-tetramethyl-1,3,2-dioxaborolane 化合物 B7. 的1H NMR 光譜……….104附圖 13. 4,7-bis(1,3,2-dihexyl -2-yl)thiophen-2-yl) -2,1,3-benzothiadiazole 化合物
MR. 的1H NMR 光譜圖………105
附圖 14. 4,7-bis(1,3,2-dihexyl -2-yl)thiophen-2-yl) -2,1,3-benzothiadiazole 化合物
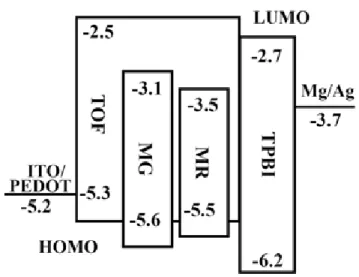
MR. 的13C NMR 光譜圖………...106
附圖 15. 4,7-bis(1,3,2-dihexyl -2-yl) -2,1,3-benzothiadiazole 化合物MG. 的1
H
附圖 16. 4,7-bis(1,3,2-dihexyl -2-yl) -2,1,3-benzothiadiazole 化合物MG. 的13 C NMR 光譜圖………...108 附圖 17. G0.32 的1 H NMR 光譜圖……….109 附圖 18. G0.32 的13 C NMR 光譜圖………110 附圖 19. G0.40 的1 H NMR 光譜圖……….111 附圖 20. G0.40 的13 C NMR 光譜圖………112 附圖 21. G0.43 的1 H NMR 光譜圖……….113 附圖 22. G0.43 的13 C NMR 光譜圖………114 附圖 23. G0.46 的1 H NMR 光譜圖……….115 附圖 24. G0.46 的13 C NMR 光譜圖………116 附圖 25. POF-G0.40 的1 H NMR 光譜圖………117 附圖 26. POF-G0.40 的13 C NMR 光譜圖………...118
有機發光二極體簡介
第一章 緒論
平面顯示器(Flan Panel Display)的出現可說是改變人類生活習慣的
一大進步,並在可預見的未來成為家家戶戶的「日用品」。但從黑白 到彩色、從非自發光到自發光,人類對於視覺感官的要求是越來越嚴 格;從外觀畫質到功能的整合,平面顯示器可說是所有資訊的介面。 而在未來資訊應用產品的設計上,具備自發光特性的顯示器相信是繼 液晶顯示器後另一個可能急速成長的產品。傳統的陰極射線管(CRT) 顯示技術已無法滿足市場的要求,輕、薄、省電、高畫質的平面顯示 器將成為本世紀的主流,有機電激發光(organic electroluminedcence, OEL)顯示技術,被認為是下一世代的平面顯示器主流技術,因為它 具有自發光、廣視角,高應答速度、低耗電性、對溫度的穩定性、所 以近幾年來有機電激發光元件(organic light emitting diode, OLED)已 廣為被研究。有機發光二極體(OLED)顯示器依其所使用的有機發光 材料之不同,可區分為兩種技術類型,一種是以小分子系(small molecular)作為有機發光層,以OLED作為泛稱;另一種是以π共軛高 分子系(polymer)作為有機發光層,俗稱為PLED。 1-1. 有機電激發光原理 有機發光二極體的元件結構類似於三明治型態;在正負電極間夾
有單層或多層的有機發光材料。在操作電壓的引導下,電洞從陽極(一 般使用具高功函數的ITO(Indiume Tin Oxide)玻璃)注入到發光材料的 HOMO;同時,電子從陰極(一般使用低功函數的金屬,如:Al(4.3 eV)、Mg(3.7 eV)、Ca(2.9 eV))注入到發光材料的LUMO。當電子電洞
在發光層再結合時,能量便已放光的形式釋出,若其能差恰為可見光 範圍時,人眼便能透過透明的ITO玻璃基質看到此材料螢光之放射行 為。
1-2. Organic Light Emitting Diode (OLED)的起源與發展
小分子有機電激發光顯示技術最早可追溯到1950年代,Bernanose 等人在1953年將acridine orange與quinacrine薄膜通入高電壓而觀察到 發光的現象1-4;1963年Pope等人在anthracene單晶上通入百伏以上的 高電壓,觀察到發光現象;1966年,Helfrich和Schneideru已含有 AlCl3-anthracene(陰極)和Na-anthracene(陽極)的電解質溶液製備高亮 度的EL元件5,但此元件需要極高的驅動電壓。爾後有其他有機分子 單晶也陸續被發現有電激發光的現象,但受限於單晶的厚度,所以這 些元件的驅動電壓都相當高。直到1980年Vincett等人以真空蒸鍍的方 式製造非晶相的anthracene薄膜6,使得有機發光元件的發展性不再受 限於厚度而導致的高驅動電壓;1987年伊士曼柯達公司的C. W. Tang 在Applied Physics Letters發表利用真空昇華技術7(vacuum sublimation)
蒸鍍有機電子傳導發光層薄膜和有機電洞傳輸層薄膜,得到雙層式元 件結構的高輝度綠光有機發光二極體,其外部量子效率可達1 %、亮 度1000 cd/m2;在元件效率大幅改善之後,OLED的發展與研究自此 後備受矚目。 1-3. OLED螢光發光材料之簡述 在早期OLED螢光材料的發展中,發光層的部份是使用主客摻雜 發光體(host guest doped emitter)系統:具有電子傳輸及發光特性的主
發光體材料,與各種高度螢光的客發光體結合得到高效率及各種不同 的光色。雖然使用主客摻雜發光體系統之元件擁有不錯的效率,但在 元件製程方面並不簡便,非摻雜系統發光材料,可簡化元件製程上精 確的摻雜濃度的控制,因此非摻雜系統的發光材料逐漸取代主客摻雜 發光體系統,成為現今螢光發光材料的主流。 N S N S S N N N N 非摻雜型紅光螢光材料 BZTA28
非摻雜型藍光螢光材料 TBSA9
1-4. Polymer Light Emitting Diode (PLED)的特性與起源
一般而言PLED 具有下列特性:(1)低溫製程,可製作在任何基板 如ITO,可橈式基板、(2)自發光且可設計發出各種顏色的光、(3)因高 分子成膜性佳,可用旋轉塗佈(spin-coating)製備大面積的基板、(4)高 應答速度(<us)、(6)低操作電壓(<10V)、(7)高流明效率(>10lm/W)、高 亮度、(8)製程簡單、低成本。 OLED與PLED兩者除了材料本身的差異,最大的不同便是在元件 製程方法的不同。OLED需要採用真空蒸鍍製程,其元件包括陰極在 內約需蒸鍍5~6層的有機薄膜或電極材料,如果真空設備針對每一層 個別以一真空室進行蒸鍍作業,則生產線將相當龐大且成本亦高。蒸 鍍方式製作薄膜的有機材料利用效率相當低(僅數個%),而且蒸鍍速 度慢產量低,基板尺寸多在40公分以下,因此製作成本高。另外,使 用遮光罩方式蒸鍍RGB畫素時,光罩(shadow mask)擺放位置的精度也 影像畫面的品質,要製作高解析度(>200ppi)面板較困難。 但PLED若欲達成全彩化面板之目標,則可以採用噴墨印製方法
製作RGB畫素。電子注入層與陰極材料的噴製只要使用個別的噴墨頭 即可,設備成本遠比小分子系OLED低,而且有機材料只噴在需要定 義的畫素上,因此不會造成材料的浪費。單就元件的製程面來說, PLED頗具發展潛力。 PLED的起源可追溯於1990年劍橋大學Buroughes10教授的研發團 隊發表以使用π共軛高分子系PPV搭配旋轉塗佈(spin coating)方法製 成薄膜以作為有機發光二極體的發光層。為有別於一般以小分子做為 發光層之有機發光二極體OLED,以高分子系做為發光層之材料便通 稱為PLED。 1992年德國拜耳公司研究群發表新型導電高分子,PEDT/PSS11, 其具有良好的熱穩定性,高導電度。在PLED元件上可幫助電洞注入, 及平滑polymer及ITO之間的介面,以提升元件的效率。此後
ITO/PEDT/PSS/light emitting polymer/cathode 此種結構已成為PLED 元件的主流。 * * SO3H n O O S * * n * * n PPV PEDT PSS
1-5. 目前常用的高分子材料 1-5-1. 聚對苯乙烯[poly(p-phenylene vinylenes)]及其衍生物 PPV具有很強的電激發光性能,且由於其具較高的分子量,所以 可形成高品質的薄膜。沒有取代基的PPV溶解度很差,可利用側鏈基 導入來改善其溶解度,而側鏈基的導入會影響其有效共軛長度,因此 可利用側鏈基的導入來得到不同顏色的PPV衍生物12。 * * OC4H9 C4H9O OC4H9 C4H9O a b c Yellow PPV * * O O n Red PPV 1-5-2. 聚茀(polyfluorene)及其衍生物 聚茀高分子13(PFs)是第一個被製成藍光的高分子電激發光元件的 高分子材料。由於其大於2.9 eV的能隙差,所以使得其可被用於藍 光,若再搭配其他的高分子形成共聚物,更可廣泛的被應用到綠光跟 紅光範圍。聚茀高分子及其共聚物具有很好的溶解度、化學安定性和
熱穩定性,以及優越的固態量子效率,因此常被用於電激發光材料中。 * * R R n PFs * S * R R Green PFs * S * R R O O n Red PFs
第二章 結論
隨著OLED/PLED 技術逐漸成熟,以 OLED/PLED 自發光、無視 角限制、反應速度快、光電效率高等優異特性,在平面顯示器市場的 應用將更為廣泛,未來OLED/PLED 產品將會迅速搶占目前的平面顯 示器市場,而對於可達到高資訊量、與高解析度的主動矩陣式 OLED/PLED 更會是下一世代平面顯示器最佳的選擇。參考文獻
1. Bernanose, E.; Comte, M.; Vouaux, P. J. Chim. Phys. 1953, 50, 64. 2. Bernanose, E.; Vouaux, P. J. Chim. Phys. 1953, 50, 261.
3. Bernanose, E.; Chim. Phys. 1955, 52, 396.
4. Bernanose, E.; Vouaux, P. J. Chim. Phys. 1955, 52, 509.
5. Helfrich, W.; Schneider, W. G. J. Chem. Phys. 1966, 44, 2902. 6. Vincett, P. S.; Barlow, W. A.; Hann, R. A.; Robert, G. G. Thin Solid
Films 1982, 94, 171.
7. Tang, C. W.; VanSlyke, S. A. Appl. Phys. Lett. 1987, 51, 914. 8. Thomas, K. R. J.; Lin, J. T.; Velusamy, M.; Tao, Y. T.; Chuen, C.
H. Adv. Funct. Mater. 2004, 14, 83.
9. Kim, Y. H.; Shin, D. C.; Kim, S. H.; Ko, C. H.; Yu, S. H.; Chae, Y. S.; Kwon, S. K. Adv. Mater. 2001, 13, 1690.
10. Buroughes, J. H.; Bradley, D. D. C.; Brown, A. R.; Marks, R. N.; Mackay, K.; Friend, R. H.; Bums, P. L.; Holmes, A. B. Nature 1990, 58, 1982.
11. Arias, A. C.; Granstrom, M.; Thomas, D, S,; Petritsch, K.; Friend, R. H. Physical Rev. B, 1991, 60, 1854.
12. Hikmet, R. A.; Thomassen, R. Adv. Mater. 2003, 15, 115. 13. Liu, M. S.; Jen, A. K. Y. Chem. Mater. 2003, 15, 269.
A 部分
非摻雜型高效率藍光之蒽衍生物發光材料
第一章 緒論
1-1. 前言 在OLED研究發展中,最重要的課題就是如何製成全彩面板的技 術,而全彩的面板需由紅、綠、藍三原色所組成。現今綠光材料已發 展成熟,可以達到很高的效率;但在紅光及藍光方面仍有發展進步的 空間,尤其是藍光材料本身具高能隙,要找到具有此特性的材料並不 容易,若要達到飽和的藍光更屬不易。許多穩定的藍光主發光體材料 已經公開在文獻報導中,而這些材料結構可粗略歸類為下列幾種1:diarylanthracene2、di(styryl)arylene(DSA)3、fluorene及pyrene等。 1-1-1. Anthracene Anthracene可說是有機電激發光的始祖,早在 1963 年就已被Pope 等人以單晶形式通入電壓而觀察到發光現象4。美國柯達的OLED團隊 於美國專利中首次發表以 9,10-di(2-naphthyl)anthracene(ADN)為主體 的衍生物;在研究中發現ADN不論是在液態或固態均有相當好的螢 光效率,目前已成為OLED元件中被廣泛應用的藍光發光材料之ㄧ。 但ADN的薄膜態不穩定且易結晶,而導致元件光色偏綠,因此如何 改善ADN薄膜態的穩定性,成為藍光螢光材料發展中的新課題。
ADN 1-1-2. Distyrylarylene, DSA DSA 為日本出光公司主發光體材料的專利,當時 DSA 為表現相 當突出的藍光材料,但受限於商業機密的緣故,一直無法得知 DSA 真正的結構,直到1995 年 Hosokawa 等人揭露以 DSA 為主體結構的 DPVBi,DPVBi 為一非平面的分子結構,具有良好的薄膜穩定性, 與 DSAamine 摻雜的元件效率表現突出,最大外部量子效率可達 2.4%,發光範圍在藍光區域。 DPVBi Ar N N Et Et DSAamine--BCzVBi
1-1-3. Pyrene 傳統上,最具代表性的藍光發光體結構是架構在多環芳香族化合 物。如1,3,6,8-tetra(phenyl)pyrene (TPP),其特性具有高螢光效率(ψf = 0.90),且發光位置在深藍光區域(420 nm),卻少有相關文獻的報導 5,乃因該化合物具有極高的對稱性,在薄膜態容易產生excimer迫使 放射峰紅位移,而導致發光效率大幅度的降低,因此限制TPP在藍光 OLED元件上的應用發展。 TPP 1-1-4. Fluorene 佳能公司在 2004 年發表新的藍光系統,即是以fluorene之衍生物 DPYFL01 為藍光主發光體,該系列化合物具有高熱穩定性,Tg可達 146 oC,再搭配以BDT3FL之衍生物為藍光客發光體,其元件具有好 的色彩飽和度,CIE色度座標為(0.15, 0.11)。
Me Me DPYFL01 N N Me Me Me Me Me Me BDT3FL 1-1-5. Spirofluorene 在藍光OLED的發展中,元件穩定度一直是各很大的問題,為了 得到良好的穩定度的藍光元件,藍光發光材料的設計便朝向改良材料 熱性質及薄膜穩定度發展。將分子接上一個龐大立體阻礙基團是最常 用的方式,而9,9-spirobifluorene便具有該特性,因此有許多藍光發光 材料便利用接上9,9-spirobifluorene來改善其熱性質及薄膜穩定度。如 TBPSF其Tg高達 195 oC6,固態薄膜的量子效率可達 80 %,顯見 9,9-spirobifluorene確實讓材料具有良好的熱性質及薄膜穩定性。因此 9,9-spirobifluorene在發光材料中掀起一股研究熱潮。
N N N N TBPSF 1-2. 研究動機 在目前藍光螢光元件中,雖已有可達到高效率的元件,但其結構 相當地複雜,除需蒸鍍電子傳輸層、電洞傳輸層等,甚至還需摻混在 主發光體材料(host material),才能達到較佳的效率;就元件的製程面 來說,結構太過繁瑣,不利於元件的生產7。而非摻雜發光材料在元 件製程上較簡便,所以非摻雜發光材料已為現今OLED發光材料的主 流。目前已有非摻雜的藍光螢光材料的文獻被報導,但在光色及效率 方面仍有可改善的空間8-10。因此本篇論文主旨在於設計新穎的非摻 雜藍光螢光材料,及其元件效率的改良。 根據文獻報導,蒽衍生物有良好的電化學性質11-17,且放射波長 偏向藍光範圍,因而被廣泛地應用在藍光材料。另外,distyrylarylene (DSA)類型的材料不論是在元件穩定性、光色純度和發光效率,在藍 光螢光元件中有著相當突出的表現,頗具發展潛力,當中最著名的就 是DPVBi。 所以在本篇論文我們結合蒽及DSA兩種結構,以期能合成高效率
的藍光材料。DSA衍生物的基本構造為Ar2C=CH-(Ar‘)-CH=CAr2*,我 們使用diphenylanthracene(DPA)作為Ar’核心部份,在 9,10-位置的取代 基則選擇了兩個剛硬的官能基團:diphenylvinyl及triphenylvinyl。這 兩個剛硬的官能基團,與核心的DPA在空間中相互扭曲,使整各分子 呈現非平面結構;除此之外,我們還在DPA 2 號位置接上tert-butyl 官能基,可避免DPA的片段發生堆疊的情形18,更增其做為非摻雜藍 光發光材料之潛力。
第二章 實驗
2-1. 藥品 (於本論文 PartA、B 所使用)1,4-Dibromobenzene 購自ARCOS
n-Butyllithium (2.5M in hexane) 購自ALDRICH
2-tert-Butylantheaquinone 購自TCI
Potassium iodide 購自 SHOWA
Sodium hypophosphite monohydrate 購自 SHOWA
1,1-Diphenylethene 購自Lancaster
Bromine 購自ACROS
Tributyl borate 購自ACROS
1-Bromo-1,2,2-triphenylethene 購自 ACROS
Aliquat 336 購自 ACROS
Potassium carbonate 購自 SHOWA
Tetrakis(triphenylphophine)palladium 購自 ALDRICH
Tributyl(2-thienyl)stannane 購自TCI
N-Bromosuccinimide 購自ACROS
Bis(triphenylphosphine)palladium dichloride 購自 Lancaster
2,1,3-Benzothiadiazole 購自TCI
鈉、鉀合金及 benzophenone 的除水蒸餾,其餘皆購自於 Merck、 Aldrich、ACROS、SHOWA、聯工等公司。 2-2. 使用儀器(PartA、B) 2-2-1. 核磁共振光譜儀 (NMR) 使 用 Varian Unity 300 、 500 MHz 核 磁 共 振 光 譜 儀 、 Bruker-DRX-300 MHz 核磁共振光譜儀。
2-2-2. 質 譜 儀 (Mass Spectroscopy) 與 元 素 分 析 儀 (Elemental Analysis)
使用交大貴儀的T-200 GC-Mass,以 EI 或 FAB 為游離方法。以 中興大學及貴儀中心的Finnigan/Thermo Quest MAT 95XL (高效能質 譜儀)。元素分析儀(EA)為交大的 HERAEUS CHN-OS RAPID。 2-2-3. 薄層色層分析法 (TLC)
使用Merck 製造的 5554 DC Silica Gel 60 F254 型鋁製薄片。 2-2-4. 管柱層析法
使用Merck 製造的 7734 Kieselgel 60 (60~230 mesh ASTM) 型與 SILICYCLE 製造的 Ultra Pure Silica Gel (70~230 mesh)矽膠。
2-2-5. 微差掃描卡計 (Differential Scanning Calorimetry, DSC) 使用SEIKO EXSTAR 6000DSC 及 Computer/Thermal Analyzer。 2-2-6. 熱重量分析儀 (Thermogravimetric Analysis, TGA)
使用交大材料系Du Pont Instrument TGA Q500 儀器。 2-2-7. 凝膠滲透層析儀 (GPC) (於本論文 Part B 中使用)
使 用 Waters 410 Differential Refractometer , Waters 600 Controller,和 Waters 610 Fluid Unit,管柱為 Waters Styragel Column, 以polystyrene 當標準品。
2-2-8. 吸收光譜儀 (UV/vis) 使用HP-8453 光譜分析儀。
2-2-9. 螢光儀 (Fluroescence Spectroscopy) 使用Hitachi F-4599 的螢光儀。
2-2-10. 循環伏特安培計 (CV)
使用美國Bioanalytical Systems Inc. 電化學分析儀,型號 100B,序 號930。 2-2-11. 昇華設備 (於本論文 Part A 中使用) 使用HTF-30SJ 高溫爐。 2-2-12. 曝光機 型號:US101,燈管功率為 1000 瓦,七貿股份有限公司。 2-2-13. 高真空蒸鍍機
型號:Auto 168(Junsun Tech co., LTD)。 2-2-14. 元件測量
使用Keithley 2400 Soouce meter 與 Newport 公司所生產的 818ST silicon photodiode 搭配 2835C Optical meter,而其量測之基本原理為 silicon photodiode 會偵測元件所放出的所有光能並將光能轉換成電 能,因此可由電能的大小得知元件所放出的光能或是亮度。 2-3. 性質測量 2-3-1. GPC 量測 (於本論文 Part B 中使用) 以polystyrene 為標準品,衝堤液為 THF,樣品濃度為 2 mg/mL THF,流速為 1 mL/min,Column 溫度設定為 45 ℃。由樣品的訊號峰 內插於標準品可得到一相對於標準品的分子量,進而換算出實際分子
量。 2-3-2. TGA 測量 取 5~10 毫克的樣品裝入鉑製 cell 中,在通入氮氣流速為 60 mL/min 的條件下,以 20 /min℃ 的升溫速度,從40 ℃升溫至 800 ℃ 來觀察裂解情形。 2-3-3. DSC 測量 取 5~10 毫克的樣品裝入鋁製的 cell 中,在通入氮氣流速為 50 mL/min 的條件下,做六階段式升溫 DSC 測試: 1.升溫速率 20 /min℃ ,範圍為50~350 ℃,固定 5min 2.升溫速率 -50 /min℃ ,範圍為 350~50 ℃,固定 5min 3.升溫速率 20 /min℃ ,範圍為 50~350 ℃,固定 5min 4.升溫速率 -50 ℃/min,範圍為 350~50 ℃,固定 5min 5.升溫速率 20 /min℃ ,範圍為 50~350 ℃,固定 5min 6.升溫速率 -50 /min℃ ,範圍為 350~50 ℃,固定 5min 2-3-4. 光學性質測量 Solution:利用逐步稀釋法配置樣品濃度在個別溶液中,使其 UV-vis 的最大吸收值介於 0.05 左右。溶液的螢光放射光譜使用最 大吸收峰的波長為激發光源。 Film:配置樣品濃度在個別溶液中的濃度為 1.0 wt %,以 2.5×2.5×0.15 cm3 的石英玻璃當作基質,以轉速 3000 rpm / 30 sec,旋轉塗佈 於石英玻璃。(於本論文Part B中使用)
2-3-5. 電化學性質--氧化還原電位測量 在此我們使用循環伏安法(cyclic voltammetry,簡稱 CV ),當外 加電位達到待測物的反應電位時,氧化或還原反應隨即發生,此時電 流將隨著電位的變化而改變。而電流的大小是由物質到電極表面的擴 散速率所控制,所以當擴散速率遠小於外加電位的變化速率當電極表 面的反應已趨完全時,此時電流即衰減下來。 <溶液態> 在氧化電位的測量中,在定量瓶中配置10-3 M的樣品及 0.1 M的 tetrabutylammonium hexafluorophosphate (TBAPF6) 之CH2Cl2為電解
液 10 mL , 通 入 氮 氣 10 分 鐘 。 以 Ag/Ag+為 參 考 電 極 , 並 以 ferrocene/ferrocenium (Fc/Fc+)為內參考電位,白金絲為導電電極,氧 化時以白金電極為工作電極,掃瞄速率為50 mV/S,範圍 0 ~ 2000 mV。 2-4. 合成部份 1. 2-tert-Butyl-9,10-bis(4-bromophenyl)anthracene 化合物A1. 18 在氮氣下,將1,4-dibromobenzene (5.30 g, 22.7 mmol)溶於 215 mL anhydrous diethyl ether中,降溫至-78 oC,將n-BuLi (9.08 mL, 22.7 mmol, 2.50 M in n-hexane)緩慢滴入,攪拌約 30 分鐘;再降溫至-78oC, 將溶於diethyl ether (45 mL)之 2-tert-Butylantheaquinone (3.00 g, 11.4
mmol),加入反應瓶中;待回到室溫後,加入水(600 mL),以diethyl ehter (2 × 150 mL)萃取有機層。待移去溶劑後,混合物與potassium iodide (6.78 g, 40.8 mmol),及sodium hypophosphite monohydrate (6.71 g, 76.1 mmol)加熱攪拌迴流 2 小時,收集白色沉澱物,以大量水清洗沉澱物, 得白色固體5.50 g,產率 89.0 %。1H NMR (300 MHz, CDCl3): δ 1.26 (s, 9H), 7.30-7.36 (m, 6H), 7.45 (dd, J = 9.3, 1.8 Hz, 1H), 7.55 (d, J = 1.5 Hz, 1H), 7.60-7.64 (m, 3H), 7.70-7.74 (m, 4H). (附圖 1) Br Br A1 2. 2,2-diphenylvinylboronic acid化合物A2. 19 在氮氣下將2-bromo-1,1-diphenylethene (5.00 g, 19.3 mmol)置於反 應瓶中,加熱抽真空三次,加入50.0 mL的anhydrous THF,降溫至-78
oC將n-BuLi (19.3 mL, 48.2 mmol, 2.50 M in n-hexane)緩緩滴入,攪拌
約半小時;再降溫至-78 oC,加入B(OBu)3 (13.1 mL, 48.2 mmol),攪
拌8 小時;終止反應後,混合物與 2.0 M HCl進行酸化約 3~4 小時, 用EtOAc萃取,抽乾後靜置待固體析出,過濾,用n-hexane洗固體,
得白色固體2.20 g,產率 50.9 %。1H NMR (300 MHz, CDCl3): δ 6.13 (s,
1H), 7.21-7.32 (m, 8H), 7.42-7.46 (m, 2H). (附圖 2)
B(OH)2
A2
3.1,2,2-triphenylvinylboronic acid 化合物 A3.
在氮氣下將1-bromo-1,2,2-triphenylethene (2.00 g, 5.99 mmol)置於 反應瓶中,加熱抽真空三次,加入37.5 mL anhydrous的THF,降溫至 -78 oC將n-BuLi (5.98 ml, 15.0 mmol, 2.50 M in n-hexane)緩緩滴入,攪 拌約半小時;再降溫至-78 oC,加入B(OBu)3 (4.05 mL, 15.0 mmol), 攪拌8 小時;終止反應後,混合物與 2.0 M HCl進行酸化約 3~4 小時, 用EtOAc萃取,抽乾後靜置待固體析出,過濾,用n-hexane洗固體, 得白色固體1.50 g,產率 83.5 %。1H NMR (300 MHz, CDCl3): δ 4.13 (s, 2H), 6.88- 6.92 (m, 2H), 7.00-7.19 (m, 8H), 7.29-7.38 (m, 5H). (附圖 3) 13C NMR (75 MHz, CDCl 3): δ 126.2, 127.0, 127.6, 128.2, 128.4, 128.6, 129.3, 129.8, 130.7, 141.9, 142.2, 143.7, 153.2. (附圖 4)
B(OH)2
A3
4. 2-tert-butyl-9,10-bis(4-(2,2-diphenylvinyl)phenyl)anthracene 化合物 A4. (ANDP)
在氮氣下,將A1 (200 mg, 0.37 mmol),A2 (247 mg, 1.10 mmol),
K2CO3 (aq) (2.0 M, 2.0 mL),aliquat 336 (~45.0 mg)及甲苯 6.0 mL加入雙 頸瓶中,進行除氧充氮氣。60 oC下,攪拌至完全溶解。開大氮氣, 快速加入Pd(PPh3)4 (~5.0 mg)並將反應升溫至 100 oC~110 oC,攪拌 3~4 小時。冷卻至室溫,用甲醇進行再沉澱,再加入等量蒸餾水攪拌,過 濾,以甲醇及蒸餾水洗沉澱物,以n-hexane做管柱層析分離,得黃色 固體240 mg,產率 88.0 %。1H NMR (300 MHz, CDCl3): δ 1.27 (s, 9H), 7.13 (d, J = 4.2 Hz, 2H), 7.20-7.42 (m, 31H), 7.55 (d, J = 1.5 Hz, 1H), 7.59 -7.68 (m, 3H). (附圖 5) 13C NMR (75 MHz, CDCl 3): δ 30.8, 34.9, 121.1, 124.4, 124.5, 124.7, 126.5, 126.8, 127.4, 127.5, 127.6, 127.7, 127.9, 128.1, 128.2, 128.3, 128.6, 128.8, 129.4, 129.7, 129.8, 130.3, 130.5, 130.9, 131.0, 136.3, 136.4, 136.5, 137.5, 140.4, 142.8, 142.9, 143.4, 143.5, 147.1. (附圖 6) Anal. Calcd for C58H46: C, 93.76; H, 6.24. Found: C, 93.52; H, 6.10.
A4
5.2-tert-butyl-9,10-bis(4-(1,2,2-triphenylvinyl)phenyl)anthracene 化 合物 A5. (ANTP)
在氮氣下,將A1 (1.00 g, 1.80 mmol),A3 (1.35 g, 4.51 mmol),
K2CO3 (aq) (2.00 M, 10.0 mL),aliquat 336 (~220 mg)及甲苯 30.0 mL加 入雙頸瓶中,進行除氧充氮氣。60 oC下,攪拌至完全溶解。開大氮 氣,快速加入Pd(PPh3)4 (~24.8 mg)並將反應升溫至 100 oC~110 oC,攪 拌3~4 小時。冷卻至室溫,用甲醇進行再沉澱,再加入等量蒸餾水攪 拌,過濾,以甲醇及蒸餾水洗沉澱物。以n-hexane做管柱層析分離, 得黃色固體1.10 g,產率 68.3 %。1H NMR (300 MHz, CDCl3): δ 1.30 (s, 9H), 7.08-7.22 (m, 37H), 7.26-7.33 (m, 3H), 7.43 (dd, J = 9.2, 2.0 Hz, 1H), 7.56-7.62 (m, 4H). (附圖 7) 13C NMR (125 MHz, CDCl 3): δ 30.9, 35.0, 121.2, 124.3, 124.4, 124.7, 126.4, 126.5, 127.6, 126.7, 126.8, 126.9, 127.5, 127.6, 127.7, 127.8, 128.3, 129.4, 129.7, 129.9, 130.6, 130.7, 131.2, 131.3, 131.4, 131.5,
131.6, 136.4, 136.6, 137.0, 137.1, 140.9, 141.0, 141.2, 141.4, 142.9, 143.0, 143.4, 143.5, 143.7, 143.8, 143.9, 147.0, (附圖 8)
Anal. Calcd for C70H54: C, 93.92; H, 6.08. Found: C, 94.06; H, 6.22.
HRMS(m/z):[M++H] calad. For C70H55 895.4304;found 895.4299
第三章 結果與討論
3-1. 合成部份
化合物 A1 反應流程為 Scheme 1,先將 1,4-dibromobenzene 溶於 anhydrous diethyl ether 以 n-BuLi 將溴取代,再對 quinone 進行反應,
經由脫水得到化合物 A1。
化合物 A4 及 A5 反應流程如 Scheme 2 所示,以本實驗室合成而 得的化合物 A1 為起始物,分別與 diphenylvinyl 及 triphenylvinyl 的硼 化物進行Suzuki coupling,先經由再沉澱及管柱層析分離,最後再進 行昇華的純化,得到產物 ANDP 及 ANTP。
Scheme 1 Ar = phenyl O O Br Ar Br n-BuLi Li Ar Br HO Ar Ar Br Br OH KI/NaHPO2 HOAc,reflux Br Br A1 Scheme 2 Br Br B(OH)2 B(OH)2 Pd(PPh3)4/K2CO3/toluene/ H2O/aliquate@336 Pd(PPh3)4/K2CO3/toluene/ H2O/aliquate@336 ANDP ANTP A1
3-2. 物理性質
3-2-1. DSC 及 TGA 測量 在熱性質部分我們使用DSC及TGA進行測量;DSC可測量物質在 不同溫度相變化的情形,如玻璃轉移溫度(Tg)、熔融溫度(Tm)等;TGA 則可藉由物質重量對溫度的變化,而獲得該物質的裂解溫度。在 OLED元件製程中,必須避免在蒸鍍的過程中材料發生結晶或是裂解 的情形,所以材料的熱性質是否穩定,對於元件效率的優劣有著相當 重要的影響。表 3A-1. ANDP 及 ANTP 之熱性質比較
Tg (oC) Tm (oC) Td(-5 %) (oC) Td(-10 %) (oC) ANDP 114 245 435 453 ANTP 155 296 445 463 Tg:樣品的玻璃轉移溫度。 Tm:樣品的熔融溫度。 Td(%):樣品重量損失百分率的溫度。 ANDP及ANTP的玻璃轉移溫度分別為114 oC、155 oC,都較 DPVBi(4,4’-bis(2,2-diphenylvinyl)-1,1’-biphenyl, Tg = 64 oC)19高,這是 因為DPA的結構較biphenyl剛硬;此外ANTP具比ANDP有較高的玻璃 轉 移 溫 度 , 是 因 為 ANTP 在 二 苯 基 蒽 兩 側 苯 環 上 具 有 較 剛 硬 的 triphenylvinyl取代基。在TGA測量方面ANDP及ANTP的5 %、10 %重 量損失溫度皆在435 oC以上,顯示ANDP及ANTP都具有良好的熱穩定 性質。
0 50 100 150 200 250 300 350 2nd heating 1st heating Endotherm ic Tg = 114 oC Tm = 245 oC Temperature (oC) 圖 3A-2-1. ANDP 之 DSC 0 50 100 150 200 250 300 350 2nd heating 1st heating Endothermic Temperature (oC) Tm = 296 oC T g = 155 o C 圖 3A-2-2. ANTP 之 DSC
0 100 200 300 400 500 600 700 800 900 0 20 40 60 80 100 ANTP 5 % wt. loss 445 oC 10 % wt. loss 463 oC Wei g ht loss (%) Temperature(oC) 0 100 200 300 400 500 600 700 800 900 0 20 40 60 80 100 Weight los s ( % ) Temperature(oC) ANDP 5 % wt. loss 435 oC 10 % wt. loss 453 oC
圖 3A-2-3. ANDP 之 TGA
3-3. 光學性質
3-3-1. UV/vis 吸收光譜與 PL 放射光譜 圖 3A-3-1. 為DPA、ANDP及ANTP的THF溶液態吸收和放射光 譜,其光譜的性質總結於表 3A-2.。在UV吸收光譜中ANDP和ANTP 在~350-400 nm 都 具 有 來 自 anthracene 上 π-π* 電 子 躍 遷 的 vibronic patterns。在放射光譜中,我們可以觀察到ANTP的最大放射波長較ANTP 藍 位 移 , 這 是 因 為 diphenylanthracene (DPA) 兩 側 苯 環 上 的 triphenylvinyl取代基,與diphenylvinyl取代基相比,在空間上會造成
較嚴重的扭曲,因而導致ANTP的共軛性較差20,導致ANTP光色較
ANDP趨近飽和藍光。圖 3A-3-2. 為ANDP及ANTP的薄膜態吸收和 放射光譜,與溶液態的光譜類似,和溶液態之最大放射波長只差約 4~6 nm,表示ANDP及ANTP蒽上的t-butyl及兩側剛硬的官能基團, 可成功地阻擋分子間堆疊,使其放光範圍仍在飽和藍光。
表 3A-2. ANDP 及 ANTP 之 UV-vis 吸收與 PL 放射量測表
λabs, sol’n (nm) λPL, sol’n (nm) λabs, film (nm) λPL, film (nm)
ANDP 267, 310, 360, 378, 397 455 271, 309, 363, 382, 403 459 ANTP 267, 316, 360, 377, 497 448 271, 316, 363, 381, 400 454 DPA 260, 354, 372, 393 410, 429 --- ---
200 300 400 500 600 700 0.0 0.2 0.4 0.6 0.8 1.0 Abs. /Em. intensit y (a.u. ) Wavelength (nm) ANDP ANTP DPA
圖 3A-3-1. DPA、ANDP 及 ANTP 在 THF 吸收/放射光譜
200 300 400 500 600 700 0.0 0.2 0.4 0.6 0.8 1.0 ANDP ANTP Abs./Em. intensity (a.u.) Wavelength (nm)
3-3-2. ANDP 及 ANTP 量子效率的測量(Quantum yield) 為了得知各個化合物的量子效率,我們測量待測物及參考標準品 的螢光光譜,並將測得的光譜積分面積值及激發波長的吸收度代入下 列公式,即可求得各化合物的量子效率。 (Φs/Φr)=(Ar/As)×(Is/Ir)×(Qr/Qs) r:reference s:sample Φ:量子效率 A:激發波長的吸收度 I:螢光放光的積分面積 Q:螢光激發光源所提供光的量子
表 3A-3. ANDP 及 ANTP 之量子效率
Quantum yield
Solution a Filmb
ANDP 0.83 0.81
ANTP 0.060 0.89
a DPA 在 cyclohexane 中以 365 nm 波長激發的量子效率為 0.9。
b ANDP 及 ANTP 以 1 wt % 摻混在 PMMA 中測得以 365 nm 波長激發,以 DPA 在PMMA 作為基準值 1。
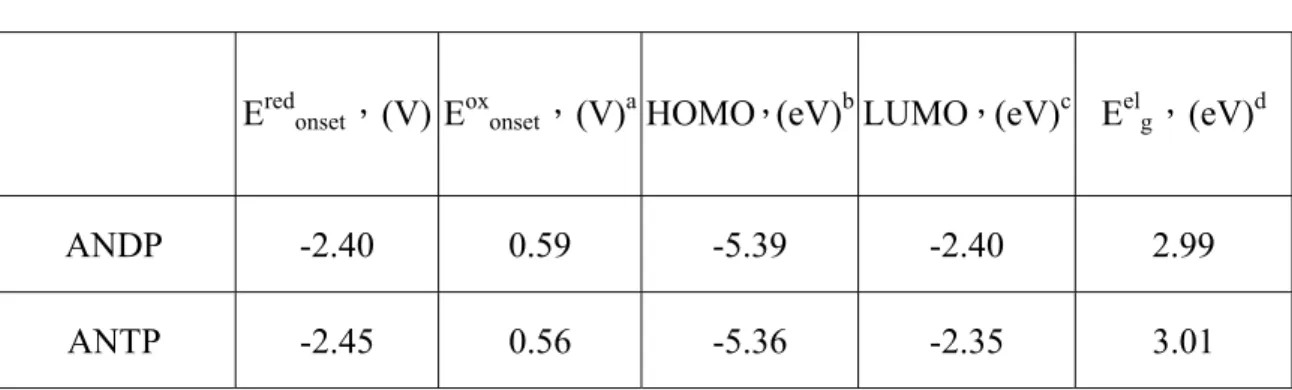
3-4.電化學性質-氧化還原電位測量
為了探討用於元件的有機材料,需建立能階圖,做為我們選用材 料特性的參考,以便預測電子與電洞結合的位置及能量轉移的效果。 我們利用下列公式來計算HOMO、LUMO值,氧化及還原起始電 位皆採用伏特作為單位(vs. Fc/Fc+),常數為 4.8 為ferrocene相對於真 空能階。 HOMO = -4.8 - Eoxonset LUMO = Eelg + HOMO 以ANDP為例,經過ferrocene標準品校正後可得為Eoxonset = 0.59 eV,代入上述公式求得HOMO = -5.39 eV。氧化電位由圖 3A-4-1. 所示。因 ANDP 及 ANTP 的還原電位皆無
法由 CV 測得,故藉由吸收光譜訂出 ANDP 及 ANTP 的能隙,再扣
除由CV 測得之 HOMO 而計算出 LUMO。氧化電位及 HOMO、LUMO 計算如表 3A-4.
表 3A-4. ANDP 及 ANTP 溶液態的氧化電位起始值及 HOMO、LUMO
Eredonset,(V) Eoxonset,(V)aHOMO,(eV)bLUMO,(eV)c Eelg,(eV)d
ANDP -2.40 0.59 -5.39 -2.40 2.99 ANTP -2.45 0.56 -5.36 -2.35 3.01
a相對於Fc/Fc+的電位 b
c LUMO = Eoxonset - Eelg dElectrochemical bandgap Eel g = 由THF溶液態的吸收光譜所訂得。 -2.5 -2.0 -1.5 -1.0 -0.5 0.0 0.5 1.0 -4 -2 0 2 4 6 ANDP HOMO = -5.4 LUMO = -2.4 Eg = 3.0 0.73 0.61 0.59 -2.5 -2.4 Current( µA) Potential (V vs.Fc/Fc+) 圖 3-4-1. ANDP 溶液態之 CV 圖 -3.0 -2.5 -2.0 -1.5 -1.0 -0.5 0.0 0.5 1.0 -2 -1 0 1 2 3 ANTP HOMO = -5.36 LUMO = -2.35 Eg = 3.01 -2.88 -2.45 0.72 0.63 0.56 Current( µA) Potential (V vs.Fc/Fc+) 圖 3-4-2. ANTP 溶液態之 CV 圖
3-5. 元件電激發光性質
為了研究 ANDP 與 ANTP 的電激發光性質,本實驗室分別以此 兩種新穎螢光材料作為發光層來製作非摻雜型藍光元件,並探討其元
件的表現。在本論文中,製備了四種不同結構之元件,分別為元件I、
II、III、IV;其中 NPB 與 TFTA 作為電洞傳輸層,ANDP、ANTP 作 為藍光主發光體,TPBI 作為電子傳輸層,元件及各材料結構如下: N N N N N N N N N TFTA NPB TPBI
元件I:ITO/NPB (30 nm)/ANDP (40 nm)/TPBI (40 nm)/Mg:Ag (100 nm)/Ag (100 nm)
元件II:ITO/TFTA (30 nm)/ANDP (40 nm)/TPBI (40 nm)/Mg:Ag (100 nm)/Ag (100 nm)
(100 nm)/Ag (100 nm)
元件IV:ITO/TFTA (30 nm)/ANTP (40 nm)/TPBI (40 nm)/Mg:Ag (100 nm)/Ag (100 nm)
分別比較以 ANDP 或 ANTP 作為主發光體的元件 EL 圖譜(圖
3A-5-1.)可發現,以 ANTP 作為主發光體所製成的藍色 OLED 元件較 ANDP 為主發光體的元件藍位移了約 8 nm,因而使其色度座標更接 近標準飽和的藍光(圖 3A-5-2.),此結果與之前在 PL 圖譜上的結果是
相符合的,也在一次印證 ANTP 因具有較大的 steric hindrance 使整個
化合物的共軛長度較短,而造成光色上的藍位移。此外,比較EL 與
PL 圖譜時可發現,不論是以 ANDP 或 ANTP 作為主發光體所製成的
元件,在 EL 圖譜上並沒有產生因激發複體(excimer)或激發複合體
(exciplex)所導致的光色偏移,這意味了 ANDP 與 ANTP 在電激發過 程中相當穩定,因此很適合應用在藍光電發光的元件上。
400 500 600 0.0 0.2 0.4 0.6 0.8 1.0 Wavelength (nm) EL Int ens ity (a.u. ) Device I Device II Device III Device IV 圖 3A-5-1. 元件 I、II、III、IV 之 EL 圖譜 CIE Coordinates 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 0 0.2 0.4 0.6 0.8 X Y 520 560 600 480 圖 3A-5-2. 元件 I、II、III、IV 之色度座標圖
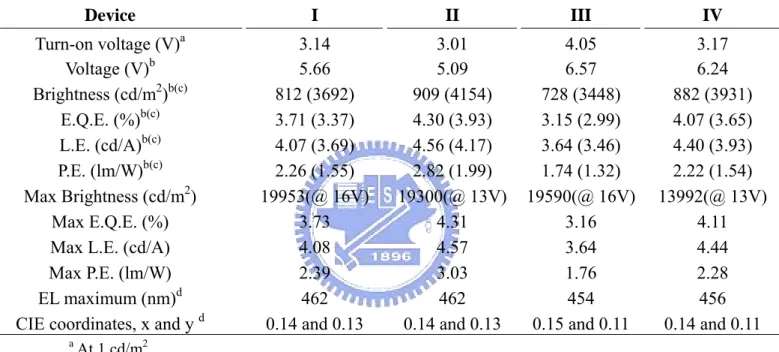
在元件效率表現上(圖 3A-5-3.、4.,表 3A-5.),以 NPB 當作電洞傳輸
層,ANDP 作為主發光體時(元件 I),元件的最大外部量子效率與發 光效率分別為3.73 %、4.08 cd/A;以 NPB 當作電洞傳輸層,ANTP 當作主發光體時(元件 III),元件的最大外部量子效率與發光效率為 3.16 %、3.64 cd/A。為了使 ANDP 與 ANTP 在元件中展現更佳的效
率,我們以本實驗室所合成的高效率電洞傳輸化合物 TFTA 取代 NPB
作為電洞傳輸層來製備元件;當以TFTA 當作電洞傳輸層,ANDP 作
為主發光體時(元件 II),元件的最大外部量子效率與發光效率分別可
達到4.31 %、4.57 cd/A;以 TFTA 當作電洞傳輸層,ANTP 當作主發 光體時(元件 IV),元件的最大外部量子效率與發光效率分別可達到 4.11 %、4.44 cd/A。發現以 TFTA 為電洞傳輸層時效率可大幅提升, 歸因於 TFTA 傳電洞的速率較 NPB 慢,以致元件中電荷較平衡,電 子電洞在發光層再結合之效率提升,因而有較高之效率。當比較不同 主發光體的元件結果後發現,不論是以 ANDP 或 ANTP 作為主發光 體的元件,都可達到極高亮度,且其效率表現是目前非摻雜型的藍色 螢光元件所能達到的最高效率,且足以與摻雜型藍色螢光元件的效率 相匹敵。然而非摻雜型的元件,在製程的簡化上卻是摻雜型元件難以 企及的;因此未來在商業化上,ANDP 與 ANTP 此兩種新穎藍色螢 光材料將具有可觀的競爭力。
. 0 200 400 600 0 1 2 3 4 5
Current Density (mA/cm2)
Ext e rnal Q u ant um Eff icienc y (%) 0 2000 4000 6000 8000 10000 12000 14000 16000 18000 Device I Device II Device III Device IV Lumi n escence (cd/m 2 ) 圖 3A-5-3. 元件 I、II、III、IV 之外部量子效率 與亮度對電流密度作圖 0 200 400 600 0 1 2 3 4 5 6 Device I Device II Device III Device IV
Current Density (m A/cm2)
Luminance Effic
iency (Cd/A
)
而 ANDP 與 ANTP 因為具有極佳的熱穩定性,因此在元件的操 作壽命上應會有令人期待的表現,目前元件穩定性與壽命的實驗正在 進行中。
表 3A-5. ANDP 及 ANTP 元件特性比較
Device I II III IV Turn-on voltage (V)a 3.14 3.01 4.05 3.17 Voltage (V)b 5.66 5.09 6.57 6.24 Brightness (cd/m2)b(c) 812 (3692) 909 (4154) 728 (3448) 882 (3931) E.Q.E. (%)b(c) 3.71 (3.37) 4.30 (3.93) 3.15 (2.99) 4.07 (3.65) L.E. (cd/A)b(c) 4.07 (3.69) 4.56 (4.17) 3.64 (3.46) 4.40 (3.93) P.E. (lm/W)b(c) 2.26 (1.55) 2.82 (1.99) 1.74 (1.32) 2.22 (1.54) Max Brightness (cd/m2) 19953(@ 16V) 19300(@ 13V) 19590(@ 16V) 13992(@ 13V) Max E.Q.E. (%) 3.73 4.31 3.16 4.11
Max L.E. (cd/A) 4.08 4.57 3.64 4.44
Max P.E. (lm/W) 2.39 3.03 1.76 2.28
EL maximum (nm)d 462 462 454 456
CIE coordinates, x and y d 0.14 and 0.13 0.14 and 0.13 0.15 and 0.11 0.14 and 0.11
a At 1 cd/m2. b At 20 mA/cm2.
c The data in the parentheses were taken at 100 mA/cm2. d At 9 V.
第四章 結論
以 DSA(distyrylarylene)為架構,分別將 diphenylvinyl 及 triphenyl- vinyl 與 DPA 做結合,得到產物 ANDP 及 ANTP。ANDP 及 ANTP
本身的非平面性結構導致其光色坐落於飽和藍光範圍,加上 anthra-
cene 本身良好的電化學性質,因此 ANDP 及 ANTP 在目前非摻雜藍
光材料中有相當優異的表現;ANDP 元件的最大外部量子效率與發光 效率分別可達到4.31 %、4.57 cd/A,其 CIE 色度座標為(0.14, 0.13);
ANTP 元件的最大外部量子效率與發光效率分別可達到 4.11 %、4.44 cd/A,其 CIE 色度座標為(0.14, 0.11)。
參考文獻
1. OLED/
有機電激發光材料與元件
, 1st, ed., 五南圖書出版股份有限 公司, 台灣, 2005.2. Shi, J.; Tang, C. W.; Appl. Phys. Lett. 2002, 80, 3201.
3. Hosokawa, C.; Higashi, H.; Nakamura, H.; Kusumoto, T. Appl. Phys.
Lett. 1995, 67, 3853.
4. Pope, M.; Kallmann, H. P.; Maghante, P.J. Chem. Phys. 1962, 39, 2042.
5. Berlman, B.; Handbook on Fluorescence Spestra of Aromatic Molecules, Academic Press, New York, 1971.
6. Wu, C. C.; Lin, Y.; Chiang, H. H.; Cho, T. Y.; Chen, C. W.; Wong, K. T.; Liao, Y. L.; Lee, G. H.; Peng, S. M. Appl. Phys. Lett. 2002, 81, 577. 7. Lee, M. T.; Liao, C. H.; Tsai, C. H.; Chen, C. H. Adv. Mater. 2005, 17,
2493.
8. Kim, Y. H.; Shin, S. H.; Ko, C. K.; Yu, H. S.; Chae, T. S.; Kwon, S. K.
Adv. Mater. 2001, 13, 1690.
9. Chiechi, R. C.; Tseng, R. J.; Marchion, F.; Yang, Y.; Wudl, F. Adv.
Mater. 2006, 18, 325.
10. Shih, H. T.; Lin, C. H.; Shih, H. H.; Cheng, C. H. Adv. Mater. 2002, 14, 1409.
11. Kim, Y. H.; Kwon, S. K.; Yoo, D. S.; Rubner, M. F.; Wrighton, M. S.
Chem. Mater. 1997, 9, 2699.
12. Horhold, H. H.; Opferrmann, J. Makromol. Chem. 1970, 131, 105. 13. Shi, J.; Tang, C. W. Appl. Phys. Lett. 2002, 80, 3201.
H. H.; Chen, C. H. Synth. Met. 1997, 9, 2699.
15. Benzman, R.; Faulkner, L. R. J. Am. Chem. Soc. 1972, 94, 6317. 16. Adachi, C.; Takito, S.; Tutsui, T.; Satto, S. Jpn. J. Appl. Phys. 1988,
27, 269.
17. Garay, R. O.; Naarmann, H.; Mullen, K. Macromolecules 1994, 27, 1922.
18. Danel, K.; Huang, T. H.; Lin, J. L.; Tao, Y. T.; Chuen, C. H. Chem.
Mater. 2002, 14, 3860.
19. Wu, F. I.; Shih, P. I.; Yuan, M.C.; Dixit, A. K.; Shu, C. F.; Chungand, Z. M.; Diau, E. W. G. J. Mater. Chem. 2005, 15, 4753.
20. Wang, S.; Warren, J.; Oldham, Jr., Raymond, A.; Hudack, Jr.; Guillermo, C. B. J. Am. Chem. Soc. 2000, 122, 5695.
21. Kim, Y. H.; Jeong, H. C; Kim, S. H.; Yang, K.; Kwon, S. K. Adv.
B 部分
高效率之白光高分子發光二極體
第一章 緒論
1-1. OLED 全彩化發展 隨著OLED技術逐漸成熟,逐漸邁向全彩化發展。在全彩色化方 面,一般說來有三種方式:三色發光法、濾光法與色變換法。發光層 使用紅、綠、藍三種發光材料分開塗佈配置。優點是充分利用三種顏 色的發光材料,但缺點則是當三種材料壽命不同時,則整體的壽命受 制於較短壽命的材料。另外在製程中採用光罩分開塗佈時,全體光罩 將由於受熱而引起熱膨脹問題,控制頗為困難,此在追求高精細化時 將會遇到一些困難。解決三色發光的缺點,近年來開發的新方法有濾 光法和色變換法,這兩種方法無須使用光罩,精細度也可以大幅提 高。濾光法的原理為發光層部分塗滿白光材料,利用液晶顯示器用的 彩色濾光片產生紅、綠、藍三種顏色,不過也由於使用彩色濾光片的 緣故使得發光效率減低,因此如何開發高效率白光材料就是重要課 題。另外一種色變換法則是與濾光法類似,只是將發光層的白光材料 改為藍光材料,彩色濾光片改為螢光膜。 對於白光材料加彩色濾光片的方式,日本山形大學大學院教授兼 有機電子學研究所長城戶淳二也曾在研討會中表示,採用三色發光法技術在大尺寸 TV 用的生產上將有實際上的困難,而採用白光有機 EL 材料和濾光片的組合方式比較可以達到大型化的目標。 1-2. 白光 OLED 之演進 在 1990 年代初期已經有很多小分子及高分子白光元件的文獻, 簡述如下: 1-2-1. 白光小分子元件,(性質如表 1.)1 1995年,Kido等人使用藍、綠、紅發光材料製備多層白光元件2; 1999年,Deshpande等人將DCM2摻混在α-NPD中做為紅光發光層,藍 光發光層選用α-NPD,綠光則選用Alq3,製成多層白光元件,效率較 先前的文獻佳;因多層的白光元件在濃度及厚度調控上不易,增加元 件製備的困難度3,所以在2002年,Mazzeo等人使用一對藍光發光材 料 N,N’-bis(3-methyl-phenyl)N,N’-diphenylbenzidine(TPD) 及 2,5-bis (tri-methylsilyl thiophene)-1,1-dioxide,經由exciplex的機制產生白光 4;2004年,Shao及Yang使用solid solution技術,製備一單層發光層之 白光元件,簡化了白光小分子元件的製程5。 1-2-2. 白光高分子元件,(性質如表 2.)1 同樣在1995年,Kido等人使用多種螢光小分子材料與poly-(N- vinylcarbazole)(PVK)相互混摻,製備單層白光高分子元件6;1996年,
Granstrom等人使用不同能障之高分子相互混摻,藉由能量轉移機制 使其達到白光7;1998年,Chao等人使用兩個藍光高分子製成雙層元 件,藉由exciplex的機制產生白光8;Gong等人在2004年發表以導電高 分子與有機金屬材料摻混達到高效率的白光元件9。 表1. 白光小分子元件性質 白光小分子元件 性質
Kido Deshpande Mazzeo Shao、Yang
Year 1995 1999 2002 2004 Voltage (V @ 1cd/m2) ~6 - ~8 ~10 EEmax (cd/A) - - - ~2.5 PEmax(lm/W) - ~0.35 - - Lmax (cd/m2) ~2200 ~13500 ~150 ~15000 Voltage (V @ Lmax) ~16 ~18 ~14 ~13 CIE coordinate - (0.33, 0.33) (0.34, 0.38) (0.29, 0.33) 表 2. 白光高分子元件性質 白光高分子元件 性質
Kido Granstrom Gong
Year 1995 1996 2004 Voltage (V @ 1cd/m2) ~8 - ~5 EEmax (cd/A) - - ~4.3 PEmax (lm/W) - - ~1.0 Lmax (cd/m2) ~4100 - ~12000 Voltage (V @ Lmax) ~20 - ~17 CIE coordinate (0.43, 0.38) (0.34, 0.32) (0.32, 0.33)
1-3. 白光高分子應用之近況 近年來關於白光高分子發光二極體(WPLED)元件越來越受重 視,因為其製程便宜又可用旋轉塗佈法做大面積的面板,因而具有很 高的應用價值;如搭配彩色濾光片製作全彩畫的顯示器,取代日光燈 作為照明器材等。 一般而言,要形成白光,必須具有波段極寬的放射光譜,範圍需 囊括藍、綠、紅光的發光波段。此特性在單一成份的小分子或高分子 中不容易形成,所以在較早期的文獻比較少有單一分子或高分子發白 光被報導;因此一般常見之白光元件,皆用兩種或兩種以上的發光材 料製成多層元件;或是高分子與高分子間之物理混摻10-12,另一途徑 為螢光、磷光材料與一高效率的藍光高分子材料做物理混摻13-17。然 而前者的製程方式太過於複雜,而且具有相當的困難度,不利於商業 上的應用;而後兩者通常有效率低,或因相分離而導致光色不穩定等 問題。為解決上述的問題,單一白光高分子逐漸備受重視與發展,因 其製程簡單,又可避免相分離的問題。 早期已有數種白光高分子被發表,如polyaniline18、具有OXD基團 的PPV與乙醚聯接的共聚物19等,但其效率並不高;在近兩年來,隨 著該領域的發展越趨成熟,已有幾篇單一成份白光高分子的文獻被發 表,且具有不錯的效率;如以fluorene及naphthalimide共聚之白光高分
子,其最大亮度效率為3.8 cd/A、最大亮度為11900 cd/m2、CIE座標為 (0.32, 0.36);另篇以fluorene及benzothiadiazole共聚之白光高分子,最 大亮度效率可達到7.5 cd/A、最大亮度為12300 cd/m2、CIE座標為(0.35, 0.32);然而此類高分子是由藍、橘光所組成的雙波段白光20-22;因此, 若應用於全彩顯示器上,會因其演色性不足,而造成色飽和度與顏色 失真之窘境。目前已有少數之文獻報導三波段之白光高分子:如以 DTPA作為綠光之客發光體及TPDCM為紅光客發光體與fluorene共聚 之三波段白光高分子,其最大亮度效率僅有0.1 cd/A23;而分別以 naphthalimide及benzothiadiazole作為綠、紅光之客發光體與fluorene共 聚之三波段白光高分子,其最大亮度效率則可達1.59 cd/A24;雖上述 兩各白光高分子可避免顏色失真,但在效率之改善仍有很大的提升空 間。 1-4. 研究動機 本篇論文旨在合成一個同時具有藍、綠、紅三波段的單一白光高 分子;POF(polyfluorene)是已知具有高效率的藍光高分子,但在這篇 文章,我們選用了PF-TPA-OXD (TOF),因為TOF除了保有POF的高 效率外,在其側鏈上導入TPA、OXD官能基團,因而兼具有傳電子、 電洞的能力,可幫助電子、電洞的平衡25,因此選擇TOF作為藍光發
光團兼主發光體高分子;另外;在先前的文獻已報導PFN-BTDZ為具 有 高 效率 的 黃綠 光 高 分 子 , 其 放 射 波 長 約 在 529~543 nm26; 而 PFO-DBT則為高效率的紅光高分子,其放射波長約在 635 nm27,因此 我 們 選 擇 2,1,3-benzo-thiadiazole(BT) 及 4,7-di-2-thienyl- 2,1,3-benzothia-diazole(TBT)作為綠光及紅光的客發光體,以期得到具 有高效率的三波段白光高分子。 N N n-Bu n-Bu n-Bu n-Bu O N N N N O C8H17 C8H17 C8H17 C8H17 * * n m PF-TPA-OXD (TOF)
第二章 實驗
1. 4,7-di-2-thienyl-2,1,3-benzothiadiazole 化合物B1.27 將4,7-dibromo-2,1,3-benzothiadiazole (1.00 g, 3.43 mmol)及tributyl -(2-thienyl)stannane (3.08 g, 8.26 mmol)溶於anhydrous THF (25 mL), 除氧後在氮氣下加入PdCl2(PPh3)2 (48 mg, 2.0 mol %),加熱至迴流, 攪拌 3 小時,移除溶劑用n-hexane進行管柱層析,再用EtOAc及 n-hexane做再結晶,得紅色針狀結晶 600 mg,產率 58.3 %。1H NMR (300 MHz, CDCl3): δ 7.20 (dd, J = 5.1, 3.6 Hz, 2H), 7.44 (dd, J = 5.1, 1.2 Hz, 2H), 7.86 (s, 2H), 8.10 (dd, J = 3.6, 0.6 Hz, 2H). (附圖 9) S N S N S B1 2. 4,7-bis(5-bromo-2-thienyl)-2,1,3- benzothiadiazole 單體B2.27 將 4,7-di-2-thienyl-2,1,3-benzothiadiazole (200 mg, 0.67 mmol)、 CHCl3 (5.0 mL)、N-bromosuccinimide (249 mg, 1.40 mmol) 及 aceticacid (5 mL) 在氮氣下置於反應瓶中,室溫下攪拌 8 小時,直到暗紅 色固體產生,過濾收集固體,用CHCl3做再結晶,得紅色針狀結晶200
mg,產率 65.5 %。1H NMR (300 MHz, CDCl3): δ 7.14 (d, J = 3.9 Hz, 2H),
S S Br Br N S N B2 3. 4,7-dibromo-2,1,3-benzothiadiazole 單體B3.28 將2,1,3-benzothiadiazole (2.00 g, 14.7 mmol)及47.0 % HBr (4.41 mL) 溶液置於反應瓶中,在氮氣下加熱至迴流、攪拌,再將Bromine (7.04 g, 44.1 mmol ) 緩慢加入,攪拌兩小時待反應乾掉,此時再加HBr 3.0 mL,繼續攪拌3小時,過濾用5.0 % sodium bicarbonate 水溶液及水洗 固體。用EtOAc : n-hexane = 1 : 5 進行管柱層析,最後以再結晶得到 產物 2.40 g,產率 55.6 %。1H NMR (300 MHz, CDCl3): δ7.71 (s, 2H). (附圖 11) N S N Br Br B3 4. 2,7-bis(4,4,5,5-tetramethyl-1,3,2-dioxaborolane-2-yl)-9,9-dioctyl- fluorene 單體 B4. 由本實驗室廖松甫學弟所提供。
B B O O O O B4 5. 9,9-bis(4-di(4-butylphenyl)aminophenyl)-2,7-dibromofluorene 單體 B5. 由本實驗室簡辰翰同學所提供。 N N n-Bu n-Bu n-Bu n-Bu Br Br B5 6. 9,9-Bis(4-(5-(4-tert-butylphenyl)-2-oxadiazolyl)phenyl)-fluorene 單體 B6. 由本實驗室葉桓綺學妹所提供。 O N N N N O Br Br B6
7.2-(9,9-dihexyl-9H-fluoren-7-yl)-4,4,5,5-tetramethyl-1,3,2-dioxa- borolane化合物B7.29
將 2-bromo-9,9-dihexyl-fluorene (2.00 g, 4.85 mmol)、bis(pina- colato)diboron (1.35 g, 5.34 mmol)、K2OAc (1.56 g, 16.0 mmol)及
anhydous DMF 30.0 mL置於反應瓶中,在氮氣下加熱至 70 oC除氧約 10 分鐘,再將PdCl2(dppf) (114 mg, 0.14 mmol)加入,恆溫在 70 oC~80 oC,反應 7~8 小時;加水終止反應,以EtOAc萃取,EtOAc : n-hexane = 2 : 98 進行管柱層析,得黃色油狀液體 1.00 g,產率 44.8 %。1H NMR (300 MHz, CDCl3): δ 0.56-0.60 (m, 4H), 0.75 (t, J = 6.9 Hz, 6H), 1.00-1.12 (m, 12H), 1.39 (s, 12H), 1.94-2.00(m, 4H), 7.30-7.34 (m, 3H), 7.68-7.74 (m, 3H), 7.80 (d, J = 6.6 Hz, 1H). (附圖 12) B O O B7 8.4,7-bis(5-(9,9-dihexyl-9H-fluoren-2-yl)thiophen-2-yl)benzo[c][1,2,5] thiadiazole 化合物 MR. 在氮氣下,將B7 (221 mg, 0.48 mmol),B2 (100 mg, 0.22 mmol), K2CO3 (aq) (2.0 M, 2.0 mL),aliquat 336 (~5.36 mg)及甲苯 3 mL加入雙
頸瓶中,進行除氧充氮氣。60 oC下,攪拌至完全溶解。開大氮氣, 快速加入Pd(PPh3)4 (~3.0 mg)並將反應升溫至 100 oC~110 oC,攪拌 3~4 小時。冷卻至室溫,用EtOAc萃取,EtOAc:n-hexane = 1:10 進行管 柱層析,n-hexane做再結晶,烘乾,得紅色粉狀固體 85.0 mg,產率 42.5 %。1H NMR (300 MHz, CDCl3): δ 0.58-0.66 (m, 8H), 0.74 (t, J = 6.8 Hz, 12H), 1.05- 1.13 (m, 24H), 1.98-2.04 (m, 8H), 7.29-7.35 (m, 6H), 7.48 (d, J = 3.9 Hz, 2H), 7.65 (s, 2H), 7.70 (m, 6H), 7.93 (s, 2H), 8.14 (d, J = 3.9Hz, 2H). (附圖 13) 13C NMR (75 MHz, CDCl 3): δ 14.0, 22.6, 23.7, 29.7, 31.5, 40.4, 51.2, 119.8, 120.0, 120.1, 122.9, 123.9, 124.7, 125.3, 125.7, 126.8, 127.2, 128.6, 132.8, 138.3, 140.5, 141.1, 146.5, 150.9, 151.6, 152.6. (附圖 14) HRMS(m/z):[M++H] calad. For C64H73N2S3 9654.4936;found 965.4943.
N S
N
S S
9.4,7-bis(9,9-dihexyl-9H-fluoren-2-yl)benzo[c][1,2,5]thiadiazole 化合物 MG. 由本實驗室博士後研究 Dr. Dixit 所提供。 在氮氣下,將B7 (330 mg, 0.70 mmol),B3 (90.0 mg, 0.30 mmol), K2CO3 (aq) (2.0 M, 2.0 mL),aliquat 336 (~9.0 mg)及甲苯 10 mL加入雙 頸瓶中,進行除氧充氮氣。60 oC下,攪拌至完全溶解。開大氮氣, 快速加入Pd(PPh3)4 (~4.09 mg)並將反應升溫至 100 oC~110 oC,攪拌 3~4 小時。冷卻至室溫,用EtOAc萃取, CHCl2/n-hexane進行管柱層 析,烘乾,得黃色粉狀固體52.0 mg,產率 65.0 %。1H NMR (300 MHz, CDCl3): δ 0.69 (m, 20H), 1.05-1.09 (m, 24H), 1.88-2.03 (m, 8H), 7.22- 7.32 (m, 6H), 7.70 (dd, J = 5.9, 1.7 Hz, 2H), 7.79 (d, J = 8.4 Hz, 2H), 7.81 (s, 2H), 7.88 (d, J = 0.9 Hz, 2H), 7.94(dd, J = 8.0, 1.7 Hz, 2H). (附 圖 15) 13C NMR (75 MHz, CDCl 3): δ 14.0, 22.6, 23.8, 29.7, 31.5, 40.3, 55.2, 119.7, 119.9, 122.9, 123.9, 126.8, 127.2, 127.9, 128.1, 133.6, 136.1, 140.6, 141.3, 151.1, 151.3, 154.3. (附圖 16)
HRMS(m/z):[M++H] calad. For C56H68N2S 800.5103;found 800.5109.
N S
N