有機發光二極體高分子發光材料的合成與性質研究
180
0
0
全文
(2) 有機發光二極體高分子發光材料的合成與性質研究 Synthesis and Characterization of Light-Emitting Polymers for Organic Light-Emitting Diodes 研 究 生:曾雅嫺. Student: Ya Hsien Tseng. 指導教授:許 慶 豐 博士. Advisor:Dr.Ching-Fong Shu. 國立交通大學 應用化學所 碩士論文. A Thesis Submitted to Department of Applied Chemistry College of Science National Chiao-Tung University in Partial Fulfillment of the Requirements for the Degree of Master in Applied Chemistry June 2005 Hsinchu, Taiwan, Republic of China. 中華民國 九十四 年 六 月.
(3) 謝誌. 兩年的研究生活轉眼間就要落幕了,突然有種驚嘆時間飛逝的錯愕,這 其中的滋味有充實、快樂、壓力以及成長,不過,一切都要感謝在我週遭每 一個人對我的幫助。首先,得感謝我的指導教授許慶豐老師,因為有了老師 嚴謹的指導及教誨,我才能不斷的成長與超越,此外,也因為投入老師門下 後,才能享受頂級的大新竹美食,所以,老師,有您真好。同時,也感謝口 試委員季昀教授、徐秀福教授和陳錦地教授百忙之中費心審查這份論文,並 在口試當天給我很多的指導與建議,我永遠也忘不了那天大家討論專業領域 時所散發出來的熱情與光芒,謝謝。 在實驗方面,首先感謝實驗室一哥芳奕學長的幫助,總是在我有疑惑 時,熱心的給予指導。而冷汗,不論在生活或實驗上總是帶給我很大的啟發 跟幫助,也因為有你,我們現在幾乎已經快全省走透透了。另外,也感謝我 的兩位同學大餅及冠宇,在這期間給我的幫助、扶持,而很有 man power 的 川哥和阿嚕咪學弟妹,也因為有了你們,實驗室才能繼續的延續跟傳承。 最後,要感謝我的家人,由於有你們的無比支持,才有現在的我。當然 還有很多很多在這段日子幫助過我的人,雖然不能一一詳述,但是我仍然由 衷感謝你們,真的,謝謝!!. i.
(4) 有機發光二極體高分子發光材料的合成與性質研究 研究生:曾雅嫺. 指導教授:許慶豐 博士. 國立交通大學應用化學研究所. 摘. 要. 本論文分為三部分,分別針對 PPV 衍生物、聚茀高分子衍生物與金屬 橘紅色磷光高分子材料之合成、性質與元件做探討。 在 A 部分中,我們以 PPV 為主鏈,在 2,5-位置導入 Müllen type 的 Dendron 取代基,此龐大的側鏈基除了提升高分子的熱穩定性,亦減少主鏈因堆疊而 降低發光效率、影響光色純度。因此,在薄膜熱處理後,仍維持發光效率及 光色的純度,其電激發光亦不隨電壓增加而改變。 在 B 部 分 中 , 我 們 在 fluorene 碳 九 位 置 導 入 xanthene , 成 spiroxanthenefluorene 中心剛硬的 sp3 正交結構,此高分子除了修飾聚茀因平 面結構所造成的物理缺陷、提升 Tg,亦避免因熱、光激發或電場操作下產 生化學缺陷而影響材料的色純度及穩定性。此外,也將具有電洞傳輸能力的 carbazole 側鏈基導入 Spiroxanthenefluorene 中,對於驅動電壓的降低及效率 的提升有明顯的助益。 在 C 部分中,以高效率藍光高分子材料 PF-TPA-OXD 當作骨架,將橘. ii.
(5) 紅光的磷光材料 Ir(piq)2cdp 以化學性摻混方式,導入聚茀側鏈,並藉由 FÖrster 能量轉移及電荷捕捉機制將能量傳輸到磷光側鏈上,得到高效率的橘紅色磷 光。此外,我們也製成物理混摻之元件,來模擬化學混摻的比例,發現以化 學混摻之磷光高分子由於分散性佳,可避免相分離,因此較物理混摻時有更 佳的元件表現。. iii.
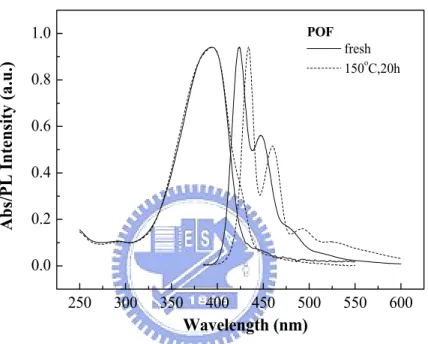
(6) Synthesis and Characterization of Light-Emitting Polymers for Organic Light-Emitting Diodes Student:Ya-Hsien Tseng. Advisor:Dr. Ching-Fong Shu. Department of Applied Chemistry National Chiao-Tung University Abstract This thesis is divided into three parts regarding the synthesis and characterization. of. poly(phenylenevinylene). derivatives,. poly[spiro(fluorene-9,9’-xanthene) and polyfluorene derivatives grafted with cyclometalated iridium complexes. We also report the fabrication and performance of electroluminescence devices based on these materials. In part A, we have synthesized a dendronized polymer, PPV-PP, that consists of a conjugated poly(p-phenylenevinylene) backbone upon which are appended pentaphenylene dendritic wedges. As a result of incorporating the dendritic pentaphenylene pendent groups, which reduce the strength of interchain interactions and suppress the formation of excimers, PPV-PP is soluble in common organic solvents and exhibits high photoluminescence efficiency in the solid state.. Even after thermal annealing at 150 ℃ for 20 hours, a long. wavelength emission band by the excimer formation was not observed. In addition, devices based on this polymer exhibit stable EL spectra which are independent of applied voltages. In part B, we have synthesis a polyfluorene containing spiroxanthene iv.
(7) pendant groups, where the planes of the xanthene and fluorene lie perpendicular to each other and are connected by a tetrahedrally bonded carbon atom. The incorporation of xanthene into the polyfluorene not only prevents the formation of aggregates and excimers in the solid state, but also inhibits the formation of a chemical defect induced by thermo-, photo-, or electro-oxidative degradations. We also introduced the two carbazole side groups into the spiro-polymer to lower the turn on voltage and enhance the quantum efficiency EL devices. In part C, two orange-light-emitting copolymers (TOFR series) grafted with Ir(piq)2cdp have synthesized. These two copolymers emit organic light through FÖrster energy transfer and charge trapping mechanisms. Devices based on TOFR series show better stability and external quantum efficiency in comparison with devices based on PF-TPA-OXD blended with iridium complex.. v.
(8) 目 錄 謝誌............................................................................................................................................. i 中文摘要.................................................................................................................................... ii 英文摘要................................................................................................................................... iv 圖目錄 ................................................................................................................................... ix 表目錄 ................................................................................................................................... xi 附圖目錄.................................................................................................................................. xii A 部分 第一章. 序論.............................................................................................................................1. 1-1. 前言 ............................................................................................................................1 1-2. PPV 及其衍生物的研究.............................................................................................2 1-3. 研究動機 ....................................................................................................................6 第二章. 實驗.............................................................................................................................8. 2-1. 藥品 ............................................................................................................................8 2-2. 使用儀器 ....................................................................................................................9 2-3. 合成部份 ..................................................................................................................11 第三章. 結果與討論...............................................................................................................20. 3-1. 合成部份 ..................................................................................................................20 3-2. 物理性質 ..................................................................................................................25 3-2-1. GPC 量測 .......................................................................................................25 3-2-2. DSC 和 TGA 測量.........................................................................................25 3-2-3. 溶解度測試...................................................................................................28 3-3. 光學性質 ..................................................................................................................28 3-3-1. PPV-PP 高分子-UV-vis 吸收光譜與 PL 放射光譜......................................28 3-3-2. PPV-PP 高分子-主鏈與側鏈之能量轉移.....................................................29 3-3-3. 量子效率的量測...........................................................................................31 3-4.. IR 吸收光譜 ...........................................................................................................32. 3-5. 電化學性質--氧化還原電位測量............................................................................34 3-6. 薄膜熱穩定性測量 ..................................................................................................37 3-7. 元件電激發光性質 ..................................................................................................38 第四章 結論...........................................................................................................................40 參考文獻...................................................................................................................................42. vi.
(9) B 部分 第一章. 序論...........................................................................................................................44. 1-1. 前言 ..........................................................................................................................44 1-2. 聚茀(Polyfluorene)的歷史回顧...............................................................................45 1-3. 研究動機 ..................................................................................................................46 第二章. 實驗...........................................................................................................................47. 2-1. 藥品 ..........................................................................................................................47 2-2. 使用儀器 ..................................................................................................................48 2-3. 合成部份 ..................................................................................................................49 第三章. 結果與討論...............................................................................................................58. 3-1. 合成部份 ..................................................................................................................58 3-2. 物理性質 ..................................................................................................................63 3-2-1. GPC 量測 .......................................................................................................63 3-2-2. DSC 和 TGA 測量.........................................................................................63 3-2-3. 溶解度測試...................................................................................................67 3-3. 光學性質 ..................................................................................................................67 3-3-1. PF-S、PF-SC 聚茀高分子-UV-vis 吸收光譜與 PL 放射光譜....................68 3-3-2. PF-SC 聚茀高分子-主鏈與側鏈之能量轉移...............................................68 3-3-3. 量子效率的量測...........................................................................................71 3-4. 電化學性質--氧化還原電位測量............................................................................72 3-5. 薄膜熱穩定性測量 ..................................................................................................76 3-6. 元件電激發光性質 ..................................................................................................79 3-6-1. PF-S 元件電激發性質...................................................................................79 3-6-2. PF-SC 元件電激發性質 ................................................................................79 第四章 結論...........................................................................................................................83 參考文獻...................................................................................................................................84 C 部分 第一章. 序論...........................................................................................................................86. 1-1. 前言 ..........................................................................................................................86 1-2. 磷光材料之原理 ......................................................................................................86 vii.
(10) 1-3. 高分子磷光材料的簡介 ..........................................................................................87 1-4. 研究動機 ..................................................................................................................91 第二章. 實驗...........................................................................................................................93. 2-1. 藥品 ..........................................................................................................................93 2-2. 使用儀器 ..................................................................................................................93 2-3. 合成部份 ..................................................................................................................95 第三章. 結果與討論.............................................................................................................103. 3-1. 合成部份 ................................................................................................................103 3-2. 物理性質 ................................................................................................................107 3-2-1. GPC 量測 .....................................................................................................107 3-2-2. DSC 和 TGA 測量.......................................................................................107 3-2-3. 溶解度測試.................................................................................................110 3-3. 光學性質 ................................................................................................................111 3-3-1.TOFR 系列-UV-vis 吸收光譜與 PL 放射光譜 ...........................................111 3-3-2. TOFR 系列-主鏈與側鏈之能量轉移 .........................................................112 3-3-3. 量子效率的量測.........................................................................................117 3-4. ICP-MS 感應偶合電漿質譜分析量測...................................................................118 3-4-1.ICP-MS 量測原理.........................................................................................118 3-4-2.ICP-MS 量測結果.........................................................................................119 3-5. 元件電激發光性質 ................................................................................................120 3-5-1. TOFR 系列元件電激發性質.......................................................................120 3-5-2. 以 Ir(piq)2pic 物理性摻混在高分子之元件電激發性質 ..........................125 第四章 結論.........................................................................................................................128 參考文獻.................................................................................................................................130. viii.
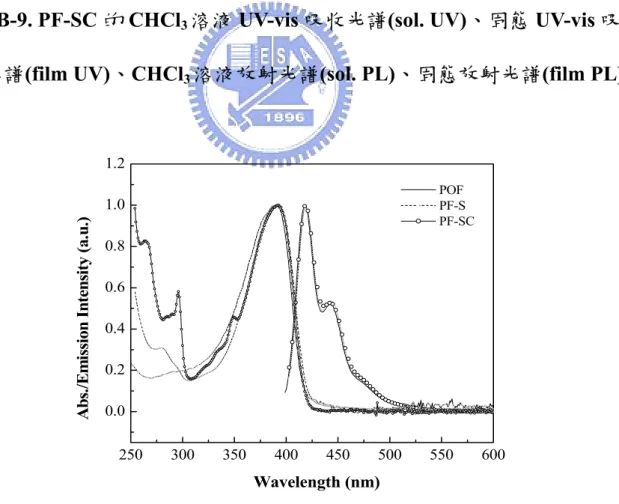
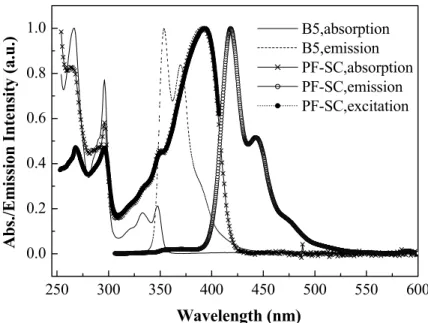
(11) 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖. 圖 目 錄 A-1 劍橋大學於 1990 年發表的元結構圖 ........................................................................1 A-2 具長碳鏈醚基或脂肪族長碳鏈取代的可溶性 PPV 衍生物 .....................................4 A-3 Hsieh 發表含苯環取代基之可溶性 PPV 衍生物......................................................5 A-4 Peng 發表含雙苯環取代基之可溶性 PPV 衍生物 ...................................................5 A-5 Mikroyannidis 發表含巨大苯環基團之可溶性 PPV 衍生物 ...................................6 A-6 Mullen type 的 Dendron 側鏈取代基.........................................................................7 A-7 PPV-PP 之 TGA 圖 ...................................................................................................27 A-8 P2 之結構圖 ..............................................................................................................27 A-9 PPV-PP 的 THF 溶液 UV-vis 吸收光譜(sol. UV)、固態 UV-vis 吸收光譜(film UV)、 THF 溶液放射光譜(sol. PL)、固態放射光譜(film PL) ..........................................30 A-10 PPV-PP(in THF, excited by 280 nm),A6(in THF, excited by 280 nm)之吸收/放射光 譜................................................................................................................................30 A-11 PPV-PP 的 IR 光譜圖................................................................................................33 A-12 PPV-PP 薄膜態之 CV 圖 ..........................................................................................36 A-13 PPV-PP 薄膜態熱穩定性比較圖..............................................................................37 A-14 PPV-PP 之 PL(in thin film)及在不同電壓下之 EL 疊圖 ........................................39 A-15 PPV-PP 之 Luminance efficiency 及亮度對電流密度圖.........................................39 B-1 ITO /PEDOT /PPV /Ca 之 PLED 元件 .....................................................................44 B-2 Polyfluorene 結構......................................................................................................45 B-3 xanthene 結構 ............................................................................................................46 B-4 PF-S 之 DSC 圖.........................................................................................................65 B-5 PF-SC 之 DSC 圖 ......................................................................................................65 B-6 PF-S 之 TGA 圖 ........................................................................................................66 B-7 PF-SC 之 TGA 圖......................................................................................................66 B-8 PF-S 的 CHCl3 溶液 UV-vis 吸收光譜(sol. UV)、固態 UV-vis 吸收光譜(film UV)、 CHCl3 溶液放射光譜(sol. PL)、固態放射光譜(film PL) .......................................69 B-9 PF-SC 的 CHCl3 溶液 UV-vis 吸收光譜(sol. UV)、固態 UV-vis 吸收光譜(film UV)、 CHCl3 溶液放射光譜(sol. PL)、固態放射光譜(film PL) .......................................70 B-10 POF、PF-S、PF-SC(in CHCl3)之吸收/放射光譜 ...................................................70 B-11 B5(in CHCl3)&PF-SC(in CHCl3, excited by 296 nm; λem = 418 nm)之溶液態吸收/ 放射/激發光譜 ..........................................................................................................71 B-12 PF-S 薄膜態之 CV 圖 ...............................................................................................75 B-13 PF-SC 薄膜態之 CV 圖 ............................................................................................75 B-14 POF 薄膜態之 CV 圖................................................................................................76 B-15 POF 薄膜態熱穩定性比較 .......................................................................................77 B-16 PF-S 薄膜態熱穩定性比較.......................................................................................78 B-17 PF-SC 薄膜態熱穩定性比較....................................................................................78 ix.
(12) 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖. B-18 PF-S 之 PL(in thin film)及 EL 光譜 .........................................................................81 B-19 Device I I-V-L 圖,內插:不同電壓下之 EL 疊圖 ................................................81 B-20 PF-SC 之 PL(in thin film)及 EL 光譜.......................................................................82 B-21 Device II I-V-L 圖,內插:不同電壓下之 EL 疊圖...............................................82 C-1 磷光材料發光原理....................................................................................................87 C-2 Tokito 發表之高分子磷光材料結構 ........................................................................90 C-3 陳壽安教授發表之高分子磷光材料結構................................................................90 C-4 曹鏞教授發表之高分子磷光材料結構....................................................................91 C-5 TOFR1、TOFR2 之高分子磷光材料結構 ..............................................................92 C-6 銥金屬雙體錯合物(dimer)及單體(monomer)的結構............................................105 C-7 TOFR1 之 DSC 圖...................................................................................................108 C-8 TOFR2 之 DSC 圖...................................................................................................109 C-9 TOFR1 之 TGA 圖 ..................................................................................................109 C-10 TOFR2 之 TGA 圖 ..................................................................................................110 C-11 PF-TPA-OXD 之結構圖..........................................................................................110 C-12 TOFR1 的 THF 溶液 UV-vis 吸收光譜(sol. UV)、固態 UV-vis 吸收光譜(film UV)、 THF 溶液放射光譜(sol. PL)、固態放射光譜(film PL) ........................................114 C-13 TOFR2 的 THF 溶液 UV-vis 吸收光譜(sol. UV)、固態 UV-vis 吸收光譜(film UV)、 THF 溶液放射光譜(sol. PL)、固態放射光譜(film PL) ........................................115 C-14 Ir(piq)2cdp 的 THF 溶液 UV-vis 吸收光譜(sol. UV)及 PF-TPA-OXD 的 THF 溶液放 射光譜(sol. PL)........................................................................................................115 C-15 TOFR1(in thin film, excited by 300 nm; λem = 608 nm)之吸收/放射/激發光譜 116 C-16 TOFR2(in thin film, excited by 300 nm; λem = 614 nm)之吸收/放射/激發光譜 116 C-17 TOFR1 之 PL(in thin film)及 EL 光譜 ...................................................................122 C-18 TOFR2 之 PL(in thin film)及 EL 光譜 ...................................................................123 C-19 Device I I-V-L 圖,內插:不同電壓下之 EL 疊圖 ..............................................123 C-20 Device II I-V-L 圖,內插:不同電壓下之 EL 疊圖.............................................124 C-21 Device I、Device II 之電流密度-外部量子效率 圖.............................................124 C-22 Device III 、Device IV 之 EL,內插:Device II 之 EL......................................126 C-23 Device III 、Device IV 之之電流密度-外部量子效率 圖 ..................................127. x.
(13) 表 表 表 表 表 表 表 表 表 表 表 表 表 表 表 表 表. A-1 A-2 A-3 A-4 A-5 A-6 B-1 B-2 B-3 B-4 B-5 B-6 B-7 C-1 C-2 C-3 C-4. 表 C-5 表 C-6 表 C-7. 表 目 錄 PPV-PP 之分子量.....................................................................................................25 PPV-PP 之 DSC 與 TGA 的數據分析表.................................................................26 PPV-PP 之溶解度測試.............................................................................................28 PPV-PP、A6 之 UV-vis 吸收與 PL 放射量測表....................................................29 PPV-PP 之相對量子效率.........................................................................................31 PPV-PP 的氧化還原電位及 HOMO、LUMO........................................................35 PF-S 與 PF-SC 之分子量.........................................................................................63 PF-S 與 PF-SC 之數據分析表.................................................................................64 PF-S 與 PF-SC 之溶解度測試.................................................................................67 PF-S、PF-SC、B5 與 POF 之 UV-vis 吸收與 PL 放射量測表.............................69 PF-S、PF-SC 之相對量子效率...............................................................................72 PF-S、PF-SC 與 POF 薄膜態的氧化還原電位及 HOMO、LUMO....................74 Device I、Device II 之元件特性.............................................................................80 TOFR 系列之分子量 .............................................................................................107 TOFR 系列之 DSC 與 TGA 的數據分析表 .........................................................108 TOFR 系列之溶解度測試 .....................................................................................111 TOFR 系列、PF-TPA-OXD 與 Ir(piq)2pic、Ir(piq)2cdp 之 UV-vis 吸收與 PL 放射 量測表......................................................................................................................114 TOFR 系列之相對量子效率 .................................................................................117 TOFR 系列之 Ir 含量百分比.................................................................................119 Device I、Device II 之元件特性...........................................................................122. xi.
(14) 附 圖 目 錄 附圖 1. 1,4-Dimethyl-2,5-bis-trimethylsilanylethynyl-benzene 化合物 A1 的 1H NMR 圖131 附圖 2. 1,4-Dimethyl-2,5-bis-trimethylsilanylethynyl-benzene 化合物 A1 的 13C NMR 圖 附圖 附圖 附圖 附圖 附圖 附圖 附圖 附圖 附圖 附圖 附圖 附圖 附圖 附圖 附圖 附圖 附圖 附圖 附圖 附圖 附圖 附圖. ..................................................................................................................................132 3. 1,4-Diethynyl-2,5-dimethylbenzene 化合物 A2 的 1H NMR 圖 ............................133 4. 1,4-Diethynyl-2,5-dimethylbenzene 化合物 A2 的 13C NMR 圖...........................134 5. 1,2-di(4-hydroxyphenyl)-1,2-ethanedione 化合物 A3 的 1H NMR 圖...................135 6. 1,2-di(4-hydroxyphenyl)-1,2-ethanedione 化合物 A3 的 13C NMR 圖..................136 7. 1,2-di{4-[(2-ethylhexyl)oxy]phenyl}-1,2-ethanedione 化合物 A4 的 1H NMR 圖137 8. 1,2-di{4-[(2-ethylhexyl)oxy]phenyl}-1,2-ethanedione 化合物 A4 的 13C NMR 圖138 9. 3,4-di{4-[(2-ethylhexyl)oxy]phenyl}-2,5-diphenylcyclopenta-2,4-dienone 化合物 A5 的 1H NMR 圖 .........................................................................................................139 10. 3,4-di{4-[(2-ethylhexyl)oxy]phenyl}-2,5-diphenylcyclopenta-2,4-dienone 化合物 A5 的 13C NMR 圖 ................................................................................................140 11. 1,4-Dimethyl-2,5-di-{3,4-di[4-[(2-ethylhexyl)oxy]phenyl]-2,5-diphenylphenylbenzene 化合物 A6 的 1H NMR 圖 ......................................................................141 12. 1,4-Dimethyl-2,5-di-{3,4-di[4-[(2-ethylhexyl)oxy]phenyl]-2,5-diphenylphenylbenzene 化合物 A6 的 13C NMR 圖 .....................................................................142 13. 1,4-Dibromomethyl-{3,4-di[4-[(2-ethylhexyl)oxy]phenyl]-2,5-diphenylphenyl}benzene 化合物 A7 的 1H NMR 圖 ......................................................................143 14. 1,4-Dibromomethyl-{3,4-di[4-[(2-ethylhexyl)oxy]phenyl]-2,5-diphenylphenyl}benzene 化合物 A7 的 13C NMR 圖 .....................................................................144 15. PPV-PP 的 1H NMR 圖 ..........................................................................................145 16. 2,7-Dibromo-9H-spiro[fluorene-9,9’-(2’,7’-dihydroxyxanthene)] 化合物 B1 的 1H NMR 圖 .................................................................................................................146 17. 2,7-Dibromo-9H-spiro[fluorene-9,9’-(2’,7’-dihydroxyxanthene)] 化合物 B1 的 13C NMR 圖 .................................................................................................................147 18. 2,7-Dibromo-9H-spiro[fluorene-9,9’-(2’,7’-dioctyloxyxanthene)] 化合物 B2 的 1H NMR 圖 .................................................................................................................148 19. 2,7-Dibromo-9H-spiro[fluorene-9,9’-(2’,7’-dioctyloxyxanthene)] 化合物 B2 的 13C NMR 圖 .................................................................................................................149 20. 2,7-Bis(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-9H-spiro[fluorene-9,9’-(2’,7’dioctyloxyxanthene)]化合物 B4 的 1H NMR 圖 ..................................................150 21. 2,7-Bis(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-9H-spiro[fluorene-9,9’-(2’,7’dioctyloxyxanthene)]化合物 B4 的 13C NMR 圖 .................................................151 22. 9-(6-Bromo-hexyl) -9H-carbazole 化合物 B5 的 1H NMR 圖 ..............................152 23. 9-(6-Bromo-hexyl) -9H-carbazole 化合物 B5 的 13C NMR 圖.............................153 24. 2,7-Dibromo-9H-spiro[fluorene-9,9’-(2’,7’-bis{[9’-6’-(hexyloxy)-9’H-carbazole]} xii.
(15) 附圖 附圖 附圖 附圖 附圖 附圖 附圖 附圖 附圖 附圖 附圖. xanthene)]化合物 B6 的 1H NMR 圖 ...................................................................154 25. 2,7-Dibromo-9H-spiro[fluorene-9,9’-(2’,7’-bis{[9’-6’-(hexyloxy)-9’H-carbazole]} xanthene)]化合物 B6 的 1H NMR 圖 ...................................................................155 26. PF-S 的 1H NMR 圖 ...............................................................................................156 27. PF-S 的 13C NMR 圖 ..............................................................................................157 28. PF-SC 的 1H NMR 圖.............................................................................................158 29. PF-SC 的 13C NMR 圖 ...........................................................................................159 30. 1-(Phenyl)isoquinoline 化合物 C1 的 1H NMR 圖................................................160 31. 1-(Phenyl)isoquinoline 化合物 C1 的 13C NMR 圖...............................................161 32. Ir(piq)2pic 化合物 C3 的 1H NMR 圖....................................................................162 33. Ir(piq)2pic 化合物 C3 的 13C NMR 圖 ..................................................................163 34. Ir(piq)2cdp 化合物 C4 的 1H NMR 圖 ...................................................................164 35. Ir(piq)2cdp 化合物 C4 的 13C NMR 圖..................................................................165. xiii.
(16) A 部份 PPV 衍生物發光材料在 PLED 上之應用. 第一章. 序論. 1-1. 前言 自 從 1990 年 , 由 Cavendish 實 驗 室 1 首 先 成 功 以 聚 對 苯 乙 烯 (poly(p-phenylene vinylene);PPV)為發光材料,並將其製作成以ITO /PPV /Ca (如圖 A-1.)的黃綠光單層式高分子發光二極體結構,發光位置約位於 550 nm,其量子效率為0.05 %。自此,高分子發光二極體的研究開始成為 目前導電高分子的重要應用之一。. 圖 A-1. 劍橋大學於1990 年發表的元件結構圖 由於PPV不溶於有機溶劑,所以在製作上須先利用Wessling method2合 成前驅聚合物(precursor polymer),成膜後經熱處理得到PPV共軛高分子, 其製程繁雜,諸多物性也因溶解度而不易量測。. 1.
(17) 為了解決溶解度及製作上的困難,便在PPV主鏈上導入含有直鏈烷鏈 或直鏈烷氧鏈的側鏈,此類高分子同時被發現具有熱相形液晶(thermotropic liquid crystals)的特性3,4,但因會產生集聚現象(aggregation),使得光學性質 及製成元件後的量子效率較低5。 為了改善此問題,1991 年,美國加州大學的Heeger 等人6發表了PPV 衍生物MEH-PPV(poly[(2-ethylhexyloxy-5-methoxy-1,4-phenylene)vinylene]) (Scheme 1.),將直鏈改為分支側鏈,為λmax = 610 nm的紅橘光高分子,較PPV 紅位移,量子效率可提高到1%。然而也因柔軟碳鏈的導入,使得玻璃轉移 溫度(Tg)較PPV低。此後,以化學方法改質高分子結構來控制光色、改善溶 解度、提昇熱穩定性便成為各研究群致力的目標。. OH. O. O. a,b. c. Cl Cl. MeO. n. MeO. MeO. MEH-PPV. 5. a. 3-(Bromomethyl)heptane, KOH, EtOH, reflux 16 h b. HCHO, concd. HCl, dioxane, 20 oC, 18 h, reflux 4 h c. KOtBu, THF, 20 oC, 24 h. Scheme 1. MEH-PPV的合成途徑. 1-2. PPV 及其衍生物的研究 由於PPV不溶於一般的有機溶劑,不容易處理,無法如同一般製作 PLED元件時,使用旋轉塗佈來製備具良好穿透率的薄膜,須採用Wessling 2.
(18) 發展的sulfonium前趨物合成途徑2(Scheme 2.),為先將可溶性的前趨物塗佈 在元件表面上,再經過加熱及真空狀態下,形成PPV高分子薄膜。由前趨 物轉換為PPV的熱處理過程中,若有氧氣的存在,則會產生化學缺陷,使 甲氧基氧化為羰基,羰基會淬熄(quench)發光而使PPV的發光效率變差7。 為了增加溶解度,使PPV能適用旋轉塗佈來製備具良好穿透率的. a ClCH2. S. ClCH2. +. Cl. Cl S. +. b,c,d. Cl S. +. OMe. e. n. f. S. +. Cl. g n. n. PPV a. Tetrahydrothiophene, MeOH, 65 oC; b. NaOH, MeOH/H2O or Bu4NOH, MeOH, 0 oC; c. Neutralization (HCl); d. dialysis (water); e. MeOH, 50 oC; f. 220 oC, HCl(g)/Ar. 22 h; g. 180-300 oC, vaccum, 12 h. Scheme 2. PPV的合成途徑 薄膜,Ohnishi8 及 Braun、Heeger6 兩團隊隨後發表以 PPV 為主幹的可溶性 、. 高分子,這些可溶性高分子不再需要以前趨物在高溫下製備元件,可避免 3.
(19) 化學缺陷發生。在側鏈中引進長碳鏈醚基或脂肪族長碳鏈(如圖 A-2.),可 避免共軛主鏈間堆疊,提升發光效率,然長碳鏈的導入也導致玻璃轉移溫 度(Tg)降低。. 圖 A-2. 具長碳鏈醚基或脂肪族長碳鏈取代的可溶性 PPV 衍生物 另外,以芳香族取代基為側鏈導入 PPV,不僅可降低共軛長度,具可 溶性,同樣也避免主鏈間堆疊而降低發光效率。Hsieh9 於 1998 年發表以 2,3-diphenyl 為側鏈的 PPV 衍生物(見圖 A-3.),此高分子在製成薄膜後的光 化學量子效率高達 65%。Peng10 於隔年發表以 2-biphenyl 為側鏈的 PPV 衍 生物(見圖 A-4.),其高分子在溶液態及薄膜態的量子效率皆高於 50%,最 4.
(20) 高達到 77%。這顯示芳香族的立體效應(steric effect)使得主鏈 PPV 及側鏈 兩者之間相互交錯,這樣的三維結構不僅避免 PPV 主鏈間的堆疊,也降低 因堆疊而產生的 self-quenching process。另外,Mikroyannidis11,12(見圖 A-5.) 及 Bao4 則都導入巨大的苯環基團側鏈於主鏈上,龐大的側鏈基團能有效阻 斷主鏈和側鏈間的共軛,產生藍位移,使得螢光光譜的最大波長皆坐落在 藍光區,為發藍光的 PPV 衍生物。. 圖 A-3. Hsieh 發表含苯環取代基之可溶性 PPV 衍生物. 圖 A-4. Peng 發表含雙苯環取代基之可溶性 PPV 衍生物. 5.
(21) 圖 A-5. Mikroyannidis 發表含巨大苯環基團之可溶性 PPV 衍生物 可溶性的PPV 型高分子,其聚合方法除了Wessling聚合外,還可利用 Gilch 等人13改良的去鹵化氫縮合聚合反應或Wittig反應14等,他們的反應溫 度均不高,而且可使得分子量提高,又因為溶解度好所以加工也更容易。. 1-3. 研究動機 對一全彩顯色器而言,必須具備紅、藍、綠三原色,現今,綠光及紅光 高分子發光材料在元件表現上已達到高亮度、高效率及超過一萬小時的壽 命;相較之下,目前藍光高分子材料並無法成功的運用在商業上15,這是因 為藍光需要較大的能階差(band gap)、較高的驅動電壓,因此藍光材料必須 具有更佳的熱穩定性、高效率與抗氧化能力。PPV本身具有良好的機械性 質,但其溶解度及光色仍需要修飾,因此本研究以PPV為主鏈,在2,5-位置 導入Müllen type的dendron取代基16. ,17. (見圖 A-6.),除了在熱性質方面提高. 玻璃轉移溫度和增加熱穩定性外,亦可減少高分子因堆疊而降低發光效 率,及影響光色的純度。此外,dendron的導入亦希望可以造成立體障礙,. 6.
(22) 讓分子鏈產生扭曲角度,阻斷高分子主鏈和側鏈間的共軛,產生藍位移, 以達到調節光色的效果。而為了使元件的製程簡化,我們希望合成出可溶 於一般溶劑的高分子,以便使用旋轉塗佈的方法來製作元件,因此我們在 Müllen type的dendron取代基上導入烷氧鏈增加溶解度,期使能合成出一高 效率的可溶性PPV藍光發光材料。. 圖 A-6. Müllen type 的 Dendron 側鏈取代基. 7.
(23) 第二章 實驗. 2-1.藥品. p-Anisil. 購自 TCI. Hydrobromic acid (HBr). 購自 聯工. N, N-Dimethyl formamide. 購自 Aldrich. 2-Ethylhexyl bromide. 購自 ACROS. Potassium carbonate. 購自 SHOWA. Magnesium sulfate. 購自 SHOWA. 1,3-Diphenylacetone. 購自 Lancaster. 1,4-Dioxane. 購自 Tedia. Tetrabutyl ammonium hydroxide (Bu4NOH). 購自 Lancaster. N-Bromosuccinimide. 購自 Aldrich. 2,2’-Azobis(isobutyronitrile) AIBN. 購自 TCI. Carbon tetrachloride. 購自 SHOWA. Potassium tert-butoxide (t-BuOK). 購自 Lancaster. Benzyl bromide. 購自 Lancaster. 上述所列藥品,不純化直接使用。溶劑中 THF 經過鈉、鉀合金及 8.
(24) benzophenone 的 除 水 蒸 餾 , tetrabutylammonium hexafluorophosphate (TBAPF6) 經過乙酸乙酯再結晶,並在 60 ℃ 的真空下烘乾。其餘皆購自於 Merck、Aldrich、Mallickrodt、Fisher Scientific、聯工等公司。. 2-2. 使用儀器 2-2-1. 核磁共振光譜儀 (NMR) 使用 Varian Unity Yinavo 500 MHz 核磁共振光譜儀、Bruker-DRX-300 MHz 核磁共振光譜儀。 2-2-2. 質譜儀(Mass Spectroscopy) 與元素分析儀 (Elemental Analysis) 使用交大貴儀的 T-200 GC-Mass,以 EI 或 FAB 為游離方法。以成功大 學貴儀中心的 JEOL JMS-HX 110 Mass Spectrometer (高效能質譜儀)。元素 分析儀 ( EA )為交大的 HERAEUS CHN-OS RAPID。 2-2-3. 薄層色層分析法 (TLC) 使用 Merck 製造的 5554 DC Silica Gel 60 F254 型鋁製薄片。 2-2-4. 管柱層析法 使用 Merck 製造的 7734 Kieselgel 60 (60~230 mesh ASTM) 型矽膠。 2-2-5. 微差掃描卡計(Differential Scanning Calorimetry,. DSC). 使用 SEIKO EXSTAR 6000DSC 及 Computer/Thermal Analyzer。 2-2-6. 熱重量分析儀(Thermogravimetric Analysis,. TGA). 使用 Perkin Elmer TGA Pyris 1 儀器。 2-2-7. 凝膠滲透層析儀(GPC) 使用 Waters 410 Differential Refractometer,Waters 600 Controller,和 Waters 610 Fluid Unit,管柱為 Waters Styragel Column,以 Polystyrene 當標 準品,THF 為沖提液。. 9.
(25) 2-2-8. 吸收光譜儀 (UV/vis) 使用 HP-8453 光譜分析儀。 2-2-9. 螢光儀 (Fluorescence Spectroscopy) 使用 Hitachi F-4500 的螢光儀。 2-2-10. 循環伏特安培計 (CV) 使用美國 Bioanalytical Systems Inc. 電化學分析儀,型號 100B,序號 930。 2-2-11. 紅外光光譜儀 FT-IR 使用 Perkin Elmer spectrum one FTIR spectrometer。 2-2-12. 曝光機 型號:US101,燈管功率為 1000 瓦,七貿股份有限公司。 2-2-13. 高真空蒸鍍機 型號:Auto 168(Junsun Tech co., LTD)。 2-2-14. 元件測量 使用 Keithley 2400 Soouce meter 與 Newport 公司所生產的 818ST silicon photodiode 搭配 2835C Optical meter,而其量測之基本原理為 silicon photodiode 會偵測元件所放出的所有光能並將光能轉換成電能,因此可由 電能的大小得知元件所放出的光能或是亮度。. 10.
(26) 2-3. 合成部分 1,4-Dimethyl-2,5-bis-trimethylsilanylethynyl-benzene 化合物 A1. 將 2,5-dibromo-p-xylene (2.00 g, 7.57 mmol),trimethylsilylethyne (3.21 ml, 22.73 mmol),piperidine (35 mL),三乙胺 (95 mL),甲苯 (25 mL)加入 三頸瓶,加熱至 50 ℃,快速攪拌 10 分鐘,並以氮氣置換反應瓶內氣體。 降溫後加入 PPh3 (70 mg),CuI (135 mg),Pd(PPh3)4 (350 mg),110℃下攪拌 24 小時。降溫後,將反應液滴入 200 mL 水中,以乙酸乙酯( 50mL × 3 ) 萃取,取有機層,加入硫酸鎂(s)除水,濃縮,以正己烷進行管柱層析分離 得 0.90 g,產率 39.8 %。. Si. Si. 1. H NMR (300 MHz, CDCl3): δ0.26 (s, 18 H), 2.35 (s, 6 H), 7.27 (s, 2 H). (附. 圖 1) 13. C NMR (75 MHz, CDCl3): δ0.1, 19.9, 99.6, 103.9, 123.0, 132.9, 137.6. (附. 圖 2) 1,4-Diethynyl-2,5-dimethylbenzene 化合物 A2. 將化合物 A1 (0.90 g, 3.02 mmol ),碳酸鉀 (1.00 g, 7.25 mmol),加入甲 醇 ( 9 mL ),THF (15 mL),室溫下攪拌 24 小時。反應溶液滴入 50mL 水中, 以乙酸乙酯( 25mL × 3 )萃取,取有機層,加入硫酸鎂(s)除水,濃縮,烘乾 11.
(27) 得 0.42 g,產率 90.1 %。. 1. H NMR (300 MHz, CDCl3): δ2.36 (s, 6 H), 3.30 (s, 2H), 7.28 (s, 2 H). (附圖. 3) 13. C NMR (75 MHz, CDCl3): δ19.9, 82.17, 82.23, 122.4, 133.3, 137.9. (附圖. 4) 1,2-di(4-hydroxyphenyl)-1,2-ethanedione,化合物 A3 將 p-anisil (10.00 g, 36.99 mmol),溶於 HBr 水溶液(40 mL),HBr/醋酸 溶液(33 %, 60 mL),加熱至 110 ℃,反應 8 小時。反應結束,冷卻至室溫, 將反應液倒入蒸餾水(300 mL)中,過濾收集沉澱,得白色固體產物 6.53 g, 產率 72.9 %。 O. O. HO. OH. 1. H NMR (300 MHz, DMSO-d6): δ 6.92 (dt, 4H, J = 9.3, 2.3 Hz), 7.73 (dt, 4H, J. = 9.3, 2.3 Hz), 10.82 (s, 2H). (附圖 5) 13. C NMR (75 MHz, DMSO-d6): δ 116.1, 124.2, 132.3, 163.9, 193.7. (附圖 6). 1,2-di{4-[(2-ethylhexyl)oxy]phenyl}-1,2-ethanedione,化合物 A4. 12.
(28) 在氮氣下,將化合物 1,2-di(4-hydroxyphenyl)-1,4-ethanedione (6.50 g, 26.83 mmol),DMF (65 mL),2-ethylhexyl bromide (13.68 g, 69.77 mmol), 碳酸鉀(s) (9.62 g , 69.76 mmol),分別置入雙頸瓶中,升溫至 120 ℃,反應 48 小時。反應結束,冷卻至室溫,將反應液倒入蒸餾水(250 mL)中,再用 乙酸乙酯萃取,取有機層,加入硫酸鎂(s)除水,以乙酸乙酯:正己烷為 1: 100 進行管柱層析分離,得黃色液體產物 9.42 g,產率 75.3 %。 O. O. O. O. 1. H NMR (300 MHz, CDCl3): δ 0.85-0.92 (m, 12H), 1.23-1.50 (m, 16H),. 1.67-1.76 (m, 2H), 3.89 (d, 4H, J = 5.7 Hz), 6.93 (dt, 4H, J = 9.5, 2.4 Hz), 7.90 (dt, 4H, J = 9.5, 2.4 Hz). (附圖 7) 13. C NMR (75 MHz, CDCl3): δ 11.0, 14.0, 23.0, 23.7, 29.0, 30.4, 39.2, 70.8,. 114.7, 126.0, 132.3, 164.7, 193.6. (附圖 8) HREI–MS (m/z): [M+H] + calcd for C30H43O4, 467.3161; found 467.3161. Anal. Calcd (%) for (C30H42O4):. C, 77.21; H, 9.07. Found: C, 77.04; H,. 9.11.. 13.
(29) 3,4-di{4-[(2-ethylhexyl)oxy]phenyl}-2,5-diphenylcyclopenta-2,4-dienone,化 合物 A5 將化合物 A4 (8.00 g, 17.14 mmol), 1,3-diphenylacetone (3.96 g, 18.85 mmol)和 1,4-dioxane (36 mL)加入雙頸瓶中,攪拌至完全溶解。升溫至 80 ℃,並加入 Bu4NOH (35 mL),在此溫度下持續攪拌一小時。反應結束,冷 卻至室溫 ,將反應液倒入蒸餾水(300 mL)中,再用乙酸乙酯萃取,取有機 層,加入硫酸鎂(s)除水,以乙酸乙酯:正己烷為 1:100 進行管柱層析分離, 得黑色固體產物 6.08 g,產率 55.3 %。. O. O. O. 1. H NMR (300 MHz, CDCl3): δ 0.90-0.97 (m, 12H), 1.30-1.49 (m, 16H),. 1.58-1.72 (m, 2H), 3.82 (d, 4H, J = 5.8 Hz), 6.72 (dt, 4H, J = 9.2, 2.3 Hz), 6.86 (dt, 4H, J = 9.2, 2.3 Hz), 7.22-7.27 (m, 10H). (附圖 9) 13. C NMR (75 MHz, CDCl3): δ 11.2, 14.2, 23.1, 23.9, 29.2, 30.6, 39.4, 70.6,. 114.0, 124.7, 125.0, 127.2, 128.1, 130.2, 131.2, 131.4, 154.2, 159.7, 200.4. (附 14.
(30) 圖 10) HREI–MS (m/z): [M+H] + calcd for C45H53O3, 641.3995; found 641.3994. Anal. Calcd (%) for (C45H52O3):. C, 84.33; H, 8.18. Found: C, 84.38; H,. 8.42. 1,4-Dimethyl-2,5-di-{3,4-di[4-[(2-ethylhexyl)oxy]phenyl]-2,5-diphenylpheny l}-benzene,化合物 A6 將化合物 A5 (10.30 g, 16.07 mmol),o-xylene (80 mL)和化合物 A2 (0.86 g, 5.60 mmol)置入雙頸瓶中,進行除氧通氮氣三次。升溫至 160 ℃,持續 攪拌 12 小時。反應結束,冷卻至室溫 ,將反應液抽乾,以丙酮再結晶, 得白色固體產物 6.20 g,產率 80.3 %。. O. O. O. O. 15.
(31) 1. H NMR (300 MHz, CDCl3): δ 0.85 (t, 12H, J = 7.1 Hz), 0.86 (t, 12H, J = 7.4. Hz), 1.26-1.45 (m, 32H), 1.55-1.63 (m, 4H), 1.90 (s, 6H), 3.63 (d, 4H, J = 6.3 Hz), 3.66 (d, 4H, J = 6.1 Hz), 6.38-6.48 (m, 8H), 6.57-6.89 (m, 20H), 7.11-7.20 (m, 10H), 7.33 (s, 2H). (附圖 11) 13. C NMR (75 MHz, CDCl3): δ 11.1, 14.1, 19.8, 23.0, 23.8, 29.1, 30.5, 39.27,. 39.3, 70.5, 113.0, 113.2, 125.1, 125.2, 125.9, 126.6, 127.5, 130.0, 130.8, 131.2, 131.4, 131.7, 131.9, 132.1, 132.37, 132.44, 132.6, 132.8, 138.7, 139.7, 139.9, 140.1, 140.2, 140.3, 140.4, 141.1, 142.2, 142.3, 156.8, 157.1. (附圖 12) HRFAB–MS (m/z): [M+H] + calcd for C100H115O4, 1379.8796; found 1379.8793. Anal. Calcd (%) for (C100H114O4):. C, 87.04; H, 8.33. Found: C, 87.13; H,. 8.50. 1,4-Dibromomethyl-{3,4-di[4-[(2-ethylhexyl)oxy]phenyl]-2,5-diphenylphen yl}-benzene,化合物 A7 在氮氣下將化合物 A6 (0.70g, 0.51 mmol),N-bromosuccinimide (0.18 g, 1.02 mmol),AIBN (10 mg),CCl4(20 mL)分別置入雙頸瓶中,加熱迴流 8 小時。反應結束,將反應液冷卻至室溫,過濾,取濾液,濃縮,再以乙酸 乙酯:正己烷為 1:200 進行管柱層析分離,得白色固體產物 0.20 g,產率 25.5 %。. 16.
(32) O. O. Br Br. O. O. 1. H NMR (300 MHz, CDCl3): δ 0.84 (t, 12H, J = 7.6 Hz), 0.85 (t, 12H, J = 7.6. Hz), 1.23-1.44 (m, 32H), 1.55-1.63 (m, 4H), 3.62 (d, 4H, J = 5.7 Hz), 3.66 (d, 4H, J = 6.0 Hz), 4.11 (d, 1H, J = 10.4 Hz ), 4.17 (d, 1H, J = 10.2 Hz ), 4.21 (d, 1H, J = 10.3 Hz ), 4.27 (d, 1H, J = 10.1 Hz ), 6.39 (d, 4H, J = 8.5 Hz ), 6.47 (d, 4H, J = 8.4 Hz ), 6.59-6.89 (m, 18H), 7.08-7.17 (m, 10H), 7.30 (s, 2H), 7.39 (s, 2H). (附圖 13) 13. C NMR (75 MHz, CDCl3): δ 11.8, 14.8, 23.7, 24.5, 29.8, 31.1, 31.2, 32.5,. 32.6, 39.96, 40.0, 71.2, 113.7, 114.0, 126.2, 126.3, 126.8, 127.6, 128.2, 130.7, 131.2, 131.4, 132.0, 132.3, 132.7, 133.05, 133.1, 133.2, 134.1, 134.3, 135.3, 138.1, 138.3, 140.1, 140.4, 140.5, 140.87, 140.93, 141.1, 142.1, 142.3, 142.5, 142.7, 157.6, 157.9. (附圖 14) 17.
(33) HRFAB–MS (m/z): [M+H]. +. calcd forC100H11379Br2O4, 1535.7005; found. 1535.7008. Anal. Calcd (%) for (C100H112Br2O4):. C, 78.19; H, 7.35. Found: C, 78.40; H,. 7.51. 高分子 PPV-PP 在氮氣下加入化合物 A7 (100mg, 65 μmol),dry THF (1 ml)加入雙頸 瓶中,攪拌至完全溶解。升溫至 55 ℃,此時將溶在 THF (1.6 ml) 的 t-BuOK(86 mg, 78 μmol)慢慢滴入雙頸瓶內,持續攪拌 12 小時後,加入 benzyl bromide (11 mg,60 μmol),反應兩小時。將反應降至室溫,用甲 醇進行再沉澱,隨後立即快速加入等量的蒸餾水,攪拌 20 分鐘,過濾,烘 乾。將粗產物溶於 CHCl3 (~3 mL)後,以甲醇(100 mL)進行再沉澱,過濾, 再用連續萃取裝置(丙酮)清洗 48 小時,烘乾,得產物 70 mg,產率 77.0 %。. 18.
(34) O. O. * *. O. O. 1. H NMR (300 MHz, CDCl3): δ 0.86 (br, 24H), 1.26 (br, 32H), 1.57 (br, 4H),. 3.61 (br, 8H), 6.60-7.45 (m, 42H). (附圖 15) Anal. Calcd (%) for (C100H110O4): C, 87.28; H, 8.06. Found: C, 84.89; H, 7.85.. 19.
(35) 第三章 結果與討論 3-1. 合成部份 3-1-1. 化合物 A2 的合成 反 應 流 程 如 Scheme 3 所 示 , 在 Pd(PPh3)4 催 化 下 , 將 2,5-dibromo-p-xylene 和 trimethylsilylethyne 進 行 Hagihara-Sonogashira coupling 反應,使兩端的溴置換為具有-SiMe3 保護基的炔基,接著去保護 基得到化合物 A2。 3-1-2. 化合物 A5 的合成 反應流程如 Scheme 4 所示,將 p-anisil 和 HBr 反應,反應後形成酚 (phenol)A3,接著在 K2CO3 鹼性條件下,進行 Williamson ether synthesis, 將酚取代為烷基以增加溶解度,而形成化合物 A4。最後將化合物 A4 和 1,3-diphenyl-propan-2-one 在 1,4-dioxane 下先升溫至 80 ℃,於此溫度下加 入 Bu4NOH 反應得到化合物 A5。 3-1-3. 化合物 A7 的合成 反應流程如 Scheme 5 所示,將化合物 A2 和 A5 溶於 o-xylene 中,進 行 Diels-Alder 反應得到 A6。此種 cyclopentadienone 和 alkyne 的 Diels-Alder 反應是合成苯環很有效的方法。接著將 A6 和 N-bromosuccinimide (NBS)反 應得到 A7,所用的溶劑為 CCl4,其密度較 NBS 小且對 NBS 溶解度不好, 在反應之初可以看到 NBS 沉澱在瓶底,反應後之 NBS 變成 succinimide,. 20.
(36) 密度較 CCl4 小,因此當觀察到 NBS 消失只剩下 succinimide 懸浮時,即表 示反應已完成,之後將 succinimide 過濾,再進一步以管柱分離純化。 3-1-4. 聚合反應 反應流程如 Scheme 6 所示,在強鹼 t-BuOK 的催化下進行 Gilch 反應, 此聚合方法需要過量的強鹼來確保縮合結構的生成,所以,鹼在此處不僅 扮演縮合試劑也是去鹵化氫試劑。值得注意的是單體 A7 具有高度的立體 障礙,所以必須在加熱的條件下反應。先將 A7 於氮氣下溶在 THF 中,於 50 ℃時將過量的鹼快速打入反應液中,反應液於幾分鐘後轉為帶強烈綠色 螢光的混濁液體,並且在反應結束前加入 benzyl bromide 來消除高分子鏈 末端未反應的官能基。經過再沉澱純化後,再放入 Soxhlet extraction 裝置 中,並以熱丙酮進行連續萃取,以除去寡聚物(oligomer)與其他雜質。. 21.
(37) Scheme 3 SiMe3 Br. Br. Me3Si. SiMe3. Pd(PPh3)4, CuI piperidine / triethylamine A1. K2CO3. THF / MeOH. A2. Scheme 4 O. O. O. O. HBr(aq). HBr / AcOH. MeO. OMe. HO. OH A3. Br. O. K2CO3, DMF. O. O. O. Bu4NOH, 1,4-dioxane. O O. O. O. A4. A5 22.
(38) Scheme 5. O. A2 +. O. A5 o-xylene. O. O A6. CCl4. NBS. O. O. Br Br. O. O. A7. 23.
(39) Scheme 6. O. A7. O. *. t-BuOK, THF. *. O. O. PPV-PP. 24.
(40) 3-2. 物理性質 3-2-1.DSC 量測 高分子的物理性質和分子量大小有關,故藉由 GPC 的測量可以得到一 個相對於標準樣品(PS)的相對分子量。在此,以 polystyrene 為標準品,THF 為沖提液,流速為 1 mL/min,分子量訊號為標準品內插而得到相對值。 由 GPC 所量測的數目平均分子量為 150052,展現高分子量,顯示 PPV-PP 雖含有剛性、巨大的 dendron 側鏈基,但於外側另導入四條柔軟的 烷氧碳鏈,使得聚分子的結構雖然剛硬,仍維持良好的溶解度,其聚合過 程不因溶解度不佳而受限 18。 GPC 測量結果如表 A-1.所示: 表 A-1. PPV-PP 之分子量 Mn ×104 (Daltons). Mw ×104 (Daltons). Mw/Mn. 15.0. 35.8. 2.38. PPV-PP Mn:數目平均分子量 Mw:重量平均分子量. Mw / Mn (polydispersity):用以指示分子量分佈的寬度。. 3-2-2. DSC 和 TGA 測量 DSC 和 TGA 主要是用來觀察化合物的熱性質,DSC 可測量到玻璃轉 移溫度;TGA 可測量出重量隨溫度的變化和裂解溫度,由其重量損失百分 率可觀察高分子的熱穩定性。. 25.
(41) 我們可由 TGA 和 DSC 得知此聚合物之熱性質,結果如表 A-2.和圖 A-7.所示。從 TGA 測量得知,PPV-PP 在 5 %與 10 %的重量損失溫度分別 在 327 ℃及 346 ℃,具不錯的熱穩定性,由此結果推測四條柔軟烷氧鏈的 導入對 PPV-PP 的熱穩定性並未造成明顯的破壞。在 DSC 量測中,升溫至 300 ℃仍未觀察到 Tg,推測可能是側鏈兩個巨大、剛硬的 dendron 基團, 導致主鏈太剛硬,造成分子因吸熱而擾動的行為不明顯,因此由 DSC 無法 明顯判讀出 Tg 的溫度範圍。此外,根據 Mikroyannidis, J. A.在 2003 年 Chem. Mater.所發表的論文 12,文中 P2(結構見圖 A-8.)的 Tg 為 176 ℃,因其結構 和 PPV-PP 相似,推測 PPV-PP 的玻璃轉移溫度(Tg),應較只接一邊 dendron 側鏈的 P2 高。 表 A-2. PPV-PP 之 DSC 與 TGA 的數據分析表. PPV-PP. Tg. Td(-5%). Td(-10%). ----. 327 ℃. 346 ℃. Tg:玻璃轉移溫度。 Td(%):樣品重量損失百分率的溫度。. 26.
(42) o. 100. -5% = 327 C o -10% = 346 C. PPV-PP. weight loss (%). 80. 60. 40. 20. 0. 0. 100. 200. 300. 400. 500. 600. 700. o. Temperature C. 圖 A-7. PPV-PP 之 TGA 圖. 圖 A-8. P2 之結構圖. 27. 800.
(43) 3-2-3. 溶解度測試 PPV-PP 對於有機溶劑的溶解度如表 A-3 所示,在常溫下,對於大部分 的有機溶劑均具有不錯的溶解度,如 THF、CHCl3、toluene、chlorobenzene, 應是 PPV-PP 於側鏈中導入巨大、剛硬的 dendron,使得主鏈之間減少作用 力,及末端四條柔軟的氧烷鏈,使得 PPV-PP 可全溶於一般常見的溶劑中。 表 A-3. PPV-PP 之溶解度測試 Polymer. CHCl3. Toluene. THF. Chlorobenzene. PPV-PP. ++. ++. ++. ++. ++:溶解, +:加熱溶解, -+:加熱部分溶解, --:不溶。. 3-3. 光學性質 Solution:利用逐步稀釋法配置樣品濃度在個別溶液中,使其 UV-vis 的最 大吸收值介於 0.05 左右。溶液的螢光放射光譜使用最大吸收峰的 波長為激發光源。 Film:配置樣品濃度在個別溶液中的濃度為 1.0 % (w/w),以 2.5×2.5×0.15 cm3 的石英玻璃當作基質,以轉速 2700 rpm / 25 sec,旋轉塗佈於石 英玻璃。 3-3-1. PPV-PP 高分子 – UV-vis 吸收光譜與 PL 放射光譜 圖 A-9.為此化合物的吸收及放射光譜,其光譜的性質總結於表 A-4。 由圖 A-9.可知,在 THF 溶液狀態下,在大約 280 nm 左右的 UV-vis 吸收峰 主要來自側鏈 dendron 基團的吸收,而共軛 PPV 主鏈上π-π*電子躍遷所 28.
(44) 造成的吸收則坐落在 444 nm。在溶液狀態下,光激發光在 503 nm、532 nm 均具有明顯的放射峰,分別代表的是 0-0,0-1,分子鏈間單重態的轉移 19。 薄膜態的吸收光譜與溶液態的吸收光譜幾乎相同,而放射光譜在 510 nm、 545 nm 均具有明顯的放射峰,從溶液態及薄膜態之最大放射波長只相差 7 nm,顯示我們所導入的巨大側鏈基團可以有效的阻止主鏈間的堆疊,避免 紅位移現象。另外,將 PPV-PP、MEH-PPV20 在薄膜態的放射光譜相比較, 發現 PPV-PP 的放光較 MEH-PPV 藍位移 85 nm,顯示 dendron 側鏈基能阻 斷主鏈和側鏈間的共軛,產生藍位移現象。 3-3-2. PPV-PP 高分子-主鏈與側鏈之能量轉移 如圖 A-10.所示,化合物 A6 在 366 nm 有明顯的放射峰,與 PPV-PP 的 吸收光譜有相當程度的重疊性,表示激發側鏈也許能夠將能量轉移到 PPV 共軛主鏈上。另外,從實驗發現,PPV-PP 的激發光譜與吸收光譜有很好的 重疊性,證明主鏈與側鏈間的確存在有效的能量轉移機制 21。當我們以側 鏈 280 nm 去激發 PPV-PP 溶液時,得到和圖 A-9.相同的螢光光譜,並未發 現側鏈的放射,顯示側鏈的能量能有效的傳遞到主鏈,並藉由主鏈放光, 使能量能完整的被使用到。 表 A-4. PPV-PP、A6 之 UV-vis 吸收與 PL 放射量測表. PPV-PP A6. UV-vis λmax (nm) THF film 280, 444 285, 450 260 29. PL λmax (nm) THF film 503, 532(sh) 510, 545 (sh) 366.
(45) Abs./Emission Intensity (a.u.). 1.0. solution film. 0.5. 0.0. 250 300 350 400 450 500 550 600 650 700. Wavelength (nm). 圖 A-9. PPV-PP 的 THF 溶液 UV-vis 吸收光譜(sol. UV)、固態 UV-vis 吸收 光譜(film. UV)、THF 溶液放射光譜(sol. PL)、固態放射光譜(film PL). 1.4. PPV-PP,absorption PPV-PP,emission PPV-PP,exitation A6,absorption A6,emission. Abs./Emission Intensity (a.u.). 1.2 1.0 0.8 0.6 0.4 0.2 0.0 -0.2 250. 300. 350. 400. 450. 500. 550. 600. 650. 700. Wavelength (nm). 圖 A-10. PPV-PP(in THF, excited by 280 nm),A6(in THF, excited by 280 nm) 之吸收/放射光譜. 30.
(46) 3-3-3.量子效率的量測 為了得知新化合物的量子效率,我們測量待測物及參考標準品的螢光 光譜,並將測得的光譜積分面積值及激發波長的吸收度代入下列公式. 22. ,. 即可求知未知物的絕對量子效率。 Φs /Φr =(Ar / As) ×(Is / Ir)×(Qr / Qs) r : Reference s : sample Φ:. 量子效率. A : 激發波長的吸收度 I : 螢光放光的積分面積 Q : 螢光激發光源所提供光的量子 根據上述公式,量子效率換算結果如下表: 表 A-5. PPV-PP 之相對量子效率 polymer. Φ (solution)a. Φ (solution)b. Φ (thin film)c. PPV-PP. 0.51. 0.48. 0.46. a:溶液態之量子效率,以 quinine sulfate(Φf = 0.53 in 0.1 N sulfuric acid)為 標準所得之相對值 22 b:溶液態之量子效率,以 coumarin 6 (Φf = 0.78 in ethanol) 為標準所得之 相對值 23. 31.
(47) c:固態之量子效率,標準品為 9,10-diphenyl anthracene (DPA) / PMMA =1/300,以 CHCl3 為溶劑配成重量百分比為 15 %之溶液,以 2.5×2.5×0.15 cm3 的石英玻璃當作基值、轉速 3000 rpm / 30 sec 旋轉塗佈於石英玻璃。 取兩者在 365 nm 為激發波長的 PL 積分值/365 nm 之吸收度所得值比 較,定 DPA 薄膜之量子效率為 0.8324 所得相對值 由上表可知 PPV-PP 在 THF 溶液中所量測的量子效率(ΦF)約為 0.5,較 Mikroyannidis et al.12 的 P2 (ΦF = 0.10)高,在薄膜態所量測的量 子效率(ΦF)為 0.46,也較 PPV (ΦF = 0.15)及 MEH-PPV (ΦF = 0.27)高 25, 由於側鏈 dendron 的立體效應,使得主鏈 PPV 及兩邊側鏈兩者之間相互 交錯,這樣的三維結構不僅避免 PPV 主鏈間的堆疊效應,進而降低因 堆疊而產生的 self-quenching process9,10,使得量子效率較文獻上優異。. 3-4. IR 吸收光譜 將高分子: KBr = 1:10,經混合研磨後,加壓製成薄片,以紅外光從 500 ~ 4000 cm-1,掃描十次,經傅利葉轉換所得之光譜。 藉由 IR 吸收光譜的測量,可得到分子中官能基的吸收波長,由光譜的 分析,即可得知分子中是否含有特定之官能基。為了判斷含共軛雙鍵的 PPV 衍生物 PPV-PP 為順式(cis-CH=CH ~873 cm-1)或反式(trans-CH=CH ~970 cm-1)構形 26,所以我們對 PPV-PP 進行了 IR 之吸收光譜測量,所測得圖譜 如圖 A-11.所示。. 32.
(48) 由 圖 A-11. 中可發現,在~970 cm-1 有一微弱但明顯的吸收出現,在 ~873 cm-1 則無訊號出現,這證明經由 Gilch reaction 所聚合而成的高分子 PPV-PP 具有反式結構,而由文獻我們也可觀察到經 Witting reaction 所合成 之 PPV 共聚物通常含有順式及反式兩種構形 26,27。因此,由上述結果可知 Gilch reaction 較適於發展規則的分子構形。 另外,對於化合物 A6 也做了 IR 吸收光譜的測試,如 圖 A-11.所示, 由此圖可發現,在~970 cm-1 並無發現任何訊號,此結果說明反式結構的生 成是經由 Gilch reaction。. 140 120. A6. %Transmittance. 100 80 60 40. PPV-PP. 20. 970cm. -1. 0 -20 500. 1000. 1500. 2000. 2500. 3000. 3500. -1. Wavenumbers (cm ). 圖 A-11. PPV-PP 的 IR 光譜圖. 33. 4000. 4500.
(49) 3-5. 電化學性質--氧化還原電位測量 為了探討用於元件的有機材料,我們先建立能階圖,來得知我們選用 的材料特性,預測電子與電洞結合的位置及能量轉移的效果。 在此,我們使用循環伏安法(cyclic voltammetry,簡稱 CV),當外加電 位達到待測物的反應電位時,氧化或還原反應隨即發生,此時電流將隨著 電位的變化而改變。而電流的大小是由物質到電極表面的擴散速率所控 制,所以當擴散速率遠小於外加電位的變化速率,當電極表面的反應已趨 完全時,此時電流即衰減下來。 配 置 0.1 M tetrabutylammonium hexafluorophosphate(TBAPF6) 的 Acetonitrile 為電解液 10 mL,通入氮氣 10 分鐘,將待測樣品配置為 1 mg/100 mg 的 CHCl3 溶液,以 2000 rpm/10 sec 旋轉塗佈於工作電極上, Ag/Ag+為參考電極,並以 ferrocene/ferrocenium (Fc/Fc+)為內參考電位,以 碳電極為工作電極,白金絲為導電電極,掃瞄速率為 50 mV/s,掃描範圍 介於-300 ~ 1800 mV 與-300~ -3000 mV。 red ), 由所測得的 CV 圖來讀取氧化起始電位(E oxonset )、還原起始電位(E onset. 並利用下列公式來計算 HOMO/LUMO 值 21a,其中氧化起始電位(E oxonset )採 用伏特為單位(vs. Fc/Fc+),常數 4.8 為 ferrocene 相對於真空能階。 HOMO = -4.8 - E oxonset red LUMO = -4.8 - E onset. 34.
(50) 以 PPV-PP 為例,經過 ferrocene 標準品校正後所得的 E oxonset 為 0.78 V, red E onset 為-2.38 V,以上述公式求得 HOMO=-5.58 eV,LUMO=-2.42 eV,表. A-6.。 由圖 A-12.中及數據分析可見,PPV-PP 在陰極部分是不可逆的 (irreversible),其還原起始電位為-2.38 V,而氧化電位亦是不可逆,氧化起 始電位為 0.78 V。由比較得知,含 dendron 側鏈基團的 PPV-PP,其 HOMO 及 LUMO 值皆高於 MEH-PPV4。 表 A-6. PPV-PP 薄膜態的氧化還原電位及 HOMO、LUMO UV(on set) λonset, (nm). PPV-PP a. 524. a red b E opt , E onset , (V) a E ox LUMO, (eV) c g onset , (V) HOMO, (eV). (eV). 2.36. -2.38. 0.78. - 5.58. Potential values are versus Fc/Fc+.. b. HOMO determined from onset oxidation.. c. E elg , (eV)d. LUMO determined from onset reduction.. d. Electrochemical bandgap E elg = LUMO - HOMO.. 35. -2.42. 3.16.
(51) 0.4. PPV-PP. 0.3. Current (mA). 0.2. -2.77. -2.38. 0.1 0.0 -0.1. 0.78. -0.2 -0.3 -0.4. 1.17 -0.5 -3. -2. -1. 0. 1 +. Potential (V vs. Fc/Fc ). 圖 A-12. PPV-PP 薄膜態之 CV 圖. 36. 2.
(52) 3-6. 薄膜熱穩定性測量 為了解 PPV-PP 薄膜之熱穩定性,以 3-3.節方式製備薄膜,測量加熱前 後放射光譜,然後於氮氣下在 150 ℃加熱 20 小時,並比較加熱前後放射光 譜之變化。 一般來說,複合激子會提供一非輻射緩解的途徑,使得製成元件時, 降低放射效率,是由一個受激發的發光體和鄰近未被激發的發光體互相作 用形成激發複合體而得,可經由薄膜態加熱一段時間後,於較長波的放射 光譜中觀察到此一現象 18。 由圖 A-13.中可發現,PPV-PP 在 150 ℃加熱 20 小時後放射波形均無 明顯改變,證明剛硬側鏈的導入不僅有助於熱穩定性的提升,也阻止了堆 疊效應與激發復合體的放光產生。. Abs./PL Intensity (a.u.). 1.2. PPV-PP fresh o 150 C,20hr. 1.0 0.8 0.6 0.4 0.2 0.0 300. 400 500 Wavelength (nm). 600. 圖 A-13. PPV-PP 薄膜態熱穩定性比較圖 37.
(53) 3-7. 元件電激發光性質 我們將 PPV-PP 製成元件,並探討其結果性質,結構如下所示: ITO/PEDOT (35 nm)/PPV-PP (160 nm)/Mg:Ag(10:1, 100 nm)/Ag (100 nm) 其中,PEDOT 為電洞注入層(hole injection layer),幫助電洞從陽極注入。。 Ag 為保護層(protection layer)。 元件 EL 光譜如圖 A-14.所示,最大放射波長為 513 nm,549 nm 處有 一披肩(shoulder),其 CIE 座標(0.30, 0.62),為一發綠光的元件材料,波形 和 PL 幾乎重疊,此結果顯示 EL 和 PL 的輻射緩解過程(radiative decay process)皆來自單態光激子(singlet exciton)的放射. 28. 。另外,在外加電壓操. 作下,元件會產生熱,當超過材料的 Tg 點則會產生不可逆的破壞,使得元 件壽命和光色受到影響;而 PPV-PP 元件隨著電壓增加,其 EL 並沒有太大 改變,這和我們在熱薄膜性質的觀察相同,顯示所導入的側鏈取代基不僅 有助於熱穩定性的提升,並且阻隔主鏈間的堆疊,維持元件光色的穩定。 此外,元件的 Luminance efficiency、亮度對電流密度的特徵圖譜見圖 A-15.,當電流密度為 89.3 mA /cm2 時,其亮度達到 1562 cd/m2,元件效率 為 1.75 cd /A。在電流密度 42.6 mA/cm2 時,達到最大元件效率為 1.93 cd/A, 此時亮度為 824 cd/m2 雖然,由實驗結果我們並未得到一高效率發藍光的 PPV 材料元件,但 其良好的元件穩定性對於應用於光電上,實有助益,未來,我們將嘗試調 整側鏈結構來達到最佳的元件結果。 38.
(54) 圖 A-14. PPV-PP 之 PL(in thin film)及在不同電壓下之 EL 疊圖. 圖 A-15. PPV-PP 之 Luminance efficiency 及亮度對電流密度圖. 39.
(55) 第四章 結論. 我 們 成 功 藉 由 Gilch reaction 合 成 出 一 高 分 子 量 的 PPV 衍 生 物 PPV-PP,其結構除了主鏈聚對苯乙烯,並於側鏈導入巨大的 dendron 取代 基及四條烷氧鏈。巨大側鏈基的導入不僅可降低主鏈間的作用力,並有助 於熱穩定性的提升,而烷氧鏈的加入則可增加溶解度。 在光物理方面,其溶液態和薄膜態的放射光譜兩者最大放射波長只相 差 7 nm,顯示我們所導入的側鏈基團可有效的阻止高分子鏈間的堆疊,而 其薄膜態的放射光譜又較 MEH-PPV 藍位移 85 nm,顯示 dendron 側鏈基能 有效阻斷主鏈和側鏈間的共軛。另外,由激發側鏈的實驗中,發現側鏈的 能量能有效的傳遞到主鏈,並藉由主鏈放光,使能量能完整的被使用到。 從 IR 吸收光譜中,發現在~970 cm-1 有一微弱但明顯的吸收出現,為 反式結構,在~873 cm-1(順式結構)則無訊號出現,證明經由 Gilch reaction 所聚合而成的高分子 PPV-PP 不僅具有反式結構,也較適於發展規則的分 子構形。 元件方面,將 PPV-PP 製程 ITO/PEDOT (35 nm)/PPV-PP (160nm)/ Mg:Ag (10:1, 100 nm)/Ag (100 nm)元件,在電流密度 42.6 mA/cm2 時,達到 最大元件效率為 1.93 cd/A,此時亮度為 824 cd/m2。將之在不同電壓的 EL 中量測,發現即使電壓增至 25 V,EL 幾乎沒有改變,表現出不錯的元件. 40.
(56) 穩定性。由結果得知 PPV-PP 雖然無法將光色調整至預期的藍光區,未來, 我們可嘗試導入其他大型的側鏈基團來解決光色問題,並仍維持其 PPV 材 料優異的光學性質和熱穩定性。. 41.
(57) 參考文獻 1. Buroughes , J. H.; Bradley , D. D. C.; Brown, A. R.; Marks, R. N.;Mackay, K.; Friend, R. H.; Bums, P. L.; Holmes, A. B. Nature 1990, 347, 539. 2. Wessling, R.A. J. Polym. Sci. polym. Symp. 1985, 72, 55. 3. Cimrova, V.; Remmers, M.; Neber, D.; Wegner, G. Adv. Mater. 1996, 8, 146. 4. Bao, Z.; Chen, Y.; Cai, R.; Yu, L. Macromolecules 1993, 26, 5281-5286. 5. Yan, M.; Rothberg, L. J.; Papadimitrakopoulos, F.; Galvin, M. E.; Miller, T. M. Phys. Rev. Lett. 1994, 73, 744. 6. Braun, D.; Heeger, A. J. J. Appl. Phys. 1991, 58, 1982. 7. Papadimitrakopoulos, F.; Konstadinidis, K.; Miller, T. M.; Opila, R.; Chandross, E. A.; Galvin, M. E. Chem. Mater. 1994, 6, 1563. 8. Doi, S.; Kuwabara, M.; Noguchi, T.; Ohnishi, T. Synth. Met. 1993, 57, 4174. 9. Hsieh, B. R.; Yu, Y.; Forsythe, E. W.; Schaaf, G. M.; Feld, W. A. J. Am. Chem. Soc. 1998, 120, 231. 10. Peng, Z.; Zhang, J.; Xu, B. Macromolecules 1999, 32, 5162. 11. Mikroyannidis, J. A. Macromolecules. 2002, 35, 9289. 12. Mikroyannidis, J. A. Chem. Mater. 2003, 15, 1865. 13. Gilch, H. G.; Wheelwright, W. L. J. Polym. Sci.:A-1 1996, 4, 1337. 14. Yang, Z.; Sokolik, I.; Karasz, F. E. Macromolecules. 1993, 26, 1188. 15. Jiang, X. Z.; Liu, S.; Ma, H.; Jen, A. K. Y. Appl. Phys. Lett. 2000, 76, 1813. 16. Berresheim, A. J.; Muller, M.; Müllen, K. Chem. Rev. 1999, 99, 1747. 17. Morgenroth, F.; Reuter, E.; Müllen, K. Angew. Chem. Int. Ed. Engl. 1997, 36, 631. 18. Shin, D.-C.; Kim, Y.-H.; You, H.; Kwon, S.-K. Macromolecules 2003, 36, 3222. 19. Neher, D. Macromol. Rapid Commun. 2001, 22, 1365. 20. Sohn, B.-H.; Kim, K.; Choi, D. S.; Kim, Y. K.; Jeoung, S. C.; Jin, J.-I. 42.
(58) Macromolecules 2002, 35, 2876 21. (a) Lee, Y. Z.; Chen, X.; Chen, S. A.; Wei, P. K.; Fann, W. S. J. Am. Chem. Soc. 2001, 123, 2296.(b) Sato, T.; Jiang, D. L.; Aida, T. J. Am. Chem. Soc. 1999, 121, 10658.(c) Bao, Z.; Peng, Z.; Galvin, M. E.; Chandross, E. A. Chem. Mater.1998, 10, 1201.(d) Peng, Z. J. Synth. Met. 1999, 105, 73. 22. Demas, J. N.; Grosby, G. A. J. Phys. Chem. 1971, 75, 991. 23. Fery-Forgues, S.; Lavabre, D. J. Chem. Educ. 1999, 76, 1260. 24. Kim,Y.; Zhu, Z.; Swager, T. M. J. Am. Chem. Soc. 2004, 126, 452. 25. (a) Hwang, D.-H.; Kim, S. T.; Li, X.-C.; Chuah, B. S.; DeMello, J. C.; Friend, R. H.; Moratti, S. C.; Holmes, A. B. Polym. Prepr. 1997, 38 (1), 319. (b) Samuel, I. D. W.; Rumbles, G.; Collison, C. J.; Crystall, B.; Moratti, S. C.; Holmes, A. B. Synth. Met. 1996, 76, 15-18. (c) Gettinger, C. L.; Heeger, A. J.; Drake, J. M.; Pine, D. J. J. Chem. Phys. 1994, 101, 1673-1678. (d) deMello, J. C.; Wittmann, H. F.; Friend, R. H. Adv. Mater. 1997, 9, 230. 26. Fan, Q.-L.; Lu, S.; Lai, Y.-H.; Hou, Y.-X.; Huang, W. Macromolecules 2003, 36, 6976. 27. Peng, Y.; Liao, L.; Ding, L.; Karasz, F. E. Macromolecules 2001, 34, 6756. 28. Baigent, D. R.; Friend, R. H.; Lee, J. K.; Schrock, R. R. Synth. Met. 1995, 71, 2171.. 43.
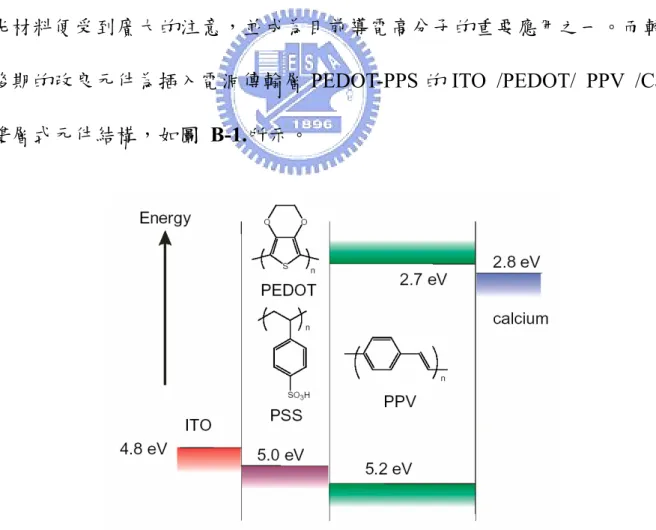
(59) B 部份 PLED 之高熱穩定性藍光發光材料. 第一章. 序論. 1-2. 前言 自 從 1990 年 , 由 Cavendish 實 驗 室. 1. 首先成功以聚對苯乙烯. (poly(p-phenylene vinylene);PPV)為發光材料,並將其製作成以 ITO /PPV /Ca 的黃綠光單層式高分子發光二極體結構。自此,以共軛高分子為主的發 光材料便受到廣大的注意,並成為目前導電高分子的重要應用之一。而較 後期的改良元件為插入電洞傳輸層 PEDOT-PPS 的 ITO /PEDOT/ PPV /Ca 雙層式元件結構,如圖 B-1.所示。. 圖 B-1. ITO /PEDOT/ PPV / Ca 之 PLED 元件. 44.
(60) 對一全彩顯色器而言,必須具備紅、藍、綠三原色,現今,綠光及紅 光高分子發光材料在元件表現上已達到高亮度、高效率及超過一萬小時的 壽命;相較之下,目前藍光高分子材料並無法成功的運用在商業上 2,這是 因為藍光需要具備較大的能階差(band gap),較高的驅動電壓,因此,藍光 材料必須具有更佳的熱穩定性、高效率與抗氧化能力。目前已有許多藍光 高 分 子 材 料 已 廣 泛 被 研 究 過 , 例 如 : poly(p-phenylene)s3 , poly(vinylcarbazole)s3,poly(oxadiazole)s3,及 polyfluorenes3 等。其中又以 polyfluorenes 系列為最佳藍光材料。. 1-3. 聚茀(Polyfluorene)的歷史回顧 Polyfluorene (如圖 B-2.)可視為 PPP (poly(p-phenylene)s)的一種形式, 為利用一個碳原子(C-9)連接相鄰的兩苯環,並將之鎖在一個共平面上。此 藍光高分子由於具備優異的量子效率及熱穩定性,所以倍受矚目。. 9. 圖 B-2.. Polyfluorene 結構. Polyfluorene 其實早在 1989 年,在 Fukuda 實驗室利用 FeCl3 為催化劑的條 件下合成出來 4,並在 1991 年首次被製成單層藍光元件 5,接著 1998 年 Dow 化學公司以 polyTPD 為電洞傳輸層,製成雙層結構,試圖提升元件效率及 穩定性 6。隨後 Polyfluorene 開始被大量的研究與改良,包括在九號碳位置 45.
(61) 導入取代基 7,物理性摻混 8,導入共聚物 9,及導入 crosslinking 基團 10 等。 直到目前為止,元件效率已有明顯的提升,從 0.3 %到現今的 1.21 %以上。. 1-4. 研究動機 聚茀(Polyfluorene)具有熱穩定性佳,高化學穩定性及優異的量子效率,但 是聚茀在加熱、UV 照射或操作電壓下,會因分子堆疊、激發複合體(excimer) 的出現或化學缺陷,在光譜 530~540 nm 位置產生額外的放射,影響光純度 和光色穩定。因此,本篇研究中,我們在 fluorene 碳九位置導入 xanthene(圖 B-3.),使成 spiroxanthenefluorene 結構,而中心的九號碳以四面體鍵結向外 延伸,使得 fluorene 和 xanthene 互呈 90 o 垂直,並以此單體聚合成 PF-S 高 分子。Spiroxanthenefluorene 的合成始於 192311,但不曾應用在 PLED 上, 這樣的結構不僅修飾聚茀因平面結構所造成的物理缺陷,增加量子效率, 同時九號碳的 spiro-鍵結也避免聚分子因熱、UV 照射或操作電壓下產生化 學缺陷而影響材料的色純度及穩定性。另外,2’,7’-位置烷氧鏈的導入,也 可降低 spiro-結構所造成的溶解度問題。. O. 圖 B-3. xanthene 結構 最後,我們更進一步將具有電洞傳輸能力的 carbazole 側鏈基導入 Spiroxanthenefluorene 中,合成出具有電洞傳輸能力的 PF-SC,期盼在電洞 注入及熱性質方面都能有所提升。 46.
(62) 第二章 實驗. 2-1. 藥品. Resorcinol. 購自 TCI. Zinc chloride. 購自 Merck. 1-Bromooctane. 購自 Lancaster. Potassium carbonate. 購自 SHOWA. N, N-Dimethyl formamide. 購自 Aldrich. n-BuLi. 購自 ACROS. Magnesium sulfate. 購自 SHOWA. Pinacol. 購自 Lancaster. Benzene. 購自 Tedia. Carbazole. 購自 Lancaster. 1,6-Dibromohexane. 購自 Lancaster. Sodium hydroxide. 購自 Lancaster. Aliquat 336. 購自 Lancaster. Tetrakis(triphenylphosphine) Palladium. 購自 Lancaster. Benzeneboronic acid. 購自 Lancaster. 47.
數據




+7
相關文件
接枝共聚合反應是材料改質的主要技術之ㄧ,已廣泛應用於高分子材料及生
另一重要的基本分析為熱值 (heating value) 測量,藉 由熱卡計以得知該燃料單位質量反應後釋放之熱量;其 又分成高位發熱值 (higher heating value, HHV) 與低 位發熱值
雖然水是電中性分子,然其具正極區域(氫 原子)和負極區域(氧原子),因此 水是一種極 性溶劑
一般而言,物質的黏度與流體間的凝聚 力和分子間的動量轉移率有關。液體分子與
一般而言,物質的黏度與流體間的凝聚 力和分子間的動量轉移率有關。液體分子與
電子 、 機械系 、 環工系 、 高分子、光電、電腦與通訊 本學程共計 7 學科, 18 學分,必須修畢全部學分,始
特性:高孔率、耐 130C 高壓滅菌,透光性佳,以 RI 值 1.515 之溶液潤濕過 濾膜即可用顯微鏡觀察過濾膜上的粒子。灰分含量 0.002 mg/cm 2 。一般用來
Kaiser 提出 MSA(Measure of Sampling Adequacy,資料做因 素分析適合性指標),雖然 MSA 的大小沒有統計上的判斷臨 界點,但實證經驗,當 MSA > 0.8 表示此組資料作因素分析