國立交通大學
環境工程研究所
碩士論文
胞外聚合物對生物重金屬溶出程序之影響
Effect of
Extracellular Polymeric Substance (EPS) on bioleaching process研究生: 范少奇
指導教授: 林志高 博士
胞外聚合物對生物重金屬溶出程序之影響
Effect of
Extracellular Polymeric Substance (EPS) on bioleaching process研究生: 范少奇 Student: Shao-Chi Fan
指導教授: 林志高 博士 Adviser: Dr. Jih-Gaw Lin
國立交通大學
環境工程研究所
碩士論文
A Thesis
Submitted to Institute of Environmental Engineering College of Engineering
National Chiao Tung University In Partial Fulfillment of the Requirements
For the Degree of Master of Science In
Environmental Engineering June 2005
Hsinchu, Taiwan, Republic of China
胞外聚合物對生物重金屬溶出程序之影響
研究生: 范少奇 指導教授: 林志高 博士 國立交通大學環境工程研究所
摘要
因微生物胞外聚合物 (Extracellular Polymeric Substance, EPS) 在生 物處理程序中可促進微生物群體之膠凝作用,進而形成顆粒化污泥或附著 性生物膜,有助於微生物總量之增加和多元化菌種之截流,以達廢水中污 染物之徹底分解。而由於 EPS 在生物溶出法中主要三大機制: (1) 保護作 用、(2) 吸附作用及(3) 酵素作用。所以可見 EPS 對於生物溶出法具有一 定的影響力。 以實驗設計的規劃為二因子 (X1= 固體物濃度、X2= 硫片添加量) 的中 央合成設計,而每個獨立因子變數分別具有 5 個水準範圍,固體物濃度 (X1) 從 0.5% 至 5.0% (w/w);硫粉添加量 (X2) 則是從 0.5% 至 4.0% (w/w)。而根據實驗設計並以氣提示反應槽來進行反應所得到的結果如下: pH: 1.15-5.82;EPS 產生量: 210-4300 mg/L;硫酸根濃度:5540-28300 mg/L;懸浮固體物去除率: 30-65%;揮發性懸浮固體物去除率: 15-62%; 銅溶出率: 23-98%;鎘溶出率: 23-98%;鉻溶出率: 11-91%;鉛溶出率: 17-52%;鋅溶出率: 42-99%;鎳溶出率: 54-98%;錳溶出率: 24-99%。由
反應曲面及等高線圖可知,只要將固體物濃度控制在 0.5-1.5% 且硫片添 加量在0.5-2.0% 之間時,重金屬溶出率即可達到 95% 以上。由 AFM 及 SEM 觀察可有效證實胞外聚合物之吸附及酵素作用,故 EPS 對污泥重金 屬溶出程序確實具有一定的影響作用。pH 除了對重金屬溶出效率和硫酸鹽 產率有一定的影響之外,對於微生物群體及 EPS 的產生也會有相當影 響,所以 pH 值對於生物溶出法為一非常重要的因子。 關鍵字: 生物溶出法; 生物膠羽作用; 吸附性生物膜; 顆粒化污泥;胞外聚 合物
Effect of
Extracellular Polymeric Substance (EPS) on bioleaching processStudent: Shao-Chi Fan Advisor: Dr. Jih-Gaw Lin
Institute of Environment Engineering National Chaio Tung University
Abstract
Because Extracellular Polymeric Substances (EPS) promote bacterial be adhesive biofilm and agglomerates. By mean of bioflocculation, it will raise bacterial population and increase capability of decompose pollutants. EPS are having three major functions in bioleaching such as adsorption, protection and catalysis on bioleaching process.
Using the experimental design method to plan Central Compose Design of two factors (X1= sludge concentration; X2= sulfur addition). The
result is: pH: 1.15-5.82; yield of EPS: 210-4300 mg/L; concentration of SO42-: 5540-28300 mg/L; SS removal ratio: 30-65%; VSS removal ratio:
15-62%; Cu solubilization: 23-98%; Cd solubilization: 23-98%; Cr solubilization: 11-91%; Pb solubilization: 17-52%; Zn solubilization: 42-99%; Ni solubilization: 54-98%; Mn solubilization: 24-99%. AFM and SEM imaged EPS include adsorption and catalysis.
EPS can reduce processing period and upgrade processing efficiency for removing heavy metals from sludge. The EPS production has increased with TS increased. However, it has a clear pick at 10-16 days. It is mean that when solution have a large number of H+ and SO42- and
metal ions it will let bacterial product large EPS. Consequently, heavy metals solubilization and EPS production have effected by pH. So pH value will be a very important factor on bioleachinig process.
Keywords: bioleaching; bioflocculation; adhesive biofilm; agglomerates; EPS
誌謝
首先,感謝我的指導教授林志高老師的諄諄教誨及循循善誘,提供我 一個學習的環境,讓我可以有機會學習以前所沒學過的部份,好讓我在研 究所的課業不會落後太多;另外,感謝我的指導博士班王至誠學長,除了 在實驗上提供寶貴的經驗及細心的指導,並協助我完成論文;最後,感謝 親民技術學院的徐瑞蓮老師及交通大學材料所博士班江姿穎學姊,提供實 驗上所需的技術及材料,並讓我可以使用該單位之儀器。在口試期間,亦 承蒙宋士武老師、陳重元老師、陳勝一老師三位口試委員的指正及建議, 使我獲益良多。 在研究生活上,感謝秀鳳學姊、人傑學長、宏邦、建銘學長及至誠學 長不吝惜提供他們寶貴的經驗,好讓我能縮短實驗上的時間及減少不必要 的錯誤;另外,感謝跟我同期畢業的好夥伴,理安、佳紘及憲昌,有他們 的配扮,讓我在研究所的日子不會趕到孤單;最後要感謝的是,佩琪、怡 湘及義雄雖然才相識一年,但我相信3S 因為有你們的加入會更發揚光大。 最後感謝一路支持我的父母親及玟靜,沒有你們的支持就不會有今天 的我,有你們的陪伴及關懷,讓我可以全心全力的投入研究的領域,所以 我有今天的成就,你們絕對是因為你的的支持鼓勵,謝謝。目錄
中文摘要 ...I 英文摘要 ...III 誌謝 ...IV 目錄 ... V 表目錄 ... VII 圖目錄 ... VIII 第一章 序論 ...1 1.1 研究緣起...1 1.2 研究內容與目的...2 第二章 文獻回顧 ...5 2.1 生物溶出法之法發展及簡介...5 2.2 生物溶出法中微生物之種類及生理特性...6 2.3 重金屬溶出機制...7 2.4 硫氧化菌吸附於硫粉上的機制...9 2.5 胞外聚合物 (EPS) 對生物溶出法 (Bioleaching) 的重要性...12 2.5.1 胞外聚合物的組成 ...12 2.5.2 胞外聚合物的功能 ...12 第三章 實驗設備與方法 ...15 3.1 實驗設備器材及材料藥品...15 3.2 實驗方法與步驟...16 3.3 污泥樣品來源及前處理...17 3.4 馴養試驗...18 3.4.1 片狀硫的製作 ...18 3.4.2 硫氧化菌的馴養試驗 ...19 3.5 生物溶出試驗...20 3.5.1 污泥重金屬總量分析 (CEM MARS 5)...21 3.5.2 污泥重金之屬連續萃取實驗 (Tessier et al., 1979)...23 3.6 生物溶出法之實驗設計...24 3.6.1 中央合成設計 (CCD)...243.6.2 反應曲面法 (Response Surface Method) ...26
3.6.3 批次實驗規劃 ...27
3.7 EPS 定量試驗 ...27
3.7.1 EPS 萃取方法 ...27
3.7.2 蛋白質定量 (Bradford protein-binding assay) ...29
3.8 菌種的鑑定...29
3.8.2 液相螢光原位雜交法步驟 ...30 3.8.3 固相螢光原位雜交法步驟 ...33 第四章 結果與討論 ...34 4.1 畜牧污泥基本特性...34 4.2 馴養實驗...35 4.3 不同固體物濃度及硫片添加量對生物溶出實驗之影響 ...37 4.3.1 不同固體物濃度及硫片添加量在生物溶出程序中對 pH、氧化還原電位 (ORP) 和導電度 (EC) 之影響...37 4.3.2 不同固體物濃度及硫片添加量在生物溶出程序中對硫酸根產生量之影響 ... 41 4.3.3 不同固體物濃度及硫片添加量在生物溶出程序中對有機物降解之影響42 4.4 生物溶出實驗...46 4.4.1 重金屬溶出效率 ...46 4.4.2 連續萃取試驗 ...56 4.5 EPS 之影響...62 4.5.1 EPS 萃取試驗 ...62 4.5.2 蛋白質試驗 ...63 4.5.3 胞外聚合物之功用 (影響)...65 4.6 精密儀器分析 (AFM/SEM)...66
4.6.1 Atomic Force Microscopy (AFM) ...66
4.6.2 Scanning Electron Microscope (SEM)...68
4.7 統計分析結果...71 4.7.1 中央合成設計結果 ...71 4.7.2 配適二階模型之設計 ...76 4.7.3 模型適當性與常態性假設檢驗 ...77 4.8 菌種鑑定及菌數估計...79 4.8.1 生物溶出法液相中菌相變化 ...79 4.8.2 生物溶出法硫片上之菌相變化 ...83 第五章 結論 ...86 第六章 參考文獻 ...88
表目錄
Table 3-1 實驗設備...15 Table 3-2 實驗材料及藥品...16 Table 3-3 因子水準表...28 Table 3-4 實驗組數表...28 Table 4-1 原始污泥的基本性質...35 Table 4-2 生物溶出法後污泥中重金屬含量...57 Table 4-3 各國污泥中重金屬含量法規標準...57 Table 4-4 添加不同 EPS 量後萃取變化情形...67 Table 4-5 添加不同 EPS 量後重金屬溶出情形...67 Table 4-6 中央合成設計因子與對應反應參數表...72 Table 4-7 銅溶出率之變異數分析...77 Table 4-8 廻歸係數預測銅溶出率之結果...77 Table 4-9 液相中 TS/S: 2.75/2.3 的變化百分比...80 Table 4-10 固相中 TS/S: 2.75/2.3 的變化百分比...83 Table 4-11 實驗組數對照表...84 Table 4-12 液相之總菌數 (cell/mL)...85 Table 4-13 固相之總菌數 (cell/mL)...85圖目錄
Figure 1-1 生物溶出法架構流程圖...03 Figure 2-1 生物溶出法流程圖...09 Figure 2-2 硫氧化反應機制...10 Figure 2-3 EPS 的反應機制...14 Figure 2-4 EPS 的吸附機制...14 Figure 3-1 生物溶出試驗流程圖...17 Figure 3-2 不繡鋼模板...18 Figure 3-3 片狀硫...18 Figure 3-4 硫氧化菌馴養流程圖...19 Figure 3-5 馴養反應槽...20 Figure 3-6 氣提式反應槽...22 Figure 3-7 2 因子 CCD 示意圖...26 Figure 3-8 FISH 流程圖...30 Figure 4-1 馴養實驗中 pH 值變化情形...36 Figure 4-2 生物溶出法中 pH 值變化情形...39 Figure 4-3 生物溶出法中 ORP 值變化情形...40 Figure 4-4 生物溶出法中 EC 值變化情形...40 Figure 4-5 生物溶出法中 SO42- 變化情形...42Figure 4-6 生物溶出法中 SS 變化情形 (A) SS Removal (B) Surface plot (C) Contours plot ...44
Figure 4-7 生物溶出法中 VSS 變化情形 (A) VSS Removal (B) Surface plot (C) Contours plot...45
Figure 4-8 生物溶出法中銅變化情形 (A) Surface plot (B) Contours polt...47
Figure 4-9 生物溶出法中鎘變化情形 (A) Surface plot (B) Contours polt...48
Figure 4-10 生物溶出法中鉻變化情形 (A) Surface plot (B) Contours polt...50
Figure 4-11 生物溶出法中鉛變化情形 (A) Surface plot (B) Contours polt...51
Figure 4-12 生物溶出法中鋅變化情形 (A) Surface plot (B) Contours polt...53
Figure 4-13 生物溶出法中鎳變化情形 (A) Surface plot (B) Contours polt...54
Figure 4-14 生物溶出法中錳變化情形 (A) Surface plot (B) Contours polt...56
Figure 4-15 連續萃取中銅之鍵結變化情形...58 Figure 4-16 連續萃取中鎘之鍵結變化情形...59 Figure 4-17 連續萃取中鉻之鍵結變化情形...59 Figure 4-18 連續萃取中鉛之鍵結變化情形...60 Figure 4-19 連續萃取中鋅之鍵結變化情形...60 Figure 4-20 連續萃取中鎳之鍵結變化情形...61 Figure 4-21 連續萃取中錳之鍵結變化情形...61
Figure 4-22 生物溶出法中 EPS 變化情形...64 Figure 4-23 生物溶出法中 EPS 與 pH 之變化情形 (TS/S: 2.75/2.3)...64 Figure 4-24 生物溶出法中 EPS 與 pH 之變化情形 (TS/S: 4.34/3.5)...65 Figure 4-25 生物溶出法中蛋白質變化情形...65 Figure 4-26 EPS 變化情形...67 Figure 4-27 利用 AFM 觀察片狀硫上的表面情形...68 Figure 4-28 利用 SEM 觀察反應前片狀硫上的表面情形...69 Figure 4-29 利用 SEM 觀察反應前片狀硫的斷面情形...69 Figure 4-30 利用 SEM 觀察反應後片狀硫上的表面情形...70 Figure 4-31 利用 SEM 觀察反應後片狀硫上的斷面情形...71 Figure 4-32 銅溶出率之反應曲面圖...73 Figure 4-33 銅溶出率之等高線圖...73 Figure 4-34 EPS 之反應曲面圖...75 Figure 4-35 EPS 之等高線圖...75 Figure 4-36 銅溶出率之殘差對配適值的圖形...78 Figure 4-37 銅溶出率之殘差對配適值圖...79
Figure 4-38 DAPI/ Thio 082/Thiopa 511 /EUB338 (液相)...81
Figure 4-39 Thio 082 之反應曲面圖...81
Figure 4-40 pH/T. thiopaurs (Thiopa0511)...82
第一章 序論
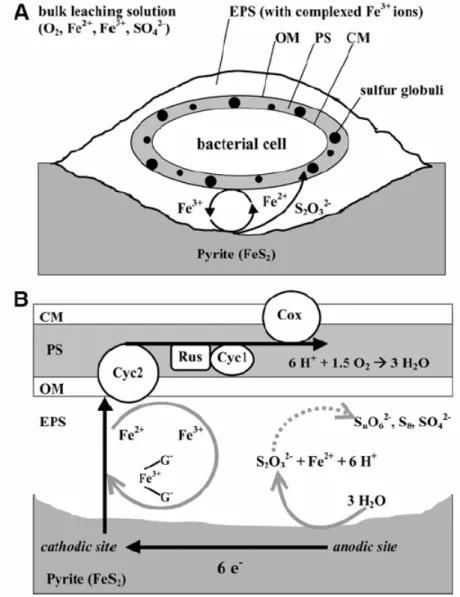
1.1 研究緣起 畜牧業污泥含有大量有機質及氮磷等營養成分,可利用為農地肥料或 土壤改良劑,除可達到資源回收之目的,且亦有畜牧場减廢之功效。但由 於畜牧方式的改良,在飼料中添加銅與鋅化學鹽類,以作為猪隻生長隻刺 激與調理劑,造成養猪廢水及污泥中含有過量的重金屬,亦造成污泥中的 重金屬含量升高,故不利於作為農地肥料或土壤改良劑。 對於污泥中重金屬的移除,比較常見方法包括螯合劑、錯合劑及酸劑 萃取 (Olver et al., 1975) 。而螯合劑對於銅、鉛、鎘的去除效率佳,但對 於鐵的效果就沒有那麼好;而酸劑萃取對於銅的溶出效果也不是都很好。成 本高、操作困難、需要大量的化學藥劑未上述兩種方法的主要缺點 (Tyagi et al., 1993)。而在採礦工業中生物濕式冶金術 (biohydrometallurgy),及生物 溶出法 (bioleaching),結合物理及化學作用,多年來已被廣泛利用,利用 生物的代謝作用,將不溶性的金屬礦物 (通常是金屬硫化物或金屬氧化物) 轉換為可溶性的金屬硫酸鹽,使得重金屬自固相轉至液相,再經由化學方 法加以收集;生物溶出方法的優點在於價格便宜,且對於不易萃取的金屬亦 能做有效溶出,如含金的砷硫礦及含硫化銅的礦物 (Muller and Porttillo, 1981)。種主要反應 (Schipper et al., 1996; Schipper and Sand, 1999; Sand et al., 2001; Rawling et al., 2002),但近幾年研究指出,在直接接觸機制中,雖 然是利用硫氧化菌的氧化能力及產酸能力來處理受重金屬污染污泥,但硫 氧化菌必需產生胞外聚合物 (Extracellular Polymeric Substances, EPS) 使微生物群體產生生物膠羽 (Bioflocculation),逕而形成架橋作用 (Gehrke et al., 1995; Escobar et al., 1997; Pogliani and Donati, 1999; Hoa et al., 2003),才能使微生物有效吸附在固體顆粒及硫片上,讓重金屬自固體物中 溶出。由於 EPS 在 pH=2 的條件下其表面電性為帶正電 (Yoshida and Murooka, 1994; Blake et al., 1995; Sharma et al., 1995),容易與帶負電性 的固體顆粒 (Blake et al., 1995) 進行結合反應,所以 EPS 在生物溶出法
中佔有及重要得角色。在傳統實驗上通常利用 pH、ORP、SO42-…等間接 的方法,來監測評估生物溶出法的處理效率及終點,並不能精確觀察實際 參於反應的微生物量,故只能利用估計的方式預測其反應結果。所以本研 究探討以直接的方法來量測其反應效率,即利用生物處理中,微生物所產 生的 EPS 來作為判斷。所量測出的數值會比傳統量測方法更有意義 (Gehrke et al., 1995, 1998) 。 1.2 研究內容與目的 利用生物溶出法處理污泥中的重金屬,添加硫片作為基質以提供微生 物所需的能量,並藉由胞外聚合物的產生增加硫氧化菌吸附在硫片上的能
力,Figure 1-1 為整個實驗的架構圖。故以大型氣提式生物溶出反應系統 (約 25 L) 來處理含重金屬之污泥,改變操作因子如:污泥濃度、植種量及硫 片添加量,來探討胞外聚合物對硫氧化菌產酸及重金屬去除之影響。
第二章 文獻回顧
2.1 生物溶出法之法發展及簡介 生物溶出法 (Bioleaching) 早年大都應用在金屬採礦工業和酸礦廢水 之處理,由於其處理效果佳,甚至以有商業規模,但生物技術於環境工程 並未廣泛應用,目前仍處於實驗研究階段,其主要應用於回收工業廢棄物 中之重金屬及受重金屬污染之底泥之處理及移除下水污泥 (包含初級污 泥、二及污泥、好氧消化污泥及厭氧消化污泥) 中之重金屬 (Blais et al., 1992; Bosecker, 1986; Chen and Lin, 2000)。以往處理含過量重金屬污泥時 , 大 都 採 取 萃 取 法 (extraction method) 或 固 化 / 安 定 化 法 (solidification/stabilization) 等傳統技術,而這謝技術主要的缺點為處理效 果不佳及處理成本過高 (高和林,1994)。 污泥中部分之重金屬是以硫化物型態所存在,而通常此部分之重金屬 不易為酸萃取法所去除,由於金屬硫化物之溶解度積 (KSP) 極小,屬難溶 性沉澱物。重金屬在中性條件下實際上是相當難溶的,在鹽酸中,鐵、錳 和鎘的硫化物是可溶的;鎳和鈷的硫化物是難溶的;鈣、鉛和汞的硫化物 只有在氧化力強的酸,特別是硝酸中才會溶解 (陳,1992) 。若利用硫氧化 菌來移除污泥中的重金屬,則可有效將以硫化物型態存在之重金屬移除, 此為生物溶出法優於化學萃取發之處。
2.2 生物溶出法中微生物之種類及生理特性 生物溶出法中最具活性的細菌是 thiobacilli 屬,為格蘭氏陰性的無芽 胞桿菌,適合於好氧環境下生存。多數 thiobacilli 屬是化學自營菌,係利 用空氣中的 CO2 為碳源來合成新的細胞,並以代謝氧化還原的硫化合物, 如 硫 化 物 、 元 素 硫 或 硫 代 硫 酸 鹽 來 獲 得 能 源 , 最 終 產 物 為 硫 酸 鹽 (Rohwerder et al., 2003)。 生物溶出法需要於酸性環境 (pH 值介於 1.5-3.0) 下進行,此時大部 份 的 重 金 屬 已 離 子 型 態 存 在 於 溶 液 中 , 故 嗜 酸 菌 種 的 Thiobacillus
ferrooxidans 及 Thiobacillus thiooxidans 對 重 金 屬 溶 出 相 當 重 要 ;T. ferrooxidans 及 T. thiooxidans 兩株菌種。T. ferrooxidans 最早由 Colmer 及 Hinkle 於 1947 年自酸礦廢水中分離出來,為格蘭氏陰性無芽胞末端 為圓形之桿狀菌可移動具單一鞭毛同時也是絕對好氧的中溫菌 (20-400C) 適合生長範圍為 pH 1.0-4.5,pH 為 2 時生長最快,未發現存活於 pH 高 於 6.5 或低於 1.0 以下的環境之中; 1992 年 Waksman 與 Joffe 分離 出 T. thiooxidans,最適合生長之 pH 範圍為 1.5-5.5,pH 2.5-4.0 時生長 速率最快,此株菌能快速的氧化元素硫,亦能利用還原態的硫化合物產生 硫酸,使 pH 降到 1.0-1.5,甚至更低,硫酸的大量產生使得岩石礦物快速 分解,可加速酸性可溶之重金屬自礦物中溶出,釋放至溶液中形成硫酸鹽。 T. ferrooxidans 氧 化 硫 的 速 度 比 T. thiooxidans 慢 , 但 其 異 於 其 他
thiobacilli 屬的在於除了能氧化硫化物外二價鐵也能當做電子供給者。 T. thioparus 為格蘭氏陰性之桿狀菌,細胞間無明顯含硫之內含物適合 生長 pH 之範圍為 5.9-9.0,pH 6.0-8.0 時生長速率最快,適合生長之溫 度與最大生長溫度與 T. thiooxidans 相似。其他的 thiobacilli 屬也能夠氧 化元素硫及硫化物,但僅能生長於 pH 值較高甚至在非酸的環境下,但此 時重金屬無法以離子型態存在於溶液之中,因此較不利於生物溶出的進行。 2.3 重金屬溶出機制 生物溶出法中微生物溶出礦石、廢棄物或污泥等介質中重金屬主要機 制大致分為兩類 (Couilard and Zhu, 1992; Bosecker et al., 1997):
(1) 直接接觸: 直接機制是藉由微生物細胞與硫化物或礦物的物理性吸附 再由酵素催化將金屬硫化物氧化成硫酸鹽其方程式如 (2-1) 式所示: ) 1 2 ( 2 2 ⎯⎯ →⎯ 4 −−−−−−−−−−−−−−−−−− − + O MeSO MeS bacteria MeS: 金屬硫化物 Me: 二價金屬 (2) 間接接觸: 經由溶液中三價鐵將金屬硫化物氧化為硫酸鹽形式,為一 化學反應 , 如 (2-2) 式所示: ) 2 2 ( ) ( 4 3 4 4 0 2 → + + −−−−−−−−−−− − +Fe SO MeSO FeSO S MeS 為使溶液中維持高量的三價鐵以進行金屬硫化物的化學氧化溶液的
pH 值需低於 4.0 以下 (Chemisty For Environmental Engineer,Fourth Edition)。而 T. ferrooxidans 與 L. ferrooxidans 能將二價鐵氧化為三價 鐵,如 (2-3) 式所示,(2-2) 式加上 (2-3) 式可使溶出反應成為一循環程序。 ) 3 2 ( ) ( 5 . 0 2FeSO4 + O2 +H2SO4 →Fe SO4 3 +H2O−−−−−−−−−− − 進行間接機制時,微生物並不需要附著至硫化物或礦物表面,但可以加 速二價鐵的再氧化,因為二價鐵的再氧化在無微生物催化之情形下,反應 非常慢;在 pH 2-3 時,微生物催化二價鐵的氧化速率比純粹化學氧化快 105-106 倍 (Rohwerder et al., 2003)。 於 (2-2) 式中產生的硫同時也可被 T. ferrooxidans 利用氧化產生硫 酸,如 (2-4) 式所示,但 T. thiooxidans 氧化硫的速度比 T. ferrooxidans 快很多,T. thiooxidans 於生長代謝過程中所產生的硫酸,可使環境中的 pH 下降而增進重金屬溶出效率。 ) 4 2 ( 2 3 2 0 + 2 + 2 ⎯⎯ →⎯ 2 4 −−−−−−−−−−−−−−−−− − SO H O H O S bacteria 重金屬溶出的過程以 Figure 2-1 來表示:
Figure 2-1 生物溶出法流程圖 (Tichy et al., 1998) 2.4 硫氧化菌吸附於硫粉上的機制 在生物溶出法中,微生物會因對流及凡得瓦力而吸附至硫及固體顆粒 物的表面,其吸附速度遠大於脫附速度,因此脫附可被忽略 (Kumer et al., 1991; Bhavaraju et al., 1992) 。當元素硫被當作電子供應者而由外界供應 時,由於元素硫的極不溶性,菌體必須附著在硫粉上生長,藉由吸附於硫 粉上,細菌能有效地獲得所需的硫原子,元素硫會緩慢的溶解,進而將硫 粉消耗。T. thiooxidabs 生長代謝硫的全反應可以 (2-4) 式表示,最佳氧化 的 pH 值在 4.0 左右,且在細菌代謝硫的氧化過程中,會產生一連串的中 間產物,其反應如 (2-5) 與 (2-6) 式。 Sulifed partial oxidation Elemental sulfur Sulfur oxidation Sulfuric acid Extraction of metals Contaminated sludge Cleaned sludge Metals separation
) 5 2 ( 2 2 3 . 2 2 0 + + ⎯⎯⎯⎯⎯→ − + + −−−−−−−−−−−−− − H SO O H O S Tthiooxidans ) 6 2 ( 5 . 0 2 42 2 3 + ⎯⎯→ −−−−−−−−−−−−−−−−−−−−−− − − − SO O SO 其中 T. thiooxidans 與 T. ferrooxidans 的硫氧化酵素可以將元素硫 氧化為亞硫酸根進而與硫反應形成硫代硫酸根 (Rohwerder et al., 2003), 以 Figure 2-2 表示。
Figure 2-2 硫氧化反應機制 (Rohwerder et al., 2003)
這些中間產物為離子型態,釋放至溶液中時提供未附著及脫附的細胞 作為生長基質來源 (Rohwerder et al., 2003)。
形成菌落約可以四個階段加以敘述。 第一階段為傳輸 (transport): 到固體表面,分為三種形式: 擴散: 細菌因布朗寧運動 (Browian movement),不規則且快速與固體表面 積接觸,即使在無攪拌、平靜的反應狀態下,任可以通過擴散層而達 到固體物表面,但與下列兩種傳輸模式比較起來來,擴散的速度是很 慢的。 對流: 細菌因水流的帶動而傳輸至固體表面。 移動: 微生物可能是隨機地碰到固體物表面或是因濃度梯度的關係而往固 體表面移動。 第二階段是初步的附著 (initial adhesion),此階段主要是一物理化學過 程,可分為可逆及不可逆的附著,可逆的附著是因為細菌持續受到布朗寧 運動的影響、顆粒表面的剪力或細菌本身的移動而自顆粒表面附著;若細菌 並不受布朗寧運動之影響或承受到強烈的力量方可自固體表面移除,則呈 現不可逆的附著。 第三階段是穩固的附著 (attachment),細菌沉降至固體表面後 , 細 菌表面的特殊構造 (如纖維或聚合物) 可將細菌細胞與固體物間形成幾密 的鍵結,這層表面薄膜主要是由多醣類 (polysaccharides) 形成。 最後的表面菌落的形成 (surface colonization),附著的細胞開始生 長,新生成的細胞並互相附著,進而形成微生物菌落或生物膜。
2.5 胞外聚合物 (EPS) 對生物溶出法 (Bioleaching) 的重要性 2.5.1 胞外聚合物的組成
胞外聚合物主要的型態分為 3 種,即黏膜狀、碎粒狀、纖絲狀,分別
存在於不同之生物處理系統。EPS 主要成分為聚碳水化合物、脂質及蛋白
質 (Nishikwa and Kariyuma, 1968; Vallom and McLoughlin, 1984;
Goodwin and Forster, 1985; Vallom and Urbain et al., 1993; Gehrke et al., 1998),但其所佔比例並非為一定值,需視廢水性質及生物處理程序而異。 故在不同條件下所產生的 EPS 會對處理效果有一定的影響,所以在選擇 處理條件時也必須慎重考慮。 2.5.2 胞外聚合物的功能 因微生物 EPS 在生物處理程序中可促進微生物群體之膠凝作用,進 而形成顆粒化污泥或附著性生物膜,有助於微生物總量之增加和多元化菌 種之截流,以達廢水中污染物之徹底分解 (Brown et al., 1980; Novak et al., 1981; Hoa et al., 2003) 。故藉由 EPS 的產生可促進生物群的膠凝及架橋 作用,逕而加速反應效果。
一般而言 EPS 在生物溶出法中主要有三大功能:
(1) 保護作用: 由之前的研究可知重金屬對於微生物有一定的抑制作用,故 在生物溶出法中所產生的重金屬或水體中所含有的中金屬 都會對於微生物具有一定的影響,所以藉由 EPS 生成可
以 吸 附 溶 液 中 的 重 金 屬 , 降 低 重 金 屬 對 微 生 物 的 影 響 (Brown et al., 1982)。 (2) 吸附作用: 因為 EPS 最主要的組成成分為蛋白質、 醣類及脂質,藉 由 EPS 的生成可以有效的使微生物穩固的吸附至固體物 表面上 (Brown et al., 1980)。同時因為組成成分的不同, 其帶電性也會不同 (Blake et al. , 1994),所以藉由帶電性 的不同又可去吸附至其他的固體物表面上。Figure 2-4 為 EPS 之吸附作用。 (3) 酵素作用: EPS 會與固體物進行反應,而侵蝕固體物表面,藉由 EPS 的酵素作用可加速整個反應速率。而 Figure 2-3 為 EPS 的反應機制 (Rohwerder et al., 2003)。 所以由於 EPS 三種反應機制的存在,才能加速整個反應速率, (2-7) 、 (2-8) 、 (2-9) 、 (2-11) 式 (Rodriguez et al., 2003) 可以表示其整個反應: ) 7 2 ( 2 4 2 2 2 2 + + ↔ + + −−−−−−−−−−−−−−−− − + − + H SO Fe O H O FeS ) 8 2 ( 2 2 1 2Fe2+ + O2 + H+ ↔ Fe3+ +H2O−−−−−−−−−−−−−−−−− − ) 9 2 ( 6 7 3 6 3 2 2 2 32 2 + + ↔ + + −−−−−−−−−−− − + − + + H O S Fe O H Fe FeS ) 10 2 ( 10 2 8 5 8 3 2 2 42 2 3 2 + + ↔ + + −−−−−−−−−− − + − + + − H SO Fe O H Fe O S 所以藉由這循環反應可一直反覆作用,以加速整個反應速率、提升反應結 果。
Figure 2-3 EPS 的反應機制 (Rohwerder et al., 2003)
第三章 實驗設備與方法
3.1 實驗設備器材及材料藥品 以下為本實驗所需用到之儀器設備、名稱、廠牌及規格,如: Table 3-1 所述。 Table 3-1 實驗設備 儀器設備名稱 廠牌及規格 1. 高溫爐 (5500C) Nabertherm, Model: L9/R 2. 烘箱 (1050C) RISEN 3. 恆溫水平震動器 FIRSTEK, Model: B603 4. 微波樣品消化器 CEM, MARS 5 5. 真空過濾機 GAST, Model: 1VSF-10-M100X 6. pH 測定儀 Suntex, Mode 7. 磁石攪拌機 Corning, Model: PC-310 8. 火燄原子吸收光譜 Hitachi, Model: Z-8100 9. 離心機 Harmoic Series10. 高速離心機 Beckman® High Speed centrifuge
11. 冷凍乾燥機 EYELA FD-5N
12. 高溫滅菌釜 Hirayama, Model HA-300M
13. 恆溫循環水槽 Channel
14. pH 電極 Mettler Toledo,
Pt4805-60-P-PA-K19/120/3M
15. ORP 電極 Mettler Toledo,
405-60-SC-PA-K19/120/3M
16. pH 監測器 Tank 96-A
17. ORP 監測器 Jenco pH/ORP Controller 3676
18. 酵素免疫分光光度計 Packard Spectra Count ELISA
以下為本實驗所需用到之藥品名稱、等級及廠牌分別,如: Table 3-2 所述。 Table 3-2 實驗材料及藥品 藥品名稱 等級 廠牌 1. 元素硫 分析級 R.D.H.,德國 2. 乙酸 HPLC 級 Fisher,英國 3. 乙醇 實驗級 R.D.H.,德國 4. 丙酮 實驗級 Fisher,英國 5. 硼酸 實驗級 Shimakyu's 6. 酚石酞 實驗級 Panreac 7. 鹽酸羥胺 實驗級 Yakuri 8. 醋酸胺 實驗級 Panreac 9. 醋酸鈉 實驗級 Merck 10. Bio-red Sigma 級 11. 牛血清蛋白 (BSA) Sigma 級 12. 不鏽鋼模板 自訂
13. 分析篩,Mesh 20 KUANG YANG
3.2 實驗方法與步驟
本研究之實驗流程圖如 Figure 3-1,包括六個部分: (1) 前處理;(2) 污泥基本性質分析; (3) 馴養實驗; (4) 生物溶出試驗; (5) EPS 萃取 試驗; (6) 菌種及菌數的鑑定; (7) 實驗數據分析。其所使用的材料及方 法分別如下:
Figure 3-1 生物溶出試驗流程圖 3.3 污泥樣品來源及前處理 本研究中的污泥來源為北部某養猪場三段式廢水處理之厭氧污泥。 所採集回來的污泥,先將其全部混和均勻,再分別裝入數個採樣桶之中, 置入低溫冰箱內保存。然後取出一部分的原始污泥,經自然風乾、研磨過 後再利用 20 mesh (0.84 mm) 細篩過篩後,再進行污泥基本性質分析。 養猪廢水厭氧污泥樣品 前處理 污泥基本性質分析 馴養試驗 生物溶出試驗 胞外聚合物萃取 及蛋白質試驗 實驗數據分析 菌種及菌數 鑑定 重金屬溶 出實驗 pH, ORP, EC, SO42-, SS, VSS 分析 AFM/SEM
3.4 馴養試驗 3.4.1 片狀硫的製作 片狀硫顆粒之製作過程為將滅菌後粉末狀的元素硫,置於 1250C 的烘 箱中加熱 1-2 小時,將溶融狀之元素硫倒入不繡鋼模板 (如 Figure 3-2), 此模板之直徑為 1 cm,厚度為 0.5 cm,於室溫下固化,等固定形狀後即 為片狀硫顆粒 (如 Figure 3-3)。 Figure 3-2 不繡鋼模板 Figure 3-3 片狀硫
3.4.2 硫氧化菌的馴養試驗 硫氧化菌馴養流程可見 Figure 3-4。首先取總固體物含量 1.5% 的污 泥 10 L,置於馴養反應槽中 (如 Figure 3-4),加入片狀硫 1Kg (10%),利 用攪拌器使污泥完全混和,並加以曝氣,待 pH 值降至 2.5 以下。重複上 述步驟,添加原始污泥 9 L 於反應槽中,再加入經馴養過的原始污泥 1 L (10%),反覆馴養直到每次 pH 值降至 2.5 以下只需 3-4 天,即完成馴 養。在 pH 2.5 以下時,微生物成對數生長,即可作為批次試驗之植種。 Figure 3-4 硫氧化菌馴養流程圖 畜牧污泥 TS 1.5% 馴養實驗 監測pH pH<2.5 馴養完成 生物溶出實驗 10% (w/v) 片狀硫 (1 Kg) 取 10% (w/v) 1 L 作為植重量
Figure 3-5 馴養反應槽 3.5 生物溶出試驗 在生物溶出試驗中,重金屬離子自固相溶出至液相,其中一個重要的 反應機制是藉由酸化溶液,使液相中的氫離子與固相中的重金屬產生置換 作用,進而使重金屬離子從固相轉至液相。 生 物 溶 出 試 驗 利 用 統 計 方 法- 中 心 組 合 設 計 (Central Composite Design) 設計 2 因子水準試驗,如: 固體物含量 (TS = 0.5-5.0%) 及硫片添 加量 (S = 0.5-4.0%),並對重金屬溶出效率作個別比較。在整個生物溶出 程序中,所使用的反應槽為氣提式生物溶出反應系統,其主要是利用曝氣 的方式達到均勻攪拌的目的。如 Figure 3-6 所示,首先加入 10% (v/v) 已 馴養完成之污泥於 25 L 氣提式生物溶出反應槽中,並於進行下一批次實 Temperature Circulator Air Diffuser pH ORP DO
驗時添加前一批回收之片狀硫顆粒,並補充添加滅菌之片狀硫顆粒至 2% 為止,於溫度300C、曝氣強度 7 L/min 下進行試驗,在實驗過程中分別取 出上、中、下層各 100 mL 之污泥分析 pH、ORP、EC、SS、VSS、重金 屬及硫酸根濃度及 EPS 和 FISH 。氣提式生物溶出反應系統實驗進行期 間同時監測pH 值與氧化還原電位 (ORP) 之變化。將溶出之重金屬濾液以 火焰式原子吸收光譜儀分析,分析的重金屬種類包括:鎳、鉛、鉻、鎘、銅、 錳 、 鋅 。 硫 酸 根 濃 度 以 紫 外 光 光 譜 儀 於 波 長 420 nm 下測其吸光度
(Standard Methods 4500E) 判定之。最後利用連續萃取實驗來分析生物溶 出反應前後重金屬鍵結的變化情形。 3.5.1 污泥重金屬總量分析 (CEM MARS 5) 此方法提供一種重金屬酸消化法係於密閉容器內以溫度控制微波加熱 作為重金屬分析之前處理。 (1) 於每一消化瓶中置入 0.5 g 風乾後污泥樣品加入 9 mL HNO3、2 mL HCl 及 3 mL HF。 (2) 除了溫度監測瓶外,旋轉其餘之消化瓶。 (3) 旋轉溫度監測瓶。 (4) 將消化瓶置於旋轉盤內從消化瓶連接排氣管制廢氣收集瓶。 (5) 將轉盤放入微波消化器內,連接溫度監測器至溫度偵測瓶。 (6) 設定加熱程式或叫出以前儲存之加熱程式。
(7) 執行加熱程式直到完成。 (8) 消化完成後,使消化瓶於爐腔內冷卻至少 10 分鐘,將轉盤取出,以人 工洩壓並且打開消化瓶。 (9) 每一消化瓶中加入約 2 g 之硼酸 (Boric acid),混和均勻使硼酸完全溶 解。 (10) 將混和液過濾,並定量至 50 mL。 (11) 於原子吸收光譜儀進行重金屬總量分析。 Figure 3-6 氣提式反應槽 進料口 採樣點 氣體進流方向 7 L/min pH ORP Temp 及時監測 Air pump
3.5.2 污泥重金之屬連續萃取實驗 (Tessier et al., 1979) 重金屬之連續萃取流程步驟: 1. 離子交換態萃取實驗: 約取 0.5 g 之風乾污泥置入 45 mL 離心管中,加入 45 mL 之 1 M MgCl2 溶液,以 250 rpm 震盪 1 小時後,並以 4000 rpm 離心 20 分鐘, 將上澄液過濾之,之後加入 HNO3 保存待測,再加 5 mL 去離子水於離心 管,離心過後捨棄廢液。 2. 碳酸鹽態萃取實驗: 承步驟 1,加入 45 mL 之 CH3COOH 及 CH3COONa 之緩衝溶液 於離心管中,以 250 rpm 震盪 6 小時後,並以 4000 rpm 離心 20 分 鐘,將上澄液過濾,之後加入 HNO3 保存待測,再加 5 mL 去離子水於離 心管,離心過後捨棄廢液。 3. 鐵錳氧化態萃取實驗: 承步驟 2,加入 45 mL 之 0.04 M NH2OH HCl ( in 25% HOAc)․ ,並 將離心管移入油浴 96±30C,以 250 rpm 震盪 5 小時後,並以 4000 rpm 離心 20 分鐘,將上澄液過濾,之後加入 HNO3保存待測,再加 5 mL 去 離子水於離心管,離心過後捨棄廢液。 4. 有機態及硫酸鹽態萃取實驗:
(1) 承步驟 3,加入 10 mL 之 0.02 M HNO3 及 10 mL H2O2 (30%) 於
離心管中,並將離心管移入油浴 85±20C,以 250 rpm 震盪 3 小時。
(2) 承步驟 4. (1),加入 10 mL H2O2 (30%) 於離心管中,並將離心管移
入油浴 85±20C,以 250 rpm 震盪 3 小時。
(3) 承步驟 4. (2),取出離心管冷卻至室溫後,加入 15 mL 之 3.2 M
CH3COONH4 (in 10% HNO3),震盪 30 分鐘,以防止萃取出之重金
屬再度吸附於污泥中,並以 2000 rpm 離心 20 分鐘,將上澄液過 濾,之後加入 HNO3 保存待測,再加 5 mL 去離子水於離心管,離 心過後捨棄廢液。 5. 殘存態萃取實驗: 承步驟 4. (3),將離心管內污泥至入消化瓶中,以總重金屬萃取方法, 分析殘存相之重金屬,取其濾液冷藏保存。 由前述五項萃取步驟所的上澄液及濾液,以火焰式原子吸光光譜儀 (FAAS) 分析欲測之重金屬,必要時加以稀釋。 3.6 生物溶出法之實驗設計 3.6.1 中央合成設計 (CCD)
為了要聯繫相關和獨立變數 (Dependent and independent variables) 並使用最少實驗組數,使用二因子的中央合成設計,這種實驗設計方法可
以建構獨立變數的二階多項式並判定變數的顯著性。 CCD 包含了一個 2K 因子設計 (實心圓點),2K 個軸點試驗 (星形 點),和 NC 個中心點試驗使得其可以估計出曲率。如果對於每個因子來說, 中心點到各因子頂點的距離是 ±1 個單位,則中心點到星點的距離是 ±α, 在此 ∣ ∣<1。CCD 通常含有因子數兩倍的星點,星點代表設計中每個α 因子的極限值 (高和低)。為了維持旋轉性,α 值與 CCD 因子部分的實驗 組數有關,如果此因子設計是全因子則α值一般定義為 α= (2K)1/4。 以二因子為例 K=2 則 α=1.414,二因子的中心組合設計概念如 Figure 3-7 所示 (Charin Techapun et al., 2002)。
實驗所需組數 N=2K + 2K + 1,其中 K 代表獨立因子變數個數,以兩 個獨立因子變數為例,K=2 故所需的實驗組數為 9 組 (Diaz et al., 2003)。為了促進比較係數和形象化 (visualization) 獨立變數在反映變數 上 , 獨 立 因 子 變 數 的 水 準 範 圍 經 由 (3-1) 式 正 規 化 (normalized) 從 -1.414 到 1.414,此正規化過程能更精準估計回歸係數而且降低線性和二 次項之間的交互關係。 2 / min) max (X X X X Xn − − = ---(3-1) X : 獨立變數的絕對值 X : 變數平均值 max X 和X min: 變數最大最小值
Figure 3-7 2 因子 CCD 示意圖
3.6.2 反應曲面法 (Response Surface Method)
反應曲面法 (RSM) 搭配著 CCD,可更有效對於我們有興趣的反應及 變數的影響達到最佳化的目標。假設重金屬溶出速率 (Y),操作因子為固體 物濃度 (X1) 及硫粉添加量 (X2),則反應速率的函數,如 (3-2) 式 Y= f (X1,X2)+ε ---(3-2 ) 其中 ε 代表反應速率 Y 中所觀測到的誤差。如簡化成 Y= f (X1,X2),則此 方程式所代表的曲面就稱之為反應曲面。利用 RSM 以及等高線圖可以決 定因子最佳操作條件或範圍。
3.6.3 批次實驗規劃
目前實驗設計的規劃為二因子 (X1=固體物濃度、X2=硫片添加量) 的
CCD,而每個獨立因子變數分別具有 5 個水準範圍,固體物濃度(X1) 從
0.5% 至 5.0%;硫片添加量 (X2) 則是從 0.5% 至 4.0%。其所對應的自
然變數 (natural levels) 以及編碼變數 (coded levels) 如 Table 3-3 所 示。經由統計軟體 minitab 的 CCD 亂數執行出來的組數及順序,中心點 取三重覆所以一共需執行 11 組批次實驗如 Table 3-4 所示。
3.7 EPS 定量試驗 3.7.1 EPS 萃取方法
沸腾水浴萃取法 (Forster, 1971;Brown et al., 1982):
一、步驟: (1) 將適量樣品污泥放入二根離心管。 (2) 污泥以 4000 rpm 離心 30 分鐘,傾棄上澄液。 (3) 加入 20 mL 蒸餾水淘洗溶解值,使下層污泥重新懸浮,重覆離心 2-3 次。 (4) 污泥在 95OC 的水中震盪 1-2 小時。冷卻至室溫,以 10000 rpm 離 心 20 分鐘,分離菌體顆粒與 EPS 溶液。 (5) 收集上澄液後,加入 1:3 的乙醇:丙酮進行 EPS 聚合。
(6) 冷藏於攝氏 40C 冰箱放置隔夜,完成 EPS 之聚合。 Table 3-3 因子水準表 Level 設計因子 -1.414 -1 0 1 1.414 X1: 固體物濃度 (%) 0.5 1.16 2.75 4.34 5.0 X2: 硫片添加量 (%) 0.5 1.0 2.3 3.5 4.0 Table 3-4 實驗組數表
Coded value Natural value
Std Order X1 X2 固體物濃度 (%) 硫片添加量 (%) 6 1 1 4.34 3.50 4 1.414 0 5.00 2.30 9 0 0 2.75 2.30 11 0 0 2.75 2.30 2 -1 -1 1.16 1.00 8 0 1.414 2.75 4.00 1 -1.414 0 0.50 2.30 3 0 -1.414 2.75 0.50 5 -1 1 1.16 3.50 10 0 0 2.75 2.30 7 1 -1 4.34 1.00
(7) 將聚合隔夜的溶液以 10000 rpm 離心 30 分鐘,所得沉澱物用蒸餾水
沖入試管中,置於攝氏零下800C 冷凍櫃結冰。
(8) 冰狀試樣用冷凍乾燥機使之乾燥脫水 24 小時以上。
(9) 乾燥後的試樣稱重,並重新溶入定量水中,以進行其他分析。在 電壓穩定的情況下,進行 24 小時即可乾燥完全。
3.7.2 蛋白質定量 (Bradford protein-binding assay) (1) 標準溶液的配製 :
Electricity 0 1 2 3 4 5
BSA (100 µg/ml) (µl) 160 128 96 64 32 0
Critrate buffer (10 mM) (µl) 0 32 64 96 128 160
Bio-Rad Dye Reagent (µl) 40 40 40 40 40 40
Total volume (µl) 200 200 200 200 200 200
Final concentrarion (µg/ml) 100 80 60 40 20 0
(2) 將配製好的 BSA 標準溶液及樣品加入每一個 well 中,利用酵素免疫
分 光 光 度 計 (Enzyme-Linked Immunofiltration spectrophotometer
Assay, ELISA) 在 595 nm 吸光值之下建立一標準曲線,並藉由之前 所建立出的標準取線來估計為之樣品中蛋白質濃度。
3.8 菌種的鑑定
本 實 驗 使 用 的 方 法 為 螢 光 原 為 雜 交 法 (Fluorescence in situ
Hybridization FISH),其原理為利用微生物 16 rRNA 的保守性,設計只針 對某屬或某種微生物具專一性的螢光探針,將微生物樣本經特殊處理後置
於載玻片上,再加上螢光探針。此經過螢光標示的探針再適宜的雜交條件 下會進入細胞內,與細胞內特定的 rRNA 配對。此探針雜交後會留在該細 胞體內便會產生螢光,置於螢光顯微鏡下便可清楚的觀察出族群分布情形 及依螢光的多寡來決定該微生物族群數量的多寡。能快速同時鑑定多個未 知菌種,而且無須任何培養,此為傳統細菌鑑定所不及的優勢。也可進一 步將微生物定性、定量。其流程圖可見 Figure 3-8。 Figure 3-8 FISH 流程圖 3.8.1 採樣及保存 採樣時必須充分混合,使樣品具有代表性,且在檢驗前不再被污染。使 用清潔並經過滅菌的容器或 Microtubes,及溫度能維持在 00C 至 50C 之 樣品儲存設備。水樣運送及保存之溫度應維持在 00C 至 40C。樣品自採樣 後 至 進 行 固 定 , 其 保 存 時 間 不 得 超 過 24 小 時 。 採 樣 後 立 即 以 4% Paraformaldehyde 固定,並保存於 50% PBS-EtOH (v/v)。 3.8.2 液相螢光原位雜交法步驟 固定 (Fixation) (1) 依 1:3 的體積比進行固定,使用 1.5 mL 的微量離心管加入 0.25 mL 採樣 固定 雜交 清洗 顯像 計數
的污泥與 0.75 mL 100% EtOH 固定 120 分鐘 (on ice)。 (2) 適用 1000 rpm 離心 20 分鐘,使污泥形成 pellet。 (3) 小心倒掉上澄液,加入 1 mL PBS (pH 7.2) 使 pellet 再懸浮。 (4) 步驟 2、3 重覆兩次以去除剩餘的固定劑。 (5) 將樣品保存於 50% PBS-EtOH (v/v)。 (6) 打散污泥:使用針筒 (3 mL-27G) 慢慢抽打污泥 10 次,再用均質器 抽打 10 次。 (7) 分別取 3 µL 固定好的樣品點到 Slide 的 well 上,室溫風乾 (避免污 染)。 (8) 分別將 Slide 浸入 50%、80%、96% (v/v) 的乙醇裡脫水 2 分鐘。 (9) 風乾後,將 Slide 保存於室溫下不受污染處。 雜交 (Hybridization)
(1) 將 16 µL 的 Hybridization buffer (註 1) (% Formamide、0.9 M NaCl、 0.01% SDS、20 mM Tri-HCl buffer (pH 7.2)、DNA probe (50 ng/16µL well) 注入各個雜交井 (50 ng/16 µL well)。
(2) 準備一個 50 mL 尖底離心管,將衛生紙 + Washing buffer (1-2 mL) 沾濕平舖於離心館中 (保濕),以備雜交 (避免被污染)。
(3) 再將 Slide 水平放入離心管,再置於培養箱 460C 下,雜交 1.5 小時
註1: Probe Name Hybridization Buffer Formnmide conc. (%) Washing Buffer NaCl conc. (mM) Reference
S-D-Bact-0338-a-A-18 20% 170 Amann et al.,
1980
S-S-Thio-08200-a-A-22 20% 170 Peceia et al.,
2000
S-S-Thiopa-0511-a-A-18 20% 170
清洗 (Washing)
(1) 取出 Slide 以 1 mL Washing buffer (No Formamide, NaCl, 0.01%
SDS, 20 mM Tris-HCl buffer (pH 8.0)) (480C) 淋洗兩次。
(2) 將雜交管中的衛生紙取出,加入 30-35 mL Washiing buffer,再將 Slide
浸入,480C 培養箱中 20 分鐘。 (3) 取出 Slide 以 1 mL 去離子水淋洗兩次,於室溫下風乾。 DAPI Staining (1) 將 DAPI 染劑 20 µL (1 µg/mL) 加入 well 中,染色 30 分鐘。 (2) 以去離子水淋洗,去除過剩的染劑。 (3) 室溫下烘乾。 一般染色之樣品本應立即觀察,因當時的螢光最顯著;若不能馬上觀 察,需儲存於乾燥盒 (Polyethylene Bag) 內,保存於 0-50C 冰箱內,可 保存一個月左右,仍可呈現螢光。使用直落式螢光顯微鏡對載玻片進行觀
察,以數位相機 (CCD camera) 觀察樣品螢光強度並對其進行分析比較。 3.8.3 固相螢光原位雜交法步驟 預先處理 (1) 取出反應槽中的硫片 (約 3-5 g),以裝入 50 mL 之離心管中,並加入 無菌水 20 mL,以 6000 rpm 離心 20 分鐘。 (2) 離心完後,將上澄液倒出,加入 20 mL 之無菌水,再次以 6000 rpm 離 心20 分鐘。 (3) 重複 1、2 兩步驟,以減少干擾。 (4) 將硫片取出予以研磨,在裝入 50 mL 之離心管中,並加入 20 mL 之 無菌水。 (5) 接下來的步驟皆與液相之螢光原位雜交法步驟相同。
第四章 結果與討論
4.1 畜牧污泥基本特性 污泥樣品取自畜牧業廢水處理廠,厭氧消化槽所產生的污泥;污泥中 基本性質如 Table 4-1 所示;由表中可知,污泥中的有機含量 (VS) 相當 的高,大約佔固體物的1/3 左右;污泥中重金屬以鋅 (4450 ± 141 mg/kg) 的 含量最高,其次為銅 (3500 ± 48.8 mg/kg)、錳 (2450 ± 79.1 mg/kg)、鎳 (910 ± 39.4 mg/kg) 的含量較高,鉛、鉻及鎘的含量都相對較低,因為養猪 飼料中添加銅與鋅等化學鹽類,做為猪隻生長之刺激與調理劑,導致污泥 中銅與鋅的含量特別高;然而草本植物中含有錳,而養猪飼料中多以草本 植物為主,所以錳在污泥中的含量也相當高,如此一來污泥中的重金屬含 量升高,不利於作為農地肥料或土壤改良劑,無法達到資源回收之目的, 對於畜牧場减廢亦無功效。 因為一般污水處理廠中,重金屬的去除大部分在第一階段的沉澱池 中,故廢水中的重金屬絕大部分會沉積在厭氧污泥中。所以污泥中的重金 屬對於資源化為一重大的屏障。Table 4-1 原始污泥的基本性質
Property Values (a)
pH 8.5±0.3 TS (%) 4.82±0.91 VS (%) 1.76±0.32 EC (ms/cm) 4.30±0.18 SS (mg/L) 35800±91.6 VSS (mg/L) 25000±79.5 TOCw (mg/L) 102±0.71 TDS (mg/L) 1920±1.1 Cu (mg/kg) 3500±48.8 Cd (mg/kg) 85.0±3.53 Cr (mg/kg) 104±6.52 Pb (mg/kg) 176±7.42 Zn (mg/kg) 4450±141 Ni (mg/kg) 910±39.4 Mn (mg/kg) 2450±79.1
a: average± standard deviation, n=5
4.2 馴養實驗 在畜牧污泥的馴養實驗中,以監測污泥的 pH 值作為馴養成效之指 標,當污泥的 pH 值降到 2.5 以下,則視為污泥中的野生硫氧化菌已充分 適應污泥環境,且大量生長。因為考慮到之後污泥酸化之影響,所以改採 以硫片來馴養,可有效將硫片加以回收,故在馴養槽中以 TS = 1.5%,S = 1.0% 來進行馴養,Figure 4-1A 中可見到第 1 次馴養的時間較長,所以 要到第 56 天污泥中的 pH 值才會達到 2.52,pH 值降低的趨勢較為緩 和,經過 3-4 次的反覆馴養,污泥中的 pH 值可在 3-4 天內達到 2.5 以
下 (Figure 4-1B),由於經過馴養的硫片上含有硫氧化菌,而硫片受到硫氧 化菌作用反應,造成硫片表面粗糙度提高,所以此時硫片的比表面積以改 變 (Liu et al., 2003),可提供多餘位址讓硫氧化菌吸附在硫片上,如此可有 效加速酸化的速率,並提供硫氧化所適合存在的環境,故此時污泥中之硫 氧化菌已活化至最佳狀況,足以作為生物溶出法之植種。 0 10 20 30 40 50 60 2 3 4 5 6 7 8 9 TS/S: 0.5/1.0 pH Time (d) A 0 2 4 6 8 10 1 2 3 4 5 6 7 8 pH Time (d) First repetition Second repetition Third repetition Fourth repetition Fifth repetition B Figure 4-1 馴養實驗中 pH 值變化情形
4.3 不同固體物濃度及硫片添加量對生物溶出實驗之影響 4.3.1 不同固體物濃度及硫片添加量在生物溶出程序中對 pH、氧化還原電 位 (ORP) 和導電度 (EC) 之影響 在生物溶出程序中,pH、ORP 和 EC 值會隨著固體物濃度及硫片添 加量的不同而有所改變。Figure 4-2 為不同操作條件下 pH 值的變化情 形。高固體物濃度會有較高的緩衝能力及較長的遲滯期 (Sreekrishnan et al., 1993),硫氧化菌在高固體物濃度下為非優勢菌種,無法在短時間內迅 速產酸,使得污泥中的 pH 下降趨勢緩慢。TS=5.0%、S=2.3% 在 20 天 內都無法將 pH 降到 2.5,而是維持在 pH 3.21 左右;在低固體物濃度 TS=0.5%、S=2.3%,在第 4 天 pH 值就降至 2.5 左右,相當迅速; TS=1.16%、S=1.0% 和 TS=1.16%、S=3.5%,在第 8 天 pH 值就降至 2.36 和 2.96,亦是相當迅速的;TS=2.75%、S=2.3%,TS=2.75%、S=1.0% 和 TS=2.75%、S=4.0%,分別在第 14 天 pH 值就降至 2.5 左右; TS=4.34.%、S=1.0% 和 TS=4.34%、S=3.5%,前者是無法使 pH 值下降 至 2.5 左右,而一直維持在 pH 5.82,其原因為硫片添加量不足,無法提 供充足的基質,故 pH 值無法有效下降;而後者在第 12 天 pH 值就降至 2.5 左右。故由上述可知,必須同時考慮到固體物濃度及硫片添加量的情 形,方能使硫氧化菌有效地產酸,同時使 pH 值是快速達到 2.5 以下。 Figure 4-3 為不同操作條件下 ORP 值得變化情形。在低固體物濃度
TS=0.5%、S=2.3%,在第 6 天 ORP 值就上升至 450 mv 左右,顯示硫 氧化菌能快速適應環境;TS=1.16%、S=1.0% 和 TS=1.16%、S=3.5%, 在第 8 天和第 12 天 ORP 值就達到 455 mv 和 451 mv;TS=2.75%、 S=2.3%,TS=2.75%、S=1.0% 和 TS=2.75%、S=4.0%,分別在第 14 天、 第 16 天和第 20 天 ORP 值就達到 455 mv、457 mv 和 450 mv; TS=4.34.%、S=1.0% 和 TS=4.34%、S=3.5%,前者在 20 天內均無法使 ORP 值達到 450 mv,而後者在第 14 天就能使 ORP 值達到 499 mv; 在高固體物濃度TS=5.0%、S=2.3%,在 20 天內無法使 ORP 值達到 450 mv,但最終也可以使 ORP 值達到 400 mv 以上。所以在生物溶出程序 中,固體物濃度越低, ORP 值上升趨勢越快速;反之固體物濃度越高, ORP 值上升趨勢越緩慢。所以固體物濃度高低,決定 ORP 值變化趨勢。 Figure 4-4 為不同操作條件下 EC 值得變化情形。在生物溶出法中, 添加硫片作為基值提供微生物所需的能量,而硫氧化菌氧化硫片導致 pH 值下降,同時溶液中存在大量的 H+、SO42- 及金屬離子,故量測 EC 值亦 可作為一種指標。在低固體物濃度TS=0.5%、S=2.3%,在第 8 天 EC 值 就上升至 23.8 ms/cm 左右; TS=1.16%、S=1.0% 和 TS=1.16%、 S=3.5%,在第 12 天 EC 值就達到 42.8 ms/cm 和 67.5 ms/cm; TS=2.75%、S=2.3%,TS=2.75%、S=1.0% 和 TS=2.75%、S=4.0%,分 別在第 14 天、第 16 天和第 18 天 EC 值就達到 22.5 ms/cm、23.5
ms/cm 和 25.78 ms/cm;TS=4.34.%、S=1.0% 和 TS=4.34%、S=3.5%, 前者在 20 天內均無法使 EC 值達到 20 ms/cm,而後者在第 12 天就能 使 EC 值達到 25.5 ms/cm;在高固體物濃度 TS=5.0%、S=2.3% 和 TS=4.34%、S=1.0%,在 20 天內均無法使 EC 值大量提升,也就是溶液
中的 H+、SO42- 及金屬離子含量較低,及經 bioleaching process 後效果
不彰。 0 5 10 15 20 1 2 3 4 5 6 7 8 9 pH Time (d) TS/S: 0.5/2.3 TS/S: 1.16/1.0 TS/S: 2.75/2.3 TS/S: 2.75/1.0 TS/S: 5.0/2.3 TS/S: 1.16/3.5 TS/S: 4.34/1.0 TS/S: 4.34/3.5 TS/S: 2.75/4.0 Figure 4-2 生物溶出法中 pH 值變化情形
0 5 10 15 20 -300 -200 -100 0 100 200 300 400 500 600 ORP (mv ) Time (d) TS/S: 0.5/2.3 TS/S: 1.16/1.0 TS/S: 2.75/2.3 TS/S: 2.75/0.5 TS/S: 5.0/2.3 TS/S: 1.16/3.5 TS/S: 4.34/1.0 TS/S: 4.34/3.5 TS/S: 2.75/4.0 Figure 4-3 生物溶出法中 ORP 值變化情形 0 5 10 15 20 0 20 40 60 80 100 120 EC (ms/cm) Time (d) TS/S: 0.5/2.3 TS/S: 1.16/1.0 TS/S: 2.75/2.3 TS/S: 2.75/0.5 TS/S: 5.0/2.3 TS/S: 1.16/3.5 TS/S: 4.34/1.0 TS/S: 4.34/3.5 TS/S: 2.75/4.0 Figure 4-4 生物溶出法中 EC 值變化情形
4.3.2 不同固體物濃度及硫片添加量在生物溶出程序中對硫酸根產生量之 影響 Figure 4-5 為 SO42- 變化情形,理論上 pH 值越低其硫酸根濃 度會越高,但在 Figure 4-5 中所顯示的並非如此,TS=0.5%、S=2.3%其 pH 值為 1.15,硫酸鹽濃度為 14300 mg/L;而 TS=4.34%、S=3.5% 其 pH 值為 1.57,硫酸鹽濃度為 28400 mg/L。故無明顯的規則,所以硫酸 根產量的多寡並不足以決定 pH 值得高低,還需考慮固體物濃度高低,因 為固體物濃度高低會影響硫氧化菌產酸的能力。但可由 Figure 4-4 和 Figure 4-5 中發現兩者有相同的變化情形,Figure 4-4 中 EC 值濃度由高 到低的變化情形為 6>8>2>1>3>4>9>5>7;而 Figure 4-5 中 SO42- 濃度 由高到低的變化情形為 8>6>3>1>2>4>9>5>7。由上述可知雖然前面幾組 有稍不同,但整體變化情形卻有相同的趨勢,某些實驗組數中其相關係數 高達 99% 以上,可能是的 SO42- 為影響溶液中導電度的最大原因,故以 EC 值 來 作 為 一 種 指 標 也 是 具 有 可 行 性 的 。 (EC/ SO42- 之 相 關 係 數 ---附錄二)
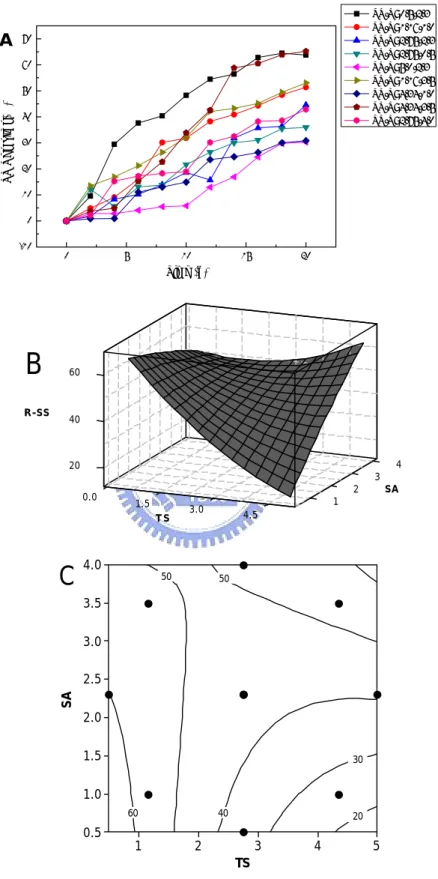
0 5 10 15 20 0 4000 8000 12000 16000 20000 24000 28000 Sulfate (mg/L) Time (d) TS/S: 0.5/2.3 TS/S: 1.16/1.0 TS/S: 2.75/2.3 TS/S: 2.75/0.5 TS/S: 5.0/2.3 TS/S: 1.16/3.5 TS/S: 4.34/1.0 TS/S: 4.34/3.5 TS/S: 2.75/4.0 Figure 4-5 生物溶出法中 SO42- 變化情形 4.3.3 不同固體物濃度及硫片添加量在生物溶出程序中對有機物降解之影 響 利用生物溶出法來使重金屬溶出的同時,有機物會隨著時間的增加而 有所降解,達到消化的作用 (Benmoussa et al., 1994)。Figure 4-6A 為生 物溶出法中懸浮性固體物降解情形,可以看出每一組試驗隨著時間的增加 都有一定程度的降解,其中降解的原因包括生物分解作用與酸溶解作用, 在 pH 值較高的實驗當中,微生物作用佔大部分,而酸溶解作用佔較少部 分;而在 pH 值較低的實驗中則是相反的。Figure 4-6B 和 Figure 4-6C 中 可知固體物濃度在較低的範圍 (0.5-1.0%),且硫片添加量在 0.5-2.0% 時,其降解情形可高達 60% 左右;反之固體物濃度在較高的範圍,若硫 片添加量不足時,其降解情形越差,但反應曲面圖並非為收斂之曲線,這
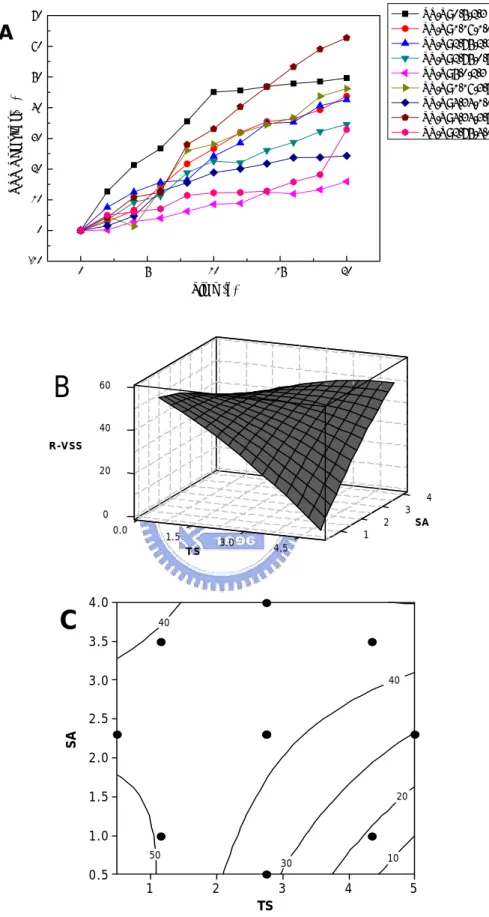
也意謂著無法由反應曲面圖找出最適當之操作範圍。其懸浮性固體物降解 情形如下: TS/S: 0.5/2.3,降解率為 63.73%;TS/S: 1.16/1.0 和 TS/S: 1.16/3.5,分別為 51.39% 和 53.05%;TS/S: 2.75/2.3,TS/S:2.75/1.0 和 TS/S: 2.75/4.0,分別為 44.57%、35.97%和 42.88%;TS/S: 4.34/1.0 和 TS/S: 4.34/3.5,分別為 30.85% 和 65.19%;TS/S: 5.0/2.3,降解率為 30.30% 。在不同操作條件下其懸浮性固體物降解率大約維持在 30-65% 左右,均較活性污泥法降解率來的高 (20-50%) (歐陽嶠暉,下水道工程學 2001)。 Figure 4-7A 為揮發性懸浮固體物降解情形,其 VSS 降解趨勢與 SS 降解趨勢大致相同,一樣會隨著時間增加而有一定程度的將解效果。Figure 4-7B 和 Figure 4-7C 中可知固體物濃度在較低的範圍 (0.5-1.0%),只要 硫片添加量足夠時 (0.5-1.5%),其降解情形可高達 50% 左右,但反應曲 面圖並非為收斂之曲線,這也意謂著無法由反應曲面圖找出最適當之操作 範圍。其揮發性懸浮性固體物降解情形如下: TS/S: 0.5/2.3,降解率為 49.65% ; TS/S: 1.16/1.0 和 TS/S: 1.16/3.5 , 分 別 為 43.75% 和 46.18%;TS/S: 2.75/2.3,TS/S: 2.75/1.0 和 TS/S: 2.75/4.0,分別為 42.56%、35.56% 和 32.88%;TS/S: 4.34/1.0 和 TS/S: 4.34/3.5,分別 為24.29% 和 62.75%;TS/S: 5.0/2.3,降解率為 15.93%。在不同操作條 件下其揮發性懸浮固體物降解率大約維持在 15-62% 左右,均較活性污泥
法降解率來的高。 0 5 10 15 20 -10 0 10 20 30 40 50 60 70 SS R e mo va l (% ) Time (d) TS/S: 0.5/2.3 TS/S: 1.16/1.0 TS/S: 2.75/2.3 TS/S: 2.75/0.5 TS/S: 5.0/2.3 TS/S: 1.16/3.5 TS/S: 4.34/1.0 TS/S: 4.34/3.5 TS/S: 2.75/4.0 A 3 4 R-SS 20 40 2 SA 60 0.0 1 1.5 3.0 4.5 T S
B
TS SA 60 50 50 40 30 20 5 4 3 2 1 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5C
Figure 4-6 生物溶出法中 SS 變化情形 (A) SS Removal (B) Surface (C) Contour plots
0 5 10 15 20 -10 0 10 20 30 40 50 60 70 VS S Remo val (%) Time (d) TS/S: 0.5/2.3 TS/S: 1.16/1.0 TS/S: 2.75/2.3 TS/S: 2.75/0.5 TS/S: 5.0/2.3 TS/S: 1.16/3.5 TS/S: 4.34/1.0 TS/S: 4.34/3.5 TS/S: 2.75/4.0 A 3 4 0 R-VSS 20 2 SA 40 60 0.0 1 1.5 3.0 4.5 T S
B
TS SA 50 40 40 30 20 10 5 4 3 2 1 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5C
Figure 4-7 生物溶出法中 VSS 變化情形 (A) VSS Removal (B) Surface plot (C) Contours plot
4.4 生物溶出實驗 4.4.1 重金屬溶出效率
因為銅容易在固體物濃度較高的情形下與有機物錯合 (Tyagi et al., 1992),故重金屬溶出效果並不佳,所以在低固體物濃度下銅的溶出效率較
佳。Figure 4-8A 為銅在 Bioleaching 程序中銅的反應曲面圖,從彎曲的幅
度歸納出固體物濃度對銅的溶出率影響較大,隨著固體物濃度增加也就是 有機物含量的增加,銅的溶出率比低固體物濃度時的溶出效果來的差,暗 示有機物含量越高將會對銅的溶出效果影響越大。Figure 4-8B 為高線圖, 其為收斂曲線,這也意謂著由等高線圖即可找出最適之操作範圍,只要將 固體物濃度控制在 0.5-1.5% 且硫片添加量在 0.5-2.0% 之間時,銅的溶 出率即可達到95% 以上。 銅的溶出率結果如下: TS/S: 0.5/2.3,溶出率為 98.89% ; TS/S: 1.16/1.0 和 TS/S: 1.16/3.5 , 分 別 為 95.74% 和 96.88%;TS/S: 2.75/2.3,TS/S: 2.75/1.0 和 TS/S: 2.75/4.0,分別為 94.88%、80.74% 和 76.31%;TS/S: 4.34/1.0 和 TS/S: 4.34/3.5,分別 為 29.29% 和 76.02%; TS/S: 5.0/2.3,溶出率為 34.81%。而重金屬溶 出效率從 30-100% 左右,其中有如此大的差距,除了與固體物濃度高低 有關之外,還有一重要因素為 pH 值;在 pH 值越低的情況之下,反應溶 液中才會有足夠的 H+ 離子與重金屬進行置換作用。(各重金屬之溶出效率 ---附錄三)
3 4 Cu 0 40 2 SA 80 120 0.0 1.5 1 3.0 4.5 T S
A
TS SA 100 80 80 60 40 20 5 4 3 2 1 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5B
Figure 4-8 生物溶出法中銅變化情形 (A) Surface plot (B) Controus plot
Figure 4-9A 為鎘的反應曲面圖,從彎曲的幅度可歸納出固體物濃度對 鎘的溶出率影響較大,隨著固體物濃度增加也就是有機物含量的增加,鎘 的溶出率比低固體物濃度時的溶出效果來的差,暗示有機物含量越高將會 對鎘的溶出效果影響越大。但仍需考慮到硫的添加量,因為硫添加量多寡 對於 pH 下降有一定的影響,所以鎘在 Bioleaching 程序中溶出的最重要 因子為 pH 值,pH 值越低其溶出效果越佳。Figure 4-9B 為高線圖部份,
其為收斂曲線,可由等高線圖找出最適當之操作範圍,只要將固體物濃度 控制在 0.5-1.5% 且硫片添加量在 0.5-2.0% 之間時,鎘的溶出率即可達 到95% 以上。鎘的溶出率結果如下: TS/S: 0.5/2.3,溶出率為 98.23%; TS/S: 1.16/1.0 和 TS/S: 1.16/3.5,分別為 95.29% 和 94.23%;TS/S: 2.75/2.3,TS/S: 2.75/1.0 和 TS/S: 2.75/4.0,分別為 85.29%、79.88% 和 61.67% ; TS/S: 4.34/1.0 和 TS/S: 4.34/3.5 , 分 別 為 23.52% 和 71.41%;TS/S: 5.0/2.3,溶出率為 24.70%。 3 4 Cd 0 40 2 SA 80 120 0.0 1.5 1 3.0 4.5 T S
A
TS SA 100 80 60 40 20 5 4 3 2 1 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5B
因為鉻屬於較難去除的重金屬,需在極酸的條件下 (pH 1.3) 才可達到 較高的去除率 (Sreekrishnan et al., 1996);隨著固體物的增加,鉻會與有
機物形成 Cr3(SO4)2的錯合物,而降低溶出效果。Figure 4-10A 為鉻的反
應曲面圖,從彎曲的幅度可歸納出固體物濃度對鉻的溶出率影響較大,隨 著固體物濃度增加鉻的溶出率比低固體物濃度時的溶出效果來的差,暗示 有機物含量越高將會對鉻的溶出效果影響越大。但硫添加量多寡對於 pH 下降有一定的影響,所以如何讓 pH 在極酸的條件下 (pH 1.3) 是對鉻溶出 效果最大影響因子。Figure 4-10B 為高線圖部份,其為收斂曲線,這也意 謂著由等高線圖即可找出最適之操作範圍,只要將固體物濃度控制在 0.5-1.0% 且硫片添加量在 1.0-2.0% 之間時,鉻的溶出率即可達到 95% 以上。鉻的溶出率結果如下: TS/S: 0.5/2.3,溶出率為 91.83%;TS/S: 1.16/1.0 和 TS/S: 1.16/3.5 , 分 別 為 90.58% 和 69.71% ; TS/S: 2.75/2.3,TS/S: 2.75/1.0 和 TS/S: 2.75/4.0,分別為 35.58%、31.25% 和 24.04%;TS/S: 4.34/1.0 和 TS/S: 4.34/3.5,分別為 11.54% 和 33.74%; TS/S: 5.0/2.3,溶出率為 13.46%。
3 4 0 Cr 40 2 SA 80 120 0.0 1 1.5 3.0 4.5 T S
A
TS SA 100 80 60 40 20 0 5 4 3 2 1 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5B
Figure 4-10 生物溶出法中鉻變化情形 (A) Surface plot (B) Contours plot
鉛 容 易 與 硫 酸 根 離 子 形 成 溶 解 度 低 的 硫 酸 鉛 PbSO4 (Ksp=
1.62×108 ),再加上鉛易與有機物結合形成難溶解性錯合物,所以通常鉛的
溶出效果並不佳 (Tyagi 1992; Chen and Lin 2001)。Figure 4-11A 為鉛的 反應曲面圖,從彎曲的幅度可歸納出固體物濃度對鉛的溶出率影響較大, 隨著固體物濃度增加鉛的溶出率比低固體物濃度時的溶出效果來的差,及 有機物含量越高將會對鉛的溶出效果影響越大。Figure 4-11B 為高線圖部
份,其為收斂曲線,這也意謂著由等高線圖即可找出最適之操作範圍,只 要將固體物濃度控制在 0.5-1.0% 且硫片添加量在 1.0-2.0% 之間時,鉛 的溶出率即可達到 50% 以上。鉛的溶出率結果如下: TS/S: 0.5/2.3,溶出 率為 52.56%;TS/S: 1.16/1.0 和 TS/S: 1.16/3.5,分別為 46.14% 和 46.88%;TS/S: 2.75/2.3,TS/S: 2.75/1.0 和 TS/S: 2.75/4.0,分別為 39.26%、38.35% 和 33.52%;TS/S: 4.34/1.0 和 TS/S: 4.34/3.5,分別 為 17.89% 和 28.32%;TS/S: 5.0/2.3,溶出率為 23.86%。 3 4 P b 20 32 2 SA 44 56 0.0 1.5 1 3.0 4.5 T S
A
TS SA 50 40 30 20 5 4 3 2 1 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5B
Figure 4-11 生物溶出法中鉛變化情形 (A) Surface plot (B) Contours plot
鋅在 Bioleaching 程序中,並不會受到固體物濃度高低影響,而導致 鋅溶出效果不佳,但溶出的時間點會有明顯的差別,pH 值下降越快,溶出 效果越佳。 Figure 4-12A 為反應曲面圖部分,從彎曲的幅度可歸納出固體 物濃度對鉛的溶出率影響較大,隨著固體物濃度增加鋅的溶出率比低固體 物濃度時的溶出效果來的差。Figure 4-12B 為高線圖部份,其為收斂曲線, 這也意謂著由等高線圖即可找出最適之操作範圍,只要將固體物濃度控制 在 0.5-2.0% 且硫片添加量在 0.5-2.0% 之間時,鋅的溶出率即可達到 95% 以上。鋅的溶出率結果如下: TS/S: 0.5/2.3,溶出率為 99.55%;TS/S: 1.16/1.0 和 TS/S: 1.16/3.5 , 分 別 為 97.75% 和 99.77% ; TS/S: 2.75/2.3,TS/S: 2.75/1.0 和 TS/S: 2.75/4.0,分別為 97.52%、94.38% 和 88.89% ; TS/S: 4.34/1.0 和 TS/S: 4.34/3.5 , 分 別 為 42.45% 和 91.07%;TS/S: 5.0/2.3,溶出率為 23.86%。只有 2 組並未達到較好的溶 出結果,主要是因為 pH 值並未有效下降至 2.5 左右,才導致結果不佳。 鎳在 Bioleaching 程序中為較容易溶出的金屬,只要 pH 值降低,污 泥中的重金屬就可輕易溶出。Figure 4-13A 為反應曲面圖部分,從彎曲的 幅度可歸納出固體物濃度對鉻的溶出率影響較大,隨著固體物濃度增加鉻 的溶出率比低固體物濃度時的溶出效果來的差,暗示有機物含量越高將會 對鉻的溶出效果影響越大。
3 4 Zn 30 60 2 SA 90 120 0.0 1 1.5 3.0 4.5 T S
A
TS SA 100 80 60 40 5 4 3 2 1 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5B
Figure 4-12 生物溶出法中鋅變化情形 (A) Surface plot (B) Contours plot Figure 4-13B 為等高線圖部份,其為收斂之曲線,這也意謂著由等高 線圖即可找出最適之操作範圍,只要將固體物濃度控制在 0.5-1.5% 且硫 片添加量在 0.5-2.0% 之間時,鎳的溶出率即可達到 95% 以上。鎳的溶 出率結果如下: TS/S: 0.5/2.3,溶出率為 98.90%;TS/S: 1.16/1.0 和 TS/S: 1.16/3.5,分別為 98.35% 和 98.90%;TS/S: 2.75/2.3,TS/S: 2.75/1.0 和 TS/S: 2.75/4.0,分別為 96.26%、93.96% 和 87.91%;TS/S: 4.34/1.0 和
TS/S: 4.34/3.5,分別為 54.28% 和 86.69%;TS/S: 5.0/2.3,溶出率為 69.23%。 3 4 40 Ni 60 80 2 SA 100 0.0 1.5 1 3.0 4.5 T S
A
TS SA 100 90 90 80 70 60 50 5 4 3 2 1 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5B
Figure 4-13 生物溶出法中鎳變化情形 (A) Surface plot (B) Contours plot
錳在 Bioleaching 程序中溶出的情形,固體物濃度高低並不會影響錳
的溶出結果,但溶出的時間點有明顯的差別,pH 值下降越快,溶出效果越
的溶出率影響較大,隨著固體物濃度增加鉻的溶出率比低固體物濃度時的 溶出效果來的差,意味著有機物含量越高將會對鉻的溶出效果影響越大。 Figure 4-14B 為高線圖部份,其為收斂之曲線,這也意謂著由等高線圖即 可找出最適之操作範圍,只要將固體物濃度控制在 0.5-2.0% 且硫片添加 量在 0.5-2.0% 之間時,鎳的溶出率即可達到 95% 以上。錳的最佳溶出 率結果如下: TS/S: 0.5/2.3,溶出率為 99.79%;TS/S: 1.16/1.0 和 TS/S: 1.16/3.5,分別為 99.59% 和 92.48%;TS/S: 2.75/2.3,TS/S: 2.75/1.0 和 TS/S: 2.75/4.0,分別為 97.14%、91.42% 和 87.95%;TS/S: 4.34/1.0 和 TS/S: 4.34/3.5,分別為 24.49% 和 83.35%;TS/S: 5.0/2.3,溶出率為 34.26%。只有 2 組並未達到較好的溶出結果,是因為 pH 值並未有效下 降至 2.5 左右,所以導致溶出結果不佳。 所以以污泥中重金屬含量較高的銅、鋅和鎳為指標,將固體物濃度控 制在 0.5-2.0% 且硫片添加量在 0.5-2.0% 之間時,鎳的溶出率即可達到 95% 以上。Table 4-2 為生物溶出法後污泥中重金屬含量,各個重金屬溶 出效率除了 TS/S: 5.0/2.3 和 TS/S: 4.34/1.0 這兩組之外,皆有達到良好 的去除結果;而 Table 4-3 為各國污泥中重金屬含量法規標準,同樣的在 扣除 TS/S: 5.0/2.3 和 TS/S: 4.34/1.0 這兩組之外,其他組數也可符合各 國法規標準。
3 4 Mn 0 40 2 SA 80 120 0.0 1 1.5 3.0 4.5 T S
A
TS SA 100 80 80 60 40 20 0 5 4 3 2 1 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5B
Figure 4-14 生物溶出法中錳變化情形 (A) Mn Solubilization (B) Surface plot 4.4.2 連續萃取試驗 經過生物溶出法後,各個重金屬鍵結情形會有明顯改變,以 Figure 4-15 為例:銅容易與有機物進行鍵結,而原始污泥中含有大量的有機物, 但隨著有機物的減少,鍵結在有機物相的重金屬也隨之減少,反而轉向鐵-錳氧化相和碳酸鹽相;由 Figure 4-16 可知鎘與銅有相同的結果;由 Figure 4-17 和 Figure 4-18 可知鉻與鉛在生物溶出反應前是以鐵-錳氧化