一氧化碳毒化現象對PEMFC性能影響之暫態分析
全文
(2) 一氧化碳毒化現象對 PEMFC 性能影響 之暫態分析 Transient Analysis of CO Posioning Effect on the Performance of PEMFC 研 究 生:廖為琦. Student:Wei-Chi Liao. 指導教授:曲新生. Advisor:Hsin-Sen Chu. 國 立 交 通 大 學 機 械 工 程 學 系 碩 士 論 文. A Thesis Submitted to Department of Mechanical Engineering National Chiao Tung University In Partial Fulfillment of the Requirements For the Degree of Master In Mechanical Engineering June 2004 Hsinchu, Taiwan, Republic of China. 中華民國 九十四 年 六 月.
(3)
(4) 一氧化碳毒化現象對 PEMFC 性能影響 之暫態分析 研究生:廖為琦. 指導教授:曲新生. 國立交通大學機械工程學系. 摘要 本文使用數值模擬的方式,探討質子交換模燃料電池在陽極觸媒 層受到一氧化碳毒化後,其內部氫氣、一氧化碳之濃度、白金表面覆 蓋率、電流密度分佈的暫態行為。在陽極觸媒層內,由於一氧化碳會 與白金形成穩定的鍵結,造成氫氣的使用率下降,因此主要是考慮氫 氣與一氧化碳因吸附、脫附以及電化學氧化行為造成在白金表面覆蓋 率的改變,進而影響到電池的性能。研究中主要是改變不同的一氧化 碳濃度、觸媒層厚度以及孔隙率,來探討不同條件對於電池內部所產 生之現象。 研究結果顯示,當所通入的一氧化碳濃度達 100ppm 時,造成電 池性能衰退了 74.7%,比 25ppm 時,多下降了 22.3%,而且到達穩態 的時間減少了 405 秒。在改變觸媒層厚度的情況之下,發現通入 10ppm 之一氧化碳時,觸媒層厚度在 5~16µm,性能表現最好。至於孔隙率 方面,孔隙率越大(0.5),性能越好,尤其是在通入越低的一氧化碳濃 度(10ppm)時,效果越明顯。. i.
(5) Transient Analysis of CO Posioning Effect on the Performance of PEMFC. Student:Wei-Chi Liao. Advisor:Hsin-Sen Chu. Department of Mechanical Engineering National Chiao Tung University. Abstract A one-dimensional, isothermal, transient mathematical model is applied to simulate the CO poisoning effects on the performance of the proton exchange membrane. CO poisons the anode reaction through preferentially adsorbing to the platinum surface and blocking active sites of hydrogen.This phenomena is described with adsorption, desorption, and electro-oxidation of CO and hydrogen. Our discussion focuses on the effects of different CO concentrations, catalyst layer thickness, and catalyst layer porosity on the performance of PEMFC. The results show that with 100ppm CO injected into the catalyst layer, the current densities is 74.7% lower than that before the poisoning process. With 25ppm CO, the performance drop is 52.4%, and the time needed to reach steady state is 405 seconds longer than that of 100ppm CO. In the situation of different catalyst layer thickness, it was found that with 10ppm CO fed into the catalyst layer, the thickness rage form 5 to 16µm has the best performance. Moreover, with larger porosity (0.5), the performance of the cell is better. It is seen obviously at lower CO concentrations (10ppm).. ii.
(6) 誌. 謝. 在研究所裡求學的期間,感謝吾師. 曲新生不辭辛勞地指導,不. 管是在課業以及生活上,均讓學生受益良多,尤其是從事研究的過程 中,所應抱持的求學態度與解決問題的方法,讓學生得以順利完成論 文。 感謝陳發林教授、宋齊有教授、嚴維謀教授以及鄭金祥教授,在 口試時所提出的建議以及平時在學業上的指正與教導。另外,感謝實 驗室裡學長姐世國、時明、建評學長及純怡,在課業與生活上的照顧。 還有實驗室同學聖琰、東洲和學弟們在課業上的互相討論,在課業之 餘一起運動,讓我在研究所的生活能更充實。 最後感謝我的家人,因為他們的支持,讓我能全心全意投入學業 當中。. iii.
(7) 目. 錄. 中文摘要 ................................................................ i 英文摘要 ............................................................... ii 誌謝 ...................................................................... iii 目錄 ...................................................................... iv 表目錄 .................................................................. vi 圖目錄 ..................................................................vii 符號說明 ............................................................... x. 一、緒論 .............................................................. 1 1.1 燃料電池簡介..................................................1 1.2 燃料電池的種類..............................................2 1.2.1 液態電解質燃料電池 ...................................... 2 1.2.2 固態電解質燃料電池 ...................................... 4. 1.3 燃料電池的基本原理......................................6 1.4 文獻回顧..........................................................9 1.5 研究動機及目的............................................ 14. 二、理論分析 .................................................... 20 2.1 一氧化碳毒化之數學模式介紹 ..........................20. iv.
(8) 2.2 基本假設.........................................................................22 2.3 統御方程式 ............................................... 23 2.3.1 濃度分佈 ........................................................ 23 2.3.2 觸媒表面積覆蓋率 ........................................ 24 2.3.3 電流密度分佈 ................................................ 25. 2.4 起始條件 .................................................. 25 2.5 邊界條件 .................................................. 26. 三、數值方法 .................................................... 28 3.1 有限差分法..................................................... 28 3.2 穩態條件........................................................ 30. 四、結果與討論................................................ 33 4.1 一氧化碳濃度效應 .................................... 33 4.2 觸媒層厚度效應........................................ 37 4.3 觸媒層孔隙率效應 .................................... 38. 五、結論與建議................................................ 62 5.1 結論 .......................................................... 62 5.2 建議 .......................................................... 63. 參考文獻 ............................................................. 64. v.
(9) 表 目 錄 表 4-1 基本操作參數.......................................................... 39. vi.
(10) 圖 目 錄 圖 1-1 燃料電池應用範圍概括圖(工研院能資所提供) ...................16 圖 1-2 燃料電池示意圖 ......................................................................17 圖 1-3 質子交換膜燃料電池各組件立體示意圖..............................18 圖 1-4 理想與真實之極化性能曲線圖 ..............................................19 圖 2-1 PEMFC 單電池五層結構之物理模型示意圖........................27 圖 3-1 Explicit Method 格點分佈示意圖..........................................31 圖 3-2 Implicit Method 格點示意圖..................................................32 圖 4-1 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,CO濃度 0 ppm, 觸媒層內氫氣濃度之穩態分佈圖 ..........................................40 圖 4-2 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,CO濃度 0 ppm, 觸媒層內氫氣覆蓋率之穩態分佈圖 ......................................41 圖 4-3 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,CO濃度 0 ppm, 觸媒層內電流密度之穩態分佈圖 ..........................................42 圖 4-4 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,CO濃度 100 ppm,觸媒層內氫氣濃度分佈隨時間之變化圖 ...................43 圖 4-5 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,CO濃度 100 ppm,觸媒層內一氧化碳濃度分佈隨時間之變化圖 ...........44 圖 4-6 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,CO濃度 100 ppm,觸媒層內氫氣覆蓋率分佈隨時間之變化圖 ...............45 圖 4-7 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,CO濃度 100 ppm,觸媒層內一氧化碳覆蓋率分佈隨時間之變化圖 .......46 vii.
(11) 圖 4-8 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,CO濃度 100 ppm,觸媒層內氫氣產生之電流密度分佈隨時間之變化圖 ... ...................................................................................................47 圖 4-9 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,CO濃度 100 ppm,觸媒層內CO產生之電流密度分佈隨時間之變化圖 ..... ...................................................................................................48 圖 4-10 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,不同CO濃度 下,觸媒層內氫氣濃度之穩態分佈圖 ..................................49 圖 4-11 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,不同CO濃度 下,觸媒層內CO濃度之穩態分佈圖.....................................50 圖 4-12 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,不同CO濃度 下,觸媒層內氫氣覆蓋率之穩態分佈圖 ..............................51 圖 4-13 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,不同CO濃度 下,觸媒層內CO覆蓋率之穩態分佈圖.................................52 圖 4-14 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,不同CO濃度 下,觸媒層內電流密度之穩態分佈圖 ..................................53 圖 4-15 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,到達穩態時, 觸媒層內CO濃度與電流密度之關係圖.................................54 圖 4-16 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,到達穩態時, 觸媒層內CO濃度與到達穩態時間之關係圖.........................55 圖 4-17 操作條件為η a = 0.01V,ε c = 0.4,L c = 20µm,不同CO濃度 下,觸媒層內電流密度之穩態分佈圖 ..................................56 圖 4-18 操作條件為η a = 0.01V,ε c = 0.4,CO濃度 10 ppm,到達穩 viii.
(12) 態時,觸媒層厚度與電流密度之關係圖 ..............................57 圖 4-19 操作條件為η a = 0.01V,ε c = 0.4,CO濃度 10 ppm,到達穩 態時,觸媒層厚度與電流密度之關係圖 ..............................58 圖 4-20 操作條件為η a = 0.01V,CO濃度 10 ppm,不同ε c下,到達穩 態時,觸媒層距離與電流密度之關係圖 ..............................59 圖 4-21 操作條件為η a = 0.01V,CO濃度 50 ppm,不同ε c下,到達穩 態時,觸媒層距離與電流密度之關係圖 ..............................60 圖 4-22 操作條件為η a = 0.01V,CO濃度 10 ppm,不同ε c下,到達穩 態時,觸媒層距離與電流密度之關係圖 ..............................61. ix.
(13) 符號說明 a:每單位體積觸媒所含有之表面積(cm2/cm3) bfH:氫氣脫附之速率常數(atm) bfCO:一氧化碳脫附之速率常數(atm) C:濃度(mole/cm3) D:擴散係數(cm2/s). ∆EH:活化能(J/mol) F:法拉第常數(Faraday constant) (C/mol). ∆Gf:吉柏自由能(Gibbs free energy) (J/mol) i:電流密度(A/cm2) I:操作電流密度(A/cm2) keH:氫氣電化學反應之速率常數(A/cm2) keCO:一氧化碳電化學反應之速率常數(A/cm2) kfH:氫氣吸附之速率常數(A/cm2 atm) kfCO:一氧化碳吸附之速率常數(A/cm2 atm) Lc:與觸媒層入口處之間的距離(µm) n:電子數 P:壓力(atm) R:理想氣體常數(J/mol K) s:化學計量數. x.
(14) T:溫度(K) t:時間(s) Uo:開迴路電壓(V) V:電位(V) X:莫耳分率 z:位置座標(µm). 希臘字母 α:傳輸係數 ε:孔隙率 θ:觸媒表面積覆蓋率 ξ:莫耳面積密度乘以法拉第常數 φ:電位(V) η:過電位(V) κ:質子傳導係數(mΩ/cm) σ:電子傳導係數(mΩ/cm). 上標 0:起始值 c:觸媒層. xi.
(15) in:觸媒層入口(z=0). 下標 0:起始值 anode:陽極 act:活化極化(Activation polarization) c:觸媒層 cathode:陰極 CO:一氧化碳 cell:電池 eff:有效值 H2:氫氣 oc:開電路(Open circuit) ohmic:歐姆極化(Ohmic polarization) ss:穩態(steady state). xii.
(16) 一、緒論 1.1 燃料電池簡介 在自然界中能源以各種不同的形式存在,如動能、位能、熱能、 光能、電能和化學能等,而人類利用不同的轉換方式,將這些能量對 外作功以達到我們的需求。最普遍的方式,莫過於經過燃燒的方式, 將物質內之化學能轉換為熱能,再藉由機械裝置轉成功,在燃燒過 後,由於使用機械裝置對作功的關係,因此受限於卡諾循環,造成過 多的能量損失。 傳統的發電方式,如火力發電,即是以燃燒化石燃料的方式,讓 水獲得熱能,再以蒸汽推動氣輪機作功,不過在發電過程中所排放之 二氧化碳、氮的氧化物及煙塵等,卻對環境造成污染。核能發電之發 電原理與火力發電相似,不過熱能的來源,是以鈾 235 進行核分裂反 應產生,發電成本相較火力發電來的低,而且減輕了空氣污染與過渡 依賴化石燃料的問題,不過發電過後之核廢料處理,卻也面臨難題。 至於太陽能發電與風力發電的方式,則受限於氣候與地理環境,需要 大規模且穩定的發電,才能提供足夠的電量。 地球上的化石燃料蘊藏量有限,根據統計[1],世界上石油的蘊 藏量可再供應人類使 40 年,天然氣 60 年,煤礦 220 年,這些能源終 有枯竭的一天,因此找尋出新的永續能源或者可以更有效率的使用化 石燃料,是目前的當務之急。 燃料電池的出現造就了新的契機,透過觸媒的催化反應只要通入 氫氣和氧氣即會產生水和電,直接將化學能轉換為電和熱,由於不像 燃燒的過程當中,需要使用額外的機械裝置,所以不受限於卡諾循. -1-.
(17) 環,發電效率高達 46 %,是傳統的發電方式所無法比擬的。另外, 燃料電池還具有啟動快速、反應過程安靜、產物水無污染,兼具高效 率與環保等優勢。不過目前氫氣的來源,仍是以化石燃料為主,無法 有效解決化石燃料逐漸枯竭的問題,如果能開發出新的氫能來源,未 來將有機會成為新興的能源。 在商業化方面,燃料電池目前在成本過高以及燃料的供給來源不 便等因素之下,還無法與傳統內燃機在市場上競爭,不過在近幾十年 的努力之下,燃料電池已經可以逐漸應用在發電廠、小型發電機、以 及汽車上,相信在不斷地綜合各個領域的人才並積極投入相關研究 中,燃料電池的商品化將會實現在不久的將來。. 1.2 燃料電池的種類 燃料電池的分類方式主要是以電解質材料的使用與輸入的燃料 不同來區分,分類如下[2]:. 1.2.1 液態電解質燃料電池 (1) 鹼性燃料電池 (Alkaline fuel cell, AFC) 鹼性燃料電池最早是由 Bacon 所發明,大多應用於太空計畫中, 操作溫度約在 70 ~ 200℃。此燃料電池電解質是液態的氫氧化鉀,其 結構分為兩種:有動態地以循環方式來運作,優點是對二氧化碳毒化 的抵抗性高、電解質可不斷循環補充、燃料混合均勻、具冷卻效果以 及帶走反應產物水,而缺點為結構複雜不利於電池的串聯以及擺設方 向的問題。因此改良型的靜態型電解質則是以石棉網支撐氫氧化鉀溶 液,雖然改善了之前的缺點,但對於燃料的選擇卻更加嚴格,供氣非 純氫氧不可,因為一旦二氧化碳進入電解質溶液中,其中和反應會形 -2-.
(18) 成碳酸鉀,降低電池壽命。多孔性電極則是以鎳或氧化鎳來作為主材 料,其電極的反應式為: 陽極:. 2 H 2 + 4OH − ⎯ ⎯→ 4 H 2O + 4e −. (1-3). 陰極:. O 2 + 4e − + H 2O ⎯ ⎯→ 4OH −. (1-4). 鹼性燃料電池是所有燃料電池中效率最高的,但其技術上的困難點在 於無可避免的二氧化碳毒化問題以及石棉網遭到禁用,這些瓶頸一直 無法解決,因次大部分研究單位轉而從事酸性電解質的研究工作。 (2) 磷酸燃料電池 (Phosphoric acid fuel cell, PAFC) 繼鹼性燃料電池之後,磷酸燃料電池是第一個開發出來的商業化 產品。此種燃料電池主要用在固定式的發電廠中,工作從分散發電廠 的電力負擔到負責啟動發電廠都有。其反應式和質子交換膜燃料電池 相同。電解質為純磷酸,在熱、化學與電化學三方面的高穩定性,以 及在運轉溫度下液態磷酸電解質低活潑性等。其電解質以碳化矽為載 體,故在長期運轉下會有腐蝕與電解質洩漏等問題。在電極方面,磷 酸燃料電池所使用的電極與質子交換膜燃料電池的電極結構中,除了 抗水的支撐層設計較嚴密外,其餘皆非常相似。這是為了避免液態的 磷酸電解質跑入電極中,產生電極的氣體輸送孔被電解質淹沒的現 象,而造成效率的降低。 (3) 熔融碳酸鹽燃料電池 (Molten carbonate fuel cell, MCFC) 熔融碳酸鹽燃料電池是從二十世紀中期開始發展的,由於它的運 轉溫度較高(600℃~800℃) ,不僅可以在燃料電池內部進行燃料重組 的過程,還可配合發電廠整體系統的設計將廢熱回收利用以提高其效 率。而且,這麼高的運轉溫度使得電極的化學反應將不再像低溫燃料 電池一般需要貴重的金屬觸媒,故可以降低燃料電池的成本。 -3-.
(19) 熔融碳酸鹽燃料電池的電解質是碳酸鋰和碳酸鈉的熔融混合 液,此電解質存放於鋁酸鋰(LiAlO2)載體中,以維持穩定。在電極方 面,陽極是鎳和鋁的合金,陰極則是氧化鎳,其電極的化學反應式為: 陽極:. 2 H 2 + 2CO32− ⎯ ⎯→ 2 H 2O + 2CO2 + 4e −. (1-5). 陰極:. O 2 + 2CO2 + 4e − ⎯ ⎯→ 2CO32−. (1-6). 熔融碳酸鹽燃料電池雖然不需用到昂貴的金屬觸媒,但由於它運轉時 的溫度較高,在燃料電池的材料選擇方面需要考慮到因溫度而產生的 一些附帶性的影響,像是熱膨脹、熱應力等問題。而目前能使用的材 料,像是鉻、鐵、鎳的合金,造價都非常昂貴,因此在材料的價格方 面也是待克服的問題。. 1.2.2 固態電解質燃料電池 (1) 質 子 交 換 膜 燃 料 電 池 (Proton exchange membrane fuel cell, PEMFC) 質子交換膜燃料電池,也稱之為固態聚合物電解質燃料電池 (Solid polymer electrolyte fuel cell),是以質子交換膜作為電解質。此 種燃料電池是一種低溫的燃料電池,通常操作溫度在 65℃~80℃。 質子交換膜燃料電池的兩電極皆是多孔性的氣體擴散電極,以確 保燃料與氧化劑可充分的供應到觸媒層以產生反應。在電極與質子交 換膜交界面塗著一層白金觸媒以促使化學反應產生,如同先前提到一 氧化碳的問題,除了加入釕(Ru)金屬外,還可將氫氣改為過氧化氫, 或是在氫氣中混入空氣以使一氧化碳氧化成二氧化碳。最新的方法是 提供一電流脈衝給電極,迫使一氧化碳氧化。 除了毒化問題之外,水管理的問題也不容忽視,燃料電池內部過. -4-.
(20) 多或過少的水都會對電池性能造成不良的影響,過多的液態水會使得 擴散層的氣孔被淹沒的現象,而太少的水分則不利於質子的傳導,目 前水管理的解決方案有使用加濕器來控制電池內部的含水量,以及交 叉流道的設計也有利於液態水的排除。 (2) 直接甲醇燃料電池 (Direct methanol fuel cell, DMFC) 結構大致上與質子交換模燃料電池相似,在燃料方面是直接以甲 醇水溶液作為燃料,因此稱為直接甲醇燃料電池,因為甲醇較氫氣容 易取得,而且不像 PEMFC 的附加設備佔空間,因此攜帶型或微小化 的燃料電池多屬此類。其薄膜分為兩種,一種是質子交換模,另一種 則和鹼性燃料電池相似,以氫氧根作為離子交換,缺點和鹼性燃料電 池一樣,在地面上無法避免二氧化碳與氫氧根的結合,因此現今薄膜 大多採用質子交換模,。 由於甲醇燃料電池是沿用質子交換膜燃料電池的結構,薄膜的部 分無法阻止甲醇的滲透,故會產生甲醇從陽極跑到陰極和陰極觸媒反 應的情形,稱為甲醇橫越現象(Methanol crossover)。目前解決的方法 有:(i)增加厚薄膜厚度(ii)將陰極的觸媒換成不會和甲醇反應的觸媒。 甲醇的化學式CH3OH,在觸媒層進行電化學反應的過程中,甲醇 會吸附到白金表面,與白金作用後,再一一將氫離子脫附出來,但在 四個氫離子脫附之後,一氧化碳與Pt形成穩定的鍵結,造成Pt無法再 跟甲醇分子結合,陽極使用氧化能力較強的Ru與Pt雙元合金可降低一 氧化碳毒化觸媒層的能力。 (3) 固態氧化物燃料電池 (Solid oxide fuel cell, SOFC) SOFC 的電解質為固態的氧化鋯,因此是固態與氣態的兩相系 統,不會產生觸媒層被淹沒、氧氣還原反應速度緩慢等問題。SOFC -5-.
(21) 的運轉溫度較高(800℃~1000℃),不但不需昂貴的觸媒,還可利用 其高溫進行內部燃料重組過程,可惜較難找到合適且便宜的材料來製 造。在電極方面,陽極為鎳與陶瓷的混合材料(YSZ-Ni),陰極為 P 型 的半導體材料,其電極的電化學反應式為: 陽極:. 2CO + 2O 2− ⎯ ⎯→ 2CO2 + 4e −. (1-7). 陰極:. O 2 + 4e − ⎯ ⎯→ 2O 2−. (1-8). 在 SOFC 的串連設計上有平板式和圓管式兩種。平板式的優點 為:成本較低、效率較高、組裝容易。缺點為:不易找到好的連接材 料與密封劑。圓管式的優點為:不需要密封劑,且有較高的穩定性。 在這六種燃料電池中,質子交換膜燃料電池由於在低溫時具有較 高的能源密度、啟動快速、無污染、無腐蝕性電解質溢出之危險以及 所需空間較小等優點,故適用於車輛的動力裝置和小型的家用發電機 等,因此近年來成為燃料電池研發工作的重點。圖 1-1 所示為各種燃 料電池應用範圍之概括圖,由圖可看出,質子交換膜燃料電池應用範 圍是其中最為廣泛的,且多適用於可移動型的小型動力能源。. 1.3 燃料電池的基本原理 當外加電壓電解液態水時,水會分解產生氫氣與氧氣,燃料電池 是利用水電解的逆反應,也就是給予氫氣與氧氣使其反應發電,將燃 料中的化學能轉換為電能,因此燃料電池是一種能量轉換的裝置,而 非能量儲存的裝置。 在結構上,見圖 1-2、1-3,最主要可分成七層,如圖 1-2,陽極 氣體擴散層、陽極觸媒層、質子交換模、陰極觸媒層、陰極氣體擴散 層,最外面再以流道夾住上述五層,構成單電池結構,如果為了提高. -6-.
(22) 強度,流道外層會再以端板支撐,如圖 1-3 所示,為一般燃料電池包 含端板之立體結構示意圖。 電極中,為了方便電子與反應氣體的傳遞,通常是以多孔性的導 電材料作為氣體擴散層,而在觸媒層當中,為了使反應快速地進行, 通常會塗佈鉑作為觸媒,陽極的反應式如下:. H 2 → 2 H + + 2e −. (1-1). 當陽極的反應發生,氫離子會通過質子交換膜到達陰極,電子則通過 陽極經由外電路到達陰極,其反應式如下:. 1 O2 + 2 H + + 2e − → H 2 O 2. (1-2). 總反應式為:. 1 H 2 + O2 → H 2 O 2. (1-3). 理論上,當上述之化學反應發生,完全將系統內之化學能轉換為 電能對外作功時時,此時電池之理想電壓可如下表示[2]:. Voc =. − ∆G f. (1-4). nF. 其中 Voc 代表燃料電池的開迴路電壓, ∆G f 為反應物生成產物後吉柏 氏自由能的改變量,燃料電池在標準狀況下為 -237 kJ/mol,n 代表參 與反應過程之電子數, F 為法拉第常數。由上式可知,燃料電池在標 準狀況下的開迴路電壓為 1.23V。這是在系統內總能量完全轉換為電 能對外作功的情形之下,所計算出來的理論值。 如果考慮能量損失,系統內總能與吉柏氏自由能(Gibbs Free Energy)的關係如下[2]: -7-.
(23) (1-5). ∆H = ∆G f + T ∆S. 系統內所含有之總能量以 H (焓)表示, G f 是系統轉換為電能對外作 功的能量,而最後一項 T (溫度) 與 S (熵) 的乘積代表系統無法對外 作功之能量損耗。所以當考慮能量損耗時,需查表得知 H、S 值之後 從(1-5)式得到適合之 G f 值,再帶入(1-4)式計算開迴路電壓。 燃料電池的理想電壓為 1.23V,但是隨著不同的操作電流密度, 會有不同的電池電位損失產生,造成電池壓無法維持理想電壓,如圖 1-4 所示,而這幾類電位損失可分為燃料穿越與內電流的損失、活化 過電位、歐姆過電位以及濃度過電位所造成損失。 (1) 燃料穿越與內電流 (Fuel crossover and internal currentts) 當電池在操作過程中,由於質子交換膜的阻隔效果不良,或是使 用液態甲醇做為燃料時,特別容易發生,當陽極燃料進入陰極時,會 直接與氧氣產生燃燒反應,消耗燃料,恐有安全之虞,由於一個氫氣 分子可分解成為兩個電子,因此當氫氣從內部通過時即視為內電流通 過,而非實際上之電流。 (2) 活化過電位 (Activation overpotential) 在低電流密度時,反應速率慢,又同時需要有額外的能量克服活 化能,使化學反應發生,因此會有較多的活化過電位損失,為了要減 低活化過電位,一般會使用白金做為觸媒與提高電池操作溫度。活化 損失可表示如下[2]: ⎛i⎞ ⎝ i0 ⎠. η act = A ln ⎜⎜ ⎟⎟. (1-6). A為與溫度及傳輸係數有關的常數i0代表交換電流密度,使用觸媒相 當於降低A值,而提高操作溫度相當於降低A與i0值。 -8-.
(24) (2) 歐姆過電位 (Ohmic overpotential) 當電流密度增大,電池在穩定的環境下操作時,此時電位損失的 主要來源為各個電池組件所造成的歐姆電阻,稱為歐姆過電位,這些 歐姆電阻的來源,還包括接觸電阻,因此在組裝上,會選擇薄、低阻 抗、組裝時提高扭力來改善。歐姆損失可表示如下[2]:. η ohmic = IR. (1-7). I 為電池之操作電流密度,R 為系統之總歐姆電阻。 (3) 濃度過電位 (Concentration overpotential) 最後,當電池在高電流密度下操作時,由於反應速率快,外界所 提供的氣體可能不足以彌補如此快的氣體消耗,因此達到極限電流密 度,此時稱為質傳或濃度過電位。其表示如下[2]:. η con =. RT ⎛ i ⎞ ln⎜ ⎟ nF ⎜⎝ ilim ⎟⎠. (1-8). ilim代表極限電流密度,R是理想氣體常數,T為電池操作溫度,n為反 應過程產生之電子數,F為法拉第常數。 燃料電池的發展以降低各個極化損失以及延長極限電流密度為 主,而通常燃料電池的運作,會以極限電流的 75 %,作為操作電流, 因此當電池的極限電流越大,對於使用上越有效益。. 1.4 文獻回顧 通入不純的燃氣進入電池內部,使得電池性衰退,大多數發生在 兩極的觸媒層,此處為電化學反應產生電流的核心所在,而這些不純. -9-.
(25) 物質的來源,在陽極有重組器,在陰極則是以空氣作為燃料來源時所 混入的污染離子,此外,加濕瓶中不潔淨的水也是污染物的來源之一。 陰極通入空氣以及加濕瓶中不純淨的水中,主要是陽離子,會造 成電池性能下降的污染粒子,Okada團隊作了一系列有關陽離子對於 燃料電池性能影響之相關研究之相關研究[3-12],這些研究在實驗部 分包括Ca ; Na ; Fe、Ni、Cu及Li、K、Rb、Cs 等陽離子的影響,結 果發現,當這些離子進入電池內部時,最直接影響到電池的是位於觸 媒層的電雙層,影響機制有二:一為Nafion結構的改變,影響到造成 電雙層帶電粒子的排列,縮小氧氣的傳輸通道,減緩電化學反應速 率,二為觸媒粒子與陽離子結合,使得白金的表面積下降,造成氫氣 無法有效的受到利用。而陽離子影響到電池的次要區域為薄膜,影響 效果與觸媒相似,均與Nafion結構的改變有關,尤其是價數高的陽離 子,可同時與多條Nafion側鏈鍵結,導致薄膜內的水含量、導電率、 氫離子 傳輸數及水的滲透細數快速下降造成薄膜收縮與脫水,但是水 擴散係數隨著污染離子增加而迅速減少,故質子交換膜內電滲透效應 大於逆擴散效應,造成薄膜內陽極的水比陰極少,所以當薄膜受到污 染時,其乾化程度會更加嚴重,造成電池性能的嚴重下降。此外從數 值計算出來的結果[11,12]發現,當陽離子進入薄膜當中,會使得薄膜 內的電滲透係數上升,擴散係數下降,造成水分分部不均,以及陽極 處產生乾化的現象。 雖然陽離子的進入會同時影響到觸媒層以及質子交換膜,但是 Okada 等人研究的方式,是採用高濃度陽離子溶液將薄膜或電極浸泡 在其中,加速污染現象的觀察。但 Okada 在文獻[13]當中提到,當燃 料電池在長時間運轉的過當中,這些污染離子進入電池內部的含量. - 10 -.
(26) 小,事實上對於電池的影響不大,一但真的發生影響,這些陽離子對 觸媒層所造成的影響將遠超過薄膜。 而在陽極部分,若是使用純氫作為燃氣,固然會使得燃料電池有 最佳的性能,但是氫氣鋼瓶的儲氫能力與管路配置的問題都需要時間 來解決,因此重組器的使用將會是目前最有可能的替代方案。 經過重組之後的氣體,其中包含了約 45% 的氫氣、10ppm的CO、 15%的CO2以及 1% CH4 [14],因此,一但使用重組器作為氫氣的來 源,那就必須注意從重組器出來的氣體當中,是否含有會使得電池性 能下降的成分,其中,一氧化碳的濃度達 5 ~ 10 ppm時[15],即會造 成電池性能的衰退,而其影響的機制在於一氧化碳對於白金的結合能 力高於氫氣,在結合之後佔據了氫氣可以反應的空間,使得反應電流 量下降,所以為了使燃料電池在使用重組器作為燃料來源時,可以穩 定地持續發電,降低重組氣體的一氧化碳濃度以及提高電池對於一氧 化碳的容忍度,是目前研究的兩大方向。 以操作環境來說,越高的電池操作溫度,對於一氧化碳的容忍度 越高[16],因為在較高的電持操作溫度之下,一氧化碳的氧化反應越 容易發生,一氧化碳也越容易從白金表面脫附或產生電化學反應,而 空出來的表面積,也使得氫氣更有機會與白金反應。 此外,當陽極通入的氣體含有一氧化碳時,陽極的氣體流量與陰 極的背壓,也是影響電池性能的重要操作條件[17],陽極若在高流 量,將會加速一氧化碳的毒化現象,原因在於提高流量相當於在單位 時間內有更大量的一氧化碳進入電池當中,加速地毒化觸媒層,而提 高陰極背壓則會使得部分氧氣擴散到陽極,有助於一氧化碳氧化,減 低一氧化碳濃度。. - 11 -.
(27) 就提升一氧化碳容忍度的方面來說,在結構的改變上,可使用 Pt-Ru 雙元合金作為過濾器,夾在氣體擴散層與觸媒層之間[18],另 一個相似的做法,即是利用碳載釕(Ru)的方式製作擴散層,直接將擴 散層作為過濾器[19],這兩種製作方式都是利用釕(Ru)金屬的高氧化 能力,在一氧化碳還未進入觸媒層之前,氧化成二氧化碳,其優點在 於結構簡單,不需要額外的控制儀器,不過使用貴金屬作為過濾器, 卻使得製作成本上升。 為了避免使用高價格的貴金屬提高成本,部分學者則是將研究重 點放在當電池受到毒化後,如何在操作過程中,使得電池性能得以回 復,通常都是以氧化一氧化碳為目標,主要有以下三種方式: 1.加入氧化物(Oxidant-Bleeding) [20,21,22]:將通入陽極的氣體, 混合 1 % 的氧化氣體,如空氣、氧氣或過氧化氫,這類氣體可以幫 助一氧化碳氧化成二氧化碳,二氧化碳對於白金的鍵結能力較低,同 時又可以減少一氧化碳濃度,因此可減緩毒化程度,不過卻需要額外 的控制系統,造成系統的複雜化。另外,這個方式是屬於比較沒有效 率的作法,因為通入的氧化氣體當中。大約每 400 個氧分子只與 1 個 一氧化碳參與氧化作用[19],其餘的與氫氣產生燃燒反應,不但消耗 氫氣,還有安全上的缺失。 2.自發性氧化(Self-Oxidation) [15,23]:在電池在操作過程中,要 直接將電池內部的一氧化碳氧化成二氧化碳,必須在高電池電壓的情 況之下,才有足夠之過電位使反應發生,因此,當電池維持在高電流 密度的情況下操作,如果有一氧化碳進入電池內部,為了維持電池的 高電流密度,陽極過電位勢必上升,雖然會造成電池性能的下降,但 也可以進一步將一氧化碳氧化,這個方式可以讓電池的結構更簡單, 不過卻需要在高電流密度之下操作,讓使用範圍受到限制。 - 12 -.
(28) 3.電流脈衝(Current-Pulsing) [23,24]:這個方法所運用到的原理, 是當電池受到一氧化碳毒化的時候,就讓電池產生一電流脈衝,此時 陽極過電位瞬間提高,提高至足以把白金表面覆蓋之一氧化碳氧化, 這樣不但可以消除覆蓋之一氧化碳,又不會造成額外的能量浪費,不 過缺點是會造成控制系統的複雜化,雖然如此,在安全性、效率與使 用範圍,整體上比上述兩種方式好。在操作的過程中,尋求脈衝之最 佳震幅、頻率以及循環時間的最佳化,是其重點。 在理論模式的分析方面,燃料電池的發展,起初是以半電池模式 [25,26]為基礎,進而發展出越來越完整的全電池模型[27],甚至還將 複雜的兩相流模式考慮在內[28,29],但是其中對於毒化現象的數學模 式建立,尤其是一氧化碳毒化的部分,這種在短時間即可對電池性能 造成衰退的現象,卻一直沒有看到數學模式的建立。 直到 2001 年 Springer 等人[30]才首先提出一套描述一氧化碳毒化 的數學模式,方程式中描述了當陽極所通入的氣體同時存在氫氣與一 氧化碳時,在觸媒表面受到吸附、脫附以及電化學反應之影響,觸媒 表面積因氫氣與一氧化碳覆蓋隨時間改變的情形,而這覆蓋率的改變 將影響到電池所產生的電流量,而其中速率常數的取決,以及速率常 數與覆蓋率之間關係式的發現,都使得理論與實驗的關係性更為準 確。2003 年 Chan 等人[31],將 Springer 等人[30]的一氧化碳毒化數學 模式與 Bernardi 等人[26,27]的全電池模式結合,解出燃料電池在穩 態、不同一氧化碳濃度下,氣體濃度與覆蓋率的分佈情形,在此算是 第一次完成全電池模式一氧化碳毒化的數學計算,但是由於 Bernardi 等人[26,27]的數學模式屬於早期的理論,因此在模型建立上還有更進 一步可改善的空間。2004 年 Wang 等人[32]探討不同一氧化碳濃度下 對燃料電池性能的影響,其研究重點放在暫態的分析上,這篇文章仍 - 13 -.
(29) 是引用 2001 年 Springer 等人一氧化碳毒化的數學模式[30],但是對於 速率常數與覆蓋率之間的關係式卻予以簡化,忽略一氧化碳所產生的 電流密度,只解陽極觸媒層,沒有考慮厚度的效應,因此雖然可以看 到性能隨時間衰退的現象,但卻無法深入探討觸媒表面覆蓋率的情 形,而且理論模式也過於簡化。 另外在重組器中,氨氣的存在對於電池性能也有負面的影響, Rune Halseid 等人 [33]則指出薄膜導電度隨著進入電池的銨根離子 濃度上升而下降,而 Zawodzinski 等人[34]在陽極使用 Pt/Ru 可減慢電 池性能衰退,而且在長時間通入氨氣後,重新通入純氫氣可讓電池性 能回覆。. 1.5 研究動機及目的 燃料電池具備高效率、低污染、無噪音、構造簡單等優點,在未 來將有可能取代現有的能源。因此提高電池性能、降低成本與增加電 池的可靠度,均是目前燃料電池所研究的重點。 以目前燃料電池的發展現況來看,未來燃料電池陽極所通入的燃 料有兩種選擇:通入純氫或是富含氫氣的重組氣體,但是使用純氫需 要有管路配置,因此,在短時間之內,重組器可能是比較優先的選擇, 而當我們使用的燃料經過重組器時,重組後的氣體將會含有 10 ~ 100 ppm 的一氧化碳,由於一氧化碳比氫氣更容易與白金觸媒形成穩定的 鍵結,覆蓋白金表面,佔去氫氣參與反應的空間,造成電池性能的衰 退。 因此為了使燃料電池能夠在使用重組器作為燃料供給來源,並能 長時間穩定運作情況下,對於其中造成電池毒化之一氧化碳方面相關 的研究則有其必要性。在文獻回顧中,對於燃料電池受到一氧化碳毒 - 14 -.
(30) 化的現象,在理論模式上也尚屬缺乏,尤其是在暫態分析的部分。因 此,本文所要探討的方向,即是利用數值計算的方式,探討當一氧化 碳進入電池後,對電池性能影響之暫態分析,希望能更進一步了解電 池受到一氧化碳毒化所發生的現象。. - 15 -.
(31) 燃料電池的應用範圍. 1W. 10 W. 100 W. 1 kW. 10 kW. 100kW. 1 MW. 10 MW. DMFC PEMFC SOFC PAFC MCFC. 圖 1-1 燃料電池應用範圍概括圖(工研院能資所提供). - 16 -. 100MW. 1GW.
(32) e-. e-. H+ H2. O2 H+. O2. H2. H+. H2. 流道. 氣體擴 散層. 觸媒層. O2. 薄模. 觸媒層. 圖 1-2 燃料電池示意圖. - 17 -. 氣體擴 散層. 流道.
(33) 氣體擴散層. 氣體擴散層 觸媒層. 觸媒層. 端板. 集電板. 雙極板. 質子交換膜. 雙極板. 圖 1-3 質子交換膜燃料電池各組件立體示意圖. - 18 -. 集電板 端板.
(34) 理想電壓. Potential( Volt ). 1.23. 活化過電位損失. 實際工作電壓 歐姆過電位損失 濃度過電位損失 Current density ( A/cm2 ). 圖 1-4 理想與真實之極化性能曲線圖. - 19 -.
(35) 二、理論分析 2.1 一氧化碳毒化之數學模式介紹 對於重組器中所含有之一氧化碳對燃料電池的性能造成衰退的 毒化現象,在實驗上,早在 1988 年,Gottesfeld 等人[35]就已做出實 驗證實,一氧化碳影響電池性能衰退的機制,在於毒化陽極觸媒層內 之白金,一氧化碳會與白金形成穩定之鍵結,造成氫氣可以利用之空 間減小,由於一氧化碳幾乎不會產生電流密度,因此一但氫氣的的使 用率下降,直接會影響到電池的發電量,而其解決的發法,是在電池 被毒化的過程當中,通入 2-5 %的氧氣進入陽極,使得一氧化碳在白 金表面氧化,讓部分的性能得以回升。隨著電腦運算功能的提升,為 了降低成本與短時間內得到一些可用的數據,藉由數值運算準確地預 測燃料電池的性能,已經成為一個必然的趨勢。 而燃料電池數學模式的發展,在 1992 年,Bernardi 等人[26] 就 已提出,這篇文章屬於全電池之數學模式,而且也是後來研究者繼續 拓展兩項流模式,或是參數引用的基礎,讓燃料電池的數學模式越來 越完整,可是在一氧化碳毒化方面的理論模式卻一直沒有發展,直到 2001 年,Springer 等人[29],由化學反應的角度,從氫氣與一氧化碳 在白金表面的化學反應式中,找到對應之數學關係,其化學反應式如 下:. H 2 + 2 Pt ← ⎯→ 2( H − Pt ). (2-1). CO + Pt ← ⎯→ (CO − Pt ). (2-2). (CO − Pt ) + H 2 O ⎯ ⎯→ Pt + CO2 + 2 H + + 2e −. (2-3). H − Pt ⎯ ⎯→ Pt + H + + e −. (2-4). - 20 -.
(36) (2-1)式代表氫氣在白表面所造成的吸附與脫附之現象,(2-2)式則代表 一氧化碳在白金表面的吸附與脫附現象,前二式只是單純的代表與白 金鍵結與脫離現象,而接下來的(2-3)式則是氫氣電化學反應之現象, 代表氫氣消耗產生電流,同樣的 (2-4)式,代表一氧化碳消耗產生電 流,因此數學模式的建立,就在利用氫氣與一氧化碳在白金表面的化 學反應,來描述氫氣與一氧化碳的質量守恆現象,其數學方程式表示 如下:. ξ. ξ. ⎛ n H Fη anode dθ H = k fH X H 2 P (1 − θ H − θ CO ) − b fH k fH θ H − 2k eH θ H sinh ⎜⎜ 2 dt ⎝ 2 RT. ⎞ ⎟ ⎟ ⎠. dθ CO ⎛ n Fη ⎞ = k fCO X CO P(1 − θ H − θ CO ) − b fCO k fCOθ CO − 2k eCOθ CO sinh ⎜ CO anode ⎟ dt ⎝ 2 RT ⎠. (2-5). (2-6). (2-5)式,左邊第一項代表氫氣在白金表面的覆蓋率隨著時間的改變 量,右邊第一項代表氫氣吸附的增加量,右邊第二項代表氫氣脫附的 減少量,右邊第三項則代表電化學反應之消耗量,(2-6)式,則是代表 一氧化碳在白金表面所牽涉到的化學反應,與(2-5)式意義相同,在數 學模式發展出來之後,Springer 等人開始尋找適當之反應速率常數, 為的是要與實驗現象相符合,在過程中,Springer 等人又更進一步發 現,氫氣吸附的速率常數與一氧化碳脫附的速率常數與一氧化碳在觸 媒表面的覆蓋率有關,因此更準確的與實驗值相符合,在往後的研究 當中成為了一氧化碳毒化的理論模式基礎,如 2004 年,Wang 等人. [31],所解出之暫態現象即是引用 Springer 等人[26],所發展出來的 數學模式,不過 Wang 等人所求解的方式,僅是單純的零維度模式 - 21 -.
(37) (Zero Dimensional),也就是只解陽極觸媒層部分的(2-5)、(2-6)式,由 於不解厚度方向的分佈情形,電池的電流密度即是(2-5)、(2-6)式的電 化學反應項之總和,另外還加入暫態的效應在內,由於不考慮觸媒層 的厚度,以及其他各層的效應,因此所得到的結果並不是那麼的準確。 本文所要研究的範圍同樣只解陽極觸媒層單獨一層,並且額外考 慮觸媒層厚度的效應,對氫氣與一氧化碳濃度分佈以及觸媒覆蓋率的 分佈進行求解,並且加入暫態的效應。由於加入了厚度的效應,因此 電流密度的求解不能單純的引用 Springer 等人在覆蓋率方程式中之 電流密度項,而且傳統解純氫氣之 Bulter-Volmer 方程式也不再適用, 必須對覆蓋率與白金單位體積所含有之面積去進行修正,計算出電流 密度之分布情形,希望能在未來能作為拓展成一氧化碳毒化之全電池 模式的數學基礎。. 2.2 基本假設 本文所要探討的是當電池受到一氧化碳毒化後,陽極觸媒層內氫 氣與一氧化碳的濃度分布、觸媒表面覆蓋率以及到達穩態所需要的時 間,因此,主要考慮的範圍定在陽極觸媒層部分( 0 ≤ z ≤ Lc ),主要包 含的假設如下:. 1. 一維之直角座標系統。 2. 電池處於恆溫狀態。 3. 氣體為理想氣體。 4. 多孔性材質之孔隙為均勻分布。 5. 擴散為唯一的傳輸模式。 6. 陽極觸媒層內只考慮氫氣與一氧化碳之傳輸行為。 7. 由於二氧化碳的形成為微量,因此,不考慮在反應進行中所產生 之二氧化碳。 - 22 -.
(38) 8. 假設陽極過電位為一定值。. 2.3 統御方程式 文章所使用之物理模型如圖 2-1 所示,由於一氧化碳毒化主要影 響的是陽極觸媒層,因此,將討論區間定在陽極觸媒層部分,因此將 原點定在陽極氣體擴散層與陽極觸媒層之交界處,A 點定為陽極觸媒 層與薄膜交界點。 以下將就氣體濃度分佈、白金表面覆蓋率、傳輸電流密度以及電 位所使用的方程式作介紹。. 2.3.1 濃度分佈 在陽極觸媒層內,氫氣與一氧化碳的濃度分佈,主要受到擴散與 電化學反應的影響,在隨著位置與時間的分佈可表示如下[30]:. H2: ε c. ∂ CH2 ∂t. = ε c DH 2. ∂ 2C H 2 ∂z. 2. −. di H 2 ⎛ s H 2 ⎞ ⎜ ⎟ dz ⎜⎝ nH 2 F ⎟⎠. ∂ CCO ∂ 2 CCO diCO ⎛ sCO ⎞ ⎟ ⎜ CO: ε c = ε c DCO − ∂t dz ⎜⎝ nCO F ⎟⎠ ∂z 2. 0 ≤ z ≤ Lc (2-7) 0 ≤ z ≤ Lc (2-8). 其中 ε c 代表孔隙率、 D 為擴散係數、 i 是所產生之電流密度、 s 是化學 計量數、 n 代表電量、 F 則是法拉第常數,第一項代表控制體積內濃 度隨時間變化的增加量,第二項代表經由擴散作用進出控制體積濃度 的變化量,第三項則是代表參與電化學反應所造成之濃度消耗量。. 2.3.2 觸媒表面覆蓋率 - 23 -.
(39) 當陽極觸媒層同時存在氫氣與一氧化碳時,氫氣與一氧化碳為了 進行化學反應,會與空出來的白金表面進行吸附、脫附以及電化學反 應產生電流,影響到白金表面氫氣與一氧化碳的覆蓋率,而進行這三 種程序的難易程度,取決於各個過程所中所涉及到的速率常數,其表 示式如下[29]:. ξ. ⎛ n H Fη anode dθ H = k fH X H 2 P (1 − θ H − θ CO ) − b fH k fH θ H − 2k eH θ H sinh ⎜⎜ 2 dt ⎝ 2 RT. ⎞ ⎟ ⎟ ⎠. 0 ≤ z ≤ Lc (2-9). ξ. dθ CO ⎛ n Fη ⎞ = k fCO X CO P(1 − θ H − θ CO ) − b fCO k fCOθ CO − 2k eCOθ CO sinh ⎜ CO anode ⎟ dt ⎝ 2 RT ⎠. 0 ≤ z ≤ Lc (2-10) ξ 為觸媒表面的面積密度與法拉第常數的乘積, k 、 b 代表速率常數, X 為莫耳分率, P 為壓力,η anode 為陽極過電位, R 為萬用氣體常數,. T 代表電池溫度。等式左邊代表覆蓋率隨時間的變化,等式右邊由左. 至右分別代表氫氣與一氧化碳的吸附項、脫附項與電化學反應造成之 消耗項。 另外,氫氣吸附的速率常數與一氧化碳脫附的速率常數與一氧化 碳在觸媒表面的覆蓋率有關,因此可表示如下[29]:. ⎡ δ (∆E H ) ⎛ ⎛ λθ CO ⎞ ⎞⎤ ⎜1 − exp⎜ ⎟ k fH = k fH 0 ⋅ exp ⎢− ⎜ θ − 1 ⎟⎟ ⎟⎥ RT ⎜⎝ ⎢⎣ ⎝ CO ⎠ ⎠⎥⎦. 0 ≤ z ≤ Lc (2-11). ⎤ ⎡ δ (∆GCO ) θ CO ⎥ b fCO = b fCO 0 ⋅ exp ⎢ ⎦ ⎣ RT. 0 ≤ z ≤ Lc (2-12) - 24 -.
(40) 其中 ∆E H 代表氫氣吸附所需之活化能、 ∆GCO 代表一氧化碳吸附所 需之吉柏氏自由能。. 2.3.3 電流密度分佈 由於受到一氧化碳毒化的影響,觸媒的表面覆蓋有氫氣與一氧化 碳兩種分子,因此電化學反應所產生之傳輸電流密度,主要由氫氣與 一氧化碳產生,因此,傳統的 Bulter-Volmer 方程式必須對白金表面 覆蓋率進行修正[30]:. ⎛ n H Fη anode di di H 2 diCO = + = 2ak eH θ H sinh ⎜⎜ 2 dz dz dz ⎝ 2 RT. ⎞ ⎞ ⎛ n Fη ⎟ + 4ak eCOθ CO sinh ⎜ CO anode ⎟ ⎟ ⎠ ⎝ 2 RT ⎠. 0 ≤ z ≤ Lc (2-13). 其中 a 代表每單位體積觸媒所含有的表面積,第一項代表氫氣反應產 生之傳輸電流密度,第二項則代表一氧化碳之傳輸電流密度。. 2.4 起始條件 在本文中所使用到的起始條件,是假定燃料電池系統處在一開始 未啟動的狀態,也就是 t = 0 時,電池內部沒有任何氣體,當 t > 0 時, 才開始有氣體通入,其數學式表示如下:. C H ( z ,0 ) = C H0 ( z ,0 ). t=0. (2-14). 0 ( z ,0 ) C CO ( z ,0 ) = C CO. t=0. (2-14). 2. 2. - 25 -.
(41) θ H ( z ,0) = θ H0. t=0. (2-15). θ CO ( z ,0) = θ H0. t=0. (2-15). 2.5 邊界條件 在濃度的邊界條件部份,是給予陽極觸媒層入口處( z = 0 ) ,固 定之濃度值,在觸媒層與薄膜交界處( z = Lc ),由於薄膜有阻隔氣體 的作用,因此給予通量為零的邊界條件:. C H = C Hin. z=0. (2-16). in CCO = CCO. z=0. (2-16). 2. DH 2. DCO. 2. ∂C H 2 ∂z. z = Lc (2-17). =0. ∂CCO =0 ∂z. z = Lc (2-17). 在電流密度部分,由於在陽極觸媒層入口處( z = 0 ),是電化學反應 最先發生的地方,因此電流也由此處開始產生,在這裡是將電流密度 定為零作為邊界條件:. z=0. i=0. - 26 -. (2-18).
(42) z Anode. Cathode. GDL. CL. Membrane. CL. GDL. Lc. 圖 2-1 PEMFC 單電池五層結構之物理模型示意圖. - 27 -.
(43) 三、數值方法 3.1 有限差分法 一般在處理複雜的偏微分方程式時,為了節省計算時間,通常都 會借助電腦來幫我們處理,而為了要將方程式化為電腦可以計算的語 言,首先必需將方程式加以離散化,變成電腦可以處理的形式,而在 本文中所選用的方法為有限差分法( Finite Difference Method )。 對於利用有限差分法來離散方程式的方法,通常有三種,前差分. ( Forward Difference )、後差分( Backward Difference )以及中央差分法 ( Central Difference ): 前差分:. ∆f i = f i +1 − f i. (3-1). 後差分:. ∆f i = f i − f i −1. (3-2). 中央差分:. ∆f i = f. i+. 1 2. − f. i−. 1 2. (3-3). 在本中所遭遇的偏微分方程屬於拋物線型(Parabolic Type),在有 限差分中,有兩種方法可解決此種類型的方程式,一種是顯性法. (Explicit Method),此方法會受限於時間格點與位置格點的大小,原 因在於求解下一個時間點的變數時,需要這個時間點所對應相鄰三個 點的變數值進行計算,如圖 3-1 所示,如果時間與位置格點取的值不 恰當,將會造成 i 格點有低溫往高溫這種違反熱力學第二定律的現 象,有穩定性的問題存在。而隱性法(Implicit Method)則不受這個條 件的限制,因此本文中選用這個方法,以下就隱性法作簡單的介紹: 一般拋物線型方程式具有以下形式(以擴散方程式為例):. - 28 -.
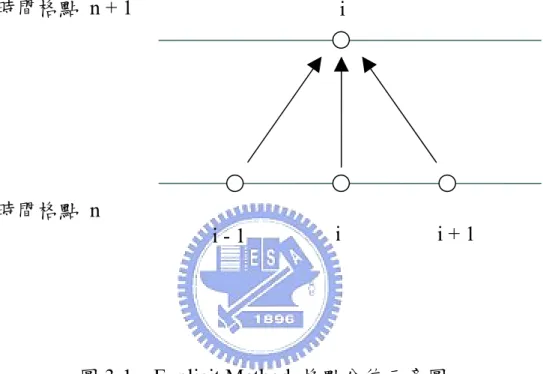
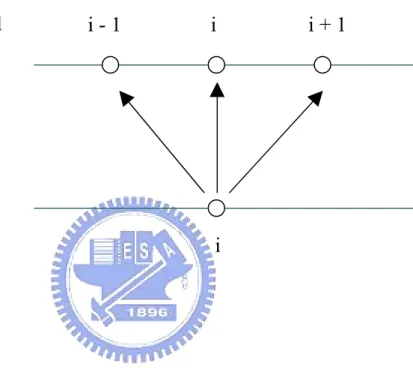
(44) ∂C ∂ 2C =D 2 ∂t ∂x. (3-4). 時間項以前差分處理,位置項以中央差分處理,上式變為:. C. n +1 i. −C ∆t. n i. C. = D. n +1 i −1. − 2C. n +1 i 2. +C. (∆ z ). n +1 i +1. (3-5). 經過移項整理後可得:. αC. 其中. n +1 H 2 ,i −1. α = DH. − ( 1 + 2α ) C. ∆t. 2. n +1 H 2 ,i. +α C. n +1 H 2 ,i +1. = −C. n H 2 ,i. (3-6). 。. (∆ z )2. 由上式可看出,在時間格點 n 的濃度為已知,時間格點 n + 1 的 三個位置的濃度為未知,如圖 3-2 所示,如再配合邊界條件,將會形 成以下形式之對角矩陣:. ⎡d ⎢b ⎢ ⎢ ⎢ ⎢ ⎢ ⎢ ⎢⎣. a d b. a d b. a d b. a d b. ⎤ ⎥ ⎥ ⎥ ⎥ ⎥ a⎥ ⎥ d ⎥⎦. ⎡ C 2n +1 ⎤ ⎢ n +1 ⎥ ⎢ C3 ⎥ ⎢ M ⎥ ⎥ ⎢ ⎢ M ⎥ ⎢C n +1 ⎥ ⎢ nxn +−11 ⎥ ⎢⎣ C nx ⎥⎦. =. ⎡ R2 ⎤ ⎢ R ⎥ ⎢ 3 ⎥ ⎢ M ⎥ ⎥ ⎢ ⎢ M ⎥ ⎢ Rnx −1 ⎥ ⎥ ⎢ ⎢⎣ Rnx ⎥⎦. (3-7). 此種類型的對角矩陣,在求解過程中,可以對於下一個時間間隔 的濃度分佈直接求解,因此沒有像顯性法有穩定性的問題。 - 29 -.
(45) 3.2 穩態條件 數值計算的過程中,主要是以不斷疊代的方式,觀察所求之變數 值隨時間之變化,當所求之變數不再隨時間變化,即代表系統到達穩 態,方程式屬於拋物線型或橢圓型均是利用相同的概念,而為了要觀 察系統是否到達穩態,在計算的過程中,必須去檢查相鄰兩個時間點 的變數值是否符合我們所設定的收斂條件,如此便可以避免電腦進行 多餘運算,在本文中所設定的收斂條件如下:. ε error =. Cin +1 − Cin ≤ 10 −8 n Ci. (3-8). 當濃度分佈、覆蓋率分佈以及電流密度分佈符合此條件時,即達 到穩態,計算也因而終止。. - 30 -.
(46) 時間格點 n + 1. i. 時間格點 n. i. i-1. i+1. 圖 3-1 Explicit Method 格點分佈示意圖. - 31 -.
(47) 時間格點 n + 1. i-1. i. i. 時間格點 n. 圖 3-2 Implicit Method 格點示意圖. - 32 -. i+1.
(48) 四、結果與討論 本文之結果是根據前面章節之基本假設、統御方程式、邊界條件 以及起始條件,並配合表 4-1 的參數進行數值計算,計算範圍在陽極 觸媒層,並考慮暫態的效應,目的在探討當陽極氣體在通入含有不同 的一氧化碳濃度以及不同的觸媒層孔隙率和厚度的情況之下,觸媒層 內部之氣體濃度分佈、覆蓋率分佈以及電流密度分佈的情形。. 4.1 一氧化碳濃度效應 圖 4-1、4-2、4-3,操作條件為陽極過電位 0.01V,孔隙率 0.4, 觸媒層厚度 10µm,一氧化碳 0 ppm,觸媒層內氫氣濃度、氫氣覆蓋 率、電流密度的穩態分佈圖。圖中左側起點,為陽極氣體擴散層與陽 極觸媒層之邊界,右邊則為陽極觸媒層與薄膜之交界處。三張圖作為 陽極觸媒層還未受到一氧化碳毒化的一般情形,從圖 4-3 可看出,電 池在穩態時的電流密度約為 1.02 A/cm2 ,在這種高電流密度之下,由 於反應速率快,因此,氫氣也消耗得也特別快速,從圖 4-1 可以看出, 距離觸媒層入口 1.5µm處,氫氣已幾乎消耗殆盡,因此氫氣覆蓋在觸 媒表面的分佈,也集中在距離觸媒層入口與距離 1.5µm之間,由於在 觸媒層入口處,氫氣的濃度最高,因此最大覆蓋率也發生在此處,約. 0.85。 當電池啟動時,如果通入的重組氣體中含有一氧化碳,將對電池 性能造成衰退,以下將探討本文中所計算出來的結果。 圖 4-4~4-9 操作條件為陽極過電位 0.01V,孔隙率 0.4,觸媒層厚 度 10µm,一氧化碳濃度 100ppm,觸媒層內氫氣與一氧化碳之濃度、 覆蓋率以及電流密度分佈隨時間之變化圖。與圖 4-1~4-3 未受污染的. - 33 -.
(49) 結果比較可發現,當一氧化碳濃度為 100ppm 時,直接所造成的影響, 是白金覆蓋率的改變,由於一氧化碳比氫氣更容易與白金形成穩定的 鍵結,不易發生起電化學反應產生電流,因此一氧化碳會一直慢慢累 積在白金表面,造成氫氣所產生出來的電流密度下降,由圖 4-4 與 4-5 氫氣與一氧化碳之濃度分佈隨時間之變化圖可看出,原本在未受毒化 之前,如圖 4-1 所示,氫氣在距離觸媒層入口約 1.5µm 即消耗殆盡, 而且覆蓋率集中在入口與 1.5µm 之間,如圖 4-2 所示。可是一旦有一 氧化碳進入觸媒層,一氧化碳便開始與氫氣搶奪觸媒,一氧化碳吸附 在白金表面的量,與一氧化碳擴散到觸媒表面的速度以及濃度有關, 擴散速度越快、濃度越高則吸附量越多。由於的一氧化碳分子量比氫 氣大,擴散速度慢,因此一開始的幾秒鐘,似乎不受毒化的影響,可 是一旦一氧化碳擴散到白金表面,就會穩固地吸附在白金表面,如圖. 4-7 所示。隨著時間經過,一氧化碳所累積的覆蓋量越來越多,使得 氫氣只能與剩餘的觸媒表面積作用,隨著一氧化碳在觸媒表面的累 積,氫氣覆蓋率隨時間下降,如圖 4-6 所示。當氫氣與觸媒的反應面 積減少時,氫氣的消耗程度反而不如未受污染的時候來的快,因此多 餘的氫氣會往觸媒層與薄膜交界處擴散,去尋找可以發生反應的區 域,如圖 4-4 所示。而一氧化碳的消耗量少幾乎沒有什麼損耗,主要 是因為一氧化碳吸附在白金表面後,脫附與電化學反應的消耗量少, 因此會造成在觸媒層內累積的現象,如圖 4-5 所示。從電流密度分佈 來看圖 4-8、4-9,氫氣與一氧化碳電化學反應所產生之電流量,一氧 化碳小到可以忽略不計,因此可以斷定電流密度主要是由氫氣的反應 所產生,因此在往後討論中,將不再考慮一氧化碳所產生之電流密 度。換言之,一旦氫氣與白金反應的表面積減少,那產生之電流密度 即會相對減小。. - 34 -.
(50) 從圖 4-6 、 4-8 ,也可以看出氫氣覆蓋率的最大值由 0.85 降到. 0.145,電流密度也從 1.02 A/cm2 降到 0.26 A/cm2,下降約 74.45 %, 另外到達穩態的時間也因為爭奪白金表面積的關係,由 1 秒拉長到. 541 秒。在反應的過程中,覆蓋率的改變影響到達穩態的時間,而覆 蓋率的變化主要取決於觸媒表面的一氧化碳濃度與擴散速度,由於一 氧化碳的擴散速度慢,因此一氧化碳需要較長的時間才會到達觸媒表 面,可是一旦一氧化碳與觸媒接觸後,一氧化碳與白金將會形成穩定 的鍵結,然後逐漸累積在白金表面,因此當通入的一氧化碳濃度越 高,白金表面被覆蓋的速度越快,到達穩態的時間越短。 圖 4-10 是操作條件為陽極過電位 0.01V,孔隙率 0.4,觸媒層厚 度 10µm,在不同的一氧化碳濃度下,觸媒層內氫氣之穩態分佈圖。 隨著一氧化碳 濃度上升,毒化現象趨於嚴重,造成氧氣的使用率下 降,使得多餘的氧氣往觸媒層內部擴散。圖 4-11 是操作條件為陽極 過電位 0.01V,孔隙率 0.4,觸媒層厚度 10µm,在不同的一氧化碳 濃 度下,觸媒層內一氧化碳之穩態分佈圖。一氧化碳濃度會在觸媒層內 逐漸累積,主要是因為一氧化碳的消耗是由一氧化碳在白金表面吸 附、脫附與電化學反應有關,由於從一氧化碳與白金產生穩定的鍵 結,因此一氧化碳在吸附之後不易產生脫附與電化學反應之現象,因 此一氧化碳的消耗量少,當一氧化碳通入的濃度越低,相對的消耗掉 的一氧化碳濃度也比較高。圖 4-12 是操作條件為陽極過電位 0.01V, 孔隙率 0.4,觸媒層厚度 10µm,在不同的一氧化碳濃度下,觸媒層內 氫氣覆蓋率之穩態分佈圖。圖 4-13 是操作條件為陽極過電位 0.01V, 孔隙率 0.4,觸媒層厚度 10µm,在不同的一氧化碳濃度下,觸媒層內 一氧化碳覆蓋率之穩態分佈圖。氫氣的覆蓋率隨著一氧化碳濃度的上 昇而下降,由(2-9)、(2-10)式可以知道,氫氣與一氧化碳在白金表面 - 35 -.
(51) 的覆蓋率,與本身的莫耳分率有關,因此當通入的一氧化碳莫耳濃度 下降,會造成觸媒層內,一氧化碳的覆蓋率分佈的整體下降,而在觸 媒層內,一氧化碳覆蓋率有從入口外內部遞增的現象,主要是因為入 口處是給予固定氣體濃度之邊界條件,在入口處由於氫氣與一氧化碳 分率固定,而且氫氣的分率始終大於一氧化碳,因此到達穩態時,一 氧化碳在入口處之覆蓋率上升有限,往觸媒層內部,由於氫氣受到電 化學反應的消耗,造成一氧化碳分率的相對提升,增加了一氧化碳在 白金表面覆蓋的比率。 圖 4-14 是操作條件為陽極過電位 0.01V,孔隙率 0.4,觸媒層厚 度 10µm,在不同的一氧化碳濃度下,觸媒層內電流密度之穩態分佈 圖。由於電流密度主要是由氫氣發生電化學反應時所產生,而在發生 電化學反應之前,氫氣必須先吸附在白金表面,因此當白金表面有一 氧化碳覆蓋時,氫氣可以反應的面積減小,自然影響到所產生的電流 密度,造成電池性能的下降。圖中所標的點,是從 2004 年Wang等人. [32]與 1996 年Oetjen等人[36]之極化曲線中,找出未受毒化之電流密 度值(約 1A/cm2)作為基準,然後將相對應不同一氧化碳濃度毒化過後 之電流密度值找出。為了讓計算結果與實驗值相符合,本文主要是調 整速率常數,讓理論值逼近實驗值。本文之結果,在電池未受毒化之 前,由圖 4-3 可看出,電流密度約 1.02 A/cm2,可是當通入的一氧化 碳濃度到達 10 ppm時,電流密度為 0.697 A/cm2 (Wang等人[32]之結 果約為 0.72A/cm2),下降了 39.7%,一氧化碳濃度到達 25 ppm時,電 流密度為 0.487 A/cm2 (Oetjen等人[36]之結果約為 0.45A/cm2),下降了. 52.4%,一氧化碳濃度到達 50 ppm時,電流密度為 0.365 A/cm2 (Oetjen 等人[36]之結果約為 0.38A/cm2),下降了 64.3%,一氧化碳濃度到達. 100 ppm 時,電流密度為 0.262 A/cm2(Oetjen 等人 [36] 之結果約為 - 36 -.
(52) 0.22A/cm2),下降了 74.7%。圖 4-15 是操作條件為陽極過電位 0.01V, 孔隙率 0.4,觸媒層厚度 10µm,到達穩態時,觸媒層內一氧化碳濃度 與電流密度之關係圖。從圖中可以發現,隨著一氧化碳濃度的上升, 毒化現象趨於嚴重,但是下降電流密度的量,有減緩的趨勢,最主要 是因為一氧化碳在白金表面的覆蓋率見漸趨於飽和,必須加入更多的 一氧化碳,才能使其附著在白金的表面。圖 4-16 是操作條件為陽極 過電位 0.01V,孔隙率 0.4,觸媒層厚度 10µm,到達穩態時,觸媒層 內一氧化碳濃度與到達穩態時間之關係圖。當一氧化碳濃度濃度越 低,由於一氧化碳擴散速度慢加上在白金表面濃度較低,使得一氧化 碳不易附著於白金表面,因此所需要到達穩態的時間越長。. 4.2 觸媒層厚度效應 圖 4-17 是操作條件為陽極過電位 0.01V,孔隙率 0.4,觸媒層厚 度 20µm,在不同的一氧化碳濃度下,觸媒層內電流密度之穩態分佈 圖。從圖中可以發現,當改變觸媒層厚度時,對於電流密度只有在低 一氧化碳濃度之下才會有明顯的改變,在 10µm時,電流密度由 1.02. A/cm2下降到 0.697 A/cm2,衰退了 39.7%,可是當處媒層厚度增加到 20µm時,電流密度卻下降到 0.515 A/cm2,衰退了 49.8%,明顯比前 者多衰退了 10.1%。圖 4-18 是操作條件為陽極過電位 0.01V,孔隙率. 0.4,一氧化碳濃度 10ppm,到達穩態時,觸媒層厚度與電流密度之 關係圖。這是為了更進一步找到觸媒層厚度的最佳範圍,從圖中可以 發現到,當陽極觸媒層的厚度到達 16µm時,電流密度值開始下降, 因此在陽極觸媒層厚度小於 16µm時,電池會有較佳的性能,原因可 能如下,當通入的一氧化碳濃度較低時(10ppm),對電池性能的下降 雖然有,但不至於像一氧化碳濃度高的時造成性能下降的那麼嚴重, 換句話說,一氧化碳在白金表面的覆蓋率有限,因此在厚度拉長的情 - 37 -.
(53) 況下,反而使得質子與電子傳導路徑加長,增加了歐姆阻抗,造成觸 媒層厚度增加卻有電流密度隨之減少的情形發生。圖 4-19 是操作條 件為陽極過電位 0.01V,孔隙率 0.4,一氧化碳濃度 10ppm,觸媒層 厚度與到達穩態所需時間之關係圖。由圖中可以發現,當厚度拉長所 需到達穩態的時間也跟著增加,這是因為厚度加長後,氫氣與一氧化 碳所需要擴散的距離加長,反應範圍擴大,因此到達穩態所需的時間 也相對增長。. 4.3 觸媒層孔隙率效應 圖 4-20 是操作條件為陽極過電位 0.01V,孔隙率 0.4,一氧化碳 濃度 100 ppm,到達穩態時,觸媒層厚度與電流密度之關係圖。從圖 中可以發現,當孔隙率越大時,電池性能越好,不過這個現象在這個 時候並不明顯,孔隙率 0.3~0.5,下降的電流密度比率,只差大約 6 %, 推測是因為電池的毒化程度嚴重,白金幾乎被一氧化碳所覆蓋,因此 看不出明顯的差異。圖 4-21 是操作條件為陽極過電位 0.01V,孔隙率. 0.4,一氧化碳濃度 50 ppm,到達穩態時,觸媒層厚度與電流密度之 關係圖。這個時孔隙率 0.3~0.5,下降的電流密度比率,相差大約 9 %, 同樣孔隙率對於性的影響不太明顯。圖 4-22 是操作條件為陽極過電 位 0.01V,孔隙率 0.4,一氧化碳濃度 10 ppm,到達穩態時,觸媒層 厚度與電流密度之關係圖。在這裡可以明顯看出差別,這個時孔隙率. 0.3~0.5,下降的電流密度比率,相差大約 19 %,這個時候由於毒化 程度較輕微,而且由於一氧化碳的莫耳分率低,在白金表面的覆蓋率 有限,因此當孔隙率加大時,可有效地幫助氫氣快速地進入電池內部 反應,產生較大的電流密度,因此在通入低濃度的一氧化碳雖然對電 池有不良的影響,可是加大孔隙率卻可以改善此現象。. - 38 -.
(54) 表 4-1 基本操作參數 參數. 符號. 值. 電池溫度. T. 353 K. 陽極壓力. P. 3 atm. 開迴路電壓. Uo. 1.23 V. [26]. 傳輸係數. α. 0.5. [26]. 氫氣化學計量數. sH2. 0.5. [26]. 氫氣反應之電子數. nH 2. 1. [26]. 氫氣擴散係數. DH 2. 每單位一氧化碳所影響的範圍. λ. 氫氣吸附速率常數. k fH 0. 氫氣脫附速率常數. b fH. 氫氣電化學反應速率常數. k eH. 一氧化碳吸附速率常數. k fCO. 10 A/cm2atm. 一氧化碳脫附速率常數. b fCO 0. 1.51*10-9 atm. 一氧化碳電化學反應速率常數. k eCO. 1*10-8 A/cm2. 一氧化碳吉柏氏自由能. δ (∆GCO ). 氫氣活化能. δ (∆E H ). RT. RT. - 39 -. 2.59*10-6 cm2/s 4 – 6. [26] [29]. 100 A/cm2atm 0.5 4 A/cm2. 6.8. [29]. 4.6. [29].
(55) 1. 0.6. 2. CH / Cin. 0.8. 0.4. 0.2. 0. 0. 2. 4. 6. 8. Lc ( µm ) 圖 4-1 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,CO濃度 0 ppm, 觸媒層內氫氣濃度之穩態分佈圖。. - 40 -. 10.
(56) 1. 0.8. θH. 0.6. 0.4. 0.2. 0. 0. 2. 4. 6. 8. Lc ( µm ) 圖 4-2 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,CO濃度 0 ppm, 觸媒層內氫氣覆蓋率之穩態分佈圖。. - 41 -. 10.
(57) i ( A / cm2 ). 1.2. 0.8. 0.4. 0. 0. 2. 4. 6. 8. Lc ( µm ) 圖 4-3 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,CO濃度 0 ppm, 觸媒層內電流密度之穩態分佈圖。. - 42 -. 10.
(58) 1 t = 1 sec t = 1 0 0 sec t = 3 0 0 sec t = 5 4 1 sec. CH2 / Cin. 0.8. 0.6. 0.4. 0.2. 0. 0. 2. 4. 6. 8. L c ( µm ) 圖 4-4 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,CO濃度 100. ppm,觸媒層內氫氣濃度分佈隨時間之變化圖。. - 43 -. 10.
(59) 1. CCO / Cin. 0.8. 0.6. 0.4 t = 1 sec t = 1 0 sec t = 3 0 0 sec t = 5 4 1 sec. 0.2. 0. 0. 2. 4. 6. Lc ( µm ). 8. 圖 4-5 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,CO濃度 100. ppm,觸媒層內一氧化碳濃度分佈隨時間之變化圖。. - 44 -. 10.
(60) 1. t = 1 sec t = 1 0 0 sec t = 3 0 0 sec t = 5 4 1 sec. 0.8. θH. 0.6. 0.4. 0.2. 0. 0. 2. 4. 6. 8. Lc ( µm ) 圖 4-6 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,CO濃度 100. ppm,觸媒層內氫氣覆蓋率分佈隨時間之變化圖。. - 45 -. 10.
(61) 1. 0.8. θ CO. 0.6. 0.4. t = 1 sec t = 1 0 sec t = 1 0 0 sec t = 5 0 0 sec t = 5 4 1 sec. 0.2. 0. 0. 2. 4. 6. 8. Lc ( µm ) 圖 4-7 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,CO濃度 100. ppm,觸媒層內一氧化碳覆蓋率分佈隨時間之變化圖。. - 46 -. 10.
(62) i H2 ( A / cm2 ). 1.2. 0.8 t = 1 sec t = 1 0 0 sec t = 3 0 0 sec t = 5 4 1 sec 0.4. 0. 0. 2. 4. 6. 8. Lc ( µm ) 圖 4-8 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,CO濃度 100. ppm,觸媒層內氫氣產生之電流密度分佈隨時間之變化圖。. - 47 -. 10.
(63) 8x10-8 t = 1 sec t = 1 0 0 sec t = 3 0 0 sec t = 5 4 1 sec. iC O ( A / cm2 ). 6x10-8. 4x10-8. -8. 2x10. 0 0. 2. 4. 6. 8. Lc ( µm ) 圖 4-9 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,CO濃度 100. ppm,觸媒層內CO產生之電流密度分佈隨時間之變化圖。. - 48 -. 10.
(64) 1 CO 10 ppm CO 25 ppm CO 50 ppm CO 100 ppm. CH2 / Cin. 0.8. 0.6. 0.4. 0.2. 0. 0. 2. 4. 6. 8. L c ( µm ) 圖 4-10 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,不同CO濃度 下,觸媒層內氫氣濃度之穩態分佈圖。. - 49 -. 10.
(65) 1. CCO / Cin. 0.8. 0.6. 0.4. CO 10 ppm CO 25 ppm CO 50 ppm CO 100 ppm. 0.2. 0. 0. 2. 4. 6. Lc ( µm ). 8. 圖 4-11 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,不同CO濃度 下,觸媒層內CO濃度之穩態分佈圖。. - 50 -. 10.
(66) 1. CO 10 ppm CO 25 ppm CO 50 ppm CO 100 ppm. 0.8. θH. 0.6. 0.4. 0.2. 0. 0. 2. 4. 6. 8. Lc ( µm ) 圖 4-12 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,不同CO濃度 下,觸媒層內氫氣覆蓋率之穩態分佈圖。. - 51 -. 10.
(67) 1. 0.8. θ CO. 0.6. 0.4 CO 100 ppm CO 50 ppm CO 25 ppm CO 10 ppm. 0.2. 0. 0. 2. 4. 6. 8. Lc ( µm ) 圖 4-13 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,不同CO濃度 下,觸媒層內CO覆蓋率之穩態分佈圖。. - 52 -. 10.
(68) 0.8. Wang et al. [32] CO 10 ppm CO 100 ppm. i ( A / cm2 ). 0.6. Oetjen et al. [36] CO 25 ppm CO 50 ppm CO 100 ppm. 0.4. 0.2. present results CO 10 ppm CO 25 ppm CO 50 ppm CO 100 ppm. 0. 0. 2. 4. 6. 8. Lc ( µm ) 圖 4-14 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,不同CO濃度 下,觸媒層內電流密度之穩態分佈圖。. - 53 -. 10.
(69) 1.2. i ( A / cm2 ). 1. 0.8. 0.6. 0.4. 0.2. 0. 0. 200. 400. 600. 800. 1000. Cco ( ppm ) 圖 4-15 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,到達穩態時, 觸媒層內CO濃度與電流密度之關係圖。. - 54 -.
(70) 1600. tss ( sec ). 1200. 800. 400. 0. 0. 200. 400. 600. 800. 1000. C co ( ppm ) 圖 4-16 操作條件為η a = 0.01V,ε c = 0.4,L c = 10µm,到達穩態時, 觸媒層內CO濃度與到達穩態時間之關係圖。. - 55 -.
(71) 0.8 CO CO CO CO. i ( A / cm2 ). 0.6. 10ppm 25ppm 50ppm 100ppm. 0.4. 0.2. 0. 0. 4. 8. 12. 16. Lc ( µm ) 圖 4-17 操作條件為η a = 0.01V,ε c = 0.4,L c = 20µm,不同CO濃度 下,觸媒層內電流密度之穩態分佈圖。. - 56 -. 20.
(72) 0.8. i ( A / cm2 ). 0.7. 0.6. 0.5. 0.4. 5. 10. 15. 20. 25. ACL Thickness ( µm ) 圖 4-18 操作條件為η a = 0.01V,ε c = 0.4,CO濃度 10 ppm,到達穩 態時,觸媒層厚度與電流密度之關係圖。. - 57 -. 30.
(73) 2800. tss ( sec ). 2400. 2000. 1600. 1200. 5. 10. 15. 20. 25. ACL Thickness ( µm ) 圖 4-19 操作條件為η a = 0.01V,ε c = 0.4,CO濃度 10 ppm,觸媒層 厚度與到達穩態所需時間之關係圖。. - 58 -. 30.
(74) 1. i ( A / cm2 ). 0.8. εc = 0.5 εc = 0.4 εc = 0.3. 0.6. 0.4. 0.2. 0. 0. 2. 4. 6. 8. Lc ( µm ) 圖 4-20 操作條件為η a = 0.01V,CO濃度 100 ppm,不同ε c下,到達 穩態時,觸媒層距離與電流密度之關係圖。. - 59 -. 10.
(75) 1. εc = 0.5. i ( A / cm2 ). 0.8. εc = 0.4 εc = 0.3. 0.6. 0.4. 0.2. 0. 0. 2. 4. 6. 8. Lc ( µm ) 圖 4-21 操作條件為η a = 0.01V,CO濃度 50 ppm,不同ε c下,到達穩 態時,觸媒層距離與電流密度之關係圖。. - 60 -. 10.
(76) 1. i ( A / cm2 ). 0.8. 0.6. εc = 0.5. 0.4. εc = 0.4 εc = 0.3. 0.2. 0. 0. 2. 4. 6. 8. Lc ( µm ) 圖 4-22 操作條件為η a = 0.01V,CO濃度 10 ppm,不同ε c下,到達穩 態時,觸媒層距離與電流密度之關係圖。. - 61 -. 10.
(77) 五、結論與建議 目前一氧化碳毒化造成電池性能的衰退在實驗上已受到證實,如 果在數學模式上的建立能夠準確的預測電池性能,那未來應用電腦模 擬運算上將會使得燃料電池的發展更有效率。 本文的計算的區間主要是陽極觸媒層 ( 一氧化碳毒化的主要區 域),並結合厚度與暫態效應,將 Wang 等人的文章[21]做更進一步的 延伸,希望能藉由本文的結果,提供未來在發展一氧化碳毒化之全電 池模式時,作為拓展的基礎。. 5.1 結論 本文所探討的是當質子交換模燃料電池內部之陽極觸媒層,受到 一氧化碳毒化時,氫氣與一氧化碳的濃度、覆蓋率以及電流密度在觸 媒層內的分布情形,並加入暫態之效應,觀察對於時間的變化情形。 主要討論的參數包括不同的一氧化碳濃度、觸媒層厚度以及孔隙率所 造成的影響,經過數值計算後,可以獲得以下結論:. 1. 一氧化碳 100ppm 時需 541 秒,25ppm 時則延長至 946 秒,影響到 達穩態的時間,主要與一氧化碳和白金觸媒之間的鍵結的速度有 關,一氧化碳濃度越高,在觸媒表面鍵結的機會越高,到達穩態 所需的時間也越短。. 2. 通入一氧化碳的濃度在 25ppm 時,電池性能下降了 52.4%,通入 100ppm 時,則下降 74.7%,所通入的一氧化碳濃度越高,電池性 能下降越多。. - 62 -.
數據


相關文件
TRANSFER TEST SWITCH : NORMAL FUEL LEVEL TRANSMITTER: High Level FUEL PRESSURE SWITCH : Low Press TRANSFER PUMP SWITCH : ON. 敘述說明圖二中 Blocking
Lin Xueling, A Study on the Literary Images and Narrative Persuasion in Dunhuang Telling and Singing Literature "Qiu Yin Yi Ben". Hung Ifang, The Content and
Lin Xueling, A Study on the Literary Images and Narrative Persuasion in Dunhuang Telling and Singing Literature "Qiu Yin Yi Ben". Hung Ifang, The Content and
①尼古丁 ②焦油 ③一氧化碳
有人說「血液中之二氧化碳含量應該維持一定」 ,你認為這樣
Lin Xueling, A Study on the Literary Images and Narrative Persuasion in Dunhuang Telling and Singing Literature "Qiu Yin Yi Ben". Hung Ifang, The Content and
Teachers may encourage students to approach the poem as an unseen text to practise the steps of analysis and annotation, instead of relying on secondary
化學風化作用(Chemical Weathering) :係岩石被溶解、氧化及
![表 4-1 基本操作參數 參數 符號 值 電池溫度 T 353 K 陽極壓力 P 3 atm 開迴路電壓 U o 1.23 V [26] 傳輸係數 α 0.5 [26] 氫氣化學計量數 s H 2 0.5 [26] 氫氣反應之電子數 n H 2 1 [26] 氫氣擴散係數 D H 2 2.59*10 -6 cm 2 /s [26] 每單位一氧化碳所影響的範圍 λ 4 – 6 [29] 氫氣吸附速率常數 k fH 0](https://thumb-ap.123doks.com/thumbv2/9libinfo/8028020.161260/54.892.127.799.169.1148/開迴V傳輸係數α之電子數氫氣擴散每單位一氧化影響範圍λ.webp)