第三章 牡丹皮單寧酚之分析
第一節 牡丹皮單寧成分之高效能液相層析
3-1-1 前言
3-1-1-1 牡丹皮類藥材
「牡丹皮」以色丹者為上,雖結子而根上生苗入藥用其根皮故名。牡 丹皮在神農本草經收錄為上品,自古用於清熱、涼血、和血、消瘀等用於 鎮靜、鎮痛、為目的。據最近中藥典之記載,主治熱入血分、發斑、吐血、
衄血、骨蒸勞熱、婦人經閉等,為常用中藥材之一,本品為毛茛科植物 Paeonia suffruticosa Andrew (或 P. moutan)的乾燥根皮,多係栽培,主產於 安徽、四川、陝西、湖北、山東、甘肅等地,秋季或春初採挖洗淨泥土,
除去鬚根及莖苗,剝下根皮、晒干,「刮丹皮」則需刮去外皮,晒干即得。
本品呈圓筒狀或半圓筒狀,一側常有縱縫,兩邊多向內卷曲,長短不一,
一般長 2~3 寸,直徑 1~4 分,厚約一分,外表面灰褐色或紫褐色,有縱線 紋,微突起的長圓形橫生疤痕及須根痕,「刮丹皮」外表面則顯粉紅色,
內表面棕色或淡灰色有細縱紋,並常有多數亮銀星,在放大鏡下觀察,可 見為無色透明的針狀或柱狀結晶,質硬而脆,易折斷,斷面較平坦,外層 灰褐灰色或粉紅色,內層粉白色,有特殊香氣,味微苦而澀,稍有麻舌感。
牡丹皮在日本亦有出產,產於長野,奈良,年約十餘噸。韓國亦有產。但 據陳仁山藥物生產辨云:「兩論以朝鮮為好,向日多到,惟氣味萬不及中 國所產也」,究其品質上之分別如何,尚無人比較研究,牡丹皮以條長無 木心,皮厚斷面粉白色,粉性足,香氣濃,亮銀星多者佳,條細帶根鬚及 木心,斷面粉性小,無亮銀星者質次[92]。
Martiniu 早在 1878 年就從事於牡丹皮成分的研究[92]。而 Tahara 也對 此有濃厚的興趣,由於不斷的研究,因此在 1891 年首先從牡丹板之中,
抽出酚類化合物;經過檢定後命名為牡丹酚(Paeonol)[92]。爾後雖然有 研究的熱潮,但是都沒有突破性的進展,一直到 kariyone 在 1956 年時,
利用管柱分離的方法,很幸運的從 Suffruticosa Andrews 的根,分離出兩種 晶體配醣類。該配醣體經過水解,可分解成牡丹酚及醣類由牡丹酚與葡萄 糖結合者稱為丹皮 (Paeonoside,牡丹酚-右型配醣體),若再接一個阿 拉伯糖時稱鼠李丹皮 (Paeonolide)其化學構造如下:
67
OCH3
O COCH3
Glu Ara
Paeonol Paeonoside Paeonolide
由於有上述突破性的發現,大家對牡丹皮成分研究興起了熱潮,尤其 是日本學者,更是不遺餘力地從事此項工作[92]。因此先後發現牡丹皮中,
還有β-sitoterol、Campesterol、安息酸、芍藥醇(Paeoniflorin)[93]、苯甲 醯 氧 芍 藥 醇 ( Benzoyloxy paeoniflorin ) [94] 、 苯 甲 醯 芍 藥 醇
(Benzoylpaeoniflorin)及 0.15%的揮發油。
圖 3-1-1 牡丹皮植物之外觀圖[98] 圖 3-1-2 牡丹皮藥材之外觀圖[98]
牡丹皮在神農本草經列上品[49],其性微寒、味苦辛,入心、肝、腎 三經。主要用於清血熱、散瘀血、鎮痛及通經藥,對頭痛、腰痛、關節痛、
月經不調及產後諸病等有效。最近的藥理實驗發現,牡丹皮水煎劑有強烈 的抗菌作用,可抑制革蘭氏菌、大腸菌、葡萄球菌、連鎖狀球菌、枯菌之 增殖;有降血壓的功用,可治療原發性高血壓;能使鼻腔粘過敏症狀消失,
可治療過敏鼻炎[92]。Archi 發現牡丹皮的 70%甲醇萃取液可作為抗炎、抗 菌及抗過敏性症之藥劑[95]。
牡丹酚是牡丹皮的主要成份,根據 Harada[96]等人的研究報告,發現 它有鎮靜、催眼、鎮痛、退熱、抗痙等作用。可用為抗炎、抗菌及抗催產 劑[97]。
牡丹酚能使動物鎮靜、體溫降下,可抑制因腸傷寒疫苗引起之發熱現 象,能延長己巴比妥(hexobarbital)睡眼時間。對於小白鼠之尾部刺激法 或醋酸扭動症均有抑制作用,顯示有鎮痛效果。又有抑制由電擊法或 pentylentetrazole、番木鱉鹼(strychnine)、nicotine 等藥物引起之痙攣。
本品抽取物中之苯甲醯芍藥醇(benzoylpaeoniflorin)等,對於大白鼠 以 carrageenin 引起之浮腫有抑制作用。甲基芍藥 及牡丹酚能防止由 ADP 引起之血小板凝集作用,苯甲基芍藥 對於 plasminogen 活性化及 plasnin 有妨礙作用[98]。
3-1-1-2 單寧
單寧已於本篇第二章第一節介紹。單寧屬於多酚類化合物,是指分子量 500 以上的類黃酮酚類化合物(flavonoid phenolic compounds),以網狀 結構或氫鍵與蛋白質結合的物質,主要可分為縮合單寧(condensed tannins)與水解性單寧(hydrolysable tannins)二類。縮合單寧是由 flavan-3-ols 或 flavan-3,4-diols 縮合而成的聚合物[74]。水解性單寧則 分成沒食子單寧(gallotannins)及鞣花單寧(ellagitannins),為沒食 子酸(galic acid)或鞣花酸(ellagc acid)與糖類及其他類似的醇類 形成之聚酯類化合物,易為酸所水解[75]。
69
牡丹皮之單寧屬於水解性單寧。1992 年 Itsuo Nishioka[69]等人曾以 逆相 HPLC 分析大戟屬植物中水解型單寧,而所分析成分在層析圖中多有 重疊,且時間冗長(90 分鐘);1995 年 Haruo Kawamoto[107]等人利用 HPLC 測量水解型單寧的含量,本文擬開發簡便的丹皮單寧分析方法。
3-1-1-3 丹皮單寧指標成分之結構
本章節利用逆相高效能液相層析法分析牡丹皮中的八個牡丹皮單寧 成分【 4,6-di-GG (1),1,2,3,6-tetra-GG (2) ,1,2,3,4,6-penta-GG (3) , 1,3,4,6-tetra-GG (4) ,3,4,6-tri-GG (5) ,1,3,6-tri-GG (6) , 3,6-di-GG (7) , 1,2,6-tri-GG (8) 。指標成分,並評估此分析方法之適宜性。
八個指標成分結構如下:
1. 4,6-di-GG 2. 1,2,3,6-tetra-GG
O OH
HO C HO
HO
HO
O
OH CH2
O C HO OH
HO
O
O
O HO
CH2 C HO OH
HO
O O
C HO
HO
HO O
O
C
OH OH OH
O O
C
HO OH OH O
O
3. 1,2,3,4,6-penta-GG 4. 1,3,4,6-tetra-GG
5. 3,4,6-tri-GG 6. 1,3,6-tri-GG
O CH2 C HO OH
HO
O O
C HO
HO
HO O
O
C
OH OH OH
O O
C
HO OH OH O
O C
HO
HO
HO
O
O
O OH
OH CH2 C HO OH
HO
O
O
C HO
HO
HO
O O C HO
HO
HO
O
O
O
OH HO
CH2 C HO OH
HO
O
O
C HO
HO
HO O
O
C
OH OH OH
O O
O
OH CH2 C HO OH
HO
O
O
C HO
HO
HO O
O
C
OH OH OH
O O
C HO
HO
HO
O
O
71
7. 3,6-di-GG 8 1,2,6-tri-GG
IS protocatechuic acid
圖 3-1-3 牡丹皮指標成分結構圖
O OH
OH HO
CH2 C HO OH
HO
O
O
C HO
HO
HO
O O
O HO
CH2 C HO OH
HO
O
O
C
OH OH OH
O HO
C
HO OH
OH O
O
O
COOH
OH OH
3-1-2 實驗部分
3-1-2-1 藥品與儀器
3-1-2-1-1 實驗藥品
(1) 牡丹皮的指標成分 4,6-di-GG (1),1,2,3,6-tetra-GG (2),1,2,3,4,6- penta-GG (3) , 1,3,4,6-tetra-GG (4) ,3,4,6-tri-GG (5) ,1,3,6-tri-GG (6) , 3,6-di-GG (7) ,1,2,6-tri-GG (8) 。為大仁技術學院林大禎博 士提供。
(2) 內標準品protocatechuic acid購自Nacalai Tesque (Kyoto, Japan)。
(3) 磷酸鹽及磷酸購自Acros (New Jersey, USA),甲醇(Methanol)及氰甲 烷(Acetonitrile)購自Merck(Darmatadt,Germany)。
(4) 配 置 樣 品 及 流 動 相 的 去 離 子 水 (deionized water) 取 自 於 Milli-Q System (Millipore, Bedford,MA,USA)。
3-1-2-1-2 實驗儀器
(1)高效能液相層析(HPLC) 泵:Waters 510 pump 兩個
注射器:Microliter type 802 (25µL loop) 偵測器:Waters 990 photodiode array detector
資料處理器:Shimadzu SPD-M10AVP and 宏碁-586電腦 (2)酸鹼測定儀( pH meter ):Suntex SP-2200
(3)超音波震盪器:Elma Transsonic Sigital
(4)離心機:Hettic Universal 轉盤為10 mL(15mL)¯12 (5)pipette:Nichiryo (Japan) 0-1 mL,0-5 mL兩支
73
3-1-2-2 分析條件
3-1-2-2-1 最佳分析條件
前置管柱:Guard-Pak µ-Bondapak C18(Millipore, Milford, MA, USA) 分離管柱:Cosmosil 5C18-MS, 5µm, 25cm×4.6mm (Nacalai tesque,
Kyoto, Japan)
流動相: (A) 20 mM KH2PO4(以 10%H3PO4 調整至 pH = 4.00) (B) CH3OH/H2O=70/30
梯度沖提程式:
表3-1-1 丹皮單寧分析方法之梯度沖提程式 時間(min)
流速
(mL/min) A% B% Curve initial 1.0 100 0
15 1.0 85 15 linear 25 1.0 70 30 linear 35 1.0 50 50 linear 45 1.0 50 50 linear 50 1.0 0 100 linear 55 1.0 0 100 linear 60 1.0 100 0 linear
分析時間:60分鐘 平衡時間:15分鐘 偵測波長:280 nm
3-1-2-2-2 分析條件的選擇
(1)分離管柱的選擇
選擇四種不同填充材料之管柱(表3-1-2),以表3-1-1之梯度沖提程式及 流動相分析條件進行分析,各組進行兩次重覆注射,以探討不同填充材料 之管柱對各成分的分離效果。
表3-1-2 分離管柱的種類及其材質表 管柱品名a 孔徑
(Å)
表面積 (m2/g)
含碳比 (%)
鍵結型式b 110 330 20 mono 120 300 16 mono 120 300 16 polymeric Cosmosil 5C18
Cosmosil 5C18-MS Cosmosil 5C18-AR
Cosmosil 5C18-AR II 120 300 17 polymeric
a.四種管柱皆是出自Nacalai tesque, Kyoto, Japan。
填充粒子大小 5 µm,長度 25cm,內徑 4.6mm。
b.
(CH2)17CH3
(2)流動相(A)中不同鹽類濃度的探討
選定最適當的分離管柱後,分別配製20、30、40、50 mM的磷酸二氫 鉀溶液,並用磷酸將pH值調至4.00作為一系列流動相(A),以前述之梯度沖 提程式進行分析,各組重覆二次注射。
(3)流動相(A)中不同酸鹼值的探討
在最適當的磷酸鹽濃度流動相(A)中加入不同量10%的磷酸,配製不同 酸鹼度的緩衝溶液,其pH值範圍由2.50至5.00,以前述之梯度沖提程式進 行分析,各組重覆二次注射。
(4)流動相(B)中不同甲醇/水之比例的探討
由於鹽類的加入,流動相(B)需含適量的水,以防止鹽類析出及獲得較 平整的基線,所以配製不同甲醇/水比例的流動相(B),比例分別為甲醇/水 (V/V) = 90/10,80/20,70/30,60/40,50/50。依上述適當的磷酸鹽緩衝溶
75
液及梯度沖提程式進行分析,每組重覆操作兩次。
3-1-2-2-3 配製標準品溶液及製作檢量線
稱取26.0 mg 的protocatechuic acid 以70%甲醇配成25 mL溶液,做為 內標準品溶液(IS)。
分別稱取 4,6-di-GG (1) 4.2 mg,1,2,3,6-tetra-GG (2) 4.0 mg,1,2,3,4,6- penta-GG (3) 2.3 mg, 1,3,4,6-tetra-GG (4) 3.2 mg,3,4,6-tri-GG (5) 3.7 mg,
1,3,6-tri-GG (6) 1.5 mg, 4,6-di-GG (7) 3.7 mg,1,2,6-tri-GG (8) 1.5 mg,溶 於 70%甲醇,分別配成 10 mL 標準品母液 1-8 【
I
】。分別以吸量管取標準母液【
I
】中4,6-di-GG (1)6.0mL、1,2,3,6-tetra-GG (2) 6.0mL 、1,2,3,4,6- penta-GG (3) 6.0 mL為標準母液【II
】,分別取標準 母液【II
】5.0、3.0、2.0、1.0、0.5 mL之標準品於量瓶中,各加入1.0 mL 之內標準品溶液,再以70%甲醇配成10 mL溶液。分別以吸量管取標準母液【
I
】中 1,3,4,6-tetra-GG (4)5.0mL、4,6-di-GG (7) 5.0 mL、 1,2,6-tri-GG (8) 6.0 mL為標準母液【III
】,分別取標準母液【III
】 4.5、3.5、3.0、2.5、1.5、0.5 mL之標準品於量瓶中,各加入1.0 mL之內標 準品溶液,再以70%甲醇配成10 mL溶液。分別以吸量管取標準母液【
I
】中3,4,6-tri-GG (5) 5.0 mL 、1,3,6-tri-GG (6) 6.0mL為標準母液【IV】,分別取標準母液【IV】3.5、3.0、2.5、1.5、0.5 mL之標準品於量瓶中,各加入1.0 mL之內標準品溶液,再以70%甲醇 配成10 mL溶液。
各濃度的標準品1-8,分別在280 nm波長下,以3-1-2-2-1之最佳分析條 件重覆兩次分析,每次注入10 µL ,取其平均值作檢量線。
3-1-2-2-4 分析條件之適宜性評估
(1)再現性(Reproducibility)
取標準母液【
II
】1.0 mL、標準母液【III
】1.0 mL及標準母液【IV】1.0 mL於量瓶中,加入1.0 mL之內標準品溶液,以70%甲醇水溶液稀釋至 10mL , 作 為 檢 液 。 每 次 注 射 10 μ L 進 行 分 析 ; 同 一 天 內 重 覆 六 次 ( intraday ),不同天總計重覆六次 ( interday ) 。
(2)回收率(Recovery)
精稱牡丹皮粉末 1.0 g,以70%甲醇10 mL作為萃取溶劑,超音波震盪 15 分鐘後離心,重覆三次,合併萃取液,濃縮至10 mL,取5mL於10mL 量瓶,加入0.5 mL標準母液【
II
】、0.5 mL標準母液【III
】及0.5 mL標準母 液【IV】,再加入1.0 mL之內標準品溶液,以70%甲醇水溶液稀釋至10 mL,經 0.45μm濾膜過濾,作為檢液。以3-1-2-2-1之最佳分析條件重覆兩次分 析,每次注射10μL進行分析,定量值為兩次注射的平均分析結果。
(3)偵測極限
逐步稀釋標準品溶液,注入偵測,直到 signal /noise = 3 / 1以下,計算 其注入量及其濃度。
3-1-2-2-5 桂皮之定量分析
精稱牡丹皮粉末 1.0 g,以 70%甲醇 10 mL 作為萃取溶劑,超音波震 盪 15 分鐘後離心,重覆三次,合併萃取液,濃縮至 10 mL,取 5mL 於 10mL 量瓶中,加入 1 mL 的內標準品溶液,再以 70%甲醇稀釋至 10 mL,
經 0.45μm 濾膜過濾,再經過 Silica 材質的 Sep-pak 過濾,依 70%甲苯沖 提液沖提,作為檢液。以 3-1-2-2-1 之最佳分析條件重覆兩次分析,每次注 射 10μL 進行分析,定量值為兩次注射的平均分析結果。
3-1-3 結果與討論
3-1-3-1 分析條件的選擇
1992年,Nishioka[69]等人以逆相HPLC分析大戟植物中的水解型單 寧,但因所分析成分在層析圖中解析度並不理想,且用磷酸溶液,酸性太
77
強(H=1.60),對管柱壽命的維持十分不利。因此,改為磷酸鹽條件,並 以甲醇取代氰甲烷作為流動相。
(1)偵測波長的選擇
由附錄一中可以看出,發現1-8化合物的最大吸收波長在210nm附近,
由於B相中是以甲醇為主,甲醇在210 nm會有很大的吸收,因此選擇第二 大吸收波長【4,6-di-GG (1)210nm、278nm,1,2,3,6-tetra-GG (2) 210nm、
278nm,1,2,3,4,6- penta-GG (3) 210nm、278nm,1,3,4,6-tetra-GG (4) 210nm、
278nm, 3,4,6-tri-GG (5) 210nm、278nm,1,3,6-tri-GG (6) 210nm、278nm,
3,6-di-GG (7) 210nm、278nm,1,2,6-tri-GG (8) 210nm、278nm,】,故以280nm 進行樣品分析。
(2)分離管柱的選擇
本實驗室積多年經驗,發現cosmosil
5C18、5C18-MS、5C18-AR
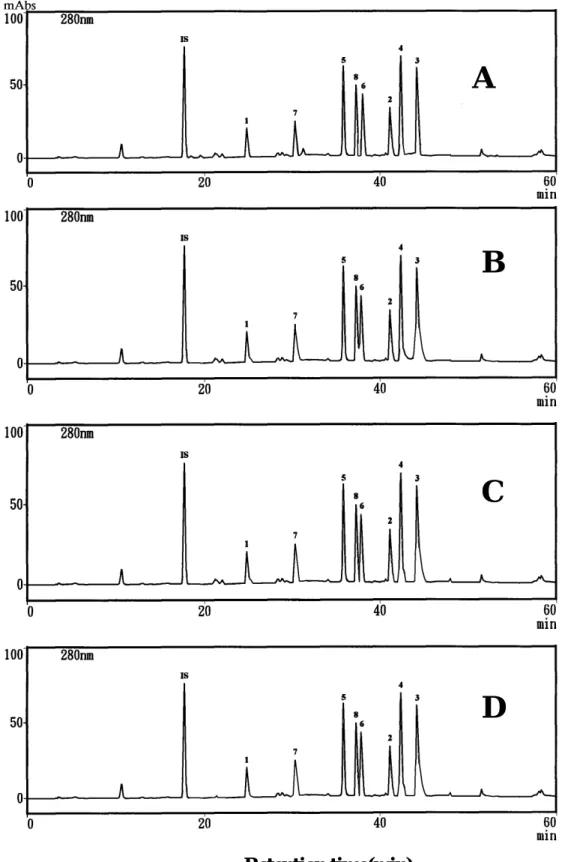
是天然 藥材物分析較理想的管柱。在牡丹皮成分分析上,本文選取該三種管柱,加上近年來新開發的5C18-AR II等四種來比較,分析圖譜如圖3-1-4。經整 理,其Rs及N值結果如表3-1-3、圖3-1-5及圖3-1-6所示,發現5C18-MS管柱 分析成分1 –8結果不錯,其理論板數最好。
表 3-1-3 不同分析管柱與各成分 N 值(N×104)的關係表
化合物 5C18-MS 5C18 5C18-AR 5C18-AR II
1 13.72 2.28 4.38 5.51
2 11.61 2.21 5.61 2.52
3 11.58 1.45 4.98 3.96
4 10.54 2.76 4.87 5.99
5 5.14 4.11 4.86 4.28
6 6.66 2.82 3.56 3.76
7 5.44 1.82 2.49 1.21
8 6.00 3.22 3.43 4.21
若由表3-1-4解析度來做比較, 5C18管柱分離6和8之解析度最差;
5C18-AR及5C18-AR II在6/8的解析度均在1以上,但還是以5C18-MS在6/8 的解析度最好;對全部指標成分而言,5C18-MS、5C18-AR及5C18-AR II 均可有效分離,但綜合理論板數及解析度兩因素,則以5C18-MS最佳。
表 3-1-4 不同管柱與 Rs 值的關係表
Rs 5C18-MS 5C18 5C18-AR 5C18-AR II 6/8 1.599 0.761 1.001 1.061
(3)流動相(A)中不同鹽類濃度的探討
在本篇第二章第一節中曾討論桂皮單寧成分之分析,以採用磷酸鹽系 統作為分析流動相(A)最宜,故本節先以磷酸鹽作為流動相(A)來探討分析 效果。
為了探討磷酸鹽對各化合物的影響,在流動相(A)中溶有不同濃度 之磷酸鹽及適當量之磷酸,使pH=4.00,作一系列比較。結果如圖2-1-7。
由圖中可看到,對大部分成分而言,磷酸鹽濃度由20~50 mM皆有不錯的分 離效果。當磷酸鹽濃度增加時,對於5、6和8等成分解析度不佳以外,其 它化合物皆能明顯分離。由圖2-1-7的K’值可以看出在水相中加入磷酸鹽 後,化合物的滯留時間縮短,這主要是因為磷酸鹽可覆蓋管柱表面殘餘矽 羥基基團,因而阻止吸附樣品及參與離子樣品的滯留,因此分析時間縮短。
然而,濃度過高可能造成鹽類析出,降低管柱壽命,對於泵的損耗較 大;由圖中可看出磷酸鹽濃度對大部分成分的分離並無太大影響,唯獨對 於5、6和8等成分影響較大,因為這四種成分受磷酸鹽濃度影響不同,且 滯留時間非常接近,故在磷酸鹽濃度的選擇上,考量以這四種成分的解析 度大小為指標,其解析度如表2-1-6所示,其中可看到在濃度40mM、50mM時 5、6和8等成分的解析度較差,而濃度20mM時5、6和8等成分之解析度佳且 理論板數亦優(5.14×104至1.37×105),所有化合物之理論板數如表3-1-5及 圖3-1-8所示。考量管柱保養和成分分離解析度二方面的數據,選擇20mM磷
79
酸鹽作為流動相(A)的濃度。
表3-1-5 添加不同濃度磷酸鹽與各成分N值(N×104)的關係表
化合物 20 mM 30 mM 40 mM 50 mM
pH 4.00 4.00 4.00 4.00 1 13.72 8.34 7.79 6.89 2 11.61 10.33 7.21 8.63 3 11.58 6.75 5.56 4.75 4 10.54 9.18 6.36 7.50 5 5.14 2.65 0.52 1.02 6 6.66 1.01 0.86 0.59 7 5.44 1.75 0.66 0.76 8 6.00 2.01 1.52 0.58
表3-1-6 添加不同濃度磷酸鹽與Rs值的關係表
Rs 20 mM 30 mM 40 mM 50 mM 5/8 2.081 1.241 0.812 0.775 6/8 1.599 1.001 0.765 0.654
(4)流動相(A)中不同酸鹼值的探討
在 20 mM 磷酸二氫鉀容液中,加入不等量的 10%磷酸,配製不同 pH 值 的流動相(A),其值分別為 2.5、3.0、3.5、4.0、4.5、5.0 來探討 pH 值對 分離的影響,圖 3-1-9 顯示酸鹼值與 k’值的關係。事實上,當 pH 低於 3.0 時,吸收峰 5、6、8 解析度較差,參見表 3-1-8,且理論板數也大幅下降,
參見表 3-1-7 及圖 3-1-10。因此,考量解析度與滯留時間等因素,本研究 選擇 20mM 磷酸二氫鉀水溶液,以 10%磷酸調整 pH 值至 4.00 作為流動 相(A)的組成。
表3-1-7不同酸鹼值與各成分N值(N×104)的關係表
化合物 2.50 3.00 3.50 4.00 4.50 5.00
1 8.12 8.88 7.72 13.72 6.42 7.67 2 8.56 1.31 8.76 11.61 9.65 10.65 3 5.52 3.02 6.01 11.58 4.12 2.67 4 10.27 8.65 9.12 10.54 7.41 8.34 5 2.60 3.03 3.23 5.14 1.22 1.63 6 2.30 3.20 2.79 6.66 0.84 1.48 7 1.52 2.31 2.34 5.44 0.68 1.61 8 2.01 3.04 4.14 6.00 5.01 4.02
表3-1-8不同酸鹼值與Rs值的關係表
Rs 2.50 3.00 3.50 4.00 4.50 5.00 5/8 0.520 0.623 1.052 2.081 0.970 1.021 6/8 0.642 0.789 0.902 1.599 1.201 0.901
(5)流動相(B)中不同甲醇/水之比例的探討
由於流動相(A)中含有鹽類,當與完全為有機溶劑之流動相(B)混 合時很容易析出鹽類,且考量當二流動相混合時會有溫度的變化,導致基 線的不穩,故主體為有機溶劑之流動相(B)應包含適量的水,以防止鹽 類析出並有平整基線。
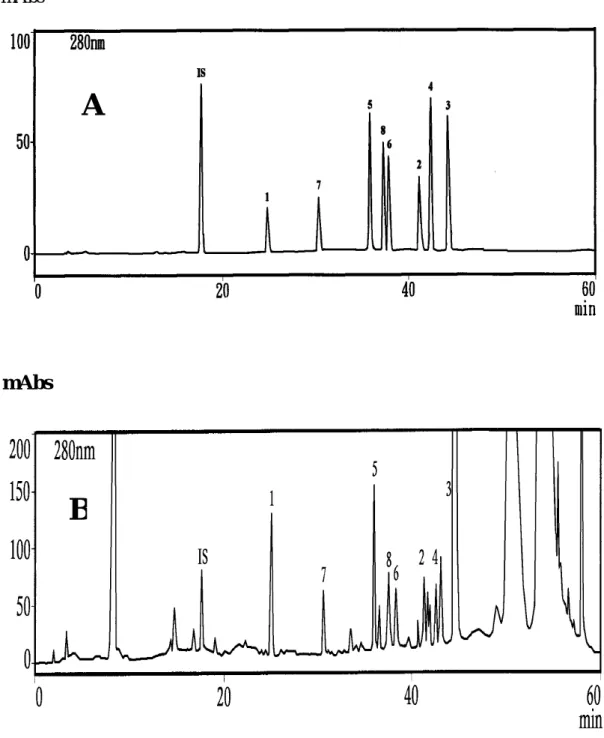
本篇第二章第一節開發的桂皮單寧成分分析條件,在B相中是以氰甲烷 為主,本節也曾經用氰甲烷/水的體積比例為80/20、70/30作為流動相(B), 由於牡丹皮單寧中之1、2、4和7成分在此條件下無法分離,結果如圖 3-1-13。因此改用甲醇代替氰甲烷,因為甲醇的表面張力及黏滯係數較氰 甲烷大,可使化合物1、2、4和7滯留時間變長,1、2、4和7成分得以分離,
但卻使5、6和8化合物解析度變差,故改變甲醇/水的體積比例為90/10、
80/20、70/30、60/40、50/50來探討流動相(B)比例對k’值的影響,結果 如圖3-1-11所示。由圖可看出水比例愈高,各成分之滯留時間愈長。如同 pH值影響的探討所述,由於各化合物滯留時間差距相當接近,在此仍以較 接近的5與8及6、8等兩組成份的解析度為抉擇依據,其值如表3-1-10。
81
由表3-1-10可知在70/30比例時有不錯的解析度,再由理論板數來看(表 3-1-9及圖3-1-12),在流動相B中增加甲醇比例,理論板數會降低,總體而 言以70/30的比例為最佳。另外當甲醇比例太高時,容易造成鹽類析出而對 管柱有不利的影響。因此,本研究方法選擇甲醇/水之體積比例=70/30作 為流動相(B)之組成。
表 3-1-9 不同甲醇/水比例與各成分 N 值(N×104)的關係表
化合物 90/10 80/20 70/30 60/40 50/50
1 2.95 2.88 13.72 10.82 9.21 2 5.35 3.84 11.61 9.64 10.21 3 1.87 1.78 11.58 8.87 5.78 4 3.89 4.12 10.54 7.61 6.45 5 1.27 1.58 5.14 4.23 1.34 6 0.35 0.56 6.66 3.96 1.01 7 0.41 0.68 5.44 3.50 1.05 8 2.12 2.02 6.00 4.03 2.01
表 3-1-10 不同甲醇/水比例與 Rs 值的關係表
Rs 90/10 80/20 70/30 60/40 50/50
5/8 0.813 1.103 2.081 1.242 1.065
6/8 0.701 1.099 1.599 1.076 1.009
Retention time(min)
圖 3-1-4 牡丹皮用不同分析管柱的分析圖譜 (A)5C18-MS (B)5C18 (C)5C18-AR (D)5C18-AR II
(成分結構圖,如圖 3-1-3 pp.69-71)
B A
C
D
83
6 7 8 9 10 11 12 13 14 15 16
5C18-MS 5C18 5C18-AR 5C18-ARII
Columns
k' (capacity factor)
1 2 3 4 5 6 7 8
圖 3-1-5 不同管柱與各成分 k’值的關係圖
0 2 4 6 8 10 12 14 16
5C18-MS 5C18 5C18-AR 5C18-ARII
Columns
N (theoretical plate number) x10
41 2 3 4 5 6 7 8
圖 3-1-6 不同管柱與各成分 N 值的關係圖
85
6.00 7.00 8.00 9.00 10.00 11.00 12.00 13.00 14.00 15.00 16.00
20 30 40 50
KH2PO4 cono. (mM)
K'(Capacity factor )
1 2 3 4 5 6 7 8
圖 3-1-7 流動相 A 中磷酸鹽濃度與各成分 k’值的關係圖
0 2 4 6 8 10 12 14 16
20 30 40 50
KH2PO4 cono. (mM)
N (theoretical plate number) x 10
41 2 3 4 5 6 7 8
圖 3-1-8 流動相 A 中磷酸鹽濃度與各成分 N 值的關係圖
87
5 7 9 11 13 15 17
2.5 3 3.5 4 4.5 5
pH value
k' (capacity factor)
1 2 3 4 5 6 7 8
圖 3-1-9 流動相 A 中不同酸鹼值與各成分 k’值的關係圖
0 2 4 6 8 10 12 14 16
2.5 3 3.5 4 4.5 5
pH value
N (theoretical plate number) x 10
41 2 3 4 5 6 7 8
圖 3-1-10 流動相 A 中不同酸鹼值與各成分 N 值的關係圖
89
5 7 9 11 13 15 17
90% 80% 70% 60% 50%
CH3OH (%)
K' (capacity factor)
1 2 3 4 5 6 7 8
圖 3-1-11 流動相 B 中甲醇/水比例與各成分 k’值的關係圖
0 2 4 6 8 10 12 14 16
90% 80% 70% 60% 50%
CH3OH (%)
N (theoretical plate number) x 10
41 2 3 4 5 6 7 8
圖 3-1-12 流動相 B 中甲醇/水比例與各成分 N 值的關係圖
91
2-1-3-2 檢量線的製作
由附錄一中各成分的UV圖可以看到,1-8化合物的最大吸收波長都在 210nm,由於B相中含有甲醇,甲醇在210 nm有很大的吸收峰故以第二大 波長280 nm做檢量線,結果如表3-1-11。
依實驗3-2-2-2所述,以吸收峰面積與內標準品面積的比值(y)與各成分 的濃度(x, mg/mL)關係作圖,得檢量線方程式:
表3-1-11 牡丹皮單寧成分在280nm之檢量線 y=ax+b
(y=peak-area ratio,x=conc.(mg/mL)) 線性範圍 Slope Intercept R2 Compound
(µg/mL) a b 1 4,6-di-GG 21.0 – 336 10.189 -0.0433 0.9995 2 1,2,3,6-tetra-GG 20.0 – 320 17.677 -0.0762 0.9990 3 1,2,3,4,6-penta-GG 23.0 – 368 14.182 +0.084 0.9993 4 1,3,4,6-tetra-GG 16.0 – 256 28.296 -0.0410 0.9999 5 3,4,6-tri-GG 18.5 – 296 6.467 0.0158 0.9999 6 1,3,6-tri-GG 15.0 – 240 24.580 0.0789 0.9996 7 3,6-di-GG 18.5 – 296 6.467 -0.0158 0.9995 8 1,2,6-tri-GG 15.0 – 240 24.580 -0.0789 0.9991
3-1-3-3 分析條件之適宜性評估
(1)再現性
以 最 佳 分 析 條 件 對 各 成 分 進 行 定 量 , 在 同 一 天 內 連 續 注 射 六 次 ( intraday )及不同天總計注射六次 ( interday )。分別以吸收峰面積比及遷移 時間,來計算相對標準偏差 ( RSD, % ),見表3-1-12。
一般而言,在有機相比例較高時,管柱內表面張力較小,再現性良好,
滯留時間之RSD值均在3%以內,同一天滯留時間的相對標準偏差可在 0.28-0.56%,不同天滯留時間的相對標準偏差可在0.22-0.95%之間。
同一天面積比的相對標準偏差在1.16-2.79%之間,不同天面積比的相 對標準偏差在0.19-2.43%之間,照常理不同天面積比的相對標準偏差應該 大於同一天面積比的相對標準偏差,但每天前洗較長時間、前置管柱也得 充分清洗使得管柱沖洗得較乾淨,以致於不同天的RSD有小於同一天RSD 者,不過其值都小於4,可以看出再現性良好。
表 3-1-12 牡丹皮分析條件之再現性 再現性(RSD,%)
化合物 Intraday(n=6) Interday(n=6) 面積比 滯留時間 面積比 滯留時間 1 1.63 0.32 2.10 0.95 2 2.79 0.35 1.00 0.44 3 1.16 0.28 2.43 0.37 4 2.18 0.35 0.19 0.46 5 1.49 0.46 1.12 0.53 6 1.83 0.49 0.51 0.27 7 1.39 0.41 1.89 0.76 8 1.47 0.56 0.54 0.22
(2)回收率(Recovery)
以3-2-1之最佳分析條件重覆兩次分析,每次注射10μL進行分析,定 量值為兩次注射的平均分析結果。結果顯示在已知含量成分的桂皮藥材中 添加各成分純品,如表3-1-13所示。各成分的回收率97-103﹪之間。
(3)偵測極限
逐步稀釋標準品母液,每次注入10μL予以分析,直到signal/noise = 3/1 以下,並記錄此時的濃度值及注入量。結果如表3-1-13:
93
表3-1-13 牡丹皮單寧分析條件之回收率與偵測極限 偵測極限
化合物 回收率
(%) µg/mL ng 1 97 0.51 10.20 2 98 0.07 1.34 3 99 0.08 1.54 4 101 0.04 0.80 5 103 0.72 14.43 6 99 0.05 1.00 7 97 0.93 18.66 8 99 0.05 1.00
3-1-3-4 牡丹皮藥材定量結果
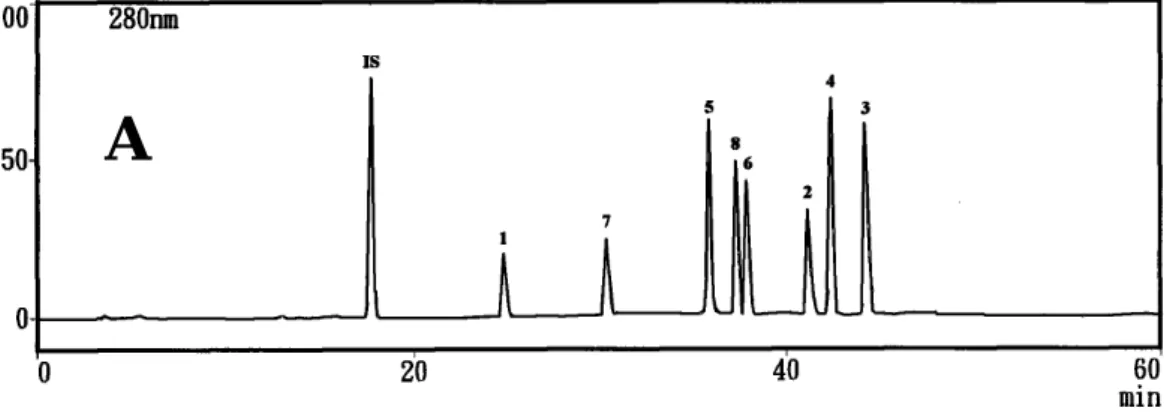
取市售牡丹皮藥材三批(n=3)萃取液進行定量,重覆注射3次,求 各成分含量之平均值,結果如表3-1-14。層析圖譜見圖3-1-14。
表 3-1-14 牡丹皮藥材單寧成分定量結果
化合物 代碼 mean±SD
(mg/g)
4,6-di-GG 1 15.155 ± 0.002 1,2,3,6-tetra-GG 2 6.706 ± 0.002 1,2,3,4,6-penta-GG 3 147.089 ± 0.021 1,3,4,6-tetra-GG 4 6.396 ± 0.011 3,4,6-tri-GG 5 10.547 ± 0.008 1,3,6-tri-GG 6 9.964 ± 0.007
3,6-di-GG 7 8.121 ± 0.005 1,2,6-tri-GG 8 2.454 ± 0.006 Total 206.428 ± 0.019
Retention time (min)
圖 3-1-13 不同 B 相的丹皮單寧成分分析圖譜 (A)CH3CN﹝70%﹞(B)CH3OH﹝70%﹞
(成分結構圖,如圖 3-1-3 pp.69-71)
A
B
mAbs
mAbs
95
mAbs
Retention time (min)
圖 3-1-14 牡丹皮藥材之 HPLC 層析圖 (A)八個標準品(B)市售藥材
(成分結構圖,如圖 3-1-3 pp.69-71)
A
B
mAbs
第二節 牡丹皮單寧檢液之製備
3-2-1 前言
中藥組成成分繁多複雜,具有許多結構相似、物理性質相同的物質,
因此在定量分析上,常會遭遇許多未知成分的干擾而成效不佳。桂皮藥材 即有此困擾。本章第一節利用 HPLC 分析牡丹皮之單寧成分,在標準品的 分析上雖有不錯的分離,但在藥材方面由於雜質較多而使吸收峰無法回到 基線。在牡丹皮各單寧成分中 1,2,3,6-tetra-GG (2)、1,2,3,4,6-penta-GG (3) 和 1,3,4,6-tetra-GG (4)會和未知化合物重疊,而且因為眾多微量成分的存 在,使得基線非常不平穩,常導致積分上的困擾。
因而嘗試利用不同萃取方法或前處理,希望藉由提高指標成分的濃度 或去除未知物的干擾,來改善桂皮藥材的分析,處理方法以下列二個方向 來進行:
1. 不同種類的萃取溶液 2. 經過系列前處理
a. 選擇不同 sep-pak b. 選擇不同沖提流程
本章節利用前處理使牡丹皮藥材中的八個單寧成分做有效定量,尤其 1,2,3,6-tetra-GG (2)、1,2,3,4,6-penta-GG (3)和 1,3,4,6-tetra-GG (4)受到未知 物干擾的此三個指標成分結構如下:
2. 1,2,3,6-tetra-GG 3. 1,2,3,4,6-penta-GG
O HO
CH2 C HO OH
HO
O O
C HO
HO
HO O
O
C
OH OH OH
O O
C
HO OH OH O
O
O CH2 C HO OH
HO
O O
C HO
HO
HO O
O
C
OH OH OH
O O
C
HO OH OH O
O C
HO
HO
HO
O
O
97
4. 1,3,4,6-tetra-GG
圖 3-2-1 牡丹皮指標成分結構圖
3-2-2 實驗部分
3-2-2-1 藥品與儀器
3-2-2-1-1 實驗藥品
(1) 牡丹皮的指標成分 4,6-di-GG (1),1,2,3,6-tetra-GG (2),1,2,3,4,6- penta-GG (3) , 1,3,4,6-tetra-GG (4) ,3,4,6-tri-GG (5) ,1,3,6-tri-GG (6) , 3,6-di-GG (7) ,1,2,6-tri-GG (8) 。為大仁技術學院林大禎博 士提供。
(2) 內標準品protocatechuic acid購自Nacalai Tesque (Kyoto, Japan)。
(3) 磷酸鹽及磷酸購自Acros (New Jersey, USA),丙酮(Aceton)、乙酸乙 酯(Ether acetate)、乙醚(Ether)、正己烷(n-Hexane)、甲苯(Toluene)、
甲醇(Methanol)及氰甲烷(Acetonitrile)購Merck(Darmatadt,Germany)。
(4) 配 置 樣 品 及 流 動 相 的 去 離 子 水 (deionized water) 取 自 於 Milli-Q System (Millipore, Bedford,MA,USA)。
(5) Sep-Pak(C18、C8、CM、Silica) 購自Waters
O
OH CH2 C HO OH
HO
O
O
C HO
HO
HO O
O
C
OH OH OH
O O
C HO
HO
HO
O
O
3-2-2-1-2 實驗儀器
(1)高效能液相層析(HPLC) 泵:Waters 510 pump 兩個
注射器:Microliter type 802 (25µL loop) 偵測器:Waters 990 photodiode array detector
資料處理器:Shimadzu SPD-M10AVP and 宏碁-586電腦 (2)酸鹼測定儀( pH meter ):Suntex SP-2200
(3)超音波震盪器:Elma Transsonic Sigital
(4)離心機:Hettic Universal 轉盤為10 mL(15mL)¯12 (5)pipette:Nichiryo (Japan) 0-1 mL,0-5 mL兩支
3-2-2-2 分析條件
3-2-2-2-1 最佳分析條件
前置管柱:Guard-Pak µ-Bondapak C18(Millipore, Milford, MA, USA) 分離管柱:Cosmosil 5C18-MS, 5µm, 25cm×4.6mm (Nacalai tesque,
Kyoto, Japan)
流動相: (A) 20 mM KH2PO4(以 10%H3PO4 調整至 pH = 4.00) (B) CH3OH/H2O=70/30
梯度沖提程式:
表3-2-1 牡丹皮單寧分析方法之梯度沖提程式 時間(min)
流速
(mL/min) A% B% Curve initial 1.0 100 0
15 1.0 85 15 linear 25 1.0 70 30 linear 35 1.0 50 50 linear 45 1.0 50 50 linear 50 1.0 0 100 linear 55 1.0 0 100 linear 60 1.0 100 0 linear
99
分析時間:60分鐘 平衡時間:15分鐘 偵測波長:280 nm
3-2-2-2-2 配製適當檢液之探討 (1)採用不同種類之萃取溶劑
精稱牡丹皮粉末 1.0 g,以 70%甲醇 10 mL 作為萃取溶劑,超音波震 盪 15 分鐘後離心,重覆三次,合併萃取液,濃縮至 10 mL,取 5mL 於 10mL 量瓶中,加入 1 mL 的內標準品溶液,再以 70%甲醇稀釋至 10 mL,
經 0.45μm 濾膜過濾,作為檢液。以 3-2-2-2-1 之最佳分析條件重覆兩次分 析,每次注射 10μL 進行分析,定量值為兩次注射的平均分析結果。
同法,改變溶劑為乙酸乙酯、乙醚、正己烷、丙酮依上述步驟操作。
(2)不同種類之 Sep-pak 的探討
精稱牡丹皮粉末 1.0 g,以 70%甲醇 10 mL 作為萃取溶劑,超音波震 盪 15 分鐘後離心,重覆三次,合併萃取液,濃縮至 10 mL,取 5mL 於 10mL 量瓶中,加入 1 mL 的內標準品溶液,再以 70%甲醇稀釋至 10 mL,
經 0.45μm 濾膜過濾,分別再經過四種材質的 Sep-pak(C18、C8、CM、Silica) 過濾,作為檢液。以 3-2-2-2-1 之最佳分析條件重覆兩次分析,每次注射 10μL 進行分析,定量值為兩次注射的平均分析結果。
(3)沖提液的選擇
精稱牡丹皮粉末 1.0 g,以 70%甲醇 10 mL 作為萃取溶劑,超音波震 盪 15 分鐘後離心,重覆三次,合併萃取液,濃縮至 10 mL,取 5mL 於 10mL 量瓶中,加入 1 mL 的內標準品溶液,再以 70%甲醇稀釋至 10 mL,
經 0.45μm 濾膜過濾,再經過 Silica 材質的 Sep-pak 過濾,分別以丙酮、
乙酸乙酯、甲苯為沖提液沖提,作為檢液。以 3-2-2-2-1 之最佳分析條件重 覆兩次分析,每次注射 10μL 進行分析,定量值為兩次注射的平均分析結 果。
(4)不同比例之甲苯沖提液的探討
精稱牡丹皮粉末 1.0 g,以 70%甲醇 10 mL 作為萃取溶劑,超音波震 盪 15 分鐘後離心,重覆三次,合併萃取液,濃縮至 10 mL,取 5mL 於 10mL 量瓶中,加入 1 mL 的內標準品溶液,再以 70%甲醇稀釋至 10 mL,
經 0.45μm 濾膜過濾,再經過 Silica 材質的 Sep-pak 過濾,依 75%、72%、
70%、67%和 60%甲苯沖提液沖提,作為檢液。以 3-2-2-2-1 之最佳分析條 件重覆兩次分析,每次注射 10μL 進行分析,定量值為兩次注射的平均分 析結果。
3-2-3 結果與討論
3-2-3-1 萃取方法的選汰
(1)不同種類之溶劑的探討
牡丹皮藥材用丙酮、乙酸乙酯、乙醚、正己烷、70%甲醇,配製一系 列之萃取液,再直接使用本章第一節之HPLC分析條件(3-2-2-2-1)分析。
由於牡丹皮之單寧為高極性化合物,所以在高極性的萃取液中萃取牡 丹皮藥材之單寧含量較多,將實驗結果整理如下表3-2-2,萃取液之極性越 高則牡丹皮之單寧的萃取量越多,表中數據顯示以70%甲醇之萃取液,1-8 化合物萃取量最多。惟2、4和3化合物會和未知物重疊,如圖3-2-2、圖3-2-3 須再進一步探討。
表3-2-2 不同種類之溶劑萃取液與各成分之含量的關係表
(mg/g) 丙酮 乙酸乙酯 70
%甲醇乙醚 正己烷
pH 4.00 4.00 4.00 4.00 4.00
1 0 0 15.155 0 0
2 0 0
6.7060 0
3 47.181 45.386
147.08915.345 0
4 0 0
6.3960 0
5 5.273 0
10.5470 0
6 0 0
9.9640 0
7 2.554 0
8.1210 0
8 0 0
2.4540 0
101
(2)不同材質之Sep-pak的探討
牡丹皮為水解性單寧由沒食子酸(galic acid)或鞣花酸(ellagc acid)與糖類及其他類似的醇類形成之聚酯類化合物,易為酸所水解[75],
雖然之前探討萃取液以 70%甲醇,1-8 化合物含量最多,還是有 2、3、4 化合物吸收峰沒有回到基線,所以繼續討論用不同材質之 Sep-pak 的探討 (C18、C8、CM、Silica),以 CM (結構為-CO3--Na+)過濾,1、2、3 和 6 吸 附率達 20%以下但 4、5、7 和 8 之吸附率高於 50%,C18、C8 與 Silica 是 利用極性高低不同來吸附,而以 Silica 過濾,1-8 吸附率均高於 60%,如表 3-2-3、如圖 3-2-4。所以選擇 Silica 材質為前處理之 Sep-pak。
表3-2-3不同種類之Sep-Pak與各成分之吸附率(%)的關係表
回收率 C18 C8 CM Silica
1 27.8
%66.8
%9.5
%66.4
%2 79.5
%27.7
%18.1
%72.1
%3 57.2
%31.4
%8.2
%74.7
%4 76.8
%50.5
%56.2
%60.9
%5 51.3
%59.1
%70.0
%71.7
%6 86.6
%74.6
%15.0
%79.7
%7 55.7
%51.3
%75.5
%76.3
%8 20.9
%28.9
%64.2
%89.2
%(3)不同種類之沖提液的探討
之前探討以Silica材質為前處理之Sep-pak,1-8吸附率最高,在此繼續 以不同種類之沖提液做探討。
乙酸乙酯之沖提液無法從Sep-pak中沖提出1-8化合物之含量,丙酮雖 然可沖提出1-8化合物,但回收率都在60%以下,而以甲苯為沖提液之回收 率為最高,綜合以上比較,以甲苯為Sep-pak之沖提液。結果如表3-2-4。
表 3-2-4 不同種類之沖提液與各成分之回收率(%)的關係表
回收率 丙酮 乙酸乙酯 甲苯
90% 70% 86% 72% 75% 72%
1 11% 16% * * 18% 44%
2 26% 29% * * 40% 81%
3 18% 19% * * 42% 94%
4 20% 22% * * 45% 98%
5 60% 58% * * 94% 98%
6 21% 25% * * 41% 89%
7 20% 5.7% * * 37% 80%
8 34% 37% * * 51% 99%
(*表示沒有含量)
(4)不同比例之甲苯沖提液的探討
探討以Silica材質為Sep-pak,以甲苯做為沖提液2-8回收率最高,但化 合物1之回收率只有40%。在此繼續依75%、72%、70%、67%和60%比例 之甲苯沖提液做一系列之探討。
75%甲苯沖提液只有5化合物回收率達到90%,甲苯比例降低至72%,
化合物2-8回收率80%以上,唯獨1化合物回收率50%以下,甲苯比例繼續 降低至70%,1化合物回收率到達90%,雖然化合物2-8回收率有稍微降低 但回收率都有80%以上,67%甲苯沖提液1化合物回收率81%其它回收率都 有60%以上,甲苯比例降低至60%,化合物1-8回收率全都低於50%,其結 果如表3-2-5和圖3-2-5。綜合以上討論,以70%甲苯為Silica之Sep-pak沖提 液比例。
103
表 3-2-5 不同比例之甲苯沖提液與各成分之回收率(%)的關係表
回收率 75% 72% 70% 67% 60%
1 18% 44% 90% 81% 42%
2 40% 81% 80% 61% 38%
3 42% 94% 90% 86% 46%
4 45% 98% 84% 80% 29%
5 94% 98% 89% 82% 22%
6 41% 89% 80% 70% 37%
7 37% 80% 84% 73% 19%
8 51% 99% 97% 76% 35%
mAbs
Retention (min)
圖 3-2-2 不同萃取液之牡丹皮分析圖譜【1】
(A)70%甲醇 (B)丙酮 (C)乙酸乙酯
(成分結構圖,如圖 3-1-3 pp.69-71)
A
B
C
105
Retention (min)
圖 3-2-3 不同萃取溶液之牡丹皮分析圖譜【2】
(D)乙醚 (E)正己烷
(成分結構圖,如圖 3-1-3 pp.69-71)
D
E
Retention time (min)
圖 3-2-4 70%甲醇萃取液經不同 Sep-Pak 處理之牡丹皮分析圖譜 (A) C8 (B)C18 (C)Silica (D)CM
(成分結構圖,如圖 3-1-3 pp.69-71)
mAbs
B
C A
D
107
A
mAbs
mAbs
Retention time (min)
圖 3-2-5 各樣品之 HPLC 層析圖 (A) 標準品 (B)70%甲醇 (C)70%甲苯*
(*是 70%甲醇萃取液再經過 Sep-pak 處理)
(成分結構圖,如圖 3-1-3 pp.69-71)
B
C
mAbs
第三節 牡丹皮單寧成分之毛細管電泳分析
3-3-1 前言
高效能液相層析(HPLC)和毛細管電泳(CE)兩分析方法有很多時 候呈現彼此互補的關係,HPLC 較利於中低極性化合物的分離,而 CE 則 適合離子和高極性化合物的分析。關於牡丹皮之定量分析方法,在本章第 一節中已利用 HPLC 分離並定量其中一些單寧成分。在本節中,將探討利 用 CE 為分析工具的可能性,並藉此比較二分析方法的優缺點及適用性。
牡丹皮單寧的藥效和成分說明如本章第一節 3-1-1 所述。本章第一節 的高效能液相層析法已成功分離牡丹皮中的八種指標成分,但所費時間冗 長(60 分鐘),故希望能開發更快速有效的方法。由該節之敘述中可得知 牡丹皮單寧的指標成分主要以醣類接沒食〈gallic acid〉居多,屬於水解型 單寧,在酸性環境下很容易水解,故考慮以微膠粒電動毛細管電泳(MEKC)
分析這些成分。
3-3-2 實驗部分
3-3-2-1 實驗藥品
1. 牡丹皮的指標成 1-8 為大仁技術學院林大禎博士提供。
2. 內標準品protocatechuic acid購自Nacalai Tesque (Kyoto, Japan);sodium borate(Na2B4O7) 購 自 Acros (New Jersey, USA) ; 界 面 活 性 劑 sodium cholate (SC)、sodium dodecylsulfate (SDS)購自Sigma (St. Louis, MO, USA);磷酸購自Acros (New Jersey, USA)。
3. 異丙醇(isopropyl alcohol)購自Merck(Darmatadt,Germany)。
4. 配 置 樣 品 及 流 動 相 的 去 離 子 水 (deionized water) 取 自 於 Milli-Q System(Millipore, Bedford,MA,USA)。
109
3-3-2-2 實驗儀器
1. 毛細管電泳系統:Spectra PHORESIS 1000
毛細管長度及內徑:70 cm× 75 μm I.D.uncoated (J&W Scientific, USA),分析長度70 cm,有效長度62 cm。
偵測器:on-line UV detector 210 nm 數據積分處理系統:OS/2 system
PHORESIS 1000 v1.05b PC1000
2. 酸鹼度計(pH meter):SP 2000(Suntex Instruments Co.,LTD) 3. 高速離心計:Hettich Universal D-7200 10 mL× 12
4. 超音波震盪器:Elma Transsonic Digital
3-3-2-3 最佳分析條件
毛細管沖洗模式:
1.新毛細管使用時,要先用1 M NaOH清洗5分鐘(60℃),再以0.1 M NaOH 5分鐘(60℃)及去離子水10分鐘(60℃)清洗毛細管,才能開始使 用。
2.每天開始實驗前,沖洗時間分別為:以去離子水5分鐘, 0.1 M NaOH 5分鐘及去離子水10分鐘沖洗毛細管。
3.在每次樣品注射前,去離子水3分鐘(30℃),0.1 M NaOH 3分鐘(30℃) 及緩衝溶液4分鐘(25℃)。
4.在每次樣品分析後,去離子水5分鐘(30℃),MeOH 7分鐘(30℃)及去 離子水7分鐘(30℃)。
緩衝溶液:
含20 mM SDS和25 mM硼酸鈉,以10% H3PO4調pH值至5.50的溶 液,和7%異丙醇比例混勻。
分析時間:50分鐘 電壓:25 kV 溫度:25.0℃
樣品注射模式:hydrodynamic;注射時間 3 sec。
3-3-2-4 緩衝溶液的條件選擇
(1)不同硼酸鈉濃度的探討
配製含 20mM SDS 及 15、20、25、30 和 35 mM 等不同濃度的硼酸鈉 溶液,並以 10% H3PO4調 pH 值至 5.50,再加異丙醇(7%,v/v ),配製成 系列緩衝溶液,以探討硼酸鈉濃度對牡丹皮單寧成分分離的影響,各緩衝 溶液重覆操作三次。
(2)不同pH值的探討
在 20mM SDS 及 25mM 硼酸鈉溶液中,分別以 10% H3PO4調 pH 值至 4.00、5.00、5.50、6.00 和 7.00,再加入異丙醇(7%),配製成系列緩衝 溶液,以探討不同 pH 值對牡丹皮成分分離的影響,各緩衝溶液重覆操作 三次。
(3)不同比例有機修飾劑的探討
在 20mM SDS 及 25mM 硼酸鈉溶液中,以 10% H3PO4調 pH 值至 5.50,
再加入異丙醇,依 10%、7%、5%、3.5%和 2.5%不同比例(v/v),配製成 系列緩衝溶液,以探討不同比例有機修飾劑對牡丹皮成分分離的影響,各 緩衝
溶液重覆操作三次。
(4)SDS、SC 與 pH 值三變因相關性的探討
在 25mM 硼酸鈉 SDS(20mM)及 SC(20mM)溶液中,分別加入不 等量的 10% H3PO4調 pH 值至 4.00、5.00、5.50、6.00、6.50 和 7.00,再加 入異丙醇(7%),配製成系列緩衝溶液,以探討 SDS、SC 與 pH 值三者 對牡丹皮成分分離的影響,各緩衝溶液重覆操作三次。
(5)不同 SDS 濃度的探討
配製含 25mM 硼酸鈉及分別為 10、15、20、25 和 30 mM 等不同濃度 的 SDS 溶液,並以 10% H3PO4調 pH 值至 5.50,再加入異丙醇(7%),
配製成系列緩衝溶液,以探討不同 SDS 濃度對牡丹皮成分分離的影響,各 緩衝溶液重覆操作三次。
111
3-3-2-5 配製標準品溶液及製作檢量線
稱取26.0 mg 的protocatechuic acid 以70%甲醇配成25 mL溶液,做為 內標準品溶液(IS)。
稱取 4,6-di-GG (1) 4.2 mg,1,2,3,6-tetra-GG (2) 4.0 mg,1,2,3,4,6- penta-GG (3) 2.3 mg, 1,3,4,6-tetra-GG (4) 3.2 mg,3,4,6-tri-GG (5) 3.7 mg,
1,3,6-tri-GG (6) 1.5 mg, 4,6-di-GG (7) 3.7 mg,1,2,6-tri-GG (8) 1.5 mg,分 別以 70%甲醇配成 10 mL 標準品母液 1-8 【
I
】。分別以吸量管取標準母液【
I
】中4,6-di-GG (1)6.0mL、1,2,3,6-tetra-GG (2) 6.0mL 、1,2,3,4,6-penta-GG (3) 6.0 mL為標準母液【II
】,分別取標準母 液【II
】5.0、3.0、2.0、1.0、0.5 mL之標準品於量瓶中,各加入1.0 mL之 內標準品溶液,再以70%甲醇配成10 mL溶液。分別以吸量管取標準母液【
I
】中 1,3,4,6-tetra-GG (4)5.0mL、4,6-di-GG (7) 5.0 mL、 1,2,6-tri-GG (8) 6.0 mL為標準母液【III
】,分別取標準母液【III
】 4.5、3.5、3.0、2.5、1.5、0.5 mL之標準品於量瓶中,各加入1.0 mL之內標 準品溶液,再以70%甲醇配成10 mL溶液。分別以吸量管取標準母液【
I
】中3,4,6-tri-GG (5) 5.0 mL 、1,3,6-tri-GG (6) 6.0mL為標準母液【IV】,分別取標準母液【IV】3.5、3.0、2.5、1.5、0.5 mL之標準品於量瓶中,各加入1.0 mL之內標準品溶液,再以70%甲醇 配成10 mL溶液。
各濃度的標準品1-8,分別在280 nm波長下,以3-3-2-3之最佳分析條件 重覆三次注射,取其平均值作檢量線。
3-3-2-6 分析條件之適宜性的評估
(1)再現性(Reproducibility)
取標準母液【
II
】1.0 mL、標準母液【III
】1.0 mL及標準母液【IV】1.0 mL於量瓶中,加入1.0 mL之內標準品溶液,以70%甲醇水溶液稀釋至
10mL,作為檢液。同一天內重覆六次 ( intraday ),不同天總計重覆六次 ( interday ) 。
(2)回收率(Recovery)
精稱牡丹皮粉末 1.0 g,以70%甲醇10 mL作為萃取溶劑,超音波震盪 15 分鐘後離心,重覆三次,合併萃取液,濃縮至10 mL,取5mL於10mL 量瓶,加入0.5 mL標準母液【
II
】、0.5 mL標準母液【III
】及0.5 mL標準母 液【IV】,再加入1.0 mL之內標準品溶液,以70%甲醇水溶液稀釋至10mL,經 0.45μm濾膜過濾,作為檢液。以3-3-2-3之最佳分析條件重覆三次分 析,取其平均值,計算回收率。
(3)偵測極限
將各檢量線之最低濃度檢測液,逐步稀釋,每次稀釋一倍,注入分析,
直至S/N<3/1為止,計算其偵測極限。
3-3-2-7 藥材之定量分析
精稱牡丹皮粉末 1.0 g,以 70%甲醇 10 mL 作為萃取溶劑,超音波震 盪 15 分鐘後離心,重覆三次,合併萃取液,濃縮至 10 mL,取 5mL 於 10mL 量瓶中,加入 1 mL 的內標準品溶液,再以 70%甲醇稀釋至 10 mL,
經 0.45μm 濾膜過濾,作為檢液。以 3-3-2-3 之最佳分析條件重覆三次分 析,取其平均值。
3-3-3 結果與討論
3-3-3-1 最佳分析條件之選擇
以本篇第二章第三節曾使用的 MEKC 條件為基礎,進行桂皮單寧之分 析方法開發,該條件用 20mM SC(sodium cholate)、25 mM 硼酸鈉溶液以 10%H3PO4配製 pH 值至 7.00 再加入異丙醇(7%)作為緩衝溶液。
發現用上述分析條件,並無法將牡丹皮之單寧 1-8 指標成分分離,由 於牡丹皮單寧為水解型化合物,在酸性溶液下易解離,修飾上述條件用
113
20mM SC(sodium cholate)、25 mM 硼酸鈉溶液以 10%H3PO4配製 pH 值 7.00、6.50 和 6.00 再加入異丙醇(7%)作為緩衝溶液,改變 pH 值依然無 法分離牡丹皮 1-8 之指標成分,卻發現 pH 值越小解析度越好,由於 pH 值 6.00 以下 SC(sodium cholate)會產生沉澱;用 SDS (sodium dodecylsulfate) 取代 SC,成功的將牡丹皮之單寧指標成分 1-8 分離。分析圖形如圖 3-3-7。
3-3-3-1.1緩衝溶液的條件選擇
(1)不同硼酸鈉濃度的探討
為了探討硼酸鹽濃度對牡丹皮成分分離的影響,在 20 mM SDS 中,
加入硼酸鈉,使成為 15、20、25、30 和 35 mM 等不同濃度的硼酸鈉溶液,
並以 10% H3PO4調 pH 值至 5.50,再加入異丙醇(7%),配置成一系列緩 衝溶液,分析結果如圖 3-3-1 及圖 3-3-2。
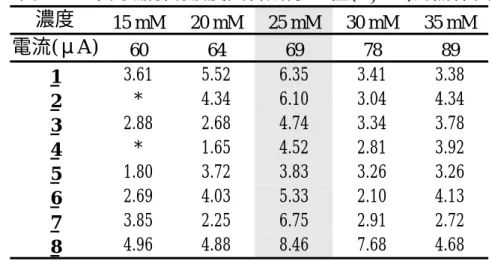
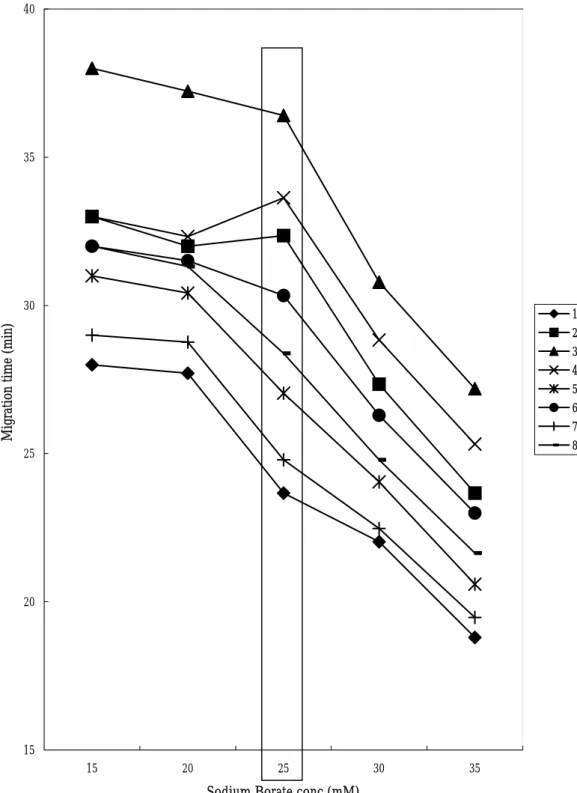
硼酸鈉濃度增加,會使離子強度增加,電流變大,增加 EOF 速度,減 少各成分的遷移時間;此外,當硼酸鈉濃度由 15mM 增加到 35mM 時,電 流強度會由 60μA 增加到 89μA 。
各成分的離子強度不同,往後遷移的速度亦不同,所以會造成分析物 與未知物間有所重疊;不同硼酸鈉濃度下,分析物間的解析度及理論板 數,整理如表 3-3-1 和表 3-3-2;15
mM
硼酸鈉濃度2/4
的解析度甚差,各 種情況下,以 25mM
硼酸鈉濃度2/4
的解析度最好;理論板數也是 25mM
硼酸鈉濃度最高,綜合比較之下,以硼酸鈉濃度為 25mM 時的解析度、理 論板數最佳。表 3-3-1 不同硼酸鈉濃度對解析度的影響 濃度
15 mM 20 mM 25 mM 30 mM 35 mM
電流(μA)60 64 69 78 89
2/4 0 0.95 2.00 0.99 0.97
表 3-3-2 不同硼酸鈉濃度與各成分 N 值(N×104)的關係表 濃度
15 mM 20 mM 25 mM 30 mM 35 mM
電流(μA)60 64 69 78 89
1 3.61 5.52 6.35 3.41 3.38 2 * 4.34 6.10 3.04 4.34 3 2.88 2.68 4.74 3.34 3.78 4 * 1.65 4.52 2.81 3.92 5 1.80 3.72 3.83 3.26 3.26 6 2.69 4.03 5.33 2.10 4.13 7 3.85 2.25 6.75 2.91 2.72 8 4.96 4.88 8.46 7.68 4.68
(*為吸收峰重疊)
(2)不同pH值的探討
為了探討不同 pH 值對分析成分的影響,在 20mM SDS 及 25mM 硼酸 鈉中,分別以 10 % H3PO4調 pH 值至 4.00、5.00、5.50、6.00 和 7.00,再 加入丙醇(7%),配置一系列的緩衝溶液。圖 3-3-3 為不同酸鹼值下,各 成分的遷移時間圖。
緩衝溶液的酸鹼值會影響醇基的解離,進而影響化合物與鹽類間的作 用力,造成不同的淌度,並使分離效果提高。由圖 3-3-3 來看,隨著 pH 值 增加,EOF 延後,會導致所有化合物的遷移時間往後延。
遷移時間延後,理論上各成分應該可以分離,但因各成分淌度不同,
往後遷移速度亦有不同,會造成解析度的差異。下表 3-3-3 可以發現,當 pH 值增加至 7.00 或 pH 值減低至 4.00 都無法分離
1-8
的化合物,pH=5.00 的1-
8 解析度都不佳,而在 pH=6.00 時 2/4 的解析度不好;綜合比較之下,以 pH=5.50 為最佳分析條件的酸鹼值。
115
表 3-3-3 不同 pH 值對解析度的影響
pH 值 4.00 5.00 5.50 6.00 7.00
1/7 0 0 1.08 1.17 0
2/4 0 0 2.00 0 0
2/6 0 0 4.53 2.51 0 5/8 0 1.28 1.69 1.08 0 6/8 0 0 2.49 1.84 0
(3)不同比例有機修飾劑的探討
為了探討有機修飾劑對分析成分的影響,在 20mM SDS 及 25mM 硼酸 鈉中,以 10%的 H3PO4調 pH 值至 5.50,再加入異丙醇,依 0%、2.5%、
3.5%、5%、7%和 10%等不同比例,配成一系列的緩衝溶液,以探討有機 修飾劑對牡丹皮成分分離的影響;各分析成分在不同比例的有機修飾劑 下,遷移時間的變化,整理如圖 3-3-4。
添加有機修飾劑會增加緩衝溶液的黏滯性[90]及降低偶電層的 zeta 勢,因而降低了 EOF 速度,使遷移時間往後面延遲出現;由下表 3-3-4 當 異丙醇比例由 0%增加到 5%解析度漸增,但成分 5/8、6/8 的解析度仍差,
而異丙醇比例增加到 10%,成分
1/7
、2/4
解析度反而變更差;綜合以上探 討,以異丙醇 7%之比例為最佳分析條件。表 3-3-4 不同異丙醇比例對解析度的影響
Rs 0 % 2.5 % 3.5 % 5.0 % 7.0 % 10 % 1/7 0.91 0.96 1.14 1.12 1.08 0 2/4 0.83 0.82 0.92 0.91 2.00 0 5/8 0 0 0.74 0.82 1.69 1.13
6/8 0 0 0 0 2.49 1.98
(4) SDS和SC與pH值的探討
為了探討 SDS 和 SC 與 pH 值對分析成分的影響,在 25mM 硼酸鈉溶 液中,分別加入 SDS、SC,再用 10% H3PO4調 pH 值至 4.00、5.00、5.50、
6.00、6.50 和 7.00,再加入異丙醇(7%),配製成系列緩衝溶液,以探討
SDS 和 SC 與 pH 值對牡丹皮成分分離的影響;由下表 3-3-5 得知 pH=7.00 無法分離牡丹皮 1-8 之指標成分,卻發現 pH 值越小解析度越好,由於 pH 值 6.00 以下 SC(sodium cholate)會產生沉澱;用 SDS (sodium dodecylsulfate) 取代 SC,pH 值 5.00 以下也無法分離牡丹皮 1-8 之指標成分,綜合比較之 後取決於 pH 值 5.50 和 20 mM SDS 為最佳分析條件。
表 3-3-5 SDS 和 SC 與 pH 值對解析度的影響
SDS SDS SDS SDS SDS SC SC pH 值 4.00 5.00 5.50 6.00 7.00 6.50 7.00
1/7 0 0 1.08 1.17 0 0 0
2/4 0 0 2.00 0 0 分叉 0
2/6 0 0 4.53 2.51 0 分叉 0 5/8 0 1.28 1.69 1.08 0 分叉 0 6/8 0 0 2.49 1.84 0 分叉 0
(5)不同SDS濃度的探討
為了探討 SDS 濃度對牡丹皮成分分離的影響,在 25 mM 硼酸鈉中,
加入 SDS 配製 10、15、20、25 和 30 mM 等不同濃度的 SDS 溶液,並以 10% H3PO4調 pH 值至 5.50,再加入異丙醇(7%),配置成一系列緩衝溶 液,分析結果如圖 3-3-5 及圖 3-3-6。
前述實驗曾嘗試以 SC 進行分析,發現其無法分離 1-8 八種成分,因 此仍以 SDS 進行 MEKC 分析。
十二烷基磺酸鈉(SDS)為具有親水端磺酸根及疏水性長碳鏈的分子結 構,當濃度大於 8~10 mM (臨界濃度 CMC)時,則可形成膠束。膠束內部 是一疏水性內核,外部則佈滿 SO3-離子,故為一帶大量負電的膠束,其 移動方向與 EOF 相反。當化合物的極性越小與膠束作用越強,移動速度也 就越慢。
從圖 3-3-5 及圖 3-3-6 亦可看出 SDS 濃度為 10 mM 時,完全無法分離 1-8 八種成分,這是因為界面活性劑濃度必須在 CMC 以上才能形成微膠 粒,以進行 MEKC 的分離。由圖可看出幾乎所有成分的遷移時間皆隨 SDS
117
濃度增加而增加。各成分在不同 SDS 濃度下的解析度列於表 3-3-6,SDS 濃度增加至 20 mM 時,即有不錯的分離效果,當濃度增加至 35 mM 時,
除了分析時間加長,對於分離效果幫助不大,另外,理論板數以 20mM SDS 濃度時為最佳。結果如表 3-3-7 及圖 3-3-6。綜合比較之後取決於 20 mM SDS 為最佳分析條件。
表 3-3-6 不同 SDS 濃度對解析度之影響
Rs 10 mM 15 mM 20mM 25 mM 30 mM 1/7 0 0.98 1.08 0.94 0.90 2/4 0 1.02 2.00 1.17 1.12 5/8 0 0.88 1.69 0.98 0.97 6/8 0 1.13 2.49 0.97 0.98
表 3-3-7 不同 SDS 濃度與各成分 N 值(N×104)的關係表 濃度
10 mM 15 mM 20mM 25 mM 30 mM
1 0 3.31 6.35 2.96 3.28
2 0 5.02 6.10 3.55 5.95
3 0 3.59 4.74 1.92 2.95
4 0 4.45 4.52 3.04 2.60
5 0 3.11 3.83 2.72 2.72
6 0 4.80 5.33 2.55 2.62
7 0 2.71 6.75 1.88 1.56
8 0 5.73 8.46 5.16 6.52
圖 3-3-1 硼酸鹽濃度與遷移時間的關係
15 20 25 30 35 40
15 20 25 30 35
Sodium Borate conc.(mM)
Migration time (min)
1 2 3 4 5 6 7 8
119
圖 3-3-2 硼酸鹽濃度與各成分 N 值的關係圖
0 1 2 3 4 5 6 7 8 9
15 20 25 30 35
Sodium Borate conc. (mM)
N (theoretical plate number)x10
41 2 3 4 5 6 7 8
10 15 20 25 30 35 40
4 5 5.5 6 7
pH value
Migration time (min)
1 2 3 4 5 6 7 8
圖 3-3-3 pH 值與遷移時間的關係
121
20 22 24 26 28 30 32 34 36 38 40
0 2.5 3.5 5 7 10
isopropanol cono.(%)
Migration time (min)
1 2 3 4 5 6 7 8
圖 3-3-4 異丙醇比例(v/v)遷移時間的關係
圖 3-3-5 SDS 濃度與遷移時間的關係
15 20 25 30 35 40
10 15 20 25 30
SDS cono.(mM)
Migration time (min)
1 2 3 4 5 6 7 8
123
圖 3-3-6 SDS 濃度與各成分 N 值的關係圖
0 1 2 3 4 5 6 7 8 9
10 15 20 25 30
SDS conc. (mM)
N (theoretical plate number)x10
41 2 3 4 5 6 7 8