國立臺灣大學環境工程學研究所 碩士論文
Graduate Institute of Environmental Engineering National Taiwan University
Master Thesis
前加氯劑量對快濾床中生物活性的影響
THE IMPACTS OF PRECHLORINATION DOSAGE TO MICROBIAL ACTIVITIES IN RAPID SAND
FILTRATION
陳柏志 Bor-Jyh Chen
指導教授:童心欣 博士 Advisor: Hsin-Hsin Tung, Ph.D.
中華民國 99 年 6 月
June, 2010
口試委員會審定書
誌謝
完成這篇論文的同時,也表示著研究所生活即將告一段落,在環工所的日子,
不論是課業、研究以及休閒活動都過的十分充實,兩年前期許自己可以盡快的完 成學位;兩年後的現在要離開這裡,卻有許多不捨。這些日子受了許多人的幫助,
論文才得以順利完成,首先要感謝我的指導老師童心欣老師,活潑的個性如其名 一樣,在研究內容以及時間上都給了很大的彈性,對學術的熱誠與態度也影響了 整個研究團隊的風氣。也感謝王根樹老師以及吳先琪老師提供許多指正與建議,
使此篇論文的內容可以更加完善。亦感謝本校生命科學院TechComm 共同科技空 間,提供了研究上所需的儀器與技術協助。
很慶幸自己能進入童老師研究室中,謝謝雅芳學姐、易學學長不論在實驗方 法、儀器操作及論文撰寫都給予很多的協助。以及佳真、景瑜經常一同討論研究 上的內容與瓶頸。還有Monica 提供美味的便當,補充實驗所需的體力。研究室內 的每個成員的歡笑聲,讓我在這忙碌的研究室中過的非常愉快。305 的朝祥、新珮、
昱文與嘉容,與你們閒聊與出遊的過程充實了許多研究以外的生活,也了解許多 不同的思考方式,希望畢業後大家能找到各自理想的方向。感謝我的爸爸、媽媽 與姐姐,讓我生活上沒有後顧之憂,以及雅嵐在我感到煩躁與不安時給予支持與 包容。
最後要感謝是我國中時期的童軍團長郭松石老師,因為祢的鼓勵,讓我有機 會一步一步朝著理想前進。僅以此論文,獻給老郭以及一路上陪伴我的好友們,
一同分享這份喜悅,希望我能永遠讓你們感到驕傲。
柏志 2010 年 6 月
摘要
自由餘氯具有良好的氧化力與殺菌能力,被廣泛應用在淨水處理廠中前氧化 與消毒處理。而自由餘氯與水中的天然有機物(Natural Organic Matter, NOM)反應時 會產生消毒副產物(Disinfection by products, DBPs),其中以三鹵甲烷
(Trihalomethane, THM)濃度最高,鹵乙酸(Haloacetic acid, HAA)次之。消毒副產物 對人體健康具有危害性,需控制消毒副產物在飲用水中的濃度以維護飲用水安全。
淨水處理廠中濾床的生物降解作用有助於控制鹵乙酸及消毒副產物前趨物質,而 水中所含有的餘氯量可能會抑制濾床的生物活性。因此,了解前加氯劑量對濾床 生物活性、消毒副產物及天然有機物降解的影響,有助於改善消毒副產物所產生 的問題。
本研究於小型自來水淨水模廠中進行,設有兩組由不同濾料所組成之快濾床,
分別為顆粒狀活性碳(GAC)/石英砂、無煙煤/石英砂,另設陶瓷珠濾床連接於無煙 煤/石英砂快濾床之後,討論不同前加氯劑量對於濾床的影響。由三磷酸腺苷(ATP) 之單位體積濃度代表生物活性,以鹵乙酸的變化做為生物降解能力的指標,並由 非揮發溶解性有機碳(NPDOC)、比紫外光吸收度(SUVA),分析濾床對於有機物質 的利用。
結果顯示前加氯劑量會影響濾床之生物活性以及HAA 的生成。當前加氯劑量 由8 mg-Cl2/L 降至 4 mg-Cl2/L、2 mg-Cl2/L 時,GAC 與無煙煤的 ATP 濃度提升了 15 倍與 10 倍。而生物活性之提高可提升 NPDOC 與消毒副產物生成潛勢(DBPFP) 於快濾床中的去除效率約15%,也可使快濾床對於二氯乙酸之降解效率提升 10%。
而本研究之陶瓷珠濾床僅對於前加氯所生成之二氯乙酸、三氯乙酸之降解性有所 提升。因此,降低前加氯劑量可提升快濾床中的生物活性並提升消毒副產物與其 前趨物質之生物降解程度,對於水處理系統中消毒副產物之控制有所幫助。
關鍵字:前加氯劑量、生物降解、生物活性、濾床
Abstract
Free chlorine has been commonly used in preoxidation and disinfection of water treatment. For plants practicing filtration, the residual chlorine concentration is able to affect the bioactivity significantly. To compare the effects of prechlorination dosage to the bioactivity and biodegradation in filters, the formation and degradation of haloacetic acids were analyzed in a pilot treatment plant. Three filters composed with granular activated carbon (GAC)/sand, anthracite/sand, and ceramic sand were used in this study.
Different prechlorination dosage was applied to the pilot plant. Bioactivity on the sand surface was measured as adenosine tri-phosphate(ATP) concentration per unit volume of filter media. Haloacetic acid concentrations were measured as an indicator of biodegradation. Non-purgeable dissolved carbon(NPDOC) concentrations and specific ultraviolet absorbance(SUVA) were measured as the efficiency of utilization of organic matter for the biofilters.
The results showed that the prechlorination dosage affected the bioactivity of the filters and haloacetic acids formation significantly. The bioactivity of GAC and anthracite increased 15 and 10 fold when the prechlorination dosage was lowered from 8 mg/L to 4 mg/L and 2 mg/L, respectively. The increase of bioactivity rose the removal of NPDOC and DBP formation potential in the filtration process to 15% as well as the degradation of dichloroacetic acid to 10%. Meanwhile, the ceramic sand filters could only degrade the dichloroacetic acid and trichloroacetic acid.
In conclusion, lowering prechlorination dosage could control the formation of DBP’s by increasing the bioactivity in the filters and the biodegradation of DBP’s precursor in drinking water treatment.
Key Words: Prechlorination dosage, Bioactivity, Biodegradation, filtration
目錄
口試委員會審定書 ... I 誌謝 ... II 摘要 ... III Abstract ... IV 圖目錄 ... VII 表目錄 ... VIII 附錄 ... IX
第一章 前言 ... 1
1.1 研究背景 ... 1
1.2 研究目的 ... 2
第二章 文獻回顧 ... 3
2.1 前氧化應用於自來水處理 ... 3
2.2 消毒副產物生成及種類 ... 3
2.3 三鹵甲烷與鹵乙酸基本介紹 ... 5
2.4 消毒副產物生成影響因子 ... 6
2.4.1 天然有機質 ... 6
2.4.2 pH 值 ... 7
2.4.3 溫度 ... 7
2.4.4 劑量與反應時間 ... 8
2.4.5 溴離子 ... 8
2.5 消毒副產物之控制 ... 9
2.6 天然有機質與消毒副產物之生物降解 ... 9
2.6.1 天然有機質之生物降解 ... 9
2.6.2 微生物降解消毒副產物 ... 10
2.7 生物濾床 ... 11
2.7.1 生物濾床與天然有機質 ... 11
2.7.2 生物濾床與消毒副產物 ... 12
第三章 實驗材料與方法 ... 14
3.1 模廠架構與維護 ... 15
3.1.1 模廠配置 ... 15
3.1.2 單元設計 ... 17
3.1.3 操作與維護 ... 18
3.1.3.1 沉澱槽排泥 ... 18
3.1.3.2 濾床反沖洗: ... 18
3.1.4 採樣 ... 19
3.2 水質與濾料分析 ... 19
3.2.1 溫度、pH ... 20
3.2.2 濁度 ... 20
3.2.3 總餘氯與自由餘氯 ... 20
3.2.4 非揮發性溶解有機碳 ... 20
3.2.5 UV254吸光度 ... 21
3.2.6 鹵乙酸萃取及衍生 ... 21
3.2.7 三鹵甲烷萃取 ... 23
3.2.8 消毒副產物生成潛勢分析 ... 24
3.2.9 三磷酸腺苷濃度檢測 ... 25
第四章 結果與討論 ... 28
4.1 環境背景與模廠功能 ... 29
4.2 需氯量及自由餘氯之變化 ... 30
4.3 生物活性 ... 34
4.4 天然有機質降解性 ... 38
4.5 消毒副產物降解性 ... 43
第五章 結論與建議 ... 51
5.1 結論 ... 51
5.2 建議 ... 51
參考文獻 ... 53
附錄 ... 56
圖目錄
圖2-1 加氯反應 TOX 組成圖 ... 4
圖2-2 三鹵甲烷結構式 ... 5
圖2-3 鹵乙酸結構式(HAA9) ... 6
圖3-1 實驗架構 ... 14
圖3-2 模廠淨水處理程序 ... 15
圖3-3 模廠配置 ... 16
圖3-4 OVEN 升溫程式(HAA9) ... 22
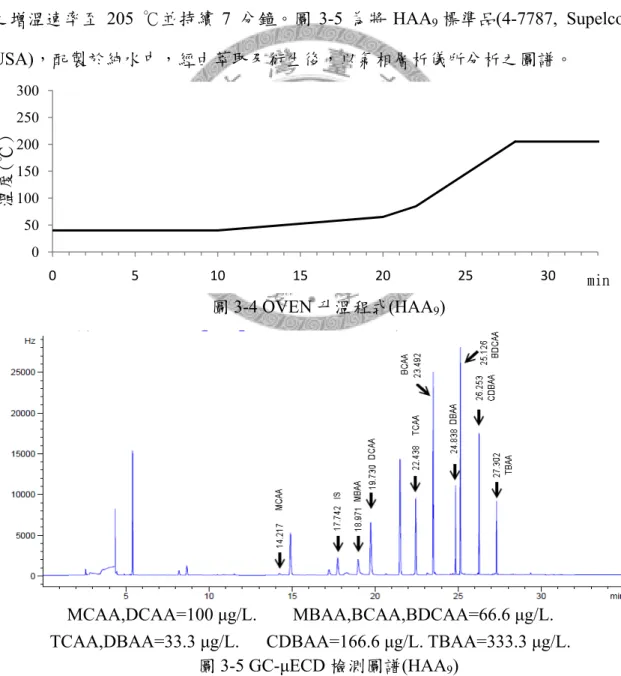
圖3-5 GC-μECD 檢測圖譜(HAA9) ... 22
圖3-6 OVEN 升溫程式(THM) ... 24
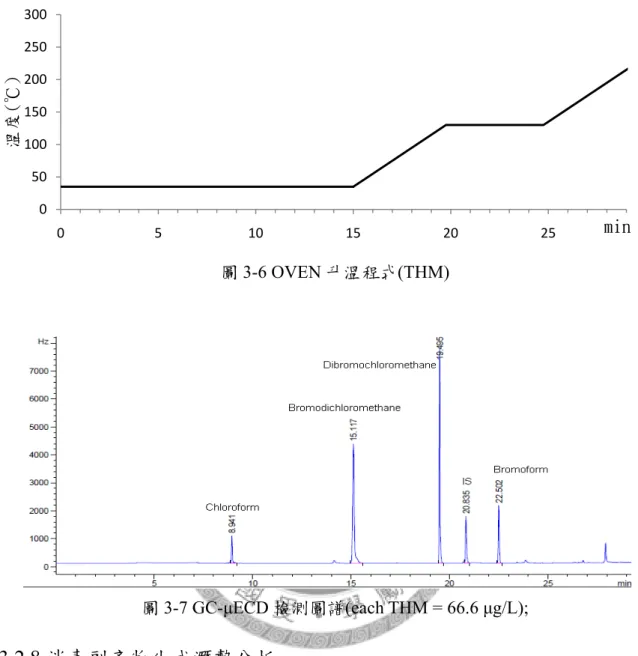
圖3-7 GC-μECD 檢測圖譜(THM) ... 24
圖3-8 ATP 與冷光酶反應示意圖 ... 25
圖3-9 ATP 濃度檢測流程 ... 27
圖4-1 操作期程 ... 28
圖4-2 原水加氯量關係圖 ... 31
圖4-3 自由餘氯於淨水程序之變化 ... 32
圖4-4 快濾床深度與自由餘氯之關係 ... 33
圖4-5 分層濾砂之 ATP 濃度 ... 37
圖4-6 NPDOC 濃度於淨水程序之變化 ... 39
圖4-7 NPDOC 與 SUVA 於濾床進出流水之比值 ... 41
圖4-8 DBPFP 與 DBPFP/NPDOC 於濾床進出流水之比值 ... 42
圖4-9 氯仿於快濾床進出流水之比值 ... 44
圖4-10 DCAA 於淨水程序之變化 ... 46
圖4-11 TCAA 於淨水程序之變化 ... 47
圖4-12 DCAA 與 TCAA 於濾床前後濃度與操作時間之關係 ... 48
圖4-13 鹵乙酸於濾床進出流水之濃度比 ... 50
表目錄
表3-1 單元設計規劃 ... 17
表3-2 濾砂材料性質 ... 18
表3-3 採樣位置 ... 19
表4-1 環境背景 ... 29
表4-2 配水槽出流水性質 ... 30
表4-3 濾床進出流總餘氯與自由餘氯濃度 ... 34
表4-4 各濾料之 ATP 濃度 ... 36
表4-5 NPDOC 於快濾床之去除率 ... 40
表4-6 濾床進出流 DBPFP 濃度 ... 43
表4-7 鹵乙酸於濾床之降解率 ... 50
附錄
附錄一 濾砂 ATP 濃度檢測數據 ... 57
附錄二 模廠 DBPFP 檢測數據 ... 58
附錄三 濾床進出流水濁度與操作時間之關係 ... 59
附錄四 濾床進出流水 NPDOC 與操作時間之關係 ... 60
附錄五 濁度於淨水程序之變化 ... 61
附錄六 pH 值於淨水程序之變化 ... 62
附錄七 溫度於淨水程序之變化 ... 63
附錄八 總餘氯於淨水程序之變化 ... 64
附錄九 UV254吸光度於淨水程序之變化 ... 65
附錄十 SUVA 於淨水程序之變化 ... 66
附錄十一 氯仿於淨水程序之變化 ... 67
第一章 前言
1.1 研究背景
水,是維持生命不可或缺的元素,也是各種產業發展所需的資源,人類對於乾 淨、安全與穩定的飲用水需求,是自來水工程發展的動力,自來水供水普及率也 成為文明社會的指標。水利署統計至2009 年底,台灣自來水普及率已達 92.2%,
在供給穩定的環境下,如何使水質安全與品質更加提升,是台灣自來水系統發展 重要的方向。
消 毒 副 產 物(Disinfection by products, DBPs) 為 消 毒 劑 與 水 中 天 然 有 機 質 (Natural organic matter, NOM)反應所生成,其對健康的危害是自來水工程所重視的 問題。以次氯酸鈉等含氯藥劑作為消毒劑的淨水系統中,三鹵甲烷(Trihalomethane, THM)與鹵乙酸(Haloacetic acid, HAA)為生成量最高的消毒副產物。添加消毒劑的 目的為減少致病菌以及抑制管線中生物膜之生長,依台灣飲用水水質標準規定,
自來水需保有 0.2-1 mg/L 的自由餘氯,避免致病菌生長影響飲用水安全,因此會 於清水池添加消毒劑,使配水系統中的餘氯濃度保持在法規範圍內。而水源水質 不良及藻類滋生會造成處理效率不佳及管線阻塞等問題,為了克服該問題,會於 淨水處理流程前加入前加氯處理單元。前加氯(Prechlorination)是將氯系消毒劑作為 前氧化劑,將有機質先行氧化,提高混凝沉澱效率,也利用餘氯抑制微生物生長 避免影響淨水系統的操作。
消毒副產物的問題,可使用化學氧化、吸附及薄膜分離等理化方法控制,而消 毒副產物以有機質為主,部分可被微生物所利用,故可利用生物降解減少水中的 消毒副產物濃度。生物濾床,即是使用具有生物活性的濾料,降解消毒副產物及 消毒副產物前趨物質(DBP precursors)以減少配水系統中消毒副產物含量。
傳統的淨水程序,多著重於理化處理機制。砂濾槽分為快濾床與慢濾槽兩種
類別,因占地與效率的考量,快濾床較廣泛被使用,其設置著重於物理篩除之機 制,並未考量生物降解汙染物的效果。然而快濾床所填充之濾料具高孔隙與表面 積,可提供微生物附著生長的空間。Kim 與 Rodrigue 等人均觀察到長時間操作的 快濾床對鹵乙酸具有去除效果,但對三鹵甲烷無去除能力(Kim, 2009; Rodriguez et al., 2007)。兩者之間的差異為三鹵甲烷在好氧狀態下難以被微生物所利用,而鹵乙 酸可由微生物產生之脫鹵酵素(Dehalogenase)所降解。因此,快濾床應具有一定的 生物活性,可進行生物降解。
前加氯雖可使淨水流程保持一定之自由餘氯濃度,然而在抑制微生物生長的同 時,也可能影響快濾床對於天然有機質與消毒副產物的生物降解作用,若能在不 影響水廠正常操作的前提下,適當的調整前加氯劑量,使快濾床充分利用微生物 降解天然有機質與消毒副產物之能力,可減少消毒副產物於飲用水中的濃度以提 升水質安全。
1.2 研究目的
本研究之目的為了解前加氯劑量與濾床中生物活性之關係,並探討前加氯劑量 對於消毒副產物與天然有機質降解性之影響。以期能在既有的淨水程序中,改善 消毒副產物之問題。
第二章 文獻回顧
2.1 前氧化應用於自來水處理
典型的自來水處理流程為混凝、膠凝、沉澱、砂濾及消毒程序,為了提升淨水 廠的處理效率以及改善藻類與微生物阻塞淨水單元之問題,常於混凝單元前進行 前氧化程序,達到初步氧化水中汙染物及控制微生物生長的目的。前氧化可添加 次氯酸鹽、二氧化氯、臭氧與二氧化錳等氧化劑,也可使用 UV 光照射,其中次 氯酸鹽為最常使用之前氧化藥劑,除了其強氧化力可改善混凝效果外,亦具有良 好的消毒能力並可在水中殘留一定的餘氯濃度,達到控制全處理流程中藻類、細 菌等微生物生長之效果。次氯酸鹽之使用易產生各種含氯消毒副產物,雖臭氧、
UV 等方式也具有良好的前氧化能力,但未能產生持續性的消毒效果,且成本較高,
故現今仍以次氯酸鹽為主要之前氧化劑與消毒劑。
2.2 消毒副產物生成及種類
自然水體中的天然有機質與消毒劑或氧化劑反應,會產生消毒副產物,自1974 年 Rook 等人發現加氯消毒會產生氯仿等消毒副產物至今(Rook, 1974),已檢測出 數百種消毒副產物,已知種類有三鹵甲烷(Trihalomethane, THM)、鹵乙酸(Haloacetic acid, HAA)、鹵乙氰類(haloacetonitriles, HAN)、鹵化酮(Haloketones)、氯化苦 (Chloropicrin, CP)等鹵化消毒副產物;以及醛類(Aldehydes)、羧酸類(Carboxylic Acids)、N-亞硝基二甲胺(N-nitrosodimethylamine, NDMA)等非鹵化消毒副產物。
現今使用較普及的消毒劑為次氯酸鹽、二氧化氯、氯胺等含氯消毒劑,因此消 毒副產物中,以含氯消毒劑、天然有機質及鹵離子(如溴、碘)反應所產生的含鹵消 毒副產物占大宗。有學者針對美國2000 年至 2002 年間,12 個淨水廠出水之消毒 副產物進行抽樣調查,結果顯示三鹵甲烷及鹵乙酸為重量濃度最高的消毒副產物 族群(Krasner et al., 2006)。
以次氯酸鹽為消毒劑與水中天然有機質及鹵離子產生含鹵消毒副產物的化學 反應如式2-1 所示,水中鹵離子濃度與種類也會影響消毒副產物之組成。
HOCl + X- + NOM → DBPs 式 2-1 目前消毒過程中所產生的有機鹵化物,其性質及對人體的危害性僅有部分被了 解,即為一般所知的消毒副產物。2008 年有研究取自 Cambridge 當地淨水廠的原 水進行試驗,原水中溶解性有機碳(Dissolved organic carbon, DOC)濃度為 4.7 mg/L,
在水溫20℃、pH=7 及加氯劑量 8.2 mg-Cl2/L 的條件下反應 72 小時,分析產生的 總含鹵有機質(Total Organic Halogen, TOX),結果如圖 2-1 所示,已知的消毒副產 物占有47 %,且其中以 THM 及 HAA 族群占大宗,而未知的含鹵有機質占 53%,
其部分可能為有害但未被了解的消毒副產物(Hua and Reckhow, 2008)。
UTOX:未知含鹵有機質(unknown-TOX) THM:三鹵甲烷(Trihalomethane)
DHAA:二鹵乙酸(Dihaloacetic acid) THAA:三鹵乙酸(Trihaloacetic acid)
DHAM:二鹵乙氰(Dihaloacetonitrile) CP:氯化苦(Chloropicrin)
DCP:二氯丙酮(Dichloropanone) TCP:三氯丙酮(Trichloropanone) 圖2-1 加氯反應 TOX 組成圖(Hua and Reckhow, 2008)
UTOX 53.0%
THM 23.1%
DHAN 1.1%
DCP 0.1%
TCP 0.8%
CP 0.1%
DHAA 6.5%
THAA 15.3%
2.3 三鹵甲烷與鹵乙酸基本介紹
消毒副產物的物化性質以及對健康的危害性正持續的被研究與評估,本節針對 最常見的三鹵甲烷與鹵乙酸,介紹其基本性質與危害性。
三鹵甲烷為最早被發現的消毒副產物,也是多數飲用水中所發現濃度最高的消 毒副產物,其包含氯仿(Chloroform)、一溴二氯甲烷(Bromodichloromethane)、二溴 一氯甲烷(Dibromochloromethane)及溴仿(Bromoform),結構式如圖 2-2。
Bromoform H
Br Br Br Dibromochloromethane
Cl Br Br H
Chloroform Cl
Cl Cl H
Bromodichloromethane Cl
Cl Br H
圖2-2 三鹵甲烷結構式
三鹵甲烷對人類的主要暴露途徑為飲水、呼吸及皮膚吸收,其對健康具有致 癌性及生殖性等危害。美國環保署(USEPA)之致癌性分類中,將氯仿、一溴二氯甲 烷、溴仿歸類於 Group B2(極可能為人類致癌物),而二溴一氯甲烷歸類於 Group C(可能為人類致癌物);USEPA 與台灣飲用水水質法規將總三鹵甲烷管制標準訂為 80 μg/L。
鹵乙酸是飲用水中濃度僅次於三鹵甲烷的消毒副產物,其結構為乙酸的第二個 碳 與 鹵 離 子 鍵 結 , 以 氯 化 及 溴 化 之 鹵 乙 酸 較 為 常 見 , 分 別 為 一 氯 乙 酸 (Monochloroacetic acid, MCAA)、二氯乙酸(Dichloroacetic acid, DCAA)、三氯乙酸 (Trichloroacetic acid, TCAA)、一溴乙酸(Monobromoacetic acid, MBAA)、二溴乙酸 (Dibromoacetic acid, DBAA)、三溴乙酸(Tribromoacetic acid, TBAA)、一溴一氯乙酸 (Bromochloroacetic acid, BCAA)、一溴二氯乙酸(Bromodichloroacetic acid, BDCAA) 與一氯二溴乙酸(Chlorodibromoacetic acid, CDBAA),合稱 HAA9,結構式如圖2-3 所示。
鹵乙酸中以DCAA 與 TCAA 最常由飲用水中被檢測出,且濃度最高。鹵乙酸
對人體健康具有肝毒性、基因毒性、生殖毒性及致癌性等危害,於USEPA 之致癌 性分類中,將DCAA 歸類為 Group B2,TCAA 為 Group C;USEPA 於飲用水中針 對其中5 種鹵乙酸之總和(HAA5:MCAA, DCAA, TCAA, MBAA, DBAA)訂定 60 μg/L 的管制標準。鹵乙酸沸點均在 180℃以上,屬非揮發性有機物質,具有親 水性及低 pKa 值(<2.86)之性質,使鹵乙酸於自然水體中大多為解離態(Urbansky, 2000),穩定存在於水中。因此,人體主要暴露途徑為飲水所攝入。
H Cl
O
H Cl
Cl
O
H Cl
Cl
H Cl
O
H Br
O
H Cl
Br
Br Br
Cl
O
H Cl
H
H Br
O
H
H
Br Br
O
H
Br
Br Br
O
H H
H Cl
O
H
MCAA
DCAA
TCAA
MBAA
DBAA
TBAA BDCAA CDBAA
BCAA
圖2-3 鹵乙酸結構式(HAA9)
2.4 消毒副產物生成影響因子
消毒副產物的生成受到許多環境因子所影響,包括pH 值、溫度、消毒劑劑量、
反應時間、有機質含量及溴離子濃度等,皆會影響消毒副產物的生成量與組成。
2.4.1 天然有機質
天然有機質(Natural organic matter, NOM)泛指天然水體中所有的有機物質,其 組成複雜,且結構、分子量與物化性質均不同,因此,常會使用其他易於檢測的 替代參數來表示天然有機質含量,例如總有機碳(Total Organic Carbon, TOC)、溶解
性有機碳(DOC)、UV254吸光度等水質參數。NOM 為消毒副產物之前驅物質 (Precursor),前趨物質的濃度與種類會影響消毒副產物之生成。2002 年 White 調查 阿拉斯加17 個小型水廠之水源,分析原水中 DOC、UV254吸光度等參數與消毒副 產物生成潛勢(Disinfection by products formation potential, DBPFP)之間的關係,結 果顯示天然水體的三鹵甲烷生成潛勢(Trihalomethane formation potential, THMFP)、
鹵乙酸生成潛勢(Haloacetic acid formation potential, HAAFP)與 DOC 之相關係數分 別為0.87 及 0.86,而與 UV254吸光度之間的相關係數為0.99(White et al., 2003),
NOM 的含量與消毒副產物生成量有顯著正相關。
不同種類的有機質對消毒副產物的貢獻也不相同。Lu 等人將松花江(Songhua River) 的 河 水 , 經 由 混 凝 、 沉 澱 與 過 濾 處 理 後 , 以 樹 脂 將 水 中 有 機 質 分 餾 (Fractionation),依親疏水與酸鹼性質分為 Hydrophobic acid(HOA)、Hydrophobic neutral(HON) 、 Hydrophobic base(HOB) 、 Hydrophilic acid(HIA) 、 Hydrophilic neutral(HIN)及 hydrophilic base(HIB),將濃度均一後(DOC=2 mg/L),分別進行 THMFP 與 HAAFP 試驗,結果顯示各種有機質的 THMFP 與 HAAFP 有顯著差異,
THMFP 之生成量以 HIA 最高,HOA 次之,而 HAAFP 之生成量則為 HOA 最高,
HOB 與 HIN 不易生成 THM 與 HAA (Lu et al., 2009)。
2.4.2 pH 值
pH 值對不同消毒副產物生成的影響程度不一,高 pH 值時較利於 THM 生成,
而低 pH 值時,則有利於 HAA、三鹵乙醛、三鹵丙酮及鹵化氰生成。水中的總含 鹵有機質在高pH 值時濃度較低,是由於含鹵有機質在高 pH 值時易產生水解反應 而減少,而THM 的生成量則會隨水解反應增加而上升(Singer, 1994)。HAA 中不同 的物種對於pH 的改變會有不同反應,三鹵乙酸生成量會隨 pH 值上升而下降,而 二鹵乙酸受pH 值改變的影響則較不顯著(Liang and Singer, 2003)。
2.4.3 溫度
溫度會影響消毒劑與有機質的反應速率,消毒副產物的總生成量與溫度提升
成正相關,而溫度對不同消毒副產物之間具有不同的影響。Hua 以 Cambridge 當地 淨水廠的原水進行消毒副產物生成量試驗,其原水之pH 值為 7、DOC 含量為 4.7 mg/L,試驗中加氯消毒劑量為 6 mg-Cl2/L,並分別以 5℃、15℃與 30℃之反應 進行48 小時。結果顯示由 5℃提高至 30℃時,THM 生成量增加超過 100%,二鹵 乙酸提升了73%,而三鹵乙酸僅提高 16% (Hua and Reckhow, 2008)。實際上,溫度 不只影響反應速率與機制,也會影響原水水質特性,造成季節性的影響,例如Chang 等學者於2007 年冬季及夏季時,針對台灣北中南各個水廠進行 THM 及 HAA 之調 查,結果發現夏季THM 與 HAA 濃度普遍高於冬季(Chang et al., 2009)。
2.4.4 劑量與反應時間
消毒劑的劑量會影響消毒副產物的生成量。在固定溫度 20℃下,加入 1-6 mg-Cl2/L 的次氯酸鹽在原水中反應 48 小時,可知 THM、HAA 的生成量會隨劑量 提高而成長(Hua and Reckhow, 2008)。
同樣的,當消毒劑與原水中天然有機質的反應時間越長,消毒副產物的生成 量也會提高。Liang 與 Singer 研究 1999-2000 年間,五個不同水廠的反應時間與 THM、
HAA 生成量的關係,結果顯示反應時間越長,HAA、THM 濃度越高,但生成速 率隨著反應時間增加而遞減(Liang and Singer, 2003)。
2.4.5 溴離子
水中的溴離子並不會直接與NOM 反應,而是當水中加入氯酸鹽或臭氧等氧化 劑時,反應生成溴酸鹽(如式 2-2),溴酸鹽進而與天然有機質反應產生含溴的消毒 副產物。
Br
-+ HOCl + OCl
-→ Cl
-+ HOBr + OBr
-式 2-2 在低溴離子濃度時(<1.6 mg/L),THM 各物種間的含量以 CHCl3為最高,其次 為依序為 CHCl2Br、CHClBr2與 CHBr3,當原水中含有高濃度溴離子時,THM 各 物種間含量變成以 CHBr3最多,其次依序為 CHClBr2、CHCl2Br 及 CHCl3。當溴 離子濃度由低提升至高濃度時,會使鹵乙酸組成以氯乙酸為主改變為以溴氯乙酸
為主(Sun et al., 2009)。這是因為溴酸鹽比氯酸鹽更容易與天然有機質反應,故溴離 子濃度對THM 與 HAA 的組成會有顯著影響(Luong et al., 1982)。
2.5 消毒副產物之控制
消毒副產物會對飲用水安全造成影響,因此要如何控制消毒副產物的濃度成為 重要的課題。現今消毒副產物的控制方法主要分為三類,其最有效的方式為將消 毒副產物的前趨物質(NOMs)去除,如利用加強混凝、活性碳吸附及薄膜分離等方 式,減少前趨物質與消毒劑反應的機會;第二種方式可使用替代的消毒藥劑如氯 胺、臭氧、二氧化錳及 UV 光照射等,但不論何種消毒藥劑都有不同種類及程度 的消毒副產物產生,且非氯系藥劑不具有持續性的消毒效果,為配合法規所定,
飲用水中須保有0.2-1.0 mg/L 自由餘氯濃度,仍需於進入配水前添加氯系消毒藥劑;
第三種方式是去除已生成的消毒副產物,薄膜分離、活性碳吸附以及臭氧、UV 光 等高級氧化處理,都具有去除消毒副產物的效果。飲用水的最終使用者,可藉由 加熱沸騰的方式,將沸點低、易揮發的THM 去除 90%以上,但無法去除 HAA 等 非揮發性消毒副產物(Wu et al., 2001)。
2.6 天然有機質與消毒副產物之生物降解
部分的天然有機質與消毒副產物,可作為微生物的生長與能量來源,本節將 介紹微生物利用天然有機質與消毒副產物的基本特性。
2.6.1 天然有機質之生物降解
天然有機質以DOC 表示其濃度時,可分為生物可利用性有機碳(biodegradable organic carbon, BDOC)與非生物可利用性有機碳(non-biodegradable organic carbon, non-BDOC),生物濾床可利用生物降解作用去除 BDOC,而微生物降解 BDOC 的 速率又有快慢之分。典型NOM 的微生物降解模式,初期降解速率快,主要為減少 易降解的BDOC(fast-BDOC),後期之降解速率趨緩,是為降解較難分解的
BDOC(slow-BDOC),而最終有機質濃度趨於穩定時,剩餘的有機質為
non-BDOC(Klevens et al., 1996)。由此可知,天然有機質的生物可利用性並非相等,
除了量測BDOC 外,也有研究利用比紫外光吸收度(specific ultraviolet absorbance, SUVA)來評估 NOM 的生物降解效率,SUVA 值為 UV254吸光度與DOC 之比值,
其計算方式如式2-3:
SUVA = UV254(cm-1) x 100 / DOC (mg/L) 式 2-3 SUVA 值可表示水中有機質的組成,SUVA 值越高(>4),表示水中有機質組成 以大分子、疏水性與腐植質的物質比例較高;相反的,當低SUVA 值時(<2),表示 水中有機質的組成偏向小分子、親水性與非腐植質有機物質(Edzwald and Tobiason, 1999)。Yapsakli 以 Omerli 水庫水為原水,進行生物降解性試驗,原水 DOC 值為 3.5~5.8 mg/L,SUVA 值在 2~3.4 之間,結果顯示 SUVA 值與 DOC 的生物降解率相 關系數為-0.82,當 SUVA 值越高,生物降解率越低(Yapsakli and Cecen, 2010)。而 Saadi 曾以 Haifa 當地的汙水進行生物降解試驗,原水 DOC 為 1.95 mg/L,SUVA 值為1.18,其結果顯示 DOC 降解 54%時,SUVA 值會提升 56%(Saadi et al., 2006)。
由 SUVA 值的變化可知,微生物利用天然有機質時,偏好利用的有機質特性為小 分子、親水性與非腐植質有機質。
2.6.2 微生物降解消毒副產物
環境中存在部分微生物具有脫鹵酵素(Dehalogenase),可與含鹵消毒副產物或 其於含鹵有機質作用,將鹵素脫除,達到降解的效果。常見的消毒副產物中,THM 因氧化態高的關係,不易在好氧狀態下由微生物所利用(Vogel, 1993),而 HAA 較 易由微生物所利用,因此常以 HAA 代表可被生物降解的消毒副產物。HAA 被認 為可藉由鹵酸脫鹵酵素(Haloacid dehalogenase)將其水解為 Hydroxy-alkanoic acid 及 Oxoalkanoic acid(Hashimoto et al., 1998)。
Zhang 在 2009 年分別從經前加氯處裡的 GAC 濾床、配水鑄鐵管及配水末端自 來水中,純化出8 種可降解 HAA 的細菌,分別進行這 8 種細菌對於不同 HAA 的
純菌降解能力試驗,結果顯示這8 種細菌對於 MCAA、DCAA 的降解能力較佳,
但對TCAA 之降解能力較低或無法降解(Zhang et al., 2009)。
這些可降解 HAA 的微生物雖存在於飲用水系統中,但水中自由餘氯會抑制微 生物的活性,可能會影響配水系統中微生物降解HAA 之能力。因此有研究在探討 水中的自由餘氯濃度與HAA 的分佈關係,Vanessa 於 1999 年針對 Corpus Christi 與Carthage 兩地的配水系統,分析不同時期配水前、中、末端的餘氯量與 HAA 的 濃度的關係,發現當水中保有高濃度的餘氯時,HAA 的濃度不會有明顯的降低,
部分還有提高的現象,當中、末端水中的餘氯降低時,HAA 的濃度會隨之降低。
推論高濃度的餘氯抑制了微生物的生長,影響HAA 的生物降解,並持續與水中的 有機質反應持續產生HAA(Speight and Singer, 2005)。
2.7 生物濾床
如能善用微生物的降解能力,可對減少天然有機質與消毒副產物的含量有所 幫助。生物濾床即是使用適合微生物生長的材料作為濾料,藉濾料中微生物的生 物降解作用,同時減少消毒副產物前趨物質與消毒副產物,達到飲用水DBPs 控制 目的。本節將介紹生物濾床用於天然有機質與消毒副產物的去除,以及環境因子 對生物降解作用的影響。
2.7.1 生物濾床與天然有機質
由於微生物的降解反應需要一定的反應時間,且如2.7.1節所提,BDOC的生物 降解速率也有快慢之差異,因此在操作生物濾床時,空床接觸時間(Empty-bed contact time, EBCT)的長短會影響NOM的去除效果,生物濾床所需的最小空床接觸 時間(EBCT),需能使水中的fast-BDOC降解(Klevens et al., 1996)。
由於分子較小的有機質較易受微生物所利用,因此,為了提高生物濾床降解 NOM的效果,可使用氧化劑與有機質反應,將大分子有機質水解,使BDOC於NOM 中的比例提升;Yavich即以臭氧為氧化劑進行前處理,了解其對NOM生物降解的 影響,其以Huron River的河水進行試驗,原水DOC為6.4 mg/L,BDOC為1.15±0.11
mg/L,在添加0.5 mg-O3/mg-C的臭氧後,BDOC提升為2.31 mg/L,且可將EBCT由 47.8分鐘降至16.8分鐘(Yavich et al., 2004)。Chaiket也曾以顆粒狀活性碳/石英砂與 無煙煤/石英砂兩種生物濾床取代傳統快濾床,討論生物濾床去除NOM與DBPFP的 效果。其研究使用White River 水處理廠之原水,結果顯示當原水經前臭氧處理後 再加以混凝沉澱,其THMFP與HAAFP的去除主要由前臭氧與混凝沉澱所貢獻,生 物濾床對其無顯著降解效果,而原水經混凝沉澱後才進行臭氧氧化,在通過生物 濾床後可將THMFP減少11%、HAAFP減少15%(Chaiket et al., 2002)。因此,生物濾 床對於天然有機質的降解,可減少後續消毒程序的消毒副產物生成量,而BDOC 佔NOM之比例與EBCT之長短影響了生物濾床的降解效率。
2.7.2 生物濾床與消毒副產物
由於HAA 較易由微生物所利用,因此生物濾床對消毒副產物的降解常以 HAA 為代表。有研究利用生物活性碳(bio-activated carbon, BAC)作為生物濾床之濾料,
討論其對HAA 的處理效果,在 EBCT 為 20 分鐘的操作下,初期因吸附作用的關 係,HAA 的去除效果良好,隨著吸附能力達飽和後,出流濃度會有上升的現象,
但經持續操作60 天後,隨著生物膜增長,產生具有 HAA 的降解能力的微生物,
使出流濃度漸下降至近乎操作初期的去除效果(Xie and Zhou, 2002)。
另一研究探討顆粒狀活性碳(granular activated carbon, GAC)濾床對不同 HAA 的處理效果。進流水的HAA5(MCAA、MBAA、DCAA、TCAA 及 DCAA)濃度分 別固定於40~60 μg/L 之間,通過 EBCT 為 5 分鐘的 GAC 濾床進行試驗。操作初期 各種HAA 出流濃度均極低,三天後 MCAA、DCAA 與 MBAA 達 GAC 濾床之貫 穿點,使出流濃度顯著上升,但此時TCAA、DBAA 的濃度仍較低,尚未達 GAC 濾床之貫穿點,這是由於不同HAA 之間對 GAC 的吸附能力不同所造成。在濾床 持續運作下,TCAA 與 DBAA 的出流濃度因 GAC 的的吸附能力逐漸飽和而上升,
MCAA、DCAA 及 MBAA 的出流濃度則隨著生物膜的增長而下降,結果顯示 MCAA、
DCAA 與 MBAA 的生物降解性較高;而 TCAA 生物降解性較差,吸附作用是 TCAA
主要的去除機制(Tung et al., 2006)。
Wu 曾探討空床接觸時間與溫度對於 HAA 在 BAC 濾床中去除率的影響,該學 者以於實廠操作2.5 至 3 年的 GAC 作為生物濾床的濾料。研究結果顯示對 6 種 HAA 而言,EBCT 越長、溫度越高,去除率也會越好,而 EBCT 與溫度對於不同 HAA 之間的影響也會有差異。以TCAA 與 DCAA 兩種鹵乙酸相較,DCAA 在溫度大於 20℃即有超過 90%的去除效果,而 TCAA 需在溫度大於 20℃且 EBCT 超過 10 分 鐘,才會有高於 80%的去除率,顯示 TCAA 較不易由微生物所利用(Wu and Xie, 2005)。不同的濾料材質,對於生物濾床的 DBPs 去除率也會有所影響,Wobmay 於1999 年,使用 GAC 與無煙煤填充高效生物活性碳濾床,EBCT 為 3.6 分鐘的條 件下,經過長時間操作,GAC 濾床對 HAA 具有降解的能力,但無煙煤濾床沒有 降解的情形發生,可能是無煙煤(anthracite)的生物容量(Biomass capacity)較低,或 是EBCT 不足所致(Wobma et al., 2000)。
傳統淨水場中的快濾床被認為不具HAA 的降解能力(Rodriguez et al., 2004);
然而也有研究發現快濾床具有 HAA 的去除能力,其中對 DCAA 的去除效果較為 顯著,且去除效果與季節性之溫度變化有關,而快濾床對THM 並無去除效果,這 與生物濾床降解消毒副產物的特性相似,因此快濾床可能具有生物活性,發揮生 物濾床的功能(Rodriguez et al., 2007; Kim, 2009)。
而在使用前加氯程序的淨水處理廠中,濾床之進流水會有自由餘氯殘留,可能 會對濾料中的微生物產生影響。有研究比較Corpus Christi 地區水廠中 GAC 濾床 與無煙煤/石英砂濾床的 HAA 去除率,出流餘氯濃度較低的 GAC 濾床對於 HAA 的去除效果也較好(Speight and Singer, 2005),可能是餘氯濃度影響濾砂中的生物活 性,也可能是GAC 有較高的吸附能力或生物容量(Biomass capacity)較高所產生的 結果。
第三章 實驗材料與方法
由於各個淨水廠的水源水質條件、處理程序、單元規劃設計等不盡相同,且 無法排除其他因素的干擾(如颱風、乾旱及高濃度汙染源等),無法將不同淨水場運 作之前加氯劑量與濾床的關係作客觀的比較,因此本研究之採樣與操作均於小型 自來水處理模廠中進行。模廠之控制因子為前加氯劑量,初始劑量8 mg-Cl2/L,分 段調整為4 mg-Cl2/L 及 2 mg-Cl2/L。在不同劑量下採取各單元水樣進行水質分析,
並於更換劑量前,採取濾砂樣品作為濾料分析之用,最後以不同前加氯劑量之水 質與生物分析數值進行比較與討論。實驗架構如圖3-1 所示。
圖3-1 實驗架構
3.1 模廠架構與維護
3.1.1 模廠配置
模廠之規劃設計參照台灣常用的實廠設計以符合模擬實廠操作之目的,主要處 理單元依序為前加氯、混凝沉澱、快濾及消毒,以次氯酸鈉溶液(5000mL, Haiter, Taiwan)作為前氧化劑及消毒劑,以硫酸鋁(First Chemical Works, Taiwan)作為混凝 劑。
原水來源為台灣大學環工所內之地表水體,取回後置於 250 公升之 PVC 水槽 內供給模廠之運作。原水由蠕動幫浦注入預氯槽後,以重力流通過快混槽、混凝 槽與沉澱槽,沉澱上澄液流入沉澱出水槽後再由蠕動幫補注入快濾床內。實廠中 常用之快濾床為三層濾料,上層為無煙煤或GAC,中層為石英砂,底層為礫石層,
因此模廠中設置兩種不同材質組合之快濾床,分別為 GAC/石英砂(快濾床 A)與無 煙煤/石英砂(快濾床 B)之濾料組合,底層用網布取代礫石層達到支撐濾砂之功能並 減小濾床體積。無煙煤/石英砂快濾床分流部分出流水,以蠕動幫浦導入陶瓷珠所 填充之濾床,由於近年來有許多研究以多孔性材質所填充之槽體作為生物濾床之 用,因此本模廠也以具有多孔特性之陶瓷珠顆粒作為生物濾床之濾料。各濾床出 水經消毒槽後個別設置配水槽,配水槽停留時間為一天,並以PVC 水管攪拌,模 擬配水管線之水流,以此了解消毒副產物在配水管線之中的變化。因此,本淨水 模廠共有三種淨水處理程序,如圖3-2 所示。模廠整體配置如圖 3-3。
圖3-2 模廠淨水處理程序
原水槽
預氯槽
預氯出水槽
快混槽
慢混槽
沉澱槽
沉澱出水槽
快濾床(A) 快濾床(B)
快濾出水槽(A) 快濾出水槽(B)
消毒槽(A) 消毒槽(B)
陶瓷砂濾床
消毒槽(C)
配水槽(A) 配水槽(B) 配水槽(C)
RW
PC
CO
SE
FA FB
FC
DC DA
DB
EA EB EC
次氯酸鈉溶液
硫酸鋁溶液
次氯酸鈉溶液
淨水單元 加藥點 水質分析採樣點
圖3-3 模廠配置
3.1.2 單元設計
各處理單元之尺寸、停留時間、溢流率等設計參數,參考自「給水工程,高肇 藩」,依實際操作情況調整,各單元之材質、流量、停留時間等各項參數如表3-1、
濾砂材料性質如表3-2 所示。
表3-1 單元設計規劃
單元 流量
(L/Day)
停留時間
(min) 材質 槽體規劃
原水槽 130 - PVC 250 L
預氯槽 130 1.4 PP 扇葉攪拌
Dose:8、4、2 mg-Cl2/L
預氯出水槽 130 3.7 PP
快混槽 130 1.4 PP
扇葉攪拌
Vs:43 m/Day ;G:>100 /sec Dose:50 mg/L
慢混槽 130 35.4 PE 扇葉攪拌
Vs:2.1 m/Day;G::43~51 /sec 沉澱槽 130 53.2 PVC Vs:4.6 m/Day
沉澱出水槽 130 12.2 HDPE
快濾床A 64 12 壓克力
EBCT:7.2 min ;Vs:120 m/Day 填充:GAC/石英砂
(30 cm/30 cm)
快濾床B 64 12 壓克力
EBCT:7.2 min ;Vs:120 m/Day 填充:無煙煤/石英砂
(30 cm/30 cm) 快濾出水槽
(A、B) 64 27.1 HDPE
陶瓷珠濾床 32 34 壓克力
EBCT:14.9 min Vs:42.4 m/Day 填充:陶瓷珠 (44 cm)
消毒槽A 64 30 玻璃 磁石攪拌
消毒槽
(B、C) 32 50 玻璃 磁石攪拌
配水槽
(A、B、C) 20 1 (Day) PP PVC 管轉速 100 rpm
表3-2 濾砂材料性質
GAC 無煙煤 石英砂 陶瓷硃
平均粒徑(mm) 1-3 1-3 1 4-8
孔隙率 0.65 0.58 0.43 0.47
比重 1.32 1.20 2.55 1.51
濕密度(g/mL) 1.12 1.09 1.88 1.27
乾密度(g/mL) 0.46 0.42 0.89 0.53
3.1.3 操作與維護
本研究所使用之模廠操作模式為連續流,為了維持模廠的穩定運作,需對模 廠進行每日維護作業,維護項目及方法如下:
3.1.3.1 沉澱槽排泥
本實驗模廠之沉澱槽未有自動排泥設計,而過多的淤泥會阻塞沉澱槽,降低 沉澱效率,故需將沉澱汙泥排除,避免沉澱汙泥滿溢,影響後續單元操作。排泥 頻率為每日一次。
3.1.3.2 濾床反沖洗:
快濾床具有攔截、篩除懸浮物的功能,經長時間操作,懸浮物會阻塞濾材孔 隙,增加水頭損失,因此需對快濾床進行反沖洗作業。快濾床上下皆設有三通閥門,
反沖洗作業時,將沉澱出水槽端與快濾床出水槽端之閥門關閉,開啟反沖洗進流與 出流閥門,以由下而上之水流方向進行反沖洗作業。反沖洗水之來源為自來水,以 流量1 L/min 逆洗 2 分鐘,接著正洗 10 秒,最後將閥門復原,完成反沖洗作業。
反沖洗頻率為每日一次,並與沉澱槽排泥同時進行。
由於陶瓷珠濾床之機制並非將汙染物截除,其濾料孔隙大、接於快濾床之後,
不易有阻塞之問題產生,且為了使陶瓷珠表面之生物膜可穩定增長,因而不進行反 沖洗作業。
3.1.4 採樣
對模廠水質進行採樣與分析,需於沉澱槽排泥及快濾床反沖洗維護後,間隔 12 小時以上才可進行採樣。於各處理單元間皆進行採樣及水質分析,水質分析採 樣點與代號如表3-3。
表3-3 採樣位置
採樣點 代號 採樣位置
原水 RW 進入預氯槽前
預氯 PC 預氯出水槽
混凝 CO 慢混槽出水
沉澱 SE 沉澱槽出水
快濾床A FA 快濾出水槽A 快濾床B FB 快濾出水槽B 陶瓷珠濾床 FC 陶瓷珠濾床出水
消毒A DA 消毒槽A 出水 消毒B DB 消毒槽B 出水 消毒C DC 消毒槽C 出水 配水A EA 配水槽A 出水 配水B EB 配水槽B 出水 配水C EC 配水槽C 出水
3.2 水質與濾料分析
本研究針對採取的水樣進行水質分析,分析項目包含pH、溫度、濁度、總餘 氯、自由餘氯、UV254吸光度、NPDOC、HAA9、THM、HAAFP 與 THMFP。此外,
亦 進 行 濾 料 中 三 磷 酸 腺 苷(Adenosine tri-phosphate, ATP) 之 單 位 體 積 濃 度 (pmole/cm3)之分析。各項分析方法與採樣頻率將於本文 3.2.1 節至 3.2.9 節說明。
3.2.1 溫度、pH
使用附溫度校正功能之攜帶式pH 計量測(TS-2, SUNTEX, Taiwan),其誤差值 為pH±0.1、溫度±0.1℃。採樣頻率為每日一次。
3.2.2 濁度
使用攜帶式濁度計量測(2100P Portable turbidimeter, HACH, USA),偵測極限為 0.01 NTU,誤差值為±2%。採樣頻率為每日一次。
3.2.3 總餘氯與自由餘氯
總 餘 氯 濃 度 與 自 由 餘 氯 濃 度 使 用 口 袋 型 比 色 計 (Cat#58700-00, Pocket colorimeter ,Ⅱ Hach, USA)量測。儀器內建波長為 528 nm,偵測範圍 0.02-2.00 mg-Cl2/L。檢測方法為在樣品瓶中置入 10 mL 水樣,放入比色計內歸零,加入總餘 氯試劑(Cat#21056-28, DPD Total chlorine reagent, Hach, USA),搖晃數秒後,靜置 2 分鐘,由比色計讀取總餘氯濃度數值;另取水樣10 mL 入樣品瓶中,放入比色計 內歸零,加入自由餘氯試劑(Cat#21058-28, DPD Free chlorine reagent, Hach, USA),
搖晃10 秒,讀取自由餘氯濃度數值。當總餘氯濃度與自由餘氯濃度大於偵測範圍 時,以蒸餾水稀釋水樣至濃度小於 2 mg-Cl2/L 再進行檢測,將儀器讀值與稀釋倍 數相乘,即為實際濃度。採樣頻率為每日一次。
3.2.4 非揮發性溶解有機碳(non-purgeable dissolved carbon, NPDOC)
分析NPDOC 所使用之容器,需浸泡 10%之硫酸溶液至少 4 小時,再以超音波 震盪5 分鐘,最後以去離子水潤洗 3 次,而玻璃容器需再置於 450℃高溫爐中烘烤 1 小時以上,方可用於本試驗分析。水樣以玻璃燒杯採集後,經孔徑0.5 μm 之玻璃濾紙(GC-50, Advantec, Toyo Roshi Kaisha, Japan)真空抽氣過濾後,將濾液置入含鐵弗龍墊片之 40 mL 玻璃瓶 中,以磷酸(Cat#27618-55, 85%, Nacalai Tesuque, Kyoto, Japan)酸化至 pH 值小於 2 後,由總有機碳分析儀(Mode1010, OI Analytical, USA)進行分析,樣品以 4 ℃冷藏
保存並於一周內完成分析。採樣頻率為每周兩次。
3.2.5 UV
254吸光度(UV
254absorbance)
水樣以玻璃燒杯採集後,以孔徑0.5 μm 之玻璃濾紙(GC-50, Advantec, Toyo Roshi Kaisha, Japan)真空抽氣過濾,置入含鐵弗龍墊片之 40 mL 玻璃瓶中,於 3 小時內以分光光度計量測波長 254 nm 的吸光度,採樣頻率為每周兩次。
3.2.6 鹵乙酸萃取及衍生
水樣於採集時,使用氯化銨(Cat#024-24, Nacalai Tesuque, Kyoto, Japan)去除自 由餘氯,使自由餘氯反應為氯胺,避免HAA 持續生成。取 30 mL 水樣置入含鐵弗 龍墊片之 40 mL 玻璃瓶中,並以硫酸(Cat#30743, 95-97 %, Sigma-Aldrich, Saint Louis, MO, USA)將水樣酸化至 pH< 2,HAA 於酸性條件下可穩定保存且可避免微 生物將HAA 降解,而後進行萃取分析。樣品冷藏保存於 4 ℃並於兩周內完成萃取。
採樣頻率為每周兩次。
本研究鹵乙酸萃取方法依據美國EPA Method 552.3,並依實際情況做部分修改。
萃取前水樣需與室溫平衡,將標準品配置於30 mL 超純水中與水樣同步進行萃取。
首先添加1.5 mL 濃硫酸(Cat#30743, 95-97%, Sigma-Aldrich, Saint Louis, MO, USA) 降低水樣pH 值至 0.5 以下,使大部分鹵乙酸以非解離態存在。添加 3 mL 含內標 準品(Internal standard (IS), 300 μg/L of 1,2-dibromopropan in MTBE)之 MTBE (Cat#5398-08, Mallinckrodt Chemical, USA)後,加入 10 克硫酸鈉(Cat#8024-61, Mallinckrodt Chemical, Mexico),劇烈搖晃使大部分硫酸鈉溶解達飽和狀態,降低 鹵乙酸與 MTBE 於水中的溶解度,促使鹵乙酸進入有機層中。靜置數分鐘使水層 與有機層介面分離,當有機層有過多氣泡或雜質產生時,利用低速離心 (1000 rpm, 3 min)使其分離。分離後使用巴斯德滴管取 1mL 上層有機溶液至 15 mL 玻璃管中,
加入1 mL 硫酸甲醇溶液(10 %(v/v)),置於 50℃水浴槽兩小時進行衍生化反應,使 鹵乙酸與甲醇反應,衍生為鹵乙酸甲脂,此步驟的時間與溫度需掌控精確,將影 響分析結果的準確度。而後將樣品移出水浴槽與室溫平衡,加入1 mL MTBE 與 3
mL 硫酸鈉溶液(150 g/L),劇烈搖晃後靜置 1 分鐘使介面分離。取 1 mL 上層液至 1.5 mL 玻璃瓶中,以氣相層析儀(6890N Gas Chromatography, Agilent Technologies, USA)進行分析。
氣相層析儀(GC)所搭配的偵測器為微電子捕捉器(μECD)。管柱為 DB-1701,
長度30 m,管徑 0.25 mm,膜厚 0.25 μm。其他相關設定如下:進樣體積為 1 μL、
注入口溫度為210℃、採不分流模式(Splitless)、μECD 溫度為 290 ℃、管柱流量 1 mL/min、流速 19 m/s。Oven 溫控程式如圖 3-4,起始為 40 ℃維持 10 分鐘,以 2.5
℃/min 之增溫速率至 65 ℃,再以 10 ℃/min 之增溫速率至 85 ℃,最後以 20 ℃/min 之增溫速率至 205 ℃並持續 7 分鐘。圖 3-5 為將 HAA9標準品(4-7787, Supelco, USA),配製於純水中,經由萃取及衍生後,以氣相層析儀所分析之圖譜。
圖3-4 OVEN 升溫程式(HAA9)
MCAA,DCAA=100 μg/L. MBAA,BCAA,BDCAA=66.6 μg/L.
TCAA,DBAA=33.3 μg/L. CDBAA=166.6 μg/L. TBAA=333.3 μg/L.
圖3-5 GC-μECD 檢測圖譜(HAA9)
0 50 100 150 200 250 300
0 5 10 15 20 25 30
溫度(℃)
min
3.2.7 三鹵甲烷萃取
水樣於採集時,加入維生素丙(Cat#A7506, Sigma, USA)去除水中餘氯,置入含 鐵弗龍墊片之40 mL 玻璃瓶中,進行液相萃取分析。水樣採集時須滿瓶並確認無 氣泡。樣品以4 ℃冷藏保存並於兩周內萃取完成。採樣頻率為每周兩次。
三鹵甲烷萃取方法依據美國EPA Method 551.1,並依實際情況做部分修改。萃 取前將水樣與室溫平衡,將水樣取30 mL 另裝入 40 mL 玻璃瓶中,另將標準品配 置於30 mL 超純水中與水樣同步進行萃取。首先於水樣中添加 3 mL 含內標準品 (Internal standard, 300 μg/L of 1,2-dibromopropan in MTBE)之 MTBE (Cat#20257,
>99%, Fluka, Germany)後,加入 10 g 顆粒狀硫酸鈉(Cat#8024-61, Mallinckrodt Chemical, Mexico)並劇烈搖晃使大部分硫酸鈉溶解達飽和狀態,降低三鹵甲烷與 MTBE 於水中的溶解度,靜置數分鐘使水層與有機層介面分離,當有機層產生過 多氣泡或雜質時,以低速離心(1000rpm, 3min)使其分離。之後使用巴斯德滴管取 1 mL 上層有機溶液至 1.5 mL 樣品瓶中,以氣相層析儀分析樣品。
GC 所搭配的偵測器與管柱同鹵乙酸之分析,其他相關設定:進樣體積為 1 μL、
注入口溫度為200 ℃、採不分流模式(Splitless)、μECD 溫度為 272 ℃、管柱模式為 定壓6 psi;Oven 溫控程式如圖 3-6,起始為 35 ℃維持 15 分鐘,以 20 ℃/min 之增 溫速率至130 ℃維持 5 分鐘,最後以 20 ℃/min 之增溫速率至 220 ℃。圖 3-7 為將 THM 標準品(4S8746, Supelco, USA)配製於純水中,經由萃取後,以氣相層析儀所 分析之圖譜。
圖3-6 OVEN 升溫程式(THM)
圖3-7 GC-μECD 檢測圖譜(each THM = 66.6 μg/L);
3.2.8 消毒副產物生成潛勢分析
消毒副產物生成潛勢(Disinfection by products formation potential, DBPFP),為評 估水中消毒副產物前趨物質含量的方式之一,本研究針對三鹵甲烷生成潛勢 (Trihalomethane formation potential, THMFP)與鹵乙酸生成潛勢(haloacetic acid formation potential, HAAFP)兩類進行分析。依 Standard Method 5710 B 定義 THMFP 為水樣使用緩衝溶液維持在pH 7.0,添加足夠之自由餘氯,在恆溫 25℃條件下,
七天所產生之THM 總量,且自由餘氯須再 3~5 mg/L 之間。HAAFP 之定義亦同 (Method 5710 D)。
操作方式參考Method 5710 B,並依實際情形做部分修改。將水樣與緩衝溶液
0 50 100 150 200 250 300
0 5 10 15 20 25
溫度(℃)
min
(68.1 g KH2PO4 and 11.7 g NaOH in 1L water)依 50:1 比例混合,以 0.1 N HCl 及 0.1 N NaOH 溶液調整水樣之 pH 值至 7.0,次氯酸鈉溶液添加量以式 3-1 計算(Krasner et al., 1993),將水樣裝滿於含鐵氟龍墊片 250 mL 血清瓶中,保存在 25℃避光環境下 7 天,經確認自由餘氯在 3-5mg/L 後,依 3.2.6 節與 3.2.7 節分析 HAA 與 THM 濃 度,即可得HAAFP 與 THMFP。於每種前加氯條件下採取兩次水樣,進行 THMFP 與HAAFP 分析。
加氯量
(mg-Cl2/L)=3DOC
(mg-C/L)+7.6NH
3(mg-N/L)+3~5
(mg-Cl2/L) 式3-13.2.9 三磷酸腺苷(Adenosine tri-phosphate, ATP)濃度檢測
ATP 提供了生物體內各種生理反應的能量需求,活性越高的微生物體內會帶有 越高濃度的ATP 以維持能量供給。當微生物密度越高時,單位體積內 ATP 濃度也 會上升。因此,本研究使用ATP 濃度作為濾砂中微生物活性與數量的參考數值。
ATP 濃度量測之作用原理為 ATP 與 Beetle Luciferin 及 O2作用,經由Luciferase 與Mg2+的催化下,放出冷光訊號,藉由分析冷光訊號的強度(relative light units, RLU),可知 ATP 的濃度。反應示意圖如圖 3-8 所示。
圖3-8 ATP 與冷光酶反應示意圖(Part# TB337, Promega) Beetle Luciferin
Luciferase Mg2+
S N
-O N
S
O- S
N O
H N
S
COOH
Oxyluciferin
+ ATP + O
2+ AMP + PPi + CO
2+ Ligh t
ATP 濃度測定方法係根據 Silvana Velten 於 2007 年針對量測 GAC 濾砂上 ATP 濃 度之方法(Velten et al., 2007)依情況調整。
本實驗測定之樣品包含GAC、石英砂(快濾床 A)、無煙煤、石英砂(快濾床 B) 與陶瓷珠,各等分為上、中、下三層共15 份樣品。將樣品各自混合均勻後,取 200 mg(濕重)之濾料樣本置入 1.5 mL 管中,加入 100 μL 磷酸緩衝溶液與 BacTiter-GloTM reagent(Cat#G8231, BacTiter-GloTM Microbial Cell Viability Assay, Promaga, USA)並 置於30 ℃水浴槽內 3 分鐘,再加入 300 μL BacTiter-GloTM reagent,輕輕混和後置 於30℃水浴槽內 90 秒。取上層液 200 μL 上機分析(MDS Flex Station® 3, Molecular Devices, USA)。檢量線之製作方式為取 2 g 濾砂加入 5 mL 磷酸緩衝溶液,以 60℃
水浴槽加熱21 小時後以 5 mL 磷酸緩衝溶液洗滌 3 次,取 200 mg 濕重濾砂置入 1.5 mL 管中,加入 100 μL 已配置 ATP 標準濃度之磷酸緩衝溶液,加入 300 μL BacTiter-GloTM reagent 後之步驟與樣品相同。
量測完成後,可由冷光訊號強度(RLU)得到樣品 ATP 濃度(μM),將濾砂烘乾 秤重後,經式 3-2 及式 3-3 之計算,可得各濾料單位體積之 ATP 含量。操作流程 如圖3-9 所示。
單位乾重濃度 pmole/g 檢測濃度 μM 磷酸緩衝溶液體積 100 μL
濾砂乾重 g
式3 2
單位體積濃度 pmole/cm 單位乾重濃度 pmole/g 乾密度 g/cm 式3 3
圖3-9 ATP 濃度檢測流程
第四章 結果與討論
本研究操作時程分為三階段(stage1-3)。如圖 4-1 所示,模場建製與操作穩定期 歷經六個月(2009 年四月起至十月底),期間前加氯量為 8mg/L。於此時間範圍內各 處理程序對於濁度、NPDOC 的去除效果以及各濾床之鹵乙酸降解情形皆趨於穩定。
每一階段期程為40 至 60 天,第一階段(stage1)由 2009 年 11 月 1 日至 2009 年 12 月30 日止,期間之前加氯量為 8 mg-Cl2/L。第二階段(stage2)由 2010 年 1 月 1 至 2 月9,操作之前加氯量為 4 mg-Cl2/L。而第三階段(stage3)前加氯量則為 2 mg-Cl2/L,
期程為2010 年 2 月 11 日至 4 月 1 日止。
圖4-1 操作期程
0 1 2 3 4 5 6 7 8 9
前加氯劑量(mg/L)
4 mg-Cl2/L
2 mg-Cl2/L 8 mg-Cl2/L
Stage1
Stage2
Stage3
4.1 環境背景與模廠功能
表4-1 為 stage1-3 操作期程間之原水水質參數以及模廠環境溫度。其顯示各操 作期程間pH 值、NPDOC、濁度、UV254吸光度與SUVA 並無明顯差異,表示各操 作期程之原水水質相近,符合以模廠操作進行本研究之目的。但由於三操作期程 間,Stage2 之溫度較為偏低(P<0.05),可能會影響微生物的生理狀態,進而對有機 物與消毒副產物之去除產生影響。模廠所使用之原水pH 值符合飲用水水源標準於 6~8.5 之範圍。而小於 2 之 SUVA 值表示天然有機質的組成性質以非腐植質、小分 子與親水性之有機質為主(Edzwald and Tobiason, 1999),且低 SUVA 值水體所含之 有機物質具有較理想的生物降解性(Yapsakli and Cecen, 2010)。
表4-1 環境背景
檢測項目 Stage 1 Stage 2 Stage 3 平均值 ±標準差
pH 7.94 ±0.39 7.73 ±0.24 7.79 ±0.44 濁度 (NTU) 14.49 ±4.73 15.05 ±4.32 14.83 ±4.47 NPDOC (mg/L) 3.53 ±0.33 3.56 ±0.47 4.04 ±1.02 UV254吸光度(1/cm) 0.0464 ±0.0019 0.0460 ±0.0035 0.0499 ±0.003
SUVA (m-L/mg) 1.3 ±0.1 1.4 ±0.1 1.3 ±0.3 溫度 ( )℃ 22.6 ±2.3
19.7 ±1.8
22.5 ±2.5表4-2 為模廠配水槽出流水性質,其顯示在不同操作流程與階段下配水出流水 濁度、NPDOC 與 pH 值。濁度為自來水工程評估淨水廠處理效率以及水質狀況所 常用之指標,本模廠於三種操作程序下,皆可使配水槽出流水濁度低於1 NTU,
符合飲用水法規標準(<2 NTU),表示此模廠具有一般淨水處理廠之功能性。模廠 對原水中NPDOC 具有 30%至 50%之去除率,雖然飲用水法規將 DOC 定位在影響 適飲性之參數,管制較為寬鬆(500 mg-C/L),但將水中 DOC 降低,對於減少消毒
副產物之生成以及控制管線中生物膜之生長有所幫助。另外配水中的pH 值控制在 大於7 的條件下較為理想,可降低金屬管線的腐蝕速率,本模廠各程序之配水出 流水均符合pH>7。
表4-2 配水槽出流水性質
檢測項目 Stage 1 Stage 2 Stage 3
Process 平均值 ±標準差
pH
A 7.60 ±0.10 7.53 ±0.11 7.26 ±0.08 B 7.57 ±0.22 7.52 ±0.14 7.25 ±0.12 C 7.54 ±0.10 7.46 ±0.12 7.21 ±0.11
濁度 (NTU)
A 0.55 ±0.32 0.68 ±0.67 0.39 ±0.17 B 0.45 ±0.25 0.56 ±0.60 0.26 ±0.13 C 0.38 ±0.16 0.49 ±0.43 0.32 ±0.12
NPDOC (mg/L)
A 1.78 ±0.32 1.79 ±0.17 2.15 ±1.47 B 1.78 ±0.31 2.37 ±1.75 1.81 ±1.12 C 1.81 ±0.35 1.66 ±0.64 1.62 ±0.51
4.2 需氯量及自由餘氯之變化
前加氯所需劑量之評估,為使沉澱出流水仍保有0.1 mg/L 以上之自由餘氯濃 度,以抑制處理單元中藻類增生。因此需了解原水對於自由餘氯消耗之情形,本 研究將原水添加不同劑量之次氯酸鈉,反應90 分鐘後量測殘留之自由餘氯與總餘 氯濃度。結果如圖 4-2 所示,加氯量與總餘氯之關係並無顯著折點(break point),
但加氯劑量至 1.3-2 mg/L 以上時,加氯劑量與總餘氯量呈正比關係,此為加氯量 超過折點後所具有之特性,且加氯劑量於2 mg/L 時,即保有 0.2mg/L 之自由餘氯 濃度,符合前加氯之需求。因此,本研究於三操作期程之前加氯劑量,均達原水 之需氯量。
加氯量(mg-Cl2/L)
0 2 4 6 8
餘氯量(mg-Cl2/L)
0 1 2 3 4
自由餘氯濃度 總餘氯濃度
圖4-2 原水加氯量關係圖
圖4-3 為模廠實際操作下各流程間自由餘氯濃度變化情形。自由餘氯濃度於前 加氯後隨接觸時間增加而遞減,至沉澱出流水仍有殘留(>0.1 mg/L),與圖 4-2 之試 驗結果相符。不同操作階段下,自由餘氯於沉澱出流水之濃度有所差異(2.3 mg-Cl2/L(Stage1), 0.65 mg-Cl2/L(Stage2), 0.14 mg-Cl2/L(Stage3)),故快濾床(A, B)於 各階段下受進流水自由餘氯接觸之影響有所不同。而水中自由餘氯通過兩快濾床 後,濃度均明顯下降至0.1 mg-Cl2/L 以下,表示濾床消耗了大量的自由餘氯。因此 接續於快濾床(B)後之陶瓷珠濾床,於不同操作時程下,進流水之自由餘氯濃度均 偏低(<0.1 mg-Cl2/L),使陶瓷珠濾床並不直接受自由餘氯影響。處理水經消毒槽再 次添加消毒劑後,配水槽出流水之自由餘氯濃度皆符合法規規定0.2-1 mg-Cl2/L 之 濃度。
Process A
RW PC CO SE FA DA EA
0 1 2 3 4 5 6 7
Process B
RW PC CO SE FB DB EB
自由餘氯 (mg-Cl2/L)
0 1 2 3 4 5 6 7
Process C
RW PC CO SE FB FC DC EC
0 1 2 3 4 5 6 7
2009/11/01~2009/12/30 Stage1, 8 mg-Cl2/L, n=30 2010/01/01~2010/02/11 Stage2, 4 mg-Cl2/L, n=25 2010/02/20~2010/04/01 Stage3, 2 mg-Cl2/L, n=32
圖4-3 自由餘氯於淨水程序之變化
探討自由餘氯於快濾床中大量消耗之原因,是由於快濾床將非溶解性有機物 質攔截與篩除時,使濾料上之有機質濃度提高,增加與餘氯反應之機會;且有文 獻指出自由餘氯與GAC 之表面產生顯著之氧化還原反應,會消耗大量之自由餘氯 (Urfer et al., 1997),故處理水通過含有 GAC 之快濾床後,自由餘氯濃度會大幅降 低。圖 4-4 為模廠之快濾床於第一階段操作下(8 mg-Cl2/L),自由餘氯於不同濾床 深度之變化關係,結果顯示自由餘氯於快濾床上層之GAC 與無煙煤濾料中即快速 降低,於20 公分之濾床深度時,自由餘氯濃度已低於 0.1 mg-Cl2/L,表示 GAC 濾 料確實會大量消耗自由餘氯,且無煙煤也有相同之情形發生,可能其表面可進行 與GAC 同樣之反應。也由於自由餘氯已大量消耗於 GAC 與無煙煤濾料中,使得 進流水之自由餘氯無法直接直接影響快濾床下層之石英砂。
深度(cm)
0 10 20 30 40 50 60
自由餘氯濃度(mg-Cl2/L)
0.0 0.5 1.0 1.5 2.0 2.5
快濾床A(GAC/石英砂) 快濾床B(無煙煤/石英砂)
圖4-4 快濾床深度與自由餘氯之關係
反沖洗作業會使濾料混合,因此於不同深度之GAC 與無煙煤濾料,皆可能至 濾床上層受高濃度之餘氯量所影響,而石英砂由於比重較大,較不易與GAC 與無 煙煤互相混合而至濾床上層。
自由餘氯於GAC 與無煙煤濾料之降解,可以一階降解反應表示之。如式 4-1
與式4-2
GAC :C/C0 = EXP {-0.234 x 深度(cm)} 式 4-1 無煙煤:C/C0 = EXP {-0.181 x 深度(cm)} 式 4-2
於30 公分的填充深度之下,兩濾床之進流水餘氯需大於 223 mg-Cl2/L(快濾床 A) 與45.6 mg-Cl2/L(快濾床 A),才會使底層之石英砂接觸到大於 0.2 mg-Cl2/L 之自由 餘氯。因此,於正常操作下,快濾床進流水之自由餘氯大部分於上層之GAC 與無 煙煤濾料即消耗,不會對下層之石英砂產生影響。
表4-3 濾床進出流總餘氯與自由餘氯濃度
檢測項目 Stage 1 Stage 2 Stage 3 採樣點 平均值 ±標準差 (mg-Cl2/L)
總餘氯
SE 2.67 ±0.50 0.91 ±0.18 0.34 ±0.13 FA 0.18 ±0.08 0.08 ±0.02 0.04 ±0.02 FB 0.14 ±0.05 0.09 ±0.03 0.04 ±0.02 FC 0.09 ±0.04 0.06 ±0.02 0.03 ±0.02
自由餘氯
SE
2.30 ±0.50 0.65
±0.14 0.14 ±0.09 FA 0.06 ±0.04 0.03 ±0.10 <0.02 FB 0.05 ±0.03 0.02 ±0.01 <0.02 FC 0.03 ±0.02 0.02 ±0.02 <0.02*n:Stage1=30, Stage2=25, Stage=32
4.3 生物活性
研究結果顯示餘氯濃度可能顯著影響生物濾床之生物活性。表 4-4 顯示在低餘 氯濃度下 GAC 與無煙煤有明顯較高的生物量。GAC 與無煙煤被廣泛應用於快濾 床之上層濾料,係因其孔隙較大,可將大顆粒懸浮物先行攔截並增加過濾深度、
減緩下層石英砂堵塞、延長濾程與可提供吸附的能力。也因其多孔隙與大表面積
之特性,GAC 與無煙煤較石英砂適合微生物的增長,因此生物容量應較石英砂為 高。但於本研究中GAC 與無煙煤置於快濾床之上層,進流水的自由餘氯對上層濾 料的影響直接,使GAC 與無煙煤濾料於 Stage1 時之生物活性以 ATP 濃度表示反 較石英砂為低。Sun 於 2008 年的研究中,曾比較自由餘氯劑量對配水中 PVC 水管 上生物模生長的影響,管壁的平均生物膜密度(Average steady-state biofilm density) 於自由餘氯劑量為0.2 mg/L 時為 4.71±0.07(log CFU/cm3),而在自由餘氯劑量為 1.0 mg/L 時為 2.4±0.05(log CFU/cm3),顯示自由餘氯濃度對生物膜生長的影響顯著(Sun and Liu, 2009)。因此於 Stage1 時,快濾床進流水含有較高自由餘氯濃度(2.3±0.5 mg-Cl2/L),抑制 GAC 與無煙煤上微生物的生長而使 ATP 濃度偏低。
前加氯劑量降低可明顯使 GAC 與無煙煤生物活性提高。表 4-4 顯示前加氯量 由8 mg/L(Stage1)降至 4 mg/L(Stage2)時,GAC 之 ATP 濃度增加幅度(12 倍)明顯大 於無煙煤(5 倍),而當前加氯劑量由 4mg/L 降至 2 mg/L 時而 GAC 之 ATP 濃度提升 幅度(1.3 倍)反較無煙煤為低(2 倍),表示自由餘氯量抑制微生物生長的情形對 GAC 的影響較小,因此當前加氯量由8 mg/L 降至 4 mg/L 時,GAC 上所生長之生物量 已接近其生物容量上限。推測是由於GAC 表面上之孔隙率(0.65)與無煙煤高(0.58),
表面積也較大,可提供微生物較佳的生長環境以抵抗自由餘氯所致。
不同前加氯劑量對於石英砂的 ATP 濃度的影響較少,由圖 4-4 可知大部分餘 氯在上層濾床即被消耗,使下層石英砂中的餘氯濃度低,對微生物影響較小,因 而無明顯變化。
陶瓷珠濾床在三種操作時程下,進流水自由餘氯濃度均低於 0.1 mg-Cl2/L,因 此陶瓷珠濾床不受進流水自由餘氯所影響,但陶瓷珠濾料的ATP 濃度仍會隨前加 氯劑量降低而增加,可能是由於較低的前加氯劑量,微生物的生存率提高進而使 通過快濾床的微生物量增多,加上陶瓷珠濾床未有反沖洗操作,生物膜有較理想 的生長環境,使陶瓷珠的ATP 濃度增加。而陶瓷珠濾床進流水之自由餘氯濃度均 低,但陶瓷珠濾料之ATP 濃度顯著低於 GAC、無煙煤與石英砂濾料,表示其單位
體積內之生物量較低,系因陶瓷珠之孔隙率與石英砂較接近(0.47, 0.43)且陶瓷珠之 粒徑較大(4-8 mm),使得單位體積濾料中之微生物生長所需之表面積較低,微生物 量較少,因此陶瓷珠濾床所量測之ATP 濃度較低。
表4-4 各濾料之 ATP 濃度
濾料種類 Stage 1 Stage 2 Stage 3 平均值 ±標準差 (pmole/cm3)
GAC 15.9 ±4.7 195.5 ±43.8 250.1 ±11.7 石英砂A 47.1 ±12.3 36.9 ±10.3 68.5 ±22.8
無煙煤 15.9 ±4.0 85.8 ±18.6 174.0 ±37.6 石英砂B 80.1 ±12.1 41.5 ±11.0 67.8 ±11.1
陶瓷珠 0.5 ±0.4 7.1 ±3.6 16.4 ±5.9
圖4-5 將濾料的 ATP 濃度以長條圖分段表示之,可發現濾料之 ATP 濃度於 Stag1 與Stage2 時會隨濾床深度上升,當濃度上升至高點後有逐漸下降之趨勢,而 Stage3 時ATP 濃度則完全由上而下逐漸降低。由於進流水之自由餘氯與濾床上層最先接 觸,圖4-4 也顯示出上層濾料之自由餘氯濃度最高,因此生物活性受自由餘氯抑制 而較低,當水中自由餘氯逐漸被消耗,隨著深度而降低濃度,對微生物生長的抑 制效果減少,使下層濾料的ATP 濃度相對較高。
微生物之生長除了受抑制劑與消毒劑所影響外,亦與水中養分含量有關,水中 生物可利用性有機質為微生物生長之碳源,當濾料中之微生物將生物可利用性有 機質濃度降低後,下層濾料微生物可利用之碳原減少而使生長受影響導致ATP 濃 度下降。
由於快濾床每天會進行反沖洗作業,GAC、無煙煤與石英砂之間會因比重不同 而分層,但相同濾料之上下層間會因反沖洗作業而重新混合。故前加氯劑量影響 著GAC 與無煙煤整體的 ATP 濃度,而上下層間的濃度變化則以自由餘氯於濾床深