以CaO捕獲廢氣中二氧化碳溫室氣體之吸附與再生效能研究
101
0
0
全文
(2) 以 CaO 捕獲廢氣中二氧化碳溫室氣體之吸附與再生效能研究 Adsorption and Regeneration of Carbon Dioxide from Waste Gas by CaO Chemical Adsorbent. 研. 究. Student:Chin-Ming Huang. 生:黃 欽 銘. Advisor:Hsunling Bai. 指 導 教 授:白 曛 綾. 國 立 交 通 大 學 工學院專班永續環境科技組 碩 士 論 文 A Thesis Submitted to Degree Program of Environmental Technology for Sustainability College of Engineering National Chiao Tung University in Partial Fulfillment of the Requirements for the Degree of Master of Science in Degree Program of Environmental Technology for Sustainability. June 2007. Hsinchu, Taiwan, Republic of China. 中 華 民 國 九 十 六 年 六 月.
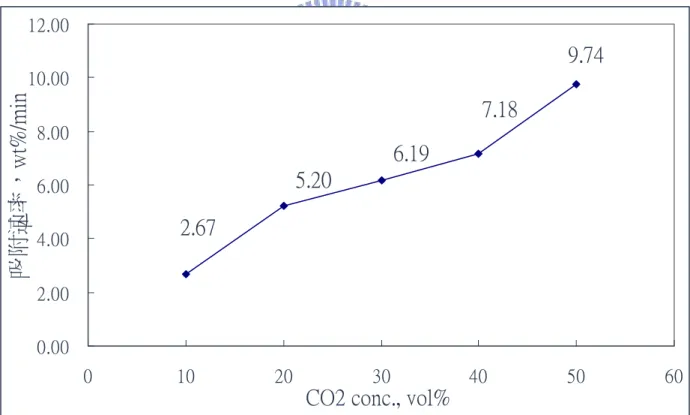
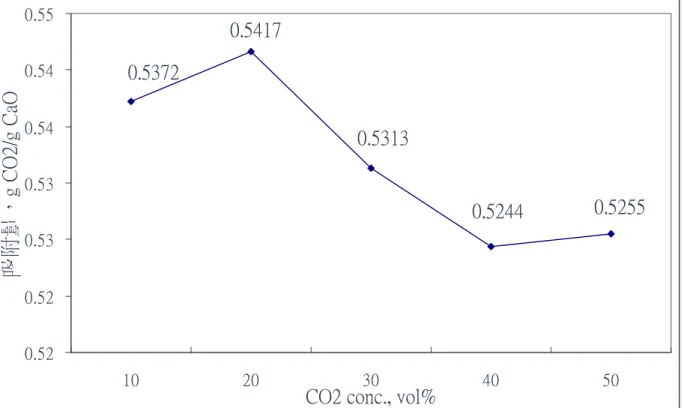
(3) 以 CaO 捕獲廢氣中二氧化碳溫室氣體 之吸附與再生效能研究 學生:黃欽銘. 指導教授:白曛綾. 國立交通大學工學院專班永續環境科技學程碩士班 摘要 本研究之主要目標是以台灣 3 個不同礦區所生產的石灰石進行 CO2 溫 室氣體吸脫附特性研究。探討之參數包括幾個重要操作參數對 CO2 吸脫附 之影響,本次測試之操作參數包括石灰石(CaCO3)的種類、石灰(CaO)補充 率、再生循環次數、CO2 體積分率、處理氣體含水率等。 測試結果顯示,實驗所用的各種類石灰石經過鍛燒產生之 CaO,對 CO2 吸附量相差很小。當石灰石在 700℃恆溫進行 CO2 的吸脫附實驗時,有較高 的吸附量與較佳的反覆吸脫附再生性,但是其吸脫附速率較低;而在 950℃ 脫附、650℃吸附時,則有較高的吸脫附速率,但其 CO2 吸附量較低。在石 灰(CaO)補充率實驗中,隨著補充率增加,CO2 吸附量亦隨之提高,唯增加 幅度不大。而於吸附時通入水氣增濕,對於 CO2 的吸附有加強的效果。最 後隨著 CO2 體積分率的升高(10%增加至 50% v/v),CaO 對 CO2 的吸附速率 顯著提高,但吸附量會有略微下降的趨勢。而反覆 10 次的吸脫附實驗雖然 CO2 吸附量逐漸降低但還是維持 0.2 gCO2/gCaO 吸附量,而且衰減的速率的 有越來越慢的趨勢。 經由此次研究後,可知 CaO 的確具有相當高的 CO2 吸附量,但商用石 灰石有再生率不佳的缺點,如何提升再生率,將是未來研究的課題。 關鍵字:溫室效應,吸附,二氧化碳捕獲與封存,氧化鈣. i.
(4) Adsorption and Regeneration of Carbon Dioxide from Waste Gas by CaO Chemical Adsorbent Student:Chin-Ming Huang. Advisor:Dr. Hsunling Bai. Degree Program of Environmental Technology for Sustainability College of Engineering National Chiao Tung University. ABSTRACT The purpose of this study is to understand the CO2 adsorption characteristics and its regeneration by limestone from three different mining areas in Taiwan. The important operating parameters being researched are limestone type, limestone supplement volume, number of regeneration times, different CO2 concentration, and gas moisture content. The test result indicates that after calcination the difference between each limestone is very small in terms of their CO2 adsorbing amounts. As the adsorption and regeneration of CO2 was at constant temperature of 700℃, it has greater CO2 absorbing amount and regenerative ability, but its adsorption rate is lower. On the other hand, as regenerated at 950℃ and adsorbed at 650℃, the adsorption rate is faster whereas the adsorption amount is lower. In the experiment of limestone supplement volume, as the CO2 supplement rate increases the adsorption capacity is enhanced. The presence of moisture increases the adsorption capacity of CO2. Increasing the CO2 inlet concentration from 10% to 50% (v/v) leads to an increase of the CO2 adsorption rate, but the adsorption capacity is slightly smaller. Result on the 10 times of cyclic adsorption test shows that the CO2 adsorption capacity reduces gradually, but it still maintains at adsorptive capacity of around 0.2g CO2/gCaO. Keywords: Greenhouse Effect,adsorption,CCS (carbon dioxide capture and storage),CaO. ii.
(5) 誌. 謝. 二年多的研究生涯,既不長也不短,如今能夠順利完成本論文,一路 上得到許多人的幫助。首先由衷的感謝指導教授白曛綾老師,在我研究的 過程,不斷給予我許多寶貴的意見,並細心的指導我錯誤的地方。此外還 要感謝口試委員袁如馨老師和徐恆文老師,在論文口試時給我的指導及寶 貴的意見,使我的論文得以順利完成,從他們身上我學到了做研究的嚴謹 觀念,而不是只有追求快速和效率。同時也要感謝所上所有上過課的老師, 在這段期間所給予的指導。 另外也感謝同事志峰、萬霞、靜宜等人的協助,論文的實驗才能順利 完成,在這兩年多的在職求學生涯,有你們的協助與鼓勵才能使我順利完 成學業,感謝你們!同時也要感謝博士班的研究生錦德和碩士班的研究生奕 岑,在實驗的過程中給予我許多操作上的幫助使實驗能順利完成。 二年多的在職求學生涯是很辛苦的,在這過程中我也歷經了二件人生 大事,其一是和這輩子的最愛聖芬結婚;另一個就是最疼愛的寶貝女兒雅 辰誕生,因此將此論文獻給我最摯愛的兩人和扶養我長大的父母。. iii.
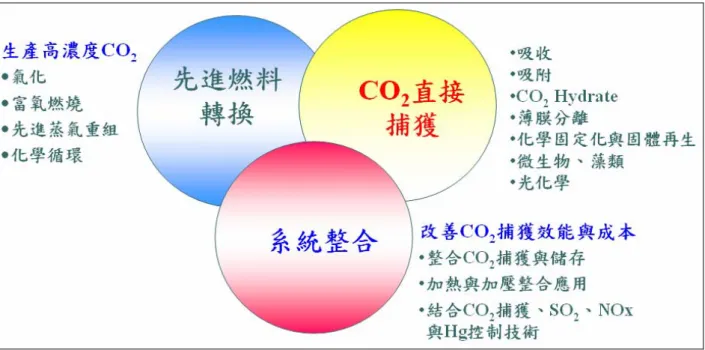
(6) 目 中文摘要 英文摘要 誌謝 目錄 表目錄 圖目錄 一、 1.1 1.2 二、 2.1 2.1.1 2.1.2 2.1.3 2.1.4 2.1.5 2.2 2.3 2.4 2.4.1 2.4.2 2.4.3 2.4.4 三、 3.1 3.2 3.3 3.4 四、 4.1 4.1.1 4.1.2 4.1.3 4.2 4.3. 錄 ……………………………………………………….. ……………………………………………………….. ……………………………………………………….. ……………………………………………………….. ……………………………………………………….. ……………………………………………………….. 前言………………………………………………….. 研究動機與背景…………………………………….. 研究目的…………………………………………….. 文獻回顧…………………………………………….. 二氧化碳捕獲技術概況……..……………………… 吸附法………….……………………………………. 吸收法………………..…………………………….... 薄膜分離法……..………………………………….... 富氧燃燒法………………..……………………….... 低溫冷凝法(低溫蒸餾法)………………..……….… 金屬氧化物吸附原理……..…………………….…... CaO 捕獲二氧化碳文獻回顧…………………..…... CaO 的改質…………………….………………..…... 濕式沉降處理程序………………………………….. 添加鹽類….………..………………………………... 添加鹼金屬….……….. ………….…………………. 前驅物製備 CaO.………………….....……………… 研究方法…………………………………………….. 實驗材料…………………………………………….. 實驗設備…………………………………………….. 實驗流程…………..………….……………………... 名詞定義…………..………….…………….……….. 結果與討論……………………………………….…. 探討最佳之石灰石礦產種類…………………….…. 石灰石重量損失測試………………..……………… 反應穩定時間測試………………..………………… 石灰石種類及 CO2 氣體含水率對系統操作的影響.. CO2 進流濃度的影響……………………………….. 石灰石再生率測試……..…………………………… iv. 頁次 i ii iii iv vi vii 1 1 7 9 11 17 22 26 32 32 36 41 45 45 48 48 49 54 54 54 57 58 60 60 60 60 66 66 70.
(7) 4.3.1 4.3.2 4.4 五、 5.1 5.2 參考文獻. 等溫吸脫附與等速加溫吸脫附模式之比較……….. 石灰石(CaCO3)補充率對去除率的影響…………… 與實驗級氧化鈣之反覆再生比較………….……..... 結論與建議………………………………….………. 結論………………………………………….………. 建議………………………………………….………. ……………………………………………….……….. v. 70 75 79 83 83 84 86.
(8) 表 目 錄 表 2-1 表 2-2 表 2-3 表 2-4 表 2-5 表 2-6 表 2-7 表 2-8 表 4-1 表 4-2 表 4-3 表 4-4 表 4-5. 國外二氧化碳控制技術之研究彙整表……………… CO2 排放濃度…………………………………………. 13X 分子篩性質介紹…………………………………. 不同高分子薄膜材質在 CO2/N2 系統中之選擇率…... CO2 分離和回收技術總結……………………………. 公式(13)相關參數…………………………………….. Lu et al. (2006)實驗中五種前驅物所生成 CaO 的比 表面積和孔隙體積……………………………………. Gupta et al. (2002)實驗中 8 種不同物質的比表面積 和孔隙體積……………………………………………. 3 種試料各取 5 次進行鍛燒後的 CO2 脫附量,單位(g CO2/g CaO)…………………………………….……… 3 種試料吸附碳酸化 1 小時和 2 小時 CO2 的吸附量, 單位(g CO2/g CaO)………………………………….… 試料 C 在不同 CO2 體積分率下之 CO2 吸附量……… 等溫吸附模式與等速加溫模式之吸脫附速率比較.… 試料 C 在 5 種補充率的反應數據,單位(g CO2/g CaO). vi. 頁次 13 15 20 30 34 43 52 52 61 65 68 76 78.
(9) 圖 目 錄 圖 2-1 圖 2-2 圖 2-3 圖 2-4 圖 2-5 圖 2-6 圖 2-7 圖 2-8 圖 2-9. 圖 2-10 圖 2-11 圖 2-12 圖 2-13 圖 2-14 圖 2-15 圖 2-16. 圖 3-1 圖 3-2 圖 4-1 圖 4-2 圖 4-3 圖 4-4 圖 4-5 圖 4-6. CO2 減量技術國際研究的主題..……………………. 二氧化碳捕獲流程與系統概況..…………………… 氣體吸附量隨壓力及溫度變化的情形.…………… KS-1 回收二氧化碳的流程圖………………………. 薄膜分離機制示意圖……………………………….. 高分子膜回收二氧化碳製程……………………….. 氧化鈣在 TGA 中進行碳酸化反應…………………. 石灰石 100 次吸脫附前後表面結構比較………….. 以粒徑 0.4-0.6 mm 的氧化鈣通入二氧化碳在 850℃ 下脫附 5 分鐘和 650℃下吸附 5 分鐘循環 500 次, 時間和重量的變化圖…………………………..…… 實驗條件同圖 2-9,CaO 的轉化率和循環次數圖.... PCC 製備配置圖…………………………………….. 不同濃度倍數的 Ca(OH)2(相對於飽和濃度)pH 值 和反應時間的關係圖……………………………….. Lu et al. (2006)實驗中五種前驅物 CaO 的 XRD 分 析…………………………………………………….. Gupta et al. (2002)實驗中六種不同來源 CaO 的 XRD 分析……………………………………………. Lu et al. (2006)實驗中五種前驅物所生成 CaO 的孔 徑分佈……………………………………………….. CaAc2-CaO 反覆吸脫附(等溫吸脫附 700℃,氣體濃 度(a) 30 vol %CO2, balance 氦氣,27 次(b) 10 vol % H2O + 30 vol % CO2, balance 氦氣,17 次)………… 實驗流程…………………………………………….. TGA 的電子天平、天平控制器與反應器…………. 3 種試料吸附反應穩定時間測試短時間內的重量變 化圖………………………………………………….. 3 種試料吸脫附反應穩定時間測試重量變化圖…… 3 種石灰石 1 小時和 2 小時 CO2 負載率(g CO2/g CaCO3)比較圖……………………………………….. 在 38.0 %RH 各石灰石在增濕與未增濕情況下的吸 附量比較…………………………………………….. 吸附速率與 CO2 體積分率關係圖………………….. 不同 CO2 體積分率與 CO2 吸附量關係圖………….. vii. 頁次 10 16 20 28 30 31 39 40. 44 44 47 47 51 51 53. 53 55 56 63 63 65 67 68 69.
(10) 圖 4-7 圖 4-8 圖 4-9 圖 4-10 圖 4-11 圖 4-12 圖 4-13. 試料 C 在 700℃等溫模式的重量變化曲線………… 試料 C 在等速加溫模式吸附 650℃,脫附 950℃的 重量變化曲線………………………………….……. 試料 C 在等溫模式和等速加溫模式的二氧化碳吸 附量變化量………………………………………….. 石灰石捕獲二氧化碳碳酸化與鍛燒循環示意圖….. 試料 C 於補充後之實際吸附量與預期吸附量數據 比較………………………………………………….. 二種吸附劑反覆 10 次吸脫附二氧化碳吸附量比較 圖…………………………………………………….. C 試料 10 次循環吸脫附二氧化碳的轉化率和公式 (13)比較………………………………………….…... viii. 71 74 74 76 78 81 82.
(11) 一、前言 1.1 研究動機與背景 氣 候 變 化 國 際 間 審 查 小 組 (The Intergovernmental Panel on Climate Change, IPCC)2001年科學評估報告顯示:如果CO2排放情景維持現狀,2100 年時全球平均溫度將上升攝氏1.4至5.8度,這種快速升溫情況在過去的1000 年不曾發現,而這項結果將會導致海平面上升9至88公分。這是過去一萬年 以來的最大增溫幅度。從氣候變化的觀點來看,目前氣溫與上次冰河時期 也不過相差攝氏4度,和上次IPCC 1995年評估報告攝氏1.5度至3度的增溫幅 度相比,攝氏1.4至5.8度的預測結果應該是令人們所震驚的,其所延伸的氣 象災害也必定是災情慘重的。IPCC 2001年報告預估,全球暖化所引發的氣 象災害將造成每年將超過三千億美元的損失。此外,溫室氣體如CO2在大氣 中的生命週期可長達50~200年,N2O 120年,甲烷12年,微量但溫室效應更 強的氟氯碳化物也高達50年。即使全球排放減量策略奏效,也只能短期減 緩大氣溫室氣體濃度上升,必須經過一段長時間,溫室氣體濃度方得穩定。 所以,溫室氣體減量策略是一項長遠性、前瞻性的政策考量。[1]. 全球氣候溫暖化的問題,聯合國於1992年通過氣候變化綱要公約 (United Nations Framework Convention on Climate Change, UNFCCC),1995 年開議,在1997年12月於日本京都簽定議定書之後,終於在2004年10月得. 1.
(12) 到俄羅斯同意批准議定書,並使議定書於2005年2月16日正式生效。而我國 行政院也分別針對京都議定書召開兩次全國能源會議,相關部門也因此舉 辦數場的研討會,針對議定書之六大議題進行研商以擬定出應對的方法。 溫室效應(Greenhouse Effect),指的是當太陽光以短波輻射穿透大氣 層,照射至地表後再以長波幅射反射出來,這些長波幅射可被大氣中某些 氣體吸收,將能量保留下來,此為維持地表溫度的重要機制,而這些可以 吸收長波輻射的氣體有CO2、CH4、N2O、O3及CFCs等,其中以CO2在大氣 層的含量最高。. 近年來,由於人類活動的頻繁,化石燃料的大量使用,其燃燒所產生 的 CO2 氣體,使大氣中 CO2 濃度遽增[2] ,致使全球暖化的情況越來越嚴 重。有研究顯示,以化石燃料如石油、煤礦或天然氣為原料的火力發電廠 所排放的 CO2 量比例最重[3] ,幾乎占了人為排放的 1/3 以上。2005 年我 國全國燃料使用所排放的 CO2 為 262,657 千公噸/年,而各部門燃料燃燒所 排放出來的 CO2 總排放量為 254,235 千公噸/年(各部門不包括用電排放的 CO2),其中能源(轉換)工業部門排放量為 157,127 千公噸/年約占 61.80%、 工業部門排放量為 49,666 千公噸/年約占 19.54%、運輸業部門排放量為 34,508 千公噸/年約占 13.57%、商業部門排放量為 2,178 千公噸/年約占 0.86%、住宅部門排放量為 5,656 千公噸/年約占 2.22%、農林漁牧業排放量為. 2.
(13) 2,716 千公噸/年約占 1.07%和其他部門排放量為 2,384 千公噸/年約占 0.94%; 由上述資料換算我國 2005 年人均排放 CO2 為 11.52 公噸/人[4] ,而 IEA, KEY WORLD ENERGY STATISTICS, 2005 中統計我國 2003 年人均排放 CO2 為 10.85 公噸/人,比 OECD 國家的人均排放 CO2 為 11.08 公噸/人略 低外,卻遠高於全球的人均排放 CO2 為 3.99 公噸/人。因此,如何減少 CO2 氣體排放至大氣中,為目前最熱門的環保議題之ㄧ。. 國內環保署日前完成了「溫室氣體減量法」草案送行政院審議,行政 院院會並於2006年9月20日通過「溫室氣體減量法」草案,草案中確定未來 將進行溫室氣體限量管制,國內產業的二氧化碳排放額度,也可以進行市 場交易。草案中也訂定了相關罰責,二氧化碳排放量超過核定分配的額度, 可以處50萬元以上、500萬元以下的罰款。如果各種溫室氣體減量措施施行 後,還是達不到國家總體減量的標準,將會立法實行「碳稅制度」向排放 戶收稅[5] 。經濟部工業局目前也已完成的相關法令修訂,說明如下: 1.. 已修訂促進產業升級條例,將投資於利用新及淨潔能源、節約能源及 工業用水再利用之設備或技術,及投資於溫室氣體排放量減量或提高 能源使用效率之設備或技術納入,當年度起 5 年內抵減各年度應納營 利事業所得稅額。. 3.
(14) 2.. 將提供製造業之溫室氣體排放減量工程技術服務業、節約能源或利用 新及淨潔能源工程技術服務業,納入新興重要策略性產業獎勵,新增 投資 5 年免徵營利事業所得稅。 〔6〕. 溫室氣體減量技術大概可分為三項如下: (1)增加能源使用效率(2) 使用再生、乾淨或新能源(3)CO2 捕集與封存技術等,其中第 3 項有學者 提出將 CO2 從煙道排放氣體中分離出來,而收集下來的 CO2 再注入油田或 海底等地處置。在 IPCC Special Report on Carbon Dioxide Capture and Storage (2005)中評估在第三次評估報告(2001)以後出版的有關 CO2 排放源、捕獲 系統、運輸及其各種封存機制,根據 IPCC 的工作程式,2005 年 9 月 22-24 日在加拿大蒙特利爾召開的 IPCC 第三工作組會議上,各國政府逐一同意通 過了本報告的決策者摘要,因此該特別報告和技術摘要已經被各國政府所 接受,在此特別報告中將二氧化碳捕獲和封存(Carbon Dioxide Capture and Storage, CCS)技術列為 CO2 減量的一個可行的方法之ㄧ[7] 。關於分離 CO2 的方法,早期有以 Monoethanolamine (MEA)等溶液進行化學吸收,唯再生 成本過高、廢液處理和二次污染等問題[8] ;Knowles et al. [9] 、Kim et al. [10]及 Zheng et al. [11]等提出以胺類(例如 polyethylenimine, PEI 或 3-aminopropyl-triethoxysilane, APTS)去修飾具高比表面積的吸附材,例如 SBA-15、MCM-41 或 MCM-48 等,對 CO2 進行吸附行為,此吸附劑具有良 好的再生率且可在室溫下進行吸附,但吸附量普遍偏低,仍有待改進。 4.
(15) 在目前提出的吸附劑中,氧化鈣(CaO)可說是最具有發展價值的一個, 雖然氧化鈣在自然界中並不是一個穩定的形式,但石灰石(CaCO3)卻大量存 在於環境中,而石灰石高溫脫附後會形成CaO。 因石灰石必須先經過脫附 CO2 之步驟,若要應用於 CO2 溫室氣體之控 制,必須要能重複使用才可以達到 CO2 減量之目的。其化學反應式如(1)(2) 所示: >700 C CaCO3 ⎯⎯⎯→ CaO + CO2 -180KJ. (1). <700 C CaO + CO2 ⎯⎯⎯→ CaCO3 + 180KJ. (2). o. o. 因此由反應(1)可知,一莫耳 CaCO3 在脫附 CO2 後,其重量損失將為原 來之 44/100=44%,亦即其剩餘重量為原來之 56%。而由反應式(2)可知一莫 耳的 CaO 可以吸附一莫耳的 CO2,若換算成重量百分比,則 CaO 之理論吸 附量為 44/56=0.7857 g CO2/g CaO。熱分解乾燥和鍛燒石灰石的反應溫度在 1200 K 時,能量需求在 210 千焦/mole CO2 的範圍內[12] 。CaO 捕集 CO2 之優點如下: 1.. CaO 的化學穩定性高,即多次反覆利用後仍具有較高的吸收活性,雖 然經多次重複使用後有活性慢慢減弱的現象,但 CaO 價格便宜、產地 多可以大規模生產且取得容易,因此可以添加新鮮的 CaO 以補償損失。. 5.
(16) 2.. 設備簡單處理量大,目前雖未有商業化之實績,但各部分獨立之操作, 於工業界已有大型機組正在運轉,要商業化不是問題。. 3.. 可直接在煙氣環境下分離 CO2,比較沒有傳統吸收程序之限制(氣體 組成成分、氣體溫度、氣體壓力、處理量等) ,且處理後煙氣 CO2 濃度 低,再生時可以產生高純度的 CO2。. 4.. 沒有危險物質存在,所用之 CaO (生石灰)與 CaCO3(熟石灰) ,較 其他化學吸收劑而言安全許多。. 5.. 而 CaO 捕集 CO2 之吸收負載,理論上最高可達 786mg CO2/g CaO。而 實際上在理想狀態下約有 393mg CO2/g CaO,相對化學吸收劑而言, 可以少量之吸收體積,吸收較多的 CO2(35℃ 時 30%MEA: 343mg CO 2 /g sorbent、30%AMP:315mg CO 2 /g sorbent〔13〕) 。 台彎蘊藏豐富的石灰石,根據經濟部礦務局的資料顯示,台灣地區石. 灰石的蘊藏量相當豐富,石灰石蘊藏大致可分南部和北部二個地區。南部 地區分布於嘉義、台南、高雄一帶,近年來產量已日漸枯竭,北部份布於 新竹、花蓮和宜蘭縣蘇澳等地。這些石灰石均蘊藏於第三紀及第四紀地層 中,大都露天開採,我國在 1997 年的石灰石產量為 15,447,434 公噸達到最 高峰,而後逐年降低在 2006 年石灰石產量為 351,779 公噸,產量降低是因 為政府實施出口管制所致。國內東部石灰石蘊藏量十分豐富,尤其中央山 脈東斜面,自花蓮和平至瑞穗區段間之蘊藏量即超過 4000 億公噸,可謂取 6.
(17) 之不盡用之不竭[14]。但是國內缺乏相關針對石灰石分離二氧化碳的研 究,雖然國外有許多學者已經進行 CaO 吸附二氧化碳相關的研究,如 Grasa et al.(2006)等進行石灰石多次吸脫附試驗[15] 、Abanades et al.(2004)等進 行吸收劑的費用評估[16] 、Hughes et al.(2004)進行石灰石在流體化床裡的 變化[17]和 Stanmore et al.(2005)等探討石灰石利用斷燒及碳酸化分離二 氧化碳[18]等,可是 Hughes et al.(2004)在其實驗中針對 2 種石灰石進行 成分分析,由其分析結果發現雖然都屬石灰石,但其組成不完全相同,光 CaO 的成分就差了快 3%,也因此針對國內如果將來要利用石灰石在高溫下 分離二氧化碳,則進行類似的研究是必需的,並可將研究結果提供給將來 設計反應器時所需要的參考資料。. 1.2 研究目的 本研究利用熱重分析儀(Thermal Gravimetric Analysis, TGA)探討以石灰 (CaO)來處理氣體中的 CO2,當在不同的條件下其吸附量的差異性,以達成 下列研究目的: 1.. 石灰石(CaCO3)重量損失測試,研究各試料二氧化碳脫附量與理論值吸 附量的差異,以了解不同地區石灰石的純度差異。. 2.. 反應穩定時間測試,研究各試料對二氧化碳吸脫附反應穩定時間變化 的結果,以決定穩定的反應時間。. 7.
(18) 3.. 等溫吸脫附與等速加溫吸脫附模式之循環再生能力比較。. 4.. 石灰石補充率和 CO2 體積分率對去除率的影響。. 5.. CO2 氣體含水率對系統操作的影響及實驗級氧化鈣跟石灰石的差異 性。. 6.. 多次反覆利用後是否仍具有較高的吸收活性。. 8.
(19) 二、文獻回顧 二氧化碳氣體的管制策略,除了(1)節約能源、(2)提升發電效率、(3)增 加再生能源的使用等抑制二氧化碳氣體排放的方案外,從傳統的燃煤、油、 天然氣等電廠及工廠(4)煙道廢氣中捕集二氧化碳氣體,為目前各先進國家 的研究重點,如圖2-1所示。但節約能源、提昇發電廠效率及增加再生能源 等方案,在短期內甚至長期的效果有限,無法大幅降低二氧化碳氣體的排 放,俾以減緩溫室效應的現象。而被認為可以有效大幅減少二氧化碳氣體 排放的核能發電廠,在世界各國(包括我國在內)都因安全上的問題不為 大眾所能普遍接受。. 相較之下,若煙道中捕集二氧化碳氣體技術可以達到抑制二氧化碳氣 體排放效果,加上其控制方法又與一般去除空氣污染物(SOx、HCl、NOx 等酸性氣體)技術相似,且在經濟上又確切可行,相信此一技術必可為民 眾及廠商業者所接受。因此,以日本、美國及歐洲各國為主的先進國家, 均已投入相當多的人力與經費從事煙道中二氧化碳氣體捕集技術的研究發 展工作。. 9.
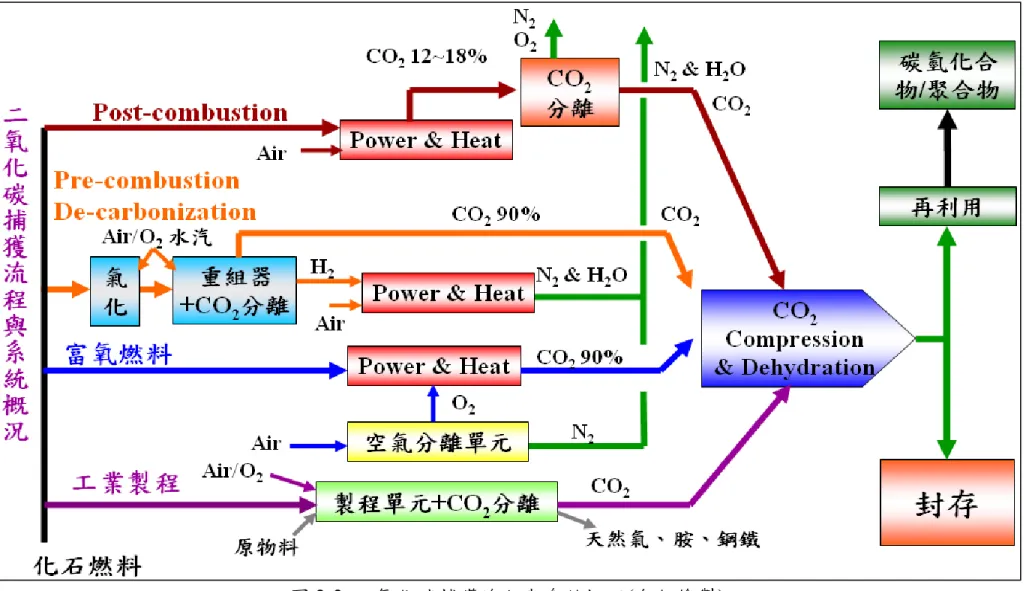
(20) 圖 2-1 CO2 減量技術國際研究的主題 資料來源:Carbon Sequesration Technology Roadmap and Program Plan-2004 [19]. 10.
(21) 2.1 二氧化碳捕獲技術概況 二氧化碳的捕集技術,以化學溶劑吸收法的技術研究的最多也最廣 泛,但是大多採用溼式的化學藥劑吸收方法,較少有半乾式吸收系統 (Semi-Dryer Adsorption System,SDA)或單獨以氧化鈣為吸附劑對二氧化碳 之控制效果及影響因子研究,且仍在實驗室實驗階段,尚未有實廠應用的 實際個案。國內外有關二氧化碳控制技術之研究,整理如表2-1所示。 CO2捕獲技術可以由煙道排氣(flue gas)或是由燃燒前的氣體中捕集而 得,表2-2所列為各種運作模式的發電廠排放之CO2濃度,顯示使用不同原 料,燃燒方式及燃燒時機均會導致煙道排氣之CO2含量不同。CO2捕獲技術 有四種捕集路徑:如圖2-2所示。 1.. 燃燒前捕集(post-combustion capture). 2.. 燃燒後捕集(pre-combustion capture). 3.. 氧氣燃料燃燒(oxy-fuel combustion). 4.. 工業製程(industrial process). 每種路徑其條件不盡相同,可供選擇的主要有下列幾種捕獲技術:化 學/物理吸收、化學/物理吸附、薄膜分離、富氧燃燒法和低溫冷凝等技術, 依照四種捕集路徑不同的條件分別搭配上列的捕獲技術,以下為各技術概. 11.
(22) 述,目前國外CO2捕獲技術已商業化的有物理吸收法、化學吸收法和薄膜分 離法。. 12.
(23) 表 2-1 國外二氧化碳控制技術之研究彙整表(1/2) 技術名稱 Activated MDEA. 研究單位 德國BASF. Selexol. Union Carbide Corporation. Rectisol. 德國Linde與Lurgi 聯合開發. Benfield. 美國 UOP. Carsol Catacarb. 比利時 Carbochim 美國 Eichmeyer Associata. Flexsorb. 美國 Exxon’s. G-V. 義大利 Giammarco. Amine Guard FS. 美國 UOP. 技術(系統)單元. 技術重點(優、缺點) 參考文獻 1.吸收二氧化碳後生成的碳酸氫鹽,可加熱再生 Jiangang Lu, 2005 濕式洗滌塔 [20] 2.缺點是吸收速率慢須添加活化劑及水處理設施增加負荷 1.使用之吸收劑(dimethyl ether of polyethylene glycol)具有無 Chao Chen, 2003 濕式洗滌塔 毒、熱穩定性好、不分解及無腐蝕性等特點 [21] 2.缺點是吸收劑費用和處理費較高及水處理設施增加負荷 1.此法最適合用於脫除由含硫重油或煤部分氧化生成的氣體 中之二氧化碳和硫化物。 H. Schlichting, 濕式洗滌塔 2003[22] 2.缺點是此法所使用之甲醇因蒸氣壓較高,故須在低溫下 (-55~35°C)操作 1.吸收劑是熱碳酸鉀溶液使用活性劑是烷基醇胺類 David Dortmundt, 填充式洗滌塔 1999[23] 2.缺點是吸收速率慢須添加活性劑增加吸收率易腐蝕槽體 1.吸收劑是熱碳酸鉀溶液使用活性劑是烷基醇胺類 Tone Novak, 2005 濕式洗滌塔 [24] 2.缺點是吸收速率慢須添加活性劑增加吸收率易腐蝕槽體 1.吸收劑是熱碳酸鉀溶液使用活性劑是烷基醇胺類 Rosemarie M. 濕式洗滌塔 2.缺點是吸收速率慢須添加活性劑增加吸收率且易腐蝕槽體 BOWLER, 2002[25] 1.吸收劑是熱碳酸鉀溶液使用活化劑是立體障礙醇胺 Robert B. Fedich, 濕式洗滌塔 2005[26] 2.缺點是熱容量、處理費用較高及回收水處理設施增加負荷 1.吸收劑是熱碳酸鉀溶液使用活化劑是胺基乙酸活性劑 V.K. Bali, 2005 濕式洗滌塔 2.缺點是 As2O3 吸收劑有毒目前用胺基乙酸替代但吸收速率 [27] 較慢及水處理設施增加負荷 1.使用 MEA 當吸收劑吸收速率快價格便宜 UOP網頁[28] 濕式洗滌塔 2.缺點是吸收容量低易被 SO2 毒化且易腐蝕槽體. 13.
(24) 表 2-1 國外二氧化碳控制技術之研究彙整表(2/2) 技術名稱 Econamine FG PlusSM. 研究單位. 技術(系統)單元. 技術重點(優缺點) 參考文獻 1.使用 30wt%MEA 當吸收劑吸收速率快價格便宜 Howard Herzog, 美國 Fluor 濕式洗滌塔 1999[29] 2.缺點是吸收容量低易被 SO2 毒化且易腐蝕槽體 1.N-methy-pyrrolidone Christopher 德國 Lurgi 濕式洗滌塔 Purisol Higman, 1990[30] 2.缺點是吸收劑費用和處理費較高及水處理設施增加負荷 1.alkanolamine and tetrahydrothiophene dioxide P. J. Teevens, 美國 Shell 濕式洗滌塔 Sulfinol 2004[31] 2.缺點是吸收劑費用和處理費較高及水處理設施增加負荷 1.能在高溫環境下(370℃)回收二氧化碳。另外,其也能在天 然氣中從二氧化碳分離出氫氣,並能從甲烷氣中分離二氧 美國能源部 高溫 李政弘,2001[32] 薄膜槽 化碳 Los Alamos 薄膜分離法 國家實驗室 2.缺點是對高分子材料而言,氣體透過率及分離度往往互相衝 突,即分離度大者透過率低,反之亦然 1.具有不需使用強酸、鹼及較少廢水之優點, 再生離子 美國 Membrana 和 2.缺點是煙道氣溫度偏高及二氧化碳濃度偏低,不利於樹脂再 Membrana[33]、DOW 離子交換樹脂塔 網頁[34] 交換樹脂法 DOW 等 生;還有 SOx 及 NOx 會溶入水中使水中之硫酸根與硝酸根 離子濃度增加,不利於水質處理 1.在低溫與高壓下,將水與二氧化碳形成二氧化碳水合物,並 日本產業技術綜合 日本產業技術綜合研 二氧化碳 儲存於海洋 研究所[35] 、美國 究所、美國喬治亞理 高壓低溫反應槽 水合物法 2.缺點是此技術還在評估其二氧化碳去除效率及能源可能耗 喬治亞理工學院網 工學院 頁[36] 用過大. 14.
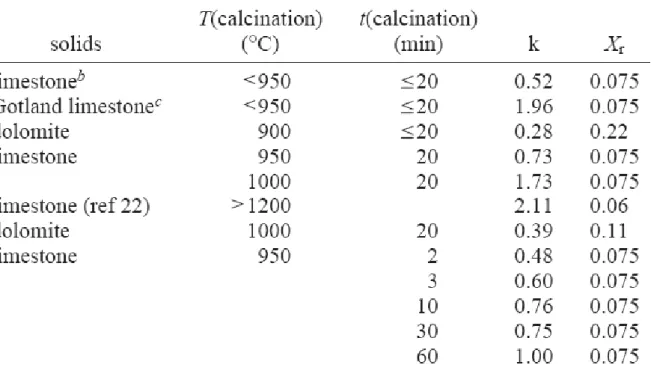
(25) 表 2-2 CO2 排放濃度 CO2 排放濃度,體積百 分比 燃燒後煙道排氣 ¾ 燃煤鍋爐. 14. ¾ 天然氣鍋爐. 8. ¾ 天然氣複合循環(natural gas. 4. combined cycle) ¾ 煤-富氧 燃燒. >80. 燃燒前煙道排氣 ¾ 煤氣化煙道氣. 40. ¾ 天然氣部分氣化煙道氣. 24. 資料來源:IEA GHG program[37]. 15.
(26) 圖 2-2 二氧化碳捕獲流程與系統概況(自行繪製) 資料來源:IPCC「二氧化碳捕獲和封存」特別報告〔7〕 16.
(27) 2.1.1 吸附法. 吸附也屬於一種傳質過程,物質內部的分子和周圍分子有互相吸引的 引力,但物質表面的分子,其中相對物質外部的作用力沒有充分發揮,所 以液體或固體物質的表面可以吸附其他的液體或氣體,尤其是表面面積很 大的情況下,這種吸附力能產生很大的作用,所以工業上經常利用大面積 的物質進行吸附,如活性炭、水膜等。吸附過程有兩種情況:(1)物理吸附 (Physical adsorption 或 physisorption),物理吸附吸附體(adsorbate)藉凡得瓦 力(van der waals force)吸附在物體表面上稱物理吸附。由於作用力為超距 力,因此在較高壓力下,可形成多層吸附。吸附體的物理吸附能較低,約 小於 0.5eV/atom,與其氣相原子凝結熱相當,在吸附過程中物質不改變原 來的性質,因此吸附能小,被吸附的物質很容易再脫離,如用活性炭吸附 氣體,只要升高溫度,就可以使被吸附的氣體逐出活性炭表面。(2)化學吸 附(Chemisorption),化學吸附可視為吸附體分子與物質表面原子,藉著一 個或多個電子軌道的重疊,而進行的一種化學反應。化學吸附有極高的方 向性,一般限制在表面單層。化學吸附鍵能很高,與自由分子中的主要化 學鍵結能相當,因此吸附能較大,要逐出被吸附的物質需要較高的溫度, 而且被吸附的物質即使被逐出,也已經產生了化學變化,不再是原來的物 質了。由於表面位置並非完全相同,原子在表面上的吸附熱,會隨著氣體. 17.
(28) 吸附量的增加而減少,一般催化劑都是以這種吸附方式起作用。 1.物理吸附法 此法是以碳素系及 zeolite 固體吸附劑來吸著二氧化碳,依其再生操作 方 式 大 致 分 為 三 種 , 一 為 以 變 化 壓 力 的 變 壓 吸 附 法 (Pressure Swing Adsorption, PSA)法來達到吸脫附二氧化碳;另一為採用溫度變化的變溫吸 附法 (Temperature Swing Adsorption, TSA)法來進行吸脫附二氧化碳,有時 也可採用兩種方式的組合型態來吸脫附二氧化碳,如變溫變壓吸附法 (Pressure Temperature Swing Adsorption, PTSA);其他的尚有真空變壓吸附 法(Vacuum Swing Adsorption, VSA)和低電壓電流再生吸附法(Electrical Swing Adsorption, ESA) 法。ESA 是對吸附物通以低電壓的電流再生,但 此法業界較少使用。物理吸附法的優點是操作較簡單及維修容易,但是其 缺點是需先對在廢氣中之 SOx 及水氣等做前處理,以避免這些氣體毒害 吸附劑,且因吸附劑吸附二氧化碳效率低,通常需加裝二段以上之吸附系 統以增加二氧化碳的吸附量,因此目前大處理量之實際應用案例少,應用 範圍較窄。目前工業上用來進行 CO2 與氫氣分離之分子篩以 13X(zeolite) 最多,其性質如表 2-3 所示。13X 的沸石是指 X 型晶體結構的鈉型,是一 種鹼金屬銈鋁酸鹽。這類 X 型的分子篩,具有較大的孔徑,能吸附臨界直 徑小於 10A 的分子,同時也具有較高的吸附容量,以及較佳的質傳速率。. 18.
(29) 它的用途有稀有氣體跟氫氣等氣體的乾燥、深冷法設備中脫除水份與二氧 化碳、液態碳氫化合物與天然氣的脫硫和用作催化劑載體。以下分別為變 壓吸附法吸附法及變溫吸附法的介紹: (1). 變壓吸附法吸附法. 變壓法提純或分離單元是根據恆定溫度下混合氣體中不同組份在 吸附劑上吸附容量或吸附速率的差異以及不同壓力下組分在吸附劑上 的吸附容量的差異而實現的,由於採用了壓力漲落的循環操作,強吸附 組份在低分壓下脫附,吸附劑得以再生;吸附劑的使用壽命一般為十年 以上,所以PSA過程基本是無原料消耗過程。 (2). 變溫吸附法. 變溫吸附法或變溫變壓吸附法是根據待分離組份在不同溫度下的 吸附容量差異實現分離,由於採用溫度漲落的循環操作,低溫下的被吸 附的強吸附組份在高溫下得以脫附,吸附劑得以再生,冷卻後可再次於 低溫下吸附強吸附組份。確定是否採用吸附法分離的主要依據為待分離 物和吸附劑之間的吸附關係,如圖2-3所示在不同溫度下T2、TA、T0和 T1的氣體吸附量隨壓力及溫度變化的情形︰對於污染排放物如果PA與 P0的吸附容量差別較大,則可考慮PSA技術;若污染排放物於T2與T1間 的吸附量差別較大時,可考慮採用TSA技術[38] 。 19.
(30) 表2-3 13X沸石性質介紹 性能 單位 形狀. 球. 標準孔徑. (A). 10. 直徑. mm. 3.0-5.0. 粒度. %. ≥ 96. 堆積密度. G/ml. ≥ 0.60. 磨耗率. %. ≥ 0.20. 抗壓强度. N. ≥ 60/p. 静態水吸附. %. ≥ 25. 二氧化碳空氣處理量. NL/g. ≥ 14. 二氧化碳吸附量. g/g. ≥ 17.5. 包裝水含量. %. ≥ 1.5. 吸附分子. 有效直徑<10A的分子. 排出分子. 有效直徑<10A的分子. 參考資料:陳君豪(2001)[38]. 圖 2-3 氣體吸附量隨壓力及溫度變化的情形 參考資料:陳君豪(2001)[38] 20.
(31) 2.化學吸附法 利用 CO2 跟吸著劑表面伴隨的化學反應來捕獲 CO2,以從混合的煤氣 中分離 CO2。 (1). 無機鹼 CO2呈弱酸性因此能和固體的無機鹼產生反應,捕捉CO2後會產生 碳酸鹽或碳酸氫鹽,如(4)和(5)式。 2MOH + CO2 U M2CO3 + H2O M =Li、Na、K等等. (4). M(OH) 2 + CO2 U MCO3 + H2O M =Mg、Ca等等. (5). 但這些產生的碳酸鹽如果要再生使用需要使用高溫來分解(分解溫 度最低的MgCO3的分解溫度600℃),再生鹼需要大量的能量所以並不實 用。另外氫氧化鈉及氫氧化鉀易受潮,也因此使得這些固體的處理更加 困難,如果能有效的利用廢熱來進行再生工作,則可大幅減少能量的消 耗;利用生成的碳酸鹽、CO2和水一起反應成碳酸氫鹽也是可行的如(6) 式。 M2CO3 + CO2 + H2O U 2MHCO3 M =Li、Na、K等等. (6). 這些的反應與下面敘述的熱碳酸鉀法相同,不過熱碳酸鉀法是使用. 21.
(32) 碳酸鉀的水溶液作為吸收液。因為固體的碳酸鹽或碳酸氫鹽易受潮導致 體積膨脹,這些固體鹽若直接用於CO2的回收使用,在吸附塔建造的工 藝方面將有困難且不實用。如果能在多孔隙材料的細孔上保持像這樣易 受潮的固體鹽,則可能能迴避有關吸附劑本身受潮的問題。至少直接使 用固體的無機鹼鹽進行CO2的捕捉和分離被認為目前工藝上有所困難。 (2). 固體胺. 如果將無機的強鹼鹽改變,而使用弱鹼性的胺來替代的話,能使捕 捉的CO2更為容易再生分離。因為在太空站和潛水艇等封閉的空間中, 由於人類長期間的逗留所產生的CO2,就是利用固體胺的方法來去除空 氣中的CO2。這些固體胺和適度的水分共存下能捕捉CO2,在100℃左右 的水蒸氣加熱下或者減壓下,因為外部加熱使捕捉到的CO2又被分離。 吸附能力是看吸附劑重量。像這樣固體胺在有水蒸氣存在下使用100℃ 以上的高溫,便能使胺基分解而能將CO2回收分離,因此在吸收CO2時 儘可能要在低的溫度下使用。目前該方法只適用於小流量系統的階段 [39] 。. 2.1.2 吸收法 吸收法根據溶液吸收 CO2 的方式和分離 CO2 回收的方法分為 2 種,有 隨著物理溶解的物理吸收法和吸收液中的化學物質和 CO2 產生化學反應 22.
(33) 的化學吸收法。 1.物理吸收法. 物理吸收法的原理是透過交替改變二氧化碳和吸收劑(通常是有機溶 劑)之間的操作壓力和操作溫度以實現二氧化碳的吸收,從而達到分離處 理二氧化碳的目的。其優點是在高壓及低溫的條件下吸收,吸收容量大, 吸收劑用量少,且吸收效率隨著壓力的增加或溫度的降低而增加。在整個 吸收過程中不發生化學回應,因而消耗的能量要比化學吸收法要少,而在 吸收飽和之後,採用降壓或常溫氣提的方式將二氧化碳分離而使吸收劑再 生。物理吸收法中常用的吸收劑有丙烯酸酯、甲醇、乙醇、聚乙二醇及聚 乙二醇二甲醚等高沸點有機溶劑。目前,工業上常用的物理吸收法有 Fluor 法、Rectisol 法、Selexol 法等,Rectisol 法和 PSA 為目前歐洲在處 理氫氣和二氧化碳分離時的主要分離法。物理吸收法由於 CO2 在溶劑中的 溶解遵循亨利定律,因此僅適用於 CO2 分壓較高的條件,且吸收劑會因硫 化物劣化而減少再生次數。 2.化學吸收法. 與物理吸收法不同,化學吸收法是吸收劑與二氧化碳發生化學反應來 達到回收二氧化碳並利用其逆反應進行吸收劑再生,因此化學吸收法較物 理吸收法來的有效率,其能獲得較高的二氧化碳脫除率且適合於處理二氧 23.
(34) 化碳分壓低的混合氣體。在移除二氧化碳之前,先行將混合氣體冷卻,及 盡可能除去其中的雜質如硫化物,粒狀物等,然後氣體通過一吸收容器 (absorption vessel),但是真正移除二氧化碳的是與此吸收容器相接連的化 學吸收劑,二氧化碳與吸收劑發生化學反應,形成鍵結較弱的化合物,吸 收飽合後在一再生管(recovery column)中加熱,發生吸收二氧化碳的逆反 應,二氧化碳被釋放出來,如此吸收劑得以再生,與此同時,釋放的二氧 化碳於再生管中被壓縮後運送,此法可回收 98%的二氧化碳,而純度可達 99%以上。但其缺點有以下三點:溶劑與其他氣體(如 O2、SOx 或 COS) 發生不可逆的化學反應,使吸收劑之再生次數減少,因而增加操作成本; 由於吸收劑多為鹼性溶液,會對吸收塔、再生塔及周邊管線造成腐蝕作 用;操作變數較多,因此操作較為繁瑣。由於二氧化碳為酸性氣體,故一 般選用具有鹼性之吸收劑,並將常用之方法簡述如下: (1). 熱碳酸鉀吸收法. 此法最初是在美國開發利用煤合成液體燃料方案中的一部分發展 而起的,主要是利用碳酸鉀溶液吸收二氧化碳反應產生碳酸氫鉀。再生 的話,將已吸收二氧化碳的碳酸鉀溶液加熱到碳酸氫鉀的分解即可發生 逆反應,產生二氧化碳並將反應生成的碳酸鉀再使用。50年代初此法發 展為活化熱碳酸鉀法,因為將吸收二氧化碳的溫度提升至105~120℃及. 24.
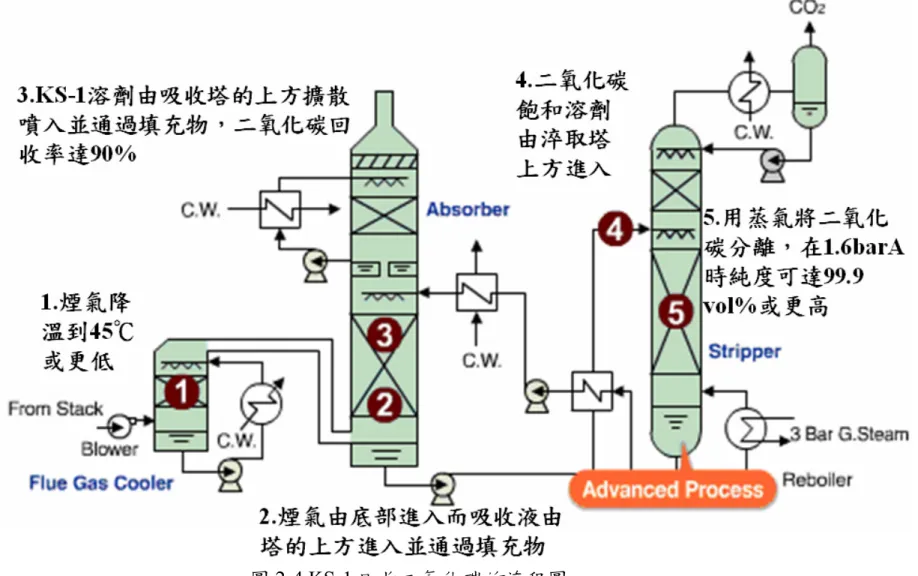
(35) 壓力提高至2.3MPa,且在同溫度下採用降壓的方法來再生吸收劑,其結 果是增加反應速率及吸收容量,但吸收速率仍慢,而且由於溫度的提升 會造成嚴重的腐蝕,故加入活性劑來提高吸收與再生速率並減輕腐蝕, 因而稱為活化熱碳酸鉀法。常用的活性劑有無機活性劑(砷酸鹽、硼酸 鹽和磷酸鹽)和有機活性劑(有機胺和醛、酮類有機物) 如(7)式。 K2CO3 + H2O + CO2 U 2KHCO3. (7). (2). 醇胺吸收法. 一般常用之醇胺類(alkanolamies)有一級醇胺(如MEA)、二級醇胺(如 DEA、DIPA)及三級醇胺(如MDEA、TEA)。一級醇胺和二級醇胺具有 強的鹼性,故其與二氧化碳反應具有較快的速率,但由於反應形成的產 物為carbamate,使得其吸收容量限制於0.5mol-CO2/mol-醇胺,由下列反 應式(8)可看出。 CO2+2RR`NH U RR`NCOO-+RR`NH2+. (8). 三級醇胺因鹼性較弱而降低與二氧化碳反應的速率,然而其吸收容 量卻能達到1.0mol-CO2/mol-醇胺,因此雖然其吸收速度較慢,但是可以 透過添加“加速劑”--DEA或是piperazine等,使之具有吸收速度快且較不 易被腐蝕的優點。近來,立體障礙醇胺(如AMP)被使用來代替傳統醇胺 作為吸收劑,因其具有較快之吸收速率且能如三級醇胺具有. 25.
(36) 1.0mol-CO2/mol-醇胺的高吸收容量。另外,混合醇胺也是目前研究方 向之一,因混合醇胺是溶液中混有兩種以上之醇胺溶液,綜合各級醇胺 的優點,故具有快吸收速率與高吸收容量之特性,常使用之混合醇胺有 MEA-MDEA 、 MEA-TEA 、 DEA-MDEA 、 DEA-TEA 、 DEA-AMP 、 MEA-AMP及DEA-TEA-AMP等[39]。Mitsubishi Heavy Industries及 Kansai Electric Power Company 使用代號為KS-1之溶劑取代MEA,據稱 可使用較低之吸收液流速、降低再生溫度及降低其與CO2之反應熱,此 外即使存在氧時,在130℃時仍不具腐蝕性,因之現有不少回收CO2工 廠已使用KS-1為吸收溶劑,圖2-4即為KS-1回收二氧化碳的流程圖。. 2.1.3 薄膜分離法 使廢氣通過polyamide resin及cellulose acetate等薄膜,選擇性將二氧化 碳與其他氣體分離,此法需在高壓條件下進行,壓力大約為17~35 atm, 其主要優點為省能、不會造成環境污染、操作簡易、屬於清潔生產技術、 設計上較具彈性、沒有Moving Parts因而易保養等,但其缺點為薄膜耐久 性差,且分離效率低,因此需要使用二段以上之薄膜分離程序,才能達到 一定的分離效率,故較少應用於實廠內,高效能的薄膜與便宜的模組仍然 是最大的問題所在。另外,可利用浸潤的微孔薄膜或其他多孔材料為支撐 體,經浸泡使孔洞充滿可以吸收二氧化碳的液體(如MEA或DEA),此方式. 26.
(37) 若能改善其回收效率,未來應該會有不錯的應用前景。圖2-5為薄膜分離 機制示意圖,薄膜可分為多孔性薄膜與緻密性薄膜兩種,多孔性薄膜的穿 透機制可分成三種,如圖2-5中的a、b、c所示: a. 孔徑遠大於溶質與溶劑分子時,不論溶質或溶劑皆可穿透薄膜。 b. 孔徑略大於溶質與溶劑分子時,則以吸附與擴散方式通過薄膜。 c. 孔徑介於溶質與溶劑分子之間時,以分子篩為主。 緻密性薄膜的分離機制則以溶解擴散( Solution – Diffusion )為主,如 圖2-5中d所示,其分為三個步驟: 1. 分子在薄膜表面產生吸附並溶解到薄膜內。 2. 分子在薄膜內部進行擴散。 3. 分子由另一端脫附而離開薄膜[40] 。 將薄膜分離常用的方法簡述如下:. 27.
(38) 圖 2-4 KS-1 回收二氧化碳的流程圖 資料來源:三菱重工業株式會社網頁[41] 28.
(39) 1.高溫薄膜分離法. 此法能在高溫環境下(370°C)回收二氧化碳。另外也能在天然氣中從二 氧化碳分離出氫氣,並能從甲烷氣中分離二氧化碳缺點是對高分子材料而 言,氣體透過率及分離度往往互相衝突,即分離度大者透過率低反之亦然。 2.高分子薄膜. 在室溫下操作時,此法能得到CO2對N2之高選擇率(表2-4);但當溫 度升高時,選擇率即會下降,此外薄膜的穩定性也會大幅下降,使得其較 難應用於排放氣中CO2之回收,圖2-6為一利用高分子薄膜以分離CO2與N2 之範例製程。 3.無機膜. 無機膜主要分為金屬膜與陶瓷膜。一般而言,金屬膜主要為不銹鋼、 鈀及鈀合金、鎳或鋯等金屬材質所製成的緻密性薄膜,其在工業上幾乎僅 應用於氫及氧等氣體之穿透,且穿透速率甚低,因而不太適用於自排放氣 中回收CO2。至於陶瓷膜大多是由氧化鋁、氧化矽、氧化鋯、二氧化鈦、 碳化矽、沸石等所製成之多孔性薄膜。陶瓷膜中的沸石薄膜( Zeolite Membrane )近年來在分離上的應用上越來越多,例如同分異構物的分離、 自燃燒氣體中回收二氧化碳、醇水溶液的分離等。 29.
(40) 圖2-5 薄膜分離機制示意圖 資料來源:以薄膜回收二氧化碳之技術手冊[40]. 表2-4 不同高分子薄膜材質在CO2/N2系統中之選擇率 薄膜材質. 温度, ℃. 選擇率. 21 – 70. 19 – 35. 25. 69 – 84. 50. 38 – 46. 25. 63. Cellulose Acetate. 25. 50. Polyimide. 25. 25. Polycarbonate. 25. 40. 25. 9.4. 25. 12. 25. 11.5. Polyetherimide Poly(ethylene oxide) Poly(ethylene oxide-co-epichlorohydrin). Poly(3-dodecylthiophene) (PDDT) Hydrazine PDDT Diethoxydimethlysilane on ester of cellulose. 資料來源:以薄膜回收二氧化碳之技術手冊[40]. 30.
(41) CO2 LIOUID @260 PSIA, -14℉, 80%. NH3 -30℉. COMPRESSOR 3. C.W. 85℉. MEMBRANE STAGE 2. RECOVERY. BOILER EXHAUST. C.W . 85℉ -100℉. COMPRESSOR 1. C.W . 85℉. MEMBRANE STAGE 1. COMPRESSOR 2. C.W . 85℉. -60℉ GAS TO COMP.3 MEMBRANE STAGE 3. N2 @15 PSIA, -315℉. COLD BOX. NH3 -30℉. COMPRESSOR 7. C.W . 85℉ C.W . COMPRESSOR 4 85℉. 85% RECOVERY COMPRESSOR 6. 圖 2-6 高分子膜回收二氧化碳製程 資料來源:以薄膜回收二氧化碳之技術手冊[40] 31. VENT O2, CO2 &N2.
(42) 4.液膜 液膜之發展最早見於1967年,Ward 與 Robb 利用多孔性醋酸纖維膜 發展之固定式液膜(Immobilized liquid membrane, ILM)研究。後來1974年 Schultz與Goddard與1977年Smith et al.將此稱為支撐式液膜,由於支撐式液 膜最大之問題是液膜的穩定性,因為在進行操作時,液膜溶液容易因揮發 而流失,為了克服前述問題,即發展含浸液體式之中空纖維薄膜(Hollow fiber contained liquid membrane,FCLM),將萃取劑含浸於兩水溶液之間的 薄膜中,目前該技術尚在實驗室階段[39] 。. 2.1.4 富氧燃燒法. 讓化石燃料使用純氧燃燒,使廢氣中的CO2濃度提高100%附近再進行 回收。廢氣(CO2)的一部分回收,殘餘和燃燒用的純氧混合濃度調整利用。 因為使用純氧燃燒有一定的困難因此將廢氣中的CO2再循環,混合從空氣 中分離出來的純氧,根據適當的O2/CO2混合比例和化石燃料進行燃燒。這 個方法,能提高廢氣中的CO2濃度在95%以上,再利用低溫冷凝法回收CO2 進行利用。美國有國立研究中心進行煤燃燒的測試(煤400kg/h),並探討燃 燒爐內的溫度分佈,傳熱狀態等,目前可以得到CO2濃度在94~95%之間 的廢氣[39] 。. 2.1.5 低溫冷凝法(低溫蒸餾法) 32.
(43) 此法主要利用兩階段壓縮冷凝方式(低溫-60℃、高壓40atm)將二氧 化碳液化或固化成乾冰,然後以蒸餾方法將液態或固態二氧化碳中之不純 物分離出來,使二氧化碳純化,其中之不純物包括SOx及NOx等,純化後 之二氧化碳可經過物理處理於深海或是再利用。此法針對CO2濃度高的煙 道排氣,因此可望在燃燒前捕集及氧氣燃料燃燒的程序中使用,而目前則 是廣泛應用於高濃度CO2(>90%)的純化,此法優點在於捕集後的CO2就是 固態或液態的了,便於接下來的運送,缺點是降溫以凝固CO2的能量消耗 非常驚人。該裝置構成複雜、設備費高且因為氣體的回收需降溫及降壓需 要消費能量,因此該法被普遍認為不合適處理較低濃度的CO2等,在CO2 濃度比較低的燃燒尾氣的回收比較難適用[39] 。. 關於本節所介紹的CO2分離和回收技術的原理、特性、經濟評估及相 關課題等都歸結在表2-5裡。. 33.
(44) 表 2-5 CO2 分離和回收技術總結(1/2) 化學吸收法 醇胺法. 熱碳酸鉀法. 化學吸附法 半乾式 Ca(OH)2. 原理. 利用胺系吸收液的化 學反應分離 CO2。. 利用碳酸鉀吸收液的 化學反應分離 CO2。. 利用氫氧化鈣吸收液的 化學反應分離 CO2。. 材料. arukanoruamin 等. 碳酸鉀溶液. 氫氧化鈣溶液. 優 點. 常壓下操作,適合 CO2 濃度低的煤氣。 大規模化比較容易。. 比胺法的熱效率高。 沒有硫氧化合物使吸 收液退化的問題。. 氫氧化鈣由碳酸鈣產生 台灣蘊藏量豐富。 可操作溫度較高>100℃. 缺 點. 在吸收液的再生上需 要使用較大能源。 廢氣中的雜質易使吸 收液惡化。. 如果用於廢氣需要加 壓,增加能源的耗用。 吸收液的反應性很 低,腐蝕性高。. 和廢氣中 SOx 產生 CaSO4 不易再生. 0.41~1.1 kWh (el.)/kgCO2*. 2.3 NT/ kg of CO2 (不再 生) 0.63 kWh (el.)/kgCO2. 使用吸附劑吸附 CO2,在 利用減壓、加熱再生吸附 劑。 沸石,活性炭等 需要的能源比化學吸收法小。 裝置簡單,適合中小規模 機械設備。 硫氧化物不會使吸收液退 中小規模比化學吸收法在 化,腐蝕性低。 成本上有利。 在吸附劑的再生上需使用 較大的能源。 如果用於廢氣需要加壓,增加 NOx 和 SOx 需要的事前 能源的耗用。 消除。 吸收液的汽化損失大。 電子管的轉換頻繁,表面 容易產生耐久性的問題。 3 4.5402 NT/Nm -CO2(適用 發電成本增加 1.3 倍 於煉鐵廠熱風爐的廢氣 ) 3 (煤炭氣化複合發電廠適用) 4.6795 NT/Nm -CO (適用 2 0.09 kWh/kgCO2* 於燃燒的廢氣). 因需加壓下才適合吸 收,對於一般廢氣使用 較困難。. 單獨使用氫氧化鈣溶液 吸收效率不高,需混合 其他鹹液增加效率。. 因需加壓下才適合吸收,對於 因為沒有大規模化的實際 成績,為了大規模化需要 一般廢氣使用較困難。 開發新技術。. 已有商業化產品應用 於油氣開採上。. 目前有許多用於除酸系 統中. 特 性. 經濟評 估 相關課 題 其他. 約 1.3927 NT/kWh (電力包括液化 ) 0.53~0.78 kWh (el.)/kgCO2 * 再生吸收液的能源降 低。 廢氣中的雜質對吸收 液惡化的改善對策。 在美國有使用的例子 用在天然瓦斯燃燒的 廢氣。. 物理吸收法 對甲醇等吸收液用物理方法 吸收,使用減壓、加熱回收 CO2。 甲醇,聚乙烯二醇系溶液等. 適用於需加壓煤氣的煤炭氣 化複合發電廠有使用前途。. 資料來源:有關全球變暖對策技術開發的調查/CO2 分離回收技術的調查研究[42] *The Energetics of Carbon Dioxide Capture in Power Plants[43] 34. 物理吸附法. 在日本的煉鐵廠對熱風爐 瓦斯和轉爐瓦斯有使用的 例子。.
(45) 表 2-5 CO2 分離和回收技術總結(2/2) 高分子膜 原理. 材料. 薄膜分離法 液膜. 利用對高分子膜的氣體的 根據膜的選擇性來 CO2, 透過速度的差異分離 CO2。 保存並輸送 以分離 CO2。 聚醯亞胺膜,醋酸纖維素 膜,porisuruhon 膜等. 醋酸纖維素膜+重 碳酸銫鹽等. 無機膜. 富氧燃燒法. 利用在多孔質的無 讓礦物燃料用氧燃 利用 LNG 冷熱冷卻廢 機膜的分子流,表 燒,使廢氣中的 C 氣,讓 CO 昇華作為 2 面擴散流等分離 O2 濃度提高 100%到 乾冰回收。 CO2。 附近回收。 多孔質玻璃,氧化 鋁多孔體. -. 因為回收尾氣中的 裝置簡單,適合小規模機械 比高分子膜有較高 優 設備。 耐熱性佳,適合在 不純物沒有關係的 的 CO 2 選擇分離效 點 因為不伴隨相位改變能源 高溫的 CO2 分離。 CO2,適合煤炭燃 果。 燒。 消耗少。 特 大容量化容易。 性 由於乾燥使的功能 膜的成本非常高。 下降等等穩定性有 為了製造氧使用深 缺 用於一般廢氣需要事前消 問題。 冷分離法等等,需要 點 除固體粒子和液體成分。 CO2 的透過速度 很大的能量。 CO2 回收率低。 比高分子膜劣。 經濟 評估. 相關 課題. 其他. 0.9214 NT/kgCO2 (1.6194 NT/kgCO2 包括液 化;適用於 100MW 級煤炭 火力電廠). -. 昇華法. 發電成本增加 1.8 倍 (適用於粉煤煤炭火 力發電). -. 35. 壓縮液化包含 CO2 的煤氣,利 用凝結溫度的差 異使用蒸餾分離 CO2。. -. -. 低成本且清潔的。. 適合大量和高純 度的瓦斯的製 造。. LNG 儲藏設施和機械 設備需要將近一(以 上)平方公里的面積。. 設備費用高, 對低濃度的 CO2 廢氣不適用。. -. -. 透過分離機構的闡 明。 氧製造裝置的動力 防止乾冰對傳熱管的 膜的分離能力,可靠性,耐 CO /N 透過係數 削減,所要空間的討 粘著,除濕裝置的性能 2 2 久性的提高等。 比的提高(高溫), 論等。 提高等。 耐久性的確認。 在南非的粉煤煤炭 在天然氣或瓦斯的純化使 現在還在基礎的研 用於高溫廢氣有充 分的研究,但 火力發電廠有整套 現在處於重要技術的 用、裝填瓦斯有使用的例 究階段。 CO /N 透過係數 設備實際的運作成 開發階段。 2 2 子 。 比未充分討論。 績。 CO2 透過速度及 CO2/N2 透過係數 比的提高。 穩定性的提高。. 低溫冷凝法. 對於 CO2 分離回 收的適用較難, 不過對於回收後 的精製較有效。.
(46) 2.2 金屬氧化物吸附原理 藉由氣相CO2和固體金屬氧化物(MO)反應產生MCO3 (碳酸化),當MO 達轉化能力的極限,可藉由加熱再生排出CO2,還原生成MO (鍛燒再生), 如(9)和(10)式所示。 MO+CO2→MCO3. (9). MCO3→MO+CO2. (10). MO的選擇必須根據MO碳酸化(carbonation)/鍛燒(calcination)的溫度 範圍來選擇,MCO3的鍛燒溫度若>1000℃的金屬氧化物則不適合因為耗 能。MO之鍛燒溫度如下所示: 1. CaCO3:~750℃ 2. MgCO3:~385℃ 3. ZnCO3:~340℃ 4. PbCO3:~350℃ 5. CuCO3:225~290℃ 6. MnCO3:~440℃ 7. 溫度範圍:200~800℃. 因為碳酸化的溫度低於鍛燒溫度,因此這些MO可於煙道氣條件下進. 36.
(47) 行碳酸化反應(捕集CO2)。Gupta and Fan[44]以ZnO、MgO、CuO、MnO2、 NiO、PbO及CaO等MO進行CO2分離實驗,發現除了CaO外,其餘MO的重 量增加率皆低於0.2%,所以在上列的金屬氧化物中CaO是較佳的吸附劑。 由圖2-7中可以發現在溫度為225℃時碳酸化的速率急速增加(重量快速增 加),當溫度約在600℃時,碳酸化的速率變慢(由於CaCO3層的阻礙),當 溫度達900℃,開始進行逆反應由CaCO3鍛燒生成CaO。圖2-8為石灰石在 100次吸脫附前後用掃描式電子顯微鏡拍攝的照片。使用金屬氧化物吸附 劑的優點如下: 1.煙氣條件下即完成 CO2 分離 一 般 石 化 燃 料 的 燃 燒 源 溫 度 約 在800~120℃ , 壓 力 是 低 於 大 氣 壓 (subatmosphere),一般火力發電廠煙道氣中CO2濃度約5~30%[37],在低 溫高壓的情形下sorbent的吸附越佳,但以現有的煙氣狀況要達到此種條件 需要耗費大量的成本,而使用MO系統即可在既有的煙氣條件下獲得很好 的捕集率。經由冷卻、壓縮、液化可得到很純的CO2。 2.MO 通常具備高吸附容量(g CO2/ kg sorbent) (1) MEA:343 g of CO2/kg (2) silica gel:13.2 g of CO2/kg (3) activated carbon:110 g of CO2/kg 37.
(48) (4) CaO-based :393 g of CO2/kg (假設 50%CaO 重複循環使用) 劑量需求少、反應器小、低壓降等優點。 3.經處理後的煙道器殘餘的 CO2 很少。 4.再生過程可產生非常純的 CO2。[45]. 38.
(49) 圖 2-7 氧化鈣在 TGA 中進行碳酸化反應 資料來源:Gupta et al. (2002)[44]. 39.
(50) (a) 新鮮的石灰石鍛燒後表面的照片.. (b)和 a 一樣的石灰石經過 100 次碳酸化/鍛燒後的表面 的照片(Scale bar 為 2μm.) 圖 2-8 石灰石 100 次吸脫附前後表面結構比較 資料來源:Alvarez et al. (2005)[46]. 40.
(51) 2.3 CaO 捕獲二氧化碳文獻回顧 由前面1.1節可以知道二氧化碳主要是由化石燃料的燃燒所產生,而燃 燒過程將產生高溫,因此高溫的CO2吸收劑應具有以下幾個特性:綜合以 下述4點,氧化鈣吸收劑具有所有的優點。 1.. 在 6 0 0 ~ 700℃範圍內,具有較高的反應速率. 2.. 化學穩定性高, 即多次反覆利用後仍具有較高的吸收活性. 3.. 具有較高的機械穩定性,即耐磨損性. 4.. 可以大規模生產且價格廉價、容易取得 碳酸化/鍛燒(CaCO3/ CaO)循環過程這概念最早是1867年提出,在1931. 年Gluud等[45]就採用CaO吸收水煤氣反應產生的CO2,促進CO轉化和 CO2分離,製備高純氫氣。1966年Curran等[45]提出用鈣基吸收劑脫除 煤炭氣化的過程中所產生的CO2,但當時CO2釋放入大氣當中並不是一個 重要的議題,也應此沒有在進一步的研究;1976年時Squires於煤炭氣化所 產生的混合氣體中(gasification of carbon)加入石灰處理CO2,同樣也未受到 大家的注意。一直到了1994年Han等[45]提出了利用碳酸化/鍛燒的可逆 反應,作為製氫過程中高溫分離CO2的方法,這種思考才重新引起大家的 注意。Shimizu等[45]採用雙流化床反應器對燃燒過程中脫除煙氣中的 CO2進行了研究,Abanades等[15]分析了CO2與石灰反應時的轉化極限,. 41.
(52) 提出了吸收劑最大吸收能力只與循環次數有關的半經驗模型。在此同時, 加拿大的CANMENT能源技術中心和日本的CCUJ都相繼展開了這方面的 研究工作[45]。 Abanades和其研究夥伴先後進行了許多以石灰石經鍛燒後作為CO2吸 附 劑 的 相 關 研 究 , 2002 年 Abanades 單 獨 發 表 “The maximum capture efficiency of CO2 using a carbonation/calcination cycle of CaO/CaCO3”[47] 後,一直到2006年和Grasa一起發表 “CO2 Capture Capacity of CaO in Long Series of Carbonation/Calcination Cycles”[15]該研究將Abanades歷年來的 研究資料都納入其中,並進行了一系列CaO轉化率的研究,也推導出一些 公式,分別為(11)~(13)式[47] [48] [15],(13)為Abanades 2006年在Ind. Eng. Chem. Res.期刊上所發表,用於推導XN時較為可靠,公式(13)相關參 數如表2-6所示[15]。. x c,N =f N+1 +b. (11). X N =f m N (1-f W )+f W. (12). XN =. 1 1 +kN 1-X r. +X r. (13). 圖2-9為Grasa et al.(2006)進行氧化鈣吸附二氧化碳循環500次的結 果,圖2-10實驗條件和圖2-9一樣只是以不同結果作圖表示,由圖2-10中可 42.
(53) 知道CaO初期轉化率衰退很快,但到了中期幾乎都可以維持0.1以上的轉化 率,前面10次循環甚至維持在0.3以上[15]。. 表 2-6 公式(13)相關參數. 參考資料:Grasa et al.(2006)[15]. 43.
(54) 圖 2-9 以粒徑 0.4-0.6 mm 的氧化鈣通入二氧化碳在 850℃下脫附 5 分鐘和 650℃下吸附 5 分鐘循環 500 次,時間和重量的變化圖 參考資料:Grasa et al.(2006)[15]. 圖 2-10 實驗條件同圖 2-9,CaO 的轉化率和循環次數圖 參考資料:Grasa et al.(2006)[15]. 44.
(55) 2.4 CaO 的改質 天然CaO的主要缺點是當它從石灰石或白雲石(dolomite)鍛燒成CaO 時,其孔徑大小是呈現微孔洞(microporous, < 2 nm)的狀態,在它和CO2反 應的過程中會生成一層很薄的CaCO3(~100 nm)[49],容易因填滿產生孔 洞堵塞,進一步限制了CaO的轉化反應(減少約CaO化學計量的45~50%), 循環越多次,吸附能力(容量)遞減越快,因此有學者開始討論CaO的改質, 增加CaO的吸附容量,CaO和CaCO3的莫爾體積比較如下: CaO:17 cm3/mol CaCO3:37 cm3/mol CaO的缺點還有鍛燒再生CaO的過程會排放CO2,CaO使用量、鍛燒耗 能與吸附劑回收比例之間的矛盾,若CaO用於高溫吸附則耗能的問題將容 易解決,再生過程產生的CO2配合水蒸氣的萃取跟低溫冷凝也可將問題解 決。. 2.4.1 濕式沉降處理程序 由Gupta et al. (2002)提出一種濕式沉降處理程序(wet precipitation process)製備沉積碳酸鈣(Precipitated Calcium Carbonate, PCC): 1.PCC 製備: 45.
(56) (1). 500 mL H2O 加 0.0575g N40V 加 12.8 g Ca(OH)2 配 成 2.56% 的 Ca(OH)2此時pH=12,Ca(OH)2濃度是飽和濃度的16倍=>Ca(OH)2懸浮 液。加入N40V的目的是產生表面零電位,以利生成CaCO3。 (2). 通入CO2 持續監測pH,通入CO2 是為了產生CO32- ,能與Ca2+ 生成 CaCO3 , 圖 2-11 為 PCC 製 備 配 置 圖 , 圖 2-12 為 不 同 濃 度 倍 數 的 Ca(OH)2(相對於飽和濃度)pH值和反應時間的關係圖。 2. PCC 性質: 合成的沉積碳酸鈣,高表面積(BET 60 m2/g),PCC的主要孔洞結構是 中孔(5~20nm),使得由PCC製得的CaO,較不受孔隙堵塞影響,CO2轉化 率可高達90%以上,即使是在超過2次的碳酸化與鍛燒反應的反覆循環, 仍可維持原有的高轉化率(>90%)[44] 。. 46.
(57) 圖2-11 PCC製備配置圖 資料來源:Gupta et al. (2002)[44]. 圖2-12 不同濃度倍數的Ca(OH)2(相對於飽和濃度)pH值和反應時間的關係 圖 資料來源:Gupta et al. (2002)[44] 47.
(58) 2.4.2 添加鹽類 Salvador et al. (2003)嘗試添加鹽類(如NaCl、Na2CO3)於石灰石中進行 改質,結果如下: 1.在流體化床的測試: 添加NaCl、Na2CO3於石灰石中,CO2的捕集容量逐次大幅下降,以添 加0.5% NaCl為例,發現在第一次循還是40%,第三次已降至只剩5%。其 原因可能是添加物在鍛燒過程生成覆蓋表面的物質,阻礙了CO2吸收。但 這情況在TGA test卻沒有出現。 2.在 TGA 的測試: 添加Na2CO3沒有影響其吸收容量,但添加NaCl卻造成初始吸收容量下 降,只剩下50%,但後來的下降就非常少了,循環13次只有些微衰退。計 算13次循環後結果添加NaCl吸收CO2容量最高,因此由TGA數據可知添加 NaCl能用來促進CO2捕集,添加NaCl改變了吸附劑的孔洞大小結構。 於FBC系統,若以純100% CO2將氧化鈣進行碳酸化,將有助於明顯改 善氧化鈣對CO2的捕集容量。不過這種情形在其他系統並沒發現[50] 。 2.4.3 添加鹼金屬. 48.
(59) Reddy and Smirniotis (2004)提出使用鹼金屬(alkali metals) 添加在 CaO上能有效提升CO2的捕集。 1.製備方法: 使用初濕含浸法,取1公克的CaO到80 cm3 鹼金屬前驅物的水溶液, 加熱攪拌直到水分完全去除,125℃乾燥一夜,在充滿氦氣的環境下,加 熱到750℃鍛燒5個小時。 2.結果如下: (1). 添加金屬於CaO造成吸附強弱的順序為Li < Na < K < Rb < Cs,Cs是 最具正電性的鹼金屬。 (2). Cs/CaO展現最佳的能力且對於N2及O2零親和力,高CO2吸附量,廣 泛的吸收脫附溫度範圍,可高達700℃。 (3). 經XPS證明CO2主要吸附在Cs2O上而非CaO,表面原子的比例隨吸附 量增加而遞增(~20%),但更高吸附量並無法增加吸附,這是由於在 CaO表面生成paracrystalline Cs2O。 (4). 添加CsOH和Cs2CO3於CaO較添加CsCl更佳,這是由於在CaO表面生 成高分散性的Cs2O[51] 。 2.4.4 前驅物製備CaO. 49.
(60) Lu et al. (2006)使用不同的前驅物製備各種CaO,前驅物有 CaO、 Ca(NO3)2• H2O、Ca(OH)2、CaCO3和Ca(CH3COO)2• H2O,Ca(CH3COO)2• H2O在圖表中以CaAc2•H2O表示,每一種前驅物以加熱速率(10℃/min)從 50℃加熱至750℃,並於750℃維持30分鐘使其完全鍛燒為CaO (在氦氣的 環境下) [52] 。結果如圖2-13所示這五種前驅物所生成的CaO晶體結構大 致一樣,圖2-14為Gupta et al. (2002)將6種不同物質鍛燒成CaO所作的XRD 分析,和圖2-13的CaO晶體結構也是一樣的。 表2-7為Lu et al. (2006)實驗中五種前驅物所生成的CaO的比表面積和 孔隙的體積,表2-8為Gupta et al. (2002)實驗中8種不同物質的比表面積和 孔隙的體積,這8種物質為LC(Linwood CaCO3)、LC-CaO、dolomite(白雲 石)、FCD-CaO(完全鍛燒的白雲石,fully calcined dolomite)、LH(Linwood Ca(OH)2)、LH-CaO、PCC和PCC-CaO,表2-7和表2-8中PCC的比表面積最 大,CaAc2•H2O-CaO的孔隙體積最大,由此可以判斷CaAc2•H2O-CaO的孔 徑較PCC大,由圖2-15可以確定CaAc2•H2O-CaO的孔徑分布在大孔洞居多。 圖2-16為CaAc2•H2O-CaO在700℃下反覆進行等溫吸脫附,氣體濃度為 (a) 30 vol %CO2混氦氣循環27次和(b) 10 vol % H2O + 30 vol % CO2混氦氣 循環17次。不加水經過 27循環轉換率仍有62%,而加水只有在循環17次 以內維持62%的轉換率,因此CaAc2•H2O-CaO添加水會降低他的吸附能力。. 50.
(61) 圖2-13 Lu et al. (2006)實驗中五種前驅物CaO的XRD分析 資料來源:Lu et al. (2006)[52]. 圖2-14 Gupta et al. (2002)實驗中六種不同來源CaO的XRD分析 資料來源:Gupta et al. (2002)[44] 51.
(62) 表2-7 Lu et al. (2006)實驗中五種前驅物所生成CaO的比表面積和孔隙體積. 資料來源:Lu et al. (2006)[52]. 表2-8 Gupta et al. (2002)實驗中8種不同物質的比表面積和孔隙體積. 資料來源:Gupta et al. (2002)[44]. 52.
(63) 圖2-15 Lu et al. (2006)實驗中五種前驅物所生成CaO的孔徑分佈 資料來源:Lu et al. (2006)[52]. 圖2-16 CaAc2-CaO反覆吸脫附(等溫吸脫附700℃,氣體濃度(a) 30 vol %CO2, balance氦氣,27次(b) 10 vol % H2O + 30 vol % CO2, balance氦氣,17次) 資料來源:Lu et al. (2006)[52] 53.
(64) 三、研究方法 3.1 實驗材料 本研究之實驗流程如圖 3-1 所示,使用 3 種不同來源的石灰石(CaCO3), 依序分別以 A、B 和 C 為業者的代號,將購買之石灰石搗碎並研磨成 2mm 以下的細顆粒,再以篩網(詠欣公司)篩選 200 mesh (相當於<74μm 之顆粒) 的石灰石試料,每次實驗取用 15~20 mg 的石灰石。 熱重分析儀(Thermal Gravimetric Analysis, TGA)所使用的氣體為健仁氣 體公司的氮氣鋼瓶(99.9%)和二氧化碳、氮氣混合鋼瓶(二氧化碳濃度分別為 10%、20%、30%、40、50%)所提供之氣體。. 3.2 實驗設備 此實驗系統主要是以 TGA 進行分析,其元件包括電子天平與天平控制 器、反應器和氣體進料系統將於以下說明。電子天平、天平控制器與反應 器三者皆包含在 TGA 內其關係如圖 3-2 所示。 熱重分析儀規格: 1. 型號:TG 209 F1 Iris® - Technical Specifications (subject to change) 2. 操作溫度範圍: (10) 20℃~1000℃ 3. 加熱和冷卻速率: 0.001 K/min~100 K/min (temperature-dependent). 54.
(65) 開始. 關閉 CO2. 試料取樣. 粒徑(200mesh)、組成. 置入試料. 試料(含載體)秤重,w1(15~20mg). 補充試料. 試料(含載體)秤重,w5. 升溫. 試料取樣. 降溫. 鍛燒後試料(含載體)秤重,w2,w6. 溫度:650℃(維持 15min 穩定). 試料取樣. 試料(含載體)秤重,w3,w7(參考用,目的為 了解此降溫未反應過程重量改變). 通入 H2Og. 依實驗規劃打開或關閉蒸氣入口閥,通入微量 H2Og. 通入 CO2. TGA 測量試樣. 是. 通入氮氣:40 ml/min 升溫速度: 15 ℃/分鐘(約需 1hr) 溫度:950℃(維持 15min 穩定). 氣體流速:40 ml/min. 試料(含載體)秤重,w4,w8. 循環 否 結束. 圖3-1 實驗流程 55.
(66) 圖3-2 TGA的電子天平、天平控制器與反應器. 56.
數據
![圖 2-7 氧化鈣在 TGA 中進行碳酸化反應 資料來源:Gupta et al. (2002)[44]](https://thumb-ap.123doks.com/thumbv2/9libinfo/8102242.165233/49.892.148.779.283.839/圖27氧化鈣在TGA中進行碳酸化反應資料來源Guptaetal2244.webp)
+6
相關文件
酸性氣體(二氧化硫、二氧化氮)可以飄浮到離源頭很遠的地
• 進口商依據美國生產者為符 合國內環境標準的成本及財 政部決定的溫室氣體量,支 付碳費.
二、高壓氣體用途甚廣,各事業單位大多使用以作為生產製程之消耗性原、物
①尼古丁 ②焦油 ③一氧化碳
有人說「血液中之二氧化碳含量應該維持一定」 ,你認為這樣
[r]
聯合國(UN)氣候小組 9 日發佈指標性報告,表示全球暖化瀕臨失控邊緣,就算 各國極力減少碳排放,20 年內地球溫度仍將提高
聯合國(UN)氣候小組 9 日發佈指標性報告,表示全球暖化瀕臨失控邊緣,就算 各國極力減少碳排放,20 年內地球溫度仍將提高