國立台灣大學生命科學院分子與細胞生物學研究所 碩士論文
Institute of Molecular and Cellular Biology College of Life Science
National Taiwan University Master Thesis
三種蝴蝶蘭屬植物核糖體 RNA 基因的實質定位 Physical mapping of ribosomal RNA genes
in three Phalaenopsis species
研究生:曾治中 Chih-Chung Tseng 指導教授:高燕玉 Yen-Yu Kao
中華民國 98 年 7 月
July, 2009
誌謝
三年,回想起來 真是段漫長的歲月。這一路走來,縱然坎坷,充 滿挫折,但因為身邊許多人的陪伴、支持與鼓勵,終究還是成功地到 達終點。
首先要感謝的是我的指導教授 高燕玉老師三年來細心的教導,給 予我諸多研究上的啟發。嚴謹的教學與生活上的經驗分享,總能讓我 有所成長。而論文的修改,亦由老師辛苦細心的多次修正,才完成初 稿,並承蒙鍾美珠老師、吳文鑾老師辛苦撥空前來參與我的口試,提 供許多寶貴的建議,使論文更臻完善,特此致謝。
再者是益豪學長、玟珉學姐、欣羚學姐及三年研究生涯裡一起打 拼的實驗室夥伴凌巧學姊、怡璇、劉蓉和智全,藉由彼此的幫忙及打 氣,也讓實驗室苦悶的生活多了點樂趣。
最要感謝的,莫過於爸媽、姐夫、姐姐及小弟,總在背後默默的 支持我,關心我,並適時的提供必要的幫忙,還忍受一向非常沒耐性 的我偶而脾氣爆發。還有可愛小外甥淵明,總能讓我重拾那早已不復 見的純真,並得到心裡真正的平靜,亦為這段日子添增不少歡樂的色 彩。
最後是好麻吉建志、峻賢和鈺晃,雖然你們在研究上好像沒幫到 什麼忙,但在人生旅途中,卻是很棒的朋友。另外是學妹惠芳,總在 需要時提供協助。
要感謝的人很多,也因為這麼多人的幫忙與鼓勵,才讓我在這一 階段更順利的完成,因此,僅以此論文獻給所有幫助我及關心我的 人!
治中 2009. 08
中文摘要
屬於 Amboinenses 節之三種蝴蝶蘭原生種 P. fasciata、P. mariae 和 P. pallens 皆具 38 條染色體 (2n = 2x = 38),且均為中型及小型染色 體。利用雙標的螢光原位雜交將 rDNA 實質定位的結果,三種蝴蝶蘭 皆具一對 5S 及 45S rDNA 基因座,且均位於小型染色體的末端。而 屬於同節的 P. lueddemanniana、P. bastianii 及 P. pulchra 在染色體形 態、DNA 含量以及 rDNA 基因座的數目皆與此三種蝴蝶蘭相似,顯 示 此 六 物 種 的 親 緣 關 係 較 接 近 ; 然 而 亦 屬 Amboinenses 節 之 P.
amboinensis、P. venosa 和 P. violacea 則染色體較大,DNA 含量亦較
高,且具 1~2 對 5S rDNA 基因座和 4~7 對 45S rDNA 基因座,與前六 種蝴蝶蘭有顯著差異,故可將此九種蝴蝶蘭分為兩群,此與過去利用 5S rDNA 的 IGS 序列以及 45S rDNA 的 ITS 序列所建立之親緣關係樹 的結果相吻合。rDNA 的實質定位提供蝴蝶蘭屬植物親緣關係探討的 另一種證據。Abstract
Phalaenopsis fasciata, P. mariae and P. pallens classified to section
Amboinenses had 38 chromosomes (2n = 2x = 38). Their chromosomes
were small and medium in size. Physical mapping of rDNA using double- target fluorescence in situ hybridization (FISH) showed that all of these three species possessed one pair of 5S rDNA loci and one pair of 45S rDNA loci, and all of rDNA loci were located in the terminal site of small chromosomes. These results were similar to those of P. lueddemanniana,P. bastianii and P. pulchra. In addition, karyotype and DNA content
among these six species were also much the same. It seemed that they were closely related. However, P. amboinensis, P. venosa and P. violacea also belonging to the same section had larger chromosomes and higher DNA content. They contained 1-2 pair of 5S rDNA loci and 4-7 pair of 45S rDNA loci. Therefore, these nine species could be divided into two groups. It was consistent with the previously constructed phylogenetic trees established by intergenic spacer (IGS) region of 5S rDNA and internal transcribed spacer (ITS) region of 45S rDNA. Physical mapping of rDNA provide another evidence for investigating phylogenetic relationships of Phalaenopsis species.目錄
中文摘要...i
英文摘要...ii
圖目錄...iv
表目錄...v
壹、前言...1
貳、材料與方法...9
一、植物材料...9
二、根尖染色體觀察...9
三、抽取含 rDNA 選殖體之質體 DNA ...12
四、rDNA 探針的製備...12
五、螢光原位雜交...15
1. 染色體的製備 ...16
2. 前處理與雜交反應 ...16
3. 清洗 ...17
4. 訊號偵測 ...18
5. 訊號擴增 ...18
6. 對比染色 (counterstaining)...19
7. 螢光顯微鏡影像觀察 ...19
參、結果...20
ㄧ、染色體的觀察...20
二、螢光原位雜交...20
肆、討論...26
伍、參考文獻...31
圖目錄
圖 1:本實驗三種蝴蝶蘭花朵及葉片形態...10 圖 2:三種蝴蝶蘭原生種的核型...21 圖 3:以 5S 及 45S rDNA 為探針,與三種蝴蝶蘭原生種有絲分裂中期
染色體進行雙標的螢光原位雜交的結果...23
表目錄
表1:本實驗三種蝴蝶蘭原生種之分類、地理分佈與形態...11
表 2:三種蝴蝶蘭原生種的染色體數目、大小及 DNA 含量...22
表 3:三種蝴蝶蘭原生種 5S 及 45S rDNA 基因座的數目及位置 ...25
表 4:22 種蝴蝶蘭原生種之染色體大小及 DNA 含量...27
表 5:兩種 rDNA 在 22 種蝴蝶蘭原生種染色體上的分佈...29
壹、前言
蘭科植物 (Orchidaceae) 屬於單子葉植物綱 (Monocotyledoneae) 之 天 門 冬 目 (Asparagales) , 是 被 子 植 物 中 最 大 的 一 科 , 估 計 約 有 17,000~35,000 種,其中蝴蝶蘭屬於樹蘭亞科 (Epidendroideae)、萬代 蘭 族 (Vandeae) 、 風 蘭 亞 族 (Aeridinae) 之 蝴 蝶 蘭 屬 (Phalaenopsis) (Dressler, 1993)。Phalaenopsis 是由希臘文 phalaena 意指蝴蝶與 opsis 意指相似兩字結合而來,形容其花型優美如蝴蝶一般。蝴蝶蘭花朵色 彩鮮豔,花型別緻,花期甚長,深受民眾喜愛,是蘭科植物中栽培最 為廣泛且最受歡迎的花卉之一,因此在眾多的熱帶蘭花中,蝴蝶蘭素 有洋蘭皇后的美稱。依據 Christenson (2001) 的分類,全屬共 63 種,
主要分布於東南亞熱帶、亞熱帶地區及太平洋上的一些大島嶼,東邊 分佈達巴布亞新幾內亞 (Papua New Guinea);向西分佈至斯里蘭卡 (Sri Lanka)、喜馬拉雅山麓及南印度地區 (south India);南至澳大利亞 北部 (northern Australia);北至大陸雲南省、菲律賓 (Philippines) 以及 台灣 (Taiwan)。
蝴蝶蘭屬植物最早在 1740 年於呂宋島發現,其分類始於 1860 年,Reichenbach 以唇瓣 (lip) 中裂片有無捲鬚的特徵,將蝴蝶蘭簡單 分為兩群,共十一個種。1980 年,Sweet 利用蝴蝶蘭花瓣 (petal)、唇 瓣和萼片 (sepal) 等特徵,將蝴蝶蘭屬植物分為 9 個節 (sections),包 括 43 個 原 生 種 和 4 個 天 然 雜 交 種 (natural hybrids) 。 2001 年 Christenson 更依據地理分佈、花朵及葉片等特徵,將蝴蝶蘭分成五個 亞屬 (subgenus),八個節,共包含 62 個原生種及 1 個天然雜交種。
蝴蝶蘭受限於材料取得不易,因此有關細胞遺傳學的研究,都只 侷限在利用傳統染色法來觀察染色體大小、數目以及雜交種減數分裂 時染色體配對的情形。蝴蝶蘭原生種為二倍體植株,具 38 條染色體 (2n = 2x = 38) (Woodard, 1951; Sagawa, 1962),染色體長度依物種不同 而有所差異,約為 1.5~3.5 μm。Shindo 和 Kamemoto (1963) 曾觀察八 種 蝴 蝶 蘭 及 一 種 朵 麗 蘭 (Doritis pulcherrima) 的 染 色 體 核 型 (karyotype),發現最大與最小的染色體差距達 2.8 倍,並依據地理分 佈,將蝴蝶蘭分為兩群 : 一群分佈於菲律賓,染色體較小,核型較對 稱 (symmetry) , 包 括 P. amabilis、
P. boxallii
、P. equestris
、P.
lindenii
、P. lueddemanniana 和 P. schilleriana ; 另一群分佈於菲律賓以
外 的 地 區 , 染 色 體 較 大 , 核 型 較 不 對 稱 (asymmetry) , 包 括 P.mannii
、P. violacea 和 D. pulcherrima。Arends (1970) 觀察八種蝴蝶蘭
雜交種第一次減數分裂中期 (metaphase Ⅰ) 染色體的配對情形。依染 色 體 大 小 分 為 兩 群 , 第 一 群 染 色 體 較 小 , 核 型 類 似 , 包 括 P.amabilis、P. stuartiana、P. sanderiana、P. aphrodite 和 P. equestris;
第 二 群 染 色 體 較 大 , 核 型 較 不 一 致 , 包 括 P. lueddemanniana、P.
mannii 和 P. amboinensis。結果發現屬於同一群的植物經雜交後產生
的雜交種,其染色體於第一次減數分裂中期均可形成 19 個二價體 (bivalents),而不同群的物種雜交所產生的雜交種,染色體配對較差,顯示核型類似的物種,基因組之同源性較高。Lin 等人 (2001) 利用細 胞流測 (flow cytometry) 的技術,分析 18 種蝴蝶蘭原生種及一種朵麗 蘭的基因組大小,發現 P. parishii DNA 含量最大為 16.61 pg/2C,而 P.
sanderiana DNA 含量最小為 2.74 pg/2C,二者差異達 6.06 倍。Kao 等
人 (2001) 利用 Feulgen 染色法觀察九種蝴蝶蘭原生種及一種朵麗蘭的 染色體,將染色體分為大 (大於 2.5 μm)、中 (2.0~2.5 μm)、小 (小於 2.0 μm) 三型,並發現異染色質 (heterochromatin) 的含量與染色體大小 及細胞核內 DNA 含量呈正比關係,推測異染色質含量的多寡是造成 蝴蝶蘭核型差異的主要原因。
異染色質是由重複性序列 (repeated sequences) 所組成 (Verma, 1988)。真核生物 (eukaryotes) 基因組含有大量的重複性序列,以植物 為例,基因組最小的阿拉伯芥 (Arabidopsis thaliana) 約有 14% 的重複 性序列,而基因組較阿拉伯芥大十倍的番茄,重複性序列約佔 30%
(Peterson et al., 1996),另外基因組分別較阿拉伯芥大 60 倍及 200 倍 的玉米和小麥,其重複性序列更佔整個基因組的 60~80% (Lapitan, 1992)。重複性序列依其在基因組的分布可分為散佈型重複性序列 (interspersed repeated DNA sequences) 和 頭 尾 相 接 型 重 複 性 序 列 (tandemly repeated DNA sequences) (Flavell, 1986),前者分佈於整個基 因 組 中 , 如 轉 移 元 素 (transposable elements) , 包 括 轉 移 子 (DNA transposon) 及逆轉移子 (retrotransposon);後者主要聚集 (cluster) 在染 色體某些區域,如衛星體 DNA (satellite DNA)、端粒重複性序列 (telomeric repeats) 及 核 糖 體 RNA 基 因 (ribosomal RNA genes) 等 (Lapitan, 1992)。
真核生物細胞內含有大量核糖體 RNA 基因,可轉錄為核糖體 RNA,是組成核糖體次單位不可或缺的重要成份,參與蛋白質合成的 工作。核糖體 RNA 基因可分成 5S rDNA 及 45S rDNA 兩種。5S 核糖
體 RNA 基因的長度因物種不同而有差異,單一重複序列長度約 200 bp 至 900 bp,其中包含約 120 bp 的基因轉錄區 (transcribed region) 和 基因間間隔區 (intergenic spacer, 簡稱 IGS),每單倍體基因組內的拷貝 數為 1,000 至 50,000 個。45S 核糖體 RNA 基因則由 17~18S – 5.8S – 25~28S rDNA 所組成,其中 17~18S 與 5.8S rDNA 之間以及 5.8S 與 25~28S rDNA 之間分別被兩個內部轉錄間隔區 (internal transcribed spacer, 分別簡稱為 ITSⅠ 與 ITSⅡ) 所隔開,45S rDNA 單一重複序列 包含基因轉錄區、內部轉錄間隔區及基因間間隔區,長度隨物種不同 而有所差異,以植物為例,單一重複序列的長度從 7.8 kb 至 18.5 kb,
每單倍體基因組內的拷貝數為 600 至 8,500 個 (Lapitan, 1992)。
核糖體 RNA 基因轉錄區的序列具高度保守性 (conserved),但基 因間間隔區及內部轉錄間隔區的序列和長度在種內 (intraspecies) 或種 間 (interspecies) 均存在變異性 (Lapitan, 1992),因此 IGS 及 ITS 可用 來 比 較 物 種 間 的 親 緣 關 係 。Cox 等人 (1997) 研究拖鞋蘭 (slipper orchids) 發現屬於同ㄧ節的拖鞋蘭不論在染色體數目、基因組大小及 ITS 序列皆較類似。本研究室高 (2001) 曾利用 5S rDNA 的 IGS 序列探 討 28 種蝴蝶蘭及一種朵麗蘭之親緣關係,結果顯示蝴蝶蘭屬植物的 演 化 為 單 源 發 生 (monophyly) , 並 將 其 分 為 七 群 , 其 中 P.
amboinensis、P. venosa、P. violacea 屬於同ㄧ群,而 P. equestris 與 Phalaenopsis 節 的 P. amabilis 、 P. aphrodite 、 P. sanderiana 、 P.
stuartiana、P. schilleriana 則屬於另一群,此結果雖然與 Sweet (1980)
及 Christenson (2001) 的分類系統不完全符合,但仍與核型觀察的結果(Shindo and Kamemoto, 1963; Kao et al., 2001) 相吻合。Tsai 等人 (2006) 利用 ITSⅠ 及 ITSⅡ 序列,將 53 種蝴蝶蘭原生種及 13 種外類群 (outgroup) 的物種建立親緣關係樹,結果支持 Christenson (2001) 將朵 麗蘭屬 (Doritis) 及金氏蝴蝶蘭屬 (Kingidium) 歸類為蝴蝶蘭屬的分 類。
45S 核 糖 體 RNA 基 因 位 於 染 色 體 的 核 仁 組 成 區 (nucleolar organizer regions; 簡稱 NORs),轉錄產物 45S rRNA 為組成核仁的主要 成分 (Pardue et al., 1970)。當核糖體 RNA 基因表現時,利用傳統染色 技術觀察細胞有絲分裂中期 (metaphase) 的染色體,可在染色體上觀 察到次級收縮區 (secondary constriction) 及衛星體 (satellite),因此藉由 觀察染色體的衛星體,可判斷 45S 核糖體 RNA 基因的位置 (Heslop- Harrison, 1991),但有些物種受限於染色體太小,不容易觀察到衛星 體,至於 5S rDNA 則完全無法藉由傳統染色法觀察。真核生物中,
5S 和 45S 核糖體 RNA 基因在染色體上的位置因物種不同而異,有些 位在相同染色體上,如小麥 (wheat) (Appels et al., 1980; Dvorak et al., 1989) 和黑麥 (rye) (Mukai et al., 1990);但絕大多數物種則位於不同的 染色體上,如豌豆 (Ellis et al., 1988)、番茄 (Lapitan et al., 1991) 和玉 米 (Mascia et al., 1981) 等。
Gall 和 Pardue (1969) 利用放射性同位素標定探針,發展出原位雜 交 (in situ hybridization) 的技術。然而放射性同位素標定的探針半衰期 長,容易造成污染,實驗過程費時,解析度亦不佳,且一次只能標定 一種探針。隨著分子生物技術的進步,利用免疫的原理,將帶有螢光
物質的抗體與探針結合,可以顯示目標序列在染色體上的位置,稱為 螢光原位雜交 (fluorescence in situ hybridization, 簡稱 FISH),不僅改善 同位素原位雜交的缺點,更可同時標定多個探針,進行多彩螢光原位 雜交 (multicolor FISH),利用攜帶不同螢光物質的抗體與探針結合,
在一個分裂細胞上同時偵測到多種訊號。
藉由螢光原位雜交技術,將核糖體 RNA 基因實質定位 (physical mapping) 在染色體上,有許多的應用:
(1) 作為辨識染色體及核型分析的分子標誌 (molecular markers)。
Murata 等人 (1997) 利用兩種 rDNA 進行雙標定螢光原位雜交 (double labeling FISH),發現阿拉伯芥的第一對染色體無 rDNA,第二對染色 體有一個 45S rDNA,第四對染色體則同時含有 5S 及 45S rDNA,第 三對及第五對雖然皆含有 5S rDNA,但第五對染色體上的 5S rDNA 位置較靠近中節,因此成功藉由兩種 rDNA 的實質定位辨識所有阿拉 伯芥的染色體。Brown 等人 (1999) 將 18S 和 5S rDNA 實質定位於大 麥 (Hordeum vulgare L.) 的 7 對染色體,發現第一對到第四對染色體 均含有 5S rDNA,但第一對染色體訊號位於短臂靠近中節處,第二對 及第三對染色體訊號位於長臂,但第二對染色體訊號較強,第四對染 色體訊號位於長臂但接近端粒處;而第六對及第七對染色體皆含有 18S rDNA,但第七對染色體訊號較強,至於第五對染色體則皆無訊 號,因此成功辨識大麥的 7 對染色體。
(2) 分 析 基 因 組 的 組 成 (genome organization) (Heslop-Harrison, 2000)。例如 Badaeva 等人 (1996) 將 5S 及 18S – 26S rDNA 定位在 11 種山羊草屬 (Aegilops) 植物的染色體上。依據較早的研究,Aegilops 基因組可分為 S、T、U、C、N、M 和 D 七種,而較原始的物種,其 5S rDNA 基因座主要分佈在第一對及第五對染色體,而 18S – 26S rDNA 基因座則分佈在第一對、第五對及第六對染色體。研究結果發 現屬於 S、T 及 M 基因組的第一對、第五對及第六對染色體具有 18S – 26S rDNA 基因座;而屬於 U、C、N 及 D 基因組的其 18S – 26S rDNA 基因座只出現在第一對及第五對染色體,第六對染色體則無,
故推測 S、T 及 M 基因組的物種較為原始。
(3) 分析物種間的親緣關係。Seijo 等人 (2004) 利用 5S 及 18S – 25S rDNA 為探針,實質定位於九種蔓花生屬 (Arachis) 植物的染色體 上, 發現兩種四倍體植物 A. hypogaea 和 A. monticola 染色體之 rDNA 基因座的數目及位置與分別屬於 A 基因組的二倍體植物 A. duranensis 及屬於 B 基因組的 A. ipaensis 相吻合,因此推測 A. hypogaea 及 A.
monticola 為 A. duranensis 和 A. ipaensis 雜交產生的後代。
本研究室李 (2002) 由蝴蝶蘭原生種 P. aphrodite 選殖出 5S 及 45S rDNA,利用雙標的螢光原位雜交,將兩種 rDNA 定位在七種蝴蝶蘭 原生種的染色體上。其中 P. lueddemanniana、P. mannii 及 P. cornu-
cervi 皆具有一對 5S rDNA 及 45S rDNA 基因座。依據傳統分類,雖然
P. lueddemanniana 屬於 Amboinenses 節,而 P. mannii 及 P. cornu-cervi
屬 於 Polychilos 節 (Christenson, 2001) , 但 Arends (1970) 發 現 P.lueddemanniana × P. mannii 雜交種在減數分裂時染色體配對正常,顯
示 P. lueddemanniana 與 P. mannii 和 P. cornu-cervi 的親緣關係相當接 近。李 (2007) 亦將此兩種 rDNA 定位於七種蝴蝶蘭染色體上,其中 P.equestris、P. lindenii 和 P. celebensis 皆具有一對 5S rDNA 及 45S rDNA
基 因 座 , 此 三 種 蝴 蝶 蘭 皆 屬 於 Stauroglottis 節 (Sweet, 1980;Christenson, 2001),又與利用 ITS 序列所建構的親缘關係樹歸屬於同 一群的結果相吻合 (Tsai et al., 2006)。另外屬於 Phalaenopsis 節的 P.
sanderiana 具 2 對 5S rDNA 基因座及 1 對 45S rDNA 基因座,與同節
之 P. aphrodite 相同 (李, 2002),且 P. sanderiana × P. aphrodite 雜交種 在減數分裂時染色體配對正常 ( 林, 未發表 ),顯示 P. sanderiana 與 P.aphrodite 親 缘 關 係 相 當 接 近 ; 但 同 屬 於 此 節 的 P. stuartiana 、 P.
schilleriana 和 P. philippinensis 則具有 3 對 5S rDNA 基因座及 1 對 45S
rDNA 基因座,Tsai 等人 (2006) 利用 ITS 序列將此五個物種分成兩 群,而 rDNA 的定位亦支持其結果。本實驗的三種蝴蝶蘭原生種 P. fasciata、P. mariae 和 P. pallens,
均屬於 Amboinenses 節 (Christenson, 2001),先利用 Feulgen 染色法,
觀察染色體,再利用螢光原位雜交將 5S 及 45S rDNA 定位在染色體 上,所得結果與其他蝴蝶蘭原生種的研究相比較,以探討其親緣關 係。
貳、材料與方法
一、植物材料
本實驗所使用的三種蝴蝶蘭原生種 P. fasciata、P. mariae 和 P.
pallens ( 圖 1; 表 1),植株由秦添煌先生提供,以水苔種植,培養於台
大園藝系的精密溫室中。二、根尖染色體觀察
以解剖刀切取蝴蝶蘭新生根尖約 0.5~1 公分,將根尖縱剖兩半,
放入裝有 2 mM 8-hydroxyquinoline 溶液的錐形瓶中,於 18~20℃ 培養 箱中震盪處理 6 小時,再以 95% 酒精 : 冰醋酸 = 3 : 1 之固定液處理 隔夜,然後放至 70% 酒精中,於 -20℃ 冰箱儲存備用。
染色前先將根尖放入二次蒸餾水中清洗三次,每次三分鐘,洗去 酒精,然後移至 60℃ 之 1 N HCl 中處理七分鐘,再以二次蒸餾水清 洗三次,每次三分種,接著以 leuco-basic fuchsin ( 林純藥工業株式會 社 ) 溶液置黑暗處染色 1.5 小時,再放入 1% macerozyme (Yakult Honsha) 溶液於 37℃ 處理半小時。將根尖置於載玻片上,滴ㄧ滴 45%
醋酸 (Merck),將根尖搗碎,蓋上蓋玻片 (18 mm × 18 mm),反轉於濾 紙上壓片,封蠟後,置顯微鏡下觀察。
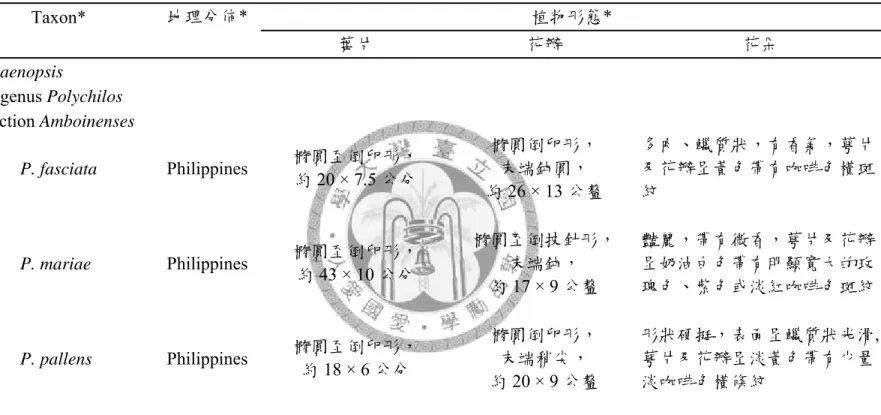
圖 1:本實驗三種蝴蝶蘭花朵及葉片形態。(A), (B) P. fasciata;(C), (D) P. mariae;(E), (F) P. pallens。
A
B
C D
E F
表1:本實驗三種蝴蝶蘭原生種之分類、地理分佈與形態。
Taxon* 地理分佈* 植物形態*
葉片 花瓣 花朵
Phalaenopsis
subgenus Polychilos section Amboinenses
P. fasciata Philippines 橢圓至倒卵形,
約 20 × 7.5 公分
橢圓倒卵形,
末端鈍圓,
約 26 × 13 公釐
多肉、蠟質狀,有香氣,萼片 及花瓣呈黃色帶有咖啡色橫斑 紋
P. mariae Philippines 橢圓至倒卵形,
約 43 × 10 公分
橢圓至倒披針形,
末端鈍,
約 17 × 9 公釐
豔麗,帶有微香,萼片及花瓣 呈奶油白色帶有明顯寬大的玫 瑰色、紫色或淡紅咖啡色斑紋
P. pallens Philippines 橢圓至倒卵形,
約 18 × 6 公分
橢圓倒卵形,
末端稍尖,
約 20 × 9 公釐
形狀硬挺,表面呈蠟質狀光滑, 萼片及花瓣呈淡黃色帶有少量 淡咖啡色橫條紋
* Christenson (2001)
三、抽取含 rDNA 選殖體之質體 DNA
45S 及 5S rDNA 選殖體由蝴蝶蘭原生種 P. aphrodite 篩選得到 ( 李, 2002)。質體 DNA 以煮沸法 (boiling method) 抽取 (Ausubel et al., 1987; Sambrook et al., 1989)。將含有質體的大腸桿菌 (E. coli) 單一菌 落接種於 3 ml 含 100 μg/ml ampicillin 的 LB 培養液 (Luria-Bertani medium: 1% NaCl, 1% tryptone, 0.5% yeast extract),以 37℃ 震盪培養 16~17 小時。然後於 4℃ 以 8,000 rpm 離心 2 分鐘,倒掉上清液,加 入 600 μl 的 STET 溶液 (8% sucrose; 0.5% Triton-X-100; 50 mM EDTA, pH 8.0; 10 mM Tris-HCl, pH 8.0),震盪混合,使菌懸浮。將 混 合 液 移 至 微 量 離 心 管 中 , 加 入 37 μl 的 lysozyme (20 mg lysozyme/ml TE),以沸水煮 45 秒後,迅速以 13,000 rpm 離心 6 分 鐘,用滅菌過的牙籤挑出管內的細菌殘骸,加入 300 μl 的 7.5 M ammonium acetate,上下搖勻,置離心管於冰上 15~20 分鐘,再以 13,000 rpm 離心 5 分鐘。將上清液移至新的微量離心管中,加入 600 μl 的 isopropanol,於室溫靜置 20 分鐘後,以 13,000 rpm 離心 6 分 鐘,倒掉上清液,在沈澱的 DNA 加入 1 ml 預冷的 70% 酒精清洗,
以 13,000 rpm 離心 5 分鐘,倒掉上清液。DNA 晾乾後,加入 15~20 μl 的 TE 緩衝溶液 (10 mM Tris-HCl; 1 mM EDTA, pH 8.0) 溶解,置 於 -20℃ 冰箱中儲存。
四、rDNA 探針的製備
(a) 5S rDNA
5S rDNA 以聚合酶連鎖反應 (polymerase chain reaction, 簡稱 PCR) 擴增 (amplify),並以 digoxigenin-11-dUTP 進行標定。其步驟 參考 New England Biolabs 的使用說明步驟加以修改,反應液成分如 下:
反應液成分 體積 (μl) 最終濃度
10× ThermoPol Reaction Buffer 5 1× * 10 mM dATP 1 0.2 mM 10 mM dGTP 1 0.2 mM 10 mM dCTP 1 0.2 mM 10 mM dTTP 0.9 0.18 mM 1 mM digoxigenin-11-dUTP (Roche) 1 0.02 mM 50 ng/μl plasmid DNA 1 1 ng/μl 10 pmol/μl forward primer (20mer) 1 0.2 pM (5'-ATCACGATTCTCGTGCCGCC-3')
10 pmol/μl reverse primer (20mer) 1 0.2 pM (5'-CCGTCTTGATGGTCGAACGG-3')
Taq DNA polymerase 0.5 2.5 units (5 units/μl)
*1× ThermoPol Reaction Buffer : 20 mM Tris-HCl, pH 8.8; 10 mM (NH4)2SO4; 2 mM MgSO4; 10 mM KCl and 0.1% Triton X-100.
上述反應液置於 0.5 ml 的微量離心管中,加入無菌水使最終體 積為 50 μl,充分混合後,短暫離心,置 PCR 反應器 (PTC-150 MiniCycler TM, MJ RESEARCH) 中反應。PCR 反應程式設定如下:
Step 1 : 94℃, 2 mins
Step 2 : 94℃, 30 secs
Step 3 : 50℃, 42 secs
Step 4 : 72℃, 45 secs
Step 5 : cycling to step 2, 44 cycles
Step 6 : 72℃, 7 mins
Step 7 : 4℃, 24 hrs
反應後將產物吸出,以 1.4% 低溫凝結瓊脂糖膠體 (low gelling temperature agarose) 進行電泳,然後將 DNA 條帶切出,以 Gel AdvancedTM Gel Extraction System (Viogene) 進行純化,然後置 -20℃
冰箱儲存。
(b) 45S rDNA
將含有 45S rDNA 的質體 DNA (constract) 以限制酵素 EcoR 1 切 出 45S rDNA 片段,以 0.8% 瓊脂糖膠體進行電泳,使其與載體 DNA 分離。切下的 rDNA 條帶,利用 Gel AdvancedTM Gel Extraction System (Viogene) 進行純化。若 DNA 濃度不足,無法進行缺口轉譯 (nick translation) 標定,則進行沉澱濃縮。在 DNA 中加入 0.1 倍體積 的 4 M LiCl 和總體積 2.5 倍預冷的絕對酒精,充分混合後,置 -70℃
超低溫冷凍櫃中 1~2 小時。然後於 4℃ 以 13,000 rpm 離心 15 分鐘,
倒掉上清液,將沈澱的 DNA 加入 1 ml 預冷的 70% 酒精清洗一次,
於 4℃ 再以 13,000 rpm 離心 15 分鐘,倒掉上清液。晾乾後之 DNA 加入適量 TE 緩衝液溶解。
探針以 nick translation 的方法製備。以 1 μg DNA 作為模版 (template),加入 4 μl Biotin-Nick Translation Mixture (Roche),再加 入無菌水使最終體積為 20 μl,混合均勻,短暫離心,於 15℃ 反應 90 分鐘。加入 1 μl 之 0.5 M EDTA (pH 8.0),於 65℃ 反應 10 分鐘終 止反應,再加入 2.5 μl 之 4 M LiCl 和 75 μl 預冷 (-20℃) 的絕對酒 精,混合均勻後,置 -70℃ 超低溫冷凍櫃中 1~2 小時沈澱 DNA。然 後在 4℃ 以 13,000 rpm 離心 15 分鐘,倒掉上清液,將沈澱的 DNA 加入 1 ml 預冷的 70% 酒精清洗一次,於 4℃ 以 13,000 rpm 離心 15 分鐘,倒掉上清液。晾乾後之 DNA 加入適量 TE 緩衝液溶解,置於 -20℃ 冰箱儲存。
五、螢光原位雜交
螢光原位雜交主要是參考 Schwarzacher 及 Heslop-Harrison (2000) 的方法,其步驟如下:
1. 染色體的製備
將儲存於 70% 酒精中的根尖,浸在二次蒸餾水中三次,每次 5 分鐘,洗去酒精,加入 40 μl 之 0.25 M HCl 反應 10 分鐘,再置於酵 素緩衝液 (enzyme buffer : 4 mM citric acid; 6 mM sodium citrate, pH 4.8) 平衡 10 分鐘,將根尖含分生組織的部份切下,滴上 50 μl 的酵 素溶液 [enzyme solution : 2% (W/V) cellulose Onozuka R10 (Yakult Honsha) 及 1% (W/V) macerozyme R10 (Yakult Honsha) 溶於於酵素緩 衝液 ],在 37℃ 處理 1.5~2 小時。吸除根尖表層之根被 (velamens) 後,滴上無菌水,浸泡約 10 分鐘以減緩酵素作用。將水與根尖細胞 混勻,吸至新的微量離心管中,以 800 rpm 離心 10 分鐘,吸去上清 液。然後加入 32 μl 95% 酒精 : 冰醋酸 = 3 : 1 之固定液,彈勻並短暫 離心。吸取 8 μl 的細胞懸浮液,於 15 公分的高度滴至經 vectabond (Vector Laboratories) 處理過的載玻片上,晾乾後,在顯微鏡下觀 察,挑選含有較多分裂細胞且染色體形態良好的玻片,置電子乾燥 箱中隔夜,然後保存於 -20℃ 冰箱中備用。
2. 前處理與雜交反應
滴 200 μl RNase A (Sigma) 溶液 (100 μg/ml RNase A 溶於 2× SSC) 於載玻片上,蓋上經 95% 酒精消毒過的塑膠片,置保濕容器中,在
37℃ 處理 1 小時。接著於室溫以 2× SSC 溶液清洗 3 次,每次 5 分 鐘。再將載玻片浸入新鮮配製的 4% paraformaldehyde (Merck) 溶液 中於室溫處理 10 分鐘,再以 2× SSC 溶液清洗 3 次,每次 5 分鐘,
接著依序在 50%、70% 及 95% 酒精中脫水各 3 分鐘,然後將載玻片 置於電子乾燥箱中乾燥備用。
先 將 載 玻 片 置 65℃ 烘 箱 中 預 熱 10 分 鐘 , 再 放 入 含 70%
formamide 的 2× SSC 變性溶液中,在 72℃ 反應 2.5 分鐘,使染色體 變性。隨即將載玻片依序放入預冷的 70%、95% 及絕對酒精中各 2 分 鐘 , 進 行 連 續 脫 水 。 另 外 雜 交 混 合 液 (50% formamide , 10%
dextran sulphate,2× SSC,濃度約 3~6 ng/μl 的 5S 及 45S rDNA 標識 探針,0.1% SDS) 以 80℃ 加熱 10 分鐘,冰浴 5 分鐘。載玻片晾乾 後,每片滴上 20 μl 的雜交混合液,蓋上 22 mm × 22 mm 蓋玻片,
以相片膠 (rubber cement) 封住蓋玻片四周,將載玻片置於保濕盒,
放入 37℃ 培養箱中,進行雜交反應 16 小時。
3. 清洗
雜交反應後,將載玻片泡在 2× SSC 中去除相片膠。再將載玻片 放在 2× SSC 溶液中搖動,使蓋玻片自然滑落。接著放入 42℃ 的清 洗液 (washing solution : 20% formamide, 0.2× SSC) 10 分鐘,接著在 42℃ 的 2× SSC 溶液清洗 5 分鐘,取出染缸於室溫繼續搖盪 5 分 鐘,再以 2× SSC 清洗 3 次,每次 5 分鐘。
4. 訊號偵測
5S rDNA 以 digoxigenin-11-dUTP 標定,利用 anti-digoxigenin- fluorescein 偵測;而以 biotin-16-dUTP 標定之 45S rDNA,則利用 avidin-Texas red 偵測。將載玻片浸泡於 4× SSC,0.2% Tween 20 溶 液中 5 分鐘,取出載玻片,滴上 200 μl 覆蓋溶液 [blocking reagent : 4× SSC, 0.2% Tween 20, 5% BSA (bovine serum albumin)(Sigma)],
蓋上塑膠片,置保濕容器中反應 10 分鐘,移除塑膠片,滴上 50 μl 含 anti-digoxigenin-fluorescein 及 avidin-Texas red 的混合溶液 [5 μg/ml anti-digoxigenin-fluorescein (Roche), 6.6 μg/ml avidin-Texas red (Vector Laboratories), 4× SSC, 0.2% Tween 20, 5% BSA],蓋上塑膠 片使液體均勻分布,置保濕容器中於 37℃ 反應 1.5 小時。挑掉塑 膠片,放入 4× SSC,0.2% Tween 20 溶液中清洗 3 次,每次 8 分 鐘。
5. 訊號擴增
由於利用 anti-digoxigenin-fluorescein 偵測的 5S rDNA 訊號較為 微弱,因此藉由二次抗體 fluorescein-conjugated anti-sheep IgG,將訊 號擴增。取出載玻片,滴上 200 μl 兔子血清溶液 [5% 兔子血清 (Vector Laboratories) 溶於 4× SSC,0.2% Tween 20 溶液中 ],蓋上塑 膠片,於室溫在保濕容器中反應 10 分鐘。移除塑膠片,滴上 50 μl fluorescein-conjugated anti-sheep IgG 溶液 [25 μg/ml anti-sheep IgG (Vector Laboratories), 4× SSC, 0.2% Tween 20, 5% 兔子血清 ],蓋上
塑膠片,置於保濕容器中於 37℃ 處理 1 小時。移除塑膠片,放入 4× SSC,0.2% Tween 20 溶液中清洗 3 次,每次 8 分鐘。
6. 對比染色 (counterstaining)
將載玻片放入 PBS 緩衝溶液 (68 mM NaCl, 1.3 mM KCl, 5 mM Na2HPO4, 0.9 mM K2PO4) 中平衡 5 分鐘,以 DAPI (4’ ,6-diamidino-2- phenylindole) 溶液 (0.1 μg/ml DAPI 溶於 PBS 緩衝液中 ) 對比染色 10 分鐘,再將載玻片置於 PBS 緩衝液中清洗 30 秒鐘,取出晾乾,滴 上 13 μl 抗螢光衰退劑 [mounting medium (Vector Laboratories)],蓋 上 22 mm × 22 mm 蓋玻片,以指甲油封閉蓋玻片四周。
7. 螢光顯微鏡影像觀察
將載玻片置於 Olympus AX70 螢光顯微鏡下觀察。觀察時,照 射波長 355 nm 的激發光,可見 DAPI 放出 450 nm 的藍色螢光;照 射波長 495 nm 的激發光,Texas red 放出 615 nm 紅色螢光,而 fluorescein 放出 515 nm 綠色螢光。以 Fujicolor Superia 200彩色底片 照相,並利用冷卻 CCD (cooled charged-coupled device) 照相,將影 像數位化後輸入電腦,再以軟體 Adobe Photoshop 處理。
參、結果
ㄧ、染色體的觀察
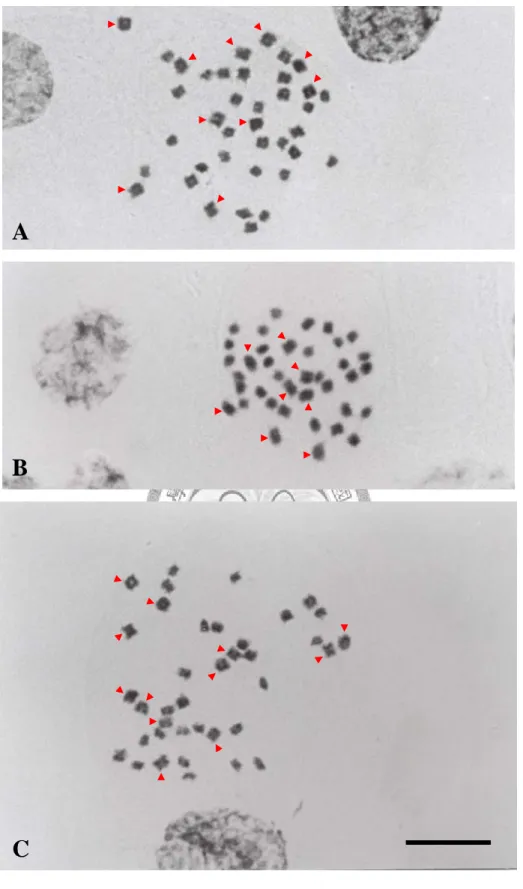
三種蝴蝶蘭原生種 P. fasciata、P. mariae 和 P. pallens 皆具 38 條染色體,其中 P. fasciata 具 28 條小型染色體及 10 條中型 染色體;P. mariae 具 30 條小型染色體及 8 條中型染色體;而 P.
pallens 則具 26 條小型染色體及 12 條中型染色體。它們的染色
體 大 都 屬 於 中 位 中 節 (metacentric) 或 次 中 位 中 節 (submetacentric),且均未觀察到具衛星體的染色體 ( 圖 2)。綜合 整理如表 2。二、螢光原位雜交
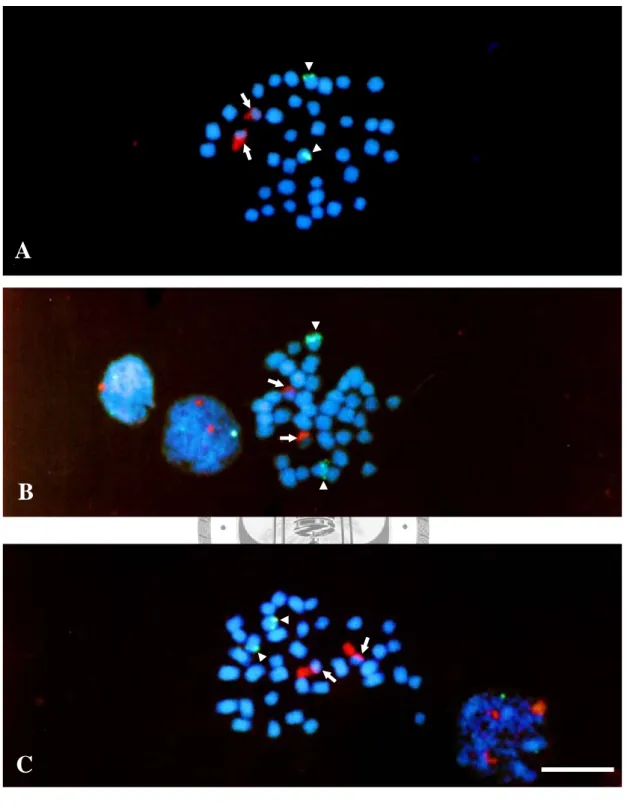
5S rDNA 以 digoxigenin-11-dUTP 標定,與蝴蝶蘭的根尖細 胞進行原位雜交,以與 fluorescein 結合的 anti-digoxigenin 偵 測,在照射波長 495 nm 的激發光下,標定部位發出綠色螢光;
而 45S rDNA 以 biotin-16-dUTP 標定,以有 Texas red 結合的 avidin 偵測,在照射波長 495 nm 的激發光下,標定部位發出紅 色螢光;染色體則以 DAPI 對比染色,在照射波長 355 nm 的激 發光下,染色體呈現藍色螢光。P. fasciata 之 5S rDNA 在一對 小型染色體的末端呈現訊號,強度相同,而 45S rDNA 則位於 另 外 一 對 小 型 染 色 體 的 末 端 , 但 訊 號 強 度 呈 現 多 型 性 (polymorphism) (圖 3A);P. mariae 與 P. pallens 之 5S rDNA 均
圖 2:三種蝴蝶蘭原生種的核型。(A) P. fasciata;(B) P. mariae;(C)
P. pallens 。 箭 頭 所 指 為 中 型 染 色 體 。 比 例 尺 為 10 μm 。
B
C
A
表 2:三種蝴蝶蘭原生種的染色體數目、大小及 DNA 含量。
Taxona 2n Chromosome size (µm)b Nuclear DNA contentc
< 2.0 2.0~2.5 > 2.5 (pg/2C) Phalaenopsis
Subgenus Polychilos Section Amboinenses
P. fasciata 38 28 10 0 6.56±0.07
P. mariae 38 30 8 0 6.48±0.11
P. pallens 38 26 12 0 -
a: Christenson (2001) b: Kao et al. (2001)
c: Lin et al. (2001)
圖 3:以 5S 及 45S rDNA 為探針,與三種蝴蝶蘭原生種有絲分裂中 期染色體進行雙標的螢光原位雜交的結果。(A) P. fasciata;(B) P.
mariae;(C) P. pallens。其中 5S rDNA 呈現綠色訊號 ( 以箭頭標
示 ),45S rDNA 呈現紅色訊號 ( 以箭號標示 ),染色體以 DAPI 對比 染色,呈現藍色。比例尺為 10 μm。A
B
C
在一對小型染色體的末端呈現訊號,而 45S rDNA 則位於另外 一對小型染色體的末端,兩種 rDNA 的訊號強度皆無差異 (圖 3B, 3C)。綜合整理如表 3。
表 3:三種蝴蝶蘭原生種 5S 及 45S rDNA 基因座的數目及位置。
5S rDNA loci 45S rDNA loci
Taxona Chromosome size (µm) Polymorphism Chromosome size (µm) Polymorphism
< 2.0 2.0-2.5 > 2.5 < 2.0 2.0-2.5 > 2.5
Phalaenopsis
subgenus Polychilos
section Amboinenses
P. fasciata 2Tb - 2T +
P. mariae 2T - 2T -
P. pallens 2T - 2T -
a: Christenson (2001)
b: T, terminal site
肆、討論
蝴蝶蘭 Amboinensis 節共包含 22 個原生種 (Christenson, 2001),
本 研 究 室 至 目 前 為 止 共 探 討 了 9 個物種,包括 P. fasciata、P.
mariae、P. pallens、P. lueddemanniana、P. bastianii、P. pulchra、P.
amboinensis、P. venosa 和 P. violace
a,皆具 38 條染色體 (Kao et al., 2001; 陳, 2009; 本實驗 )。其中 P. fasciata、P. mariae、P.pallens、P. lueddemanniana、P. bastianii 及 P. pulchra 均含有中型與
小型染色體,且大都屬於中位中節或次中位中節,核型較對稱,DNA 含量介於 6.37 ~ 6.56 pg/2C 之間;然而其它三個物種 P.
amboinensis、P. venosa 和 P. violacea 則具大、中、小型染色體,且
大都屬於次末端中節 (subtelocentric) 或近端中節 (acrocentric),核型 較不對稱,三者 DNA 含量介於 9.52 ~ 15.03 pg/2C 之間 (Kao et al., 2001; Lin et al., 2001; 陳, 2009; 表 4)。因此,藉由染色體形態 和 DNA 含量,可將此 9 個物種分為兩群。一般利用傳統染色法可觀察具衛星體的染色體,藉以判斷 45S rDNA 在染色體的位置,然而本實驗的三種蝴蝶蘭 P. fasciata、P.
mariae 及 P. pallens,均未觀察到具衛星體的染色體 ( 圖 2),利用 5S
及 45S rDNA 進行雙標的螢光原位雜交,則可偵測到 rDNA 的訊號 ( 圖 3)。Srisuwan 等人 (2006) 利用傳統染色法觀察 5 種蕃薯屬 (Ipomoea) 的植物 I. triloba、I. trifida (2n = 2x = 30)、I. setosa、I.tabascana 及 I. trifida (2n = 4x = 60),發現它們分別只有 2、2、1、1
表 4:22 種蝴蝶蘭原生種之染色體大小及 DNA 含量。
Chromosome size (μm)b DNA content Taxona 2n <2.0 2.0~2.5 >2.5 (pg/2C)c Ref.d
Phalaenopsis
subgenus Polychilos section Amboinenses
P. fasciata 38 28 10 0 6.56±0.07 1
P. mariae 38 30 8 0 6.48±0.11 1
P. pallens 38 26 12 0 - 1
P. bastianii 38 26 12 0 - 2
P. pulchra 38 28 10 0 6.37±0.22 2
P. lueddemanniana 38 28 10 0 6.49±0.22 3
P. amboinensis 38 8 4 26 14.36±0.19 3
P. venosa 38 12 4 22 9.52±0.27 3
P. violacea 38 6 6 26 15.03±0.21 3
section Polychilos
P. cornu-cervi 38 34 4 0 6.44±0.16 3 P. mannii 38 0 6 32 13.50±0.12 3 section Zebrinae
P. tetraspis 38 12 18 8 - 2
subgenus Phalaenopsis section Phalaenopsis
P. amabilis 38 38 0 0 - 2
P. aphrodite 38 38 0 0 2.80±0.06 3
P. sanderiana 38 38 0 0 2.74±0.04 4
P. stuartiana 38 38 0 0 3.13±0.07 4
P. schilleriana 38 38 0 0 - 4
P. philippinensis 38 38 0 0 - 4
Section Stauroglottis
P. celebensis 38 38 0 0 - 4 P. equestris 38 38 0 0 3.37±0.05 4 P. lindenii 38 38 0 0 - 4 section Esmeralda
P. pulcherrima 38 0 6 32 13.49±0.21 3
a: Christenson (2001) b: Kao et al. (2001) c: Lin et al. (2001)
d: 1: 本研究; 2: 陳 (2009); 3: Kao et al. (2001); 4: 李 (2007)
和 4 對的染色體具有衛星體,但利用螢光原位雜交卻偵測到各具 3、3、2、5 和 5 對 45S rDNA 的基因座,顯示螢光原位雜交較靈 敏,可以解決傳統染色法無法偵測的問題。
除少數物種外,絕大部份的真核生物 5S 及 45S rDNA 位於不同 的染色體上 (Lapitan, 1992)。本實驗之 3 種蝴蝶蘭,李 (2002) 探討的 7 種蝴蝶蘭,李 (2007) 進行的 7 種蝴蝶蘭,彭 (2007) 觀察的朵麗 蘭,以及陳 (2009) 研究的 4 種蝴蝶蘭,兩種 rDNA 在這 22 個物種 皆位於不同的染色體上 ( 表 5)。
螢光原位雜交除了可偵測目標序列的位置外,亦可依訊號強弱 定量出序列拷貝數 (copy number) 的多寡。rDNA 屬於頭尾相接型之 重複性序列,拷貝數的差異是由不均等交換作用 (unequal crossing over) 所造成的 (Flavell, 1985)。本研究室已探討的 22 種蝴蝶蘭中,
其中 45S rDNA 在 P. fasciata、P. mannii、P. celebensis 和 P. amabilis 以及 5S rDNA 在 P. aphrodite、P. philippinensis 和 P. equestris 均呈 現多型性,顯示 rDNA 的拷貝數有差異 ( 表 5)。
rDNA 的實質分佈,可用來分析物種間的親緣關係。Singh 等人 (2001) 利用螢光原位雜交將 rDNA 定 位 於 16 種二倍體大豆屬 (Glycine) 的植物 (2n = 40),發現莢果呈彎曲型的兩個物種 G. curvata 及 G. cyrtoloba 具兩對 45S rDNA 基因座,而其餘莢果呈筆直狀的 14 個物種,僅具ㄧ對 45S rDNA 基因座,且此兩群的植物雜交後產生 的 子 代 均 為 不 孕 性 , 顯 示 兩 群 的 植 物 親 缘 關 係 疏 遠 。
表 5:兩種 rDNA 在 22 種蝴蝶蘭原生種染色體上的分佈。
5S rDNA loci 45S rDNA loci
Taxona 2n <2.0 2.0~2.5 >2.5 <2.0 2.0~2.5 >2.5 Ref.c Phalaenopsis
subgenus Polychilos section Amboinenses
P. fasciata 38 2Tb 2T* 1
P. mariae 38 2T 2T 1
P. pallens 38 2T 2T 1
P. bastianii 38 2T 2T 2
P. pulchra 38 2T 2T 2
P. lueddemanniana 38 2T 2T 3
P. amboinensis 38 2I 10T 4T 3
P. venosa 38 2I 10T 3
P. violacea 38 4T 6T 2T 3
section Polychilos
P. cornu-cervi 38 2T 2T 3 P. mannii 38 2I 2T* 3 section Zebrinae
P. tetraspis 38 2T 8T 2T 2
subgenus Phalaenopsis section Phalaenopsis
P. amabilis 38 4T 2T* 2
P. aphrodite 38 2T*;2I 2T 3
P. sanderiana 38 4T 2T 4
P. stuartiana 38 4T; 2I 2T 4
P. schilleriana 38 4T; 2I 2T 4
P. philippinensis 38 4T; 2I* 2T 4
section Stauroglottis
P. celebensis 38 2T 2T* 4 P. equestris 38 2T* 2T 4 P. lindenii 38 2T 2T 4 section Esmeralda
P. pulcherrima 38 2I 6T 2T 5
a: Christenson (2001)
b: T, terminal site; I, interstitial site
c: 1: 本研究; 2: 陳 (2009); 3: 李 (2002); 4: 李 (2007); 5: 彭 (2007)
* polymorphism
九種蝴蝶蘭原生種進行 rDNA 實質定位的結果,P. fasciata、P.
mariae、P. pallens、P. lueddemanniana、P. bastianii 及 P. pulchra 各
具一對 5S rDNA 及 45S rDNA 基因座,且均位於小型染色體的末 端;然而 P. amboinensis、P. venosa 和 P. violacea 卻各具有 1、1、2 對 5S rDNA 基因座及 7、5、4 對 45S rDNA 基因座,且 5S rDNA 皆 位於大型染色體,而 45S rDNA 則大都位於小型染色體的末端,僅 少部份出現在中型染色體的末端 ( 表 5),顯示兩群植物有明顯差 異。過去高 (2001) 曾利用 5S rDNA 之 IGS 序列分析 28 種蝴蝶蘭原 生種,結果 P. fasciata、P. mariae、P. pallens、P. lueddemanniana 及P. pulchra 歸為一群,而 P. amboinensis、P. venosa 與 P. violacea 則
屬於另一群。Tsai 等人 (2006) 利用 45S rDNA 的 ITS 序列建立親缘 關係樹亦將此九物種分為兩群。再綜合 rDNA 實質定位、染色體形 態以及 DNA 的含量,均有助於此 9 種蝴蝶蘭在親緣關係上的確 認。Amboinenses 節的 22 個蝴蝶蘭原生種,Tsai 等人 (2006) 共探討
了 19 個 物 種 , 並 依 ITS 序 列 將 其 分 為 7 群 , 因 此 並 不 支 持 Christenson (2001) 的分類結果。目前本研究室僅探討其中 9 個物 種,未來如果有更多物種的研究來佐證,則更能釐清蝴蝶蘭物種的 親緣關係,將有利於更進一步的分類。伍、參考文獻
高玉馨. 2001. 以 5S rDNA 基因間空白區序列探討蝴蝶蘭屬植物之親 緣關係. 國立台灣大學植物學研究所碩士論文.
李文靜. 2002. 蝴蝶蘭屬植物核醣體 RNA 基因的選殖及實質定位. 國 立台灣大學植物學研究所碩士論文.
彭欣羚. 2007. 利用數種重複性 DNA 序列的分佈建立朵麗蘭的核型.
國立台灣大學分子與細胞生物學研究所碩士論文.
李益豪. 2007. 核糖體 RNA 基因於七種蝴蝶蘭屬植物的分佈. 國立台 灣大學分子與細胞生物學研究所碩士論文.
陳怡璇. 2009. 五種蝴蝶蘭屬植物核糖體 RNA 基因之染色體定位. 國 立台灣大學分子與細胞生物學研究所碩士論文.
Appels, R., W. L. Gerlach, E. S. Dennis, et al. 1980. Molecular and chromosomal organization of DNA sequences coding for the ribosomal RNAs in cereals. Chromosoma 78: 293-311.
Arends, J. C. 1970. Cytological observations on genome homology in eight interspecific hybrids of Phalaenopsis. Genetica 41: 88-100.
Ausubel, F. M., R. Brent, D. D. More, J. G. Sediman, J. A. Smith, and K.
Struhl. 1987. Current Protocols in Molecular Biology. Greene Publishing Associates and Wile-Interscience USA.
Badaeva, E. D., B. Friebe, and B. S. Gill. 1996. Genome differentiation in
Aegilops. 2. Physical mapping of 5S and 18S-26S ribosomal RNA
gene families in diploid species. Genome 39: 1150-1158.Brown, S. E., J. L. Stephens, N. L. V. Lapitan, and D. L. Knudson. 1999.
FISH landmarks for barley chromosomes (Hordeum vulgare L.).
Genome 42: 274-281.
Christenson, E. A. 2001. Phalaenopsis: A Monograph. Timber Press, Portland, Oregon.
Cox, A. V., A. M. Pridgeon, V. A. Albert, and M. W. Chase. 1997.
Phylogenetics of the slipper orchids (Cypripedioideae,
Orchidaceae): nuclear rDNA ITS sequences. Plant Syst. Evol. 208:
197-223.
Dvorak, J., H. B. Zhang, R. S. Kota, and M. Lassner. 1989. Organization and evolution of the 5S ribosomal RNA gene family in wheat and related species. Genome 32: 1003-1016.
Dressler, R. L. 1993. Phylogeny and classification of the orchid family.
Cambridge University Press, Cambridge.
Ellis, T. N., D. Lee, C. M. Thomas, et al. 1988. 5S rRNA genes in Pisum:
sequence, long range and chromosomal organization. Mol. Gen.
Genet. 214: 333-342.
Flavell, R. B. 1985. Repeated sequences and genome change. In: B. Hohn and E.S. Dennis (eds). Genetic Flux in Plants. Springer-Verlag, Wien, New York. pp. 139-156.
Flavell, R. B. 1986. Repetitive DNA and chromosome evolution in plants.
Phil. Trans. R. Soc. Lond. B 312: 227-242.
Gall, J. G., and M. L. Pardue. 1969. Formation and detection of RNA- DNA hybrid molecules in cytological preparations. Proc. Natl.
Acad. Sci. USA 63: 378-383.
Heslop-Harrison, J. S. 1991. The molecular cytogenetics of plants. J. Cell Sci. 100: 15-21.
Heslop-Harrison, J. S. 2000. Comparative genome organization in plants:
from sequence and markers to chromatin and chromosomes. Plant Cell 12: 617-635.
Kao, Y. Y., S. B. Chang, T. Y. LIN, C. H. Hsieh, Y. H. Chen, W. H.
Chen, and C. C. Chen. 2001. Differential accumulation of heterochromatin as a cause for karyotype variation in Phalaenopsis orchids. Ann. Bot. 87: 387-395.
Lapitan, N. L. V., M. W. Ganal, and S. D. Tanksley. 1991. Organization of the 5S ribosomal RNA genes in the genome of tomato. Genome 34: 509-514.
Lapitan, N. L. V. 1992. Organization and evolution of higher plant nuclear genomes. Genome 35: 171-181.
Lin, S., H. C. Lee, W. H. Chen, C. C. Chen, Y. Y. kao, Y. M. Fu, Y. H.
Chen, and T. Y. Lin. 2001. Nuclear DNA contents of Phalaenopsis sp. and Doritis pulcherrima. J. Amer. Soc. Hort. Sci. 126: 195-199.
Mascia, P. N., I. Rubenstein, R. L. Phillips, et al. 1981. Localization of the 5S rRNA genes and evidence for diversity in the 5S rDNA region of maize. Gene 15: 7-20.
Mukai, Y., T. R. Endo, and B. S. Gill. 1990. Physical mapping of the 5S rRNA multigene family in common wheat. J. Hered. 81: 290-295.
Murata, M., J. S. Heslop-Harrison, and F. Motoyoshi. 1997. Physical mapping of the 5S ribosomal RNA genes in Arabidopsis thaliana by multi-color fluorescence in situ hybridization with cosmid clones. Plant J. 12: 31-37.
Pardue, M. L., S. A. Gerbi, R. A. Eckhardt, J. G. Gall. 1970. Cytological localization of DNA complementary to ribosomal RNA in polytene chromosomes of Diptera. Chromosoma 29: 268-290.
Peterson, D. G., H. J. Price, J. S. Johnston, S. M. Stack. 1996. DNA content of heterochromatin and euchromatin in tomato (Lycopersicon esculentum) pachytene chromosomes. Genome 39:
77-82.
Sagawa, Y. 1962. Cytological studies of the genus Phalaenopsis. Am.
Orchid Soc. Bull. 31: 459-465.
Sambrook, J., E. F. Fritsch, and T. Maniatis. 1989. Molecular Cloning: a laboratory manual, 2nd ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York.
Schwarzacher, T., and P. Heslop-Harrison. 2000. Practical in situ Hybridization. BIOS Scientific Publishers Limited, Oxford, UK.
Seijo, J. G., G. I. Lavia, A. Fernandez, A. Krapovickas, D. Ducasse, and E. A. Moscone. 2004. Physical mapping of the 5S and 18S-25S rRNA genes by FISH as evidence that Arachis duranensis and A.
ipaensis are the wild diploid progenitors of A. hypogaea
(Leguminosae). Am. J. Bot. 91: 1294-1303.Shindo, K., and H. Kamemoto. 1963. Karyotype analysis of some species of Phalaenopsis. Cytologia 28: 390-398.
Singh, R. J., H. H. Kim, and T. Hymowitz. 2001. Distribution of rDNA loci in the genus Glycine Willd. Theor. Appl. Genet. 103: 212-218.
Srisuwan, S., D. Sihachakr, S. Siljak-Yakovlev. 2006. The origin and evolution of sweet potato (Ipomoea batatas Lam.) and its wild relatives through the cytogenetic approaches. Plant Sci. 171: 424- 433.
Sweet, H. R. 1980. The genus Phalaenopsis. Day Printing Corp., Pomona, California.
Tsai, C. C., S. C. Huang, and C. H. Chou. 2006. Molecular phylogeny of
Phalaenopsis Blume (Orchidaceae) based on the internal
transcribed spacer of the nuclear ribosomal DNA. Plant Syst. Evol.256: 1-16.
Verma, R. S. 1988. Heterochromatin: Molecular and structural aspects.
Cambridge University Press, Cambridge.
Woodard, J. W. 1951. Some chromosome numbers in Phalaenopsis. Am.
Orchid Soc. Bull. 20: 356-358.