發光高分子材料的合成與性質研究及其在有機發光二極體的應用
118
0
0
全文
(2) 發光高分子材料的合成與性質研究及其在有機發光二極體 的應用 Synthesis and Characterization of Light-Emitting Polymers and Applications in Organic Light-Emitting Diode. Student: Han. 研 究 生:劉 漢 康 指導教授:許 慶 豐. Kang Liu. Advisor:Dr.Ching-Fong Shu. 博士. 國立交通大學 應用化學所 碩士論文 A Thesis Submitted to Department of Applied Chemistry College of Science National Chiao-Tung University in Partial Fulfillment of the Requirements for the Degree of Master in Applied Chemistry July 2004 Hsinchu, Taiwan, Republic of China. 中華民國 九十三 年 七 月. ii.
(3) 發光高分子材料的合成與性質研究及其在有機發 光二極體的應用. 研究生:劉 漢 康. 指導教授:許 慶 豐. 博士. 國立交通大學應用化學研究所. 摘. 要. 本論文分為兩個部分, A 部分為 fluorene 及 phenylene vinylene 的衍生 物之共聚合物;B 部分為聚茀高分子的衍生物,分別對其合成、性質與元 件作討論。 在 A 部分中,我們合成出含有 polyfluorene 及 phenylene vinylene 的衍 生物,以 Wittig-Horner reaction 的合成途徑,合成出具有 Mullen type 樹枝 狀側鏈取代基的高分子 P1 及 P2,以及做為比較的高分子 P3。P1 及 P2 可 溶於一般有機溶液中,導入 Mullen type 的巨大側鏈取代基後,除了具有較 高的玻璃轉移溫度和較佳的熱穩定性之外,亦因為側鏈取代基所造成的立 體障礙使分子鏈不易堆疊,在薄膜熱處理後,可以維持發光效率及光色的 純度。此外其電激發光亦不隨電壓增加而改變。. i.
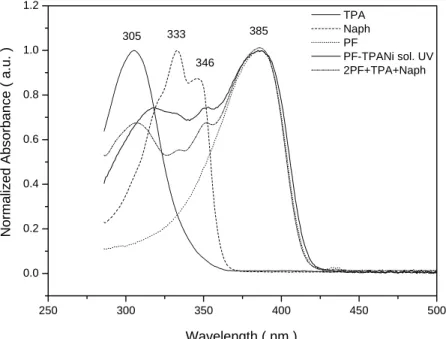
(4) 在 B 部分中,我們將具有電洞傳輸及電子傳輸能力的片段 triphenylamine (TPA)及 1,8-naphthalimide (Naph)以化學鍵結導入 polyfluorene ( PF) 高分子側鏈上,合成出高分子 PF-TPANi。而 TPA 和 Naph 兩個巨大側鏈取代基的導入,使得高分子鏈較不容易擾動,因此增加高分 子的熱穩定性且提升玻璃轉移溫度至 185 ℃;此高分子在光激發下,溶液 態為 polyfluorene 主鏈的放光,而薄膜態以側鏈取代基 TPA 和 Naph 之間激 態錯合物(exciplex)之放光為主。以此高分子製成元件後,其電激放光在 9~13 V 的電壓下均坐落於白光的範圍內。. ii.
(5) Synthesis and Characterization of Light-Emitting Polymers for Applications of Light-Emitting Diode. Student: Han Kang Liu. Advisor: Dr. Ching-Fong Shu. Department of Applied Chemistry National Chiao-Tung University. Abstract. This thesis is divided into two parts. In part A, we report the synthesis and characterization of three poly(fluorenevinylene-co-phenylenevinylene) copolymers, P1–P3. In Part B, a polyfluorene derivative has been synthesized. We also report the fabrication and the performance of the devices based on these materials. In part A, P1 and P2, which contain Mullen type dendric pendants were synthesized via Wittig-Honer Reaction, while P3, without dendritic side chains was also synthesized for comparison purpose. P1 and P2 are readily soluble in common organic solvents. Attributed to the introduction of bulk Mullen type pendants, P1 and P2 exhibit improved thermal properties and the formation of aggregate in solid state is significantly reduced. After isothermally heating of the polymer thin films (150℃ for 10h), P1 and P2 show no significant aggregates or excimers emission. In addition, devices based on P1 and P2 exhibit stable EL spectra which are independent of applied voltages. In part B, the triphenylamine (TPA) and 1,8-naphthalimide (Naph) iii.
(6) derivatives with hole- and electron-transporting properties, respectively, were introduced to polymerfluorene as side chains. Incorporation of these two rigid bulk groups increases the glass transition temperature to 185℃. The photoluminescence spectrum in solution state mainly contributes from polyfluorene backbone, but the emission of exciplex between TPAs and Naphs dominates in solid state. The device made from this polymer emits white light at voltages between 9 – 11 V.. iv.
(7) 誌謝 當兵和唸碩士班的不同處在於當兵是義務役,而碩士班是志願役,當兵如果沒有意 外的話應該是兩年退伍,但是碩士班則不一定,當兵訓練的是體力,而碩士班訓練的是 腦力,不過相同的地方是在這兩個地方我都遇到了很好的老闆及一些很好的夥伴。這邊 要對我的指導老師 許慶豐博士致上最高的敬意及感謝,除了在實驗上的指導之外,老 師對我們做人做事的教導及生活上的照顧都很讓人感動,另外老師鍥而不捨的態度及活 力都很值得我們學習;感謝吳芳奕學長在實驗的指導及元件的製作,每當心情遇到低潮 時聽聽學長的建議總是會有很好的效果。 本論文的完成並不是單打獨鬥就可以的,以下幾位是我在碩士班期間的好夥伴及支 援:The discussions with postdoctoral fellows Dr. Dodda and Dr. Dixit helped me so much in experiment skills and make my English better. They also widen my view towords the world. 張耀德、吳昇璋、周嘉宏、黃豐貿、吳昶慶、陳靜馨幾位學長姐對當初我們這群不懂事 的碩一新生多所包容教導,使我們可以順利適應環境,蘇惠真、曾翔暘、葉桂如同學對 我的加油打氣及討論實驗,使我覺得求學的路上並不孤單,施炳彝、曾雅嫺、陳冠宇、 簡辰翰、魏菱均這幾位學弟妹除了容忍我這只聽孫燕姿的怪人之外,在實驗上也對我有 很多的幫助。這邊建立起來的情感不亞於當兵朝夕相處的情感。感謝李蘊明小姐,張秋 景小姐在 Mass 及 NMR 上的幫助。 最後要感謝的是我的父親 劉增彩先生和母親 李喜美女士及胞弟劉漢鈞的鼓勵及 物質上的幫助,讓我能很幸福的專心在學業上。 再次的謝謝大家並將本論文獻給各位。. v.
(8) 目錄 中文摘要 .....................................................................................................................................i 英文摘要 ...................................................................................................................................iii 誌謝 ...........................................................................................................................................vi 目錄 ...........................................................................................................................................vi 圖目錄 .......................................................................................................................................ix 表目錄 .......................................................................................................................................xi A 部分 ........................................................................................................................................ 1 第一章 序論 ............................................................................................................................ 1 1-1. 前言............................................................................................................................1 1-2. 高分子發光二極體(PLED)之簡介 ...........................................................................1 1-2-1. 有機發光二極體發光原理及元件介紹 ........................................................1 1-2-2. 有機發光二極體材料簡介 ............................................................................3 1-3. 研究動機.................................................................................................................. 11 第二章 實驗 .......................................................................................................................... 13 2-1. 藥品..........................................................................................................................13 2-2. 使用儀器..................................................................................................................14 2-2-1. 核磁共振光譜儀 (NMR).............................................................................14 2-2-2. 質譜儀(Mass Spectroscopy) 與元素分析儀 (Elemental Analysis) ...........14 2-2-3. 薄層色層分析法 (TLC) ..............................................................................14 2-2-4. 管柱層析法 ..................................................................................................14 2-2-5. 微差掃描卡計(Differential Scanning Calorimetry, DSC) ...........................14 2-2-6. 熱重量分析儀(Thermogravimetric Analysis, TGA)....................................14 2-2-7. 凝膠滲透層析儀 (GPC) ..............................................................................14 2-2-8. 吸收光譜儀 (UV/vis) ..................................................................................15 2-2-9. 螢光儀 (Fluroescence Spectroscopy) ..........................................................15 2-2-10. 循環伏特安培計 (CV) ..............................................................................15 2-2-11. 真空薄膜蒸度機 ( Vacuum Coater ) .........................................................15 2-3. 合成部份..................................................................................................................15 第三章 結果與討論 .............................................................................................................. 32 3-1. 合成部份..................................................................................................................32 3-2. 物理性質..................................................................................................................38 3-2-1. GPC 量測.......................................................................................................38 3-2-2. DSC 和 TGA 測量 ........................................................................................38 3-2-3. 溶解度測試 ..................................................................................................43 3-3. 光學性質..................................................................................................................43 vi.
(9) 3-3-1. UV-vis 吸收光譜與 PL 放射光譜 ................................................................43 3-3-2. 量子效率的測量 ..........................................................................................46 3-3-3. 薄膜熱穩定性測量 ......................................................................................48 3-4. 電化學性質--氧化還原電位測量 ...........................................................................51 3-5. 元件電激發光性質..................................................................................................54 3-5-1. 高分子有機發光二極體元件製作與光電性質量測 ..................................54 3-5-2. 元件電激發光性質 ......................................................................................57 第四章 結論 .......................................................................................................................... 64 B 部分 ...................................................................................................................................... 65 第一章 前言 ............................................................................................................................ 65 1.1 白光高分子發光二極體的製備 ...............................................................................65 1.2 激態複合體 ( exciplex )簡介, ..................................................................................67 1.3 研究動機 ...................................................................................................................67 第二章 實驗部分 .................................................................................................................. 69 2-1.藥品............................................................................................................................69 2-2. 使用儀器..................................................................................................................69 2-2-1. 核磁共振光譜儀 (NMR).............................................................................69 2-2-2. 質譜儀(Mass Spectroscopy) 與元素分析儀 (Elemental Analysis) ...........70 2-2-3. 薄層色層分析法 (TLC) ..............................................................................70 2-2-4. 管柱層析法 ..................................................................................................70 2-2-5. 微差掃描卡計(Differential Scanning Calorimetry, DSC) ...........................70 2-2-6. 熱重量分析儀(Thermogravimetric Analysis, TGA)....................................70 2-2-7. 凝膠滲透層析儀 (GPC) ..............................................................................70 2-2-8. 吸收光譜儀 (UV/vis) ..................................................................................70 2-2-9. 螢光儀 (Fluroescence Spectroscopy) ..........................................................71 2-2-10. 循環伏特安培計 (CV) ..............................................................................71 2-2-11. 真空薄膜蒸度機 ( Vacuum Coater ) .........................................................71 2-3. 合成部分..................................................................................................................71 第三章 結果與討論 .............................................................................................................. 76 3-1. 合成部份..................................................................................................................76 3-1-1. 化合物 B1 的合成........................................................................................76 3-1-2. 化合物 B2 的合成........................................................................................76 3-1-3. PF-TPANi 的聚合反應..................................................................................76 3-2. 物理性質..................................................................................................................78 3-2-1. GPC 量測.......................................................................................................78 3-2-2. DSC 和 TGA 測量 ........................................................................................78 3-3. 光學性質..................................................................................................................81 3-3-1. PF-TPANi 之 UV-vis 吸收光譜與 PL 放射光譜 .........................................81 vii.
(10) 3-4. 電化學性質--氧化還原電位測量 ...........................................................................88 3-5. 元件電激發光性質..................................................................................................93 3-5-1. 高分子有機發光二極體元件製作與光電性質量測 ..................................93 3-5-2. PF-TPANi 元件電激發光性質......................................................................94 第四章 結論 ........................................................................................................................ 100 參考文獻 ................................................................................................................................ 101. viii.
(11) 圖目錄 圖 圖 圖 圖 圖 圖. 1 光激發光原理示意圖 ......................................................................................2 2. 單層發光二極體元件結構 .............................................................................2 3. 電激發光原理示意圖 .....................................................................................3 4. PPV 衍生物的化學結構..................................................................................7 5. Dow Chemical 公司所合成的 polyfluorene 系列高分子..............................8 6. Polyfluorene 的共聚物 ....................................................................................9. 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖 圖. 7. PPV 衍生物....................................................................................................10 8. Mullen type 的樹枝狀側鏈取代基................................................................12 9. P1 之 DSC 圖 .................................................................................................40 10. P1 之 TGA 圖...............................................................................................40 11. P2 之 DSC 圖 ...............................................................................................41 12. P2 之 TGA 圖...............................................................................................41 13. P3 之 DSC 圖 ...............................................................................................42 14. P3 之 TGA 圖...............................................................................................42 15. P1 的 THF 溶液/固態 UV-vis 吸收光譜、光激發光譜.............................45 16. P2 的 THF 溶液/固態 UV-vis 吸收光譜、光激發光譜.............................45 17. P3 的 THF 溶液/固態 UV-vis 吸收光譜、光激發光譜.............................46 18. P1 的固態光激發光譜(film PL)在 150℃下經過十小時的變化 ...............49 19. P2 的固態光激發光譜(film PL)在 150℃下經過十小時的變化 ...............50 20. P3 的固態光激發光譜(film PL)在 150℃下經過十小時的變化 ...............50 21. P1 之 CV 圖 ................................................................................................53 22. P2 之 CV 圖 ................................................................................................53 23. P3 之 CV 圖 ................................................................................................54 24. ITO 清洗流程...............................................................................................57 25. DeviceI 和 DeviceIII 的電流—電壓—亮度比較圖 ...................................59 26 DeviceII 和 DeviceIV 的電流—電壓—亮度比較圖...................................60 27 元件 I 在不同電壓下之 EL .........................................................................60 28 元件 II 在不同電壓下之 EL........................................................................61 29 元件 III 在不同電壓下之 EL ......................................................................61 30 元件 IV 在不同電壓下之 EL ......................................................................62 31 元件效率(power efficiency)比較圖.............................................................62 32. 白光有機發光二極體元件分析 .................................................................66 33. PF-TPANi 之 DSC 圖 ..................................................................................80 34. PF-TPANi 之 TGA 圖 ..................................................................................80 35. PF-TPANi 的甲苯溶液/固態 UV-vis 吸收光譜/放射光譜(film PL)..........82 36 TPA、Naph 及 polyfluorene 之結構 ...........................................................83 ix.
(12) 圖 37. (TPA:Naph)/PMMA 固態溶液和固態 PF-TPANi 的放射光譜 .................84 圖 38. Naph 的 PMMA 固態溶液吸收/放射光譜 .................................................84 圖 39. PF-TPANi、側鏈取代基及主鏈溶液 UV-vis 吸收光譜和加成的 UV-vis 吸 收光譜 ..............................................................................................................86 圖 40. PF-TPANi film UV-vis 吸收光譜、excitation 光譜 ...................................86 圖 41. PF-TPANi 和 polyfluorene 混合的固態放射光譜(film PL).......................87 圖 42. PFTPANi film 和 PMMA 固態溶液放射光譜............................................88 圖 43. PF-TPANi 及側鏈取代基(TPA, Naph)、主鏈(PF)能階相對位置示意圖.91 圖 44. PF-TPANi 放光機制示意圖 ........................................................................92 圖 45. PF-TPANi 之 solution-CV 圖 ......................................................................92 圖 46. PF-TPANi、TPA、Naph 及 polyfluorene 之 solution-CV 圖 ...................93 圖 47. Device BI 之電流密度-電壓-亮度 圖.......................................................95 圖 48. Device BI 在不同電壓下 EL .......................................................................96 圖 49. Device BII 之電流密度-電壓-亮度 圖 .....................................................98 圖 50. Device BII 在不同電壓下 EL......................................................................98. x.
(13) 表目錄 表 1. P1~P3 的分子量量測......................................................................................38 表 3. P1~P3 之 DSC 與 TGA 的數據分析表..........................................................39 表 4. PPV 衍生物之溶解度測試............................................................................43 表 5. P1~P3 之 UV-vis 吸收與 PL 放射量測表 .....................................................44 表 6. P1~P3 之相對量子效率..................................................................................48 表 7. P1~P3 的氧化還原電位及 HOMO、LUMO................................................52 表 8. Device I~IV 在電流密度 20 mA ( 100 mA ) /cm2 的元件效率...................63 表 9. PF-TPANi 的分子量量測 ..............................................................................78 表 10. PF-TPANi 之 DSC 與 TGA 的數據分析表 ................................................79 表 11. PF-TPANi 之 UV-vis 吸收與 PL 放射量測表 ............................................82 表 12. PF-TPANi 及側鏈的氧化還原電位及 HOMO、LUMO ..........................90 表 13. ITO/PEDOT/PF-TPANi/TPBI/Mg:Ag 在電流密度 20 mA/cm2 and 100 mA/cm2.的元件效率........................................................................................96 表 14. ITO/PEDOT/PF:PF-TPANi=4:96/TPBI/Mg:Ag 在電流密度 20 mA/cm2 及 100 mA/cm2.的元件效率.................................................................................99. xi.
(14) xii.
(15) A 部分 第一章 序論 1-1. 前言 人們不斷追求影音效果以及資訊的即時性,因此對顯示器的需求日益 增加,有機發光二極體(Organic light emitting diode, OLED)所製成的顯示器 具有(1)無視角限制,(2)低製造成本,(3)高應答速度,(4)省電,(5)可使用的 溫度範圍大,(6)重量輕、厚度薄等優點,因此在平面顯示器的系統中具有 極大的發展潛力,成為頗受重視的科技。 有機發光二極體顯示器以材料的不同可分為小分子型(OLED) 1及共軛 高分子型(PLED)2,3兩種,小分子材料的優點是合成及純化較高分子容易, 發光顏色也比高分子純(發光波寬較窄);高分子材料具有較高的熱穩定性且 成膜容易,可以用旋轉塗佈( spin coating )製成元件,使元件製程簡化,且 可製作大面積的顯示器。. 1-2. 高分子發光二極體(PLED)之簡介 1-2-1. 有機發光二極體發光原理及元件介紹 有機發光二極體的發光可分為光激發光(photoluminescence, PL)和電激 發光(electroluminescence, EL) 兩種形式。光激發光的發光原理如圖 1 所 示,分子經過照光吸收能量之後,位於最高填滿軌域(highest occupied molecular orbital, HOMO)的電子躍遷至最低未填滿軌域(Lowest unoccupied. 1.
(16) molecular orbital, LUMO)形成單態激子(singlet exciton),電子以放光的形式 從 LUMO 回到 HOMO 釋放出能量,稱為光激發光;單層的有機發光二極 體元件如圖 2 所示,當外加電壓於元件時,陰極和陽極分別注入電子和電 洞進入發光層,電子、電洞受到電場的作用移動,當在同一條高分子鏈相 遇時,電子以放光的形式從 LUMO 回到 HOMO 釋放出能量,稱為電激發 光,如圖 3 所示。. LUMO. hν'. hν. HOMO singlet excited state. 圖 1 光激發光原理示意圖. 金屬電極(陰極). 發光層 ITO(陽極). 圖 2. 單層發光二極體元件結構. 2.
(17) - Cathode + eLUMO. hν'. - e-. HOMO radical anion. singlet excited state. radical cation. Anode. +. 圖 3. 電激發光原理示意圖. 1-2-2. 有機發光二極體材料簡介 在 1990 年,英國劍橋大學研究群 D. D. C. Bradley 等人首先成功的以聚 對 苯 乙 烯 (poly (p-phenylene- vinelyene) ; PPV)3 為 發 光 材 料 , 製 成 ITO/PPV/Ca 單層高分子發光二極體元件,而開啟了共軛高分子在有機發光 二極體領域的研究。PPV 的放射波長為 551 nm (2.25 eV)和 520 nm (2.4 eV),為黃綠色光;但是此元件的 EL 效率並不好,僅 0.1% photon/electron, 且由於高分子材料結構有缺陷,其發光效率仍不及小分子材料。 為了要製成 PLED 元件,一般傾向於使用旋轉塗佈來製備具有良好穿 透率的薄膜,但是 PPV 不溶於一般有機溶劑,因此不容易處理;而使用 Wessling 和 Zimmerman 發展出的 sulfonium 前趨物合成途徑4(Scheme 1)則 可以解決這個困難,先將可溶性的前趨物塗佈在元件表面,再經過加熱及 真空下,形成 PPV 高分子薄膜。. 3.
(18) Scheme 1. PPV 合成途徑. a ClCH2. S. ClCH2. +. Cl. Cl S. +. b,c,d. Cl S. +. OMe. e. n. f. S. +. Cl. g n. n. PPV a. Tetrahydrothiophene, MeOH, 65oC; b. NaOH, MeOH/H2O or Bu4NOH, MeOH, 0oC; c. Neutralization (HCl); d. dialysis (water); e. MeOH, 50oC; f. 220oC, HCl(g)/Ar. 22 h; g. 180-300oC, vaccum, 12 h. PPV 薄膜亦可將前趨物以氣相沉積(chemical vapor deposition)蒸鍍於元 件表面再加熱轉換成高分子得到,如 Scheme 2 所示;將化合物 15、2 或 36 蒸鍍在元件表面,加熱產生中間物 4,再以 200℃、真空下轉換為 PPV 高分 子。但是經由此種合成途徑製成的元件效率並不好,僅有 0.002%。. 4.
(19) Scheme 2. 經由蒸鍍前趨物合成 PPV 高分子的合成途徑 Cl ClCH2. ClCH2. Cl. 3. 1. a. c. X. b H3C. ClCH2. X=Cl, Br n. 4. 2. d. n. PPV a. 500-700oC, 0.01 mbar; b. 580oC, 10 Pa; c. 800-900oC, 0.01 mbar, 60 oC, 0.1 mbar d. 200oC, vaccum. 由前趨物轉換為 PPV 的熱處理過程中,若有氧氣的存在會使甲氧基被 氧化產生羰基,羰基會淬熄( quench )發光而使得所製成的 PPV 量子效率變 差7,8;為了改善此一缺點,因此發展出可溶性的 PPV 衍生物,1991 年美國 加. 州. 大. 學. 的. Heeger. 等. 人. 發. 表. 了. MEH-PPV. :. (poly[(2-ethylhexyloxy-5-methoxy-1,4-phenylene)vinylene])2,此衍生物具有兩 個烷氧基(alkoxy group)而使其光色較 PPV 紅位移,為紅橘色的光(放射波長 5.
(20) 為 610 nm)。這一類的 PPV 衍生物可於有機溶劑中合成,且可溶於一般有 機溶劑中,簡化了 PLED 的製程,而側鏈的存在可以阻隔共軛高分子鏈彼 此之間的作用,使得發光效率提高,量子效率提高到 1%2。但是也因為導 入了烷氧基,使得玻璃轉移溫度較低。 MEH-PPV 聚合反應如 Scheme 3 所示,是由 Gilch 等人所發展出的去鹵 化氫縮合聚合反應 2,9,化合物 5 在 THF 溶液中使用十倍過量的 KOBu 行聚 合反應。 Scheme 3. MEH-PPV 的製備(Gilch route). OH. O. O. a,b. c. Cl Cl. MeO. n. MeO. MeO. MEH-PPV. 5. a. 3-(Bromomethyl)heptane, KOH, EtOH, reflux 16 h b. HCHO, concd. HCl, dioxane, 20oC, 18 h, reflux 4 h c. KOtBu, THF, 20oC, 24 h. 另外一些 PPV 的衍生物及其光色如圖 4 所示,一般說來具有樹枝狀的 側鏈取代基較直鏈的取代基有較好的溶解度。而取代基的大小也會影響發 光效率,隨著取代基由小到大,發光效率先是增加接著又變小10;化合物 811 即是因為取代基太大,所以使得高分子共軛性質被稀釋,而發光效率不佳,. 6.
(21) 發光效率最好的 PPV 衍生物為化合物 6,其外部量子效率可達到 2.1%12。. O Si n. MeO. 6 紅色. 7 綠色. OR. n. H. 8 R=. H. H. H. n. RO. 9 R= OC9H19 紅色 OMe OC7H15. MeO. n. OC7H15. 10 紅色. 圖 4. PPV 衍生物的化學結構 除了 PPV 之外,另一類受到重視的高分子材料為 polyfluorene 系列的高 分子。在 1989 年 Yoshino 等人首先以 ferric chloride 氧化聚合出在九號碳位 置為烷基取代的可溶性 polyfluorene13,14;其後 Dow chemical 的研究人員以 Suzuki coupling15合成許多具有高分子量的 polyfluorene 共聚物(copolymer) 及 homopolymer16,17,如圖 5 所示。Polyfluorene 是藍光的高分子, PL 和. 7.
(22) EL 發光效率很好,具有不錯的熱穩定性,其九號碳位置很容易做不同的化 學取代,且因為是 sp3 混成,所以使高分子為非平面性,因而增加了溶解度 並且可以防止分子鏈之間的堆疊。 R. R R'. R. Ar. R'. n. Ar=. R. N X. N S. R. N. N. Ph. N O. N. R. R. S. S. Ph. N. N. N. N. N. R. R. N S. 圖 5. Dow Chemical 公司所合成的 polyfluorene 系列高分子 高分子發光材料可以經由不同的單體形成不同的共聚物,或是導入不 同的側鏈取代基以改變其光色、溶解度、熱性質、發光效率及電荷傳輸能 力,之前的研究有許多以 polyfluorene 為主的共聚物,希望可以得到較佳的 光色及元件效率,如圖 6 所示。化合物 1118,19的放射波長為 410 及 420 nm, 比起 polyfluorene 較藍位移,且此化合物有較好的溶解度、excimer 放射減 少,顯示所導入的苯環使得 fluorene 的平面性變得較差,分子不易堆疊、有 8.
(23) 效共軛長度較短;化合物 1318 和 11 的不同是導入了雙鍵的結構,其放射波 長為 465 和 475 nm,顯示雙鍵結構可以比苯環提供更好的平面性,使得有 效共軛長度較化合物 11 長;化合物 1420的放射波長為 477 nm,導入烷氧基 後(15),放射波長紅位移至 495 nm18;化合物 1618 的放射波長為 422 nm, 這是因為間位取代的有效共軛長度變短;而以不同比例的 14 和 16 所合成 的化合物 1821,其放射波長和 14 相近(475 nm),16 的能量轉移至 14,其中 以 14:16 為 7:3 所得到的共聚物發光效率是化合物 14 的七倍。 OC10H21 n. C6H13. n. C6H13. C6H13. n. C6H13. C6H13. 12. 11. C6H13. OC10H21. 13 OC6H13. n. C6H13. n. C6H13. C6H13. C6H13. OC6H13. 15. 14. n. C6H13. *. n. C8H17. C6H13. C8H17. m. 17. 16. m n. C6H13. n. C6H13. C6H13. C6H13. C6H13. C6H13. 19. 18. 圖 6. Polyfluorene 的共聚物 另外一類的共聚物是以 PPV 為主,導入不同取代基,以改變其光色及 電荷傳輸能力(圖 7) ,化合物 21 為紅色的高分子(590 nm)22,其顏色主要 9.
(24) 是因為受到烷氧基的影響,而 cyano group 則是使得其電子親合力變好,對 光色不產生影響。化合物 2323 因為有異丙基取代,使得分子鏈產生扭轉, 使得有效共軛長度變短,放射波長為 510 nm,成為綠色的放光;進一步將 苯環改為間位取代(24),使得共軛長度更短,放光變為藍色23。除了可以用 cyano group 來改善高分子的電子親合力之外,化合物 25-2724導入鹵素亦可 以增加電子親合力,其中又以化合物 27 效果最好, 25 和 26 的放射為 620-630 nm,27 放射波長為 540-570 nm,但是製成元件後發光效率不好, 因此較適合做為電子傳輸、電洞阻擋層。. OMe. OC6H13. OC6H13 CN. n m. MeO. NC H13C6O. C6H13O. 20. n. 21. OC6H13 O. CN. O. CN MeO. NC. NC. C6H13O. n. n. MeO. 23. 22. OC8H17. OC6H13 CN. OMe. n n. n. F3C. X. CN. 27. CH3. X=Cl 25 X=Br 26. 24. 圖 7. PPV 衍生物 10.
(25) 1-3. 研究動機 顯示器需要紅、綠、藍三原色以達到全彩的效果,目前綠光與紅光高 分子發光材料在元件效率有不錯的表現,而藍光高分子材料仍有相當大的 改善空間,這是因為藍光材料需要有較大的能階差,驅動電壓較大,因此 要有更好的熱穩定性及抗氧化能力,目前已經有的藍光高分子材料有 poly(p-phenylene)25,poly(vinylcarbazole)26,27,polyfluorene;其中又以 polyfluorene 系列的高分子為最有潛力的材料。 Polyfluorene 具有良好的化學穩定性、熱穩定性及優越的螢光量子效 率,且在其九號碳位置很容易進行化學修飾做不同的取代,但是其機械性 質較差,且元件需要較高的操作電壓;而 PPV 本身具有很好的機械性質, 但是其溶解度及光色仍需要加以修飾;因此本研究是以 PPV 和九號碳上有 不同取代的 fluorene 單元共聚合,希望合成出具有 PPV 和 polyfluorene 優點 的藍光高分子材料。 PLED 元件在操作及製程中均會產生熱,為了增加材料的穩定性,我們 導入了 Mullen type 的樹枝狀側鏈取代基28,29 (圖 8),除了在熱性質方面可 以提高玻璃轉移溫度和增加熱穩定性之外,亦可以減少高分子鏈的堆疊, 避免因為堆疊的產生而降低發光效率,並且影響光色的純度。. 11.
(26) 圖 8. Mullen type 的樹枝狀側鏈取代基 而為了使元件的製程簡化,我們希望可以合成出可溶於一般有機溶劑 的高分子,以便使用旋轉塗佈的方法來製作元件,因此我們在 Mullen type 的樹枝狀側鏈取代基上導入了烷氧基以增加其溶解度,而在 fluorene 單元方 面,P2 導入了八個碳的長碳鏈取代、而 P1 則是使用 9,9-spirobifluorene , 以其 sp3 的立體結構減少高分子鏈之間的作用,以增加溶解度。 我們導入 Mullen type 巨大側鏈取代基亦希望可以造成立體障礙,讓分 子鏈產生扭曲角度(torsion angle),而阻斷高分子的有效共軛長度,使放射波 長變短,以達到調節光色的效果。. 12.
(27) 第二章 實驗 2-1. 藥品. 2,5-Dibromo-p-xylene. 購自 Lancaster. Trimethylsilylethyne. 購自 ACROS. Piperidine. 購自 Lancaster. Trimethylamine. 購自 Tedia. Triphenylphosphine. 購自 Lancaster. Copper Iodide. 購自 Riedel-de Haen. Tetrakis(triphenylphosphine)palladium. 購自 Aldrich. 2-Ethylhexyl bromide. 購自 ACROS. 1,3-Diphenyl propan-2-one. 購自 Lancaster. Tetrabutyl ammoniumhydroxide/1M sol. In MeOH 購自 Lancaster N-Bromosuccinimide (NBS). 購自 Aldrich. 2,2’-azobis(2-methyl propionitrile) (AIBN). 購自 TCI. N, N-Dimethyl foramide. 購自 Aldrich. Potassium carbonate. 購自 SHOWA. triethyl phosphite. 購自 Sterm. 上述所列藥品,不純化直接使用。THF 經過鈉、鉀合金及 benzophenone 13.
(28) 的除水蒸餾, Tetrabutylammonium hexafluorophosphate (TBAPF6) 經過乙酸 乙酯再結晶,並在 60 ℃ 的真空下烘乾。其餘皆購自於 Merck、Aldrich、 Mallickrodt、Fisher Scientific、聯工……等公司。. 2-2. 使用儀器 2-2-1. 核磁共振光譜儀 (NMR) 使用 Varian Unity-300 MHz 核磁共振光譜儀、Bruker-DRX-300 MHz 核 磁共振光譜儀。 2-2-2. 質譜儀(Mass Spectroscopy) 與元素分析儀 (Elemental Analysis) 使用交大貴儀的 T-200 GC-Mass,以 EI 或 FAB 為游離方法。以及清大 貴儀中心的 JEOL JMS-HX 110 Mass Spectrometer (高效能質譜儀)。元素分 析儀 ( EA )為交大的 HERAEUS CHN-OS RAPID。 2-2-3. 薄層色層分析法 (TLC) 使用 Merck 製造的 5554 DC Silica Gel 60 F254 型鋁製薄片。 2-2-4. 管柱層析法 使用 Merck 製造的 7734 Kieselgel 60 (60~230 mesh ASTM) 型矽膠。 2-2-5. 微差掃描卡計(Differential Scanning Calorimetry, DSC) 使用 Du Pont TA 2000 及 Computer/Thermal Analyzer。測試方式為:量 取 5~10 毫克的樣品裝入鋁製的 cell 中,在通入氮氣為 60 mL/min 下,做數 階段式升溫 DSC 測試。 2-2-6. 熱重量分析儀(Thermogravimetric Analysis, TGA) 使用 Du Pont Instrument TGA 2950 儀器,測試方法為取 5~10 毫克的樣 品裝入鉑製的 cell 中,在通入氮氣流速為 60 mL/min 下,由 30 ℃至 900 ℃ 以每分鐘 10 ℃升溫速率,來分析裂解之情形。 2-2-7. 凝膠滲透層析儀 (GPC). 14.
(29) 使用 waters 410 Differential Refractometer,Waters 600 Controller 和 Waters 610 Fluid Unit,管柱為 Waters Styragel Column,以 Polystyrene 當標 準品,THF 為沖堤液,樣品濃度為 2mg/1ml THF,流速為 1ml/min,管柱溫 度設定為 45℃。 2-2-8. 吸收光譜儀 (UV/vis) 使用 HP-8453 光譜分析儀,配製液體樣品置於 10 mm 的石英樣品槽, 測量範圍為 200~800 nm。 2-2-9. 螢光儀 (Fluroescence Spectroscopy) 使用 Acton Research 的螢光儀,型號為 Spectra Pro-150。 2-2-10. 循環伏特安培計 (CV) 使用美國 Bioanalytical Systems Inc. 電化學分析儀,型號 100B,序號 930。 2-2-11. 真空薄膜蒸度機 ( Vacuum Coater ) TRC 18 吋旋轉式 coater,含六個基板,兩個機動光罩,八個電熱坩鍋, 五個震盪感應器,IC-5 膜厚控制儀及 diffusion pump。. 2-3. 合成部份 1. 1,4-Dimethyl-2,5-bis-trimethylsilanylethynyl-benzene30 化合物 A1. 將 2,5-dibromo-p-xylene (2.00 g, 7.57 mmol ),trimethylsilylethyne (3.21 ml, 22.73 mmol),piperidine (35 ml),三乙胺 (95 ml),甲苯 (25 ml)加入三 頸瓶,加熱至 50 ℃,快速攪拌 10 分鐘,並以氮氣置換反應瓶內氣體。降 溫後加入 PPh3,CuI,Pd(PPh3)4,110℃下攪拌 24 小時。降溫後,將反應液. 15.
(30) 滴入 200 ml 水中,以乙酸乙酯( 50ml×3 )萃取,取有機層,加入硫酸鎂(s)除 水,濃縮,以正己烷進行管柱層析分離得 0.9g,產率 40 %。. Si. Si. A1 1. H NMR (300 MHz, CDCl3): δ7.27 (s, 2 H), 2.35 (s, 6 H), 0.26 (s, 18 H) (附圖. 1) 13. C NMR (75 MHz, CDCl3): δ 137.6, 132.9, 123.0, 103.9, 99.6, 19.9, 0.07. (附. 圖 2) GC-MS (m/e): 298 (M+).(附圖 3) 2. 1,4-Diethynyl-2,5-dimethylbenzene30 化合物 A2. 將化合物 A1 (0.9 g, 3.02 mmol ),碳酸鉀 (1.00 g, 7.25 mmol),加入甲醇 ( 9 ml ),THF (14.6 ml),室溫下攪拌 24 小時。反應溶液滴入 50ml 水中,以 乙酸乙酯( 25ml×3 )萃取,取有機層,加入硫酸鎂(s)除水,濃縮,烘乾得 0.42g, 產率 91 %。. A2 1. H NMR (300 MHz, CDCl3): δ7.28 (s, 2 H), 3.30 (s, 2H), 2.36 (s, 6 H). (附圖. 4) 16.
(31) 13. C NMR (75 MHz, CDCl3): δ 137.9, 133.3, 122.4, 82.23, 82.17, 19.9. (附圖 5). GC-MS (m/e): 154 (M+).(附圖 6). 3. 1,2-Bis-(4-hydroxy-phenyl)-ethane-1,2-dione31 化合物 A3. 將 p-anisil (10.00 g, 37.0 mmol ),溶於 HBr 水溶液( 40 ml ), HBr/醋酸 溶液 ( 33%, 60 ml ),加熱至 110℃,攪拌 8 小時。待降至室溫後,反應液 倒入水中( 300 ml ),過濾收集沉澱。得產物 6.54 g,產率 73%。 O. O. HO. OH. A3 1. H NMR (300 MHz, DMSO-d6): δ10.82 (s, 2H, -OH), 7.73 (dt, 4H, J=9.3, 2.3. Hz), 6.92 (dt, 4H, J=9.3, 2.3 Hz). (附圖 7) 13. C NMR (75 MHz, DMSO-d6): δ 193.7, 163.9, 132.3, 124.2, 116.1. (附圖 8). GC-MS (m/e): 242 (M+).(附圖 9). 4. 1,2-Bis-[4-(2-ethyl-hexyloxy)-phenyl]-ethane-1,2-dione 化合物 A4. 將化合物 A3 (4.00 g, 16.5 mmol ),碳酸鉀 (5.92 g, 42.9 mmol),2-ethylhexyl bromide ( 7.67 ml, 42.9 mmol ),置於雙頸瓶中,加入 N,N-二甲基甲醯 胺( DMF ),加熱至 120℃攪拌 12 小時。降溫後,反應溶液滴入 200ml 水中,. 17.
(32) 以乙酸乙酯( 100ml×3 )萃取,取有機層,加入硫酸鎂(s)除水,濃縮,以乙酸 乙酯:正己烷為 1:4 進行管柱層析分離,得 7.3g,產率 94 %。 O. O. O. O. A4 1. H NMR (300 MHz, CDCl3): δ7.90 (dt, 4H, J = 9.5, 2.4 Hz), 6.93 (dt, 4H, J =. 9.5, 2.4 Hz ), 3.89 (d, 4H, J = 5.7 Hz), 1.76~1.68 (m, 2H), 1.51~1.21 (m, 16H), 0.90 (t, 12H, J=8.0 Hz). (附圖 10) 13. C NMR (75 MHz, CDCl3): δ 193.7, 164.8, 132.4, 126.1, 114.8, 71.0, 39.3,. 30.5, 29.1, 23.8, 23.1, 14.1, 11.1. (附圖 11) HRMS [M++H] calad. for C30H43O4 467.3161, found 467.3161. Anal. Calcd for C30H42O4: C, 77.21; H, 9.07. Found: C, 77.04; H, 9.11.. 5. 3,4-Bis-[4-(2-ethyl-hexyloxy)-phenyl]-2,5-diphenyl-furan 化合物 A5. 架設冷凝管,加液漏斗,將化合物 A4 (7.00 g, 15.0 mmol ),1,3-diphenylpropan-2-one (3.47 g, 16.5 mmol),溶於 1,4-二氧陸圜( 30 ml ),加熱至 80℃, 在此溫度下加入 tetrabutylammoniumhydroxide,攪拌 1 小時。降溫後,反應 溶液滴入 250 ml 水中,以乙酸乙酯( 75 ml×3 )萃取,取有機層,加入硫酸鎂. 18.
(33) 除水,濃縮,以乙酸乙酯:正己烷為 1:4 進行管柱層析分離,得產物 7.3g, 產率 94 %。. O. O. O. A5 1. H NMR ( 300 MHz, CDCl3): δ7.22~7.27 ( m, 10H ), 6.86 ( dt, 4H, J = 9.2, 2.3. Hz ), 6.72 ( dt, 4H, J = 9.2, 2.3 Hz ), 3.82 ( d, 4H, J = 5.8 Hz ), 1.65~1.75 ( m, 2H ), 1.26~1.55 ( m, 16H ), 0.92 ( t, 6H, J=7.4Hz), 0.88 (t, 6H, J=6.9Hz). (附圖 12) 13. C NMR (75 MHz, CDCl3): δ200.4, 159.7, 154.2, 131.4, 131.2, 130.2, 128.1,. 127.2, 125.0, 124.7, 114.0, 70.6, 39.4, 30.6, 29.2, 23.9, 23.1, 14.2, 11.2. (附圖 13) HRMS [M++H] calad. for C45H53O3 641.3995, found 641.3994. Anal. Calcd for C45H52O3: C, 84.33; H, 8.18. Found: C, 84.38; H, 8.42.. 6. 1,4-Bis-{[3,4-bis-[4-(2ethyl-hexyloxy)]-phenyl]-2,5-diphenylphenyl}-2,5dimethyl benzene 化合物 A6. 19.
(34) 取化合物 A2 ( 0.52 g, 3.37 mmol ),化合物 A5 ( 6.70 g, 10.46 mmol ),溶 於鄰二甲苯(o-xylene)( 50 ml ),加熱至 160℃,攪拌 12 小時。降溫後,以迴 旋濃縮儀抽去鄰二甲苯,以丙酮再結晶兩次,過濾得白色固體,產率 80 %。. O. O. O. O. A6 1. H NMR ( 300 MHz, CDCl3): δ7.33 ( s, 2H ), 7.10~7.24 (m, 10H ), 6.56~6.88. ( m, 20H ), 6.38~6.47 ( m, 8H ), 3.66 ( d, 4H, J = 6.1Hz ), 3.63 ( d, 4H, J = 6.1Hz ), 1.88~1.90 ( m, 6H ), 1.58~1.64 ( m, 4H ), 1.27~1.47 ( m, 32H ), 0.85 ( t, 12H, J=7.4Hz), 0.84 ( t, 12H, J=7.1Hz ). (附圖 14) 13. C NMR (75 MHz, CDCl3): δ157.1, 156.8, 142.2, 141.1, 140.3, 140.2, 140.1,. 139.9, 139.7, 138.7, 132.8, 132.6, 132.44, 132.37, 132.1, 131.9, 131.7, 131.4, 131.2, 130.8, 130.0, 127.5, 126.6, 125.9, 125.2, 125.1, 131.2, 123.0, 70.5, 39.31, 39.26, 30.5, 29.1, 23.8, 23.0, 19.8, 14.1, 11.1 (附圖 15) HRMS [M++H] calad. for C100H115O4 1379.8796, found 1379.8793. Anal. Calcd for C100H114O4: C, 87.04; H, 8.33. Found: C, 87.13; H, 8.50.. 20.
(35) 7. 1,4-Bis-{[3,4-bis-[4-(2ethyl-hexyloxy)]-phenyl]-2,5-diphenylphenyl}-2,5bis-bromomethyl benzene 化合物 A7. 取化合物 A6 ( 0.70 g, 0.51 mmol ),N-bromosuccinimide (NBS) ( 0.18 g, 1.02 mmol ),2,2’-azobis( 2-methylpropionitrile ) (AIBN) (10 mg, 0.13 mmol) ,溶於四氯化碳( 20 ml ),加熱至 90℃,攪拌 4 小時。降溫後,以迴 旋濃縮儀抽去四氯化碳,加入正己烷( 10 ml ),過濾除去 succinimide,濃縮, 以 Hexane 進行管柱層析分離,得白色固體 0.2 g,產率 26 %。. O. Br O. O. Br O. A7 1. H NMR ( 300 MHz, CDCl3): δ7.39 ( s, 1H ), 7.30 ( s, 1H ), 7.08~7.16 (m,. 12H ), 6.59~6.89 ( m, 18H ), 6.47 ( d, 4H, J=8.6 Hz ), 6.40 ( d, 4H, J=8.6 Hz), 4.09~4.25 ( m, 4H ), 3.66 ( d, 4H, J = 5.9 Hz ), 3.62 (d, 4H, J = 5.9 Hz ), 1.56~1.62 ( m, 4H ), 1.25~1.42 ( m, 32H ), 0.90 ( t, 12H, J=7.6 Hz ), 0.88 (t, 12H, J=7.2 Hz). (附圖 16) 13. C NMR (75 MHz, CDCl3): δ157.9, 157.6, 142.7, 142.5, 142.3, 142.1, 141.14,. 141.08, 140.94, 140.88, 140.5, 140.4, 140.1, 138.3, 138.1, 135.3, 134.3, 134.1, 21.
(36) 133.2, 133.14, 133.06, 132.7, 132.3, 132.0, 131.4, 131.2, 130.7, 128.2, 127.6, 126.8, 126.3, 126.2, 114.0, 113.7, 71.2, 40.00, 39.96, 32.6, 32.5, 31.2, 31.1, 29.8, 24.5, 23.7, 14.8, 11.8. (附圖 17) GC-MS (m/e): 1537 (M+) (附圖 18) Anal. Calcd for C100H112Br2O4: C, 78.19; H, 7.34. Found: C, 78.40; H, 7.51.. 8. 1,4-Bis-{[3,4-bis-[4-(2ethyl-hexyloxy)]-phenyl]-2,5-diphenylphenyl}-2,5bis-(diethyl methylphosphonate) benzene 化合物 A8. 取化合物 A7 ( 1.60 g, 1.04 mmol ),triethyl phosphite ( 3ml ),加熱至 110 ℃,攪拌 14 小時,待冷卻後,減壓濃縮除去 triethyl phosphite,以正己烷再 結晶,得白色固體 0.64 g,產率 37.4%。. O. O O P O O. O O P O. O O. A8 1. H NMR ( 300 MHz, CDCl3): δ7.33 ( s, 1H ), 7.26 ( s, 1H ), 7.07~7.19 (m,. 12H ), 6.64~6.86 ( m, 16H ), 6.33~6.54 ( m, 10H ), 3.83~3.93 ( m, 8H ), 3.66 ( d, 4H, J=5.9 Hz ), 3.62 ( d, 4H, J=5.6 Hz ), 3.00~3.08 ( m, 2H ), 2.50~2.62 ( m, 2H ), 1.57 ( s, 4H ), 1.16~1.46 ( m, 38H ), 1.09 ( t, 2H, J= 7.0 Hz ), 1.00 ( t, 2H,. 22.
(37) J= 7.0 Hz ), 0.83~0.87 ( m, 24H ). (附圖 19) 13. C NMR (75 MHz, CDCl3): δ157.0, 156.7, 142.2, 142.0, 141.2, 141.1, 140.6,. 139.8, 139.7, 139.4, 138.6, 132.4, 132.1, 131.4, 130.8, 129.8, 127.8, 127.4, 127.0, 126.6, 125.9, 125.3, 113.2, 112.9,70.3, 61.8, 39.21, 39.17, 30.9, 30.4, 29.0, 23.7, 22.9, 16.4, 16.2, 16.0, 14.0, 11.0. (附圖 20) GC-MS (m/e): 1652 (M+) (附圖 21) Anal. Calcd for C108H132O10P2: C, 78.51; H, 8.05. Found: C 77.62; H 8.08.. 9. 9,9-spirobifluorene-2,7-dicarbaldehyde 化合物 A9. 取 2,7-dibromo-9,9’-spirobifluorene ( 1.50 g, 3.16 mmol ),溶於無水 THF(50 ml)中, ,-78℃下以加液漏斗慢慢加入 n-BuLi ( 3.48 ml,2.5 M Hexane solution,8.70 mmol ),自然回溫下攪拌 90 分鐘後,再降溫至-78℃,快速 加入 N,N-dimethyl formamide (DMF) ( 0.97 ml, 12.60 mmol ),自然回溫到室 溫,攪拌 12 小時。在冰浴下,將反應液倒入 2M HCl(aq) ( 30 ml ),攪拌 30 分鐘,以乙酸乙酯( 30 ml×3 )萃取,取有機層,加入硫酸鎂(s) 除水,濃縮, 以以乙酸乙酯:正己烷為 1:9 再結晶,得淡黃色固體 1.02 g,產率 86 %。. OHC. CHO. A9 23.
(38) 1. H NMR ( 300 MHz, CDCl3): δ 9.83 ( s, 2H ), 8.06 ( d, 2H, J= 7.5 Hz), 7.95. ( d, 2H, J= 8.1 Hz), 7.88 ( d, 2H, J= 7.8 Hz), 7.40 ( t, 2H, J= 7.4 Hz), 7.29 ( s, 2H ), 7.11 ( t, 2H, J= 7.5 Hz), 6.67 ( d, 2H, J=7.5 Hz ). (附圖 22) 13. C NMR (75 MHz, CDCl3): δ 191.8, 151.3, 146.6, 146.3, 142.3, 137.3, 130.5,. 128.8, 128.4, 125.8, 124.0, 121.9, 120.8, 65.9. (附圖 23) HRMS [M++H] calad. for C27H16O2 372.1149, found 372.1145. (附圖 24). 10. 9,9-dioctyl-fluorene-2,7-dicarbaldehyde 化合物 A10 n-octyl. n-octyl. OHC. CHO. A10 由本實驗室葉桂如同學提供 11. P1 取化合物 A9 ( 45.1 mg, 121.2 µmol ),A8 ( 200.0 mg, 121.2 µmol ),溶於無水 THF ( 6.4 ml )中,冰浴下慢慢加入 1M t-BuOK (0.97 ml, 0.97 mmol ),加完 後,升溫至 60℃,攪拌 24 小時,之後加入 benzaldehyde ( 0.1 ml ),攪拌兩 小時,再加入 diethyl benzylphosphonate ( 0.1 ml ),攪拌兩小時。降至室溫 後,反應液濃縮至大約 3 ml,滴入 40 ml 甲醇中再沉澱,再以 THF 溶解, 滴入甲醇中再沉澱兩次,最後用連續萃取裝置,以熱丙酮清洗 48 小時。得 產物 135 mg,產率 65%。. 24.
(39) O. R. R. R:. n. O. P1 1. H NMR ( 300 MHz, CDCl3): δ 7.66~7.79 (m , 4H), 7.04~7.27 (m, 20H),. 6.37~6.67 (m, 34H), 3.67 (d, 8H, J= 13.2 Hz), 1.29~1.62 (m, 36H), 0.86~0.89 (m, 24H). (附圖 25). 13. C NMR (75 MHz, CDCl3): δ 157.1, 156.8, 149.4, 148.6, 141.9, 141.6, 141.0,. 140.4, 139.5, 137.5, 132.6, 130.0, 127.4, 126.0, 125.2, 124.0., 122.3, 119.9, 113.1, 112.8, 70.4, 65.6, 39.3, 30.5, 29.1, 23.8, 23.0, 14.1, 11.1. (附圖 26) Anal. Calcd for C127H126O4: C, 88.87; H, 7.40. Found: C, 86.94; H, 7.64.. 12. P2 取化合物 A10 ( 40.5 mg, 90.9 µmol ),A8 ( 150.0 mg, 90.9 µmol ),溶於無水 THF ( 4.8 ml )中,冰浴下慢慢加入 1M t-BuOK ( 0.72 ml, 0.72 mmol ),加完 後,升溫至 60℃,攪拌 24 小時,之後加入 benzaldehyde ( 0.1 ml ),攪拌兩 小時,再加入 diethyl benzylphosphonate ( 0.1 ml ),攪拌兩小時。降至室溫 後,反應液濃縮至大約 3 ml,滴入 40 ml 甲醇中再沉澱,再以 THF 溶解, 滴入甲醇中再沉澱兩次,最後用連續萃取裝置,以熱丙酮清洗 48 小時。得 產物 70 mg,產率 43%。. 25.
(40) n-octyl. O. n-octyl R. R. n. R:. O. P2 1. H NMR ( 300 MHz, CDCl3): δ 7.42~7.52 (m , 10H), 6.43~7.16 (m, 40H), 3.65. (d, 8H, J= 13.5 Hz), 0.78~1.61 (m, 102H) (附圖 27) 13. C NMR (75 MHz, CDCl3): δ 157.1, 156.9, 156.7, 151.2, 149.4, 142.1, 141.3,. 140.6, 140.4, 139.8, 139.5, 136.8, 134.1, 132.6, 132.3, 130.0, 127.6, 126.6, 126.0, 125.3, 124.0, 121.5, 119.9, 113.1, 70.4, 54.7, 39.3, 39.3, 31.7, 30.5, 30.2, 29.3, 23.7, 23.0, 22.6, 14.1, 11.1. (附圖 28) Anal. Calcd for C131H152O4: C, 87.87; H, 8.56. Found: C, 87.02; H, 8.43.. 13. 1-Bromo-4-(2-ethyl-1-hexyloxy) benzene32化合物 A11. 將 4-bromopheol (5.00 g, 28.9 mmol ),碳酸鉀 ( 3.98 g, 28.9 mmol), 2-ethyl- hexyl bromide ( 4.63 ml, 26.01 mmol ),置於雙頸瓶中,加入 N,N-二 甲基甲醯胺( DMF )( 50 ml ),加熱至 120℃攪拌 20 小時。降溫後,反應溶 液滴入 50ml 水中,以乙酸乙酯( 50ml×3 )萃取,取有機層,加入硫酸鎂(s)除 水,濃縮,以乙酸乙酯:正己烷為 1:10 進行管柱層析分離,得無色液體 6.3g,產率 76 %。. 26.
(41) Br. O. A11 1. H NMR ( 300 MHz, CDCl3): δ 7.36 ( d, 2H, J=9.0 Hz ), 6.78 ( d, 2H, J= 9.0. Hz), 3.79~3.82 ( m, 2H ), 1.68~1.74 ( m, 1H ), 1.30~1.57 ( m, 8H ), 0.90~0.96 ( m, 6H ). (附圖 29) 13. C NMR (75 MHz, CDCl3): δ 158.5, 132.1, 116.3, 112.4, 70.7, 39.3, 30.4,. 29.0, 23.8, 23.0, 14.1, 11.1. (附圖 30) GC-MS (m/e): 284 (M+), 286([M+2]+). (附圖 31). 14. 4-(2-Ethyl-1-hexyloxy) benzene boronic acid 化合物 A12. 取化合物 A11 ( 3.00 g, 10.52 mmol ),溶於無水 THF ( 40 ml )中,-78℃ 下以加液漏斗慢慢加入 n-BuLi ( 6.31 ml,2.5 M Hexane solution,15.78 mmol ),自然回溫下攪拌 50 分鐘後,再降溫至-78℃,快速加入 B(OBu)3 (2.80 ml, 21.05 mmol ),自然回溫到室溫,攪拌 12 小時。將反應液倒入 2M HCl(aq) ( 40 ml ),攪拌 4 小時,以乙酸乙酯( 40ml×3 )萃取,取有機層,加入硫酸鎂 除水,濃縮,得粗產物 2.2 g,產率 76 %,直接進行下一步反應。 HO B. O. HO. A12 27.
(42) 15. 4,4’’-Bis-(2-Ethyl-hexyloxy)-2’,5’-dimethyl-[1,1’,4’,1’’]terphenyl 化合物 A13. 將化合物 A12 ( 2.00 g, 8.00 mmol ),2,5-dibromo-p-xylene ( 1.00 g, 3.78 mmol ), aliquat 336 ( 382 mg, 940 µmol ),加入甲苯 ( 90 ml )、碳酸鉀水溶 液 ( 2M, 12 ml ),加熱至 60 ℃,快速攪拌 10 分鐘,並以氮氣置換反應瓶 內氣體。冷卻後加入 Pd(PPh3)4 ( 109 mg, 94 µmol ),升溫至 110 ℃,攪拌 24 小時後,將反應降至室溫,濃縮除去甲苯和水,以正己烷進行管柱層析 分離,得無色液體 2.00 g,產率 48 %。. O. O. A13 1. H NMR ( 300 MHz, CDCl3): δ 7.27 ( d, 4H, J=8.4 Hz ), 7.11 ( s, 2H ), 6.94 ( d,. 4H, J= 8.4 Hz ), 3.87 ( d, 4H, J=5.4 Hz ), 2.62 ( s, 6H ), 1.70~1.78 ( m, 2H ), 1.24~1.54 ( m, 16H ), 0.84~0.96 ( m, 12H ). (附圖 32) 13. C NMR (75 MHz, CDCl3): δ 158.3, 140.2, 133.8, 132.6, 131.9, 130.2, 114.0,. 70.5, 39.4, 30.6, 29.1, 23.9, 23.1, 20.0, 14.1, 11.1. (附圖 33) HRMS [M+] calad. for C36H50O2 514.3810, found 514.3810. (附圖 34). 28.
(43) 16. 2’,5’-Bis-bromomethyl-4,4’’-bis-(2-ethyl-hexyloxy)- [1,1’,4’,1’’] terphenyl 化合物 A14. 取化合物 A13 ( 1.00 g, 1.95 mmol ),N-bromosuccinimide (NBS) ( 0.69 g, 3.89 mmol ),2,2’-azobis( 2-methylpropionitrile ) (AIBN) (38.3 mg, 233 µmol ) ,溶於四氯化碳( 28 ml ),加熱至 90℃,攪拌 4 小時。降溫後,過 濾除去 succinimide,濃縮,以正己烷進行管柱層析分離得白色固體 1.00 g, 產率 76 %。. Br. O. O. Br. A14 1. H NMR ( 300 MHz, CDCl3): δ 7.40 ( d, 4H, J=7.7 Hz ), 7.39 ( s, 2H ), 6.99. ( d, 4H, J= 8.7 Hz ), 4.46 ( s, 4H ), 3.90 ( d, 4H, J=5.7 Hz ), 1.72~1.78 ( m, 2H ), 1.25~1.58 ( m, 16H ), 0.85~0.97 ( m, 12H ). (附圖 35) 13. C NMR (75 MHz, CDCl3): δ 159.7, 154.2, 131.2, 130.2, 128.1, 127.2, 125.0,. 114.0, 70.6, 39.4, 30.6, 29.2, 23.9, 23.1, 14.2, 11.2. (附圖 36) HRMS [M+] calad. for C36H48O279Br81Br 672.2000, found 672.2007. (附圖 37) Anal. Calcd for C36H48O2Br2: C, 64.29; H, 7.19. Found: C, 64.26; H, 7.32.. 29.
(44) 17. [5’-(Diethyl-phosphorylmethyl)-4,4’’-bis-(2-ethyl-hexyloxy)-[1,1’,4’,1’’] terphenyl-2’-ylmethyl]-phosphonic acid diethyl ester 化合物 A15. 取化合物 A14 ( 1.00 g, 1.49 mmol ),triethyl phosphite ( 3ml ),加熱至 110 ℃,攪拌 12 小時,待冷卻後,減壓濃縮除去 triethyl phosphite,以乙酸乙酯: 正己烷= 4:1 為沖堤液進行管柱層析分離,得白色固體 400 mg,產率 35%。 O. OEt P OEt. O. O EtO P EtO. O. A15 1. H NMR ( 300 MHz, CDCl3): δ7.39 ( d, 2H, J=1.2 Hz ), 7.33 ( d, 4H, J=9.0. Hz ), 6.93 ( d, 4H, J= 8.7 Hz ), 3.89~4.01 ( m, 8H ), 3.86 ( d, 4H, J= 5.7 Hz ), 3.17 ( d, 4H, J=21 Hz ), 1.67~1.75 ( m, 8H ), 1.23~1.57 ( m, 24 H ), 1.19 ( t, 12H, J=6.9 Hz ), 0.84~0.95 ( m, 12H ). (附圖 38) 13. C NMR (75 MHz, CDCl3): δ 158.6, 141.0, 132.7, 130.6, 127.7, 114.2, 70.5,. 61.9 (d, J=6 Hz), 39.4, 30.8, 30.5, 29.1, 23.8, 23.0, 16.4, 16.3, 14.1, 11.1. (附圖 39) HRMS [M+] calad. for C44H68O8P2 786.4383, found 786.4386. (附圖 40) Anal. Calcd for C44H71O8P2: C, 66.90; H, 9.06. Found: C, 66.60; H, 8.58.. 30.
(45) 18. P3 取化合物 A10 ( 58.8 mg, 131.9 µmol ),A15 ( 100.0 mg, 131.9 µmol ),溶於無 水 THF ( 3.8 ml )中,冰浴下慢慢加入 1M t-BuOK ( 1.06 ml, 1.06 mmol ),升 溫至 60℃,攪拌 24 小時,之後加入 benzaldehyde ( 0.1 ml ),攪拌兩小時, 再加入 diethyl benzylphosphonate ( 0.1 ml ),攪拌兩小時。降至室溫後,反 應液濃縮至大約 2 ml,滴入 10 ml 甲醇中再沉澱,再以 THF 溶解,滴入甲 醇中再沉澱兩次,最後用連續萃取裝置,以熱丙酮清洗 48 小時。得產物 90 mg,產率 74%。. O n-octyl. n-octyl. n O. P3 1. H NMR ( 300 MHz, CDCl3): δ6.77~7.76 (m, 20H), 3.74~3.94 (m, 4H),. 0.80~1.80 (m, 64H). (附圖 41) 13. C NMR (75 MHz, CDCl3): δ 158.8, 153.8, 151.6, 139.8, 136.5, 134.7, 132.8,. 131.0, 127.5, 124.8, 121.8, 119.9, 114.2, 70.6, 54.8, 39.4, 31.8, 30.6, 30.1, 29.2, 29.1, 23.9, 23.1, 22.6, 14.1, 14.0, 11.1. (附圖 42) Anal. Calcd for C67H88O2: C, 86.96; H, 9.58. Found: C, 84.19; H, 9.11. 31.
(46) 第三章 結果與討論 3-1. 合成部份 3-1-1. 化合物 A1 的合成 化合物 A1 反應流程如 Scheme 4 所示,在 Pd(PPh3)4 的催化下, 2,5-dibromo-p-xylene 和 trimethylsilylethyne 進 行 Hagihara-Sonogashira coupling33反應,在一邊取代之後,反應性變得較差,經過長時間之後 (48 小時) 仍有單邊取代的產物,因此反應 24 小時之後即收反應,以管柱分離 純化,並回收單取代的產物。. 3-1-2. 化合物 A2 的合成 化合物 A2 是由化合物 A1 在甲醇和 THF 中,以碳酸鉀進行去保護基的 反應,反應相當完全,產率亦相當高。. 3-1-3. 化合物 A3 的合成 化合物 A3 是由 p-anisil 和 HBr 反應,反應後形成酚( phenol ),因為苯 環上的碳為 sp2 混成,不會進行 SN2 反應形成鹵化物,所以反應停留在 phenol。. 3-1-4. 化合物 A4 的合成 化合物 A4 是由化合物 A3 在 K2CO3 鹼性條件下和 2-ethyl- hexyl bromide 進行 Williamson ether synthesis,因為反應位置為 phenol,其 hydroxy group 較一般烷基取代的 hydroxy group 酸性為強,因此在 K2CO3 溫和的條件下即. 32.
(47) 可進行反應。導入此分支的烷氧基可以增加高分子之溶解度。. 3-1-5. 化合物 A5 的合成34 化合物 A5 反應流程如 Scheme 5 所示,化合物 A4 和 1,3-diphenylpropan-2-one 在 1,4-dioxane 中,先升溫至 80 ℃,在此溫度下,以加液漏斗 加入 tetrabutylammoniumhydroxide,反應液立刻由黃色變成紅棕色。純化後 得黏稠狀的固體。. 3-1-6. 化合物 A6 的合成 化合物 A2 和化合物 A5 溶於 o-xylene 中,進行 Diels-Alder 反應可得到 A6,選用 o-xylene 是因為需要較高的反應溫度,在高溫下,Diels-Alder 反 應的產物會脫去 CO,形成較穩定的芳香環結構;此種 cyclopentadienone 和 alkyne 的 Diels-Alder 反應是合成苯環很有效的方法。. 3-1-7. 化合物 A7 的合成 化合物 A7 由 A6 和 N-bromosuccinimide (NBS)的溴化反應得到,所用 的溶劑為 CCl4,其密度較 NBS 小且對 NBS 溶解度不好,在反應之初可以 看到 NBS 沉澱在瓶底,反應後之 NBS 變成 succinimide,其密度較 CCl4 小, 因此當觀察到 NBS 消失只剩下 succinimide 懸浮時,即表示反應已完成,之 後將 succinimide 過濾,再進一步以管柱分離純化。. 3-1-8. 化合物 A8 的合成 化合物 A8 的反應途徑如 Scheme 6 所示,經 Arbuzov 反應得到,反應. 33.
(48) 完畢以減壓蒸餾除去 triethyl phosphite 及 C2H5Br 後,得黏稠狀的固體,經 由正己烷再結晶可得到白色固體,但是因為此化合物的溶解度很好,所以 以再結晶純化回收的產率並不高。. 3-1-9. 高分子聚合反應35 此系列高分子聚合反應流程如 Scheme 6 所示,取相同莫耳數之 aldehyde 及 phosphonate,溶於無水的 THF 中,在冰浴下慢慢加入 1M 的 t-BuOK/THF 溶液,若水氣含量過高則 t-BuOK 會水解,使聚合反應失敗。 若滴加速度過快,或是反應溫度過高,則會在局部形成分子量過高的產物, 造成分子量分布不平均,因此在反應時要注意滴加的速度及磁石的攪拌效 率。另外為了增加元件及高分子的化學穩定性,在聚合反應結束之後加入 end cap 取代較不穩定的醛基。. 34.
(49) Scheme 4 Si Br. Br. Si. piperidine triethyl amine toluene PPh3 CuI Pd(PPh3 )4. Si. A1 K 2 CO 3 MeOH THF. A2 Scheme 5 O. O. HBr(aq) HBr/AcOH. O. O. O O. O. O. Br. HO. OH. K2CO 3 DMF. A3. O. O. A4. O. 1. 1,4-dioxane 2. t-Bu4NOH. O. O. A5. 35. + O.
(50) Scheme 6. A2 +. R. o-xylene A5. O. 160oC R:. R. A6. NBS AIBN. R. R Br Br. CCl4. R. O. R. A7. A6. P(OEt)3. R. P OEt OEt. O EtO. P OEt. O. R. A8. R OHC. A8. CHO. A9. +. n-octyl. 1M t-BuOK/THF THF. OHC. P1 n-octyl. n-octyl. n. R. n-octyl R. CHO. R. A10 P2 36. n.
(51) Scheme 7. 1. n-BuLi 2. B(OBu)3 3. H+. O. aliquat 336 Pd(PPh3)4 2M K2CO3 Toluene. O. Br HO. Br. B. O. Br. OH O. A12. A11. R. A13. NBS AIBN CCl4. R. R Br Br R. A14 P(OEt)3 R R:. P OEt OEt. O. O. EtO. O. P OEt. R. A15. n-octyl. A15 + OHC. 1M t-BuOK/THF THF. n-octyl. n-octyl. n-octyl R. CHO. R. P3 37. n.
(52) 3-2. 物理性質 3-2-1. GPC 量測 高分子的物理性質和分子量的大小有關,由 GPC 的測量可以得到一個 相對於標準品的分子量。在此所用的標準品是 polystyrene,沖堤液為 THF, 流速為 1mL/min,分子量訊號由標準品內插而得相對值,所測試的結果如 表 1 所示。 表 1. P1~P3 的分子量量測 Mw. Mw. Mn. P1. 27218. 12531. 2.17. P2. 44343. 20025. 2.21. P3. 60921. 24417. 2.50. Mn. Mw :重量平均分子量。. Mn :數目平均分子量。 Mw. Mn. (polydispersity):用以指示分子量分佈的寬度。. 因為 P1、P2 的側鏈取代基團比起 P3 較為巨大,產生的立體阻礙使得聚 合反應較不容易進行,因此 P1 及 P2 的分子量均比 P3 來得低。. 3-2-2. DSC 和 TGA 測量 DSC 和 TGA 主要是用來觀察高分子的熱性質,DSC 可測量到玻璃轉移 溫度(Tg);TGA 可測量出重量隨溫度的變化和裂解溫度,由其重量損失百 分率可觀察高分子的熱穩定性。. 38.
(53) 我們可由 DSC 和 TGA 觀察此系列高分子的熱性質,結果如表 2 與圖 9~ 圖 14 所示。DSC 的升溫速率為 20 ℃/min,範圍為 20~280 ℃,降溫速率 為 50 ℃/min。 此系列高分子導入了 Mullen-type 的樹枝狀側鏈結構,使得玻璃轉移溫 度比 P3 高 25℃以上。而 P1 因為有 9,9'-spirobifluorene 這個更為剛硬的基 團,所以其 Tg 又比 9 號碳位置為烷基取代的 P2 高了 15℃。 由 TGA 的證據顯示,P1、P2 有著出色的熱穩定性,在氮氣環境下, 5% 與 10% 的重量損失溫度分別介於 433~439 ℃和 448~456 ℃之間,甚至 在 900℃都還有 50 %以上的重量存在。而 P3 因為側鏈取代基較小,因此雖 然分子量較高,其熱穩定性表現仍不如 P1 及 P2。 表 2. P1~P3 之 DSC 與 TGA 的數據分析表 Tg. Td(-5%). Td(-10%). P1. 157 ℃. 439 ℃. 456 ℃. P2. 142 ℃. 433 ℃. 448 ℃. P3. 117 ℃. 382 ℃. 410 ℃. Tg:玻璃轉移溫度。 Td(%):樣品重量損失百分率的溫度。. 39.
(54) -900. DSC (mV). -1000. -1100 o. 157 C. -1200. -1300. -1400. -1500. -1600 50. 100. 150. 200. 250. o. Temp( C). 圖 9. P1 之 DSC 圖. 100 o. -5% = 439 C. weight loss (%). o. -10% = 456 C. 80. 60. 51% 40. 20. 0 0. 100. 200. 300. 400. 500. 600. o. Temp. ( C). 圖 10. P1 之 TGA 圖. 40. 700. 800. 900.
(55) 2000 1800. DSC (mV). 1600 1400 1200. o. 142 C. 1000 800 600 400 200 0 50. 100. 150. 200. 250. 300. o. Temp( C). 圖 11. P2 之 DSC 圖. 100 o. -5% = 433 C. weight loss (%). 80. o. -10% = 448 C. 60. 50%. 40. 20. 0 0. 100. 200. 300. 400. 500. 600 o. Temp. ( C). 圖 12. P2 之 TGA 圖. 41. 700. 800. 900.
(56) o. 117 C. -1000. -1200. -1400. 50. 100. 150. 200. 250. o. Temp( C). 圖 13. P3 之 DSC 圖. 120. 100 o. -5% = 382 C weight loss (%). DSC (mV). -800. 80. o. -10% = 410 C. 60. 40. 20. 0 0. 100. 200. 300. 400. 500 o. Temp. ( C). 圖 14. P3 之 TGA 圖 42. 600. 700. 800.
(57) 3-2-3. 溶解度測試 取 0.5 mg 之樣品,加入 100 mg 的溶劑,觀察在不同溶劑中的溶解度, 其結果如表 3 所示 。化合物 P1~P3 因為均有烷氧基的存在, P2、P3 在 fluorene 單元上導入了八個碳的長碳鏈取代、而 P1 則是使用 9,9-spirobifluorene ,具有 sp3 的立體結構可以減少高分子鏈之間的作用,以增加溶解 度,因此在一般的有機溶劑均有不錯的溶解度;P1、P2 的巨大側鏈取代基 可以減少高分子鏈之間的作用力,因此其溶解度又比 P3 稍好。 表 3. PPV 衍生物之溶解度測試 Polymer. CHCl3. CH2Cl2 Toluene. THF. Chlorobenzene. DMF. DMSO. P1. ++. ++. ++. ++. ++. +-. --. P2. ++. ++. ++. ++. ++. +-. --. P3. ++. ++. ++. ++. ++. -+. --. ++:溶解, +-:加熱溶解, -+:加熱部分溶解, --:不溶。. 3-3. 光學性質 3-3-1. UV-vis 吸收光譜與 PL 放射光譜 Solution:利用逐步稀釋法配置樣品濃度在 THF 溶液中的濃度為 0.4 mg/L, 其 UV-vis 的最大吸收值介在 0.05 左右。溶液的螢光放射光譜使 用最大吸收峰的波長為激發光源。 Film:以氯苯( chlrobenzene ) 配置樣品溶液,濃度為 0.5 wt%,以 2.5×2.5×0.15. 43.
(58) cm3 的石英玻璃當作基質,以轉速 3000 rpm / 30 sec 旋轉塗佈於石 英玻璃。 圖 15~圖 17 為 P1~P3 的吸收和放射光譜,其光譜的性質總結於表 4。. P1 和 P2 的最大的吸收峰 λmax 分別在 438 nm、440 nm。而在 THF 溶液狀 態下 P1 光激發光的最大放射波長為 479 nm (在 510 nm 處有 shoulder),P2 的最大放射波長為 482 nm (在 514 nm 處有 shoulder)。P1 和 P2 之薄膜狀態 的放射光譜與溶液狀態的光譜有 4 nm 的紅位移,和 P3 的 10 nm 位移比較 起來,顯示我們所導入的側鏈基團可以較有效的阻止高分子鏈之間的堆疊 產生。 表 4. P1~P3 之 UV-vis 吸收與 PL 放射量測表 UV-vis λmax (nm) THF P1 P2 P3. 438, 456 440, 460 433. Film 435 440 437. PL λmax (nm) THF 479, 510 (sh) 482, 514 (sh) 476, 509 (sh). 44. film 483, 513 (sh) 486, 518 (sh) 486, 516 (sh).
(59) 1.2. sol. UV 438, 456 sol. PL 479, 510 film UV 435 film PL 483, 513. 1.0. intensity (a. u.). 0.8. 0.6. 0.4. 0.2. 0.0 250. 300. 350. 400. 450. 500. 550. 600. 650. 700. Wavelength (nm). 圖 15. P1 的 THF 溶液/固態 UV-vis 吸收光譜、光激發光譜. 1.2. sol. UV 440, 460 sol. PL 482, 514 film UV 440 film PL 486, 518. intensity (a. u.). 1.0. 0.8. 0.6. 0.4. 0.2. 0.0 250. 300. 350. 400. 450. 500. 550. 600. 650. 700. 750. Wavelength (nm). 圖 16. P2 的 THF 溶液/固態 UV-vis 吸收光譜、光激發光譜. 45.
(60) 1.2. sol. UV 433 sol. PL 476, 509 Film UV 437 Film PL 486, 516. intensity (a. u.). 1.0. 0.8. 0.6. 0.4. 0.2. 0.0 250. 300. 350. 400. 450. 500. 550. 600. 650. 700. 750. Wavelength (nm). 圖 17. P3 的 THF 溶液/固態 UV-vis 吸收光譜、光激發光譜. 3-3-2. 量子效率的測量 量子效率(quantum yield,Φ)為物質放出光子數與吸收光子數之比,可 表示為: Φ= (number of emitting photon )/(number of absorbed photons ) 我們測量的量子效率為相對量子效率(relative quantum yield),選定已知量子 效率值的參考標準品後,在待測物及參考標準品的光學密度 ( optical density )、儀器各參數皆相同的情況下,測量待測物及參考標準品的螢光光 譜,並將測得的積分面積值及激發波長的吸收度代入(式一) ,即可求出未知 物的相對量子效率36。 Φs /Φr =(Ar / As) ×(Is / Ir)×(Qr / Qs)37,38 (式一). 46.
(61) s:待測樣品(sample) r:標準參考品(standard) Φ:量子效率 A:激發波長的吸收度 I:螢光放光強度的積分面積 Q:螢光激發光源所提供光的量子。. 參考標準品39的選擇需具有下列特點: (1) 已知且正確的量子效率 (2) 沒有自身吸收(self-absorption)的現象 (3) 對待測溶劑的溶解度高 (4) 純度高且具光安定性 (5) 吸收及放射波長範圍和待測物相近 此處我們分別選擇 Coumarin 6 及 9,10-diphenyl anthracene (DPA)為溶液 及固態量子效率測量的標準品。 溶液態之量子效率 : 將高分子溶於 THF 中,Coumarin 6 溶於乙醇中,取 兩者在 420 nm 為激發波長的 PL 之積分值/420 nm 之吸收度所得值 作比較,定 Coumarin 6 之量子效率為 0.7840所得相對值。 固態量子效率 :將高分子樣品配成重量百分比為 0.5 %之氯苯溶液,標準. 47.
(62) 品為 9,10-Diphenyl anthracene (DPA) / PMMA = 1/300,以 CHCl3 為溶 劑配成重量百分比為 15 %之溶液,以 2.5×2.5×0.15 cm3 的石英玻璃 當作基質、轉速 3000 rpm / 30 sec 旋轉塗佈於石英玻璃。取兩者在 365 nm 為激發波長的 PL 之積分值/365 nm 之吸收度所得值比較,定 DPA 薄膜之量子效率為 0.8341所得相對值。 所測得結果總結於表 5,在溶液態中此三個高分子的量子效率頗為相 近,但是在固態時,P3 之量子效率則較另外兩者下降較多,這是因為 P3 的側鏈取代基無法有效的阻止堆疊產生,因此使得其固態的量子效率下降。 表 5. P1~P3 之相對量子效率 THFa. Filmb. Filmc. P1. 0.81. 0.25. 1.78. P2. 0.75. 0.21. 1.50. P3. 0.76. 0.14. 1. a: 溶液態之量子效率,以 Coumarin 6 為標準比較所得之相對值 b: 固態之量子效率,以 DPA/PMMA 之薄膜為標準比較所得之相對值 c: 固態之量子效率,以 P3 為標準所得之相對值. 3-3-3. 薄膜熱穩定性測量 以前述方式製備薄膜,測量加熱前吸收及放射光譜。於氮氣下在 150 ℃ 加熱 10 小時,測量加熱後的吸收及放射光譜。圖 18~圖 20 為 normalized. 48.
(63) 的光譜圖,P1 及 P2 在加熱後沒有多餘的放射峰產生,而 P3 除了 520 nm shoulder 高度較加熱前增加外,557 nm 以後因堆疊所產生的長波長範圍強 度亦增加;另外加熱前後 P1 及 P2 的放射強度僅有些微的下降,P3 則有大 幅的下降,(如圖 18~圖 20 之插圖所示),在加熱時高分子鏈會擾動而重新 排列得較為緊密,而 P1、P2 因為有較大的側鏈取代基團可以有效的阻止高 分子鏈之間的堆疊,因此可以避免量子效率下降,另外 P3 因為 Tg 點遠低 於 150 ℃,因此在此溫度下其擾動及堆疊的程度更嚴重,因此發光效率變 得較差,且有更多 excimer 形成。. 1.2. Fresh o 150 C,10 hrs. 483 1.0. Fresh o 150 C,10 hrs. 483 70. Relative intensity (a.u.). intensity (a.u.). 80. 0.8. 514 0.6. 60 50. 511. 40 30 20 10 0 -10 400. 450. 500. 550. 600. 650. 700. wavelength (nm). 0.4. 0.2. 0.0 400. 450. 500. 550. 600. 650. 700. wavelength (nm). 圖 18. P1 的固態光激發光譜(film PL)在 150℃下經過十小時的變化. 49.
(64) 1.2. Fresh o 150 C,10 hrs. 485 1.0 50. Relative intensity (a.u.). intensity (a.u.). 0.8. 520 0.6. Fresh o 150 C,10 hrs. 40. 30. 20. 10. 0. 400. 450. 500. 550. 600. 650. 700. wavelength (nm). 0.4. 0.2. 0.0 400. 450. 500. 550. 600. 650. 700. wavelength (nm). 圖 19. P2 的固態光激發光譜(film PL)在 150℃下經過十小時的變化. 1.2. Fresh o 150 C,10 hrs. 486 1.0 70. 0.6. 50. Relative intensity (a.u.). intensity (a.u.). 520. Fresh o 150 C,10 hrs. 487. 60. 0.8. 557. 40. 30. 20. 10. 0 400. 450. 500. 550. 600. 650. 700. wavelength (nm). 0.4. 0.2. 0.0 400. 450. 500. 550. 600. 650. 700. wavelength (nm). 圖 20. P3 的固態光激發光譜(film PL)在 150℃下經過十小時的變化. 50.
(65) 3-4. 電化學性質--氧化還原電位測量 為了探討用於元件的有機材料,我們先建立能階圖,來得知我們選用 的材料特性,預測電子與電洞結合的位置及能量轉移的效果。 在此我們使用循環伏安法( cyclic voltammetry,簡稱 CV ),當外加電位 達到待測物的反應電位時,氧化或還原反應隨即發生,此時電流將隨著電 位的變化而改變。而電流的大小是由物質到電極表面的擴散速率所控制, 所以當擴散速率遠小於外加電位的變化速率,當電極表面的反應已趨完全 時,電流即衰減下來。 首先配置 0.1 M tetrabutylammonium hexafluorophosphate (TBAPF6) 的 Acetonitrile 溶液 10 mL 為電解液,通入氮氣 10 分鐘,將待測樣品配置為 1 mg/100 mg 的 CHCl3 溶液,以 3000 rpm/10 sec 旋轉塗佈於工作電極上, Ag/Ag+為參考電極,並以 ferrocene/ferrocenium (Fc/Fc+)為內參考電位,以碳 電極為工作電極,白金絲為導電電極,掃瞄速率為 50 mV/S,範圍 0 ~ 2000 mV 與 0 ~ -2000 mV。 red ),再配合 從 CV 圖中可讀取氧化起始電位(E oxonset )、還原起始電位(E onset. UV-vis 的吸收光譜圖來建立元件分子電子能階圖。 我們利用下列公式來計算 HOMO、LUMO42值,其中氧化起始電位(E oxonset ) 採用伏特為單位( vs. Fc/Fc+),常數為 4.8,為 ferrocene 相對於真空能階,E opt g 為 UV-vis 光譜開始吸收位置的能隙值。. 51.
(66) HOMO = -4.8 - E oxonset red LUMO = -4.8 - E onset. 以化合物 P1 為例,經過 ferrocene 標準品校正後所得 E oxonset 為 0.60V、 red E onset 為-2.13 V,利用公式求得 HOMO = -5.40 eV、LUMO = -2.67 eV,其餘. 氧化還原電位及 HOMO、LUMO 計算如表 6。 由 CV 圖( 圖 21~圖 23 ) 及數據分析可見,此系列高分子在陰極部份 是不可逆的(irreversible),其還原起始電位分別為-2.13、-2.09 V,而氧化過 程電位亦是不可逆的,氧化起始電位為 0.60,0.64 V。. P1 和 P2 的氧化還原電位很相近,顯示在 fluorene 碳 9 位置做不同的化 學修飾對於電位的影響不大。. 表 6. P1~P3 的氧化還原電位及 HOMO、LUMO UV(on set) λonset,. (nm). d el E opt , E red , (V) a E ox , (V) a g HOMO, (eV)b LUMO, (eV) c E g , (eV) onset onset. (eV). 495 2.51 -2.13 0.60 P2 501 2.47 -2.09 0.64 P3 490 2.53 -2.32 0.71 a + Potential values are versus Fc/Fc . b HOMO determined from onset oxidation. c LUMO determined from onset reduction. P1. d. - 5.40 - 5.44 -5.51. Electrochemical bandgap E elg = LUMO - HOMO.. 52. -2.67 -2.71 -2.48. 2.73 2.73 3.03.
(67) 1500 1000. -2.40 -2.13. I (uA). 500 0 -500. 0.60 0.83. -1000 -1500 -2000. 1.06. -2500 -2500. -2000. -1500. -1000. -500. 0. 500. 1000. +. E vs. Fc/Fc (V). 圖 21. P1 之CV圖. -2.41 500. -2.09. I (uA). 0. 0.64. -500. 0.83 -1000. -1500. 1.14 -2500. -2000. -1500. -1000. -500. 0 +. E vs. Fc/Fc (V). 圖 22. P2 之CV圖. 53. 500. 1000. 1500. 1500.
(68) 300 200. -2.56. -2.32. I (uA). 100 0 -100. 0.71. -200. 1.33 -300. 0.93 1.80. -400 -500 -3.0. -2.5. -2.0. -1.5. -1.0. -0.5. 0.0. 0.5. 1.0. 1.5. 2.0. 2.5. +. E vs. Fc/Fc (V). 圖 23. P3 之CV圖. 3-5. 元件電激發光性質 3-5-1. 高分子有機發光二極體元件製作與光電性質量測 3-5-1-1. ITO 玻璃之線路製備(pattern) 3-5-1-1-1. ITO 玻璃之線路形成前之清潔 裁取尺寸為 3.9 × 3.9 cm 的 ITO 玻璃,置於中性清潔劑:去離子=1:50 的溶劑中,置於超音波震盪器中震盪 5 分鐘,依序於去離子水、丙酮中震 盪 5 分鐘,最後以氮氣吹乾。. 3-5-1-1-2. 光阻劑(photoresist, PR)之旋轉塗佈(spin coating) 取清潔後之 ITO 玻璃,置於旋轉塗佈機上,先滴上 1 mL 之光阻劑,啟 動開關使之旋轉,轉速為 2000 rpm,時間為 20 秒,旋轉期間再滴入光阻劑 54.
(69) 3 mL,接著將已塗佈上光阻劑的玻璃置於 90 ℃的烘箱中 1.5 小時,以除去 光阻劑中的溶劑。. 3-5-1-1-3. 曝光顯影(exposure and development) 將節 3-5-1-1-2.之 ITO 玻璃置於曝光機中,以製備好的光罩圖形覆蓋在 ITO 玻璃上,曝光能量及時間為半光 15 秒;顯影液=3:1,將曝光完成的 ITO 玻璃浸泡於顯影液中 30 秒,取出玻璃以去離子水沖乾淨。. 3-5-1-1-4. ITO 玻璃之蝕刻(etching) 配製去離子水:濃鹽酸:硝酸=50:45:5 (V/V/V)之溶液,將節 3-5-1-1-3. 之 ITO 玻璃浸泡於上述溶液中,14 分鐘後取出 ITO 玻璃並以去離子水將酸 液去除,接著以丙酮將光阻劑洗去,再以氮氣吹乾。. 3-5-1-2.高分子發光元件之製作 為了探討本研究所合成出之高分子聚合物電激發光性質,我們製作了高 分 子 發 光 二 極 體 元 件 , 其 結 構 為 ITO/PEDOT/polymer/Mg:Ag/Ag 及 ITO/PEDOT/polymer/TPBI/Mg:Ag/Ag。其中 ITO 基材與 Mg:Ag 分別為陽極 和陰極,Ag 為保護層;TPBI 為電子傳輸及電洞阻隔層,平衡電子電洞傳輸 速度,並限制電子、電洞再結合區域,以提升元件效能。為了改善 ITO 表 面平整度並增加電洞注入效率,所以在 ITO 表面塗佈上一層具有高導電度 及良好熱穩定性的 poly(3,4-ethylenedioxythiophene) (PEDOT)為電洞注入 層。. 55.
數據




+7
相關文件
中興國中
中興國中 楊秉鈞..
我們觀察很遠的物體時,物體所發出(反 射)的光線,到物鏡前會很接近平行光,但並非
如圖所示,將馬達、發光二極體、光電 二極體組合成光遮斷器。當馬達運轉時,安
另一重要的基本分析為熱值 (heating value) 測量,藉 由熱卡計以得知該燃料單位質量反應後釋放之熱量;其 又分成高位發熱值 (higher heating value, HHV) 與低 位發熱值
紅外線發光二極體的發射強度因發射方向而異
回顧樣本背光模組中的導光板設計,其 Face6 散射點佈放面,由 大小不同的散射點控制。Face1 光源入射面有 V 型槽結構,其 V 型 槽方向為平行 X 軸方向;Face5 導光板出光面亦有
本研究在有機物部分,除藉由螢光光譜儀進行螢光激發發射光 譜圖(Excitation emission fluorescent matrix,