碩士論文
Department of Biochemical Science and Technology College of Life Science
National Taiwan University Master Thesis
不同葉酸含量對高油飲食小鼠腎臟的影響 Effects of high-fat diet and folate status on kidney
辜祥霖 Xiang-Lin Koh
指導教授:林璧鳳博士 Advisor: Bi-Fong Lin, Ph.D.
中華民國 105 年 8 月
Aug, 2016
摘要
台灣的末期腎臟病發生率自 2001 年十年以上排名世界之冠,現代化生活的飲 食型態趨向於高油低蔬果,是否葉酸營養會影響腎健康議題值得探討。有研究指出 人體血液葉酸含量與慢性腎衰竭發生率呈負相關,因此,本研究探討葉酸對高油誘 發肥胖小鼠的腎臟之影響。實驗方法先以不同葉酸含量培養小鼠腎間膈細胞株 MES-13,測定細胞分泌促發炎細胞激素的含量是否受葉酸缺乏影響,並且分析高 油誘發肥胖小鼠的腎臟發炎相關基因表現與葉酸的相關性。進而以實驗動物,分別 給 C57BL/6J 公鼠正常油脂 (NF-f1) 組與不同葉酸含量的高油飲食:葉酸缺乏組 (HF-f0)、葉酸 1 倍組(HF-f1)與葉酸 10 倍組(HF-f10),分組餵飼 48 週時給予馬兜鈴 酸三週後犧牲,測定血液、脾臟與腎臟發炎細胞激素和促纖維化指標 TGF-β 與 galectin-3、及腎臟組織切片觀察。結果顯示,小鼠腎間膈細胞株 MES13 在 LPS (lipopolysaccharide)刺激下,葉酸缺乏時,顯著分泌較高的 IL-6 與 MCP-1。高油誘 發肥胖小鼠之腎臟 Il-6 基因表現量,也與血液葉酸含量呈負相關 (r=-0.69, p=0.002),
顯示葉酸缺乏可能促進腎臟發炎反應。並且,葉酸缺乏的高油肥胖小鼠 HF-f0 組有 顯著較高的發炎性細胞激素例如血清 IL-6,以及顯著的促纖維化指標,包括血清 和腎臟 galectin-3 含量、血清與腎臟以及脾臟細胞分泌的 TGF-β 含量。此外, HF- f0 組也有顯著較高的尿蛋白比值、腎病理組織染色的腎絲球面積較大、細胞浸潤 較多、以及基底膜增厚的現象。綜合以上結果顯示,葉酸缺乏可能促進高油誘發肥 胖小鼠的發炎反應與腎臟纖維化進展。
關鍵字: 高油誘發肥胖、葉酸缺乏、腎臟纖維化、TGF-β、galectin-3
Abstract
End-stage renal disease in Taiwan had the highest prevalence in the world for more than ten years since 2001. To study whether the folate status in high-fat diets with low vegetables and fruits intake in industrialized countries, which may be related to kidney disease. It has been reported that there was a negative correlation between human serum folate concentration and chronic kidney failure. This study aimed to investigate the effects of folate deficiency on kidney in high-fat diet mice. First, MES-13 mesangial cells were used to investigate the influence of different folate status on the secretion of pro- inflammatory cytokines in vitro. Also, analysing the correlation between renal gene expression of inflammation-related cytokines and serum folate concentration in high-fat fed mice. Next, C57BL/6 male mice fed with normal-fat diet (NF-f1) and high-fat diet were divided into three groups randomly: no folate (HF-f0) as folate deficient group, 2 mg folate/kg diet as a control group (HF-f1), and 20 mg folate/kg diet as high folate group (HF-f10). Mice were sacrificed at week 51 after giving 3 weeks aristolochic acid in the high-fat diet and analyzed (1) Cytokines from blood, splenocytes, kidney, and (2) TGF- β, galectin-3 from blood, kidney, (3) Histological sections of the kidney. Results indicated that folate deficiency group had higher secretion of IL-6 and MCP-1 in LPS stimulated MES-13. There was a negative correlation between serum folate concentration and renal il-6 mRNA gene expression in 20 weeks high-fat diet mice (r=-0.69, p=0.002). Also, folate deficiency group had higher serum IL-6, galectin-3 in blood and kidney, TGF-β in blood, splenocytes, kidney and had higher urine protein/creatinine ratio, In addition, glomerular sections were expanded, elevated cellular infiltration and glomerular basement membrane expansion in the folate deficiency group. In conclusion, folate deficiency may promote the inflammatory response and renal fibrosis progression.
Keyword: high-fat-diet induced obesity, folate deficiency, renal fibrosis, TGF-β, galectin-3
目錄
摘要 ... i
Abstract ... ii
圖目錄 ... v
表目錄 ... vi
縮寫對照表 ...vii
第一章、緒論 ... 1
第一節 文獻回顧 ... 1
一、慢性腎臟疾病 ... 1
二、肥胖 ... 9
三、葉酸 ... 11
第二節、研究動機與架構 ... 14
第二章、葉酸含量對腎間膈細胞 MES-13 與高油飲食小鼠腎臟促發炎細胞激素基因表現 量的影響 ... 17
第一節、前言 ... 17
第二節、材料與方法 ... 18
一、細胞實驗 ... 18
二、動物飼養 ... 19
三、腎間膈細胞之細胞激素測定 ... 20
四、腎臟組織基因表現量分析 ... 22
五、統計方法 ... 24
第三節、結果與討論 ... 25
(一) 葉酸含量對 MES-13 小鼠腎間膈細胞分泌細胞激素的影響 ... 25
(二) 葉酸含量對小鼠腎臟發炎與纖維化相關細胞激素基因表現量的影響... 26
第三章、葉酸含量對高油飲食小鼠腎損傷的影響 ... 31
第一節、前言 ... 31
第二節、材料與方法 ... 32
一、動物飼養 ... 32
二、血清葉酸濃度測定 ... 33
三、血糖分析 ... 35
四、血脂質分析 ... 35
五、肝臟脂質萃取與測定 ... 36
六、血液與腎臟組織 galectin-3 含量測定 ... 36
七、組織細胞單離培養 ... 36
八、組織、血清與細胞之細胞激素測定 ... 37
九、尿液 creatinine 含量測定 ... 38
十、尿液或腎臟組織蛋白質測定 ... 38
十一、血清 BUN 測定 ... 39
十二、組織染色切片 ... 39
十三、統計方法 ... 39
第三節、結果與討論 ... 40
(實驗一) ... 40
(一) 不同葉酸含量之高油飲食小鼠添加 AA 後的體重與生命期 ... 40
(二) 不同葉酸含量高油飲食小鼠添加 AA 後的腎臟損傷情形 ... 43
(三) 不同葉酸含量高油飲食小鼠添加 AA 後的肝臟脂質代謝情形 ... 46
(實驗二) ... 48
(一) 高油飲食小鼠體重與器官重量 ... 48
(二) 小鼠禁食血糖、血脂及血清葉酸含量 ... 51
(三) 高油飲食小鼠的尿蛋白比值 ... 52
(四) 小鼠血清發炎和纖維化指標以及肌酸酐的含量 ... 53
(五) 小鼠腎臟細胞激素含量與組織切片染色 ... 54
(六) 小鼠脾臟細胞和腹腔細胞分泌細胞激素的能力 ... 56
(七) 小鼠血清葉酸與腎損傷指標的相關性 ... 60
第四章、綜合討論與總結 ... 64
第五章、參考文獻 ... 67
附錄 ... 74
圖目錄
圖 1-1. 腎元基本構造 ... 2
圖 1-2. 免疫細胞在慢性腎臟疾病扮演的角色 ... 4
圖 1-3. 不同型態巨噬細胞對慢性腎臟疾病的影響機制 ... 5
圖 1-4. 肥胖對慢性腎臟疾病的作用 ... 10
圖 1-5. 葉酸之化學結構 ... 11
圖 1-6. 每日葉酸攝取和血液葉酸含量與腎絲球過濾率相關性 ... 13
圖 2-1. 細胞實驗設計 ... 18
圖 2-2. 動物實驗設計 ... 19
圖 2-3. 不同葉酸含量對 MES-13 小鼠腎間膈細胞株分泌 MCP-1 與 IL-6 的影響... 25
圖 2-4. 不同葉酸含量高油飲食對小鼠腎臟發炎與纖維化相關細胞激素基因表現量的 影響 ... 26
圖 2-5. 不同葉酸含量高油飲食對小鼠血液葉酸含量與腎臟 IL-6 基因表現量的相關性 ... 27
圖 2-6. 葉酸缺乏高油飲食小鼠的腎臟發炎相關基因表現量之間的相關性 ... 28
圖 2-7. 葉酸一倍高油飲食小鼠的腎臟發炎相關基因表現量之間的相關性 ... 29
圖 2-8. 葉酸十倍高油飲食小鼠的腎臟發炎相關基因表現量之間的相關性 ... 30
圖 3-1. 實驗設計 ... 32
圖 3-2. 馬兜鈴酸對不同葉酸含量高油飲食與正常油脂飲食小鼠體重的影響 ... 41
圖 3-3. 馬兜鈴酸對不同葉酸含量高油飲食與正常油脂飲食小鼠存活率的影響 ... 42
圖 3-4. 不同葉酸含量高油飲食與正常油脂飲食小鼠血清葉酸濃度 ... 42
圖 3-5. 馬兜鈴酸對正常油脂飲食與不同葉酸含量高油飲食小鼠的尿蛋白比值的影響 ... 44
圖 3-6. 馬兜鈴酸對不同葉酸含量高油飲食小鼠尿蛋白比值與血清尿素氮的影響 .... 45
圖 3-7. 不同葉酸含量高油飲食小鼠腎臟組織切片染色的影響 ... 45
圖 3-8. 不同葉酸含量高油飲食小鼠的肝臟組織切片染色 ... 46
圖 3-9. 不同葉酸含量高油飲食 51 週對小鼠體重的影響 ... 48
圖 3-10. 不同葉酸含量高油飲食對小鼠腹睪脂堆積情形 ... 49
圖 3-11. 不同葉酸含量高油飲食小鼠 ... 51
圖 3-12. 不同葉酸含量高油飲食對小鼠尿蛋白比值的影響 ... 52
圖 3-13. 不同葉酸含量對高油飲食小鼠 3 週 AA 後腎臟組織切片染色 ... 55
圖 3-14. 不同葉酸含量對高油飲食小鼠 3 週 AA 後血液葉酸含量與腎損傷之相關性 ... 63
表目錄
表 1-1.2002 美國 K/DOQI 對慢性腎臟病的準則 ... 3
表 2-1.AIN-93G 飼料組成表... 20
表 3-1.AIN-93G 飼料組成表... 33
表 3-2. 不同葉酸含量高油飲食小鼠器官重量 ... 41
表 3-3. 不同葉酸含量高油飲食與正常油脂飲食對小鼠脂質代謝的影響 ... 46
表 3-4. 不同葉酸含量對高油飲食小鼠 3 週 AA 後的器官重量 ... 50
表 3-5. 不同葉酸含量對高油飲食小鼠 3 週 AA 後血清發炎和纖維化指標以及肌 酸酐含量的影響 ... 53
表 3-6. 不同葉酸含量對高油飲食小鼠 3 週 AA 後腎臟促發炎、抗發炎與促纖維 化細胞激素含量的影響 ... 54
表 3-7. 不同葉酸含量對高油飲食小鼠 3 週 AA 後脾臟細胞分泌 Th1 與 Th2 細胞 激素的能力 ... 56
表 3-8. 不同葉酸含量對高油飲食小鼠 3 週 AA 後脾臟細胞分泌促發炎與調節型 與 Th17 細胞激素的能力 ... 58
表 3-9. 不同葉酸含量對給予 3 週 AA 高油飲食小鼠腹腔細胞分泌細胞激素的能 力 ... 59
表 3-10. 葉酸缺乏高油飲食小鼠血清葉酸與腎臟發炎相關細胞激素含量之間的相 關性 (HF-f0/AA) ... 61
表 3-11. 不同葉酸高油飲食小鼠血清葉酸與腎臟發炎相關細胞激素含量之間的相 關性 (HF-f1/AA 與 HF-f10/AA) ... 62
縮寫對照表
縮寫 全名
BUN Blood Urea Nitrogen BW Body weight
CKD Chronic Kidney Disease CRP C-reactive protein Ccr Creatinine clearance ESRD end-stage renal disease FBP folate binding protein
FDA Food and Drug Administration Gal-3 galectin-3
GFR glomerular filtration rate HIF-1 hypoxia-inducible factors-1 IL-1β interleukin-1β
K/DOQI Kidney Disease Outcomes Quality Initiative mRNA messenger RNA
MCP-1 monocyte chemoattractant protein-1 NTD neural tube defect
ROS reactive oxygen species Th T helper cells
TLR-4 Toll-like receptor 4
TGF-β transforming growth factor-β Treg Regulatory T cell
TNF-α tumor necrosis factor-alpha
第一章、 緒論 第一節 文獻回顧
一、慢性腎臟疾病 (Chronic Kidney Disease, CKD)
(一) 腎臟的構造與功能
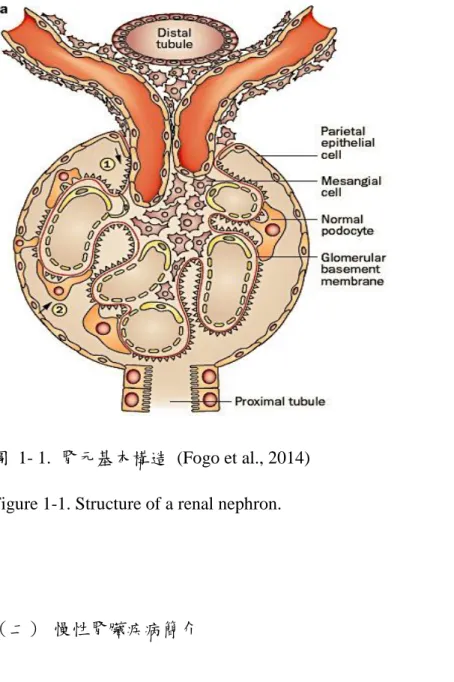
腎臟屬於泌尿系統的一部分,維持細胞外體液和電解質的平衡,負責過濾血 液中的含氮物質。同時也調節內分泌系統與血壓的功能。腎臟位於人體腹腔兩側後 方肋骨旁下緣,外形似蠶豆狀,大小跟拳頭接近,每顆腎臟重量約為 125-150 公 克。腎臟組織中由約100萬個腎元 (nephrons) 所構成,腎元的構造如圖1-1,腎元由 腎 絲 球 (glomerulus) 與 腎 小 管 (tubule) 共 同 組 成 。 腎 絲 球 內 含 腎 間 膈 細 胞 (mesangial cell)、足細胞 (podocyte)、腎絲球基底膜 (glomerular basement membrane) 共同維持腎臟過濾功能。而腎小管由近曲小管 (proximal tubule)、亨氏管 (loop of Helen)、遠曲小管 (distal tubule) 和集尿管 (collecting duct) 共同組成,維持腎臟再 吸收 (reabsorption) 與分泌作用 (secretion) 功能。
當血液流經腎絲球進行過濾 (filtration) 後,隨之流入鮑氏囊 (Bowman’s capsule) 形成濾液,濾液會再流向腎小管進行營養素的再吸收,最終形成尿液由膀 胱排出體外;過程中的腎絲球過濾率 (glomerular filtration rate,GFR) 可作為腎功 能評估指標之一。在生理功能上,腎臟主要負責: (1) 血流量的調控、(2) 血紅素形 成、(3) 電解質與滲透壓的恆定、(4) 血壓的調節、(5) 排除含氮代謝物與藥物或毒 素、(6) 骨骼發育、(7) 將維生素D轉變成活化態型式、與(8) 荷爾蒙製造等等。
圖 1- 1. 腎元基本構造 (Fogo et al., 2014) Figure 1-1. Structure of a renal nephron.
(二) 慢性腎臟疾病簡介
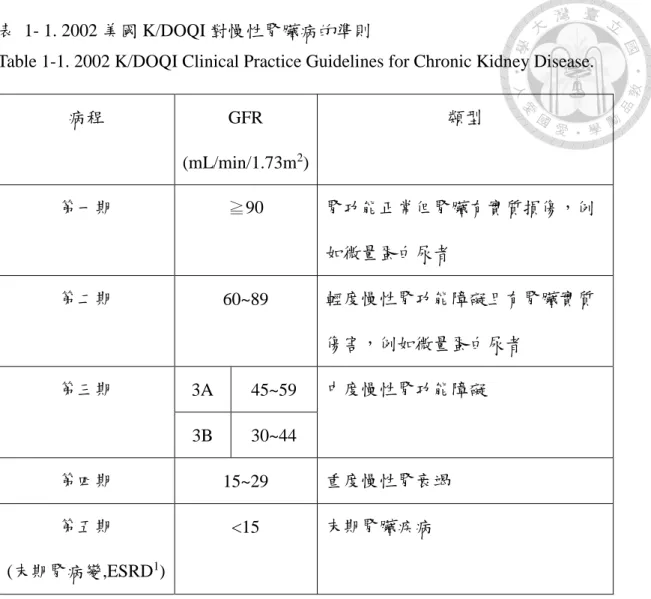
「慢性腎臟病」的定義為經診斷檢查,由病理組織學或影像學檢查腎臟結構或 血液 BUN 或尿液檢查尿蛋白有異常發現。依據腎絲球過濾率 (glomerular filtration rate , GFR) 小於每分鐘 60 毫升 (mL/min/1.73m2) 持續 3 個月或以上,對慢性腎臟 疾病進行疾病程度分類,而訂定出 Kidney Disease Outcomes Quality Initiative (K/DOQI) (表 1-1)。慢性腎臟疾病發生初期無明顯症狀,可能僅有些微量白蛋白隨 尿液中排出,後期會出現持續性尿蛋白、下肢水腫、易感全身疲倦、貧血與高血壓 等現象的出現。GFR 數值逐漸下降,亦表示腎功能逐漸衰竭中,最終引發末期腎 衰竭,需通過血液透析或腎臟移植維持腎功能。
表 1- 1. 2002 美國 K/DOQI 對慢性腎臟病的準則
Table 1-1. 2002 K/DOQI Clinical Practice Guidelines for Chronic Kidney Disease.
病程 GFR
(mL/min/1.73m2)
類型
第一期 ≧90 腎功能正常但腎臟有實質損傷,例
如微量蛋白尿者
第二期 60~89 輕度慢性腎功能障礙且有腎臟實質
傷害,例如微量蛋白尿者
第三期 3A 45~59 中度慢性腎功能障礙
3B 30~44
第四期 15~29 重度慢性腎衰竭
第五期
(末期腎病變,ESRD1)
<15 末期腎臟疾病
1ESRD : end-stage renal disease
(三) 慢性腎臟發炎反應
發炎反應是人體與生俱來的免疫保護機制。當體內受到外來抗原入侵時,便 會啟動先天性免疫反應,產生一連串非特異性之防禦機制來清除抗原與修復受損 組織。受損的組織一旦釋出組織胺 (histamine)、趨化素 (chemokine) 等趨化因子,
將吸引免疫細胞聚集於受損部位,過程中微血管之通透性增加,也更有助於免疫細 胞的浸潤。免疫細胞活化後釋出了非專一性的殺菌分子,這些分子會間接破壞組織 的完整性,導致組織腫脹並壓迫神經,產生紅、腫、熱、痛之現象。
在慢性腎臟疾病中,早期浸潤的嗜中性白血球 (neutrophil)、自然殺手细胞(NK cell)、輔助T细胞 (T helper cells,Th) Th1與Th17等活化促發炎型態M1巨噬細胞 (macrophage) 分泌促發炎細胞激素影響病情 (圖1-2)。一旦腎臟組織中M1巨噬細 胞受到活化將分泌促發炎激素: tumor necrosis factor-alpha (TNF-α)、interleukin-1β (IL-1β)、IL-6、IL-23、reactive oxygen species (ROS) 與monocyte chemoattractant protein-1 (MCP-1)等,最終促使發炎反應加劇,更加惡化病情 (Cao et al., 2015)。
Horii等學者 (1993) 的研究指出,腎臟中腎絲球基底膜增厚、腎小管腫大與細 胞間質構造損傷等病變的出現,皆與腎臟中IL-6 mRNA 基因表現呈正相關; 且腎 臟組織切片發現,組織的受損程度與尿液的IL-6排出量呈正相關。MCP-1為一種具 吸引巨噬細胞與單核球聚集於受損組織的趨化素,腎臟中的腎間膈細胞可分泌 MCP-1,研究指出腎間膈細胞中MCP-1表現量增加,會加劇糖尿腎病變的進展 (Banba et al., 2000)。綜合以上,發炎反應在慢性腎臟疾病的進程中扮演了重要的角 色。
圖 1- 2. 免疫細胞在慢性腎臟疾病扮演的角色 (Cao et al., 2015) Figure 1-2. Role of macrophage in chronic kidney disease.
(四)慢性腎臟纖維化反應
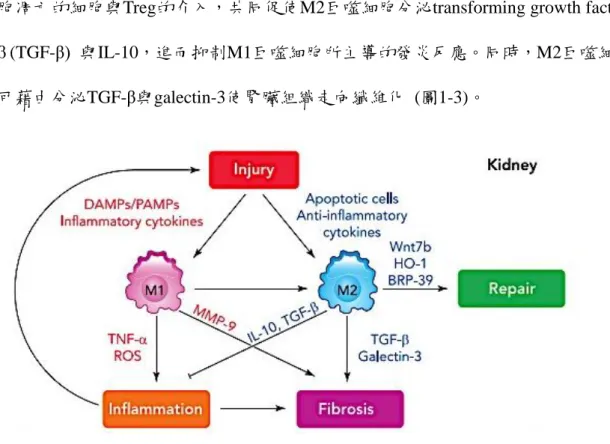
慢性腎臟疾病後期會有Th2與Treg (調節型T細胞,Regulatory T cell) 細胞浸潤 到腎臟組織中進行免疫反應的調控,藉由Th2分泌的IL-4與Treg分泌的IL-10共同促 使抗發炎M2巨噬細胞的活化,以減緩腎臟微環境的發炎反應。一旦發炎反應無法 有效的受到調控時,持續的發炎反應與促纖維化因子 (例如: TGF-β與galectin-3等) 的介入,最終促使腎臟走向纖維化的路徑。慢性腎臟疾病後期,巨噬細胞吞噬了細 胞凋亡的細胞與Treg的介入,共同促使M2巨噬細胞分泌transforming growth factor- β (TGF-β) 與IL-10,進而抑制M1巨噬細胞所主導的發炎反應。同時,M2巨噬細胞 可藉由分泌TGF-β與galectin-3使腎臟組織走向纖維化 (圖1-3)。
圖 1- 3. 不同型態巨噬細胞對慢性腎臟疾病的影響機制 (Cao et al., 2015)
Figure 1-3. The mechanism of different types of macrophage in chronic kidney disease.
(五) 慢性腎臟疾病生化指標
判別慢性腎臟疾病的發生除了腎絲球過濾率之外,也可藉由尿蛋白、血液肌 酸酐 (serum creatinine) 與血液尿素氮 (blood urea nitrogen) 含量反應腎功能。當腎 絲球功能正常但近曲小管 (proximal tubules) 的吸收能力下降時,尿液中可能有尿 蛋白的出現。隨著慢性腎臟疾病病情的進展,會有更多的白蛋白 (albumin) 經由尿 液 排 出 體 外 , 此 階 段 稱 為 巨 量 白 蛋 白 尿 (macroalbuminuria) 或 蛋 白 尿 (albuminuria)。蛋白尿為腎病變發生時第一表徵,臨床評估上以檢測微蛋白尿作為 早期篩檢指標 (Rabkin, 2003)。腎臟具有排除體內代謝含氮物質的重要器官,可調 節與維持血液中化學物質之組成與濃度。當腎功能下降時,血液中的含氮物質無法 有效的被排出體外,造成血液循環中累積過多的含氮物質與代謝產物 (尿素氮與肌 酸酐)。因此評估早期腎功能時,血液尿素氮、血液肌酸酐與蛋白尿 (urinary albumin excretion, UAE) 可作為簡易檢測指標 (Dabla, 2010) 。
(六)常見誘發腎損傷的動物模式
利用動物模式可以模擬人類腎臟疾病的進程與機制,以下為幾種常見誘發腎 損傷動物模式。
1. 輸尿管梗阻 (Unilateral Ureteric Obstruction)
輸尿管梗阻,Unilateral Ureteric Obstruction (UUO) 為最常見誘發慢性腎臟疾 病動物模式之一。優點為能反覆重複,因不受動物個體差異而影響誘發情形,且短 時間與易操作 (Hewitson et al., 2007)。經外科手術施壓於輸尿管對動物造成腎臟損 傷,會促進renin-angiotensin system運作使腎臟血管收縮,且增加巨噬細胞浸潤與腎
小管細胞凋亡,最終腎功能下降 (Chevalier et al., 2006)。此動物模式缺點為 (1) 剩 餘腎臟功能補償受影響的腎功能,而導致無法精準測量腎功能改變情形,(2) UUO 動物模式造成的腎功能過於快速流失,將無法有效觀察實驗組介入的結果。
2. 部份腎切除 (Sub-total Nephrectomy)
Sub-total Nephrectomy,又稱5/6腎切除,動物模式多以大鼠進行操作,而小鼠 較不易進行 (Strauch et al., 1988)。5/6腎切除是指經外科手術將一邊腎臟完全切除,
另一邊切除2/3組織,使腎功能迅速下降。
3. 缺血性急性腎臟衰竭 (Ischemic Acute Renal Failure)
Ischemic Acute Renal Failure (IARF),缺血性急性腎臟衰竭是經外科手術方式 將腎臟動脈阻斷血流供應,而造成嚴重腎臟損傷 (Forbes et al., 2001)。此動物模式 最常用於研究成人族群急性腎臟衰竭的發生 (Molitoris et al., 1998)。缺點為手術過 程中必須準確控制缺血時間,與實驗動物品系和年齡,些許差異都會對實驗誘發造 成很大的影響。
4. 腎小管毒性藥物 (Tubular Toxins-Cisplatin)
Cisplatin為一種高度抗腫瘤生長的化療藥物,但對1/3使用過的病人具腎毒性 (Razzaque et al., 2007)。 利用intraperitoneal (IP) 方式注射 (6-20 mg/Kg body weight) (Wei, Q et al., 2005; Deng, J et al., 2001) 的劑量。Cisplatin經由腎小管吸收,促使上 皮細胞凋亡與壞死,以及腎小管功能喪失 (Lee, S et al., 2006),實驗操作方法簡單 與易重複,反覆注射於實驗大鼠體內將導致發炎反應與纖維化的發生 (Yamate, J et
5. 高劑量葉酸致腎小管阻塞 (Tubular Obstruction- Folic Acid)
高劑量葉酸以IP (intraperitoneal) 方式注射於小鼠,將在腎小管迅速形成葉酸 晶體,最終導致急性腎小管受阻塞而壞死與纖維化 (Yuan et al., 2003)。
6. 藥物誘發第一型糖尿腎病變模式 (Metabolic Models- Models of Type 1 Diabetes) 利用STZ (streptozotocin),一種與葡萄糖結構相似的化合物,能經由GLUT 2 運輸進入胰臟β-細胞,而對細胞DNA直接進行破壞,最終破壞胰臟β-細胞的功能。
喪失了功能的β-細胞,無法分泌insulin調控體內血糖的平衡,而產生高血糖現象 (hyperglycemia)。在大鼠實驗中經由尾巴靜脈注射STZ誘發第一型糖尿病。GLUT 2 不只表現於胰臟β-細胞,也表現於肝臟與腎臟細胞,因此實驗過程中不只高血糖現 象對腎臟產生傷害,STZ的毒性也直接作用在肝臟與腎臟,需小心監控誘發劑量 (Hewitson et al., 2009)。
7. 高油導致肥胖誘發第二型糖尿腎病變模式 (Metabolic Models- Models of Obesity and Type 2 Diabetes)
人類第二型糖尿病通常發生於肥胖與胰島素抗性族群,第二型糖尿病病情嚴 重最終可能導致糖尿腎病變,因長期高血糖可能促使尿蛋白增加與腎絲球受損。經 由動物模式誘發肥胖能夠了解人類第二型糖尿病的發生與機制,給予C57BL/6小鼠 高油飲食誘發肥胖與胰島素抗性為最常見動物模式,但誘發高血糖之C57BL/6小鼠 隨著老化血糖有隨之趨近正常的現象 (Breyer et al., 2005)。
8. Aristolochic Acid Nephropathy (AAN)
Aristolochic acid nephropathy (AAN),據文獻報導馬兜鈴酸存在於中國、日本 與印度的傳統民俗用藥。利用馬兜鈴酸 (aristolochic acid) 能誘發快速且持續性腎 間質腎炎與腎纖維化,而最終導致慢性腎臟疾病的動物模式 (Debelle et al., 2008)。
二、肥胖
(一) 高油飲食對肥胖與發炎反應的影響
當熱量攝取過多的情形下,脂肪細胞過度的脂質堆積及脂肪細胞不斷的增大,
即是肥胖的產生。肥胖者體內過多的脂肪使人體處於慢性且低程度發炎的狀態,脂 肪細胞出現局部缺氧 (microhypoxia) 的情形會造成細胞壓力增加,使脂解作用 (lipolysis) 旺盛,造成游離脂肪酸 (free fatty acid, FFA) 大量增加,進而活化 HIF- 1 (hypoxia-inducible factors-1)的基因表現。活化後的 HIF-1 與 JNK-1 和 IKK/NF- κB,共同使得發炎相關的基因表現量增加而生成大量促發炎細胞激素釋出 (Fantuzzi, 2005)。
巨噬細胞可藉由分泌趨化素和促發炎細胞激素,聚集更多的巨噬細胞到脂肪 細胞處。脂肪細胞與巨噬細胞之間的交互作用 (cross-talk) 加劇了脂肪細胞的發炎 反應 (Strissel, et al., 2007; Trayhurn, et al., 2008; Schenk, et al., 2008)。研究指出,
FFA 可經由 PKC 或 Toll-like receptor 4 (TLR-4) 等路徑活化下游的 NF-κB 與 IKK,
誘使發炎反應 (Gao, et al., 2004; Shi, et al., 2006)。
(二) 肥胖對慢性腎臟疾病的影響
肥胖個體脂肪組織中游離脂肪酸量的增加及 adiponectin 量的減少,除了會影 響葡萄糖代謝,造成胰島素阻抗、高胰島素血症、糖尿病,還會刺激交感神經對血 管的收縮,造成血壓上升,而影響腎功能 ( Brown et al., 2000; Goldstein et al., 2004)。
肥胖過程中,增大的脂肪細胞分泌出促發炎激素如: IL-6、TNF-α 等,促使體內傾 向發炎反應,在長期影響之下,最終可能導致腎臟發炎、腎絲球病變與腎小管纖維 化的出現 (圖 1-4)。
圖 1- 4. 肥胖對慢性腎臟疾病的作用 (Felizardo, R.J.F. et al., 2014) Figure 1-4. Effects of obesity on chronic kidney disease
三、葉酸
(一) 葉酸簡介
葉酸為水溶性維生素 B 群之一。自然界中天然型態的葉酸以 pteroyl glutamic acid 存在,在中性或偏鹼性液中較為穩定,對光敏感度高。葉酸主要基本結構由蝶 啶 (pteridine 或 pterin)、對胺基苯甲酸 (para-aminobenzoic acid, pABA) 以及多個 麩胺酸鏈 (glutamic acid) 三部分組成 (圖 1-5)。因哺乳類動物和人類缺乏相關酵素 將 pterin 與 pABA 連接起來合成 pteroic acid,導致人類無法自行合成葉酸,必需經 由膳食或其它途徑中攝取足夠的葉酸。自然界中葉酸的食物來源主要來自於深綠 色蔬菜、豆類、酵母、小麥胚芽、水果、蘆筍等。
圖 1- 5. 葉酸之化學結構 (Tam, 2012) Figure 1-5. Folate structure.
葉酸在人體細胞中參與多條生化代謝路徑,扮演了重要輔酶的角色、負責單碳 代謝利用、用於合成體內 thymidine 與 purine,為細胞增生時 DNA 複製的原料,
也提供甲基使同半胱胺酸合成甲硫胺酸、協助胺基酸如組胺酸 (histidine) 的代謝 等;此外,懷孕婦女長期葉酸攝取不足可能與胚胎的神經管發育不全 (neural tube
defect, NTDs) 有關,葉酸的補充能有效的預防此疾病的發生 (Blom et al., 2006)。
葉酸在體內廣泛參與 DNA、RNA 的合成,對血球的分化成熟,胎兒的血球增生與 神經發育皆有重大的影響。
美國食品藥物管理局 (U.S. Food and Drug Administration, FDA) 在 1998 年實 施在添加 140 mg/100g 的葉酸含量,以便強化美國人的葉酸營養狀況,希望透過此 一政策降低新生兒的神經管缺陷風險。根據台灣行政院衛生署 (現為衛生福利部) 於 2011 年所公布的「國人膳食營養素參考攝取量修訂版第七版」的建議,成年男 女每日建議攝取量為 400 µg、孕期為 600 µg、哺乳期為 500 µg。
(二) 葉酸與免疫反應
葉酸參與細胞增生及DNA的合成,影響細胞分裂的進行。早期有研究指出,
葉酸缺乏的巨球型貧血症的患者,體內免疫反應有受到影響與抑制 (Gross et al., 1975)。由於葉酸參與體內thymidine與purine的內生性合成,當體內葉酸缺乏時會減 低DNA的複製與其穩定性,而降低多種免疫細胞的增生反應,包括T淋巴球、B淋 巴球、自然殺手細胞與顆粒球等免疫細胞 (Courtemanche, 2004; Abe, 2012)。Kolb AF 及 Petrie L 在 (2013) 年 指 出 , 在 缺 乏 葉 酸 的 條 件 下 培 養 小 鼠 巨 噬 細 胞 株 RAW264.7,發現當細胞內葉酸濃度降低時,RAW264.7生長速率減緩,且促發炎介 質包括IL-1β、IL-6、TNF-α和MCP1的RNA及蛋白質表現量皆較高。綜合以上,葉 酸的缺乏對於發炎反應與免疫細胞有很大的影響,顯示葉酸在體內免疫反應扮演 重要角色。
動物實驗方面,有研究給予雄性 Sprague-Dawley大鼠45天葉酸缺乏飲食,大 鼠血清的MCP-1顯著上升 (Li et al., 2007)。人體實驗方面,發現給予BMI介於25至
29 kg/m2的肥胖受試者補充12週葉酸後,血清MCP-1與急性蛋白CRP (C-reactive protein) 含量減低,且胰島素抗性也獲得改善 (Solini et al., 2006),顯示葉酸補充可 能減緩肥胖者體內發炎反應。Duthie學者 (2010) 的實驗結果,也發現血中的葉酸 含量與補體蛋白的含量有顯著正相關性。綜合以上,顯示葉酸對於免疫反應扮演重 要的角色。
(三) 葉酸與慢性腎臟病
Hassan 學者在 2015 年發現飲食和血中的葉酸含量與腎絲球過濾率呈負相關,
意味著飲食中葉酸攝取越少,慢性腎臟疾病病情越嚴重 (圖三)。Zhang 等學者在 2010 年指出,給予經單一腎切除的 Sprague-Dawley 大鼠 6 週缺乏葉酸飲食,發現 大鼠 24 小時尿液中尿蛋白 (urine albumin) 含量較正常飲食大鼠組更高,且尿液肌 酸酐廓清率 (creatinine clearance, Ccr) 較低,顯示了葉酸缺乏的飲食會促使腎功能 下降。
圖 1- 6. 每日葉酸攝取和血液葉酸含量與腎絲球過濾率相關性 (Hassan, 2015) Figure 1-6. Correlation between daily intake of folic acid and serum folic acid in estimated glomerular filtration rate.
CKD: Chronic Kidney Disease
第二節、研究動機與架構
一、研究動機
現代化生活的飲食型態趨向於高油低蔬果,且生活型態改變,使得活動量減少,
導致過重與肥胖發生率逐年升高 (Lin YC et al., 2003)。長期的飲食不均衡,導致許 多慢性疾病的發生,例如肥胖性高血壓與慢性腎臟疾病等。
台灣的肥胖人數日益增加,2002年的全國性抽樣報告指出,5,936 位成人,有 25.8%為過重,16.4%為肥胖 (Hwang LC et al., 2006)。肥胖所帶來的慢性疾病,耗 費許多醫療資源和人力,對國家、家庭及個人財務上造成很大的負擔,故慢性疾病 所衍生的問題是不容忽視的,尤其是肥胖導致的長期高血糖,所衍生的併發症,例 如腎臟病。
台灣洗腎人口高居世界第一。根據衛生福利部公佈的102年十大死因排名,慢 性腎臟病(包括腎炎、腎徵症候群及腎性病變)是目前台灣十大死因之一,每十萬 人口的死亡率由民國79年的11.4%逐年上升至102年的19.2% (附錄表一)。慢性腎 臟病長久以來一直是公共衛生單位關切之焦點,學者們致力於控制慢性腎臟病的 發病率,以減少洗腎人口數,降低台灣的死亡率。慢性腎臟病與許多其他十大死因 的慢性疾病的形成有關,例如糖尿病、高血壓、肥胖,皆有顯著相關性。長期高血 糖會使體內的氧化壓力增加,使體內一直處於發炎反應 (Wright et al., 2006)。 因 此糖尿病與慢性腎臟疾病的發生率皆會增加。 此外,腎臟的微小血管非常容易受 到高血壓的傷害,功能已經下降的腎臟更會因肥胖性血壓升高而大幅加速損害的 程度。控制收縮壓及舒張壓均能有效減緩高血壓帶給腎臟的傷害 (Hsu CY et al., 2009; Felizardo et al., 2014)。
當腎臟長期處於慢性發炎時會造成巨噬細胞的浸潤而使得發炎反應加劇 (Cao et al., 2015)。細胞實驗證實葉酸缺乏促使小鼠巨噬細胞株 RAW264.7 分泌促 發炎細胞激素 IL-6、TNF-α 和其他發炎介質基因表現量的增加 (Kolb AF., 2013),
且有公衛研究指出膳食中葉酸攝取量與腎絲球過濾率呈負相關 (Hassan, 2015)。本 實驗室在探討葉酸缺乏對 LPS 誘發急性發炎的研究中,發現葉酸缺乏增加肝臟組 織中 IL-6 與 IL-1β mRNA 的表現量 (修, 2015)。
故本次研究藉由不同葉酸含量的高油飲食,來探討葉酸在高油飲食所誘發的 腎臟疾病模式上所扮演的免疫角色。
二、研究架構
一、葉酸對腎間膈細胞 MES-13 與高油飲食小鼠腎臟促發炎細胞激素基因表現量 的影響
1. in vitro 實驗:
葉酸濃度對小鼠腎間膈細胞(mesangial cell) MES-13 細胞株分泌促發炎介質的 影響。
2. in vivo 實驗:
葉酸與高油飲食小鼠腎臟發炎相關基因表現的相關性。
二、葉酸含量對高油飲食小鼠腎損傷的影響
實驗一: 以馬兜鈴酸誘發餵食不同葉酸含量高油飲食小鼠的腎損傷
不同葉酸含量高油飼料飼養 C57BL/6J 小鼠 16 週後,添加馬兜鈴酸於飼料以 誘發腎損傷,觀察不同葉酸含量對高油飲食小鼠生命期、肝脂質堆積與腎損傷的影 響。
實驗二: 餵食不同葉酸含量之高油飲食對小鼠腎臟發炎與纖維化的影響
實驗一的未添加馬兜鈴酸小鼠於實驗進行第 48 週時給予馬兜鈴酸連續三週誘 發腎損傷,探討長期 51 週不同葉酸含量高油飲食對 C57BL/6J 小鼠腎發炎與腎纖 維化的的影響。
第二章、葉酸含量對腎間膈細胞 MES-13 與高油飲食小鼠腎臟促發炎 細胞激素基因表現量的影響
第一節、前言
腎臟腎間膈細胞表面有 TLR-4 (Toll-like receptor 4),且能分泌促發炎相關的細 胞激素。研究指出人類初代腎間膈細胞會藉由 TLR-4 的活化而啟動 NF-κB 的表現,
最終增加 MCP-1 基因表現量 (Chang et al., 2005),MCP-1 具有吸引單核球浸潤至 腎小管的作用,單核球附著到腎小管間質的內皮細胞,加劇腎臟發炎反應與促進腎 病變的進程 (Viedt et al., 2000)。
葉酸參與細胞 DNA 合成與生長,文獻指出葉酸具有抑制經 LPS 誘發子代 NTDs (neural tube defects) 疾病小鼠模式中,胎盤 JNK 磷酸化與 NF-κB 活性,進 而減少母體血清與胎盤中 TNF-α、IL-1β 和 IL-6 分泌量 (Zhao et al., 2014)。細胞實 驗證實葉酸缺乏促進小鼠巨噬細胞株 RAW264.7 分泌促發炎細胞激素 TNF-α、IL- 6 的表現量的增加 (Kolb AF., 2013),另有細胞實驗也指出高劑量葉酸能抑制 LPS 誘發的 MAPKs 磷酸化與 NF-κB 活性,進而減少促發炎細胞激素的分泌 (Feng et al., 2011) 。
本實驗室過去研究顯示,補充葉酸能降低小鼠腸道組織 TNF-α 與 IL-6 的分泌 量 (黃,2013)。在探討葉酸缺乏對 LPS 誘發急性發炎的研究中,發現葉酸缺乏小 鼠的肝臟組織中 IL-6 與 IL-1β mRNA 的表現量較高 (修,2015),顯示葉酸缺乏導 致體內有較高的發炎反應。
因此,本實驗利用 MES-13 腎間膈細胞株與高油飲食小鼠,初探葉酸對腎臟發 炎反應的影響。
第二節、材料與方法
一、細胞實驗
自食品工業發展研究所生資中心/國家衛生研究院細胞庫 (新竹,台灣) 購入,
生資中心編號 BCRC 60366,細胞株名稱 SV40 MES 13,組織來源為 glomerular mesangial cells from an SV40 transgenic mouse。培養基為 RPMI medium 1640 (11875- 085,Gibco), 95% 與 FBS 5% 以及 14 mM HEPES,培養條件為 37℃與 5%CO2環 境下。繼代培養方式為移除培養基,用 1×PBS 洗滌細胞 2 次後移去 PBS,加入 trypsin-EDTA 溶液,使其能 rinse 所有細胞後,移去 trypsin-EDTA,放在 37℃作用 5 分鐘後,輕拍培養瓶使細胞自瓶壁脫落,加入新鮮培養基,均勻混合後轉移至新 的培養瓶中。不同葉酸含量三組分別為: F0 為 RPMI medium 1640 without Folic Acid (27016-021,Gibco)、F1 為 RPMI medium 1640 與 F10 為 RPMI medium 1640 中額 外添加 9 倍葉酸粉末 (F8758-5G,Sigma)。
圖 2- 1. 細胞實驗設計
Figure 2-1. Cell culture experimental design
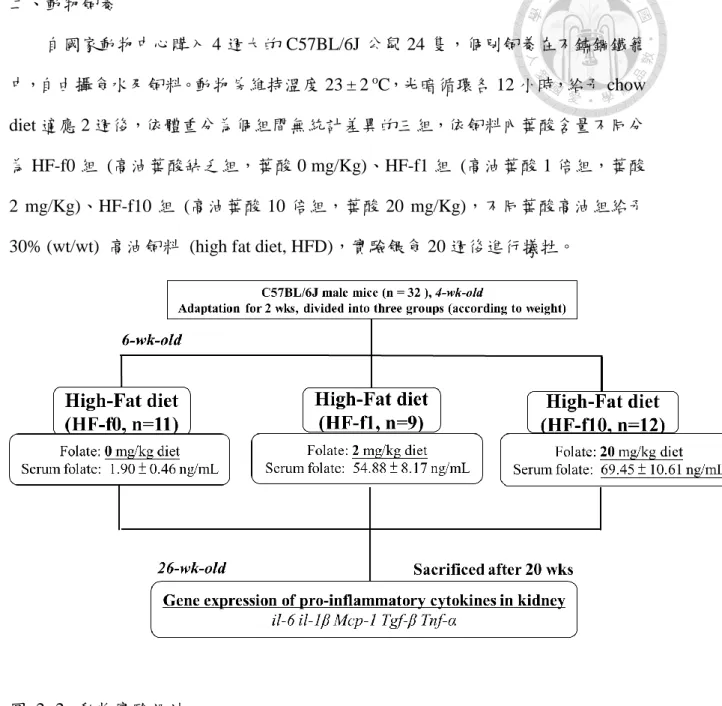
二、動物飼養
自國家動物中心購入 4 週大的 C57BL/6J 公鼠 24 隻,個別飼養在不鏽鋼鐵籠 中,自由攝食水及飼料。動物房維持溫度 23 ± 2 oC,光暗循環各 12 小時,給予 chow diet 適應 2 週後,依體重分為個組間無統計差異的三組,依飼料內葉酸含量不同分 為 HF-f0 組 (高油葉酸缺乏組,葉酸 0 mg/Kg)、HF-f1 組 (高油葉酸 1 倍組,葉酸 2 mg/Kg)、HF-f10 組 (高油葉酸 10 倍組,葉酸 20 mg/Kg),不同葉酸高油組給予 30% (wt/wt) 高油飼料 (high fat diet, HFD),實驗餵食 20 週後進行犧牲。
圖 2- 2. 動物實驗設計
Figure 2-2. Animal study experimental design
表 2- 1. AIN-93G 飼料組成表
Table 2-1. Ingredient of the modified AIN-93G diets.
成分 (g/kg diet) HF-f0 HF-f1 HF-f10
Casein (Sigma, C7078) 254 254 254
Cellulose (JRS PHARMA, Germany) 61 61 61
Sucrose (台糖精緻細砂) 321 321 321
Soybean oil (台糖) 10 10 10
Butter (安佳無水奶油) 290 290 290
AIN-93G mineral mix (MP Biochemicals) 44.5 44.5 44.5 AIN-93G vitamin mix w/o folic acid (MP Biochemicals) 12.5 12.5 12.5
L-cystine (Wako, Japan) 4 4 4
Choline (Sigma, C1879) 3 3 3
Folate, mg (Sigma, F7876) - 2 20
熱量 (kcal/1000g)
CHO/calorie (%) 25.6 25.6 25.6
Protein/calorie (%) 20.57 20.57 20.57
Fat/calorie (%) 53.83 53.83 53.83
三、腎間膈細胞之細胞激素測定
(一)eBioscience ELISA kit
【試劑】
1. Coating buffer:將 10x coating buffer 以一次水稀釋 10 倍。
2. Assay buffer:將 5x assay diluents buffer 以一次水稀釋 5 倍。
3. Wash buffer:添加 0.05% Tween 20 的 PBS
4. Capture antibody (1oAb):Purified anti-mouse MCP-1, TGF-β, IL-5, IL-17A 5. Detection antibody (2oAb): Biotin-conjugated anti-mouse MCP-1, TGF-β, IL-5,
IL-17A
7. 過氧化酵素基質液:Tetramethylbenzibine (TMB) 8. Stop solution:2N H2SO4
【方法】
於 96 孔盤中加入 100 μL 1oAb,於 4℃放置隔夜,以 PBST 清洗 4 次後以 200 μL assay buffer 進行 blocking 1 小時,清洗 5 次後加入以 assay buffer 稀釋的樣品及 標準品50 μL,反應 2 小時,清洗 6 次後加入 100 μL 2oAb 反應 1 小時,清洗 7 次 後再加入100 μL avidin-HRP,反應 30 分鐘後,清洗 8 次後加入 100 μL TMB,呈 色至適當顏色時,加入50 μL stop solution,測定 450 nm 吸光值。
(二)BioLegend ELISA kit
【試劑】
1. Coating buffer:將 5x coating buffer 以一次水稀釋 5 倍 2. Assay buffer:將 5x assay diluents buffer 以 PBS 稀釋 5 倍 3. Wash buffer:添加 0.05% Tween 20 的 PBS
4. Capture antibody (1oAb): Purified anti-mouse IL-6, IL-10, IL-1β, IFN-γ, TNF-α, IL-2, IL-4, IL-13
5. Detection antibody (2oAb):Biotin-conjugated Purified anti-mouse IL-6, IL-10, IL-1β, IFN-γ, TNF-α, IL-2, IL-4, IL-13
6. BioLegend Avidin-Horseradish Peroxidase (HRP):以 assay buffer 稀釋 1000 倍 7. 過氧化酵素基質液:Tetramethylbenzibine (TMB)
8. Stop solution:2N H2SO4
【方法】
於 96 孔盤中加入 100 μL 1oAb,於 4℃放置隔夜,以 PBST 清洗 4 次後以 200 μL assay buffer 進行 blocking 1 小時,清洗 4 次後加入以 assay buffer 稀釋的樣品及
後再加入100 μL avidin-HRP,反應 30 分鐘後,清洗 5 次後加入 100 μL TMB,呈 色至適當顏色時,加入50 μL stop solution,測定 450 nm 吸光值。
四、腎臟組織基因表現量分析
(一)總 RNA 之抽取
取約 0.1 g 腎臟,以 TRIzol reagent 均質至無大塊組織後,以 12000 g 離心 1 分 鐘,取上清液至滅菌的管內,加入等體積的絕對酒精後劇烈震盪,並將液體注入 Zymo-Spin IIC Columnin 中,置於 collection tube 上,以 12000 g 離心 1 分鐘後將 collumn 移到新的 collection tube 上,加入 RNA wash buffer 後離心 1 分鐘,直接在 膜上加入 DNase I cocktail 並置室溫反應 15 分鐘,離心 30 秒後加入 RNA prewash buffer 離心 1 分鐘,倒掉 collection tube 中的液體,重複此步驟。加入 RNA wash buffer 並離心 1 分鐘,倒掉管中的液體後再離心 2 分鐘以完全去除 wash buffer,之 後將 collumn 移到 RNase-free tube 上,加入 DNase/RNase free-H2O 於膜上,離心 1 分鐘後,取得總 RNA 溶液,以 NanoDrop 2000 Spetrophotometer 測定 RNA 濃度。
【試劑】
Direct-zolTMRNA MiniPrep kit (Cat. No 2052, Zymo Research, USA)
(二) 總 RNA 反轉錄成 cDNA
使用反轉錄試劑套組(High Capacity cDNA Archive Kit),將取得的總 RNA 溶液 以 DEPC 水稀釋至 0.2 μg/μL 後取 10 μL 的 RNA,加入 10X RT buffer 2 μL、25X dNTP mixture 0.8 μL、10X RT random primer 2 μL、無菌水 4.2 μL 與 RTase 1 μL,
總體積為20 μL(含 RNA 樣品),進行反轉錄,條件為 25°C10 分鐘,37°C 反應 120 分鐘,85°C5 秒鐘,最後冷卻至 4°C。
【試劑】
反轉錄試劑套組(High Capacity cDNA Archive Kit, P/N: 4368814, Applied Biosystems, USA)
(三) Real-time qPCR
利用 Taqman Universal PCR Master Mix 試劑分析,以 GAPDH 做為 internal control。將 cDNA 稀釋成 10 ng/μL 後取 10 μL 的樣品,加入 Taqman Universal PCR Master Mix 12.5 μL、Probe/primer mixture 1.25 μL、無菌水 1.25 μL,總體積為 25 μL,注入 96-well reaction plate 並封膜,將 plate 短暫離心後上機。上機條件為 50°C 2 分鐘 (stage 1)、95°C10 分鐘 (stage 2)、95°C15 秒 (stage 3)、60°C1 分鐘 (stage 4),再回到 (stage 3),重複 55 個循環。
【試劑】
1. TaqmanR Universal PCR Master Mix (2X, Part. No. K00861, Applied Biosystems) 2. Probes from Applied Biosystems, USA
a. TNF-α (Mm00443260_g1) b. IL-6 (Mm00446191_m1) c. IL-1β (Mm01336189_m1) d. MCP-1 (Mm00441242_m1) e. TGF-b1(Mm01178820_m1) f. GAPDH (Mm99999915_g1)
3. MicroAmpRFast 96-well reaction plate (Part No. 4346907, Applied Biosystems) 4. Optical Adhesive Covers (Part No. 4360954, Applied Biosystems)
5. ABI StepOnePlusTMReal-Time PCR System
【儀器】
核酸即時定量偵測系統(BioRad MyiQ)
(四) 計算
Ct 值(Threshold cycle):每個試驗的螢光訊號到達設定閾值所經過的循環數,若目 標基因在樣本中的含量越多,到達閾值所需的循環數越少,Ct 值越小。
1. Ct(目標基因) -Ct (Internal control) = ΔCt(sample) 2. ΔCt(sample)–ΔCt(mean of control) = ΔΔCt
3. 基因表現量以 2–ΔΔCt表示
五、統計方法
實驗數據以 Mean ± SD 表示,使用 Student’s t-test 或利用 SAS 9.3 軟體進行 ANOVA 分析,以 Duncan's multiple range test 進行多重比較。以*p < 0.05 表示顯著 差異與 0.05 < #p < 0.1 表示有趨勢。
第三節、結果與討論
(一) 葉酸含量對 MES-13 小鼠腎間膈細胞分泌細胞激素的影響
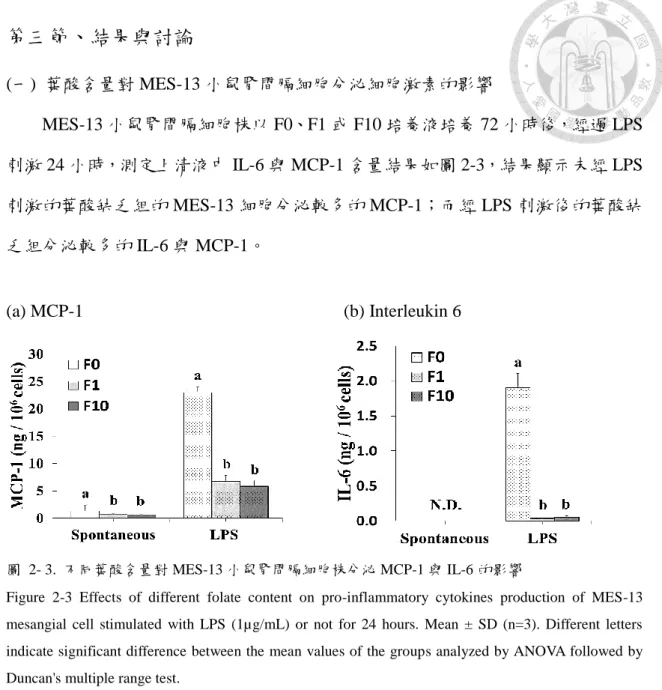
MES-13 小鼠腎間膈細胞株以 F0、F1 或 F10 培養液培養 72 小時後,經過 LPS 刺激 24 小時,測定上清液中 IL-6 與 MCP-1 含量結果如圖 2-3,結果顯示未經 LPS 刺激的葉酸缺乏組的 MES-13 細胞分泌較多的 MCP-1;而經 LPS 刺激後的葉酸缺 乏組分泌較多的 IL-6 與 MCP-1。
(a) MCP-1 (b) Interleukin 6
圖 2- 3. 不同葉酸含量對 MES-13 小鼠腎間膈細胞株分泌 MCP-1 與 IL-6 的影響
Figure 2-3 Effects of different folate content on pro-inflammatory cytokines production of MES-13 mesangial cell stimulated with LPS (1µg/mL) or not for 24 hours. Mean ± SD (n=3). Different letters indicate significant difference between the mean values of the groups analyzed by ANOVA followed by Duncan's multiple range test.
過去細胞實驗指出,人類初代腎間膈細胞透過 CRP (C-reactive protein) 活化 NF-κB,進而促使 MCP-1 基因表現量的增加 (Chang et al., 2005)。臨床研究也指出,
糖尿病病患因高血糖刺激使腎間膈細胞分泌較多 MCP-1 與基因表現量,且與血清 AGEs (Advanced glycation end products) 濃度呈正相關,推測腎間膈細胞的 MCP-1 分泌量與表現量增加,會促使糖尿腎病變病情加速 (Banba et al., 2000)。有文獻指 出,腎臟疾病的病程中,MCP-1 將啟動 NF-κB 以增加 IL-6 分泌量,且吸引單核球 浸潤並附著到腎小管間質的內皮細胞,最終引起腎臟組織的發炎反應與促進腎病
的分泌量增加,可引起 NF-κB 之活化,最終使 IL-6 分泌量增加,促使腎功能異常 或腎病變的加劇。
(二) 葉酸含量對小鼠腎臟發炎與纖維化相關細胞激素基因表現量的影響
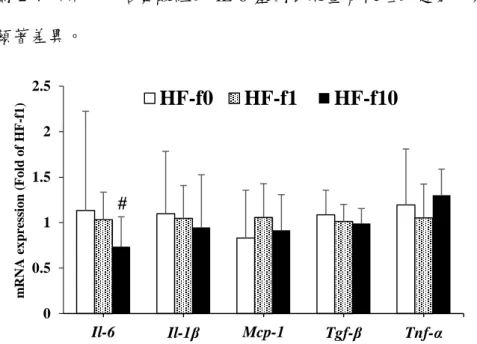
本實驗利用修淯琳碩士實驗的 C57BL/6J 小鼠,餵飼 20 週高油飲食誘發肥胖,
犧牲後取小鼠腎臟組織,分析腎臟發炎與纖維化相關細胞激素基因表現量。結果如 圖 2-4 所示,十倍葉酸組的 IL-6 基因表現量有較低的趨勢,其他基因表現量皆無 顯著差異。
圖 2- 4. 不同葉酸含量高油飲食對小鼠腎臟發炎與纖維化相關細胞激素基因表現量的影響
Figure 2-4 Effect of dietary folate content on kidney mRNA expression of inflammation-related cytokines in high-fat diet mice. Values are mean ± SD. The significance is indicated as # 0.05< p < 0.1 compared to the Control group analyzed by Student's t-test. (n = 6 for Control, n = 9 for HF-f0, n = 11 for HF-f10)
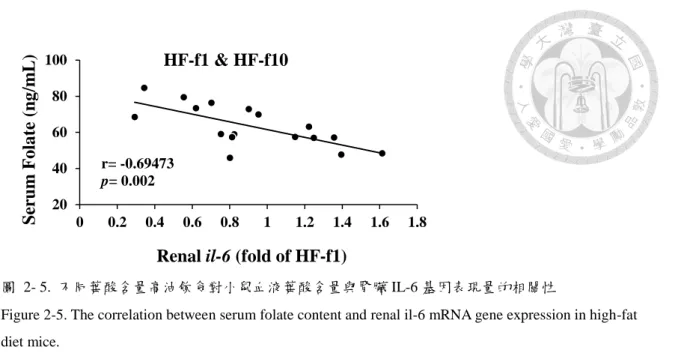
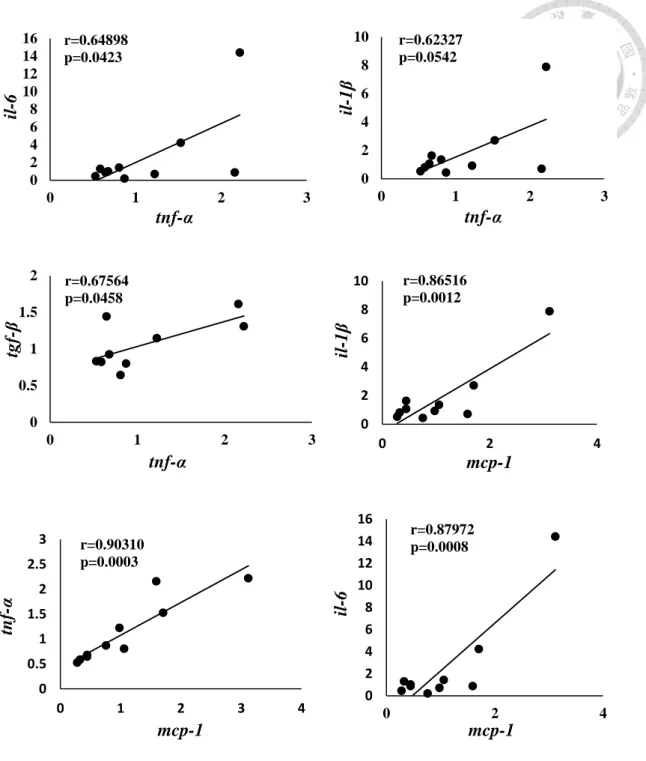
如圖 2-5 所示,血清葉酸含量與腎臟 IL-6 基因表現量呈顯著負相關 (r=- 0.69473, p=0.002),顯示不同葉酸含量高油飲食對小鼠腎臟的免疫影響可能會有所 不同。因此分析不同葉酸含量各組間的腎臟發炎相關基因表現量之間的相關性,結 果如圖 2-6 至圖 2-8 所示,唯有在葉酸缺乏的高油飲食之下,腎臟發炎相關基因表 現量彼此呈顯著正相關 (圖 2-6),顯示葉酸缺乏的高油飲食可能促使腎臟發炎反應 加劇發生。
0 0.5 1 1.5 2 2.5
Il-6 Il-1β Mcp-1 Tgf-β Tnf-α
mRNA expression (Fold of HF-f1)
HF-f0 HF-f1 HF-f10
#
圖 2- 5. 不同葉酸含量高油飲食對小鼠血液葉酸含量與腎臟 IL-6 基因表現量的相關性
Figure 2-5. The correlation between serum folate content and renal il-6 mRNA gene expression in high-fat diet mice.
有公衛研究指出,膳食和血中的葉酸含量與腎絲球過濾率呈負相關,顯示膳食 葉酸攝取越少,慢性腎臟疾病進展越加劇 (Hassan, 2015)。另外,動物實驗結果指 出,給予經單一腎切除的 Sprague-Dawley 大鼠 6 週葉酸缺乏飲食,導致大鼠 24 小 時尿液的尿蛋白 (urine albumin) 含量較正常飲食大鼠組更高,且尿液肌酸酐廓清 率 (creatinine clearance, Ccr) 較低,顯示了葉酸缺乏飲食會促使腎功能下降 (Zhang et al., 2010)。本實驗發現血液葉酸含量與腎臟 IL-6 基因表現量呈顯著負相關 (圖 2-5),且只有在葉酸缺乏組的促發炎細胞激素之間呈顯著正相關 (圖 2-6),葉酸 1、
10 倍組皆無此相關性 (圖 2-7 與圖 2-8)。
在 STZ (streptozotocin) 誘發大鼠糖尿病實驗結果顯示,糖尿病組大鼠腎臟皮 質 (renal cortical) 的 IL-6 基因表相量顯著高於對照組,且與尿蛋白排除率呈正相 關 (Navarro et al., 2006)。臨床研究也指出,第二型糖尿病病患的血清 IL-6 含量與 腎絲球基底膜 (glomerular basement membrane) 增厚之現象呈正相關 (Dalla et al., 2005)。
綜合以上推測, 膳食中葉酸缺乏將導致腎臟組織 IL-6 基因表現量增加,且藉 由影響促發炎細胞激素之間的表現量,進而引起腎臟發炎加劇與腎臟腫大,最終可 能導致腎功能逐漸下降。
20 40 60 80 100
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8
Serum Folate (ng/mL)
Renal il-6 (fold of HF-f1)
r= -0.69473 p= 0.002
HF-f1 & HF-f10
圖 2- 6. 葉酸缺乏高油飲食小鼠的腎臟發炎相關基因表現量之間的相關性
Figure 2-6. The correlation between renal inflammation-related mRNA gene expression in high-fat diet mice. (HF-f0)
0 2 4 6 8 10 12 14 16
0 1 2 3
il-6
tnf-α
r=0.64898 p=0.0423
0 2 4 6 8 10
0 1 2 3
il-1β
tnf-α
r=0.62327 p=0.0542
0 0.5 1 1.5 2
0 1 2 3
tgf-β
tnf-α
r=0.67564 p=0.0458
0 2 4 6 8 10
0 2 4
il-1β
mcp-1
r=0.86516 p=0.0012
0 0.5 1 1.5 2 2.5 3
0 1 2 3 4
tnf-α
mcp-1
r=0.90310 p=0.0003
0 2 4 6 8 10 12 14 16
0 2 4
il-6
mcp-1
r=0.87972 p=0.0008
圖 2- 7. 葉酸一倍高油飲食小鼠的腎臟發炎相關基因表現量之間的相關性
Figure 2-7. The correlation between renal inflammation-related mRNA gene expression in high-fat diet mice. (HF-f1)
0 0.5 1 1.5 2
0 1 2 3
tgf-β
tnf-α
r=0.20901 p=0.6529
0 0.5 1 1.5 2
0 1 2 3
il-6
tnf-α
r=-0.11279 p=0.7903
0 0.5 1 1.5 2 2.5
0 0.5 1 1.5 2 2.5
il-1β
tnf-α
r=-0.11917 p=0.7787
0 0.5 1 1.5 2
0 0.5 1 1.5 2
il-6
mcp-1 r=0.33737
p=0.4138
0 0.5 1 1.5 2 2.5
0 0.5 1 1.5 2
il-1β
mcp-1 r=-0.06326
p=0.8817
0 0.5 1 1.5 2 2.5
0 1 2
tnf-α
mcp-1 r=0.56714
p=0.1426
圖 2- 8. 葉酸十倍高油飲食小鼠的腎臟發炎相關基因表現量之間的相關性
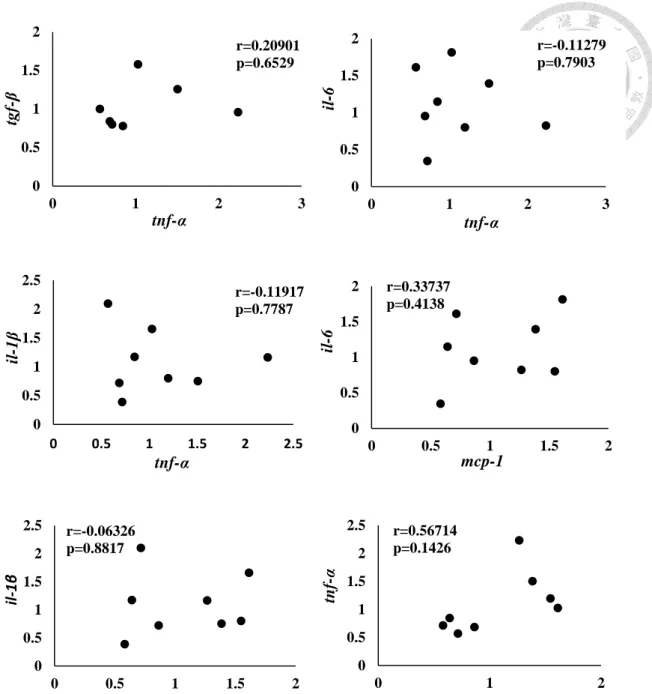
Figure 2-8. The correlation between renal inflammation-related mRNA gene expression in high-fat diet mice. (HF-f10)
0 0.2 0.4 0.6 0.8 1 1.2 1.4
0 0.5 1 1.5 2
tgf-β
tnf-α r=0.15468
p=0.6497
0 2 4 6 8
0 0.5 1 1.5 2
il-6
tnf-α r=0.41811
p=0.1762
0 1 2 3 4 5 6 7
0 0.5 1 1.5 2
il-1β
tnf-α r=0.40839
p=0.1875
0 1 2 3 4 5 6 7 8
0 1 2 3 4
il-6
mcp-1 r=0.85459
p=0.0004
0 0.5 1 1.5 2 2.5
0 0.5 1 1.5 2
il-1β
mcp-1 r=0.66798
p=0.0247
0 0.5 1 1.5 2
0 1 2 3 4
tnf-α
mcp-1
r=0.51598 p=0.0859
第三章、葉酸含量對高油飲食小鼠腎損傷的影響
第一節、前言
台灣國人膳食葉酸含量與血漿葉酸含量呈顯著正相關 (Chen et al., 2005),而 公衛研究調查結果指出飲食葉酸攝取量與腎絲球過濾率呈負相關 (Hassan, 2015)。
前一章實驗結果得知,葉酸缺乏促使小鼠腎間膈細胞 MES-13 分泌顯著較多的 IL- 6 與 MCP-1,且餵食高油飲食 20 週的 C57BL/6J 小鼠腎臟組織的 IL-6 基因表現量 與血清葉酸含量呈顯著負相關。而高油飲食誘發肥胖之高血糖現象易引起腎功能 異常 (Reena et al., 2016)。長期高油飲食促使 C57BL/6J 小鼠腎臟近曲小管、足細胞 與腎間膈細胞的 AMPK 活性降低,最終導致過量脂質堆積於當中,而產生肥胖相 關的腎臟疾病 (Mount et al., 2015)。綜合以上,葉酸對於腎臟免疫可能扮演了抗發 炎的角色,而高油飲食具有誘發腎損傷可能性。因此,本研究設計不同葉酸含量之 高油飲食餵食小鼠,觀察對小鼠腎臟的影響。
台灣末期腎臟疾病罹患率甚高,與誤食含具腎毒性馬兜鈴酸之中草藥有關 (Lai et al., 2009)。有研究為了模擬人類馬兜鈴酸致腎損傷情形,將馬兜鈴酸 (10 mg/kg) 以靜脈注射方式連續 35 天給予 Wistar 大鼠,10 天後發現血液肌酸酐含量 與尿蛋白皆顯著增加,建立了一個短期誘發腎纖維化的動物模式 (Debelle et al., 2002)。過去研究多以注射方式投予馬兜鈴酸誘發腎損傷為主要動物模式,較少添 加於飼料中讓實驗動物自由攝食的方式誘發腎損傷。而本實驗將馬兜鈴酸添加於 飼料中以加速小鼠腎損傷的發生。
因此,本研究藉由不同時間點添加馬兜鈴酸分為兩部分探討葉酸含量對高油 飲食小鼠腎損傷的影響。實驗一: 添加馬兜鈴酸於 16 週 (27 週齡) 不同葉酸高油 飲食小鼠飼料,觀察腎臟損傷情形。實驗二: 觀察長期不同葉酸含量之高油飲食誘 發肥胖與高血糖現象對小鼠腎損傷情形,並於實驗 48 週 (59 週齡) 添加馬兜鈴酸 加速腎損傷。
第二節、材料與方法
一、動物飼養
自國家動物中心購入 6 週大的 C57BL/6J 公鼠 51 隻,個別飼養在不鏽鋼鐵籠 中,自由攝食水及飼料。動物房維持溫度 23 ± 2 oC,光暗循環各 12 小時,每週固 定記錄小鼠體重。給予 chow diet 適應 4 週,接續適應粉狀 AIN-93G 飼料 1 週後,
依體重開始分三組 35.3% (w/w)高油飼料 (high fat, HF) 分別含葉酸 0 mg/Kg 的高 油葉酸缺乏組 (HF-f0/AA)、葉酸 2 mg/Kg 的高油葉酸 1 倍組 (HF-f1/AA 組)、葉 酸 20 mg/Kg 的高油葉酸 10 倍組(HF-f10/AA)和一組 1 倍葉酸含油脂 7% w/w 的正 常油脂組 (NF-f1 組)。實驗一小鼠於 27 週齡添加 8 mg/Kg/day 馬兜鈴酸 (AA, aristolochic acid, A9451, Sigma)觀察生命期,於死亡時立即採取腎臟與肝臟以組織 切片觀察組織型態,分析肝臟脂質含量;實驗二為未添加馬兜鈴酸小鼠繼續餵飼至 59 週齡添加馬兜鈴酸連續三週。
圖 3- 1. 實驗設計
Figure 3-1. Experimental design
表 3- 1. AIN-93G 飼料組成表
Table 3-1. Ingredient of the modified AIN-93G diets.
成分 (g/kg diet) HF-f0 HF-f1 HF-f10 NF-f1 /AA /AA /AA /AA Corn starch (Samyang Genex Corporation, Korea) - - - 529.5 Casein (Sigma, C7078) 264.6 264.6 264.6 200 Cellulose (JRS PHARMA, Germany) 54 54 54 50 Sucrose (台糖精緻細砂) 33.1 33.1 33.1 100
Fructose 231.5 231.5 231.5 -
Soybean oil (台糖) 10 10 10 70
Butter (安佳無水奶油) 342.8 342.8 342.8 - AIN-93G mineral mix (MP Biochemicals) 44.5 44.5 44.5 35 AIN-93G vitamin mix w/o folic acid (MP Biochemicals) 12.5 12.5 12.5 10 L-cystine (Wako, Japan) 4 4 4 3 Choline (Sigma, C1879) 3 3 3 2.5 Folate, mg (Sigma, F7876) - 2 20 2
熱量 (kcal/1000g) 5292 5292 5292 3948
CHO/calorie (%) 20 20 20 63.8
Protein/calorie (%) 20 20 20 20.2
Fat/calorie (%) 60 60 60 16.0
二、血清葉酸濃度測定
本研究以 Lactobacillus casei (ATCC 7469)微生物法測定葉酸含量(Grossowicz et al., 1981)。葉酸為 Lactobacillus casei 生長之必須營養素,菌生長與繁殖速度與 樣品中葉酸的含量成一定的對應關係,利用此關係可對樣品中葉酸進行定量。
(一) 菌液製備
已滅菌之養菌管中加入 5 mL 培養液,取 200 µL 冷凍之 Lactobacillus casei 至管中,37°C 震盪培養並接種 2 代。使用前觀察養菌管底有白色的 pellet,取懸
浮液 1 mL 至微量離心管,以 12000 rpm 離心 20 秒,倒掉上清液,加入 1 mL 0.9% NaCl 洗菌(此步驟重複 3 次);最後加入 1 mL 0.9 % NaCl 懸浮菌為菌液,
以 Folic acid casei medium 將菌液稀釋 2000 倍。
【試劑】
1. 培養液:將 1.9 g Lactobacilli Broth AOAC (290110, DIFCO) 粉末溶於 50 mL 一 次水,經 121°C 滅菌 15 分鐘,存於 4°C。
2. 0.9 % NaCl:秤取 0.45 g NaCl,加入 50 mL 一次水溶解,121°C 滅菌 30 分鐘。
3. Folic acid casei medium (1259786, BD):秤 4.7 g Folic acid casei medium 粉末溶 於 50 mL 二次水,加入 25 mg L-Ascorbic acid (A7506, Sigma),121°C 滅菌 5 分鐘,使用時新鮮配。
(二) 葉酸測定
於滅菌 96 孔盤中加入以 Phosphate buffer 稀釋之樣品與標準品,加入等體積 以 Folic acid casei medium 稀釋之菌液後蓋上無菌蓋,37°C 培養 16~18 小時,測 定 620 nm 吸光值,每個樣品做三重複,全程以避光進行。
【試劑】
1. Phosphate buffer:1 倍無菌 PBS 加 0.05% L-Ascorbic acid,121°C 滅菌 5 分鐘。
2. 葉酸標準品:用二次水將葉酸粉末(F8758, Sigma)配成 0.5 mg/mL,稀釋至 200 μg/mL 於-80°C 保存,測定前稀釋至 0.5 ng/mL 使用。
三、血糖分析
實驗動物禁食 12 小時,空腹眼窩採血。採用市售試劑組 (Randox Cat. No.
GL2623)。利用 glucose oxidase 與 peroxidase 的作用所產生的紫紅色色素,藉由測 量此色素之吸光值,計算 glucose 之含量。加入經過系列稀釋的標準液 (100 mg/dL) 及以 dd H2O 稀釋 8 倍之血清 10 μL 於 96 孔盤中,再加入 250 μL 之反應試劑,於 37oC 反應 10 分鐘後測定 490 nm 之吸光值。
四、血脂質分析
實驗動物血脂質分析皆禁食 12 小時,空腹眼窩採血。
1. 血清三酸甘油酯含量測定
採用市售試劑組 (Randox Cat. No. TR 213),先將緩衝液 (含有 pipes buffer, pH 7.6, 4- chlorophenol, magnesium ions) 與 Enzyme Reagent (含有 4-aminophenazone, ATP, lipase, glycerol-kinase, glycerol-3-phosphate oxidase, peroxidase) 混合均勻配成 反應試劑,再加入系列稀釋的標準溶液 (12.5-200 mg/dL) 及以二次水稀釋 4 倍之 血清10 μL 於 96 孔盤中,接著加入 250 μL 之反應試劑,於 37 oC 反應 10 分鐘後 測定 490 nm 之吸光值。
2. 血清膽固醇含量測定
採用市售試劑組 (Randox Cat. No. CH 201),將經系列稀釋的標準溶液 (12.5- 200 mg/dL) 及以二次水稀釋 4 倍之血清 10 μL 於 96 孔盤中,接著加入 250 μL 之 試劑組試液(含 4-aminoantipyrine, phenol, peroxidase, cholesterol esterase, cholesterol oxidase, pipes buffer, pH 6.8),於 37 oC 反應 10 分鐘後測定 490 nm 之吸光值。
五、肝臟脂質萃取與測定
採用 Folch 等人 (1957) 的方法,取約 0.2 g 肝臟置於 20 cm 樣品瓶內,以剪刀 剪碎組織後加入少量萃取溶劑(CHCl3:CH3OH = 2:1,v/v)後用均質機磨碎,以 1 號 濾紙過濾後用萃取溶劑定容至 10 mL。取少量脂質萃取液至 10 cm 玻璃試管內,置於 通風除使溶劑揮發後以試劑組分析 (同第四點血清脂質分析)。
六、血液與腎臟組織 galectin-3 含量測定
選用 BOSTER Immunoleader 的 mouse galectin-3 ELISA Kit (EK0765)。於 96 孔 盤中加入以 sample diluent buffer 稀釋的樣品及標準品 100 μL,於 37℃放置 90 分 鐘,拍打 4 次後加入 100 μL Biotinylated anti-mouse Galectin-3 antibody working solution ,於 37℃放置 60 分鐘,以 PBST 放置孔盤中一分鐘,重複清洗 3 次且拍 乾後加入 100 μL ABC working solution,於 37℃放置 30 分鐘,清洗 5 次後加入 90 μL TMB 呈色劑,於 37℃放置 30 分鐘且避光,呈色至適當藍色時,加入 100 μL TMB stop solution,測定 450 nm 吸光值。
七、組織細胞單離培養
(一)脾臟細胞之取得與培養
【試劑】
1. 裂殖素:ConA 1.25 μg/mL (Concanavalin A, Sigma C-5275) LPS 10 μg/mL (Lipopolysaccharide, Sigma L-2654)
2. TCM/RPMI 培養液:20 mL 之 TCMTM 代用血清 (Celox laboratories, Inc.) , 加入 1L 之 RPMI-1640 medium (Gibco 11875),並加入 10 mL 之三合一抗生素 (Sigma A-5955;成分包含 10000 units/mL penicillin、10 mg/mL streptomycin 及 25 μg/mL amphotericin)。
3. HBSS 緩衝液:HBSS 緩衝液粉末 (Sigma H2387) 溶於去離子水中,並定容 為 1L,經 121oC,30 分鐘滅菌後,加入 10 mL 三合一抗生素 (Sigma A-5955),
再以 7.5% NaHCO3 將顏色調整為桃紅色。
4. ACK lysing buffer:NH4Cl 8.29 g、Na2EDTA 37.2 mg、KHCO3 1.0 g,加入滅 菌水定容至 1L,再以 0.22 μm filter 過濾。
【方法】
小鼠採用 CO2窒息法安樂死,取出脾臟置於有 3 mL TCM/RPMI 培養液的 3 cm dish 中。以無菌針筒尾端將脾臟磨碎,將上層細胞懸浮液吸取至 15 mL 離心管 中,再加入 3 mL 的 HBSS 緩衝液至 dish 中,繼續磨碎剩餘組織,並吸取至離心管 中,最後用 3 mL HBSS 緩衝液沖洗 dish,收集殘留細胞。細胞懸浮液以 300 x g 離 心 10 分鐘後,倒去上清液,再加入 ACK lysing buffer 去除紅血球,靜置 1 分鐘後 加入 3 mL HBSS 緩衝液,以 300 x g 離心 10 分鐘後,用 HBSS 緩衝液洗 3 次,洗 去 ACK lysing buffer。以 2 mL TCM/RPMI 培養液使成細胞懸浮液。計算細胞總 數,將細胞密度調整至 1x107 cell/mL,取 500 μL 培養於 48 孔盤中,加入 500 μL 含有 ConA 或 LPS 的 TCM/RPMI 培養液,使最終細胞密度為 5 x 106 cell/mL,培 養 48 小時後,收取上清液分析細胞激素。
八、組織、血清與細胞之細胞激素測定
同第二章第二節腎間膈細胞之細胞激素測定。
九、尿液 creatinine 含量測定
採用市售試劑套組 (BioAssay Systems DICT-500),將 50μL RA、50μL RB 與 100μL 一次水混勻配成反應試劑。將收集到的小鼠尿液樣本與標準樣品個取 5μL 於 96 孔盤。分別於加入反應試劑後和第 5 分鐘個測一次 520 nm 吸光值,再將其 吸光值代入算式計算樣本中 creatinine 含量。
尿液 creatinine 含量計算:
十、尿液或腎臟組織蛋白質測定
為定量尿液或腎臟組織蛋白質含量,本研究利用 Bio-Rad Bradford 之蛋白質定 量法進行測量 (Bradford, 1976),其原理為 Coomassie blue dye 中的苯環與硫酸根,
與蛋白質發生親和作用而呈色。標準樣品選用 BSA (bovine serum albumin, Sigma, A4503),以二次水 2 倍稀釋尿液樣本或 100 倍稀釋腎臟組織樣本和系列稀釋標準 樣本後取 10 μL/well 於 96-well ELISA plate,再加入 Bio-Rad protein assay dye 試劑 200 μL,室溫下等候 5 分鐘,以 ELISA reader 測 620 吸光值,利用標準曲線計算尿 液或腎臟組織蛋白質濃度。