第四章 實驗二
實驗一討論中提到,山苦瓜凍乾粉末與山苦瓜乙酸乙酯萃取物兩組間血 脂結果不同,可能是因萃物在處理過程中氧化,降低活化能力,故實驗二將 萃取處理量減少,並縮短存放時間,試圖避免其活性降低;此外,因單純由 活化肝臟 PPAR-α 的角度無法合理解釋各組間差別,除此種 apoE 剔除小鼠 特性使然,可能也因苦瓜可影響其他組織如脂肪組織而使結果複雜化,加上 實驗一中觀察到 BGP 組脂肪組織重量較輕,所以實驗二也針對脂肪組織所 分泌激素 adiponectin 及 leptin 作測量,增加考量脂肪組織受到之影響來探討 血脂變化情形。由於苦瓜影響血脂機轉中有活化 PPAR-α 及抑制 MTP 表現 兩篇細胞實驗研究 (Chao & Huang, 2003; Nerurkar et al., 2005),實驗一中觀 察到 BGP 組血液 TC、TG 及 HDL-C 改善 (PPAR-α 活化),BGP 組及 EAE 組肝臟三酸甘油脂濃度偏高現象 (MTP 受到抑制),符合兩種機轉之預期,
因此本實驗將直接測量給予山苦瓜凍乾粉末及其乙酸乙酯萃物後 PPAR-α 及 MTP mRNA 於肝臟中表現量。實驗一於第九週採血測量即看到 BGP 組血 液 TC 顯著較低的現象,因此本實驗預計為期 8 週。
第一節 材料與方法
一.實驗流程大綱
實驗流程大綱二
出生 老鼠 年齡 1
購入
9 n=15 10 24
適應期
Baseline TC TG
犧牲 秤重
(含體重、組織器官) 後續分析 (血液及組織器官) 週
實驗開始後 8 週
8 n=7 9 1 6
5 n=11 6 20
二.山苦瓜樣品製備 1. 冷凍乾燥
本實驗採用之山苦瓜為花蓮縣吉安鄉農業改良場所提供 HM2381 品種山 苦瓜,由彰化達群公司洗淨後全果進行冷凍乾燥。各成份所佔百分比如 下:澱粉 11.92%、可溶性糖 6.92%、可溶性纖維 5.64%、不可溶性纖維 48.87%、蛋白質 16.3%、灰份 7.44%、脂質 2.91%。
2. 乙酸乙酯萃取物
取山苦瓜凍乾粉末 200 克,浸泡於 4 公升乙酸乙酯,室溫下攪拌萃取 24 小時,抽氣過濾後得萃取液,過濾剩餘殘渣再浸泡於 4 公升乙酸乙酯進 行第二次萃取,過濾後所得萃取液與第一次萃取所得混合,於 45℃進行 減壓濃縮,得到山苦瓜乙酸乙酯萃取物 22 克,萃取率約 10%。
三.飼料配方製備
維持 chow diet (MF-18,ORIENTAL YEAST,日本)供應 11 天,配方成 分如第三章表 3-1-1 說明。
2. 實驗期飼料
同於第三章所述 HF、BGP、EAE 組飼料配方 (表 3-1-3)。以固體形式 供應,配製及製成固體方法同第三章所述。
四.動物飼養
自成大醫學院動物中心購入 5、8、9 週大之 C57BL/6 apoE knockout 公 鼠共 33 隻 (5 週大 n=11、8 週大 n=7、9 週大 n=15),飼養於 6 個 IVC cage 中 (5 或 6 隻/籠),動物室環境溫度維持在 25℃,並設定每日 12 小時之光照、
黑暗循環,每週更換經高溫高壓滅菌後 IVC cage 一次,飲水及飼料自由攝 取,每週更換一次飼料同時並秤重紀錄飼料消耗情形,體重每週秤量一次,
直至犧牲為止。
購入後 1 週,依照年齡及體重排序 S 形分至各籠,並剪耳標辨別,HF、
BGP、EAE 各組皆為 11 隻,以眼窩採血方式採取 baseline 血液後,開始給 予實驗飼料。
實驗過程中,BGP 組 1 隻於適應期結束後不明死亡,另 1 隻於實驗末期 發現因齒列不整進食困難體重下降明顯;EAE 組 1 隻於實驗末期因齒列不整 無法進食死亡。故各組樣本數調整如下:HF 組 n=11,BGP 組 n=9,EAE 組 n=10。
五.血液樣本收集
於實驗前以眼窩採血方式採集血液樣本約 100μl,分析 baseline TC 及 TG。實驗結束時也以眼窩採血方式各採集血液樣本。每次採集血樣前一晚 即取走飼料禁食隔夜。
六.動物犧牲
於餵食實驗飼料後第 8 週進行犧牲。犧牲前一日晚間開始禁食,隔日先 秤重,以乙醚麻醉,眼窩採血至少 1ml,取下約 0.1g 重肝臟 6 塊,迅速秤重 記錄丟入液態氮中急速冷凍,再以-70℃保存,以供日後抽取 RNA 使用;其 餘肝臟則剪下秤重記錄後丟入液態氮中急速冷凍,保存於-70℃備用;取下 腎周脂、副睪脂、脾臟、腎臟予以秤重記錄。血液以前述方法處理,取上層 血清分裝保存於-70℃。
七.血液脂質分析 1.膽固醇含量測定
同第三章第一節。
2.三酸甘油酯含量測定 同第三章第一節。
3.血液高密度脂蛋白膽固醇測定 同第三章第一節。
八.血液 leptin 分析
本實驗採用市售 Leptin ELISA kit (R&D),根據三明治 (sandwich)酵素免 疫分析原理測量血液中 leptin 濃度,此法係利用 96 孔的分析盤中已結合抗 leptin 的多株抗體,能專一的與 leptin 分子結合,再與 horseradish peroxidase conjugates anti mouse leptin polyclonal antibady 結 合 , 利 用 horseradish peroxidase 與 3,3',5,5'-Tetramethylbenzidine 及 H2O2 反應呈色而得知樣品中 leptin 濃度。操作過程為:將標準品 (系列稀釋)、血樣 (稀釋 20 倍)加入分 析盤中,室溫反應 2 小時後,進行 wash,使未結合的樣品在清洗過程中被 洗去,再加入 horseradish peroxidase conjugates anti mouse leptin polycolonal antibady 室溫下反應 2 小時,進行 wash 後加入 3,3',5,5'-Tetramethylbenzidine
光值越高者表示樣品中所含 leptin 濃度越高,其濃度值利用標準品並乘上稀 釋倍數即可相對換算出。
九.血液 adiponectin 分析
本實驗採用市售 adiponectin ELISA kit (R&D),根據三明治 (sandwich)酵 素免疫分析原理測量血液中 adiponectin 濃度,此法係利用 96 孔的分析盤中 已結合抗 adiponectin 的單株抗體,能專一的與 adiponectin 分子結合,再與 horseradish peroxidase conjugates anti mouse adiponectin polyclonal antibady 結 合,利用 horseradish peroxidase 與 3,3',5,5'-Tetramethylbenzidine 及 H2O2 反 應呈色而得知樣品中 adiponectin 濃度。操作過程為:將標準品 (系列稀釋)、
血樣 (稀釋 2000 倍)加入分析盤中,室溫反應 3 小時後,進行 wash,使未結 合的樣品在清洗過程中被洗去,再加入 horseradish peroxidase conjugates anti mouse adiponectin polycolonal antibady 室溫下反應 1 小時,進行 wash 後加入 3,3',5,5'-Tetramethylbenzidine 及 H2O2 (新鮮配置),室溫下避光反應 30 分鐘,
最後加入酸性溶液終止酵素呈色反應,並使藍色產物轉變為黃色,於波長 450 nm 下可測其吸光值,吸光值越高者表示樣品中所含 adiponectin 濃度越 高,其濃度值利用標準品並乘上稀釋倍數即可相對換算出。
十.半定量反轉錄聚合酶鏈鎖反應 1.肝臟組織 RNA 抽取
本方法係參考 Chomcyznski 等人 (1987)的方法,使用市售 TRIZOL 試 劑 (Invitroge)抽取 RNA。方法如下:將儲存於-70 度冰箱之肝臟樣本連同保 存管丟入液態氮中避免融化,依序取出樣本加入 1mL TRIZOL 試劑,使用拋 棄式微量離心管研磨杵搭配電動研磨機將組織磨碎,vortex30 秒加強打破細
加 500μL 冰 isopropanol (Merck),靜置冰上 10 分鐘,以 3900g 4℃ 15 分鐘離心,倒去上層液體,加入 1mL 冰 70%酒精潤洗 RNA pellet,靜置冰 上 15 分鐘,以 3900g 4℃ 5 分鐘離心,倒去上層酒精,倒置於抽風櫥中風 乾 5 分鐘,以 50 mL DEPC-H2O 溶解 RNA pellet,並以 55℃乾浴加熱 5 分 鐘確保 RNA 完全溶解。取少量 RNA 溶液用二次水適當稀釋後,以分光光 度計測定 OD260 及 OD280 之吸光值,依據 OD260 吸光值 1unit=40μg RNA/mL 計算 RNA 濃度,取出進行 RNA 電泳及反轉錄所需 RNA 量,剩餘 RNA 冰-70℃保存。
2.RNA 電泳
利用 RNA 電泳觀察 RNA 品質。製作 1%TBE gel (Amerseco),以 100 伏特預跑 5min。取 5μg RNA 加 6 倍 loading dye 混勻後,注入樣本槽中,
以 100 伏特電泳 30 min,電泳完以 1μg/ml EtBr 進行外染 10 分鐘,染完以 紫外線照射台及照相系統觀察 28S 與 18S 比例,了解 RNA 品質。
3.反轉錄作用
取 5μgRNA 當作模板,加入 1μL Random primer (Promega),補 DEPC-H2O 至 12μL,以 70 度加熱 10min 後馬上冰浴三分鐘,加入 4μL 5x reverse transcription reaction buffer、1μL 10mM dNTP、1μL 的 MMLV-Rtase (200U/μL) (Promega),室溫反應 10 分鐘後,移至 42℃反應 1 小時合成第 一股 cDNA,隨後以 90℃加熱 5 分鐘終止 MMLV-Rtase 作用,冰浴數分鐘後,
加入 1μL RNase (1mg/mL)於 37℃作用 1 小時以去除 RNA。將反應完第一股 cDNA 以無菌水稀釋五倍後分裝冰-20℃保存。
4.PCR 反應
取 0.25μg cDNA 當模板建立 50μL PCR 反應混和物:包含 5μL10x reaction buffer、0.5μL10mM dNTP、各 1μL 5’及 3’primer (10mM) (明欣)、
Primer 設計除參考前人文獻外,並根據 NCBI 所提供 mRNA 完整序列,
以 primer3 網站(http://frodo.wi.mit.edu/cgi-bin/primer3/primer3_www.cgi)進行 primer 設計,
且將設計所得 primer 序列比對該基因 DNA 序列,確定 5’及 3’primer 分別位 於不同 exon 上。
Primer 序列及 PCR 反應程式如下:
β-actin 依 Nudel 等人所發表之序列設計(Nudel et al., 1983)
Accession number:V01217 (103-642bases 產物大小 539bp) 5'primer 5'-GTG-GGC-CGC-TCT-AGG-CAC-CA-3'
3'primer 5'-CTC-TTT-GAT-GTC-ACG-CAC-GAT-TTC-3' 反應條件
94℃5min1cycle
94℃ 45sec 56℃45sec 72℃45sec 28cycle 72℃ 7min 1cycle
4℃soak
MTP (microsomal triglyceride transfer protein)
Accession number:BC012686 (bases 2044-2702 產物大小 659bp) 5’primer 5’-GCT-GGA-AGG-CTT-AAT-TGC-AG-3’ 位於 exon14 3’primer 5’-TAT-CGC-TTT-CTG-GCT-GAG-GT-3’ 位於 exon17 反應條件
94℃5min1cycle
94℃1min 50℃1min 72℃1min 35cycle 72℃7min1cycle
4℃soak
PPAR-α ( peroxisome proliferator activated receptor alpha) Accession number:BC016892 (basas 434-1033.產物大小 600bp) 5’primer 5-CCA-ACA-TGG-TGG-ACA-CAG-AG-3’ 位於 exon2
3’primer 5-CCG-AAT-CTT-TCA-GGT-CGT-GT-3’ 位於 exon5 反應條件
94℃5min1 cycle
94℃45sec 50℃45sec 72℃45sec 35cycle, 72℃7min 1cycle
4℃soak
反應完以含 EtBr (1μg/50mL)之 1.5%TAE gel 進行電泳,以 100 伏特 20min,使 dye 跑至膠片 1/2 到 2/3 處停止,經照相後,以 Image J 軟體 (NIH 網站提供)進行定量分析,數值以該項目除以 B-actin 表示。
十一.統計分析
數值以 Mean±SEM 表示。先檢測數據是否為常態分佈,若非常態分佈 將進行轉換,其中體重、血液總膽固醇濃度及其差異值、血液三酸甘油酯濃 度及其差異值、血液 adiponectin 濃度呈常態分佈未進行轉換;血液 HDL-C、
各臟器重量、血液 leptin 濃度進行 log 轉換;肝臟 PPAR-α及 MEP mRNA 表現量採平方根轉換。組間比較採用 one-way-ANOVA 分析組間是否具有顯 著不同,若有顯著不同,則進一步使用 Tuckey multiple comparison test 分析 差 異 情 形 , p<0.05 為有 顯著 差異 ; 相 關性 分析 使 用 two-tailed Pearson Correlation test,並進一步以 two-tailed partial correlation 排除某些因子,觀察 其 相 關 性 之 變 化 , 兩 組 間 相 關 性 (r 值 ) 之 差 異 使 用 http://home.clara.net/sisa/correl.htm 網站進行顯著性比較。使用 SPSS 11.5 軟 體進行統計分析。
第二節 結果
一.生長情形
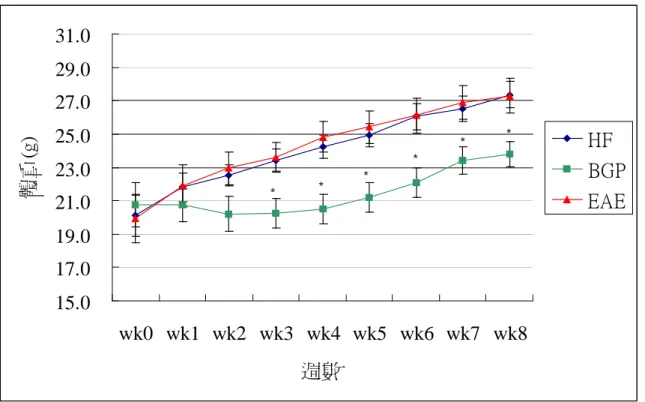
體重方面,實驗初始,體重於各組間並無顯著差異 (表 4-2-1),開始給 予實驗飼料後,BGP 組體重有下降的情形 (圖 4-2-1),和其他組出現顯著差 異,至實驗結束時 (第 8 週),BGP 組體重依舊顯著小於 HF 及 EAE 組。
體重增加量方面,實驗全程體重增加量 BGP 組顯著低於 HF、EAE 組,
考慮第 5 週後,BGP 組體重恢復至實驗前體重且生長幅度與其他組相似,因 此比較第 5 週到第 8 週體重增加情形,各組間並無顯著差異。
在攝食量及攝食效應方面,由於飼料秤重僅能代表一籠 5 隻老鼠的總攝 取量,因此各組僅有一平均攝取量數值而無標準差,更無法進行統計分析比 較差異性。單就各組數值而言,全部 8 週攝取量方面,各組皆相似為 2.5g/mouse/day;在攝食效應方面,HF 組 5.6 (weight gain g /100g food intake) 為最高,BGP 組 1.8 (weight gain g /100g food intake)為最低。若以第 5 週為 分 界 , 前 5 週 BGP 組 攝 取 量 為 2.6 g/mouse/day 較 HF 、 EAE 組 的 2.3g/mouse/day 高,但 BGP 組攝食效應 0.7 (weight gain g /100g food intake) 明顯比其他各組低;第 5 到 8 週,BGP 組攝取量 2.4g/mouse/day 低於 HF 及 EAE 組的 2.8g/mouse/day,攝食效應 3.5 (weight gain g /100g food intake)則稍 低於 HF 及 EAE 組。
圖 4-2-1 ApoE 剔除小鼠餵食實驗飼料 8 週生長曲線
fig 4-2-1 The growth curve of apoE knockout mice fed test diets for 8 weeks 1. Values are means +SEM
2. Data were analyzed by one-way-ANOVA and Tukey multiple comparison test.
*: The group is significantly different from the HF group in the same week at p<0.05 level.
15.0 17.0 19.0 21.0 23.0 25.0 27.0 29.0 31.0
wk0 wk1 wk2 wk3 wk4 wk5 wk6 wk7 wk8 週數
體重(g)
HF
BGP
* *
EAE
*
*
* *
表 4-2-1 ApoE 剔除小鼠餵食實驗飼料 8 週體重增加量、平均攝食量及攝食效應
table4-2-1 The body weight, weight gain, food intake and feed efficiency of apoE knockout mice after fed the test diets for 8weeks Initial
weight‡
wk5 weight‡
Final weight ‡
Weight gain (wk8-wk0) ‡
Weight gain (wk8-wk5) ‡
Food intake1
Feed efficiency2
Food intake1
(wk0~5) Feed efficiency2
(wk0~5)
Food intake1
(wk5~8) Feed efficiency2 (wk5-wk8)
n g g g g g g g/100 g g g/100 g g g/100 g
HF 11 20.1±1.33 24.9±0.7a 27.4±0.8a 7.2±1.0a 2.4±0.3 2.54 5.6 2.3 6.6 2.8 4.3 BGP 9 20.8±1.3 21.2±0.9b 23.8±0.7b 3.0±0.9b 2.6±0.3 2.5 1.8 2.6 0.7 2.4 3.5 EAE 10 19.9±1.4 25.4±1.0a 27.3±1.0a 7.4±0.9a 1.9±0.3 2.5 5.3 2.3 7.3 2.8 4.2 1 Food intake = g/mouse/day
2 Feed efficiency = weight gain (g)/food intake (100g) 3 Values are means + SEM.
4 Data of food intake and feed efficiency are mean of each group.
‡Data were analyzed by one-way-ANOVA and Tukey multiple comparison test. Values not sharing a common superscript letter are significantly different at p<0.05 level.
二.組織器官絕對重量與相對重量
以各組織絕對重量相比較 (表 4-2-2),BGP 組腎臟顯著小於 HF、EAE 組。
改以體重校正過後所得組織相對重量比較,BGP 組的脾臟重量顯著高於 HF,與 EAE 組則無顯著差異。
表 4-2-2 ApoE 剔除小鼠餵食實驗飼料 8 週後組織絕對及相對重量
table4-2-2 Absolute and relative organ weights of apoE knockout mice after fed test diets for 8 weeks
HF BGP EAE
(n = 11) (n =9) (n = 10) g
EWAT 0.512±0.089 0.426±0.041 0.479±0.087 RWAT 0.131±0.037 0.084±0.017 0.096±0.038 Liver 1.065±0.041 0.987±0.036 1.089±0.053 Kidney 0.294±0.008a 0.252±0.009b 0.299±0.006a
Spleen 0.084±0.006 0.092±0.005 0.088±0.002 g/wt g (%)
EWAT 1.943±0.295 1.832±0.153 1.801±0.289 RWAT 0.487±0.122 0.355±0.067 0.347±0.127 Liver 4.118±0.077 4.290±0.115 4.200±0.121 Kidney 1.142±0.033 1.094±0.027 1.162±0.026
Spleen 0.325±0.021b 0.398±0.017a 0.343±0.014ab EWAT, epididymal fat pad;RWAT, retroperitoneal fat pad.
1. Values are means +SEM
2. Data were analyzed by one-way-ANOVA and Tukey multiple comparison test. Values not sharing a common superscript letter among HF ,BGP ,EAE groups are significantly different at p<0.05 level.
三.血液脂質濃度 (一) 總膽固醇濃度
實驗初始,各組間無顯著差異 (表 4-2-3);實驗後第 8 週,BGP 組顯著 低於 HF 及 EAE 組,且低於 HF 組 28%。
在差異值方面,BGP 為負值且顯著低於 HF、EAE 組。
(二) 三酸甘油酯濃度
實驗初始,各組間無顯著差異 (表 4-2-3 );實驗開始後第 8 週,BGP 低 於 HF 及 EAE 組,但尚未達到統計上顯著差異。
在差異值方面,三組皆為負值,BGP 組顯著低於 HF 組,和 EAE 則沒 有顯著差異。
表 4-2-3 ApoE 剔除小鼠餵食實驗飼料 8 週實驗期間血液總膽固醇、三酸甘油 酯濃度
table4-2-3 Plasma total cholesterol and triglyceride concentration during experimental period
Groups n Baseline TC wk 8 TC wk 8-baseline TC Baseline TG wk 8TG wk 8-baseline TG HF 11 191.93±11.11 260.21±20.56a 68.28±17.54a 130.63±10.86 129.02±10.49 -1.62±10.04a BGP 9 214.08±10.23 185.44±14.71b -28.64±15.46b 144.34±5.80 91.45±7.26 -52.89±8.90b EAE 10 196.00±12.95 257.54±22.17a 61.54±21.90a 139.82±10.58 127.71±19.11 -12.11±15.26ab
1. Values are means + SEM. mg/dL
2. Data were analyzed by one-way ANOVA and Tukey multiple comparison test.
Values not sharing a common superscript letter among HF ,BGP ,EAE groups are significantly different at p<0.05 level.
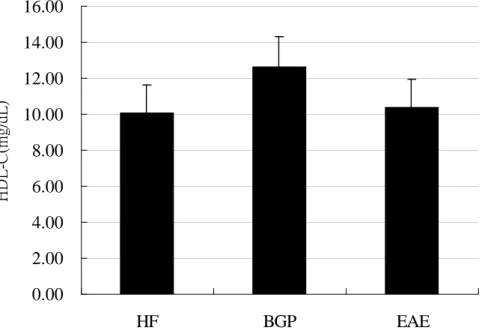
(三)高密度脂蛋白膽固醇濃度
三組間無顯著差異 (圖 4-2-2),但 BGP 組數值高於 HF 組 25%。
圖 4-2-2ApoE 剔除小鼠餵食實驗飼料 8 週後血液 HDL-C 濃度 fig.4-2-2 Serum HDL-C concentration
1. Values are means + SEM. mg/dL
2. Data were analyzed by one-way ANOVA and Tukey multiple comparison test.
There was no significantly different among HF ,BGP ,EAE groups.
0.00 2.00 4.00 6.00 8.00 10.00 12.00 14.00 16.00
HF BGP EAE
HDL-C(mg/dL)
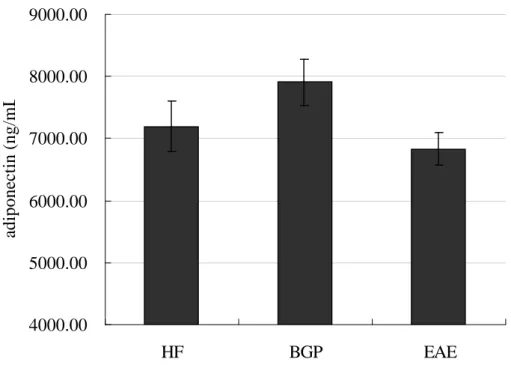
四.血液 adiponectin 濃度
三組間無顯著差異 (圖 4-2-3),但 BGP 組數值高於 HF 組 10%。
圖 4-2-3 ApoE 剔除小鼠餵食實驗飼料 8 週後血液 adiponectin 濃度 fig.4-2-3 Serum adiponectin concentration
1. Values are means + SEM. mg/dL
2. Data were analyzed by one-way ANOVA and Tukey multiple comparison test.
There was no significantly different among HF ,BGP ,EAE groups.
4000.00 5000.00 6000.00 7000.00 8000.00 9000.00
HF BGP EAE
adiponectin(ng/mL)
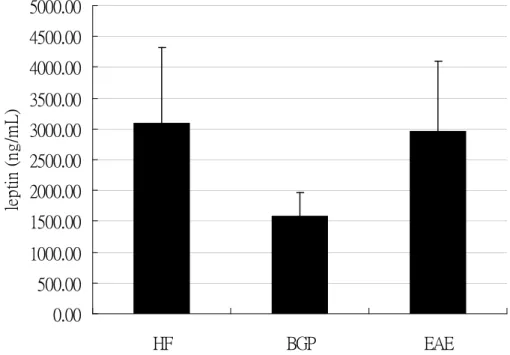
五.血液 leptin 濃度
由於血樣不足,各組 n 數調整如下:HF 組 n=11,BGP 組 n=7,EAE 組 n=7。
三組間無顯著差異 (圖 4-2-4),但 BGP 組數值低於 HF 組 49%。
圖 4-2-4 ApoE 剔除小鼠餵食實驗飼料 8 週後血液 leptin 濃度 figure 4-2-4 Serum leptin concentration
1. Values are means + SEM. mg/dL
2. Data were analyzed by one-way ANOVA and Tukey multiple comparison test.
There was no significantly different among HF ,BGP ,EAE groups.
0.00 500.00 1000.00 1500.00 2000.00 2500.00 3000.00 3500.00 4000.00 4500.00 5000.00
HF BGP EAE
leptin(ng/mL)
六.肝臟 mRNA 表現 (一)PPAR a
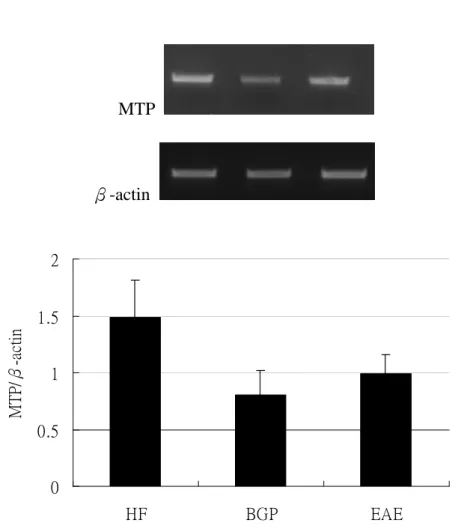
三組間無顯著差異 (圖 4-2-5)
PPAR-α
β-actin
圖 4-2-5 餵食實驗飼料 8 週後以半定量反轉錄聚合酶鏈鎖反應偵測 apoE 剔除小鼠 肝臟組織 PPAR-αmRNA 表現量
fig 4-2-5 Semiquantative RT-PCR analysis for mRNA of PPAR-αin liver of apoE knockout mice fed the test diet for eight weeks.
1.The resuls for quantification of PPAR-αmRNA using the Image J . 2 Values are means + SEM.
2. Data were analyzed by one-way ANOVA and Tukey multiple comparison test.
There was no significantly different among HF ,BGP ,EAE groups.
0 0.5 1 1.5 2 2.5
HF BGP EAE
PPAR-α/β-actin
(二)MTP
三組間無顯著差異 (圖 4-2-6)
MTP
β-actin
圖 4-2-6 餵食實驗飼料 8 週後以半定量反轉錄聚合酶鏈鎖反應偵測 apoE 剔除小鼠 肝臟組織 MTP mRNA 表現量
fig 4-2-6 Semiquantative RT-PCR analysis for mRNA of MTP in liver of apoE knockout mice fed the test diet for eight weeks.
1.The resuls for quantification of MTP mRNA using the Image J . 2 Values are means + SEM.
2. Data were analyzed by one-way ANOVA and Tukey multiple comparison test.
There was no significantly different among HF ,BGP ,EAE groups.
0 0.5 1 1.5 2
HF BGP EAE
MTP/β-actin
七.相關性分析
(一) 血液總膽固醇濃度
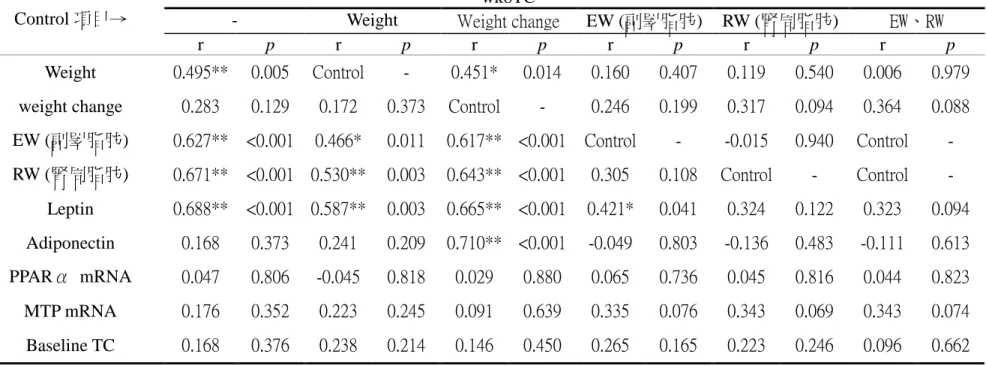
第八週血液總膽固醇濃度與體重、副睪脂重、腎周脂重、血液 leptin 濃 度呈顯著正相關 (表 4-2-4),與體重變化量、血液 adiponectin 濃度、肝臟 PPAR-α mRNA 表現、肝臟 MTP mRNA 表現及初始血液總膽固醇濃度無顯 著相關性。
經排除體重因子後,依舊與副睪脂重、腎周脂重、血液 leptin 濃度呈顯 著正相關,但相關性 (r 值)下降一些;經排除體重變化量後,相關性與原本 未排除任何因子時相似,但增加與血液 adiponectin 濃度的顯著正相關;排除 副睪脂重後,血液總膽固醇濃度僅與 leptin 濃度呈顯著正相關,與體重則無 顯著相關性;排除腎周脂重後,與各項目間皆無顯著相關性;若同時排除副 睪脂及腎周脂重量,則血液總膽固醇濃度與體重相關性下降至 0.006。
表 4-2-4 實驗第 8 週血液總膽固醇濃度與各因子相關性及排除體重、體重變化、副睪脂、腎周脂或副睪脂及腎周脂後淨相關 table 4-2-4 The correlation and partial correlation with Serum total cholesterol concentration in week 8 and other factors
wk8TC
- Weight Weight change EW (副睪脂肪) RW (腎周脂肪) EW、RW
Control 項目→
r p r p r p r p r p r p
Weight 0.495** 0.005 Control - 0.451* 0.014 0.160 0.407 0.119 0.540 0.006 0.979 weight change 0.283 0.129 0.172 0.373 Control - 0.246 0.199 0.317 0.094 0.364 0.088 EW (副睪脂肪) 0.627** <0.001 0.466* 0.011 0.617** <0.001 Control - -0.015 0.940 Control - RW (腎周脂肪) 0.671** <0.001 0.530** 0.003 0.643** <0.001 0.305 0.108 Control - Control -
Leptin 0.688** <0.001 0.587** 0.003 0.665** <0.001 0.421* 0.041 0.324 0.122 0.323 0.094 Adiponectin 0.168 0.373 0.241 0.209 0.710** <0.001 -0.049 0.803 -0.136 0.483 -0.111 0.613 PPARα mRNA 0.047 0.806 -0.045 0.818 0.029 0.880 0.065 0.736 0.045 0.816 0.044 0.823 MTP mRNA 0.176 0.352 0.223 0.245 0.091 0.639 0.335 0.076 0.343 0.069 0.343 0.074 Baseline TC 0.168 0.376 0.238 0.214 0.146 0.450 0.265 0.165 0.223 0.246 0.096 0.662
1. Data were analyzed by Pearson correlation test and partial correlation by SPSS11.5
*coefficient was considered significant at p<0.05 (2-tail)
** coefficient was considered significant at p<0.01 (2-tail)
(二) 血液三酸甘油酯濃度
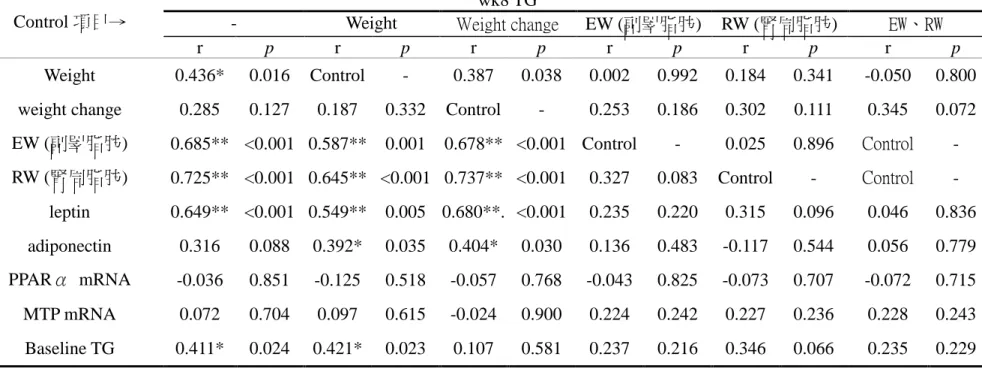
第八週血液三酸甘油酯濃度與體重、副睪脂肪重、腎周脂肪重、血液 leptin 濃度及 baseline TG 濃度呈顯著正相關 (表 4-2-5)。
經排除體重因子後,前述相關性依舊顯著,且增加血液 adiponectin 濃度 的顯著正相關;排除體重變化後,與 baseline TG 濃度相關性消失;排除副 睪脂肪重或腎周脂肪重或兩者皆排除後,前述顯著相關性皆消失,且與體重 相關性下降至-0.050。
表 4-2-5 實驗第 8 週血液三酸甘油酯濃度與各因子相關性及排除體重、體重變化、副睪脂、腎周脂或副睪脂及腎周脂後淨相關 table 4-2-5 The correlation and partial correlation with Serum triglyceride concentration in week 8 and other factors
wk8 TG
- Weight Weight change EW (副睪脂肪) RW (腎周脂肪) EW、RW
Control 項目→
r p r p r p r p r p r p
Weight 0.436* 0.016 Control - 0.387 0.038 0.002 0.992 0.184 0.341 -0.050 0.800 weight change 0.285 0.127 0.187 0.332 Control - 0.253 0.186 0.302 0.111 0.345 0.072 EW (副睪脂肪) 0.685** <0.001 0.587** 0.001 0.678** <0.001 Control - 0.025 0.896 Control - RW (腎周脂肪) 0.725** <0.001 0.645** <0.001 0.737** <0.001 0.327 0.083 Control - Control -
leptin 0.649** <0.001 0.549** 0.005 0.680**. <0.001 0.235 0.220 0.315 0.096 0.046 0.836 adiponectin 0.316 0.088 0.392* 0.035 0.404* 0.030 0.136 0.483 -0.117 0.544 0.056 0.779 PPARα mRNA -0.036 0.851 -0.125 0.518 -0.057 0.768 -0.043 0.825 -0.073 0.707 -0.072 0.715 MTP mRNA 0.072 0.704 0.097 0.615 -0.024 0.900 0.224 0.242 0.227 0.236 0.228 0.243 Baseline TG 0.411* 0.024 0.421* 0.023 0.107 0.581 0.237 0.216 0.346 0.066 0.235 0.229
1. Data were analyzed by Pearson correlation test and partial correlation by SPSS11.5
*coefficient was considered significant at p<0.05 (2-tail)
** coefficient was considered significant at p<0.01 (2-tail)
(三) 血液 adiponectin 濃度
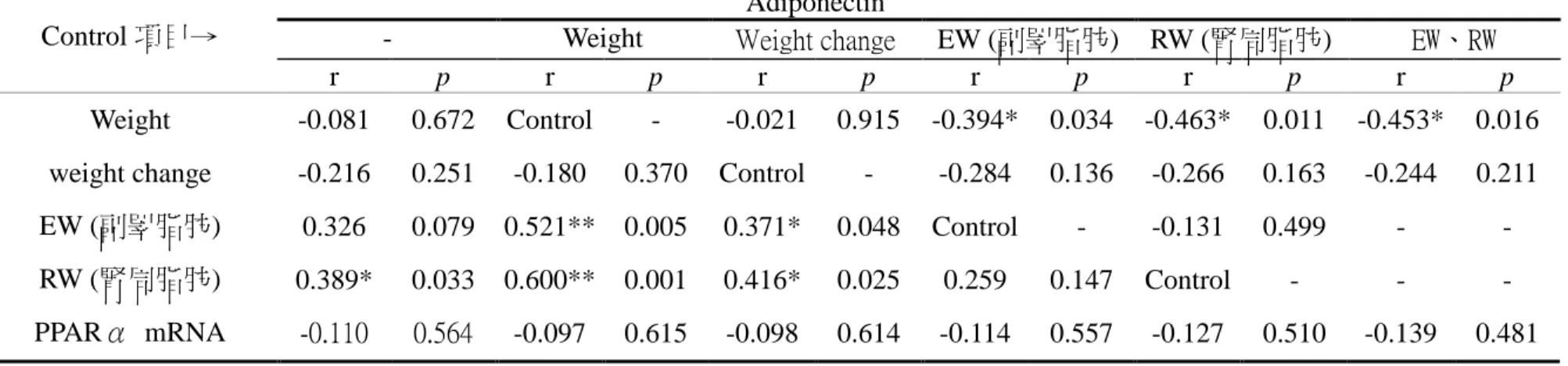
血液中 adiponectin 濃度在未排除任何因子前,僅與腎周脂肪重量有顯著 正相關 (表 4-2-6)。
排除體重因子後,與副睪脂肪重及腎周脂肪重相關性提升並且達統計上 顯著正相關;經排除體重變化量,與副睪脂肪重及腎周脂肪重呈顯著正相 關;排除副睪脂肪重或腎周脂肪重或兩者同時排除後,adiponectin 濃度與體 重呈顯著負相關。
進一步觀察三組間脂肪重量 (副睪脂肪+腎周脂肪)與 adiponectin 濃度相 關性發現 (圖 4-2-7),在 HF 組及 EAE 組,adiponectin 與脂肪重量呈正相關 (HF 組 r=0.691,p=0.019;EAE 組 r=0.446,p=0.197),在 BGP 組則呈負相關 (r=
-0.446,p=0.229),比較三者相關係數 (r 值)之差異,發現 BGP 組與 HF 組相 關性有顯著不同 (p=0.014),BGP 組與 EAE 組則無顯著不同 (p=0.085)。
表 4-2-6 血液 adiponectin 濃度與各因子相關性及排除體重、體重變化、副睪脂、腎周脂或副睪脂及腎周脂後淨相關 table 4-2-6 The correlation and partial correlation with Serum adiponectin concentration and other factors
Adiponectin
- Weight Weight change EW (副睪脂肪) RW (腎周脂肪) EW、RW
Control 項目→
r p r p r p r p r p r p
Weight -0.081 0.672 Control - -0.021 0.915 -0.394* 0.034 -0.463* 0.011 -0.453* 0.016 weight change -0.216 0.251 -0.180 0.370 Control - -0.284 0.136 -0.266 0.163 -0.244 0.211 EW (副睪脂肪) 0.326 0.079 0.521** 0.005 0.371* 0.048 Control - -0.131 0.499 - - RW (腎周脂肪) 0.389* 0.033 0.600** 0.001 0.416* 0.025 0.259 0.147 Control - - - PPARα mRNA -0.110 0.564 -0.097 0.615 -0.098 0.614 -0.114 0.557 -0.127 0.510 -0.139 0.481
1. Data were analyzed by Pearson correlation test and partial correlation by SPSS11.5
*coefficient was considered significant at p<0.05 (2-tail)
** coefficient was considered significant at p<0.01 (2-tail)
圖 4-2-7 各組血液 adiponectin 與脂肪重 (EW+RW)相關性 figure 4-2-7 The correlation of Serum adiponectin concentration and fat mass (EW+RW) in each groups
r
HF v.sr
BGP p=0.0138 ( two-tailed)r
HF v.sr
EAE p=0.4744 ( two-tailed)HF
4,000 5,000 6,000 7,000 8,000 9,000 10,000
0 0.5 1 1.5 2
脂肪重(EW+RW)(g)
adiponectin(ng/mL)
r=0.691,p =0.019
BGP
4,000 5,000 6,000 7,000 8,000 9,000 10,000
0 0.5 1 1.5 2
脂肪重(EW+RW)(g)
adiponectin(ng/mL)
r= -0.446,p =0.229
EAE
4,000 5,000 6,000 7,000 8,000 9,000 10,000
0 0.5 1 1.5 2
脂肪重(EW+RW)(g)
adiponectin(ng/mL)
r=0.446,p =0.197
(四) 血液 leptin 濃度
血液中 leptin 濃度與體重、副睪脂肪重、腎周脂肪重呈顯著正相關 (表 4-2-7)。
排除體重或體重變化量後,依舊與副睪脂肪重、腎周脂肪重呈顯著正相 關;排除副睪脂肪後,僅與腎周脂肪重有顯著正相關;排除腎周脂肪重後,
則與體重、體重變化量、副睪脂肪皆無顯著相關性;同時排除腎周脂肪及副 睪脂肪重後,可看到 leptin 與體重相關性降低至 0.011。
表 4-2-7 血液 leptin 濃度與各因子相關性及排除體重、體重變化、副睪脂、腎周脂或副睪脂及腎周脂後淨相關 table 4-2-7 The correlation and partial correlation with Serum leptin concentration and other factors
leptin
- weight Weight change EW (副睪脂肪) RW (腎周脂肪) EW、RW
Control 項目→
r p r p r p r p r p r p
weight 0.645** <0.001 Control - 0.618** 0.001 0.300 0.155 0.073 0.736 0.011 0.961 weight change 0.244 0.239 0.057 0.791 Control - 0.167 0.437 0.132 0.538 0.118 0.591 EW (副睪脂肪) 0.894** <0.001 0.829** <0.001 0.891** <0.001 Control - 0.289 0.170 Control - RW (腎周脂肪) 0.947** <0.001 0.908** <0.001 0.945** <0.001 0.727** <0.001 Control - Control -
1. Data were analyzed by Pearson correlation test and partial correlation by SPSS11.5
*coefficient was considered significant at p<0.05 (2-tail)
** coefficient was considered significant at p<0.01 (2-tail)
第三節 討論
本實驗 BGP 組體重在給予實驗飼料後出現下降情形,和其他組達顯 著差異,第 5 週才恢復至開始時體重,實驗結束 (第 8 週),BGP 組體重仍 顯著小於 HF 及 EAE 組,此情形與實驗一第 8 週時相同,但實驗一開始給 予實驗飼料後,BGP 組體重下降較實驗二明顯,觀察攝取量,實驗二 BGP 組不論是實驗全程、實驗期前 5 週或後 3 週皆未與 HF 或 EAE 組有明顯不 同,實驗一則於實驗前 7 週 BGP 組攝取量較低,實驗前期攝取量的差異推 測是因實驗一開始給實驗飼料前先給予高脂飼料適應,而實驗二則食用 chow diet,由 chow diet 轉變為高脂飼料可降低苦瓜苦味帶來的不適,因此 攝取量未減少,可作為之後實驗設計參考。實驗前 5 週,BGP 組攝食量較 HF EAE 組高,攝食效應卻明顯較低,此現象與香港大學所作實驗結果─同 樣熱量攝取下,食用苦瓜汁凍乾粉末大鼠有較低體重獲得量及攝食效應 相 同 (Chan et al., 2005),但本實驗並未看到組間脂肪組織重量有顯著差異,僅 腎周脂肪重量 BGP 組有較低的情形,且 BGP 組腎臟絕對重量小於 HF EAE 組,故 BGP 組攝食效應及體重獲得量較低並非完全因為脂肪組織改變影響,
可能也牽涉到瘦體組織的變化。BGP 組脾臟相對重量較重,可能與苦瓜籽中 某些成份有關,如有文獻指出,苦瓜籽中 lectin 於體外具有促使血球凝集的 能力 (Ng et al., 1986),已知 lectin 為一種分裂蛋白,會辨認淋巴細胞表面的 不同醣蛋白分子,於辨認結合後,會使細胞發生凝集反應並活化淋巴細胞,
因而使脾臟重量增加;苦瓜籽中另一成份 Vicine,則具有使 G6PDH 缺乏患 者出現溶血性貧血等症狀 (Dutta PK, 1981),另一研究給予大鼠 0.02、0.1 或 0.5%苦瓜凍乾粉末 8 週,與未食用者相比,食用苦瓜大鼠的體重獲得量、攝 食量及各臟器重皆無顯著差別,血液中細胞數、細胞體積及血色素數值也未 有顯著差別 (Platel et al., 1993),本實驗 BGP 組脾臟重量較高是否是因為所 採用劑量 5%凍乾粉末當中水溶性有毒性物質量較高而造成,在未來的研究 中需要小心求證。
TG 也顯著下降;EAE 組 TC 與 HF 組並無差異,TG 下降情形則低於 BGP 組但高於 HF 組,似乎具有改善血液 TG 的可能,此點與實驗一第九週時不 同,可能是因為老鼠開始介入的年齡較小、適應期為低脂 chow diet 及每批 萃物處理不同造成。
在相關性分析中發現,第八週時血液 TC 與體重、副睪脂肪重、腎周 脂肪重、血液 leptin 濃度呈顯著正相關,經校正體重或體重變化後,依舊與 副睪脂肪重、腎周脂肪重、血液 leptin 濃度呈顯著正相關,校正副睪脂肪重、
腎周脂肪重後,TC 與體重間顯著相關性消失,若同時校正副睪脂肪重及腎 周脂肪重,TC 與體重相關性下降至 0.006,可見 TC 與副睪脂肪重、腎周脂 肪重、血液 leptin 間有很強的相關性存在。在第八週血液 TG 方面也可看到 類似前述的情形,故 TC、TG 及副睪脂肪重、腎周脂肪重、血液 leptin 之間 存在有很強的相關性。
血液 HDL-C 方面,三組間未達顯著差異,但 BGP 及 EAE 組較 HF 高,與實驗一結果相同,比較數值,發現實驗一、二 BGP 組及 EAE 組數值 結果相似,但 HF 組於實驗一時濃度較低,故長期實驗處理可使組間 HDL-C 差異更顯現。
已知 adiponectin 為脂肪細胞分化時所分泌的激素,且可視為體內 PPAR-γ被活化的指標,因此本實驗利用測量血液中 adiponectin 濃度了解是 否有 PPAR-γ活化的情形。Adiponectin 濃度在三組間並無統計上顯著差異,
但 BGP 組有較高的現象,似乎表示山苦瓜凍乾粉末具有活化脂肪組織 PPAR-γ的能力,但山苦瓜乙酸乙酯萃物則無看到此現象。前人研究中也曾 發現,給予大鼠 1%苦瓜汁凍乾粉末搭配高脂飲食,相對於未食用苦瓜者,
具有較低的內臟脂肪重量與較高的血液 adiponectin 濃度 (Q. Chen & Li, 2005)。相關性分析中可看到,排除體重後,adiponectin 與副睪及腎周脂肪
正相關性,與本研究相同,但本研究進一步作圖分析三組差異,發現 HF 及 EAE 組 adiponectin 濃度與脂肪重 (副睪脂+腎周脂)呈現正相關,BGP 組則 呈現負相關,雖然本實驗樣本數少,相關性可能較不具代表性,但此一現象 似乎也說明了 BGP 組 adiponectin 生成或代謝的確與其他兩組不同。
本研究測量血液中 leptin 濃度,發現 BGP 組明顯較低,但統計上與其 他兩組未達顯著差異,前人研究給予大鼠高脂飲食加 0.375、0.75 或 1.5%苦 瓜汁凍乾粉末 9 週,可看到血液中 leptin 濃度在食用苦瓜組有較低於高脂組 的現象,但未達統計上差異 (Qixuan Chen et al., 2003b)。本實驗相關性分析 中,leptin 與體重、副睪脂肪及腎周脂肪重量呈顯著正相關,校正過體重及 體重變化後與副睪脂肪及腎周脂肪相關性依舊很高,若將副睪脂肪及腎周脂 肪一起校正,則與體重相關性僅剩 0.011,可見本研究中 BGP 組 leptin 濃度 較低應該是其體脂肪較低的另一表徵。當脂肪細胞越大或所儲存的三酸甘油 酯越多,leptin 表現也將越多 (Hamilton et al., 1995, Tritos & Mantzoros, 1997),是否 BGP 組除了具有較少的脂肪量,其脂肪細胞較小、或所含三酸 甘油酯也較少值得進一步了解。
檢測肝臟中 PPAR-αmRNA 表現,發現組間並無顯著差異,前人研究使 用 5%山苦瓜凍乾粉末或 1g/kgBW/day 乙酸乙酯萃物管餵 C57BL/6J 小鼠 2 週,可看到肝臟 PPAR-αmRNA 表現量顯著高於對照組(趙哲毅, 2003),與本 研究結果不同,然該研究採用 5%脂肪飼料餵食實驗鼠,本研究則採 20%高 脂飼料餵食,已知高脂飲食可顯著誘發小鼠肝臟 PPAR-α下游基因表現及其 本身 mRNA 表現量 (Patsouris et al., 2006),推測因此使組間差異不易顯現。
此外,由於 PPAR-αmRNA 表現量並未有組間顯著差異,但 BGP 組卻有觀 察到血液 TC、TG 下降及 HDL-C 上升等可能為 PPAR-α下游基因被活化的 情形,所以推測在高脂飲食下,山苦瓜凍乾粉末中具有可活化 PPAR-α下游 基因表現之 ligand,但並無法使 PPAR-αmRNA 表現量高於對照組。
在肝臟 MTP mRNA 表現,組間雖無顯著差異,但仍可發現 BGP 組明顯
酸甘油脂濃度偏高的情形。