國立交通大學
生物科技學系研究所
碩士論文
開發多功能性磁性奈米粒子用於胰臟癌的早期
診斷
Development of multifunctional magnetic
nanoparticles for specific and early diagnosis of
pancreatic cancer
研究生 : 林昆諒
指導教授 : 王雲銘 教授
開發多功能性磁性奈米粒子用於胰臟癌的早期診斷
Development of multifunctional magnetic nanoparticles for specific
and early diagnosis of pancreatic cancer
研究生 : 林昆諒 Student:Kun Liang, Lin 指導教授 : 王雲銘 教授 Advisor:Yun Ming, Wang
國 立 交 通 大 學 生物科技學系
碩 士 論 文
A Thesis Submitted to Department of Bioscience and Technology College of National Chiao Tung University in partial Fulfillment of the Requirements for the Degree of Master
in
Bioscience and Technology August 2011
Hsinchu, Taiwan, Republic of China
開發多功能性磁性奈米粒子用於胰臟癌的早期診斷
學生:林昆諒 指導教授:王雲銘 中文摘要
本文研究的目的為設計功能性的磁性奈米粒子應用於光學與磁振造影
雙功能的對比劑,而我們將利用 MnMEIO-NH2-mPEG 同樣修飾上 MUC4
之抗體,作為偵測胰臟癌細胞表面上的 MUC4 蛋白。本文研究奈中已經成 功設計新型的高分子聚合物 mPEG-NH2-silane 修飾到奈米粒子表面,其共 軛胺基會在奈米內側形成而不會裸露在外,此時會降低非特異性的吸附或 是鍵結,然而為了讓奈米粒子更接近電中性,利用半胱胺酸遮蔽內側胺基, 使電性中和。動態光散射儀顯示,MnMEIO 鍵結 MUC4 抗體可使水合直徑 由39.3 ± 2.2 nm 增加至 55.9 ± 5.6 nm。MnMEIO-Ab-Cy777-mPEG 在 20 MHz, 37.0 ± 0.1 ℃下的 r1及 r2弛緩率分別為 35.7 ± 1.5 和 216.1 ± 4.4 mM-1S-1,在 MRI 體外顯影上針對表面 MUC4 蛋白之細胞株獲得很好的對 比影像。因此,本文研究已成功設計出用於胰臟癌的高度專一性的功能性 磁性奈米粒子,可用於胰臟癌的早期診斷。
Development of multifunctional magnetic nanoparticles for specific
and early diagnosis of pancreatic cancer
Student:Kun Liang, Lin Advisor:Yun-Ming, Wang Abstract
Novel aspect of nanotechnology and biotechnology has been extensively exploited to develop multimodal contrast agent for cancer detection. We have developed highly specific dual modality T2 weighted MR-optical imaging agents (MnMEIO-antiMUC4-Cy777-mPEG NPs) for early detection of pancreatic cancer. A novel PEG derivative, methoxypoly(ethylene glycol)-ethylamine-silane (mPEG-NH2-silane), was strategically designed and synthesized such that amine group of NPs remain buried deep inside the entangled mPEG chains. Furthermore, in order to achieve nearly neutral surface charge of MnMEIO NPs, nonconjugated passively masked NH2 was further blocked by cysteine. Dynamic light-scattering (DLS) measurements revealed that the mPEG-NH2-silanecoated MnMEIO NPs has a relatively narrow size distribution with mean size of 39.3 ± 2.2 nm which was increased 55.9 ± 5.6 nm upon conjugating anti-MUC4 mAb, and Cy777. The relaxivity values (r1
and r2) of the MnMEIO-Ab-Cy777-mPEG NPs measured at 20 MHz and 37.0 ±
0.1 C are 35.7 ± 1.5 and 216.1 ± 4.4 mM-1s-1, respectively. In vitro MR image shows significant contrast enhancement in MUC4 positive cell line. Therefore, we believe the highly sensitive and specific MnMEIO-antiMUC4-Cy777 NPs introduced in the present thesis could potentially be used for early detection of pancreatic cancer.
誌謝 驪歌響起,鳳凰花紛飛,記憶的碩士生涯已畫下句點。回首過去的種 種,全都歷歷在目,艱辛而充滿挑戰的研究過程,充滿著未知且疑問的枷 鎖,非得找出那初淺的基礎邏輯才能把深層的概念給釐清貫通,研究的目 的在於解釋實驗的矛盾之處,並把正確的實驗法則鉅細靡遺的排列出來, 最後才可以發現原來實驗也有迷人之處,並可激起研究的熱忱。 感謝王老師在實驗室提供研究環境,並感謝光美、存洧、彥豪和山雞 學長姐在實驗上的鼓舞與解答,也感謝宗憲、英妊和善淳在我不想吃飯時 候還極力邀請我去吃爭鮮,更重要的是參加各項論文研究、學術研討會以 及發表論文演說所產生的革命情感;再感謝宗倫、淳珊以及心平學弟妹帶 給實驗室頑皮的氣氛,最後感謝新進碩一新生的學習與幫助,讓我能給予 他們指導與教誨;特別感謝已經畢業的彥勳還有辛加安在實驗上給予的協 助與參與,並討論出許多的實驗盲點,尤其是在夜晚的酒精暢談更能了解 原來乙醇能帶給研究樂趣。 最後感謝我的家人以及在背後支持我的朋友,沒有你們相信在研究以 外的生活也會暗淡無味,結束了碩二的生涯,轉往下一個旅程,挑戰的路 將再繼續。
目錄 中文摘要 ... I Abstract ... II 誌謝 ... III 表目錄 ... VII 圖目錄 ... VIII 一、緒論 ... 1 1-1 MRI 技術演進 ... 1 1-2 磁性奈米粒子(Magnetic nanoparticles) ... 5 1-3 磁性奈米粒子的合成 ... 6 1-4 化學共沉澱法製備氧化鐵奈米粒子 ... 6 1-5 高溫裂解方式製備超順磁氧化鐵奈米粒子 ... 7
1-6 生物相容性聚合物-聚乙二醇(Polyethylene Glycol, PEG) ... 8
1-7 胰臟癌標定蛋白-黏蛋白 ...10 二、研究動機與目的 ... 12 三、實驗儀器與試藥 ... 13 四、實驗步驟及方法 ... 17 4-1 超順磁氧化鐵奈米粒子參雜錳(MnMEIO)之製備與合成(5) ... 17 4-2 mPEG-acrylate (mPEG-Ac)之合成(1) ...18
4-3 N-acryl-(3-aminopropyl)triethoxy silane (APTES-Ac)之合成(2) ...18
4-4 N,N’-APTES -N-Boc(ethylenediamine)-mPEG (mPEG-NBoc-silane)之合成(3) ...19
4-5 N,N’-APTES -N-Boc(ethylenediamine)-mPEG(mPEG-NBoc-silane)的水解 (N,N’-APTES-ethylamine-mPEG) (4) ...19 4-6 近紅外光螢光團 CyTE777 之合成(7) ...20 4-7 近紅外光螢光團 CyTE777-NHS ester 之合成(8) ...21 4-8 NSMP (N-succinimidyl-3-maleimidopropionate) linker 之合成(10) ...22 4-9 超順磁氧化鐵-錳奈米粒子(MnMEIO)表面修飾 PEG 聚分子(6) ...23
4-10 水溶性超順磁氧化鐵-錳奈米粒子之表面胺基測定 ...24 4-11 近紅外光螢光基團鍵結至磁性奈米粒子上 MnMEIO(NH2)-Cy777-mPEG 之合成(9) ...25 4-12 MnMEIO-linker-Cy777-mPEG 之合成(11) ...25 4-13 Anti-MUC4 抗體修飾硫基之合成 ...26 4-14 Anti-MUC4 抗體鍵結至超順磁氧化鐵-錳奈米粒子之合成 ...27 4-14.1 實驗組 MnMEIO-Ab-Cy777-mPEG ...27 4-14.2 對照組 MnMEIO-Cys-Cy777-mPEG ...28 4-15 穿透式電子顯微鏡(TEM)之鑑定 ...28
4-16 X 光能量分散光譜(Energy Dispersive Spectroscopy, EDS)之磁性奈米粒子內部元素鑑定 ...28
4-17 超導量子干涉磁量儀(SQUID)磁性之測定 ...29
4-18 X 繞射光譜儀 (power X-ray diffraction, XRD)之晶體鑑定 ...29
4-19 核磁共振光譜儀( NMR)之鑑定 ...30
4-20 傅利葉轉換紅外線光譜儀(FT - IR)鑑定 ...30
4-21 動態光散射儀(Dynamic Light Scattering, DLS)測定 ...31
4-22 表面電位(zeta potential)測定 ...31
4-23 縱向弛緩率(r1)及橫向弛緩率(r2)之測定 ...32
4-24 蛋白質定量檢測 (BSA assay) ...32
4-25 細胞培養 ...33
4-26 流式細胞儀(Flow cytometry)測定 ...33
4-27 體外(In vitro) MRI 細胞造影 ...34
五、結果與討論 ... 36
5-1 磁性奈米粒子內部結構與其物、化性探討 ...36
5-1.1 Energy-dispersive spectrometer (EDS)鑑定 ...36
5-1.2 超順磁氧化鐵-錳奈米粒子之晶體結構 ...36
5-1.3 TEM 之奈米粒子大小測定 ...37
5-1.5 FTIR (Fouries tranform infrared, FTIR)分析磁性奈米氧化鐵表面特定官能基之吸收振動 頻率分析 ...37 5-1.6 縱向弛緩率(r1)及橫向弛緩率(r2)之分析 ...38 5-1.7 超順磁氧化鐵-錳奈米粒子表面電價與 pH 變化之分析 ...39 5-1.8 pH 值對超順磁氧化鐵-錳奈米粒子穩定性的探討 ...40 5-2.1 流式細胞儀對磁性奈米粒子上的抗體其專一性功能進行分析 ...40
5-2.2 體外(In vitro) MRI 造影實驗之探討 ...41
六、結論 ... 43
七、參考文獻 ... 44
表目錄 ... 48
表目錄
表一、傅立葉轉換紅外光光譜儀分析 MnMEIO/oleic acid/oleylamine(5),
mPEG-NH2-silane(4), and MnMEIO(NH2)-mPEG(6)。………..48 表二、MnMEIO(NH2)-mPEG、MnMEIO-linker-Cy777-mPEG、 MnMEIO-Ab-Cy777-mPEG 、MnMEIO-Cys-Cy777-mPEG 之水合直徑與弛 緩率之分析。...49 表三、表面電位對MnMEIO(NH2)-mPEG、MnMEIO-linker-Cy777-mPEG、 MnMEIO-Ab-Cy777-mPEG 、MnMEIO-Cys-Cy777-mPEG 之測定,其偵測 濃度控制在25.0 ± 0.1 ℃下,樣品濃度為 1 mg/mL。...50
圖目錄 圖一、核磁共振造影之技術演進。……….51 圖二、針對不同的胰臟癌細胞,利用西方點墨法判別不同程度的MUC4 表 現量。 ……….52 圖三、MnMEIO-linker-Cy777-mPEG 合成流程圖。………..53 圖四、APTES-Ac 之1H-NMR 光譜圖。………..54 圖五、mPEG-Ac 之 1H-NMR 光譜圖。………55 圖六、mPEG-NBoc-silane 之1H-NMR 光譜圖。………56 圖七、mPEG-NH2-silane 之 1H-NMR 光譜圖。………..57 圖八、NSMP 之1H-NMR 光譜圖。……….58 圖九、超順磁氧化鐵-錳奈米粒子之 TEM 影像,平均粒徑為 8.8 ± 0.8 nm, 焦距(A) 200,000 倍率 ; (B)500,000 倍率。……….59 圖十、室溫下超順磁氧化鐵-錳奈米粒子之磁性分佈圖(A)飽和磁化率 = 101 emu/g ; (B)矯頑磁力 ~ 10.1 Oe。………..59 圖十一、超順磁氧化鐵-錳之 EDS 元素分析,(A)疏水性超順磁裸核氧化鐵-錳奈米粒子;(B)親水性超順磁氧化鐵-錳奈米粒子。………..60 圖十二、超順磁氧化鐵-錳奈米粒子之 XRD 繞射分析。……….61
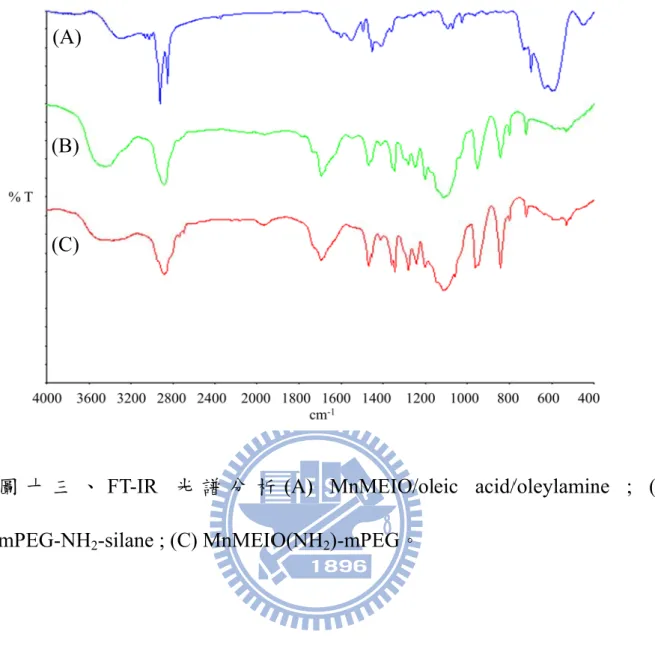
圖 十 三 、 FT-IR 光 譜 分 析 (A) MnMEIO/oleic acid/oleylamine ; (B) mPEG-NH2-silane ; (C) MnMEIO(NH2)-mPEG。………..62
圖十四、超順磁氧化鐵-錳表面電價與 pH 變化之分析圖,(◆)
MnMEIO(NH2)-mPEG 及(■) MnMEIO-linker-Cy777-mPEG。………..63 圖十五、pH 值對超順磁氧化鐵-錳奈米粒子(◆) MnMEIO(NH2)-mPEG 及(■) MnMEIO-linker-Cy777-mPEG 穩定性的探討。………..64 圖十六、超順磁氧化鐵-錳奈米粒子針對細胞株表面蛋白(MUC4)專一性作分 析,(A) HPAC (positive); (B) BxPC-3 (positive) ; (C) Panc 1 (negative)。(C: control;P:MnMEIO-Cys-Cy777-mPEG;PA: MnMEIO-Ab-Cy777-mPEG)。……….………65 圖十七、磁性奈米粒子鐵離子濃度(MnMEIO-Cys-Cy777-mPEG、 MnMEIO-Ab-Cy777-mPEG 及 ResovistTM)之磁振造影訊號圖。…………..65 圖十八、磁性奈米粒子鐵離子濃度(◆) MnMEIO-Cys-Cy777-mPEG ; (■) MnMEIO-Ab-Cy777-mPEG ; (▲) ResovistTM)之磁振造影訊號分析圖。……66
圖十九、MUC4 高表現之細胞株(HPAC、BxPC-3)與 MUC4 低表現之細胞株
(Panc 1),由實驗組 MnMEIO-Ab-Cy777-mPEG 與對照組
MnMEIO-Cys-Cy777-mPEG 反應之體外(In vitro) 磁振造影影像。……….67 圖二十、MnMEIO-Ab-Cy777-mPEG 、MnMEIO-Cys-Cy777-mPEG 體外(In vitro)磁振造影之影像訊號分析。……….68
一、 緒論 1-1 MRI 技術演進 自古以來,不藉由手術的方式,而能夠探視人體內的器官與組織架構, 一直是醫師的夢想。為了瞭解藥物在人體內的循環與治療效果,醫學診斷 的成像模式已經快速且有目的性的擴展,舉例來說,目前現有用來診斷人 體內部的功能性成像系統有:X射線(X-ray)、電腦斷層掃描(computed tomography, CT)、正子斷層造影(positron emission tomography, PET)、單光 子發射電腦斷層掃描(single-photon emission computed tomography, SPECT)、 超音波影像(ultrasound)和核磁共振造影(magnetic resonance imaging, MRI)[1],
每個系統都依據其物理原理創造出成像資訊,但有各其優缺點[2]。在電腦斷 層掃描(CT)裡,利用單一軸面的X射線旋轉照射人體,根據不同密度的人體 組織對X射線的吸收度不同,如骨骼阻擋了大部分的X射線,而軟組織及體 液則沒有,最後以電腦的運算技術重建三維的影像訊號,把斷層影像堆疊 累加形成立體影像。進行正子斷層造影(PET)掃描時,會使用半衰期較短的 放射性同位素追蹤劑(如氟化去氧葡萄糖fluorodeoxyglucose, FDG,其放射性 同位素為氟-18,常用於腫瘤成像),將其注入血液中時,衰變的過程會放出 正電子(β衰變),正電子將會與生物體內的一個電子結合,產生幾乎相反方 向的光子,當光子遇到偵測器內的閃爍晶體時會形成光點,隨即被光敏感
的光電倍增管或是光電二極體所探測到,因此當放射性同位素進入人體後, 須使其進入分子生物的代謝系統中,並集中於感興趣的腫瘤或是器官,進 而得到活體成像。單光子發射電腦斷層掃描(SPECT)的基本原理與正子斷層 造影(PET)相似,但其偵測訊號為放射性同位素衰變所產生的伽瑪射線,使 用2D鏡頭獲得多個視角,然後利用層析重建算法獲得3D的影像數據,與正 子斷層造影(PET)相同的缺點為空間的解析度上有不足。超聲波造影 (ultrasound)適用於高於人耳聽力的20千赫,典型的掃描儀器操作採用的範圍 為2至13兆赫的超聲波,利用頻率穿透人體進行圖像的空間解析度(例如,較 低頻率會給予較低的空間解析度但更大的成像深度)。現有超聲波造影劑製 成的微泡可注入人體,這些微泡有高度的迴聲並可以結合抗體鍵結到血管 內的受體,因此影像的對比是經由微泡迴聲而偵測出周圍組織間的差異性。 空間解析度最好的非核磁共振造影 (MRI)莫屬,相較於低解析度的電腦斷 層掃描以及超聲波,磁振造影提供50微米的空間解析度,因此,顯微電腦 斷層掃描(micro-CT)以及顯微超聲波(micro-US)也將踏入臨床應的與開發的 階段。比起其他成像技術而言,超聲波是觀測較小目表的理想方法 ,但針 對組織中較小的患部的變異處卻顯得不足,其原因為偵測小部位的能量訊 號會彼此覆蓋而造成影像訊號的流失[3]。而另外正子斷層造影(PET)和單光 子發射電腦斷層掃描(SPECT)有著極佳的偵測靈敏度以及生物體內三維的 空間資訊[4,5],雖然可以提供疾病的發病過程以及生理代謝活動的機制[6,7],
但放射性的同位素對人體造成的額外副作用也不能忽視。
磁振造影(MRI)是目前臨床醫學最安全的掃描儀器,由強大的磁場控制 著氫原子的內在磁場,並產生訊號的增減差異性,用來偵測人體內水分子
在不同組織與器官分布的情形[8-10],值得注意的是,其原理為利用核磁共振
(nuclear magnetic resonance, NMR)與氫原子內核自旋間所產生的交互作用
而得到MRI訊號的成像技術[1,11]。因此,像是應用於體內快速流動的血液之
功能性磁振造影(fMRI)[1,11,12],其功能可偵測腦內不同磁性的含氧或脫氧紅
血球蛋白,進而得知局部腦血容量或是血栓疾病等特徵[13],除此之外磁振
造影也可提供血液流速的技術,稱之為核磁共振血管造影(magnetic
resonance angiography, MRA),其原理為血液通過毛細管時,透過動脈自旋
標記和動態訊號增強的核磁造影技術可以追蹤血液在組織分布的情形[1],值 得注意的是,為了收集更好的量測訊號,需要更好的無線電頻率輔助,才 可架構更好的立體形象[14-16]。核磁造影技術有其獨特的潛力,比較其他可 用的檢測方式,核磁共振造影探討體內水分子的擴散(即分子隨機運動模式), 能夠帶給病人方便以及非侵入性的診斷結果[17-22]。核磁共振造影的演進與 其新的進展如圖一所示[23-29]。現在多模組功能的成像技術開始發展,提供 不同的影像解析層級,如:CT/PET, CT/SPECT和MRI/PET等例子的組合。 另一種核磁共振造影與光學成像的方式也還
nanoparticles, MION),其奈米粒子能擴散至淋巴結,因此被用於標記近紅外 光螢光物質(near-infrared fluorescence, NIRF),並可應用於光學造影的螢光
探針[30],也可在奈米表面修飾胜肽或是生物標的蛋白(如:腫瘤相關蛋白酶), 使得腫瘤相對應的組織環境有奈米粒子的沉積,藉此提高局部螢光訊號[30]。 然而,螢光在體內的偵測有時需要藉由手術或是侵入性的方式來獲取光學 資訊,因為深部組織不適用於螢光成像方法,主要在於血液中的血球蛋白 及血漿會吸收600波長內的螢光放射波長,因此考慮以近紅外光的螢光放射 波長可大大降低背景訊號的干擾。近期研究已有將螢光物質藉由靜脈注射 的方是注射入老鼠體內,並觀測骨髓細胞分化成骨頭的過程[31,32]。除此之外, 導管型的光學成像也被利用於人類冠狀動脈的量測,藉由導管方射超聲波 與反射紅外光的方式進行測量,此種新穎的技術稱為光學相干斷層掃描 (optical coherence tomography, OCT)[33,34] ,這是使用光對生物組織進行高分 辨橫截面成像的新的影像學檢查方法,其中的顯微光學成像技術可結合可 見光、螢光、共軛焦與雙光子顯微鏡。 在奈米技術發展的過去20年來,由於核磁造影技術的日漸普及,新型 的磁性奈米粒子相對應的開發中,導致生物醫學在奈米粒子應用於磁振造 影的熱潮開始展開,包括治療與診斷的應(theragnostics)如:熱療[35,36]、幹細 胞追蹤[37-39]、基因表現[40-442]、血管生成[43-46]、癌症檢測[47-49]、炎症[50-52]、 細胞凋亡檢測[53-55]和動脈硬化[56,57]。
1-2 磁性奈米粒子(Magnetic nanoparticles) 在過去的十年中,合成超順磁氧化鐵奈米粒子已經發展快速,不僅提 高科學在醫學上的效益,也包含了許多技術的應用,其中包含著磁性物質 的載體的應用,如:生物感測器[58]、醫療應用、標靶藥物[59,60]、核磁共振 造影對比劑和磁性噴墨等應用價值。能控制粒子分散在溶液中並保持顆粒 性的一致與均勻性是非常重要的議題,因為功能性的奈米晶體很大的效益 取決在於奈米粒子的尺寸。要了解磁力線體的行為並提高應用程序與發開 價值,並須認真看待相關流體的穩定性,控制表面活性劑、顆粒的大小、 材料以及物理行為是不可或缺的一環。 超順磁氧化鐵奈米粒子具有適當的表面化學結構可用於多種組織與活 體應用,如:核磁共振造影的對比強度提升、組織修復的情形、免疫學、 解毒過程中的生物內分泌動向、藥物輸送和細胞分化[61]。所有的醫學應用 必須要求這些磁性奈米粒子需要較高的磁化率,而且須小於100奈米層次並 顆粒分明,其中還包括了磁性奈米粒子的表面塗層須無毒害,且生物相容 性高,當然這些磁性奈米粒子也要具備有穩定的特異性鍵結能力(如針對腫 瘤受體的抗體功能)。這些結合蛋白質、藥物、酵素與抗體的奈米粒子可用 於組織的追蹤,或是在核磁共振造影下具有增加器官對比性的特徵[62]。因 此,在本論文綜述中將介紹如何得到一個超順磁氧化鐵奈米粒子。
膠液 法、 因為 形。 過程 見合 的氧 進行 根據 來看 環境 因此 (γ-F 1-3 磁性奈 許多化學 液法、溶膠 、注入式合 為主要是膠 。(2)合成過 程。如:超 合成磁性奈 1-4 化學共 在共沉澱 氧化物(Fe3 行反應,四 據熱力學的 看鐵三價和 境下攪拌, 此自然界中 Fe2O3),其 奈米粒子 學方式可用 膠-凝膠聚 合成法以及 膠體性質 過程是可重 超速離心篩 奈米粒子的 共沉澱法 澱法技術中 3O4或γ-Fe 四氧化三鐵 的反應,要 和鐵兩價的 不過由於 中的磁鐵礦 其反應式(2 子的合成 用於合成磁 聚合法(so-g 及電解法 ,並須注意 重複的反 篩選、體積 的方法為化 法製備氧化 中,為最簡 e2O3),通 鐵的反應式 要完成此反 的比例須為 於四氧化三 礦(Fe3O4)接 2)如下: 磁性奈米 gel)、超聲 。超順磁 意幾項規 反應,而且 積管柱層 化學共沉 化鐵奈米粒 簡單且最 通常準備由 式(1)如下 反應必須使 為2:1, 三鐵不是在 接觸氧氣 米粒子應用 聲波化學法 磁氧化鐵的 規則:(1)確 且可以工業 層析篩選或 沉澱技術。 粒子 最有效率的 由化學劑量 下: 使pH值維 而且反應 在空氣下不 氣的環境下 用於醫療成 法、水熱反 的合成是非 確定反應過 業化並沒有 或是磁過濾 的化學合成 量算出的鐵 維持在8到 應過程中必 不是很穩 下容易氧化 成像系統, 反應、水解 非常複雜的 過程中粒子 有任何複雜 濾法。然而 成途徑用來 鐵和鐵鹽類 (1) 14間,以化 必須保持在 穩定,容易被 化成赤鐵礦 ,如微乳 解和熱解 的過程, 子分布情 雜的純化 而,最常 來製備鐵 類在水中 化學劑量 在無氧的 被氧化, 礦 解 量
共沉 有限 程中 達臨 質的 必須 以反 大小 性比 發展 合成 備出 境之 備且 1-oc doso 沉澱法的主 限的,因為 中涉及兩個 臨界過度飽 的化學特性 須在晶核生 反應的過程 小以及磁特 比起高溫裂 展。 1-5 高溫裂 熱裂解法 成奈米粒子 出的奈米材 之下合成, 且反應過程 ctadecene[ osane[68,80] 主要優勢為 為只有動力 個階段,其 飽和態才會 性。此兩個 生成的同時 程必須快速 特性。不過 裂解的方式 裂解方式 法主要是在 子,其最大 材料是非水 ,其優點是 程複雜。有 [63,74-76]、ph ] 及 eicis 為可生產大 力學因素控 其一為晶核 會發生,其 個階段必須 時使得表面 速進行,改 過由於共沉 式來得低 式製備超順 在有機相中 大的優點是 水溶性的 是產物純度 有機相合成 henol ethe sane[68,80]等 大量的奈 控制著晶 核發生的 其二為晶 須分開,原 面晶體得 改變溶質 沉澱法的 ,因此開 順磁氧化鐵 中,在有界 是合成出 。水熱法 度高且適 成的奈米 er[65,66,77,78] 等),而不 奈米粒子, 晶體的生長 的過程快速 晶核增長的 原因在於要 得以擴散成 質濃度可調 的奈米粒子 開始有相對 鐵奈米粒子 界面活性劑 出的粒子粒 法是以水為 適用大部分 米粒子通常 ] 、dioctyl e 不同沸點的 ( 然而控制 長。因此, 速且短暫, 的過程是緩 要形成單分 成長並窄化 調節氧化鐵 子性不是非 對應的高溫 子 劑(surfact 粒徑分佈範 為主要溶劑 分的金屬, 常是在高沸 ether[67,70,7 的溶劑能形 (2) 制粒子的分 在共沉澱 須等到該 緩慢且須考 分散的奈米 化在特定大 鐵奈米粒子 非常完整, 溫合成氧化 tant)的高溫 範圍非常小 劑在高溫高 但是無法 沸點的溶液 79]、octade 形成的粒子 分佈卻是 澱法的過 該物質到 考慮到溶 米微粒, 大小,所 子生成的 ,且磁特 化鐵開始 溫環境下 小,但製 高壓的環 法大量製 液中(如: cane[68]、 子粒徑大 下
小不同,且高沸點的溶液在高溫下為惰性試劑。反應需加熱至200~400°C 以裂解有機金屬離子錯合物。其反應速度快、所得奈米粒子結晶程度良好 而且粒徑均勻,但表面吸附大量疏水性賦形劑,需經過配位基交換或是包 覆以增加其生物相容性。
在眾多的高溫裂解前驅物(precursor)如:Fe(CO)5[48,54,57,66,68]、
Fe(acac)3[52,53,64,65]、Fe(nitrile)3[19]、Fe(olate)3[50,61,62,69,70]和Fe(olate)2[61]之中,
本研究嘗試以正三價乙醯丙酮鐵錯合物Fe(acac)3 作為前驅物合成氧化鐵奈 米粒子,或加上正二價乙醯丙酮錳錯合物Mn(acac)2,合成氧化鐵參雜錳之 奈米粒子。以乙醯丙酮鐵錯合物為前驅物有三項原因:第一點是前驅物為 市售,取得容易且成本不高;第二點是合成的奈米粒子粒徑均勻;第三點 以乙醯丙酮鐵錯合物為前驅物的奈米粒子,尺寸的控制很自由(8 ~ 50 nm), 無需製作核種後再次反應以增加尺寸,只要利用不同濃度的前驅物或是改 變界面活性劑(surfactant)的比例即可。本研究就利用固定前驅物以及界面活 性劑的量,只改變溶劑多寡從而調整反應濃度,以達到控制奈米粒子生成 粒徑的目的。
1-6 生物相容性聚合物-聚乙二醇(Polyethylene Glycol, PEG)
近年來奈米技術的興起提供了觀察更細微部分以及從事其相關領域研 究的突破。要應用在生物體內必須符合三大基本要件,分別是無生物毒性、 水溶性以及生物相容性。無生物毒性為首要考量因素,一旦材料本身會對
生物體產生毒性或造成不良影響時,即不被考慮做為應用的材料。第二項 則是水溶性,因為生物體內水分占了極大比例,若材料是非水溶性則會造 成排斥或堵塞。最後的是生物相容性,以人為例,人體內存在著巨噬細胞 (macrophages),當異物或細菌侵入人體時,體內各處的巨噬細胞可吞噬清 除異物,此一機制系統,稱為單核球吞噬細胞系統(mononuclear phagocyte system, MPS)。由於氧化鐵奈米粒子有較大的表面積比,使得氧化鐵奈米粒 子容易產生聚集及吸附血漿蛋白(plasma proteins)。因此,當氧化鐵奈米粒 子注射到人體後,一旦氧化鐵奈米 粒子有聚集或吸附現象產生,會迅速被 單核球吞噬細胞系統之巨噬細 胞吞噬,將氧化鐵奈米粒子從血液中快速排 除,而無法到達組織細 胞。因此為了滿足這三項考量,使用高分子來做為 包覆在奈米粒子的薄膜是最常用的方法,此薄膜的材料必須具備高度的生 物相容性(biocompatible)、非免疫性(nonimmunogenic)、非抗原性 (nonantigenic)和抗蛋白質吸附(protein-resistant)。常見的高分子有二氧化矽 (silica)、聚二乙醇(PEG)、聚醚醯亞胺(PEI)、聚離氨酸 (poly-lysine)、葡萄 聚醣(dextran)等。經修飾之氧化鐵奈米粒子,即可避免其聚集與吸附,使氧 化鐵奈米粒子減少被單核球吞噬細胞系統吞噬,而能順利到達組織細胞。 聚乙二醇(poly(ethylene glycol),PEG)[16,18,19,40,41,67,68]是一個低毒性不帶 電荷的親水性殘基,並且可於體內分解代謝,因此在近十年來,有許多藥 物是藉由接上PEG 來改善它們的生物相容性,防止被蛋白質吸附,進而增
加藥物在血液中的循環時間和被細胞攝入,使PEG 在藥物設計上具有高度 的應用性。所以在氧化鐵奈米粒子的表面修飾PEG ,預期能提高氧化鐵奈 米粒子的生物相容性。 1-7 胰臟癌標定蛋白-黏蛋白 胰臟癌是人類在五年內生存率不到5%的致命癌症,死亡率高的主要原 因在於不會有明顯的病兆,直到癌症晚期才診斷出癌細胞已經擴散。現階 段的成像方式往往缺乏具有敏感性的偵測,因此利用新型的奈米生物技術 來偵測癌症並用於核磁共振造影的應用已經廣泛的發展。然而,目前有許 多作為對比劑的功能性奈米粒子因表面電荷的正電性而與細胞膜進行非特 異性的交互作用,導致專一性的標定特性降低,此時會得到靈敏度欠佳的 影像訊號。所以除了發展功能性的奈米載體外,也需要專一性的標定蛋白 來提高生物探針的靈敏度。 而黏蛋白(Mucins)是在生理功能表現上的重要生物分子,由於這蛋白能 專一的針對胰臟癌表現的病人給予正確的診斷,這是因為除了癌症外,慢 性胰臟炎和一般的胰腺表現黏蛋白的程度大有不同,藉此我們可以利用這 樣特殊的蛋白標記來診斷以及區分腫瘤與普通疾病的差異性。2001 年,Batra S. K.等人針對黏蛋白的大家族進行分析,收集腫瘤細胞的細胞株、癌症病 人以及慢性胰臟炎實驗組,對其黏蛋白之RNA 的鑑定進行反轉錄並做西方
點墨法分析,這說明了,MUC4 蛋白佔有多數細胞株的表現量,並藉此研 究團隊也針對43-84 歲間的胰臟炎患者進行 RT-PCR 分析,此結果也說明了 MUC4 在病患在不同年齡層也有不同的表現量存在,然而研究團隊最後也 針對一般胰臟炎的患者進行比較,可以看出MUC4 這蛋白不僅可以區分一 般正常細胞與癌症細胞的不同,同時也開啟了新的標定蛋白。由於目前國 內、外針對胰臟癌的研究與診斷的資訊還在開發的階段。 因此,Batra S. K.團隊藉由黏蛋白的表現量成功的區分癌症病患與一般 胰臟炎病患的差異性。2004年,Batra S. K.團隊針對此蛋白成功的純化出專 一的抗體,並利用此抗體針對不同細胞株作西方點墨法(如圖二所示),可以 看出不同細胞株表現MUC4蛋白的情形,因此,我們實驗室打算利用此抗體 (Anti-MUC4 antibody)修飾到氧化鐵奈米表面,並針對有高表現的腫瘤細胞 株(HPAC、BxPC-3)以及低表現的細胞株(Panc1)進行實驗研究,且以此構想 開發新型的對比劑及其醫學診斷之應用。
二、 研究動機與目的 由於MRI 是藉由組織器官型態改變作為主要的影像診斷依據,而MRI 對比劑的使用可加強型態改變之對比訊號強度,可於組織病變之早期即時 發現,提升疾病早期治療的診斷效率。因此若要提升MRI的檢查效果,除了 儀器本身的改良進步之外,開發具有高度對比效果的對比劑,便是另一個 努力的方向。 因此本文的設計合成是基於能增強MRI之影像訊號的對比性為前期目 標,將利用高溫裂解的方式將錳離子鑲進Fe3O4的結構中,取代亞鐵離子(Fe2+) 的位置,使得弛緩率上升。並利用生物相容性PEG聚分子修飾到磁性奈米粒 子表面,增加其水溶性與在體內的循環時間並降低其生物毒性;除此之外, 後期的目標為新合成的磁性奈米粒子將接上Anti-MUC4知單株抗體,用來診 斷胰臟癌所表現的特殊蛋白(MUC4),最後目的為達成光學與MRI雙功能性 的生物奈米對比劑。
三、實驗儀器與試藥 I. 儀器(Instrumentation):
1. 核磁共振光譜儀(Nuclear Magnetic Resonance Spectrometer, NMR):核 磁共振光譜測定使用Varian Gemini-300 proton/carbon FT - NMR 系統。化 學位移(chemical shift)以值 ppm(part per million)表示,內部標準以 solvent peak(CDCl3, D2O, TMS)為基準。提供化學之分子研究與分子結構實驗。 2. 20 MHz relaxometer:採用 NMS-120 Minispec Brucker。提供作為對比劑
(T2)橫向弛緩時間及(T1)縱向弛緩時間之測定。
3. 穿透式電子顯微鏡(transmission electron microscope, TEM):採用 JEOL JEM-2000 EX II。觀察氧化鐵奈米粒子的分散情形並計算核心尺寸。 4. 粒 徑 分 析 儀 (Dynamic Lght Scattering, DLS) : 採 用 ZetaSizer
Nano-90(Malvern Instruments, United Kingdom)。測量氧化鐵奈米粒子的 粒徑以及表面電位測定。
5. 高速冷凍離心機:採用日本 KUBOTA 5910。提供奈米粒子純化。
6. 超 導 量 子 干 涉 磁 量 儀 (Superconducting Quantum Interference Device Magnetometor, SQUID):採用美國 QUANTUM DESIGN MPMS5。提供 磁性物質之感應磁場及飽和磁化率測定。
7. 紫外光-可見光光譜儀(UV-Visible spectrophotometer):採用 Hitach, U-3010 Spectrophotometer。提供化學結構特定吸收波長之測定。
8. 傅立葉轉換紅外光譜儀(Fourier Transform Infrared Spectrometry, FT-IR: 採用Perkin Elmer System 2000 FT-IR。提供化學結構官能基特定吸收波 數之測定。
9. 質譜分析儀(mass spectrometry):採用 Micromass, Q-Tof, UltimaTM。提供 化合物分子量之測定。
10. X 光能譜散佈分析儀(Energy Dispersive Spectrometer, EDS) :利用掃描
式電子顯微鏡的附加X 射線能量分散光譜儀分析系統進行電子微探元素
分析,採用Hitachi S-3000N 掃瞄電子顯微鏡及附加 Horiba EX-250 EDS,
其加速電壓為20 KeV,並使用 EMAX 之操作軟體,可測量奈米內部的金
屬元素含量。
11. X 光繞射光譜儀(X-ray Diffraction):此為鑑定晶格結構分析,採用Bruker D8 Advance 型號,以 2θ= 20°~ 80°角為掃描範圍,每分鐘 1°角為間隔, 持續一小時。
12. 感應耦合電漿原子發射光譜分析儀(Inductively Coupled Plasma -
Atomic Emission,ICP-AES):採用 Perkin Elmer optima 2000 PV。提供奈 米粒子中鐵、錳含量的測定。
13. 酵素免疫分析儀(Enzyme-linked Immunosorbent reader, ELISA reader):採 用Sunrise 型號( Tecan Co., Grödingen, Austria)的 ELISA reader,其系統偵
測595 以下之波長,可用於測定抗體濃度。
激發螢光染體及散射偏光之測量原理,對微顆立體 (0.5mm~50mm)例如 細胞做定量之統計分析,可作為免疫染色之分析。
II. 實驗藥品(Reagents): Agar Scientific:
S162 Scientific Formvar/Carbon 200 Mesh Cu(50) Aldrich:
Iron (III) acetylacetonate, 99.9+ % Manganese (II) acetylacetonate, 99% Oleic acid, 90%
Oleylamine, 90%
1,2-Hexadecandiol, 90%
methyl poly(ethylene glycol) ( MW:2000,mPEG) Maleic anhydride, 99% β-Alanine, 99% Alfa Aesar: N-Boc-ethylenediamine, 98% Fluka: (3-aminopropyl)triethoxy silane(APTES), 98 % N’-hydroxysuccinimide(NHS), 97 % Malliockrodt: dichloromethane(DCM), 99 % ethyl ether, 90
ethanol, 95 % methanol, 99.7 % toluene, 99.9 %
sodium chloride, 100 % Pierce:
BCA potein assay reagent kit(bicinchoninic acid), 包含 A 劑(contain sodium carbonate, sodium bicarbonate, BCA detection reagent 及 sodium tartrate in 0.1N sodium hydroxide)、B 劑(alkaline medium)及測試用胎牛血清標準品 (bovine serum albumin, fraction V)
RDH: triethylamine(TEA), 99 % trifluoroacetic acid(TFA), 99.5% TEDIA: N,N-dimethylformamide(DMF) Spectrum:
四、實驗步驟及方法
4-1 超順磁氧化鐵奈米粒子參雜錳(MnMEIO)之製備與合成(5)
為了應用於磁振造影之影像追蹤,本研究需要製備超順磁奈米粒子,
且有較高的磁緩率,因此奈米粒子設計合成參考自2004 年由 Shouheng
Sun[81]團隊所合成設計的超順磁氧化鐵奈米粒子參雜錳離子的方式,其合成
方法為將將 Fe(acac)3 (4 mmol, 1.4g)、Mn(acac)2 (2 mmol, 0.51g)、oleic acid (6 mmol, 1.7g)、oleylamine (6 mmol, 1.6g)、1,2-Hexadecandiol (10 mmol, 2.58g)
和5 毫升的 benzyl ether 混合置於雙頸瓶中,並置入在高溫爐內。先加熱至 120℃約等待 15 分鐘左右,此步驟為除去多餘的水氣,接著開啟冷凝系統 並緩慢升溫至200℃ 後持續加熱二個小時使其融解並混合均勻,並加熱至 350℃,到達指定溫度並持續加熱一小時後降溫至室溫。隨後產物加入過量 的丙酮後以13,000 rpm 離心,並利用丙酮清洗,移除多餘的界面活性劑, 離心第二次之後將沉澱物溶於20 毫升的已烷中,加以溶解並離心第三次 (3000 rpm),此次離心目的為去除部分聚集而不能均勻擴散在已烷之氧化鐵 粒子,收集上清液後,再次加入丙酮作最後一次離心(13,000 rpm)隨後的沉 澱物即為MnMEIO (MnFe2O4),可溶於 chloroform、hexane 等溶劑保存。
反應藉由調整benzyl ether 的量改變金屬前驅物的濃度,藉以控制粒子粒徑,
4-2 mPEG-acrylate (mPEG-Ac)之合成(1)
將 mPEG-OH (M.W. = 2,000)(10 mmol, 20 g)加熱至 90-100℃抽真空以 除去mPEG 所包含的水份。抽真空 6 小時之後加入 dry dichloromethane (150 ml)與 TEA (30 mmol, 4.2 mL),並且在 4ºC 下緩緩滴入 acryloyl chloride (30 mmol, 2.4 mL),在室溫下反應 48 小時即完成反應。反應完成後加入碳酸鈉
移除acryloyl chloride 所產生的酸性副產物,抽氣過濾後隨後加熱抽真空以
除去未反應的TEA 與 acryloyl chloride,再用 tetrahydrfuran(THF)析出鹽類,
最後用已烷與乙醚以1:1 的比例作不同相純化,沉澱物即可得 mPEG-Ac,
利用 NMR 鑑定其結構(如圖四所示)。Yield:76 % (15.2 mmol, 31.9 g)。
1H NMR (300 MHz, CDCl
3, ): 3.37(s, 3H, CH3-O), 3.63(m, 104H, PEG chain
protons), 4.30(t, J = 4.7 Hz, 2H, C-CH2-C=O), acryl group: 5.56 (1H), 6.15 (1H),
6.37 (1H).
4-3 N-acryl-(3-aminopropyl)triethoxy silane (APTES-Ac)之合成(2)
將 APTES(40 mmol, 9.33 mL)溶解在 dry chloroform(DCM, 200 mL)並且 加入TEA(80 mmol, 12.9 ml)後 4ºC 下加入 acryloyl chloride(50 mmol, 4.6 mL) 室溫下反應6 小時,然後利用 slica-gel chromatography (eluent:hexane/ethyl acetate = 1/1) 純化即可得 APTES-Ac,利用 NMR 鑑定其結構(如圖五所示)。 yield:71.71 % (28.7mmol, 7.9 g)。1H NMR (300 MHz, CDCl3, ): 0.66 (t, J =
7.1 Hz, 2H, C-CH2-Si), 1.19(q, J = 8.1 Hz, 9H, CH3-CH2-O), 1.65(m, J = 7.5 Hz, 2H, C-CH2-C), 3.32(t, J = 7.1 Hz, 2H, C-CH2-N), 3.81(q, J = 8.4 Hz, 6H,
C-CH2-O), acryl group: 5.61 (1H), 6.11 (1H), 6.21 (1H).
4-4 N,N’-APTES -N-Boc(ethylenediamine)-mPEG (mPEG-NBoc-silane)之合成 (3)
將 APTES-Ac (6.6 mmol, 1.8 g)、mPEG-Ac (6.6 mmol, 13.6 g) 與
N-Bocethylenediamine (7.0 mmol, 0.8 g) 置 入 雙 頸 瓶 中 並 溶 解 在 dry dichoromethane (DCM) (20 mL) 之內,隨後加入 TEA (5mmol, 0.8 mL),於 40~45℃加熱迴流,在氮氣下反應 72 小時,即完成反應。反應完成後用減 壓濃縮機移除多餘的DCM,並加入 THF 析出反應中的 TEA 鹽類副產物, 抽氣過濾收集澄清液,隨後正己烷析出 mPEG-NBoc-silane,利用 NMR 鑑 定其結構(如圖六所示)。Yield:39.4 % (1.9 mmol, 4.5 g) 。1H-NMR (300 MHz, CDCl3, ):0.76 (t, 2H, Si-CH2-C, J = 4.2 Hz), 1.24(t, 9H, CH2-CH3, J = 2.4 Hz), 1.42(s, 9H, C-CH3), 2.48-2.67 (m, 2H, -C-CH2-(C=O)-N, 2H, -C-CH2-(C=O)-O), 2.82-2.98(m, 2H, N-CH2-C-(C=O)-O; 2H, N-CH2-C-(C=O)-N, 2H, N-CH2-C-N), 3.20(t, 2H, -C-CH2-NH-(C=O)), 3.27(s, 3H, -O-CH3), 3.54-3.70(m, ~190H, -(CH2-O-CH2)n-), 4.18(t, 2H, C-CH2-O-(C=O), J = 4.2 Hz). 4-5 N,N’-APTES -N-Boc(ethylenediamine)-mPEG(mPEG-NBoc-silane)的水解 (N,N’-APTES-ethylamine-mPEG) (4)
聚合物(3)的水解主要是為了移去胺基保護基,除此之外也會將silane上 的ethoxy進行酸水解而形成醇基,以trifluoroacetic acid (TFA) 跟DCM (TFA/DCM = 1/1 20 mL) 並加入聚合物分子(3),在氮氣下
進行反應,六小時後即完成水解。最後以乙醚與正己
烷 (ethyl ether / hexane=1/1) 移除TFA 並清洗數次,隨後收集沉澱物真空
抽氣後可得mPEG-NH2-silane,利用NMR鑑定其結構(如圖七所示)。1H-NMR (300 MHz, CDCl3, δ):2.54 (m, 2H, -C-CH2-(C=O)-N-, 2H, -C-CH2-(C=O)-O-), 2.67(m, 2H, N-CH2-C-(C=O)-N-, 2H, N-CH2-C-NH2), 2.86(m, 2H, N-CH2-C-(C=O)-O-, 2H, N-C-CH2-NH2), 3.13(q, 2H, -C-CH2-NH-(C=O), 3.32(s, 3H, -O-CH3), 3.59-3.70(m, ~190H, -(CH2-O-CH2)n-), 4.22(t, 2H, C-CH2-O-(C=O), J = 7.8 Hz), 4.45(s, 3H, Si-OH). 4-6 近紅外光螢光團 CyTE777 之合成(7) N N Cl O3S SO3 Na N N S O3S SO3 Na CO2H IR-783 CyTE-777 Scheme 1 此螢光團之設計合成主要在於可以利用近紅外光能穿透組織之特性用 來對活體進行螢光之追蹤。取 3-mercaptopropionic acid(0.467 mmol, 40.7 μL)
和triethylamine ( TEA ) (0.467 mmol, 65.3 μL) 溶於 DMF 10 mL 並置於圓 底燒瓶中,在室溫下攪拌20分鐘。秤取 IR-783(0.33 mmol, 250 mg)溶於 6 mL 的DMF,使vial瓶中的IR-783完全溶解(成綠色溶液) ,再將此溶液倒入 圓底燒瓶中攪拌反應約21小時(不加熱) ;利用HPLC判斷反應是否反應完全。 待反應結束,在圓底燒瓶中加入冰乙醚,將綠色固體沉澱出來,以抽氣過 濾收集固體,再以CH3OH洗入另一濃縮瓶抽乾,以HPLC分離(條件:CH3CN + 0.1 % TFA;水),純化完將其凍乾,並放在低溫冷凍保存。得綠色棉絮狀 固體0.14克,產率:91.45 %,利用NMR鑑定其結構。1H NMR (300 MHz, CD3OD, δ): 8.89 (d, 2H, J = 14.2 Hz), 7.49 (d, 2H, J = 7.4 Hz), 7.41 (t, 2H, J = 7.6 Hz), 7.34 (d, 2H, J = 7.8 Hz), 7.25 (t, 2H, J = 7.5 Hz), 6.32 (d, 2H, J = 14.3 Hz), 4.19 (t, 4H, J = 6.7 Hz), 3.06 (t, 2H, J = 7.0 Hz), 2.90-2.87 (m, 4H), 2.70 (t, 4H, J = 5.9 Hz), 2.56 (t, 2H, J = 6.9 Hz) 2.00-1.92 (m, 10H), 1.76 (s, 12H). HRMS-ESI [M]- m/z calcd for C41H51N2O8S3 795.2959, found 795.5.
4-7 近紅外光螢光團 CyTE777-NHS ester 之合成(8) N N S O3S SO3 Na N N S O3S SO3 Na CyTE-777 Scheme 2 CO2H O O N O O
官能基為羧基酸的螢光基團對於合成氧化鐵需要縮合試劑進行反應,其
過程較為複雜,為此把CyTE777 修飾成 CyTE777-NHS 較易與奈米粒子上
的胺基進行反應。取CyTE-777 之羧基化合物溶入 500 μl 除水過的 DMF,
隨後加入Dicyclohexylcarbodiimide (DCC) (1.1 mmol, 220.1 mg)以及催化劑 4-(Dimethylamino)pyridine (DMAP) (1.1 mmol, 134.4 mg)反應 12 小時,保持
在避光且氮氣下攪拌。過程由HPLC 觀測反應是否完全,反應後的產物由 冰乙醚沉澱,隨後加入甲醇清洗後凍乾,產物不再用HPLC 作純化。 4-8 NSMP (N-succinimidyl-3-maleimidopropionate) linker 之合成(10) 為了使氧化鐵奈米表面帶有maleimide的官能基,須先合成NSMP (N-succinimidyl-3-maleimidopropionate) linker 之交聯化合物,此化合物能與 超順磁氧化鐵表面胺基進行SN2離去基反應,使得氧化鐵表面能帶有 maleimide官能基,此官能基能與抗體或是胜肽上的硫基作鍵結。取maleic anhydride (10 mmol, 1g)溶於無水的DMF中,隨後加入β-Alanine (10 mmol, 0.91 g),保持在氮氣的環境攪拌1小時,接著緩慢加入DCC(20 mmol, 4.12 g) 反應overnight,攪拌均勻直到maleimide官能基的形成,加入
N-hydroxysuccinimide (12.5 mmol, 1.4 g)室溫下攪拌4-6小時,接著將溶液抽 氣過濾,移除DCU等副產物,濾液加入5倍體積的二次水,並用100 mL 之 二氯甲烷個別萃取兩次,以無水硫酸鎂除水並過濾,減壓濃縮後可得黃白
色沉澱物,接著將產物溶到適量的DCM中,緩慢加入已烷作再結晶析出,
所得白色粉末產物即為NSMP。利用NMR鑑定其結構(如圖八所示)。1H NMR
(300 MHz, CD3OD, δ): 6.74 (s, 2H, -CH=CH-), 3.93 (t, 2H, -CH2-), 2.96 (t, 2H,
-CH2-), 2.82(t, 4H, -CH2-CH2-). HRMS-ESI [M]+ m/z calcd for C11H10N2O6 266.2, found 289.1 [Na]+.
4-9 超順磁氧化鐵-錳奈米粒子(MnMEIO)表面修飾 PEG 聚分子(6)
高溫裂解的磁性奈米粒子其反應為高沸點之有機溶劑,其核外為oleic acid 和oleylamine包覆之疏水性基團,此基團不能應用在生物實驗上,因此 參考自Randy De Palma 所發表在Chemical Materials的方法,其原理為溶膠-凝膠聚合法(so-gel reaction)。首先將溶在氯仿的超順磁氧化鐵-錳奈米粒子 取1 mL,用真空抽氣移去氯仿,隨後加入20 mL甲苯(toluene),由超音波機 震盪10分鐘,接著取聚合物分子(4)以重量比1:20 的方式加到甲苯裡與磁 性奈米粒子進行配位子互換,此過程在60℃下反應,持續震盪8小時後,加 入過量的已烷促使水溶性的磁性奈米粒子沉澱,接著用已烷清洗數次,再 用真空抽氣移除多餘的已烷,加入適量的去離子水後,將水溶液的磁性奈 米粒子通過0.22 μm 的過濾膜,並用分子量為50,000透析膜以去離子水透析 24小時, 即可得到水溶性超順磁氧化鐵-錳奈米粒子。
4-10 水溶性超順磁氧化鐵-錳奈米粒子之表面胺基測定 為了能夠與CyTE777-NHS ester(8)、NSMP化合物(10)鍵結,首先須要 了解磁性奈米粒子上有多少胺基數量,此胺基能與NSMP還有CyTE777上的 NHS進行離去基取代反應,本研究利用OPA檢測法(spectrophotometric OPA assay method),作為磁性奈米粒子表面胺基的檢測方法,o-phthaldialdehyde (OPA)會與一級胺反應,其反應快速、靈敏度高。其作用原理為利用磁性奈 米粒子上其水溶性PEG內側之胺基官能基與o-phthaldialdehyde(OPA)反應, 然後利用甘氨酸與未反應的OPA作用,利用UV/VIS在波長340 nm 定量未反 應之OPA,並以OPA濃度檢量線標準樣品推測奈米粒子上胺基的濃度。 (1) OPA檢測配製: 試劑A - 將OPA溶於乙醇溶液中(0.25M),以及β-mercaptoethanol溶於0.1 M 的Na2B4O7 (pH=9.5)使其濃度為 4 %。取300μl的0.25 M之OPA乙醇水溶液 與300μl之4 %的β-mercaptoethanol 之Na2B4O7水溶液混合均勻,用去離子水 稀釋至總體積為50 mL。(OPA濃度為1.5 × 10-3 M)。 試劑B – 將glycine溶於0.1 M Na2B4O7 中,其濃度為0.06 M,以及 β-mercaptoethanol溶於0.1 M的Na2B4O7 (pH = 9.5)使其濃度為0.5 %。取500 μL之0.006 M 之glycine溶液與500 μL之0.5 % β-mercaptoethanol混合均勻後, 用去離子水稀釋至30 mL。(glycine的濃度為1.0 × 10-3 M)。 OPA標準溶液配製 – 在試管中分別加入2 ml之0.1 M Na2B4O7和100 μL
之試劑B,再配製1.5 mM、1 mM、0.5 mM、0.1 mM、0 mM不同濃度的試 劑A,取50 μL 加入其中,混合均勻後,反應兩分鐘隨後以UV/Vis光譜儀測 定340波長之吸收,得到OPA之濃度檢量線。 以OPA檢測表面胺基時,取2 mL 之試劑A於試管中,加入50μL的磁 性奈米粒子混合均勻後,反應五分鐘,以高速離心機13,000 rpm離心20分鐘, 取50 μL 未反應之OPA上清液加入含有2 ml之0.1 M Na2B4O7 和100 μL 之 試劑B的試管內,同時測量340波長處之吸光度,推算磁性奈米表面胺基數 量。 4-11 近紅外光螢光基團鍵結至磁性奈米粒子上 MnMEIO(NH2)-Cy777-mPEG 之合成(9) 由OPA檢測法可推知在10 mg/mL的磁性奈米粒子的水溶液中,其胺基 的濃度為16 mM,以此為依據,將CyTE777-NHS ester (0.002 mmol, 2mg)溶 入磁性奈米水溶液中,在4℃下反應overnight,接著將反應的溶液以分子量 50,000的透析膜透析24小時,移除未反應之螢光團。
4-12 MnMEIO-linker-Cy777-mPEG 之合成(11)
NSM 子量 4-13 團隊 奈米 抗體 析, solu 透析 好st 1 - 2 MP (0.1 m 量50,000的 3 Anti-MU 抗體的修 隊所發表的 米粒子的m 體在Thiola 接著將T ution加入至 析,移除未 tock soluti 2個硫基。 mmol, 32 m 的透析膜透 UC4 抗體修 修飾參考來 的方法,利 maleimide上 ation buffe Traut’s age 至抗體溶液 未反應的T ion後馬上 mg)反應, 透析24小時 修飾硫基 來自Steph 利用Traut 上的稀鍵 er (50 mM ent配置成 液中,在 Traut’s age 上與抗體反 在4℃下反 時,移除未 基之合成 hen O’Brie t’s agent與 鍵在水相進 M, 150mM 成stock solu 在室溫下反 ent,其反 反應,根據 反應overn 未反應之N en[82]團隊 與抗體反應 進行加成反 M NaCl, 10 ution (1 m 反應45分鐘 反應半衰期 據標準的反 night,同樣 NSMP。 以及Mart 應生成硫端 反應,其反 0 mM EDT mg/ml),取 鐘後以分子 期為一個小 反應過程 樣取反應溶 tin W. Bre 端的方式可 反應為取4 TA, pH = 取1.8 μL 的 子量12,00 小時,故須 ,此抗體會 溶液以分 echbiel[83] 可與磁性 00 μL 的 8.5)中透 的stock 0透析膜 須在配製 會修飾上 分 的 上
4-14 米粒 小時 水透 可能 PBS 次 並相 直接 性完 保存 4 Anti-MU -14.1 實驗 修飾上硫 粒子中,反 時的反應, 透析(透析膜 能造成細胞 S 透析,主 1 × PBS後 相以利於作 接與足量的 完全看抗體 存在褐色瓶 UC4 抗體鍵 驗組MnM 硫端的 An 反應在4 ℃ ,再加入c 膜分子量 胞無法貼附 主要是將非 後,將最後 作後續研究 的cysteine反 體鍵結能力 瓶中避光 鍵結至超 MEIO-Ab-A nti-MUC4 ℃下進行 cysteine去 :50,000) 附在培養皿 非共價性 後的磁性 究。此實驗 反應,未 力而定,隨 。 超順磁氧化 -Cy777-m Ab = Anti 4 之抗體 ,其反應過 去中和未反 ,主要把E 皿上,換 性鍵結之螢 性奈米粒子 驗之控制 未參與抗體 隨後以1 × 化鐵-錳奈米 PEG i-MUC4 a (400 μg) 過程必須 反應之male EDTA給去 換過 3 次去 螢光基團或 子溶液以褐 制組為male 體之鍵結, × PBS 透 米粒子之合 antibody 加入到 須避光並快 eimide官能 去除乾淨, 去離子水後 或是反應試 褐色瓶保存 eimide修飾 ,因此磁性 透析(透析膜 合成 2 mL 的 快速搖動, 能基,先用 否則殘餘 後,隨即 試劑去除 存,並置放 飾的磁性奈 性奈米粒子 膜:50,00 磁性奈 經過 12 用去離子 餘的EDTA 即再用1 × ,換過 4 放在4 ℃ 奈米粒子 子的專一 00)四次, 2 子 A
解抗 MnM 50,0 4-15 配 於鍍 200~ 4-16 子內 到外 -14.2 對照 對照組主 抗體的專一 MEIO-link 000)四次 5 穿透式電 配製0.2 ~ 鍍碳銅網上 ~500 個鐵 6 X 光能量 內部元素鑑 特性X光 外來能量(如 照組MnM 主要是要跟 一性是否會 ker-Cy777 ,保存在褐 電子顯微鏡 ~ 0.5%(W 上,待其自 鐵核計算其 量分散光譜 鑑定 光可以偵測 如:電子束 MEIO-Cys Cy 跟實驗組M 會受到磁性 7-mPEG反 褐色瓶中避 鏡(TEM)之 W/W)氧化鐵 自然乾燥後 其大小,並 譜(Energy 測表面材料 束、離子 s-Cy777-m ys = Cyste MnMEIO 性奈米粒 反應,4 小 避光。 之鑑定 化鐵奈米粒 後以穿透 並且求出其 y Dispersiv 料以及元素 子束或是光 mPEG eine -Ab-Cy77 粒子的影響 小時後以1 粒子溶液, 透式電子顯 其平均粒徑 ve Spectro 素鑑定,其 光源)的激發 77-mPEG進 響。加入過 1 × PBS透 並利用毛 顯微鏡觀察 徑。 oscopy, ED 其原理為當 發而脫離原 進行比較 過量的Cys 透析(透析 毛細管將樣 察。選取範 DS)之磁性 當原子內層 原子時,原 ,藉此了 steine與 析膜: 樣品點染 範圍內 性奈米粒 層電子收 原子的外 了 收 外
層電子很快的遷降至內層電子的空穴並釋放出兩能階差之能量。被釋放出 的能量可以X光的形式釋出,不同原子特性的能量會以不同X光散出,因此 此特性X光可以鑑定試片的各個組成元素。將有機相之磁性奈米粒子在丙酮 的環境下震盪,去除高沸點之長碳鏈分子,獲得粉狀的磁性奈米粒子,將 此粒子均勻的放置載體上以20 keV的電子伏特進行元素分析。 4-17 超導量子干涉磁量儀(SQUID)磁性之測定 其樣品配置與EDS相似,將磁性奈米粒子外層有機層利用丙酮沖洗後獲得 粉末狀的磁性奈米晶體,把粉狀奈米粒子取1-2 mg 放入樣品管中,並置入 在震盪桿下方,使樣品維持在兩磁場間,偵測由外加磁場-10 kOe到10 kOe 之間的磁矩變化量,此資訊可提供所合成出的磁性奈米粒子之飽和磁化率, 並可推測此奈米粒子是否為超順磁性質。
4-18 X 繞射光譜儀 (power X-ray diffraction, XRD)之晶體鑑定
X光進入晶體時,會被原子所組成的晶片反射,假設晶面距離為d,入射 光與晶面夾角為θ,其為繞射角度,當入射光被相鄰的晶面反射時,兩反 射光束會有一行差距為2 d sinθ,若此行剛好等於光波波長λ之整數倍,會 產生建設性干涉。滿足此條件可產生繞射,以此訂為布拉格定律。
將磁性奈米氧化鐵之乾燥後粉末放置在XRD的載體上,其掃描為每分 鐘4度,2θ為20 ~ 80度。 4-19 核磁共振光譜儀( NMR)之鑑定 化學合成的 PEG 聚合物以及 silane 衍生物分子可藉由核磁共振光譜儀 測定,其原理為偵測氫原子自旋方式在外加磁場下,其內的核磁距與磁場 交互作用而吸收無線電波,因此氫原子核內自旋電子由滴能階要遷至高能 階,此時不穩態的能量會以光或電磁波的方式再次釋放出去(即 relaxation), 因此針對氫原子在極性與非極性的原子團間之交互作用力可得到特定環境 下的氫原子發散電磁波,經由傅立葉轉換得到化學位移 (chemical shift, δ) 由此化學位移判斷聚分子化而物或是小分子化合物上的氫數含量,藉此歸 納出分子結構。 4-20 傅利葉轉換紅外線光譜儀(FT - IR)鑑定 FT - IR 是用來鑑定官能基的鍵結和位移,其原理為利用紅外光照射樣 品後,其分子中的原子間產生震動和轉動模式時,吸收適當的能量,藉此 得出在化合物分子在400 nm-1 ~ 4000 nm-1頻率間分子吸收與振動能量。由 於含鐵之聚合物化學分子無法以NMR 偵測表面之官能基,所以樣品經由乾 燥取得粉末後,與KBr 混合壓片測量。無法抽乾呈固狀粉末的非極性樣品
則利 4-21 中的 角度 以及 合物 Nan 之穩 4-22 膠體 公式 性奈 利用鹽片(N 1 動態光散 動態光散 的懸浮粒子 度量測反射 及表面材質 物磁性奈米 no- zetasiz 穩定性。 2 表面電位 表面電位 體粒子由雙 式(Henry's 表面電價 奈米粒子在 NaCl or K 散射儀(D 散射儀的原 子表面,量 射光強度的 質之折射率 米粒子水溶 zer 90 (ZS 位(zeta po 位在膠體化 雙層電子構 function) 價的測試需 在水溶液中 KBr)測定 Dynamic L 原理是利用 量測在幾個 的衰變情形 率,便可以 溶液樣品 90) 之功能 otential)測 化學中,是 構成,包含 導出電泳 需要以水溶 中真實的表 。 Light Scatt 用使用單 個反射角 形,再配 以得到粒 ,配製成 能,量測 測定 是指膠體粒 含固定層 泳的移動率 (H 溶液的形 表面帶電 tering, DL 單一波長的 角的反射光 配合理論分 粒子的平均 1 mL 的水 測粒子的水 粒子上累積 層和擴散層 率,進而求 Henry's fun 形式量測, 電性,其粒 LS)測定 的雷射光照 光強度,或 分析模式由 均大小及分 水溶液裝在 水合直徑, 積的離子所 層。一個粒 求出其表面 nction) 離子性之 粒子濃度須 照射在分散 或者固定在 由溶液的吸 分布。將高 在比色管 ,可探討奈 所引發的靜 粒子可以藉 面電位的值 之水溶液會 須要大於或 散在液相 在某一個 吸光係數 高分子聚 管內,利用 奈米粒子 靜電壓; 藉由亨利 值。 會影響磁 或等於 1 用
mg/mL 才可以量測準確,因此,測定表面電價時先將高分子聚合物磁性奈 米粒子溶入去離子水中,取1 mL 的奈米粒子 1 mg/mL 溶液置入含有電極板 之測量槽內,以固定電壓計算出電泳之移動率,藉此得到表面電位 (mV)。 4-23 縱向弛緩率(r1)及橫向弛緩率(r2)之測定 將高分子磁性奈米粒子水溶液樣品分別配製成五個不同濃度,再利用 20 MHz relaxomter 測量樣品在 37.0 ± 0.1 ºC 的縱向弛緩時間(T1)及橫向弛緩 時間(T2)。 4-24 蛋白質定量檢測 (BSA assay) BSA assy為一般常用於測量蛋白質濃度的基本方法,其原理為 Bicinchonicnic acid為水溶性鈉鹽,可與一價銅離子產生特異性的螯合作用, 所以把待測蛋白質加入至二價銅離子的環境中,蛋白質會將二價銅離子還
原成一價銅離子,而形成Cu+ - BCA complex之錯合物,顏色也會變成深紫
色,利用此特性進行蛋白質定量,以UV/Vis測定562 nm 波長之吸光值並描 繪出標準蛋白質之檢量線即可偵測出待測抗體濃度。
4-25 細胞培養
實驗中選用 Panc 1、HPAC 以及 BxPC-3 之細胞株,其培養基分別為 DMEM、F12/DMEM 以及 RPMI 1640,Panc 1 為 MUC4 低表現之細胞株,
其餘HPAC 及 BxPC-3 為 MUC4 表現較高之細胞株,分別培養在 37℃下培 養箱中。 4-26 流式細胞儀(Flow cytometry)測定 此儀器能偵測細胞表面抗原以及細胞體積和型態複雜程度,其原理為 利用雷射光照射入流體細胞上其偵測器分為FSC 以及 SSC,FSC 與細胞體 積及大小有關,而SSC 則與細胞內部複雜度有關,藉此利用免疫螢光染色
的方式,可測得螢光訊號被偵測的強度。利用Versen buffer (0.2 % EDTA)
將細胞(Panc 1、HPAC、BxPC-3)從培養皿上脫落,清洗 3 次 PBS buffer,取
細胞數目為3 × 105各別裝入3 個微量離心管內,其實驗組分成 Cell alone、 N N N N +Cu COO COO OOC OOC Cu+ Cu2+ N O OH N O HO + Protein or Peptide + OH
Cell + nanoparticles、cell + Anti-MUC4-nanoparticles,隨後加入 43 μL 的磁 性奈米粒子溶液使其總體積稀釋至200 μL (其抗體修飾之磁性奈米粒子上 的抗體濃度為0.323 μg /μL),控制組為單純的磁性奈米粒子與細胞培養在 4 ℃下,反應2 小時候,用 PBS buffer 再清洗三次,加入 Anti-mouse antibody-FITC (稀釋 500 倍)使反應總體積為 200 μL,在 4 ℃下反應 1 小時, 隨之再以PBS buffer 清洗 3 次,最後以 1 mL 的 PBS 回溶經過濾膜打散後, 隨即上機操作。
4-27 體外(In vitro) MRI 細胞造影
準 備 6 well 的 培 養 皿 , 分 三 個 實 驗 組 cell alone 、 cell + MnMEIO-Cys-Cy777-mPEG、cell + MnMEIO-Ab-Cy777-mPEG,計算細胞個 數為 3 × 105加入至培養皿中,使細胞生長 24 小時候開始與磁性奈米粒子 反應,實驗組的三株細胞(Panc 1、HPAC、BPC-3)與 50 μl (抗體濃度為 0.323 μg/μL) Anti-MUC4-nanoparticles 總反應體積為 500 μL,反應兩小時,對照 組則為把未修飾抗體的奈米粒子,取50 μL 與細胞反應使其總體積為 500 μL, 時間也為兩個小時,另一組對照組則為沒有加任何奈米粒子之細胞株,總 反應2 個小時後以 PBS buffer 清洗 3 次,隨後將細胞刮下後放入 PCR tube 中,隨即上機觀測。MRI 核磁共振造影設備其為 7 T 之外加磁場,利用 MSME (multislice multiecho) sequence 為計算模組,TE 為 22.5 ms,TR 為
五、結果與討論
5-1 磁性奈米粒子內部結構與其物、化性探討
5-1.1 Energy-dispersive spectrometer (EDS)鑑定
本實驗所合成設計之氧化鐵摻雜錳金屬之磁性奈米粒子,透過
Energy-dispersive spectrometer (EDS)之掃描結果如圖十所示,其中在油酸包
覆的MnFe2O4中可看出鐵和錳的比率接近2:1(圖十一、A),此結果說明在 高溫合成下的奈米粒子,其晶格排列符合本實驗當初設計之預期結果,即 使經過水溶性聚合分子修飾後的氧化鐵奈米粒子,也可看出鐵和錳的比率 還是接近2:1(圖十一、B),因此,在高溫合成的結果顯示其奈米粒子具有 良好的晶形結構且不會聚集而影響奈米之實用性。 5-1.2 超順磁氧化鐵-錳奈米粒子之晶體結構 氧化鐵晶體其單元晶格為 Fe3O4尖晶石構形,其特徵峰為(220)、(311)、 (400)、(422)、(511)和(440),其中的 220 為四氧化三鐵之特性吸收峰(如圖 十二所示),比照本研究合成的超順磁氧化鐵-錳奈米粒子,其化學式已由
EDS 鑑定出為 MnFe2O4,其結構與Fe3O4尖晶石構形相似,主要原因為錳
和鐵的價電荷數相同,其原子半徑相似,除了錳離子具有半滿的d 軌域之
外,其原子組態與鐵相近,由於錳可有較高的磁矩,因此將晶格中的原本
5-1.3 TEM 之奈米粒子大小測定 在鍍碳銅網上的膜可吸附磁性奈米粒子,由 TEM 可看出平均粒子大 小為8.8 ± 0.8 nm (如圖九所示),其形狀完整規則,符合預期高溫裂解方 式比共沉澱法所合成的奈米粒子結構更完整。 5-1.4 超導量子干涉儀(SQUID)之磁性分析 利用 SQUID 鑑定磁性奈米粒子之磁性,圖可看出在室溫下的飽和磁 化強度Ms 為 101 emu/g,矯頑磁力 Hc 約為 10 Oe (如圖十所示),可說明 在室溫下的磁滯現象並不明顯,這表示高溫裂解之磁性奈米粒子本身具有 超順磁性。
5-1.5 FTIR (Fouries tranform infrared, FTIR)分析磁性奈米氧化鐵表面特定 官能基之吸收振動頻率分析
FTIR 是用來鑑定官能基的鍵結和化學位移,最常用的方法為壓錠法也
就是將樣品與KBr 粉末進行壓片。為了使磁性奈米粒子表面修飾上具有生
物相溶性之polymer,利用 ligand exchange 的方式將 polymer 修飾到粒子表 面上,並將樣品與KBr 壓片,藉由 Perkin Elmer System 2000 FT-IR 測量其
修飾前以及修飾後的吸收波長,並證明水溶性的polymer 聚分子確實接到奈
米粒子上。由圖十三、A (blue)可看出在 2955-2870 cm-1有(-CH2-)之非對稱 及對稱性吸收,而(COO-)則出現在 1534 和 1407 cm-1的位置,(Fe-O)之吸收
(green)的聚合物分子已成功包覆於氧化鐵核外 MnMEIO(NH2)-mPEG (red), 最明顯的吸收峰出現在2924 cm-1之(-CH2-)官能基呈現渾圓且修長的對稱吸 收,此吸收為聚合物分子(mPEG)之獨特吸收,然而 1114&1070&1055 cm-1 也可看出(Si-O-Si)之官能基吸收,說明氧化鐵表面修飾的情形,其他吸收峰 之振動頻率顯示在表一中。 5-1.6 縱向弛緩率(r1)及橫向弛緩率(r2)之分析 弛緩率代表著水分子受到磁性奈米粒子影響後的弛緩時間,磁性奈米 粒子弛緩率越大則影響周圍水分子之自旋的弛緩速率也越大,這造成與周 圍環境的對比度上升,因此在測量縱向與橫向的弛緩時間,會是造成MRI 影像訊號上的基礎依據。由表二所示,經修飾聚乙二醇的磁性奈米粒子具 有較高的弛緩率239.66 mM-1s-1,原因在於水合直徑較小,接上螢光團與 NSMP 後水合直徑由 39.3 nm 增大至 41.59 nm,其弛緩率由 239.7 mM-1s-1 下降至209.5 mM-1s-1,由於水合直徑增大因此與水接觸的距離較遠,弛緩率 有稍微的下降,當接上抗體與半胱胺酸後,接抗體後的奈米粒子大小上升 為55.9 nm,弛緩率上升至 216.1 mM-1s-1,弛緩率上升的原因推測為抗體為 胺基酸單體組成,因此胺基與羧酸會與水分子產生氫鍵,其餘的maleimide 基團也由半胱胺酸反應完全,因此磁性奈米粒子表面由正負基團所組成, 含有大量的胺基與羧酸,因此與水產生較大的吸引力,即使水合直徑變大,
但弛緩率還是有上升的傾向。對照組則相較於實驗組而言其弛緩率210.01 mM-1s-1並沒有太大的差異。 5-1.7 超順磁氧化鐵-錳奈米粒子表面電價與 pH 變化之分析 奈米粒子的表面電價由胺基與羧酸的含量多寡所調控,在之前的研究 中,我們利用聚乙二醇的立體阻礙,使胺基藏於性奈米粒子內側,也就是 MnMEIO(NH2)-mPEG 的結構,此修飾方式有很好的優點,其為表面電價雖 然為正值,但反應端胺基因外層聚乙二醇的修飾則不易裸露於外側,會減 少與細胞表面接觸的機會,進而降低非專一性的吸附或是吞噬,由於腫瘤 為酸性環境pH 約為 4 ~ 5,因此針對磁性奈米粒子對於酸鹼的表面電位測 定有助於了解奈米粒子在酸鹼環境中的電荷狀態。由圖十四所示, MnMEIO(NH2)-mPEG 在 pH 為 7 時帶有+17.3 mV 的價電荷,而經修飾的 MnMEIO-linker-Cy777-mPEG 在 pH 為 7 時則下降至-8.72 mV,此負電價來 自於螢光團上SO3- 所產生,胺基完全被NSMP 所反應,所以表面電價比 MnMEIO(NH2)-mPEG 在水溶液中更接近於電中性,因此本實驗也測得修飾 完抗體與半胱胺酸的實驗組與對照組之磁性奈米粒子,其 MnMEIO-Ab-Cy777-mPEG 為- 4.38 mV,而 MnMEIO-Cys-Cy777 為 - 3.93 mV,此兩個組別都接近於電中性,之所以會修飾半胱胺酸的原因在於希望 能在表面電價上使得奈米粒子不會因為帶電性的關係造成對細胞的非專一
性鍵結,當然也能模擬奈米粒子在體內真實粒子流動的情形。 5-1.8 pH 值對超順磁氧化鐵-錳奈米粒子穩定性的探討 由於合成的 mPEG-NH2-silane 具有酯鍵,因此容易在鹼性環境下被水 解成酸與醇,此反應會造成奈米粒子的水溶性下降甚至造成沉澱,由圖十 四所示,奈米粒子在pH 值為 4 ~ 7 時粒子大小幾乎沒有什麼變化維持在 36 ~ 39 nm,從 pH 值 8 ~ 9 可看出奈米粒子開始下降至 27.2 nm,放置數小時 之後可看見微小的沉澱產生,此結果說明奈米粒子在酸性至中性的環境可 以保存一段時間,但往後反應的過程不得有鹼性催化劑的參與,否則將會 導致鹼性的水解,但此水解特性並不會影響奈米粒子在體內的穩定性,原 因在於體內的pH 為恆定 7.4,血液皆為等張溶液,因此 pH 對於奈米粒子 的損壞可以減低至最小。 5-2.1 流式細胞儀對磁性奈米粒子上的抗體其專一性功能進行分析 奈米粒子上的抗體會受到修飾的過程中產生降解,造成抗體的不穩定 或是結構的破壞,因此本實驗選用Traut’s agent 對抗體進行修飾,最後在 buffer 中進行磁性奈米粒子與抗體之鍵結,此過程都在無菌的狀態下完成, 盡量減少對抗體的傷害。所以在流式細胞儀的測定下,如圖十六所示,可 以看見實驗組的細胞(HPAC、BxPC-3)有些許的位移,而對照組的細胞(Panc 1)則無明顯的位移,但是實驗組的位移情形並不能代表本實驗所設計合成的
MnMEIO-Ab-Cy777-mPEG 具有標並細胞表面蛋白的能力,推測原因為本實
驗中MnMEIO-Ab-Cy777-mPEG 其抗體位子在內側,外層有 PEG 聚合分子
所形成的立體阻礙,因此二抗無法辨識在一抗的位置,造成螢光訊號的下 降。
5-2.2 體外(In vitro) MRI 造影實驗之探討
細胞實驗開始前,先將配置的標準溶液作 MRI 影像之鑑定,如圖所示, 與市售的ResovistTM進行比較,其中各取鐵離子濃度為0.5 mM、0.25 mM、 0.125 mM、0.0625 mM 作為標準濃度樣品,由圖十七可以看出本實驗設計 的MnMEIO-Ab-Cy777-mPEG 與對照組 MnMEIO-Cys-Cy777-mPEG 顏色對 比度都比ResovistTM來得強烈,這表示參雜錳離子的磁性奈米粒子確實有提 高對比效果,換算成R.O.I.訊號值後,由圖十八所示,可看到實驗組與對照 組MRI 訊號有明顯下降的趨勢,這表示在影像上會偏向黑色,因此本實驗 設計的磁性奈米粒子確實有達到預期的效果。細胞實驗的結果也顯示,具 有MUC4 表現的細胞株其顏色訊號較為黑,如圖十九所示,而對照低表現
之Panc 1 細胞株則影像訊號則沒有太大差異相較於 cell alone,由圖二十分
析的結果也指出,MnMEIO-Ab-Cy777-mPEG 能有效且專一性的鍵結上具有
MUC4 的細胞株,其訊號質有明顯的下降,此結果顯示本實驗所設計的磁 性奈米粒子具有較佳的影像對比訊號,且在偵測細胞的表面蛋白上具有良
六、 結論 本文研究已經成功的合成高溫裂解的超順磁氧化鐵-錳奈米粒子,由 EDS與XRD分析都顯示其晶體結構為完整的MnFe2O4尖晶石構形,元素分析 也指出鐵錳比為2:1,其飽和磁化率與矯磁頑力為101 emu/g以及10.1 Oe代 表著超順磁性的特徵,進一步修飾上MnMEIO(NH2)-mPEG其弛緩率為239.7 ± 15.9 mM-1s-1,其表面修飾已經透過紅外光傅立葉轉換進行鑑定,此水溶 性超順磁氧化鐵-錳奈米粒子在前期的研究中已經成功的應用於表面生長受 器的鍵結,並且降低了非專一性的吸附。而得到良好的MRI影像訊號。在本 文,又將利用此磁性奈米粒子表面胺基特性,進一步的修飾抗體與交聯化 合物(linker)與胺基進行專一性的反應,並且以半胱胺酸中和表面電價,得 到實驗組MnMEIO-Ab-Cy777-mPEG與對照組MnMEIO-Cys-Cy777-mPEG兩 組MRI對比劑,對照組目的為觀測此磁性奈米粒子是否會與細胞進行非共價 性的吸附或鍵結,由流式細胞儀的觀測雖然螢光位移的情形不多,但可看 出實驗組與對照組之間的差異性,推測其二抗螢光蛋白無法辨識在內側的 一抗,導致螢光訊號微弱。由體外MRI造影實驗可以看出有表現MUC4蛋白 之細胞株有明顯的變黑趨勢,而對照組以及低表現之細胞株則沒有明顯訊 號的下降,證實本實驗所合成能偵測胰臟癌的磁性奈米探針,確實可在MRI 影像訊號上獲得資訊,此結果也顯示磁性奈米探針具有良好的生物相容性, 更有良好的專一性鍵結,可作為未來活體實驗之參考依據。