國立交通大學
應用化學所
碩士論文
碳六十與炔及三級膦之反應與化學性質探討
Reactivity and Chemical Property Studies of C60, Alkynes and Phosphines
研究生:陳聖元 指導教授:莊士卿 博士
2 摘要 ... I ABSTRACT ... II 誌謝 ... III 表目錄 ... V 圖目錄 ... VI 縮寫對照表 ... X 1 緒論 ... 1 1.1 碳六十的發現 ... 1 1.2 碳六十的性質 ... 2 1.2.1 碳六十結構 ... 2 1.2.2 碳六十物理性質與光譜 ... 3 1.2.2.1 碳六十之溶解度 ... 3 1.2.2.2 碳六十之紫外可見光 ... 4 1.2.2.3 紅外線光譜 ... 5 1.2.2.4 循環伏安之測量 ... 5 1.3 碳六十相關反應 ... 7 1.3.1 還原反應 ... 7 1.3.2 親核加成 ... 7 1.3.3 環化加成 ... 8 1.3.4 氫化反應 ... 10 1.3.5 自由基加成 ... 11 1.4 碳六十於太陽能電池上的應用 ... 13 1.4.1 太陽能電池原理簡介: ... 14 1.4.2 太陽能電池種類: ... 18 1.4.3 基本參數介紹: ... 21 1.5 碳六十於醫療上應用 ... 22 1.5.1 酵素抑制 ... 22 1.5.2 Antiviral Activity ... 23 1.5.3 DNA 光裂解 ... 24 1.5.4 Diagnostic Applications ... 24 1.5.5 Antimicrobial Activity ... 25 1.5.6 Free Radical Scavenger ... 25 2 以三級膦及具有拉電子基之炔類製備三圓環或五圓環之碳六十衍生物 ... 26
3 2.1 研究動機 ... 26 2.2 含 DMAD 之反應 ... 29 2.2.1 DMAD 與 HMPT、碳六十之反應 ... 29 2.2.2 三圓環於酸性條件下擴環為五圓環之反應 ... 33 2.3 含 DIMER之反應 ... 35 2.3.1 Dimer 與 HMPT、碳六十之反應 ... 35 2.3.2 enyne 7 與 PPh3、碳六十之反應 ... 39 2.4 HMPT 與碳六十之反應 ... 40 2.5 紫外光譜與循環伏安數據分析 ... 43 2.6 結論 ... 47 3 對稱共軛多炔與三級膦級碳六十之反應探討 ... 48 3.1 研究動機 ... 48 3.2 含DIMETHYL HEXA‐2,4‐DIYNEDIOATE之反應... 49 3.2.1 dimethyl hexa‐2,4‐diynedioate 與 electron donating phosphine (HMPT、Tricyclohexylphosphine)、碳六十 之反應 49 3.2.3 dimethyl hexa‐2,4‐diynedioate 與 P(OEt)3 (triethyl phosphite)、碳六十之反應 ... 78
3.3 紫外光譜與循環伏安數據分析 ... 80
3.4 結論 ... 84
4 不對稱共軛多炔與三級膦級碳六十之反應探討 ... 86
4.1 研究動機 ... 86
4.2 含 METHYL 5‐PHENYLPENTA‐2,4‐DIYNOATE之反應 ... 87
4.2.1 methyl 5‐phenylpenta‐2,4‐diynoate 與 PPh3、碳六十之反應 ... 88
4.3 含METHYL 7‐PHENYLHEPTA‐2,4,6‐TRIYNOATE (20)之反應 ... 101
4.3.1 methyl 7‐phenylhepta‐2,4,6‐triynoate 與 PPh3、碳六十之反應 ... 101
4.4 含METHYL 9‐PHENYLNONA‐2,4,6,8‐TETRAYNOATE (21)之反應 ... 103
4.4.1 methyl 9‐phenylnona‐2,4,6,8‐tetraynoate 與 PPh3、碳六十之反應 ... 104
4.5 紫外光譜與循環伏安數據分析 ... 106
4.6 結論 ... 111
i
摘要
利用三級膦 (Phosphine) 和α位具有脂基之對稱炔類與碳六十反應,產生含有 葉立德的三圓環及五圓環結構之碳六十衍生物,並可觀察到 E,Z 異構物。 本篇論文則利用對稱與不對稱的雙炔類 (或三炔及四炔) 與三級膦及碳六十 進行同樣的反應,發現結果與過去文獻不同,由於雙炔 (或三炔及四炔) 在反應時 因共振的緣故,使碳六十上的三圓環結構在脂基的δ位,藉由核磁共振光譜、質 譜以及紅外線吸收光譜,更觀察到有兩個環氧基產生,並且分布於三圓環的兩側, 且葉立德在脂基的α位,但無法觀察到 E,Z 異構物的現象。ii
ABSTRACT
Using teriary phosphine and α-alkynyl esters to react with C60 to yield [60]fullerene
derivatives incorporating cyclopropane and cyclopentane rings; we can observed E,Z isomers of these compounds.
In this thesis, we use symmetrical and unsymmetrical diynes (triynes or tetraynes) and teriary phosphines react with C60 via the same equation mentioned in last paragraph.
Owing to the resonance of diynes (triynes or tetraynes) while reactions are proceeding, we get [60]fullerene derivatives whose cyclopropane rings are located on δ site of ester groups. Fuerthermore, we observed there are two epoxides which are divided from cyclopropane ring on products by analyzing NMR, Mass, and IR spectra. The ylides are located on α site of ester groups, but we can not observe the phenomenon of E,Z isomers.
iii
誌謝
為期兩年半的碩士生涯總算是劃下了一個完整的句點,而長達 18 年的學生身 份也暫時告一段落,還有很多新的挑戰等著我去迎接。而在這短短的兩年半內要 感謝的人實在是太多了。 首先要感謝我的指導老師莊士卿不厭其煩的一直提醒我們該做的事,也很認真 的跟我們討論各自的實驗,讓我們一路做下來也都還算順利,也會偶爾耍個寶讓 實驗室不那麼嚴肅。 也要感謝家人這兩年來的放心,並且細心照顧,讓我可以專心做研究。 感謝我已經畢業的同事們,俊瑋按部就班且堅毅的做事態度也未實驗室豎立了 典範,讓我也獲益良多。知蔚對於課本中的化學知識以及實驗技巧上有很多直得 我請教的地方,也常常替我解答許多疑問,實是我的良師益友。 實驗室的歡樂氣氛對於成員們來說是很重要的,在這裡總免不了要感謝實驗室 的兩位老印還有各位還在奮戰的學弟妹們,碩二的立祥、哩卡、阿龍、阿國還有 +0以及碩一的正揚、淳安跟鈺偉,在我最後這黯淡的半年實驗室生活中增添了 許多樂趣。 也特別感謝許千樹教授實驗室全體同仁:晉彥學長、百哥、小明哥、小施哥、 群哥、小毛、秋翔、大砲、輝哥、叡哥、天心、憲哥、昌哥、洪爺、修哥、小誠、 土榮、佩榮、瑋鑚、安哥、小安、逸芃、美美,把我視為一份子,感謝你們在實iv 驗之餘偶爾也會陪陪我聊天解悶甚至討論互相的實驗。 六月後正為宿舍苦惱的我,一直得到各方援助,在這裡要再次特別感謝輝哥、 修哥、安哥、政哲、一哥、朝駿、小明哥幾位的鼎力相助,讓我可以成功進駐交 大宿舍,成為一個道地的交大人。也特別謝謝群哥在我掰咖時開車帶我去看秋翔 推薦的醫生,即使他並非良醫,我還是很感激。 在實驗室需要同伴來解悶,放假或不在實驗室時當然也需要朋友。小胖、聖傑、 脖子、士傑、豆豆、索隆、小眼、洨哲、費翔、阿魯、會晤、系冷、凱鴻、笑五、 賽婷、寶薛、小蠢、鞋鞋、小花、啾、比特、小虎、家怡、盧盧、逼哀、小太陽、 婉婷、易弘、覺嵐、曉涵、欣紜、維芝、怡珊、酒客、戴 gay、Lucy、依諾、小光、 阿海、芸軒等人,在各自的空閒時間能跟我一起去散散心或是聊聊天,這些日常 看似稀鬆平常的舉動都會給我無比的元氣,也帶給我許多歡樂,如果說是環境造 就了我那或許更貼切。 如果沒有大家的支持鼓勵與陪伴,我想我的研究生涯不會如此的開心順利,點 滴銘心,由衷感謝。
v
表目錄
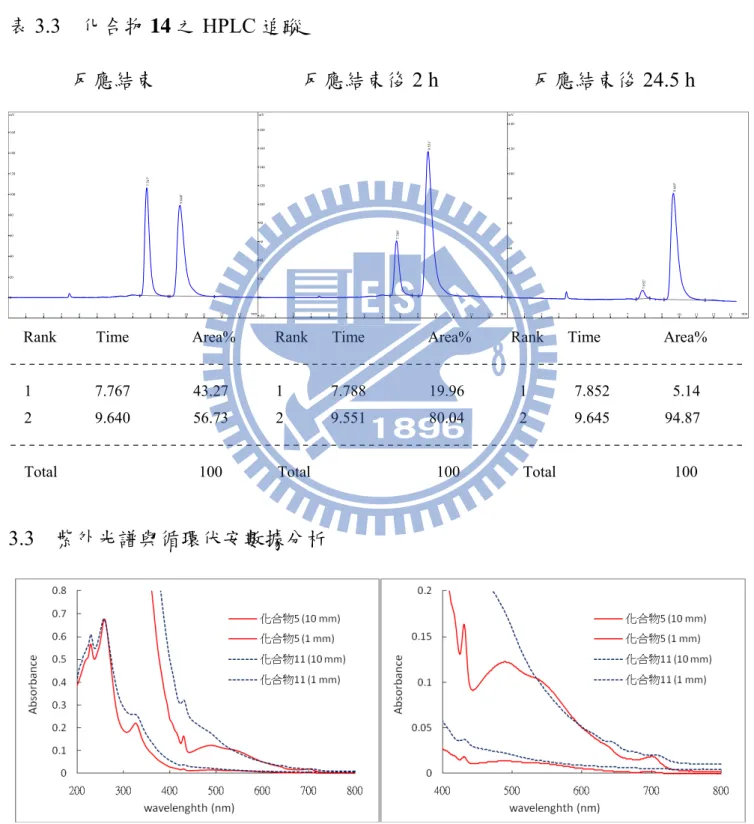
表 2.1 化合物 9 之合成條件... 40 表 2.2 化合物 5、8、9、10 之能隙、還原電位、LUMO 及 HOMO ... 46 表 3.1 鄰位有 HMPT 之化合物之31P NMR ... 51 表 3.2 含三級膦碳六十衍生物之 IR 比較 ... 62 表 3.3 化合物 14 之 HPLC 追蹤 ... 80 表 3.4 化合物 11、12、13 之能隙、還原電位、LUMO 及 HOMO ... 84 表 4.1 化合物 15、16、17 之羰基 IR 吸收值比較 ... 99vi
圖目錄
圖 1.1 碳六十之13C NMR ... 3 圖 1.2 碳六十在不同溶劑之溶解度表 ... 4 圖 1.3 碳六十之紫外-可見光譜 ... 5 圖 1.4 碳六十之紅外線吸收光譜 ... 5 圖 1.5 上) 碳六十之 CV 在 25 度下以乙腈為溶劑在掃描速率為 100 (MV/S)所下測量。下) 差式脈波伏安法 (DIFFERENTIAL PULSE VOLTAMMETRY, DPV:80 MV PULSE, 50 MS WIDTH, 200 MS PULSE PERIOD, 10 MV SCAN RATE) . 6 圖 1.6 碳六十之還原反應 ... 7 圖 1.7 碳六十之親核加成反應 ... 8 圖 1.8 碳六十之[3+2]環化加成反應 ... 9 圖 1.9 碳六十之 1,3‐DIPOLAR 環化反應 ... 9 圖 1.11 碳六十之[2+2]環化加成反應 ... 10 圖 1.12 碳六十之[2+1]環化加成反應 ... 10 圖 1.13 碳六十之[2+1]環化加成反應 ... 10 圖 1.14 碳六十之氫化反應 ... 11 圖 1.15 碳六十之自由基加成 ... 11 圖 1.16 BINGEL REACTION 之反應機構 ... 12 圖 1.17 太陽能電池發電原理 ... 17 圖 1.18 有機太陽能電池電子傳遞圖 ... 18 圖 1.19 單層太陽能電池元件結構 ... 19 圖 1.20 雙層異質接面型太陽能電池元件結構 ... 19 圖 1.21 混摻異質接面型太陽能電池元件結構 ... 20 圖 1.22 混摻異質接面串聯型太陽能電池元件結構 ... 20 圖 1.23 光強度與短路電流成正比。一開始呈線性關係,當強度大到一定值時則呈 指數關係。 ... 21 圖 1.24 THE C60 IS COLORED MAGENTA, AND THE VAN DER WAALS SURFACE OF THE ACTIVE SITE AND LIGAND ARE SHOWN. ... 23 圖 2.1 DMAD 與三級膦及碳六十反應之產物結構 ... 27 圖 2.2 E,Z 異構物之轉換 ... 28
vii 圖 2.3 含有脂基之碳六十衍生物之 IR ... 31 圖 2.4 DMAD 之紅外線吸收光譜 ... 32 圖 2.5 化合物 5 之紅外線吸收光譜 ... 33 圖 2.7 化合物 6 之結構 ... 35 圖 2.8 化合物 8 的變溫氫譜 (600 MHZ) ... 36 圖 2.9 化合物 8 的 HMQC (500 MHZ) ... 38 圖 2.10 化合物 8 的 HMBC (600 MHZ) ... 38 圖 2.11 化合物 8 (將碳六十之外的碳編號) ... 39 圖 2.12 化合物 10 的 HMQC(600 MHZ) ... 41 圖 2.13 HMPA 之紅外線吸收光譜 ... 42 圖 2.14 化合物 5、6 之紫外可見光譜疊圖 ... 44 圖 2.15 化合物 5、6、8、9、10 之紫外可見光譜疊圖 ... 45 圖 2.16 化合物 5、8、9、10 之環伏電位疊圖 ... 46 圖 3.1 化合物 11 之1H NMR ... 50 圖 3.2 化合物 11 之13C NMR 放大圖 (45-85 PPM) ... 51 圖 3.3 化合物 12 之13C NMR 放大圖 (35-90 PPM) ... 52 圖 3.5 化合物 12 之紅外線吸收光譜... 53 圖 3.6 化合物 11 之13C NMR 放大圖 (158‐170 PPM) ... 57 圖 3.7 化合物 12 之13C NMR 放大圖 (600 MHZ) ... 57 圖 3.8 化合物 11 之 SP3+SP 碳放大圖 (35-90 PPM) ... 65 圖 3.9 化合物 11 之 MALDI TOF MS/MS ... 67 圖 3.10 化合物 13 之 MALDI TOF MS/MS ... 67 圖 3.11 碳六十上同一個六圓環之三個雙鍵皆反應之衍生物 ... 70 圖 3.12 以 HUCKEL MODEL 計算 C60O3異構物的能量,上排三個為最低能量之構 型,下排三個為三個最 高能量之構型,以最低能量定為 0 EV。 ... 71 圖 3.13 化合物 12 之 HMQC 光譜局部放大圖 (甲脂基部分) ... 72 圖 3.14 化合物 12 之 HMBC 光譜 ... 72 圖 3.15 化合物 13 之1H NMR... 74 圖 3.16 化合物 13 之31P NMR ... 74
viii 圖 3.17 化合物 13 之13C NMR 放大圖 (155-175 PPM) ... 74 圖 3.18 化合物 13 之13C NMR 放大圖 (35-90 PPM) ... 75 圖 3.19 化合物 13 之紅外線吸收光譜 ... 76 圖 3.20 化合物 13 之 HMQC 光譜 (600 MHZ) ... 76 圖 3.21 化合物 13 之 HMBC 光譜(600 MHZ) ... 77 圖 3.22 化合物 13 之 HMBC 光譜放大圖(600 MHZ) ... 77 圖 3.23 化合物 14 之1H NMR (照鹵素燈前) ... 78 圖 3.24 化合物 14 之1H NMR (照鹵素燈 10 分鐘後) ... 79 圖 3.25 化合物 14 之31P NMR ... 79 圖 3.26 左) 化合物 5 與 11 疊圖 右) 左圖的局部放大圖 ... 80 圖 3.27 實線代表 C60O 在甲苯下的紫外可見光譜吸收,虛線代表 C60在甲苯下的紫外可見光譜吸收。右上圖則溶劑 為正己烷。 ... 81 圖 3.28 左) 化合物 11、12、13、14 疊圖 右) 左圖的局部放大圖 ... 82 圖 3.29 化合物 11,12,13 皆以鐵莘(FERROCENE)的半波還原電為為零的疊圖(左下與右 ... 83 下皆為放大圖) ... 83
圖 4.1 UV-VIS SPECTRA OF: (A) M1 (…), P1 (-); (B) M2 (…), P2 (-), AND (C) M3 (…), P3 (-) IN CHCL3... 86
圖 4.2 化合物 15 之1H NMR (300 MHZ) ... 88 圖 4.3 化合物 13 與化合物 15 之 SP3+SP 碳疊圖 (35-90 PPM) ... 89 圖 4.4 化合物 13 之紅外線吸收光譜... 90 圖 4.5 化合物 15 之紅外線吸收光譜... 91 圖 4.6 化合物 12、16 之1H NMR 光譜比較 ... 92 圖 4.7 化合物 12(下:150 MHZ)與化合物 16(上: 175 MHZ)之放大疊圖(35-90 PPM) ... 93 圖 4.8 化合物 16 之紅外現吸收光譜... 93 圖 4.9 化合物 12 之紅外線吸收光譜... 94 圖 4.10 化合物 16 之 HMQC 局部放大圖 ... 94 圖 4.11 化合物 16 之 HMQC 局部放大圖 ... 94 圖 4.12 化合物 16 之 HMBC 局部放大圖... 95 圖 4.13 化合物 16 之 HMBC 局部放大圖... 96 圖 4.14 H 與 C61有偶合之構型 ... 96
ix 圖 4.15 化合物 17 之13C NMR 放大圖 (35-90 PPM) ... 98 圖 4.16 化合物 17 之紅外線吸收光譜 ... 98 圖 4.17 TRI(P‐TOLYL)PHOSPHINE 之紅外線吸收光譜 ... 99 圖 4.18 環氧基之位置 ... 100 圖 4.21 化合物 16 之13C NMR 放大圖 (35-90 PPM) ... 102 圖 4.22 化合物 16 之13C NMR 放大圖 (155-175 PPM) ... 103 圖 4.23 化合物 19 之13C NMR 放大圖 (155-175 PPM) ... 104 圖 4.24 化合物 15、18、19 之13C NMR 放大疊圖 (35-90 PPM) ... 104 圖 4.25 化合物 18 之紅外線吸收光譜 ... 105 圖 4.26 化合物 19 之紅外線吸收光譜 ... 105 圖 4.27 化合物 15、16、17 之紫外-可見吸收光譜 ... 106 圖 4.28 化合物 12、13、15、16 之紫外-可見吸收光譜 ... 107 圖 4.29 (左)化合物 13、15、18、19 之紫外-可見光譜(右) 左圖之放大圖 ... 108 圖 4.30 化合物 15、16、17 之環伏電位圖 ... 109 圖 4.31 化合物 15、18、19 之環伏電位圖 ... 110 圖 4.32 (左)化合物 13、15 之環伏電位圖(右)化合物 12、16 之環伏電位圖 ... 110
x
縮寫對照表
Chx cyclohexyl Cpt cyclopentyl
DMAD dimethyl acetylenedicarboxylate HMPT hexamethylphosphorus triamide OBu butoxy
OEt ethoxy OMe methoxy
PCBM phenyl-C61-butyric acid methyl ester
Ph phenyl p-Tolyl para-Tolyl
1 1 緒論 1.1 碳六十的發現 1966 年,D. E. H. Jones 曾經提出合成以碳為基礎的中空籠狀化合物 (cage) 的 可能性,而現今,我們稱呼它為“ Fullerene"。但並未引起當時科學家的興趣, 直到 1970 年,Osawa 合成出心型環狀的 corannulene 1,才第一次有人模擬出擁有 點羣 Ih對稱的足球狀結構,也就是所謂的C60分子(fullerene) 2。 1 2
1985 年,Kroto 和 Smalley 以雷射聚焦於石墨 (graphite) 才首度觀察到只有碳 元素的 clusters Cn (n=30~190),以 time-of-flight mass spectrometry 來觀察質量的分
布。發現只有具有偶數(n≧30)碳數的離子被看到。只有在某種條件下才會只產生 分子量為 720 的 C60及840 的 C70兩種碳簇。1990 年物理學家Wolfgang Kratschmer
及 Donald Huffman 等人以石墨作電極,在氦氣壓力下,藉電弧放電法使石墨轉成 碳灰,再透過昇華 (sublimation) 或以苯 (benzene) 萃取 (extraction) 進行純化。 其中又以碳六十最為常見。
2 1.2 碳六十的性質 1.2.1 碳六十結構 碳六十是個含有 60 個頂點的 32 面體,由 12 個五圓環以及 20 個六圓環所組 成的共軛球狀物質,像一顆足球一樣,直徑為7.1 Ǻ,由於其具有點羣為 Ih的對稱 中心,一般記為 [5,6]-fullerene-60-Ih。其中,每個碳原子都是以接近 sp2.28 的混成 軌域鍵結。 3 在[60]fullerene 上面有兩種長度的鍵分別為:鍵的兩邊皆為六環的 [6,6] 鍵 結,此鍵長為1.38 Ǻ;鍵的一邊為五環,另一邊為六環的 [5,6] 鍵結,鍵長為 1.45 Ǻ。如 3 所示。 4 (C60平面展開圖)
3
核磁共振光譜 (NMR,Nuclear Magnetic Resonance) 是鑑定有機化學結構最常 見的方法之ㄧ。C60本身並沒有氫,所以無法從1H NMR 上得到訊息,而在13C NMR
上,可以見到具有對稱結構的碳六十只有一個訊號,位置在 142.5 ppm1,如圖1.1:
圖 1.1 碳六十之 13C NMR
此數值由IBM 的 Almaden Research Center 所發表:室溫 25oC 下,將碳六十溶 解在CCl4且無1H decoupling 情況下,使用 Bruker AM-500 所測得,掃描次數為 13000
次。 1.2.2 碳六十物理性質與光譜 1.2.2.1 碳六十之溶解度 由於富勒烯 (fullerene) 是個溶解度很差的物質,故反應前須注意有無完全溶 解,並依照反應需求選用適當的溶劑進行反應,。碳六十在不同溶劑的的溶解度 如圖 1.2,常用的為甲苯、二硫化碳,以 1-氯萘為最佳:2
4 圖1.2 碳六十在不同溶劑之溶解度表 1.2.2.2 碳六十之紫外可見光 碳六十在213、257、329 nm 有很強烈的吸收,404、408 nm 可以看到較小的 特性吸收峰3,而在500、540、570、600、625 nm 各有更小的吸收,如圖 1.34。由 於碳六十在可見光區內 400 nm 左右有較明顯的特性吸收,其剛好位於綠光區,所 以使得碳六十溶液呈現紫色。
5 圖1.3 碳六十之紫外-可見光譜 1.2.2.3 紅外線光譜 1988 年 Brunvoll 發表碳六十分子的振動頻率,碳六十共有 174 種振動模式,5 只有四種在紅外線光譜儀可測得 (圖 1.4),6分別是:527 , 577, 1182, 1428 cm-1 。 圖1.4 碳六十之紅外線吸收光譜 1.2.2.4 循環伏安之測量 由於碳六十有很好的親電性,很容易形成 C60n-,可以輕易的與親電子試劑 (electrophile) 進行反應。經由理論計算,碳六十有三個能量一樣的最低空軌域 (LUMO,lowest unoccupied molecular orbital),最多應可以填六個電子,形成 C606
6 -
,我們可以利用循環伏安法 (CV,cyclic voltammetry) 看出,每一個波峰都是單 一個電子的傳遞過程,如圖 1.57。
圖 1.5 上) 碳六十之 CV 在 25 度下以乙腈為溶劑在掃描速率為 100 (mV/s)所下測 量。下) 差式脈波伏安法 (Differential Pulse Voltammetry, DPV:80 mV pulse, 50 ms width, 200 ms pulse period, 10 mV scan rate)
7
1.3 碳六十相關反應 1.3.1 還原反應
首先,介紹碳六十的還原相關反應。最直接就是使用以先前介紹的電化學方 式 產 生 的 帶 有 負 電 荷 的 C60n-(fulleride anions) 。 如 ( 圖 1.6) , 將 tetra-tert-
butylammonium perchlorate (TBAClO4) 與碳六十在 benzonitrile solution 下反應,可
以形成深紅色的 C602-。它們也可以被用來合成有機碳六十衍生物 (organofullerene derivatives) 。 H3C CH3 H3C CH3 2e- MeI benzonitrile C60 C602- 1,2-C60(CH3)2 1,4-C60(CH3)2 圖1.6 碳六十之還原反應 此外,碳六十的還原反應也可以很輕易的由鹼金與鹼土金屬的參與下達成。 將溶於氨水 (ammonia) 的金屬 (Rb) 滴定到含碳六十的氨水溶液,可以形成帶有 一個負電荷到五個負電荷的碳六十陰離子 (C60n-,n=1-5) 。可以從在極性溶劑
(polar solvent) 中的溶解度證明此反應產生鹽類 (salt) 的訊息。
1.3.2 親核加成
碳六十與有機鋰 (organolithium) 和格林納試劑 (Grignard reagent),在 THF 下,很快就能形成中間產物 RC60-;如果在甲苯下反應,由於溶劑與水不互溶,所
8 以會產生 C60RnMn 沉澱。接著,加入 0.01N 的鹽酸 (HCl) 將中間產物質子化(圖 1.7)。理論上,產物應該會有 1,2-加成、1,4-加成、1,6-加成8,但是後兩者通常不穩 定。此種反應通常會在 6-6 鍵上 進行,若是在 5-6 鍵上形成產物,則易降低分子 對稱性而不為主要產物。 RLi R 0.01N HCl R H 圖1.7 碳六十之親核加成反應 1.3.3 環化加成 碳 六 十 分 子 擁 有 很 多 的 雙 鍵 , 可 以 作 為 雙 烯 (enes) 或 是 親 雙 烯 物 (dienophiles),藉由其特性,可進行多種環化反應,而這些環化反應只會在 6-6 鍵 上產生。 [3+2] Cycloaddtions 此類型多半由偶氮化合物(Diazo-compounds)、azides、trimethylenemethanes、 氮氧化物(nitril oxides)等含氮或氧的分子來參與反應。含氮的分子 Diazomethane 與碳六十的[3+2]環化反應是在 6-6 環上形成含氮的五圓環結構,經由加熱或照光 後,偶氮會形成氮氣離去,產生能量較低的[5,6]-open 和[6,6]-closed 的 C61H2兩個
9 N N HH h h - N2 - N2 H H H H CH2N2 toluene 0oC RT 圖 1.8 碳六十之[3+2]環化加成反應 若 分 子 含 氧 , 可 藉 由 分 子 易 形 成 具 有 正 負 端 的 特 性 , 在 6-6 環 上 進 行 1,3-dipolar 環化反應(圖 1.9)。 N O R N C R O C60 圖1.9 碳六十之 1,3-dipolar 環化反應 [2+2] Cycloaddtions 只具有單一叁鍵或雙鍵的分子,可與碳六十進行[2+2]環化反應 (圖 1.11),在 這裡並未觀察到[4+2]環化反應,可能是因為若進行[4+2]環化反應,會導致連接處 並非 6-6 鍵或是 5-6 鍵造成不穩定。
10 C60 NH2 COOH isoamylnitrite ; - N2 -CO2 圖 1.11 碳六十之[2+2]環化加成反應 [2+1] Cycloaddtions 常見的為 Carbenes (圖 1.12) 以及 Silylenes (圖 1.13) 與 C60 的加成反應: C60 N N O OMe OMe CH3 CH3 MeO OMe toluene, reflux MeOH Pb(OAc)4 N H N OMe 圖 1.12 碳六十之[2+1]環化加成反應 C60 Si R R toluene h - Me3SiSiMe3 [R2Si:] R = [R2Si(SiMe3)2] 圖1.13 碳六十之[2+1]環化加成反應 1.3.4 氫化反應 氫化反應 (Hydrogenations) 可以說是最早在碳六十上修飾官能基的第一個方 法(圖 1.14),但是礙於太多 sp3的碳會在球體上造成張力 (strain) ,至今,我們還
11 是無法令這一個不飽和的分子,變為飽和的 C60H60,目前能在質譜上觀察到擁有 最高氫數的分子為 C60H52。9 C60 CH3CO2H/H2O BH3 H BH2 H H 圖1.14 碳六十之氫化反應 1.3.5 自由基加成 碳六十上有30 個雙鍵,可以很容易與光化學產生的自由基分子反應,如下圖 1.15。10 圖1.15 碳六十之自由基加成 從上面的基本介紹可以知道在C60分子上,可以利用其雙鍵特性來進行很多不 同種類的反應,而此篇論文裡,皆為在 C60上接上三圓環的衍生物。Bingel reaction11
12
就是非常具有代表性的一個結構,此反應(圖 1.16)是利用鹼 (DBU) 拔走丙二酸二 乙脂 (Diethyl malonate) 在 α 位上具有較強的酸性的氫,使碳上帶負電荷而接上溴 (Bromide) 來作為離去基 (leaving group) 在鹼性條件下第二個氫很快的也被拔 掉,整個分子變成帶負電荷的親核試劑去攻打 C60得到一個三環在 C60上的產物。 此種 [2+1] 環化反應最直接可以利用在分子上產生一個負電荷來當作親核試劑進 而攻打 C60,Bingel reaction 是直接在分子上產生負電荷。在此,則是利用本就具 有高度電子密度的炔 (alkyne) 或是烯 (alkene) 分子,在作為親核試劑的三級膦存 在下,使三級膦攻打炔進而形成由兩個分子所組成的一種帶有負電荷的親核試 劑,前提是此種炔或烯必須旁邊接有拉電子基使 α 位缺電子,親核試劑 (這裏使 用三級膦) 才會有所作用 33。 EtO2C CO2Et H Br H EtO2C CO2Et Br C60 -Br- O O OEt EtO 圖1.16 Bingel reaction 之反應機構 C60衍生物在太陽能電池上的應用也是常被拿來討論的,目前能夠做到最高效 率的 PCBM 早在 1995 就被 Wudl 實驗室所發表,12 直至現在還無人能夠以其他碳 六十衍生物取代 PCBM 超越其效率。
13 1.4 碳六十於太陽能電池上的應用 現今文明發展迅速,對於能源的需求量與日俱增,然而傳統的石化能源(石油、 天然氣與煤等),因為長年大量開採,將很快面臨能源短缺危機,近年來油價節節 高漲就是個明顯例子。此外,使用石化能源也會造成環境汙染的問題,例如溫室 效應與酸雨等現象。因此,發展便宜、方便、無污染的替代能源已成為各界的共 識,希望能替地球盡一份心力,給下一帶更好的環境。無污染的再生能源主要有 太陽能、風力、水力、地熱等,而太陽能是其中最容易取得的能源。 早在1954 年,貝爾實驗室就以矽 (Silicon,Si) 為原料製做出第一個無機太陽 能電池,當時元件的能量轉換效率 (power conversion efficiency,PCE) 就已經可以 達到6%,到目前為止,單晶矽砷化鎵 (GaAs) 太陽能電池的轉換效率已經可以達 到接近理論值的 24.7%,而 GaInP、GaInAs 以及 Ge 的多層元件效率更可高達 39.3%。13由於單晶矽的製作成本太高,儘管多層元件的效率再繼續提升,製作成 本也未必能降低,如此,很難普遍使用於日常生活中。也因如此,製作成本低的 有機太陽能電池 (organic solar cell) 即使其效率並沒有無機材料來的高,卻也逐漸 受到重視。
要以太陽能作為取代的能源,就需要先了解它的優缺點。能讓我們引起興趣 想利用是因為它取得方便,太陽照射的範圍很廣,儘管因為緯度或雲層等因素讓 各地取得太陽能資源多少有所不同,但是它不需要開採挖掘也不需要運輸,就可 以直接利用,不只是方便,更節省了額外的運輸等設備成本;其次,使用太陽能
14 作為能源,不會有廢水污染、廢氣,熱還有噪音等汙染,對人體跟生態都是無害 的,大大提升了它的價值;而根據天文計算,太陽還可以持續 100 億年,這意味 著我們再也不需要再擔心能源會有竭盡的一天;另外,地球每年接受太陽的能量 約比全世界每年所消耗的總量還多三萬倍,所以欲使太陽能成為能源供應其中一 種方式,如何能有效利用它將會是重要的課題。 雖說地表上的太陽能隨處可取,但是它的強度,也就是單位時間內投射到單 位面積上的太陽能並沒有想像中的強;而太陽能最大的弱點就是並非全天候供 應,晝夜的變化以及陰雨天將使得很多時候無法供應能量,需要儲能的設備來克 服此困難;在地球不同緯度所受到的太陽輻射大不相同,同一個地方在同一天內 日出和日落的太陽輻射強度遠不如正午前後,這些因素都會使太規模的利用太陽 能的困難度增加。 1.4.1 太陽能電池原理簡介: 在眾多太陽光電池中較普遍且較實用的有單晶矽太陽光電池、多晶矽太陽光 電池及非晶矽太陽光電池等三種。 太陽光電池主要功能在將光能轉換成電能,這個現象稱之為光伏效應( photo voltaic effect )。光伏效應在 19 世紀即被發現,早期用來製造硒光電池,直到電晶 體發明後半導體特性及相關技術才逐漸成熟,使太陽光電池的製造變為可能。太 陽光電池之所以能將光能轉換成電能主要有兩個因素:一是光導效應 ( photo
15 conductive effect ) ,二是內部電場,因此在選取太陽能電池的材料時,必須要考 慮到材料的光導效應及如何產生內部電場。 光照射在物質上時,部份的光會被物質吸收,部份的光則經由反射或穿透等 方式離開物質,選取太陽光電池材料的第一考量就是吸光效果要很好,如此才能 使輸出功率增加。選取太陽光電池材料的第二考量是光導效果,欲選取光導效果 佳的材料首先必須瞭解太陽光的成分及其能量分佈狀況,進而找出適當的物質作 為太陽光電池的材料。 當電子從外界獲得能量時將會跳到較高的能階,電子處在較高的能階時並不 穩定,很快就會把獲得的能量釋放回到原來的能階。如果電子獲得的能量夠高就 擺脫原子核的束縛成為自由電子,電子空出來的位置則稱為電洞。自由電子可能 會因為摩擦或碰撞等因素損失能量,最後受到電洞的吸引而結合。例如,矽的最 外層電子要成為自由電子需要吸收 1.1eV 的能量,當矽最外層子吸收到的光能量超 過 1.1eV 時將會產生自由電子及電洞,稱之為光生電子電洞對( light-generated electron-hole pairs )。電子電洞對的數目越多導電的效果也越好,因為光使得導電 效果變好的現象稱之為光導效應 (photo conductive effect ) 。
自由電子與電洞的多寡對電氣特性有很大的影響,越多的自由電子與電洞可 以使導電性增加,同時也可以使輸出電流增加,因此可以推測陽光越強時生成的 自由電子與電洞越多,則輸出電流也越大。然而如果只是單純的產生自由電子與
16 電洞,將會因為摩擦及碰撞等因素失去能量,最後自由電子會與電洞復合而無法 利用。為更有效的利用由電子與電洞來產生電流,因此必須加入電場使自由電子 與電洞分離進而產生電流。產生電場的方式很多如 PN 接面、金屬半導體接面等, 其中最常用的方式為 PN 接面。 提高自由電子濃度常用的方法是在矽中加入少量的五價原子,五價原子的四 個價電子與矽鍵結後剩下一個價電子,使剩下的價電子游離只需要 0.05eV,比原 來的 1.1eV 小很多,在室溫超過 200 K 時即可使所有雜質產生自由電子,同樣在矽 中加入少量的三價原子可以提高電洞濃度。在矽中加入五價原子後稱之為 N 型半 導體,加入三價原子後稱之為 P 型半導體。N 型半導體及 P 型半導體雖然帶有自 由電子或電洞但本身仍然保持電中性,如果 N 型半導體及 P 型半導體內雜質濃度 均勻分佈則內部沒有電場存在。若將 N 型半導體及 P 型半導體接和在一起,會因 為兩邊自由電子與電洞的濃度不同產生擴散。N 型半導體中自由電子濃度較高, 因此自由電子由 N 型半體向 P 型半導體擴散,同樣的電洞會由 P 型半導體向 N 型 半導體擴散。擴散的結果使得接面附近的 N 型半導體失去電子得到電洞而帶正 電,P 型半導體失去洞得到電子而帶負電。
17 圖1.17 太陽能電池發電原理 因為電荷密度不均因此在接面附近產生電場,如果有自由電子或電洞在電場 內產生,則會因為受到電場的作用而移動,自由電子向 N 型半導體移動,而電洞 向 P 型半導體移動,因此這個區域缺乏自由電子或電洞而稱之為空乏區。當光照 射在空乏區內將矽原子的電子激發產生光生電子與電洞對(圖 1.17),電子與電洞對 會因為電場作用而使電池內的電荷往兩端集中,此時只要外加電路將兩端連接即 可利用電池內的電力,這即是所謂的光電效應,也是太陽光電池的轉換原理。 而使用有機材料的太陽能電池分為(1)染料敏化太陽能電池 (Dye-sensitized solar cell,DSSC) 、(2)有機光伏電池 (Organic Photovoltaic solar cell,OPV)。碳六十 在太陽能電池上的應用屬於後者,而產生電流的機制與前面所述相同,接為吸收
18
陽光後,得到一能量而使得電子從 HOMO 躍遷至 LUMO 而在 LUMO 產生電洞, 而所選的陰極需要與材料的電子予體 (donor) 能階接近,陽極需與材料的電子受 體 (acceptor) 能量接近,使得電子電洞能夠往電極兩端傳遞進而在外部產生電流 達到光電轉換的效果(圖 1.18)。
圖1.18 有機太陽能電池電子傳遞圖 1.4.2 太陽能電池種類:
a)單層太陽能電池 (single layer solar cell)
僅將材料夾在 aluminium 與 indium tin oxide (ITO) 中間,是為單層結構(圖 1.19)14。由於單一種類的分子可以涵蓋的吸收光波長範圍有限,其光電轉換效率最 高僅到 0.62%。15
19
圖1.19 單層太陽能電池元件結構 b)雙層異質接面型太陽能電池 (bilayer heterojunction solar cell)
1986 年,由 C. W. Tang 提出以 CuPc 為電子予體及 perylene 衍生物為電子受 體兩層疊在一起(圖 1.20),組成異質接面的結構,使光電轉換效率提升至 0.95%。
16
圖1.20 雙層異質接面型太陽能電池元件結構 c)混摻異質接面型太陽能電池 (bulk-heterojunction solar cell)
圖1.21 則為 Bulk heterojunction 的元件結構,其中材料部分,則是利用熱處理, 使其材料排列良好,而電子受體和電子予體的介面混合的情況,可增加接觸的表 面積,可增加電荷分離的效率,也是目前較常使用的結構之一,目前最高可做到 6%。17
20
圖1.21 混摻異質接面型太陽能電池元件結構 d)混摻異質接面串聯型太陽能電池 (Tandem solar cell)
此結構為A. J. Heeger 團隊於 2007 年發表於科學 (Science) 期刊上,成功使用 多層串連的混摻異質有機太陽能電池(圖 1.22),在 200 m W/cm2光源照射下,其光 電轉換效率可超越 6%。18
21 1.4.3 基本參數介紹: a) 短路電流 ISC : 當元件不受偏壓時所測量到的逆向光電流值為短路電流 (ISC) 短路電流與光 強度成正比關係如圖 1.2319,激子被分離後載子能不能成功移至電極是短路電流大 小一個很重要的因素,一般受到材料中載子移動速率 (Carrier mobility) 、載子生 命週期 (Carrier lifetime) 、與載子擴散長度 (Carrier diffution length) 影響。
圖 1.23 光強度與短路電流成正比。一開始呈線性關係,當強度大到一定值時則呈 指數關係。 b) 開路電壓 VOC : 太陽能電池元件受光後會產生逆向光電流,若元件受正向偏壓情況下,偏壓 會逐漸把光電流抵銷,而當偏壓大到一定的值時,整體元件淨電流為零,可視為 開路 (open circuit) ,而此時偏壓值即為開路電壓 (VOC) 而言內建電場的大小、電 子予體(donor)材料的最高填電子軌域(HOMO)與電子受體(acceptor)材料的最低為 填電子軌域(LUMO)會影響開路電壓值。
22 c) 填充因子 (Fill Factor、FF) : 關於填充因子的大小我們可以由 2-1 式求得,(VI)MAX代表元件輸出之最大功 率。可以把填充因子視為載子傳遞與在結合間的對抗,並可以代表元件串、並聯 電阻間一個綜合的表現。我們可以由 IV 特性曲線檢單看出 FF 的好壞,當逆向電 流在短路的情況附近,特性曲線受外加偏壓的影響愈小(斜率愈小)代表元件有愈大 的 FF。令外我們若由 2-2 式定義載子移動距離 d、電場 E、若 d、E 視為固定值, 載子遷移率(μ)與載子生命週期(τ)愈大,FF 愈大。 FF =
I
V
I
V
SC OC MAX MAX (1-1) d =τ×μ×E (1-2) d) 能量轉換效率 PCE (Power Conversion Efficiency) :光電轉換效率為VOC、ISC、FF 所構成的函數(2-3),而 PIN在標準情況(AM 1.5) 下 1000 W/m2,頻譜為太陽光頻譜。
P
FF
I
V
P
P
IN SC OC IN OUT POWER
(1-3) 1.5 碳六十於醫療上應用 1.5.1 酵素抑制 早在 1993 年,Friedman 等人,已經發現某些水溶性碳六十分子與 human immunodeficiency virus HIV-1 的蛋白酵素 (protease) 的活化位 (active site) 會有23
凡得瓦 (van der Waals) 交互作用,佔用疏水表面積約 298 Ǻ2
,並且看到 ligand 與蛋白質 (protein) 有結合 (association) 的現象,如圖 1.24。20
X = HOC(O)(CH2)2C(O)NH(CH2)2
圖 1.24The C60 is colored magenta, and the van der Waals surface of the active site and
ligand are shown.
1.5.2 Antiviral Activity
碳六十衍生物 (如圖 1.25) 在 1993 年被 Schinazi et al21用來對已感染急性或慢 性 HIV-1 的細胞作抗病毒活性的測試(EC50 7.3 ±3.8 M),對於慢性感染的 H9 細胞
24 (EC50 0.003-0.004 M),但是其對於感染的 H9 細胞沒有活性反應。若能提高碳六 十衍生物的抗病毒活性,在未來的實用性就更高了。 圖1.25 1.5.3 DNA 光裂解 同 樣 在 1993 年 , Tokuyama 等 人 合 成 出 可 作 為 光 誘 導 酵 素 抑 制 劑 (photo-induced enzyme inhibitor) 的碳六十衍生物(圖 1.26),測出其在光的誘導下具 有抑制某些酵素的作用。
R = CO(CH2)2CO2H; R = H; R = CO(CH2)2CO2H․NEt3
圖1.26
1.5.4 Diagnostic Applications
25 有所用途。例如,水溶性的 M@C82(OH)30可用在核磁共振中當顯影劑,22或用來作 為放射藥物;23還可將放射性金屬置於碳六十內部,並在體內追蹤其至特定位置來 殺死癌細胞。 1.5.5 Antimicrobial Activity 碳六十衍生物也被認為有殺死微生物的用途。其可藉由附著進入磷脂雙層來 造 成 細 菌 等 內 部 的 黏 膜 被 破 壞 造 成 死 亡 。 此 外 , 具 有 羧 基 的 碳 六 十 衍 生 物 (carboxyfullerene) 可以抑制由大腸桿菌誘導造成的腦膜炎。24
1.5.6 Free Radical Scavenger
當人體內存在自由基時會競爭迫害健康細胞的成對電子,產生電子轉移的反 應現象,會使組織細胞失去正常功能,甚至破壞遺 DNA,造成突變引起癌症。又 研究指出,一個碳六十分子最多可以加成 34 個甲基自由基在上面,8並且穩定存 在,現象顯示,碳六十衍生物可以幫助消去體內自由基,減少因其所造成的疾病。 上述這麼多碳六十衍生物在人體醫療上的用途,可知,若能有效增加其水溶 性,則能更廣泛為藥物所使用,對於醫學上有很大的幫助。
26 2 以三級膦及具有拉電子基之炔類製備三圓環或五圓環之碳六十衍生物 2.1 研究動機 有鑑於含氮化合物在醫學上有很多著墨,25,26,27而且在利用HMPT 此三級膦作 為親核試劑與碳六十的反應上,28過去很少有文獻提及,所以在此,以 HMPT 與其 他三級膦作為主要與多炔化合物反應的試劑。 在過去文獻裡,我們知道了三級膦會與具有拉電子基的炔反應,29,30,31進而在 碳六十上進行環化加成,這是既快速又方便的一種製作含有三圓環 C60衍生物的方 法。32,33,34 此 章 節 主 要 探 討 的 是 碳 六 十 衍 伸 物 的 化 學 。 上 述 兩 者 反 應 後 會 形 成 phosphoramidous ylide,進而加成到碳六十上面。此類具有高極性官能基的碳六十 衍伸物在生物學上有很重要的應用。24,25,26所以我們利用此類反應來建立一個修改 碳六十上高極性官能基的方法。 PR3 OMe O O MeO PR3 MeO O MeO O Scheme2.1 首先,膦(Phosphine) 為一個鹼性的親核試劑 (Nucleophile) ,當它碰到親電子 (electrophilic)的部位時,就會以膦上面的的孤對電子 (lone pair electrons) 去攻擊缺
27
電子的區域,在 Scheme2.1 裡,我們看到孤對電子攻打炔的碳而形成一個正負電荷 分離的中間產物 (intermediate,如上圖箭頭右邊) 。此過渡態產物的負端電子再攻 碳六十(fullerene cage) ,進行親核性環加成反應 (nucleophilic cycloaddition) ,形 成下圖 2.1 的碳六十衍生物 (fullerene derivative) 。 MeO2C PR3 MeO2C 圖2.1 DMAD 與三級膦及碳六十反應之產物結構 由於此反應機制較為簡易,其結構可以直接從1H、13C、31P NMR 中鑑定出來, 藉由 IR 來觀察此碳六十衍伸物上是否有 carbonyl 的官能基,確認反應物有效的接 到碳六十上,再由質譜 (MS) 來做分子量上的檢驗。此外,也可另外測量其紫外 可見光 (UV-Visible) 吸收光譜,看此類衍生物在可見光區的吸收光譜的變化,是 否會對製作成太陽能電池元件之後,得到轉換效率上的關聯。 我們可以看到,此類化合物的負端剛好位於carbonyl group 的 α 位置,即會產 生共振 (resonance) ,造成如圖 2.2 中的順反異構化產物。
28 MeO2C R3P OMe O MeO2C R3P O OMe E form Z form 圖2.2 E,Z 異構物之轉換 此共振式,可從變溫的1H NMR 來做驗證,在常溫的時候,因為共振速率快, 順反異構物不易觀察,當溫度低到-30 oC,便可以較容易看出順反異構物的比例。 在參考文獻裡的一系列反應,27,31,32,33,35 變化了很多不同種類的三級膦,而每 種三級膦對此反應的反應速率皆不同,所以需要以變化反應溫度或是稀釋 DMAD (或其他具有拉電子基的炔類) 來進行反應。 在換了很多個不同的三級膦之後,都能得到產物,唯一不同的就只是反應速 率的差別而已。但是親電試劑就一定要使用有拉電子基在旁的炔類才可以進行反 應。使用的不同三級膦可分為兩類:分別為具有推電子配位基 (PR3:R= NMe2、 cyclohexyl 等) 以及拉電子配位基 (PR3:R=Phenyl、OMe、OEt 等) 兩種。此類反 應生成的碳六十衍生物,再加入HBr 或是 HOAc 之後可能會有不同的化合物產生, 而這些不同結構的變化來自於三級膦上面不同的配位基團 (ligand) 所造成。
本章節利用兩末端為甲脂基 (methyl carboxylate group) 的炔類 (alkyne) 或烯 炔類 (enyne) 跟膦 (phosphine) 反應,在碳六十上進行環化加成反應。當親核試劑
29
HMPT (hexamethylphosphorous triamide) 與 DMAD (dimethyl acetylenedicarboxy- late)作用後與碳六十會進行[2+1]環化加成反應,產生具有三圓環 (cyclopropane ring) 在碳六十上的衍生物。 2.2 含 DMAD 之反應 2.2.1 DMAD 與 HMPT、碳六十之反應 以 DMAD 滴 入 溶 有 碳 六 十 、 HMPT 的 溶 液 中 , 所 形 成 的 產 物 對 氯 仿 (chloroform) 的溶解度很好,且紫外可見光譜測得其在 489 nm 有較明顯的吸收 峰,故溶液呈現紫紅色。首先比對質譜,HRMS (FAB+) 中測得 (M + H+) m/z = 1026.1583,推測其分子確實由碳六十、HMPT 與 DMAD 所構成。 由於 HMPT 有可能與 DMAD 形成不穩定中間產物後,會再以負電荷攻擊 DMAD,所以反應中的 DMAD 須緩慢滴入裝有碳六十以及 HPMT 的反應瓶中,故 反應進行先以 HMPT 當親核試劑,作為反應的開端,其推測結構如 Scheme 2.2 中 所示。 PR3 OMe O O MeO PR3 MeO O MeO O
30 P(NMe2)3 O MeO P(NMe2)3 MeO O OMe O MeO2C P(NMe2)3 MeO2C MeO2C (Me2N)3P OMe O (E)-5 MeO2C (Me2N)3P O OMe (Z)-5 MeO2C Scheme 2.2 在1H NMR 中,在 2.87 ppm 的一個很寬 (broad) 的訊號為 (NMe2)3 ,由於並 非每個氫都處於同樣的化學環境,所以訊號不是呈現一個細長的單重峰;一般來 說,甲氧基 (OCH3, methoxy group) 的訊號會出現在 3.0 ppm-4.0 ppm;此結構氫
31 譜中,3.70 ppm 與 3.74 ppm 為三級膦旁的甲氧基,其訊號代表著在室溫下,化合 物 5 的 E form 與 Z form 可以輕易的被觀察到,所以這兩組訊號各代表著這兩個幾 何異構物 (geometric isomers) 的初步證明;而 3.96 ppm 的單一訊號則是離三級膦 較遠的甲氧基。 31P NMR 中有兩根很接近的訊號分別為 61.68 ppm、61.78 ppm, 可用來佐證此結構有兩個異構物存在,其兩訊號比例差異不懸殊(積分比約為 3:2),以至於在 13C NMR 中的某些 sp2碳,可以被觀察到較明顯的兩組訊號。另外, 紅外線光譜 (Infrared Spectroscopy) 中,也可利用觀察羰基 (carbonyl group) 訊號 來證明有異構物的存在;理論上,羰基的訊號應該出現在 1740 cm-1,但由於 C=O 雙鍵旁邊所接的官能基會影響所測得的值;圖 2.310有一些碳六十上具有脂類的羰 基在 IR 上所被觀測的例子。
1745 cm
-11756(a),1718(b) cm
-1 a b1684 cm
-11678 cm
-1 圖2.3 含有脂基之碳六十衍生物之 IR32 經過實際測量,也可以得知 DMAD 中羰基的 IR 特性吸收峰在 1730 cm-1左 右,如圖 2.435: 圖2.4 DMAD 之紅外線吸收光譜 但是在化合物 5 中,除了原本的 1737 cm-1,又多了一根1620 cm-1 (圖 2.5) 的 訊號,這是因為磷旁邊帶負電的碳,其電子與羰基的 C=O 雙鍵產生共振,使得 C=O 的鍵級 (Bond Order) 小於 2,所以訊號會往右邊偏移,由此更可肯定三級膦 與兩個酯基的相對關係,以及此結構具有幾何異構物的說法。
33 圖2.5 化合物 5 之紅外線吸收光譜 各種訊息不斷給予鑑定此結構具有幾何異構物的可能性。最後,以 13C NMR 來做最後一道佐證的關卡;再標記碳譜上第 59、60 (75.15、75.52 ppm) 和 61 (50.82 ppm) 號碳以後,繼續把重點放在脂基雙鍵上的碳與甲氧基上,170 ppm 左右為羰 基的訊號,而化合物 5 的碳譜中出現兩組異構物的訊號,分別為 169.78 ppm、 171.02 ppm (d, 3JPC = 23.1 Hz);169.42 ppm (d, 3JPC = 17.0 Hz) , 169.99 ppm。另外, ylide 碳上還有一個特徵訊號,大約在 40 ppm 左右有一組 (或兩組) 雙重峰訊號,其具 有很大的偶合常數,由於距離磷只有一個鍵,造成其 1J 值約在 100-200 赫茲 (Hz) 之間[45.46 ppm (d, 1JPC = 197.9Hz) , 47.45 ppm (d, 1JPC = 207.3Hz)]。由這些不同的訊 息中,我們可以確定此[2+1]環化反應的結構。 2.2.2 三圓環於酸性條件下擴環為五圓環之反應
34
C60衍生物中,三圓環的化合物較常被發表,例如PCBM、Bingel reaction 的產
物…等; 文獻中指出α位含有 ylide 的三圓環在加醋酸 (acetic acid) 會開環 (ring opening) 變成五圓環 (圖 2.6),36所以我們拿化合物 5 加醋酸,觀察磷上含氮的 ylide 是否會進行同樣反應。 圖2.6 碳六十上三圓環之擴環反應機制 此結構比照加酸前,最明顯的就是多了一個羥基 (hydroxy group) ,而此官能 基在 IR 最容易被觀察到,我們看到了化合物 6 的紅外線光譜中有一個很明顯的 broad 訊號出現在 3487 cm-1,且只看到一個OCH 3的訊號出現在3.94 ppm (1H NMR) ,依照與 OCH3的積分值比例為3:1 斷定 4.76 ppm 為 OH 的訊號,也表示 著少了一個脂基。OH 旁的碳在 90-100 ppm (13C NMR) 也會有受到磷而分裂的二 重峰 (doublet) 訊號,根據光譜顯示應為文獻中所提及的結構,最後予以質譜的驗 證,(M + H+) m/z = 1012.1434,確認產物與預期分子量一致,其結構如圖 2.7:
35 MeO2C HO P(NMe2)3 O 圖 2.7 化合物 6 之結構 2.3 含 enyne 7 之反應 2.3.1 enyne 7 與 HMPT、碳六十之反應 到目前為止,已知HMPT、DMAD 與碳六十會產生[2+1]環化反應,預期 HMPT、enyne 737與碳六十也會產生三圓環 (cyclopropane ring);33有鑑於enyne 結 構中雙鍵上兩個氫在氫譜上應該有有兩組二重峰 (doublets: 6.46 ppm, J = 16 Hz; 6.87 ppm, J = 16 Hz) ,理應可以在1H NMR 中看到類似的分裂,事實上卻只觀察 到 5.68 ppm 以及 6.22 ppm 兩個較寬的訊號,說明了並非我們所預期的結構,但可 以確定的是此結構 (M + H+) m/z = 1052.1741 為三個反應物分子量總合。
36 圖 2.8 化合物 8 的變溫氫譜 (600 MHz) 雙鍵上的 JHH,trans 消失表示反應後,產物的雙鍵消失或是雙鍵上只具有一個 氫,又在變溫氫譜 1H NMR (圖 2.8) 中看到兩個較小的 OCH3訊號隨著溫度降低慢 慢變明顯,且-25oC 下 13P NMR 在 57.80 ppm 出現小峰,加上紅外線光譜的羰基 在 1615、1738 cm-1的兩個訊號,可以得知 HMPT 接在其中一個脂基的α位上形 成磷葉立德(phosphorus ylide)造成異構化,如此一來,氫譜上就只剩下兩個未知的
37 氫,便假設反應機構如 Scheme 2.3: OMe O MeO O P(NMe2)3 P(NMe2)3 CO2Me MeO2C P(NMe2)3 CO2Me P(NMe2)3 CO2Me MeO2C MeO2C O OMe P(NMe2)3 MeO2C OMe O P(NMe2)3 MeO2C MeO2C P(NMe2)3 P(NMe2)3 O MeO OMe O (E)-8-s-trans
(Z)-8-s-trans (E)-8-s-cis (Z)-8-s-cis
enyne 7
MeO2C
Scheme 2.3
鑑定至此,還不確定的兩個氫可以嘗試用 HMQC 與 HMBC (Heteronuclear Multiple Bond Correlation) ,以 1JCH與nJCH (n≧2) 兩種氫與碳對應關係來解結構;
38
圖2.9 化合物 8 的 HMQC (500 MHz)
圖2.10 化合物 8 的 HMBC (600 MHz)
39 則代表兩個 OCH3,126.26 ppm 對應 6.22 ppm 的氫,依照其碳譜的化學位移推測 應該為雙鍵上的氫,另一個氫在 2D 光譜裡面看不見訊號,只能繼續以圖 2.10 來 觀察與 Ha距離兩個鍵以上的碳;圖中可見Ha與62.25, 71.22,82.90, 148.31 ppm 有 關聯性的訊號出現,中間兩者為碳六十上的 4、5 號碳 (圖 2.11) 的訊號,前者則 為 3 號碳的訊號,後者為雙鍵上沒有氫的 1 號碳,比對至此,其氫碳之間的相對 關係恰與 Scheme 2.3 中的產物結構符合。此結構產物並非原本預期的三圓環產物, 而是產生了另一種的五圓環結構。 P(NMe2)3 CO2Me MeO2C 1 Ha Hb 2 3 4 5 6 7 8 (Hc) (Hd) 9 10 (He) 圖2.11 化合物 8 (將碳六十之外的碳編號) 2.3.2 enyne 7 與 PPh3、碳六十之反應 由於化合物 8 並不符合文獻所預期的結構,在此,選擇重複文獻的實驗33,以 enyne 7、triphenyl phosphine 與碳六十在甲苯下反應,依照化合物 8 的合成步驟在 條件上做些微調整。實驗條件與結果如下頁表 2.1:
40
表 2.1 化合物 9 之合成條件
C60 enyne 7 PPh3 Temp structure
文獻 1 eq 1.9 eq 2 eq 50 oC 三圓環 本章 1 eq 1.2 eq 10 eq 50 oC 五圓環 化合物 9 的合成是同樣也在 50 oC 下進行的反應,所以上表的重複實驗中,由 於反應性較低,相對的需把親核試劑 PPh3做增量的調整,意外的發現主要產物在 1H NMR 中有兩組單重峰 ( singlet ) 的氫訊號 ( 4.7 ppm-6.6 ppm ) ,有兩組與化 合物 8 結構相似的訊號,並沒有出現雙鍵上兩個氫的 dd 分裂,可知產物為五圓環 並非文獻所報導的三圓環結構。另外,兩隻 OCH3都有明顯分裂;31P NMR 在 17.83 ppm、20.39 ppm 也有兩個訊號;第 59、60 號碳有各有兩組相近的訊號,種種訊息 都告訴我們在室溫下就可以觀察到兩組異構物,並且結構與化合物 8 相似。而文 獻中的產物在此條件中雖有被觀察到,但是為數極少 ( trace ) 。 2.4 HMPT 與碳六十之反應 在Scheme 2.4 的反應中,使用鄰-二氯苯 (o-DCB) 作為溶劑時,觀察到副產 物 (side product) 化合物 10 的生成,且與主要產物 5 的比例大約是 1:6,在1H NMR 中,只有明顯的兩組doublet,其中一組為 NMe2的氫 (3.27 ppm) ,剩下另一組 (7.34 ppm) 偶合常數為 27 赫茲的二重峰 (doublet) ,且質譜 (M + H+) m/z = 857.0845, 證實了沒有 DMAD 參與反應的產物,只有 HMPT 與碳六十反應。HMPT 同樣做為
41 親核試劑,只是這次攻打的對象並非 DMAD 而是碳六十。 圖2.12 化合物 10 的 HMQC(600 MHz) HMQC 圖譜 (圖 2.12) 中,只看見三個點,其中有一個是代表氯仿的氫與碳 有關聯的訊號;另外兩個點分別為 37.83 ppm (13C NMR) 對應 3.27 ppm (1H NMR) 與 57.53 ppm (13C NMR) 對應 7.34 ppm (1H NMR) ,前者為已知的 HMPT,由於具 有三個 NMe2,在1H NMR 中的積分值理論上應為 18 的倍數,但實際積分值卻為 13.25 的倍數 (假設 7.34 ppm 為一個氫) ,與兩組 NMe2所擁有的 12 個氫很接近, 又 在 紅 外 線 光 譜 中 見 到 1509 cm- 1 有 P=O 雙 鍵 的 訊 號 ( 與 HMPA, Hexamethylphosphor- triamide,中 P=O 訊號接近, 圖2.1338) ,可能由系統中少量的 H2O 作為質子 (proton) 提供者以及參與水解產生 P=O 雙鍵。於是推測其結構與機
42 圖 2.13 HMPA 之紅外線吸收光譜 P N N N P N N N OH H H NP NN H2O - OH-
43 P(NMe2)3 H H2O H P N O N P(NMe2)2 H HO NMe2 H H P N HO N OH- proton shift -HNMe2 - H 2O Scheme 2.4 1H NMR 中,3.28 ppm 的 doublet 經過 HMQC 檢驗已知為氮上甲基的氫,距離磷三 個鍵,且 3JPH = 9.6 Hz,其結構上的一個氫與磷的距離為三個鍵,而在 7.34 ppm 的二重峰 (doublet) ,其 J 值為 26.7 Hz,由圖 2.12 的訊息,我們有理由相信 7.34 ppm 的氫是在碳六十上。13C NMR 70.04 ppm 的位置有組 1JPC = 100.9 Hz 的二重峰由於 上的四級碳受到磷的影響而分裂。只有一個訊號 33.86 ppm 在31P NMR 中被觀察 到,恰與此無異構物的單一結構符合。 2.5 紫外光譜與循環伏安數據分析
44 圖 2.14 化合物 5、6 之紫外可見光譜疊圖 圖2.14 的藍色線條表示化合物 5 在濃度 5.0×10–5 M 下所測得的紫外-可見光 譜,而紅色線條表示化合物 6 在濃度 2.7×10–5 M 下所測得的紫外-可見光譜,而 實線代表光徑為 10 mm 所測得的曲線,虛線代表光徑為 1 mm 所測得的曲線。通 常紫外光區的 213、257、329 nm 為碳六十的吸收,由圖可知,在接上官能基修飾 以後此區域 (400 nm 以下) 並沒有增加或減少 peak 數量,327 nm 的訊號昇高,可 能是因為接上的官能基在此些區域也有吸收;而原本碳六十在 408 nm 也有小的特 性吸收峰,在此類化合物中,位移到了430 nm 左右。在可見光區部分化合物 5 在 489 nm 有個明顯的吸收峰,540 nm 有個較不明顯的吸收峰,而化合物 6 中此兩吸 收峰幾乎消失,仔細觀察光徑10 mm 的曲線可以發現,化合物 6 在 400 到 600 nm 之間還是有兩個緩降的起伏吸收訊號,在此推測三圓環在 489 與 540 nm 左右的吸 收會比五圓環明顯。 圖中光徑 10 mm 的曲線還可見在 700nm 左右有明顯的吸收
45 峰,此吸收峰的位置則關係到能隙 (band gap) 的大小。 圖2.15 化合物 5、6、8、9、10 之紫外可見光譜疊圖 圖2.15 中為此章節所合成之化合物的紫外-可見光譜比較,化合物 6、8 和 9 皆為五圓環結構, 化合物 8 和 9 不同的地方在於磷旁邊的配位基各為苯 (Ph) 和 二甲基氮 (NMe2) ,在吸收峰波長方面看此兩不同取代基的差異並不會影響紫外 -可見光的吸收。在此章中,若以三圓環與五圓環比較化合物 5 與化合物 6、8 和 9 會發現在 500 nm 附近的吸收峰有明顯的不同,三圓環在較高的 489 nm 而五圓環 則在較低的 474 nm 左右,540 nm 的部分由於吸收峰不明顯,看不出什麼改變。跟 之前所比較的化合物皆不同的 10 號曲線在整個吸收波段的訊號都顯得特別小,由 此可猜測單純的磷化物直接在碳六十上修飾對於紫外-可見吸收光譜可能不會有 太大影響。
46 1.0 0.5 0.0 -0.5 -1.0 -1.5 -2.0 -0.000008 -0.000006 -0.000004 -0.000002 0.000000 0.000002 0.000004 0.000006 Cu rr ent / 1e -6 A Potential / V 化合物5 化合物8 化合物9 化合物10 圖 2.16 化合物 5、8、9、10 之環伏電位疊圖 圖 2.16 為還原電位的比較;由循環伏安法來測量化合物的還原電位,在此我 們使用 HPLC 級的鄰二氯苯 (o-DCB) 作為溶劑,參考電極為銀電極 (浸在溶有 0.005 M 的硝酸銀溶液中),工作電極為碳纖維電極,輔助電極則為鉑電極,而下 圖為已將參考用的鐵莘 (ferrocene) 的半波還原電位定為零以利比較。 表2.2 化合物 5、8、9、10 之能隙、還原電位、LUMO 及 HOMO
化合物 Band Gap 還原電位 LUMO HOMO
5 1.72 -1.25 3.58 5.30
8 1.67 -1.24 3.60 5.27
9 1.68 -1.27 3.56 5.24
47
以1240 除以 UV-vis 光譜中波長最長的吸收峰做切線對 X 軸所得到的值,可 以得到化合物的能隙值 (Band Gap) ,而 LUMO 可以由環伏電位的圖中得知, LUMO 的值加上能隙值即可獲得 HOMO。表 2.2 中,化合物 10 的第一還原電位最 大,其獲得電子能力最強很接近碳六十的-1.1327,表示單純磷化物修飾於碳六十上 並沒有顯著改變;而三圓環化合物 5 接受電子的能力介於 8 與 9 之間;化合物 8 與 9 的結構一樣,只有磷的配位基為甲基氮 (化合物 8) 與苯 (化合物 9) 的不同, 化合物 9 的 HOMO 因為有了芳香環的介入而比化合物 8 來的高,相反的,LUMO 卻降低了;若以越高LUMO 的電子受體材料與某一固定電子受體材料做為元件搭 配的話,其LUMO 越高越有利於 VOC的提升。由表2.2 可看出 LUMO 最高的是化 合物 9,但是由於它的溶解度不佳,所以選擇第二高的化合物 5 來做元件。 2.6 結論 成功製做出含氮的碳六十衍生物,雖然對水並沒有好的溶解度,但是新的結 構在應用方面也多了另一個選擇。使用 enyne 7 以及 HMPT 反應時,會在碳六十上 形成五圓環結構,若改以 PPh3時,發現不只可以形成文獻中提到的三圓環結構, 也會形成五圓環結構。而使用 DMAD 為反應的炔類所得到的化合物 5 在加入醋酸 後也會變成五圓環結構。並且發現直接以碳六十與 HMPT 反應,可以得到化合物 10。
48
3 對稱共軛多炔與三級膦級碳六十之反應探討
3.1 研究動機
有鑒於前一章節推測三圓環在紫外-可見光譜吸收中表現的比五圓環來的 好,且化合物 5 在 LUMO 的表現也不差。此章節則以不同的磷化物為親核試劑來 與反應性更好的 dimethyl hexa-2,4-diynedioate 反應,而此結構與 DMAD 僅相差一 個参鍵,我們預期此類產物也會為三圓環,同樣比較其紫外-可見光譜吸收以及 循環伏安曲線,以利未來的元件製作。
在此章節所用的 dimethyl hexa-2,4-diynedioate 簡稱 diyne 1,此反應物是由 methyl propiolate 在充滿氧氣的反應瓶裡,以 Hay Catalyst 催化使兩個具有甲脂基 (-CO2Me) 的末端炔相互偶合 (coupling) 形成的39。
此反應中預期磷上的孤對電子也會如形成化合物 5 一樣,攻擊羰基 α 位上的 碳,假設經由與化合物 5 一樣的反應機構,產生三圓環的碳六十衍生物,並且保 有一個参鍵,預測的反應機構如下 (Scheme 3.1):圖中三級膦的孤對電子打再 diyne 1 的α位上形成 A,在攻擊碳六十形成 B,碳六十的負電再攻擊缺電子的雙鍵形成 含有 ylide 的結構 11a,而此結構具有共振式產生異構化 (11b, 11c)。
49 OMe O MeO O PR3 PR3 CO2Me MeO2C PR3 CO2Me (Z) form (E) form MeO2C PR3 CO2Me MeO2C PR3 MeO2C OMe O PR3 MeO2C O OMe diyne 1 11b 11c 11a B A
R=cyclohexyl, dimethyl amino
(R=dimethyl amino) (R=dimethyl amino)
(R=dimethyl amino)
Scheme 3.1
3.2 含 dimethyl hexa-2,4-diynedioate 之反應
3.2.1 dimethyl hexa-2,4-diynedioate 與 electron donating phosphine (HMPT 、 Tricyclohexylphosphine)、碳六十之反應 C60 O OMe MeO O P(Chx)3 or HMPT 化合物 11 or 化合物 12 式 3-1 此節以推電子的三級膦來做為親核試劑,先將1 當量碳六十以及 10 當量三級 膦並以 1,2-二氯苯 (o-DCB) 將其溶解置於圓肚瓶,再以 5 mL/h 的速度將 1.2 當 量的 diyne 1 打入反應瓶中 (式 3-1);而 diyne 1 本身應為無色至淡黃色液體,在完 全抽乾溶劑後顏色會變深。在滴入diyne 1 的過程中,可以觀察到反應中顏色改變 比使用 DMAD 時還要快,約莫半小時就呈現紫褐色,此顏色可能為產物的顏色或
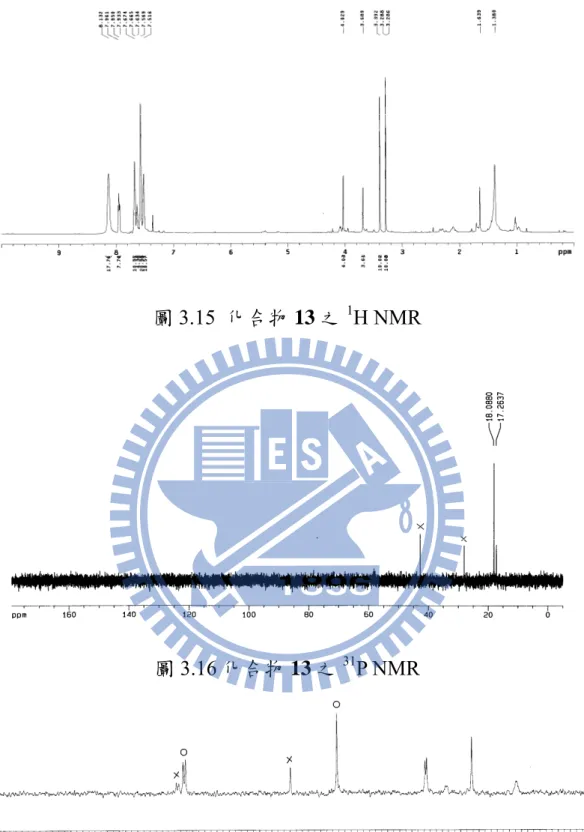
50 是 diyne 1 (其抽乾後會呈現深褐色) 所造成。經過 TLC 檢驗後,得知此兩個不同 三級膦參與反應下只得到一個產物,即使溶液顏色與多數三圓環的碳六十衍生物 在溶液中所呈現的紫紅色有差異,在此還是假設其反應照著 Scheme 3.1 所進行。 圖3.1 化合物 11 之1H NMR 首先,取得含有HMPT 碳六十衍生物的 1H NMR (圖 3.1),2.95 ppm 的二重峰 是 HMPT 上的氫受到磷的影響而分裂,3.25 和 3.85 ppm 分別為兩根 OCH3的訊號。 放大看可發現 3.88 與 3.62 ppm 有兩根小訊號疑似 OCH3,而 2.88 ppm 也有小小的 雙重峰訊號,而且在紅外線吸收光譜中也看到 1750、1629 cm–1兩個 C=O 訊號 (圖 3.4),由此推測此兩組訊號互為異構物。而 FAB Mass Spectrum 提供了(M + H+) m/z = 1050.1598 的訊息,說明此化合物分子量也是三個反應物的總和。
根據文獻以及第二章實驗結果的經驗,若出現異構物在室溫轉變到低溫下通 常磷光譜可以看到兩根訊號,但是此化合物的 31P NMR 不僅在室溫下只在 62.67 ppm 有一根訊號,50oC 的低溫下也只看到 63.43 ppm 一個訊號;由磷葉立德的 C=P 在13C NMR 的二重峰數量也可以看出是否具有異構物, 表 3.1 中有幾個含有
51 HMPT 的磷葉立德的化合物其 C=P 訊號都很接近 46 ppm。40化合物 11 中 C=P 訊 號在 49.06 ppm 且1JPC = 196.3 Hz,與表 3.1 的值相近。 表 3.1 鄰位有 HMPT 之化合物之31P NMR R1 R2 R3 R4 13C NMR (d, 1 JPC) ppm Me Me NH2 Me 46.1 (d, 1JPC = 188.1 Hz) Et Me NH2 Me 46.2 (d, 1JPC = 187.4 Hz) Me Me NHPh Me 45.9 (d, 1JPC = 188.9 Hz) Et Me NHPh Me 46.0 (d, 1JPC = 188.8 Hz) Me Et NHPh Me 46.0 (d, 1JPC = 189.6 Hz) 圖 3.2 化合物 11 之13C NMR 放大圖 (45-85 ppm) R1 O O R2 N N O R3 P (R4)2N N(R4)2 R4 R4 H
52 圖 3.3 化合物 12 之13C NMR 放大圖 (35-90 ppm) 而圖3.2 中位於 49.02 ppm 的二重峰 (1JPC = 196.3 Hz),其化學位移與表 3.1 的 幾個類似結構相近且只有一組二重峰,否定了產物具有異構化的說法,但也很有 可能其異構化速率太快導致 31P NMR 觀測不到;接著,在標記 13C NMR 訊號時也 出現了不符合的現象,而使用PCy3當親核試劑時也有一樣的狀況,若比照化合物 5 的13C NMR 訊號,可以標記出 77.22 (化合物 11)、78.57 (化合物 11);76.11 (化 合物 12)、78.55 (化合物 12) ppm 分別為此兩化合物碳六十上的 sp3訊號 (第 59、 60 號碳),而 75.69 (化合物 11)、83.46 (化合物 11);75.20 (化合物 12)、82.57 (化合 物 12) ppm 的兩根訊號為未反應的参鍵。49.45 (化合物 11)、53.44 (化合物 11);48.42 (化合物 12)、53.18 (化合物 12) ppm 為兩個 OCH3訊號以及48.68 (化合物 11)、48.21 (化合物 12) 為第六十一號碳的訊號。而訊號較小的雙重峰為 C=P 的訊號,其偶合 常數大於一百;除了一般正常的三圓環 sp3、兩個sp (炔)、兩個 OCH3以及 C=P 這 幾個碳以外,還多出四個訊號 (圖 3.2、3.3 中打圈的訊號)。
53
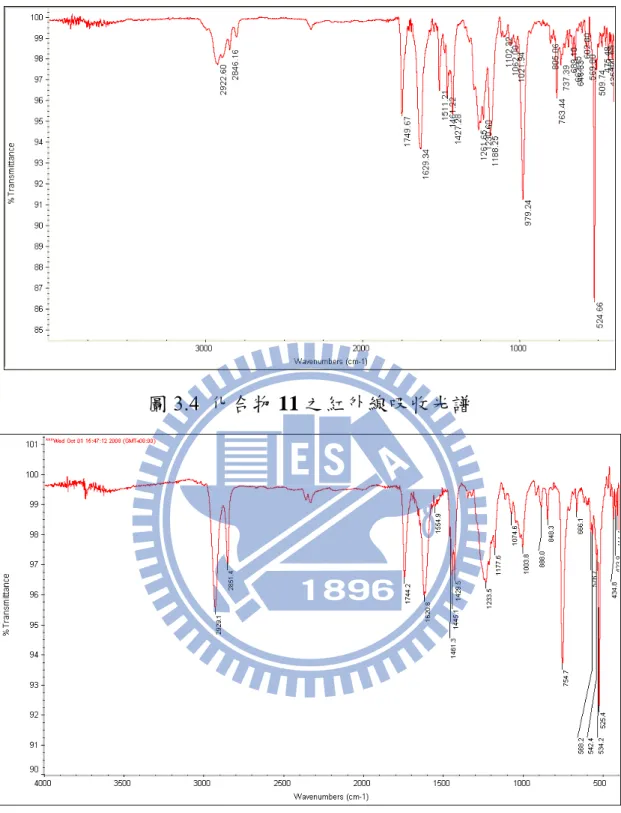
圖3.4 化合物 11 之紅外線吸收光譜
圖3.5 化合物 12 之紅外線吸收光譜
若依照 scheme 3.1 的結構所示,應該會出現六個 sp3以及兩個炔類的 sp 訊號共 八個,由於多出了四個 sp3碳 (圖 3.2、3.3 打圈處) 的訊號,在分子量不變的情況
54 下,結構就顯的不是原本預測的這麼單純,故提出了多個假設的反應機構以推測 可能的產物結構。 基於在紅外吸收光譜中觀察到1750 與 1625 cm–1左右有兩個羰基的吸收峰 (圖 3.4、3.5),表示兩個羰基具有不同的化學環境,進而假設磷上的孤對電子與推測的 一樣,反應的第一步皆為攻擊 diyne 1 羰基的α碳位置,形成在雙鍵上帶有負電荷 的中間體 (F, Scheme 3.2),假設以下反應機制: 首先,為了要符合碳數,需要盡可能使 sp3 的碳增加,於是假設反應機構如 Scheme 3.2: OMe O MeO O PR3 PR3 CO2Me MeO2C R3P MeO2C dimethyl hexa-2,4-diynedioate CO2Me CO2Me PR3 CO2Me CO2Me R3P MeO2C A B C
R=cyclohexyl, dimethyl amino
55 CO2Me PR3 CO2Me MeO2C PR 3 MeO2C D E Scheme 3.2 此推測結構 (Scheme 3.2) 中,在 1H NMR 中是看不出差異的,31P NMR 理應 因為異構化而有兩個訊號才對,除此之外,兩個羰基一個有共振而另一個無,符 合紅外吸收光譜所顯示的兩個羰基訊號,而炔類的吸收很小,並不一定看的到, 而二氧化碳的紅外線光譜位於 2353 cm–1;除了31P NMR 不合以外,Scheme 3.2 的 第三步中,A 上碳六十上的電子與参鍵反應變成一四圓環的中間產物 B,而雙鍵上 的負電荷並不穩定,故很快的變成参鍵並且將環張力大的四圓環斷開將原本 diyne 1 的兩個参鍵拆成兩邊形成 C 且可能暫時脫去三級膦並形成平衡,最後再以三級 膦的孤對電子打在三鍵上並與碳六十上另一個雙鍵反應形成 E,計算其 sp3的碳共 有八個,再加上炔上的兩個 sp 碳共十個,比碳譜上測得的十二個碳還少了兩個, 故 13C NMR 碳數上也不合。
56 OMe O MeO O PR3 PR3 CO2Me MeO2C R3P MeO2C dimethyl hexa-2,4-diynedioate O OMe MeO2C PR3 O MeO2C PR3 O OMe MeO
R=cyclohexyl, dimethyl amino
Scheme 3.3 比對13C NMR 上多出的 sp3訊號,與接在氧上的碳位置範圍接近,故假設OCH3 可能從羰基離去,從脂類變酮類,進而接到碳六十上的雙鍵上,近而增加 13C NMR 中 sp3的碳數,反應機構假設如Scheme 3.3:碳六十上的負電荷攻擊羰基使得 OCH3 脫去形成親核試劑,攻擊碳六十上的雙鍵,如此一來 sp3的碳數就會增加兩個,與 炔類 (sp) 碳數總和為十個碳,還是比碳譜測量的碳少兩個;比較文獻中類似結構 (22) 的碳譜,兩個羰基中碳的位置分別在 185.15 ppm 的二重峰 (2JPC = 10.6 Hz) 以 及 178.94 ppm,41與此結構中 13C NMR 的位置 [圖 3.6、圖 3.7:分別在 168.72 ppm 的二重峰 (2JPC = 19.2 Hz) 與 164.64 ppm 以及 169.35 ppm 的二重峰 (2JPC = 15.3 Hz) 與 164.99 ppm] 相差超過十個 ppm,比較文獻得知酮類在13C NMR 中比脂類較為 downfield,總結此結構除了碳數少二以外,13C NMR 也存有疑點。
57 22 圖3.6 化合物 11 之 13C NMR 放大圖 (158-170 ppm) 圖3.7 化合物 12 之 13C NMR 放大圖 (600 MHz) 綜觀此小節兩個碳六十衍生物的紅外吸收光譜發現参鍵的吸收特別小,因此 假設第二個参鍵也參與反應,但又因為 13C NMR 在 100 至 120 並無訊號,因此在 產物不會有雙鍵產生的前提下假設以下幾個反應機制 (Scheme 3.4、Scheme 3.5、
58 Scheme 3.6) : OMe O MeO O PR3 PR3 CO2Me MeO2C PR3 CO2Me MeO2C PR3 CO2Me MeO2C dimethyl hexa-2,4-diynedioate PR3 CO2Me MeO2C
R=cyclohexyl, dimethyl amino
G H PR3 CO2Me MeO2C R3P CO2Me MeO2C R3P CO2Me MeO2C R3P MeO2C O OMe PR3 MeO2C O MeO I J K Scheme 3.4 Scheme 3.4 中,先形成第三步的三圓環結構 (G),且葉立德 (ylide) 位於脂類
59
的α碳上,由葉立德上的電子打向碳上形成 spiro 的結構 (H),且另一個参鍵變成 雙鍵且帶有負電荷,雙鍵又繼續與碳六十反應 (I),將負電荷轉移到 spiro 環上, 經過三圓環的斷鍵之後有兩種可能產物路徑:一種為保留兩個脂類,但是會有雙 鍵在結構中(J);一種為甲氧基脫去,形成具有 spiro 結構的 ylide ketone (K)。前者 只有六個sp3的碳,比一開始假設的三圓環結構還少兩個碳,此假設結構雖與1H NMR 和紅外線吸收光譜訊息吻合,但是多出了一個雙鍵,明顯與 13C NMR 不合, 故不列入可能結構。後者的 sp3碳數為十個,而 spiro 兩邊分別是三圓環以及四圓 環而四圓環上含有葉立德在酮基的α位上,由於四圓環與五圓環張力不同,電子 雲密度分不也不同,所以在此羰基的化學位移與五圓環中羰基的位置可能會不 同,加上碳數不合,所以此結構也不太可能產生。 MeO2C CO2Me PR3 R3 P R3 P MeO2C CO2Me MeO2C CO2Me