第一章 前言
1-1. 缺血性中風的流行病學、病理生理學
根據衛生署 2002 年公佈的「台灣地區十大死亡原因」中,
腦血管疾病名列第二
(1)。缺血性中風(ischemic stroke)佔所有腦 血管疾病(cerebrovascular disease)的 80%以上
(2)。發生缺血性中 風的原因,主要是由於供給腦組織的血管發生狹窄或完全閉塞,
致使其供給的腦組織血流降低,無法獲得充分的氧氣和養分,而 導致該區域腦組織的損傷,甚至壞死,稱為腦梗塞。造成供給腦 組織血管狹窄或閉塞的原因有血栓和栓塞兩種
(2)。臨床上將梗塞 區分為梗塞核心區(ischemic core area)和梗塞旁區(ischemic penumbra) 。梗塞核心區的腦組織由於血液供應低於臨界值
(3),因 此產生不可逆損傷的細胞壞死(necrosis),而梗塞旁區由於仍有 側支循環供應血流,其神經損傷是可逆的,因此成為治療學上發 展的重心。
1-2. 缺血性中風的治療概況、研究方向及瓶頸
急性缺血性腦中風若發生於 3 小時內,原則上可用血栓溶解 劑 t-PA 來治療
(4)。根據 1999 年美國心臟醫學會及臨床神經醫學 會 所 共 同 制 訂 的 t-PA 治 療 準 則 , 建 議 治 療 以 靜 脈 注 射 recombinant t-PA(0.9 mg/kg,max. 90 mg with 10% of the dose given as a bolus followed by a 60-minute infusion)為主,但必須符 合並排除以下情形才可使用
(4)。它主要目的是在拯救梗塞旁區(
I
Is
sc
ch
he
em
mi
ic
cp
pe
en
nu
um
mb
br
ra)
a)內的神經細胞,但由於治療的黃金時間只有
3 小時十分狹窄,而且使用上限制很多,因此只有少數的患者(
約 5 % to 8 %)合乎條件而施行治療。自 1996 年 FDA 核准該療 法後
(5),對於缺血性腦梗塞的研究方向便著重於如何延長其治療 的 time window,於是有關神經細胞保護劑、自由基清除劑、NMDA 受體阻斷劑、發炎反應調節劑等的研究陸續被開展起來。
1-3. 缺血性中風發生後腦組織的分生變化
缺血性中風產最主要的原因是粥狀動脈硬化或瘢塊掉落產 生的血栓或來自心臟的血栓,造成頸動脈或大腦血管的狹窄,甚 至阻塞。在梗塞核心區,由於腦血流低於臨界值
(3),因此腦組織 缺乏足夠的氧氣和能量,進而引發一連串細胞在分子層次變化的 產生,造成梗塞核心區立即性、不可逆的神經細胞死亡以及梗塞 旁區延遲性的細胞損傷或死亡
(3)。又隨著因缺血、再灌流的產生
,導致神經細胞更多分子生物事件的相繼發生
(6),如發炎反應(
inflammation)、神經細胞毒性(excitotoxicity)、一氧化氮(nitric
oxide, NO)的生成、 自由基產生所造成的損傷(free radical
damage)、以及細胞凋亡(apoptosis)等。這些因腦組織缺血所
引起的病理變化,稱為缺血後事件(ischemic cascade)
(3)。腦組
織缺血所帶來一連串的病理變化所涉及層面相當複雜,但可簡單
歸納如下:1)因能量供應不足,而產生離子幫浦、粒腺體的失
能;2)神經細胞軸突末稍所分泌大量神經刺激物質,所形成的
神經細胞毒性;3)細胞內鈣離子超載所啟動的後續事件;4)氧
化自由基、 NO 的生成,以及對細胞的攻擊;5)細胞激素產生所
啟動的發炎反應,都會進一步形成延遲性神經細胞的損傷。
1-4. 發炎前驅細胞激素(proinflammation cytokines)與缺血性中風的關 係
細胞激素的產生會伴隨著發炎反應、免疫反應的啟動、細胞 分化或細胞死亡。缺血性中風後,啟動的發炎前驅細胞激素中,
最重要為 interleukin-1(IL-1)和 tumor necrosis factor-a(TNF-a
)
(7-10),它們的產生會加重缺血後的腦損傷
(11-13)。在大腦當中,
分泌發炎前驅細胞激素最主要的細胞是微膠細胞( microglia)
(3,11,12,14)
。缺血事件發生後,由微膠細胞分泌釋放的 TNF-a、
interleukin-1ß( IL-1ß)會進一步對微膠細胞產生活化作用,而 microglia 被活化的結果會釋出更大量的細胞激素,並誘導、活 化周邊的白血球,產生內皮細胞黏附因子、化學趨化因子,使白 血球黏附並穿透已被蛋白酵素破壞的腦血管障壁(blood brain barrier,BBB)
(15-25)。當大量的白血球進入梗塞區域後,會不斷 的釋放更多的細胞激素、氧化自由基,而導致二次腦損傷
(11)。因 此,如何降低腦梗塞後的發炎反應,成為治療上研究的重點。
1-5. 中醫應用活血化瘀中藥的源流
中醫對活血化瘀藥的應用,最早可追溯至兩千多年前,考古
學上發現最早的醫書「治百病方」,其書中五個醫方中就有活血
化瘀藥當歸、川芎、牡丹皮的記載。「五十二病方」中記載用芍
藥、川芎、茜草、鬱金、牛膝和酒來治療疾病
(26)。公元前 200 多
年,西漢時期的神農本草經書中,就記載了 41 味具有活血化瘀
作用的藥物,如丹參、牡丹皮、芍藥、蒲黃、川芎、大黃、及動
物類藥的蟅蟲、水蛭等,這些藥物具有活血化瘀、破血消瘀或攻
瘀的作用。唐代政府所頒佈的「新修本草」,堪稱為世界上第一
部藥典,又稱為「唐本草」,其書中新增補了近 30 種具有活血化
瘀的藥物,如血竭、蘇木、紅花、延胡索等,進一步豐富了活血 化瘀藥的內容
(26)。宋朝時期,唐慎微所著的「証類本草」,集宋 以前本草之大成,更運用活血化瘀藥來治療各種疾病,如三稜、
莪朮等。金元四大家臨床上常用桃仁、五靈脂及紅花等來治療疾 病。明朝李時珍的「本草綱目」,記載 100 多種活血化瘀的藥物
,其中又添了川七、穿山甲、月季花等藥。清代趙學敏的「本草 綱目拾遺」,對活血化瘀藥有更詳盡的論述,又增加土牛膝、雞 血藤、玫瑰花、一枝蒿等活血化瘀藥。應用活血化瘀藥物來治療 疾病,以及對於活血化瘀有關的論述,到了清代可說是逢勃發展
。
由以上得知活血化瘀藥的記載始於「神農本草經」,發揮於 唐宋的「唐本草」 、 「類証本草」 ,豐富於明代「本草綱目」,完善 於清代「本草拾遺」
(26)1-6 活血化瘀藥對缺血— 再灌流損傷腦梗塞之研究
現代研究顯示,活血化瘀藥可歸納為以下五個主要作用:1
)擴張血管,改善微循環;2)降低血小板的凝集、增強纖維蛋 白溶解和防止血拴形成;3)調節組織能量代謝、促進組織修復 和減少疤痕化;4)抗發炎作用;5)調節身體免疫反應
(26)。另外
,有些活血化瘀藥具有抗發炎反應、自由基清除、抑制神經細胞 毒性等作用。本實驗室先前的研究顯示,在缺血— 再灌流損傷腦 梗塞大鼠的模型中,活血化瘀藥或方劑如丹參、延胡索、牡丹皮
、槐花、補陽還五湯湯等,能夠減少梗塞面積
(27)。
1-7. 本研究之目的
本研究之目的在探討活血化瘀藥當中,在清代— 王清任「醫
林改錯」中出現頻率很高的活血化瘀藥紅花,應用腦梗塞動物模
型,客觀的評估其對腦梗塞的作用。我們應用我們實驗室先前所
建立的腦梗塞動物模型,將 Sprague-Dawley(SD)大鼠兩側的總
頸動脈和右側的中大腦動脈阻斷腦血流 90 分鐘,再經 24 小時的
再灌流。腦梗塞效用的評估是根據腦梗塞面積的大小和神經缺損
的程度。同時我們也測量周邊血液的 luciegnin-chemiluminesence
(CL) counts 來觀察超氧陰離子,以及計算腦梗塞區 TNF-a 和 IL-1ß
染色陽性細胞,來觀察 TNF-a 和 IL-1ß 與紅花的關係。
第二章 文獻探討
2-1. 中醫治療中風理論之源流
急性腦血管疾病,屬於中醫“中風”、“偏枯”的範圍。黃 帝內經
(9)就有中風相關徵候的描述,如“偏風”、“瘖痱”、“
大厥”、“煎厥”、“薄厥”、“偏枯”、“喎斜”等。《素問
.調經論》
(9)有“血之與氣,並走于上,則為大厥,厥暴則死”
的記載,說明中風的發生與與氣血有密切的關係,而且病勢發展 快速凶猛,會置人於死地。《素問.生氣通天論》
(28)中說:“陽 氣者,大怒則形氣絕,而血菀于上,使人薄厥”,提示說情緒劇 烈變動,也是中風發病的誘因之一。
西漢張仲景在《金匱要略.中風歷節篇》
(29)中首先提出中風 的病名,並用中臟、中腑、中經、中絡來作為中風的分類。如“
邪在於絡,肌膚不仁;邪在於經,即重不勝;邪入於腑,即不識 人;邪入於臟,舌即難言,口吐涎”。他們認為中風的發病是因 內虛引致外風的侵入,即「內虛邪中」,故以「外風」立論
(29)。 唐宋時代認為中風來自於外感風邪,所以治療以辛溫疏散,發汗 逐表為主,如大秦艽湯、大小續命湯、候氏黑散等,這些方中都 含有麻桂之品。自漢代仲景至唐宋之間,對於中風病的治療大體 上以疏散外邪為主流,但嚴用和在《濟生方.中風論治》認為“
若內因七情而得之者,法當調氣,不當治風;外因六淫而得之者
,亦先當調氣,然後依所感六氣,隨證治之”,提出治療以調氣
為優先,因為“大抵人之有生,以元氣為根,榮衛為本。若根本
強壯,榮衛和平,腠裡緻密,外邪客氣就不能為害,所以治療中
風應首重「調整內虛」
(11)。
金元時期的醫家體會出,在治療中風時不能將內風外風混為 一談,故在病因病機上另闢蹊徑
(30),如劉河間在《素問玄機原病 式.火類》中提出“中風癱瘓者,非為肝木之風實甚而卒中之也
,亦非外中於風爾;由乎將息失宜,而心火暴甚,腎水虛衰,不 能制之,則陰虛陽實”
(30,31),他認為“熱為本,風為標”,因此 提倡用「辛涼開竅」 、 「滋陰」等方法來治療中風,但仍不脫離唐 宋外風立論的束縛,所以有“中風外有六經之形證,先以加減續 命湯隨證治之”以及“內有便溺之阻格,復以三化湯主之”的論 點。李東垣認為“中風為百病之長,乃氣血閉而不行”,因此強 調“痰”在中風的重要性
(30,31)。朱丹溪在《丹溪心法》中提出:
“中風大率主血虛有痰,治痰為先,次養血行血”的觀點,主張
“初得即當順氣,乃日久即當活血”
(30,31)。
明朝之後,認為“木必先枯也,而後風摧之,人必先虛之,而 後風入之“,所以趨向以肝風論點來說明中風發病的原因,治療 上偏重理虛及氣、血、痰兼治
(30)。戴思恭、王綸、吳昆等承襲丹 溪痰氣學說的論點,提出”痰生於脾“、”風痰源於血虛“、”
痰本於脾胃氣虛“的觀點,而主張用「順氣化痰」 、「補益脾氣」
、 「養血活血通絡」等 方法來治療中風
(30,31)。王肯堂則沿襲河間“
心火暴甚”學說,而提出「降心火、平肝木」的治療方法
(32)。趙 獻可認為中風的根源在腎,主張滋補腎陰,溫補腎陽,對口舌歪 斜,提出「潤燥熄風法」來治療。張景岳則從內傷積損立論,對 卒中氣脫主張「急用大劑參附峻補元氣」、繼而「填補真陰以培 其本、痰壅以開痰」,病緩則用「溫脾強腎」來治本,肝血虛則
「養血以除燥,則真陰復而假風自散」等
(31,32)。繆希雍認為中風
是”內虛暗風“立論,“法當「清熱順氣開痰以救其標」;次當
治本,「分陰虛、陽虛、氣血兩虛而治之」”
(33)。李中梓用「開 閉、固脫」的治療法則,認為卒中、不語、半身不遂、口舌歪斜 應分別論治
(33)。
清中葉以前,承襲明末肝風內動理論,主張用「滋陰治風法
」 、 「潛陽鎮攝法」等的滋水涵木方法來治療中風。爾後西學東漸
,融入西醫病理解剖觀念後,產生「活血化瘀法」的觀念來治療 中風
(30),如葉天士在《臨證指南醫案》書中主張“精血衰耗,水 不涵木,木少滋榮,故肝陽偏亢,內風時起”的觀點,所以提唱「
滋液熄風」 、 「濡營養絡」、 「補陰養陽」的治療方法
(32,33)。張錫純 在《衷中參西錄》中,認為中風是“氣血並走於上”,提出“陰 損肝陽化風,夾氣血上衝“的發病論點,主張加入龍骨牡蠣潛鎮 之品來治療中風
(32,33)。張山雷的《中風斠權》和張伯龍的《雪雅 堂醫案》兩者都提倡「潛陽鎮攝」 、 「開泄痰涎」、 「順氣降逆」、 「 滋養心肝腎陰」等方法 來治療中風
(33)。王清任在《醫林改錯》
書中提出「氣虛血瘀」的理論,採用補養還五湯,重用黃耆為君
,加入活血化瘀之品,首先以「補氣活血」的方法來治療中風
(31)。
2-2. 紅花之文獻探討 2-2-1 紅花的品種
本實驗所使用的紅花為菊科(Compositae)草本植物的乾燥 花,又稱為草紅花(Carthamus tinctorious L.)與鳶尾科(Iridacae
)的番紅花(藏紅花,Crocus sativus L.)不能混為一談。兩種藥
材,科屬不同、產地不同,用法用量也有區別。藏紅花的正規藥
材名稱應為番紅花或西紅花,因為西藏本身並不出產所謂的藏紅
花,該品原產於西班牙、義大利、希臘、土耳其、利比亞、阿爾 及利亞等地中海沿岸國家,英國大量掠奪,然後殖民印度,又從 印度走私到西藏,再從西藏傳入中國大陸,因而有藏紅花之名產 生。因此在《本草綱目拾遺》中有“藏紅花來自西藏”之記載
(34)。本研究所用的川紅花,其實為草紅花的一種。草紅花的產地在 新疆、西北、華北、東北一帶,原產地為埃及,擴種至波斯,然 後轉入西域,爾後由東漢張騫出使西域將種子帶入內地,而新疆 紅花的栽培是在絲綢之路暢通後,由內地輸出農業技術,將紅花 在新疆栽培,因此草紅花由於產地不同而名稱各異,如懷紅花(
河南)、川紅花(四川)、杜紅花(浙江)、雲紅花(雲南)等。
在藥材植物學上,應只有紅花(草紅花)、藏紅花兩種,其分述 如下:
紅花:學名為 Carthamus tinctorius L.,生藥名為 flos carthanu
,英文名為 safflower、False saffron、African saffron、Bastard saffron
、Thisfle saffron。科屬為菊科,門屬為雙子葉植物門,一年生,
入藥用乾燥花花冠。
藏紅花學名為 Ceocus sativus L.,生藥學名為 Stigma croci,
英文名— 為 Saffron、Crocus。科屬為鳶尾科,門屬為單子葉植物 門,多年生,入藥用雌蕊柱頭
(34)。
2-2-2 草紅花與番紅花作用的區別:
草紅花是破血、行血、和血、補血之主藥,它性味辛、溫。
歸肝、心二經、入肝經血分。能通利經脈、能瀉能補、能破能養
、可行可導
(34)。使用劑量上在明朝.賈所學所著《藥品化義》中
記載“紅花善通利經脈,為血中氣藥,能瀉而又能補,各有妙義。
若多用三四錢,則過於辛溫,使血走散若多用三、四錢,則過於 辛溫,使血走散。若少用七、八分,以疏肝氣,以助血海,大補 血虛,此其調暢而和血也。若只用二、三分,入心以配心血,解 散心經邪火,令血調和,此其滋養而生血也。”典籍上記載草紅花 作用如下《朱氏集驗醫方》-“治女子經脈不通,如血膈者”; 《景岳 全書》-“「脫花煎」治難產經日或胎衣不下”;《金匱要略》“「紅 藍花酒」治婦人 62 種風及腹中血氣刺痛”。
番紅花性味甘平,入心肝二經,能活血化瘀、散鬱開結。一 般認為其活血化瘀之效力較草紅花為佳。“實驗證明,拌入 15%的 草紅花做飼料,小白鼠即行死亡,但拌入 2%的番紅花作為小白鼠 飼料也會馬上死亡。如果毒性與療效呈正相關存在,那麼 7.5 份的 草紅花就約等於 1 份番紅花的效力”。但從價值上來看,每千克番 紅花的價值要比草紅花貴上 63-120 倍,但番紅花的療效卻只有草 紅花的數倍而已
(34)。“為什麼番紅花會如此貴?最大的原因在於採 集上要花費太多的人工,且採之不易。番紅花是用花的雌蕊柱頭
,每千克藥材需要在清早露水未乾時翻山越嶺採集 10 萬朵鮮花,
帶回家後要去其花瓣、雄蕊、子房,單取也三分裂的柱頭,10 萬 朵花只可獲得 5000 克的雌蕊柱頭,而乾濕比又為 5:1,故最後僅 獲得 1000 克乾品,亦即 100 朵鮮花只能獲得 1 克的乾品,貴就貴 在手工上”
(34)。
番紅花與草紅花在功能主治上雖不完全相同,但同樣具有活
血化瘀、降血壓、以及對子宮的興奮作用,在番紅花不易獲得且
價格昂貴的情況下,用草紅花來代用,還是行之有效
(34)。
2-3. 紅花之現代藥理研究
紅花含黃酮類,如 Carthamin(C21H22O11),約含 0.4-0.6 % 及 其 他 黃 酮 類 Carthamone ( C21H20O11 )、 Neocarthmain ( C21H22O11)及木脂類多炔類等。另外,含紅花色素黃(safflor yellow)為 28-36 %,為多種水溶性成分棕黃色粉末。其主要成分 歸納如下:水分— 4.5-11.5 %、溶於水的黃色素 20-30 %、溶於鹼 的黃色素 2.1-6.1 %、紅花素 0.3-0.6 %、蛋白質 1.7-8.0 %、似蠟 物質 0.6-1.5 %、提取物 3.6-6.5 %、纖維素 38.4-50.4 %、灰分 2.5-3.0 %。另外,紅花富涵微量元素如鉻、錳、鋅、鉬等,具有 保護心血管、防治糖尿病的作用
(34,35)。
2-3-1 紅花富含黃酮類,具有抗氧化作用:
許多研究報告指出,紅花含有抗氧化作用的成分,在紅花組織 培 養 中 分 離 出 Kinobeon A 這個成分,具有抗氧化作用。在 NADPH-induced microsomal lipid peroxidation system 評估方法當 中顯示,Kinobeon A 這個成分具有清除超氧陰離子的作用
(36)。進 一步分析其可能的作用機轉,顯示 Kinobeon A 這個成分可能為 tyrosinase inhibitor
(37)。
從 紅 花 分 離 出 八 種 黃 酮 類 物 質 , 包 含 一 種 新 的 成 分 : quercetin-7-O- (6''-O-acetyl) -beta-D-glucopyranoside 以及七種已知 成 分 : luteolin, quercetin, luteolin 7-O-beta-D- glucopyranoside, luteolin-7-O- (6''-O-acetyl) -beta- D-glucopyranoside , quercetin 7-O-beta-D- glucopyranoside , acacetin 7-O-beta-D- glucuronide and apigenin-6-C-beta-D- glucopyrano syl-8-C- beta- D- glucopyranoside
。 其 中 強 抗 氧 化 劑 為 luteolin-acetyl-glucoside 、 quercetin-
acetyl-glucoside,其次 Luteolin , quercetin, and their corresponding
glycosides , 亦 具 有 較 強 的 抗 氧 化 作 用 , 而 其 它 兩 種 acacetin glucuronide、apigenin-6,8-di-C-glucoside,則較不具抗氧化作用
(38)2-3-2 紅花成分當中具有抗發炎作用:
紅花所含的成分當中,紅花色素黃(Safflower yellow –SY)
注射至老鼠腹腔內,可以抑制血清中 lysozyme 的濃度、以及降低 腹膜巨噬細胞及白血球的吞噬能力進而抑制發炎反應
(39)。
紅花當中所含的 Herbimycin A (HERB)、 HHI 屬於 Src tyrosine kinase inhibitors,可以通過抑制 IL-1beta, TNF-alpha 以及 IL-6,降低 COX-2 mRNA、PGE2 濃度,進而防止骨質的過度再 吸收而導致的骨質流失
(40)。
紅花萃取物— N- (p-coumaroyl) serotonin (CS)以及其 3 種衍 生物 N- (trans-cinnamoyl) serotonin (Cin.S), N-(trans-cinnamoyl) tryptamine (Cin.T)、 N-(p-coumaroyl) tryptamine (CT),可以抑制 受 LPS 刺 激 後 的 人 類 單 核 球 釋 出 發 炎 前 驅 細 胞 介 質 ( pro-inflammation cytokins)如 IL-1alpha, IL-1beta, IL-6, IL-8, and TNF-alpha。其中 Cin.S、CS 具有強自由基清除作用;CS 以及 CT 對於發炎前驅細胞介質具有強力的抑制作用;而 Cin.S 僅能抑制 IL-1alpha、IL-1beta;Cin.T 則無抑制作用
(41)。
2-3-3 紅花成分當中具有抑制 glutamate-mediated 損傷,產生神經細 胞保護作用:
在體內及體外實驗中發現,由紅花萃取出的紅花色素黃(
hydroxysafflor yellow A-HSYA)可以延長老鼠的凝血時間,並有
效 的 降 低 缺 血 性 中 風 後 的 梗 塞 面 積 。 在 動 物 實 驗 中 以
Wistar-Kyoto (WKY)rats 進行中大腦動脈阻斷(MCAO) ,發
現經舌下靜脈注射給予單一劑量 HSYA 3.0 mg/kg、6.0 mg/kgm 與 注 射 生 理 食 鹽 水 組 比 較 , 可 以 明 顯 降 低 神 經 學 缺 陷 分 數 ( neurological deficit scores)以及大腦梗塞面積。而 6.0 mg/kg 的治 療效果與西藥組-鈣離子阻斷劑 nimodipine- 0.2 mg/kg 相當。在細 胞培養當中,以 glutamate 及 sodium cyanide (NaCN)當作神經 毒性物質,並加入HSYA 做評估,發現 HYSA對 glutamate-mediated 神經元損傷的保護作用明顯優於 NaCN 所導致的神經元損傷。以 上研究顯示,紅花萃取物— 紅花色素黃(HSYA),具有神經保護 作用,可以用來治療局部缺血性中風
(42)。
在視網膜缺血性損傷的研究發現,紅花可以對抗缺血後神經 細胞所分泌的 glutamate、N-methyl-D-aspartate、kainate、quisqualate, 產生的毒性作用,並能減緩神經細胞退化性病變的發生
(39)。 綜上可知,紅花所含的成分當中,具有抗氧化作用、抗發炎 作用以及神經細胞保護作用,因此,本實驗將採「暫時性-局部缺 血性中風」的疾病動物模式,來驗證紅花對缺血性中風具有治療 作用、保護作用的假說,並進一步針對其可能的作用機轉進行研 究。
2-4 研究缺血性中風的動物模型
缺血性中風的研究主軸及實驗方式依中風時間長短來分,
主要模型有二,一為永久性阻塞(permanent occlusion);另一為 暫時性阻塞(transient occlusion)。另外,依手術方式來分,主要 可分為管腔內阻斷 ( intra-luminal occlusion)、管腔外阻斷(
extra-luminal occlusion)。
不同的模型所觀察的病理生理變化不完全相同,而本實驗室
使用的模型為暫時性、管腔外阻斷,簡稱為 BCCA+RMCAO 係 根據
(43)所提出的實驗方法 modified 而來,屬於暫時性局部中大腦 動脈阻斷模型(transient focal middle cerebral artery occlusion) 。簡 言之,就是透過手術方式,以套管將兩側總頸動脈阻斷,並經開 腦手術,以外科縫合線將右側中大腦動脈於下大腦靜脈及嗅束上 緣用活結結紮形成的暫時性血流阻斷與再灌流,而造成局部缺血
— 再灌流損傷腦梗塞的動物模型,其梗塞區域侷限於中大腦動脈 血流供應的大腦皮質區(neocortex area) 。本實驗室先前的研究,
均採用此模型
(27),利用 2% 2,3,5-triphenyltetrazolium(TTC)染色
,可用肉眼區分出梗塞區域為白色,而正常腦組織為紫紅色
(44-46)。另外一種阻斷方式為管腔內阻斷,簡言之,是以尼龍質外科縫 線尺寸為 4-0-0,在線的前端用矽膠類物質覆蓋,從頸外動脈做一 個切口,將外科縫線從此穿入,進入頸內動脈後,往顱底方向送 入縫線,最後使前端矽膠覆蓋處的位置進入 Will1s circle 後,直 達前大腦動脈與前交通支交界處,如此便可完全阻斷中大腦動脈 之血流。目前有許多文獻採用這個方法來製造缺血— 再灌流動物 模型,但其梗塞區域就不限於大腦皮質區,因為中大腦動脈會發 出許多穿通動脈進入基底核區,因此此一模型的梗塞面積會包含 中大腦動脈灌流的基底核以及皮質區,用 TTC 進行染色,同樣可 以看到梗塞區域呈現白色、正常腦組織呈現紫紅色。
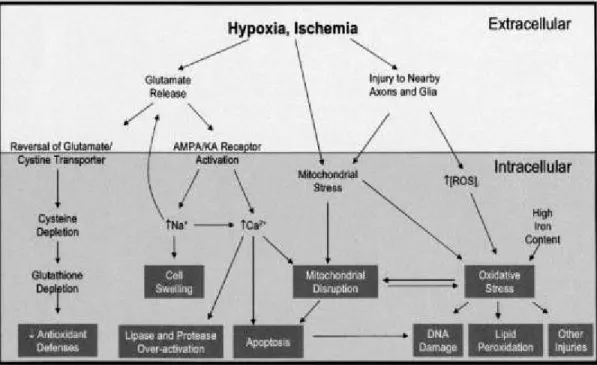
2-5. 缺 血 性 腦 梗 塞 後 之 神 經 細 胞 毒 性 物 質 之 產 生 及 傷 害 (excitotoxicity):
當缺血性腦梗塞產生後,由於血液供應不足使得神經細胞獲
得的能量下降,因此使 Na-K ATPase 受到抑制,導致星狀細胞(
astrocyte)外鉀離子濃增高,進而會使突觸前神經細胞軸突(
pre-synaptic terminal) 產生去極化作用,在突觸前釋出大量的
glutamate
(47);另一方面由於能量供應不足使 Na-K ATPase 受到抑
制會使鈉離子無法由星狀細胞內運送出,導致細胞外鈉離子濃度
降低,進而抑制 Na- dependent glutamte 回收作用,而加重細胞外
glutamate 濃 度 之 升 高 。 最 後 的 淨 結 果 就 是 突 觸 前 細 胞 (
pre-synaptic terminal)大量釋放出 gluatamte (圖 2.1)
(43)。
圖 2.1 缺 血 性 腦 梗 塞 後 事 件 (Ischemic cascade)
Glutamate 是 一 個 具 有 強 作 用 力 的 神 經 傳 導 物 質 ( neurotransmitter ),一方面它會與陽離子幫浦上的受體結合(
inotropic recepto rs)如 NMDA receptor、AMPA receptor,進而開啟 離子幫浦(cation channels)導致細胞外鈉、鈣離子大量流入突觸 後神經元;另一方面 glutamate 會催化次級傳導訊號 (second messenger))— inosiotol-1,4,5- triphosphate (IP3) ,進而使突觸後 神經元細胞內的平滑內質網(smooth endoplasmic reticulum-SER)
釋出大量的鈣離子。鈣離子超載(Ca-overload)的結果,會活化
神經細胞內的酵素系統如 protease、phospholipase、endonucleases
及其他酵素,最後導致神經細胞死亡 (圖 2.1)
(5, 47)。
2-6. 缺血性腦梗塞後自由基的產生和傷害:
當腦缺血發生時,由於腦血流的減少,產生腦部供氧不足,
但經過再灌流後,無論是自發性或是經血栓溶解劑的治療,重新 進入缺血腦組織的氧氣會和胞器內或粒腺體內許多細胞氧化酵 素發生作用,產生活性氧化自由基(reactive oxygen radicals,ROS
)。正常生理狀態下,粒腺體是細胞產生氧化自由基的來源,據 研究報告指出,約有 2%-5%腦細胞內粒腺體中的電子流會製造 出 superoxide anion (O
2·-
) 以及 hydrogen peroxide (H
2O
2)
(48)。這些正常生理狀態中所製造出來的氧化自由基會被體內的抗氧 化 系 統 給 清 除 如 superoxide dismutase ( SOD) glutathione peroxidase (GSHPx) ,以及 catalase。另一方面,其他較小的抗 氧化分子如 glutathione (GSH) 、ascorbic acid、以及 a-tocopherol 也有清除氧化自由基對細胞的毒性作用
(49)。缺血— 再灌流所產生 的神經細胞損傷,主要來自於內生性抗氧化系統與氧化自由基之 間的平衡關係遭到破壞,導致細胞內大量氧化自由基的產生,進 而引發一連串的攻擊作用。在缺血性的再灌流時期,氧化自由基 的來源,一為 cytosolic prooxidant enzyme、另一來源就是粒腺體
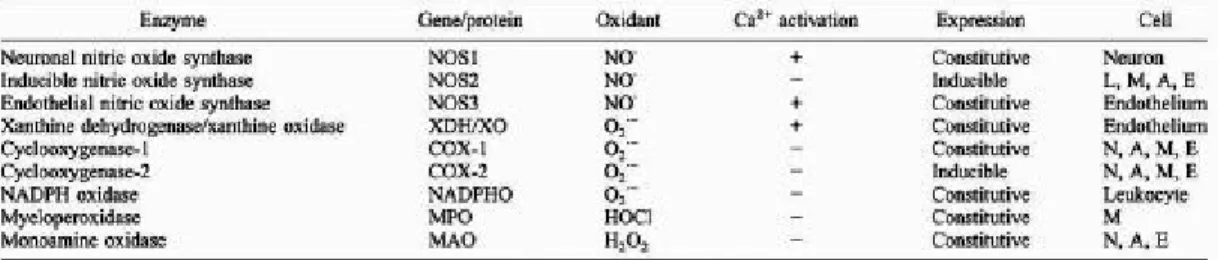
。當大腦發生缺血性時,cytosolic prooxidant enzyme 包含以下三 大類酵素可製造自由基
(49):(1) nitric oxide synthases (NOS); (2) cyclooxygenases(Cox) ,xanthine dehydrogenase(XDH) ,xanthine oxidase(XO) 、NADPH oxidase(NADPHO);(3) myeloperoxidase
(MPO)、 monoamine oxidase(MAO)(見表 2.1)。
2-6-1 氧化自由基的產生
*第一類細胞內氧化前驅酵素 NOS 及其產生的自由基:
NOS 包含三種異構物,分別為存在於大腦實質的 neuronal nitric oxide synthase (nNOS,NOS1) ,持續存在於大腦神經細胞
;第二種為經誘導產生的 NOS,稱為 inducible nitric oxide synthase
(iNOS, NOS2) ,由 microglia/macrophages 以及 astrocytes 誘導後 產生;第三種 NOS 就是持續存在於血管內皮細胞,稱為 endothelial nitric oxide synthase(eNOS, NOS3) 。nNOS 和 eNOS 的活化屬於 Ca
2+-dependent,而 iNOS 的活化是屬於 Ca
2+-independent。有研究 已證明 nNOS 以及 iNOS 製造出來的 NO 對缺血後的大腦產生 損傷作用;相反的 eNOS 所製造出來的 NO,卻因具有血管擴張 的效果,而具有神經保護作用
(49)。
*第二類細胞內氧化前驅酵素及其產生的自由基:
這類酵素包含 cyclooxygenase-1,cyclooxygenase-2 (COX-2
)、 xanthine dehydrogenase(XDH)、xanthine oxidase(XO)以 及 NADPH oxidase(NADPHO)等,主要產生的自由基為超氧 陰離子,除了 COX-2 路徑為腦缺血性發生後經誘導產生外,其 他都是持續表現。來自 leukocyte 所產生的超氧陰離子,主要是 經過 NADPHO 的作用。Nogawa et al.(1998)研究指出,腦缺 血性發生後,iNOS 產生的 NO 會加強 COX-2 的活性,而製造出 大量的超氧陰離子,而且 iNOS-positive neutrophils 十分靠近 COX-2–positive neuron
(49,50)。
*第三類細胞內氧化前驅酵素
這 類 酵 素 包 含 myeloperoxidase(MPO) 以 及 monoamine
oxidase(MAO) 。MPO 主要位於巨噬細胞(macrophage),會釋
放出大量的 hypochlorous acid(HOCL) ,而 MAO 主要位於神經
細胞、星狀細胞以及血管內皮細胞會釋放出 H
2O
2。
2-6-2 活性氧化自由基對缺血後大腦細胞攻擊產生的損傷
ROS 包括 superoxide anion、hydrogen peroxide (H
2O
2) 、hydroxyl radical(OH.) 、nitric oxide(NO)、peroxy-nitrite anion (OONO
-)等
(51)。ROS 會對細胞內的大分子產生直接攻擊,而導致脂質過氧 化作用(lipid peroxidation)、蛋白質氧化作用(protein oxidation)、
DNA 的氧化傷害(DNA oxidative damage) ,最後導致缺血後腦損
傷
(52-54)。另外,越來越多的研究顯示,ROS 也可透過氧化還原訊息
傳遞的路徑(redox signal transduction pathways) ,攻擊粒腺體、DNA 修復酵素(APE/Ref-1) ,以及核轉錄因子(nuclear transcription factors
),而導致細胞死亡
(55,56)。
表 2.1 腦缺血後的氧化酵素(prooxidant enzymes in ischemic brain)
2-7. 缺血性腦梗塞後的發炎反應:
發炎反應包括分子層次和細胞層次
(11)。研究顯示,中風後的
發炎反應進行的核心地帶,發生在於血液與微血管內皮細胞之間
的交互作用
(11,12)、大腦中的微膠細胞、星狀細胞以及血管內皮細胞
會釋放出一些發炎前驅細胞激素如 TNF-a、IL-1ß,而加重缺血後
大腦發炎反應的產生
(11,13)。在腦缺血發生後的數分鐘至數小時內,
來自周邊的白血球(leukocyte)會開始聚集、活化、進而黏附至腦 微循環中的血管壁上。由於活化的白血球大量聚集、黏附於大腦 微循環中,會進一步阻塞腦中微血管,使供血不足的情形更加的
惡化
(11,57)。另一方面,穿過血管壁的中性球(neutrophils)以及單
核球/巨噬細胞(monocytes/ macrophages)也開始進入腦梗塞區域
(11,58)
。再灌流後,來自周邊的白血球大量聚集至腦部,也會加重缺
血後的發炎反應,甚至影響血栓溶解劑的效果
(11,59)。
一些研究已指出,當大腦受到直接的傷害、缺血性傷害、神 經毒性作用、病毒感染(virus infection),或免疫反應的攻擊(
immunological challenge) ,都會產生一種應激反應,使神經膠細胞 活化(activation)
(3,14)。當神經膠細胞受到細胞激素的刺激後,大 腦內處於不活化的神經膠細胞會開始活化、增生、變形,進而演 變成具有吞噬能力的微膠細胞或巨噬細胞(macrophage)。當腦缺 血事件發生,而致使神經膠細胞活化,利用免疫染色的方法,最 早在腦缺血發生後 2 小時就可以觀察到活化狀態的微膠細胞(
activated microglia)
(12)。另外一方面,活化的神經膠細胞會大量的 釋放出細胞激素,引發更嚴重的發炎反應。因此發炎反應、細胞 素的製造與神經膠細胞的活化,三者之間形成密不可分的關係
(3)以下為需要解決的問題:
第一:可以活化神經膠細胞的細胞激素為何?
細胞激素包括 TNF-a、IL-1ß 以及 interferon-a 等都能活化神經
膠細胞
(15-20)。
第二:中樞神經系統內可以製造細胞激素的細胞為何?
Microglia、astrocytes、endothelial cells、以及 neurons 等都能製
造細胞激素
(20-25)。
第三:TNF-a、IL-1ß 在缺血性腦梗塞發生後的發炎反應,所扮演 的角色為何?
由於 TNF-a、IL-1ß、chemokines(IL-8)、黏附因子(adhesion molecules)以及 proteinases(MMP familys)等的共同作用下,來 自周邊組織的發炎細胞可以滲入大腦梗塞區。TNF-a、IL-1ß 的釋 放可以活化黏附因子 ICAM-1、化學驅化因子(chemokine 如 IL-8
),使白血球由周邊被活化並吸引至大腦微血管系統中,經由黏附 因子的作用,使周邊發炎細胞能貼附大腦微血管壁,由於蛋白酵 素的作用而破壞血腦屏障,然後在趨化因子(chemokines)的作用 下,活化的周邊白血球進而產生穿透作用而滲入梗塞區
(15-25)。
第四:周邊發炎細胞浸潤會對缺血後損傷的大腦產生何種作用?
首先,在缺血性腦損傷產生後,來 自 周邊組織的細胞如 mononuclear phagocytes、T-lymphocytes、natural killer cells、and polymorphonuclear leukocytes(PMNs)也會製造並釋放出細胞激 素,導致中樞神經系統更嚴重的發炎反應產生、神經膠細胞活化.
其次,中性球的浸潤(leukocyte infiltration)不僅會導致脂肪 性膜的過氧化(lipid-membrane peroxidation),也會因大量聚積,
且黏附於血管壁造成嚴重的阻塞作用。此外,被活化的白血球也
會不斷的釋放出活性氧化自由基以及細胞激素,這些對於已受缺
血而產生損傷的腦組織更是雪上加霜。利用免疫染色的方法在大
腦微血管內,可以看見梗塞區域內塞滿了許多白血球、梗塞核心
區外的腦組織,則是呈現水腫狀態。許多微血管內的白血球(大
多是中性球) ,緊黏著微血管壁、甚至有些已經穿透出微血管壁,
進入梗塞核心區域的大腦皮質區
(11)。
綜合以上可以整理如下:當腦缺血性發生後,缺血區的神經 細胞、微膠細胞、星狀細胞或血管內皮細胞會受到刺激,分泌細 胞激素如 TNF-a、IL-1ß 以及 interferon-a,促進神經膠細胞活化,
進一步釋出大量的細胞激素。 TNF-a、IL-1ß 會在進一步的吸引來 自周邊的白血球,使之活化,並經由黏附因子、化學趨化因子,
使這些白血球黏附並穿透已被蛋白酵素破壞的 BBB,最後進入梗 塞區,並不斷的釋放更多的細胞激素、氧化自由基,產生腦缺血 性後的二次腦損傷。
2-7-1 發炎反應所啟動的發炎前驅基因
腦缺血發生後的早期,許多基因表現會隨著大腦缺血事件的 發生而被誘發
(3,11)。許多發炎前驅基因如轉錄因子(transcription factors) 、熱休克蛋白(heat shock proteins) 、細胞激素(cytokines
)、化學驅化因子(chemokines)、黏附因子(adhesion molecules
)會被正向調控(upregulated)。在體外實驗發現,許多被正向 調控的基因如 TNF-a、 IL-1ß、 IL-6、 NOS、 cyclooxygenase-2 (COX-2)、intercellular adhesion molecule -1 (ICAM-1) ,是透過 核轉錄因子-?? (NF-?? )的調控
(11,60)。有報告顯示在人類大腦 梗塞後,神經膠細胞內會有 NF-?? 的誘導產生
(7,11,60)。
2-7-2 發炎反應所啟動的細胞激素
細胞激素屬於 polypeptides 類結構,通常會伴隨著發炎反應
、免疫反應的啟動、細胞分化或細胞死亡而產生。在周邊組織,
受細胞激素作用而活化的細胞包括巨噬細胞、單核球、淋巴球、
內皮細胞、纖維母細胞、血小板等。在中樞神經系統內,受細胞 激素活化的主要細胞是微膠細胞
(11)。當腦缺血性後,啟動的發炎 前驅細胞激素中最重要的兩個細胞激素為 IL-1 和 TNF-a
(7-10),他 們的產生會加重缺血後的腦損傷;但 也有保護性的細胞激如 IL-1–receptor antagonist (IL-1ra)、interleukin-10 (IL-10)等。
2-7-3 細胞激素— TNF-a 在缺血性中風作用的相關研究
有研究研究發現,不管是暫時性或永久性的中大腦動脈阻塞 模型中,缺血性中風發生後,都可以發現在缺血區的大腦皮質有 TNF-amRNA 的 誘 導 產 生
(11,61-63)。 有 研 究 研 究 發 現 , 給 予 TNF-receptor I (sTNF-RI)可以抑制 TNF-a 的活性,進而減少 局部缺血性腦損傷
(11,64,65)若給予抗 TNF-a 的單株抗體,同樣的也 可以降低梗塞面積
(66,67),但注射 TNF-a,則會加劇中風的程度
(11,19,65)
。但有研究卻顯示 TNF-a 對缺血性中風有保護作用,由於 在基因上剔除 TNF-a 受體的大鼠,其誘發缺血性中風後,腦損傷 的程度反而會加重
(10,21,68)。
有研究顯示,在大鼠缺血性中風發生後的 1-3 小時內,TNF-a
mRNA 以及 protein 的表現升高
(15-17)。在梗塞皮質區內,TNF-a
mRNA 的濃度最早在梗塞後 1 小時就會升高、濃度達最高值的
時間為梗塞後 12 小時,持續至梗塞後 5 天。由於 TNF-a mRNA
表現的時間早於白血球穿透入梗塞區域的時間,顯示 TNF-a 的
表現與白血球穿入梗塞核心區的反應有關。用免疫標定細胞來探
討梗塞發生時 TNF-a 來自何種細胞時,發現以 Double-label
immunofluorescence 方法標定出早期的 TNF-a 位於神經細胞上
而非星狀細胞,但缺血後 5 天,來自神經細胞的 TNF-a 減少,
這時所標定出 TNF-a 的位置大多為發炎細胞。而 TNF-a 究竟透 過什麼樣的機轉使得缺血性中風後腦損傷加重?由以下學者的 研究報告可以看出一些端倪:在直接使用 micro-injection 注射 TNF-a 進入鼠腦皮質的實驗中發現,TNF-a 可以使白血球更易黏 附至大腦微血管內皮。有人發現局部缺血性中風後,在活化的微 膠細胞以及巨噬細胞中可找到快速升高的 TNF-a mRNA 以及 protein,再次證明 TNF-a 屬於缺血性中風後內生性發炎反應的 一環
(62)。有研究認為 TNF-a 可以誘導白血球去黏附大腦微循環 的血管內皮,進而啟動缺血性中風後最早期的腦微血管發炎反應
(61)
。
2-7-4 細胞激素— IL-1ß 在缺血性中風的作用的相關研究
研究顯示,在中樞神經系統內許多細胞皆能製造 IL-1ß 如微 膠細胞、星狀細胞、神經細胞以及血管內皮細胞等
(68,69,70)。如同 TNF-a,許多研究發現 IL-1ß 具有誘導發炎反應產生的性質,而 在中樞神經系統內也可以找到其受體
(15,18,67)。在大鼠暫時缺血 性腦中風模型的研究中發現,中風後 IL-1ß mRNA 的 expression 上升
(3,13,60)。大鼠若注射 IL-1ß 也會加重其缺血後腦損傷的程度
(15,71,72)
。Liu et al. (1993) 發現,在中大腦動脈阻塞中風後 3-6 小
時,IL-1ß mRNA 會迅速的增加,於第 12 小時後達極大值,但
第 5 天後又回復到中風前的水平
(63)。近年來由於研究技術的進
步,經由免疫組織化學標定方法,利用抗體在缺血性中風後大鼠
的大腦血管、微膠細包以及巨噬細胞中標定出 IL-1ß,更證實
IL-1ß 在缺血後腦損傷所扮演的角色
(18,73,74)。IL-1 在缺血性中風
後會被大量的誘導產生,在缺血後 6 小時達到頂峰,並會持續至
數天,而產生 IL-1 的細胞以腦血管內皮細胞和微膠細胞為主
(74,75)
。IL-1 的產生會使缺血性損傷更加惡化,同時也會產生選擇 性的細胞死亡以及大腦水腫
(76)。研究顯示,若能阻斷 IL-1,則 能減少大腦缺血後損傷
(75,77),由於抑制 IL-1 可以使細胞黏附因 子 ICAM 的產生下降、並減少其他發炎前驅因子的作用
(75)。 Mulcahy et al.(2003)的研究也顯示,給予缺血性腦中風大鼠注 射 IL-1 受體阻斷劑(IL-1 receptor antagonist),可以對腦損傷產 生保護作用
(77,78)。
2-8. 非鈣離子依賴性 NMDA 受體阻斷劑-MK801 之研究:
MK801 屬 於 一 種 非 鈣 離 子 依 賴 性 的 NMDA receptor antagonist,許多研究已證實它具有神經保護作用,能減少實驗動 物中風後的梗塞面積。MK801 透過與 glutamate 競爭 NMDA 受體
,使離子幫浦不因突觸前 glutamte 濃度大量升高而被開啟,如此
,便不會使大量的鈉、鈣離子流入突觸後的神經細胞內,因而抑
制鈣離子超載及其後續事件的產生、防止神經細胞因鈉離子滲入
而產生的細胞毒性水腫(cytotoxic edema) 。有研究顯示, MK801
在暫時性顳側中大腦動脈梗塞再灌流的模型中,可以降低大腦水
腫以及梗塞面積
(80)。Collaco-Moraes et al.(1994)的研究更進一
步顯示,給予 MK-801 (3 mg/kg)術前治療,可以抑制中大腦
動脈阻塞(MCAO)大鼠大腦中 c-fos mRNA 的產生,進而產生
神經保護作用
(81)。Bertorelli et al.(1998)的研究發現,給予 MK801
可以降低永久性 MCAO 模型大鼠腦組織中 TNF-a 的濃度,並減
少梗塞面積
(82)。Gorgulu et al.(2000)的研究也顯示,在缺血後
15 分鐘給予 MK801,可以降低大腦水腫的程度,並降低梗塞面
積
(83)。因此,本實驗採用 MK801 作為與實驗組對照的陽性控制
組。
第三章 材料與方法
本研究分為兩部分,實驗一的目的在於探討紅花對缺血- 再灌流 損傷大鼠腦梗塞之效用。首先探討其藥物作用劑量,其次探討在不同 給藥時間下,最有效劑量組在術前給藥、梗塞後 30 分鐘後給藥、再 灌流後 30 分鐘給藥之效用差別,以探討其治療時機。另外,我們採 用文獻記載 NMDA 拮抗劑-MK801 為陽性控制組,一來驗證本實驗 模型是否穩定、二來可以使紅花與之比較作用效果;實驗二的研究目 的則是對紅花在缺血- 再灌流損傷大鼠腦梗塞作用機轉之探討。
3-1. 動物:
本研究所採用之實驗動物品系為 Sprague-Dawley (SD) 雄性 大鼠,體重介於 300-400 g 之間,實驗分為兩部份:實驗一分為 9 組,每組 6 隻,共計 54 隻;實驗二分為 3 組,每組 6 隻,共計 18 隻。所有的動物來源皆購自國家實驗動物中心,飼養於中國醫藥 大學動物中心,飼養環境採室內中央空調、明暗控制各 12 小時,
水和飼料每日充足供應。實驗室室溫控制在 25±1℃,所有的實驗 過程皆合乎動物倫理原則。
3-2. 動物模型之建立:
本實驗之麻醉劑使用氯化水醛(chloral hydrate, 400 mg/Kg),
採腹腔注射方式給藥麻醉。在實驗過程當中持續監測大鼠之生理指 標- 平均動脈壓、心跳(0093-101L, BP-2, Columbus, Ohio, USA)、
直腸溫度(TM-906A, Dual Channel Thermometer, Taiwan)、中大腦動
脈 腦 血 流 (Laser Doppler Blood-Flow Monitor, DRT4, Moor
instrument Ltd, England)。
實驗採用中大腦動脈缺血性梗塞模型:管腔外阻斷方式
(25)再加 上兩側總頸動脈阻斷,簡稱 RMCAO+BCCAO (right middle cerebral artery occlusion and bilateral common carotid artery occlusion) 。過程 敘述如下:
首先將大鼠秤重、測量直腸溫度,若溫度超過 38.5 度者,予以 排除本實驗,然後依大鼠體重給予腹腔注射麻醉(chloral hydrate,
,400 mg/Kg)。將大鼠頭顱部、腹側頸部、鼠蹊部之毛髮剃除,並 使呈仰臥姿勢,以利進行頸部手術。以手術刀沿大鼠頸正中線切開
,長度約 1 公分,暴露出氣管,在氣管兩旁游離出總頸動脈,並將 總頸動脈旁的迷走神經(vagus nerve)分離,用兩只尼龍繩套(nylon thread,直徑約 0.5 mm)分別繞過兩側總頸動脈,再放上套管(直 經約 1.5 mm)。
其次,進行股動脈插管監測心跳、平均動脈壓,其步驟簡述如 下:以手術刀從 SD 大鼠右側鼠蹊部切開成一個約長 2.5 cm 的傷口
,分離出右股動脈,然後插入 PE-50 管(cannulated with PE-50 polyethylene catheters),並用少量 heparin(25 unit/ml)溶液沖洗 PE-50 管,以防止凝固。PE-50 管的另一端,則連接於心跳血壓測 量儀(0093-101L,BP-2,Columbus,Ohio,USA)。整個實驗過程 中,連續監測平均動脈壓及心跳的變化,並記錄之。
插入 PE-50 管後,將大鼠呈俯臥位,並將頭部固定於小動物立 體固定儀(stereotaxic apparatus)上,從頭部左右眼角(canthux)
的正中線及左右耳翼間的正中線切開,使暴露出頭骨。將右側顳肌
( temporal muscle ) 沿 顳 骨 緣 切 開 , 用 骨 剪 進 行 顳 骨 切 開 術 (carniectomy),剪成一個直徑約 5-10 mm 的骨窗。手術過程當中,
若發現腦膜破裂產生大量出血,則動物被排除實驗。以雷射血流監
視器(Laser Doppler Blood-Flow Monitor,DRT4,Moor instrument Ltd,
,England)的探針來尋找並確定中大腦動脈,當監測刻度大於 800 LD units 時,則確定為中大腦動脈。用 8-0-0 尼龍單線微型手術針
(8-0-0 mono-filament nylon tie,ETHICON,Johnson & Johnson Ltd.
,Belgium)於嗅束上緣(Olfactory tract)與下大腦靜脈(Inferior cerebral vein)之間穿過中大腦動脈。麻醉 30 分鐘後,將兩側總頸 動脈上的套管套緊,並將 8-0-0 尼龍線以單套活結綁緊至活結下游 中大腦動脈供血區腦膜變白,而雷射血流監視器的刻度出現 50 LD units 以下時,則可確定血流阻斷成功。
3-3 藥物製備、給藥劑量及方式 3-3-1 藥物來源及製備:
紅花之來源及製備:
紅花的製劑委託科達製藥股份有限公司製作。首先秤取 80 克 紅花原生藥(原產地中國大陸四川省),將藥材置入不鏽鋼鍋,加 入 7 倍水,加熱沸騰煎煮 50 分鐘,以 100 目篩網過濾。將藥渣加 入 5 倍水,加熱沸騰煎煮 50 分鐘後以 100 目篩網過濾,收集二次 濾液進行濃縮,最後產物為 27.48 克(34.35 %)。取濕浸膏 25 g,
加入 131.7 ml phosphate buffer saline(PBS,PH7.4)成為濃度 0.2 g/ml 之紅花溶液。
MK801 購自 SIGMA 藥廠 (SIGMA-ALDRICH CHEMIE Gmbh
P.O. 1120,89552 Steinheim, Germany 49-7329-970) ,用 phosphate
buffer saline(PBS, PH 7.4)配置為濃度 1 mg/Kg,分裝保存於 4 ℃
的冰箱中。
3-3-2 給藥劑量:
紅花給藥劑量之決定:
紅花劑量的決定是根據預試驗(pilot study)的結果得知紅花 0.2 g/Kg 腹腔注射能夠減小缺血— 再灌流損傷大鼠腦梗塞面積,因 此本實驗採 0.2 g/Kg、0.4 g/Kg、0.6 g/Kg,分別於腦血流阻斷前 10 分鐘施行腹腔注射。另外,採用紅花 0.4 g/Kg 分別於血流阻斷 後 30 分鐘,及再灌流後 30 分鐘施行腹腔注射。
3-4. 動物分組及流程 3-4-1 實驗一
3-4-1-1 動物分組
將 54 隻 SD 大鼠以隨機分為 9 組,每組 6 隻(圖 3.1):
(1) 控制組(C):阻斷兩側總頸動脈和右中大腦動脈的血流 90 分鐘,然 後再灌流 24 小時,不施予任何藥物治療。
(2) 空白對照組(PBS):方法同 C,但於腦血流阻斷前 10 分鐘腹腔注射 0.2 ml/Kg PBS。
(3) 陽性對照組(MK):方法同 C,但於腦血流阻斷前 10 分鐘腹腔注射 MK801 1mg/Kg。
(4) 假手術組(S):只用 8-0-0 尼龍線穿過中大腦動脈,但 不阻斷腦血流 (5) P-0.2 組:方法同 C,但於腦血流阻斷前 10 分鐘腹腔注射紅花 0.2
g/Kg。
(6) P-0.4 組:方法同 C,但於腦血流阻斷前 10 分鐘腹腔注射紅花 0.4 g/Kg。
(7) P-0.6 組:方法同 C,但於腦血流阻斷前 10 分鐘腹腔注射紅花 0.6
g/Kg。
(8) O-0.4 組:方法同 C,於腦血流阻斷後 30 分鐘腹腔注射紅花 0.4 g/Kg (9) R-0.4 組:方法同 C,但於再灌流後 30 分鐘腹腔注射紅花 0.4 g/Kg
3-4-1-2 實驗流程
實驗一之實驗流程如圖 3.1 所示如下:
秤重、量肛溫
0分
IP給藥 經
IP給麻醉劑、開始手術 開顱、定位出MCA位置
腦血流阻斷
前
5分 5分 20分
30分鐘
.2
0小 時
Reperfusion
( 腦血流阻斷
後
90)分鐘 (再灌流後
24)小時神經學評估、犧牲 腦血流阻斷前10分鐘給藥 (P-
0.2、P-0.4、P-0.6、MK)
腦血流阻斷後30分鐘給藥 (O-0.4)
1小 時
再灌流後30分鐘給藥(R- 0.4)
圖 3.1 實 驗 一 流 程 圖 。實驗前先測量大鼠的體重和肛溫,然後用 chloral hydrate 於大鼠腹腔注射,將大鼠麻醉。將大鼠固定於立體定 位儀上,剔除頭上毛髮後,用骨剪在大鼠頭顱打一個洞,找出中大腦 動脈(MCA)。阻斷兩側總頸動脈和右側大腦動脈腦血流阻斷前 10 分鐘,腹腔注射( i.p.不同濃度的紅花 0.2 g/kg (P-0.2)、0.4 g/kg (P-0.4)
、0.6 g/kg(P-0.6)和 MK 801(1 mg/kg)。於腦血流阻斷後的 30 分
鐘腹腔注射紅花 0.4 g/kg(O-0.4)和再灌流的 30 分鐘腹腔注射紅花
0.4 g/Kg(R-0.4)。再灌流後施行神經評估,然後將大鼠犧牲取腦。
3-4-2 實驗二
將 18 隻 SD 大鼠隨機分為 3 組,每組 6 隻(圖 3.2):
(1) 控制組(C):阻斷兩側總頸動脈和右中大腦動脈的血流 90 分鐘,
然後再灌流 24 小時,不施予任何藥物治療。
(2) 對照組(MK):方法同 C,但於腦血流阻斷前 10 分鐘腹腔注射 MK801 1mg/Kg。
(3) 治療組:方法同 C,但於腦血流阻斷前 10 分鐘腹腔注射紅花 0.4 g/Kg。
每一組都分別於腦血流阻斷前 15 分鐘,阻斷後 90 分鐘,以及再 灌流後 2 小時分別從 PE-50 管抽股動脈血 0.3cc。其中 0.1cc 血置入 EDTA 管中,另 0.2cc 則置入 heparin coated 的試管中。
秤重、量肛溫
IP0分經給麻醉劑、開始手術 MCA開顱、定位出位置 腦血流阻斷
前
5分 5分
30分鐘
.2
0小時 Reperfusion (再灌流後
2小時
) 犧牲、取腦固定
第1個抽血點
0.4cc(腦血流阻斷前 10分鐘)
20分
第2個抽血點
0.4cc(腦血流阻斷後 30分鐘)
第3個抽血點5cc(再 灌流後2小時)
IP給藥 (再灌流後
24)小時
(腦血流阻斷後
90)分鐘