國立臺灣大學醫學院藥學研究所 碩士論文
Graduate Institute of Pharmaceutical Sciences College of Medicine
National Taiwan University Master Thesis
抑制上皮-間葉轉化調控因子 Slug 促進 doxorubicin 在 MCF-7/ADR 抗藥性細胞株中誘導的細胞凋亡 Inhibition of epithelial-mesenchymal transition regulator
Slug enhances doxorubicin-induced apoptosis in drug resistant MCF-7/ADR cells
周軒宇 Hsuan-Yu Chou
指導教授:陳燕惠 博士 Advisor: Yen-Hui Chen, Ph.D.
中華民國 100 年 9 月
September, 2011
ii
誌謝
首先,由衷感謝我的指導教授燕惠老師,提供了一個自由學風的研究環境,
鼓勵我們有各種實驗上的想法,並帶領我以客觀的角度好好審視自己的每一步,
支持並協助我克服在實驗上與生活中所遇到的困難。感謝口試委員許麗卿老師、
楊家榮老師對我的論文提供多寶貴的建議,使內容更加完善。同時,特別感謝許 麗卿老師在免疫螢光染色實驗上的全程幫忙。感謝顧紀華老師及其實驗室成員在 實驗上提供的資源與指導。感謝施金元醫師慷慨提供pCI-neo Slug vector 協助,得 以探索更多的實驗方向。
短短的研究生涯中,體認到了自己能力的極限,謝謝每一個幫助我的人,協 助我突破了重重關卡。感謝默默在背後支持我的家人,讓我可以不用擔心課業以 外的事務,全心專注於研究主題。謝謝實驗室的夥伴燁思、芸甄、松材、璐珊、
韋婷、慶豐、尚勳,雖然與你們相處的時間只有短短數月,但你們仍熱心地提供 我許多協助與建議。其中,特別要謝謝惠婷,我的好夥伴,培養了兩年的革命情 感,一起分擔在實驗室的事務與壓力,並共同分享生活的點滴。感謝一起重訓的 好麻吉,可名和昱宏,我會記得揮灑青春汗水的日子。每當我實驗卡關的時候,
特別感謝瑞苓學姊與昱宏在實驗方向與做法上都幫了我很大的忙,同時也謝謝佳 純學姊、貞翔、靖均、映希、可名、佳芸提供我實驗上的協助。感謝所有與我共 患難、享樂的朋友們,有了你們,多年後,我還會記住“那些年,我們一起追的 DATA。”
兩年的研究所生活,年齡的成長,心靈的成熟與處世的經驗,種種的回憶在 人生畫布上亦添加了濃墨重彩的一筆。如今揮別了我的碩士生涯,前方等待的,
是令人期待充滿希望與挑戰的未來。將此論文獻給每一個我衷心感謝的人!
周軒宇 2011 年 9 月
iii
中文摘要
目的:腫瘤細胞對於結構不同的化療藥物具有抗藥性,稱為多重抗藥性(multidrug resistance)。近來,上皮-間葉轉化(epithelial-mesenchymal transition)在研究多重抗藥 性的領域中漸被重視。因此,本研究主要的目的是探討上皮-間葉轉化調控因子 Slug 對於doxorubicin 引起細胞的抗藥性所扮演的角色。
方法:透過顯微鏡與免疫螢光染色分別觀察MCF-7/WT 與 MCF-7/ADR 型態差異與 上皮-間葉轉化的標記蛋白。藉由即時定量-聚合連鎖酶反應法和西方墨點法分析對 doxorubicin 敏感的 MCF-7/WT 與具 doxorubicin 抗藥性的 MCF-7/ADR 中上皮-間葉 轉化標記蛋白包括 E-cadherin, N-cadherin 與 vimentin 與其主要調控因子如 Snail, Slug and ZEB1 的表現量。抑制 Slug 表現則用以探討上皮-間葉轉化調控因子對於 doxorubicin 抗性的調控角色,並透過流式細胞儀、caspase-3/7 測定與 caspase-8 測 定探討Slug siRNA 引起的細胞凋亡。同樣地,藉由即時定量-聚合連鎖酶反應法分 析抑制Slug 後引起細胞凋亡相關分子如 caspase-6, DFF40, bcl-2 family 及 p53 的基 因表現。
結果:間葉細胞標記蛋白N-cadherin 與 vimentin 的表現在 MCF-7/ADR 中相對高於 MCF-7/WT,但是上皮細胞標記蛋白 E-cadherin 在 MCF-7/ADR 細胞中則較 MCF-7/WT 細胞中的表現量低。相較於 MCF-7/WT,Slug 在 MCF-7/ADR 中的表 現則顯著增加(P value=7.21×10-6)。抑制 MCF-7/ADR 中 Slug 的表現能夠促進 doxorubicin 引起的細胞凋亡,包括 cleaved PARP 與 sub-G1 細胞族群的增加。且抑 制Slug 能增加 Bad 與 p53 的表現,降低 Bcl-2 的表現,以及活化 caspase-3/7。
結論:在MCF-7/ADR 中表現上皮-間葉轉化的現象可能與多重抗藥性的有關,上皮 -間葉轉化調控因子 Slug 具對抗 doxorubicin 引起的細胞凋亡的能力,於乳癌治療 中或許能夠當作是doxorubicin 引起的抗藥性的治療標的。
iv
關鍵字:細胞凋亡、doxorubicin、上皮-間葉轉化、MCF-7/ADR、多重抗藥性、Slug、
p53
v
Abstract
Purpose: The resistance of tumor cells to a variety of structurally different chemotherapeutics is termed multidrug resistance (MDR). Recently, epithelial-mesenchymal transition (EMT) has been shown to be associated with multidrug resistance. The aim of the present study is to examine the role of EMT regulator Slug in cells resistant to doxorubicin treatment.
Methods: Differences in morphology and EMT markers between MCF-7/WT and MCF-7/ADR were observed by microscopy and immunofluorescence staining, respectively. The expression levels of EMT markers (i.e. E-cadherin, N-cadherin and vimentin) and EMT key regulators (i.e. Snail, Slug and ZEB1) in MCF-7/WT and MCF-7/ADR were determined using quantitative real-time polymerase chain reaction and Western blot analysis. Slug silencing was performed to investigate the effects of Slug on doxorubicin-induced resistance. Apoptosis upon Slug siRNA treatment was evaluated by flow cytometry, caspase-3/7 assay and caspase-8 assay. The gene expressions of apoptosis-related molecules (i.e. caspase-6, DFF40, bcl-2 family and p53) caused by Slug silencing were analyzed by quantitative real-time polymerase chain reaction.
Results: The expressions of mesenchymal markers N-cadherin and vimentin were higher in MCF-7/ADR than that in MCF-7/WT, but the expression of epithelial marker E-cadherin decreased in MCF-7/ADR, compared to MCF-7/WT. Slug expression significantly increased in MCF-7/ADR (P value=7.21×10-6). Silencing of Slug in MCF-7/ADR enhanced doxorubicin-induced apoptosis such as high levels of cleaved PARP protein, sub-G1 population, Bad and p53 expressions, and caspase-3/7 activity and lower level of Bcl-2.
vi
Conclusion: EMT was observed in MCF-7/ADR cells indicating the association of EMT and multidrug resistance. The EMT regulator Slug may be against doxorubicin-induced apoptosis and turns out as a potential therapeutic target for treating doxorubicin-induced multidrug resistance in cancers.
Key words: apoptosis, doxorubicin, epithelial-mesenchymal transition, MCF-7/ADR, multidrug resistance, Slug, p53
vii
目錄
口試委員會審定書 ... i
誌謝 ... ii
中文摘要 ... iii
英文摘要 ... v
目錄 ... vii
圖目錄 ... x
表目錄 ... xii
縮寫對照表 ... xiii
第一章 緒論 ... 1
1.1 多重抗藥性 ... 1
1.2 上皮-間葉轉化 ... 4
1.21 上皮-間葉轉化關鍵調控因子 ... 5
1.22 上皮-間葉轉化在癌症中的角色 ... 7
1.23 上皮-間葉轉化與多重抗藥性的關係 ... 9
1.3 研究動機及目的 ... 10
第二章 材料及研究方法 ... 14
2.1 實驗儀器 ... 14
2.2 細胞株的培養 ... 15
viii
2.3 免疫螢光染色 (Immunofluorescence staining) ... 16
2.4 反轉錄-聚合酶連鎖反應法 (Reverse transcription-PCR) ... 17
2.5 即時定量-聚合酶連鎖反應法 (Real-time PCR) ... 20
2.6 西方墨點法 (Western blot) ... 22
2.7 siRNA 轉染試驗 (siRNA transfection) ... 26
2.8 Propidium iodide 染色測定 ... 27
2.9 Caspase-Glo 3/7 測定 ... 27
2.10 Caspase-8 測定 ... 28
2.11 統計檢定 ... 29
第三章 研究結果 ... 33
3.1 MCF-7/WT 與 MCF-7/ADR 呈現不同的細胞型態與上皮-間葉 轉化標記蛋白 ... 33
3.2 MCF-7/ADR 呈現上皮-間葉轉化特性 ... 33
3.3 在 MCF-7/ADR 細胞中上皮-間葉轉化調控因子過度表現 .. 34
3.4 Slug siRNA 抑制 Slug mRNA 與蛋白質表現 ... 34
3.5 抑制 Slug 促進 doxorubicin 引發 MCF-7/ADR 的細胞凋亡 34 3.6 抑制 Slug 增加 Bad 與 p53 的基因表現量並降低 Bcl-2 基因表 現量 ... 36
第四章 討論 ... 53
ix
第五章 結論 ... 58 第六章 參考文獻 ... 59
x
圖目錄
圖1-1. 細胞中引起抗藥性的因素 ... 11
圖1-2. 上皮-間葉轉化 ... 12
圖1-3. 上皮-間葉轉化訊息傳遞路徑綜述圖 ... 13
圖3-1. MCF-7/WT 與 MCF-7/ADR 型態及上皮-間葉轉化標記蛋白在細 胞中的表現 ... 40
圖3-2. MCF-7/WT 與 MCF-7/ADR 中 E-cadherin、N-cadherin 與 vimentin 基因與蛋白質表現 ... 41
圖3-3. MCF-7/ADR 較 MCF-7/WT 過度表現上皮-間葉轉化調控因子。 ... 42
圖3-4. Slug siRNA 在 MCF-7/ADR 細胞中有效抑制 Slug 基因與蛋白表 現 ... 43
圖3-5. 抑制 Slug 促進 cleaved PARP 蛋白產生 ... 44
圖3-6. 抑制 Slug 造成 sub-G1 細胞族群增加 ... 45
圖3-7. 抑制 Slug 促進 doxorubicin 引起的 caspase-3/7 活性 ... 46
圖3-8. 在 doxorubicin 作用下抑制 Slug 不影響 caspase-8 活性 ... 47
圖3-9. Caspase-6 與 DFF40 在抑制 Slug 及 doxorubicin 作用下的基因表 現 ... 48
圖3-10. 抑制 Slug 降低抗細胞凋亡家族分子 Bcl-2 基因表現 ... 49
xi
圖3-11. 促細胞凋亡家族分子 Bax 與 Bak 在抑制 Slug 及 doxorubicin 作
用下的基因表現 ... 50
圖 3-12. 促細胞凋亡 BH3-only 蛋白(pro-apoptotic BH3-only proteins) Bad、Bik、Bid、Bim 及 Puma 在抑制 Slug 及 doxorubicin 作用 下的基因表現 ... 51 圖3-13. 抑制 Slug 增加 doxorubicin 誘導的 p53 基因表現 ... 52
xii
表目錄
表2-1. RT-PCR 與 real-time PCR 所使用的核酸引子(primer) ... 30 表2-2. Slug siRNA 序列 ... 32
xiii
縮寫對照表
英文 縮寫
ATP-binding cassette ABC
Apoptotic protease activating factor 1 Apaf-1
B-cell lymphoma 2 Bcl-2
Breast cancer resistance protein BCRP
Basic helix-loop-helix bHLH
Cysteinyl aspartate proteases Caspase
Cadherin-1 CDH1
Cancer stem cell CSC
Cytochrome P450 3A4 CYP3A4
DNA fragmentation factor DFF40
DNA-dependent protein kinase catalytic subunit DNA-PKcs
Doxorubicin Dox
Extracellular matrix ECM
Epidermal growth factor EGF
Epidermal growth factor receptor tyrosine kinase inhibitor EGFR TKI Epithelial-mesenchymal transition EMT Glycogen synthase kinase 3β GSK3β
Hypoxia-inducible factor HIF
Inhibitor of apoptosis IAP
Inhibitor of κB IκB
MCF-7/adriamycin resistant MCF-7/ADR
MCF-7/wild type MCF-7/WT
xiv
英文 縮寫
Multidrug resistance MDR
Multidrug resistance 1 MDR1
Mesenchymal-epithelial transition MET
Matrix metalloproteinase 2 MMP-2
Multidrug-resistance-associated protein 1 MRP1 Nuclear factor kappa-light-chain-enhancer of activated B cells NF-κB
Non-homologous end joining NHEJ
Poly(ADP-ribose) polymerase PARP
P-glycoprotein P-gp P53 upregulated modulator of apoptosis Puma
Retinoblastoma-like protein 2 Rbl2
RNA interference RNAi
Scatter factor/hepatocyte growth factor SF/HGF
Smad-interacting protein 1 SIP1
Small interfering RNA siRNA
Steroid and xenobiotic receptor SXR Transforming growth factor-β TGF-β TNF-related apoptosis-inducing ligand receptor TRAIL-R Zinc finger E-box-binding homeobox ZEB
1
第一章 緒論 1.1 多重抗藥性
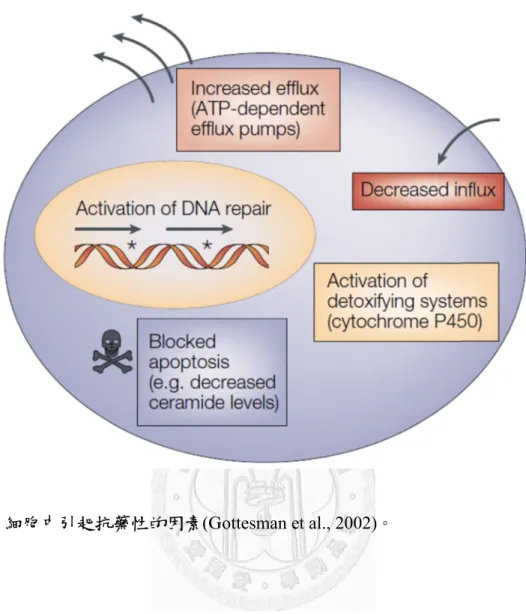
癌症目前是全球主要死因之一,根據世界衛生組織的報告顯示,2008 年全世界 有760 萬人死於癌症,占死亡總人口 13%,推測到 2030 年將有超過 1300 萬人因 癌症死亡。近年來,雖然藥物發展與醫療技術日新月異,在癌症治療上,多重抗 藥性仍然是目前遭遇的一大難題。臨床腫瘤學家觀察到在癌症治療過程中,癌症 細胞能對治療中的化療藥物產生抗藥性,甚至是對不同類型化療藥物產生交叉抗 性(cross-resistance),因而降低治療的效果,此機轉稱為多重抗藥性。多重抗藥性 機轉大多從兩個面向探討,一個是細胞在藥物運輸方面的調節,包括藥物的進入 與排出;另一面則是在基因層次的調控,藉由細胞本身解毒系統(detoxifying system) 的活化降低藥物毒性,像是DNA 修復系統的活化,細胞色素 P450 (cytochrome P450) 系統代謝藥物成非活化態,以及免於細胞凋亡(apoptosis)的機轉(圖 1-1)。
細 胞 可 透 過 控 制 藥 物 的 運 送 來 造 成 抗 藥 性 , 主 要 藉 由 ABC 運 輸 蛋 白 (ATP-binding cassette transporters)將藥物排出細胞進而降低藥效。目前已知的人類 ABC 運輸蛋白共有 48 種,其中廣為人知且與抗藥性有關的 ABC 運輸蛋白包括 ABCA2、P-glycoprotein (P-gp)、Multidrug-resistance-associated protein 1 (MRP1)、
MRP2-6 、 MRP8 與 breast cancer resistance protein (BCRP) (Stavrovskaya and Stromskaya, 2008)。多種藥物的抗藥性因上述的 ABC 運輸蛋白降低藥物於細胞內 含量所引起,包括長春花生物鹼(vinca alkaloids)藥物如 vinblastine、vincristine,蒽 環黴素(anthracyclines)藥物如 doxorubicin、daunorubicin,微小管(microtubule)穩定 藥物paclitaxel 都是 P-gp 的受質,可經由 P-gp 運輸至細胞外(Ambudkar et al., 1999)。
由MRP-1 引起抗藥性的藥物如喜樹鹼(camptothecins)藥物 Irinotecan、SN-38 (Chu et al., 1999)。Epipodophyllotoxin 藥物除了是 P-gp、MRP-1 受質外,當缺乏 P-gp 與
2
MRP-1 調控時,BCRP 也能夠排出 epipodophyllotoxin 藥物,造成癌細胞對 etoposide 或teniposide 的抗藥性(Allen et al., 2003)。從另一方面來說,抗藥性的產生也可因 為減少進入細胞的藥物量所造成,此類藥物多為需要經內噬作用(endocytosis)進入 細胞的親水性藥物,包括 methotrexate、 5-fluorouracil、8-azaguanine 及 cisplatin (Shen et al., 1998; Shen et al., 2000)。
透過細胞本身 DNA 修復系統與藥物代謝系統的活化,亦可以令細胞產生抗藥
性。多樣化的DNA 修復機制可以修復不同藥物機轉造成的 DNA 損害,減少藥物 對細胞造成的毒性。例如對拓樸異構酶抑制劑(topoisomerase inhibitor) etoposide 有 抗藥性的小細胞肺癌細胞,相較於不具抗藥性的細胞株表現出更多同源重組修復 系統(homologous recombination repair) RAD51 蛋白,也表現出對輻射處理更高的抗 性(Hansen et al., 2003)。然而 Fedier et al.認為細胞失去錯配修復(mismatch repair)能 力 , 能 引 起 拓 樸 異 構 酶 II (topoisomerase II) 藥 物 doxorubicin 、 epirubicin 與 mitoxantrone 的抗藥性(Fedier et al., 2001)。在血癌細胞中,參與非同源重組 (non-homologous end joining)修復系統的蛋白如 DNA 依賴性蛋白激酶催化次單元 (DNA-dependent protein kinase catalytic subunit, DNA-PKcs),能夠透過與磷酸化 RNA helicase A 來正向調控 MDR1 基因表現,進而影響 P-gp 蛋白表現量;Zhong et al.給予作用於 DNA-PKcs 的抑制劑,造成 P-gp 表現量降低,進一步確認 DNA-PKcs 調控P-gp 的關係(Zhong and Safa, 2007)。另一方面,Schuetz et al.使用多種藥物處 理,觀察到P-gp 也可與細胞色素 P450 協同調節抗藥性(Schuetz et al., 1996)。近來 研究更指出類固醇暨異質物受體(steroid and xenobiotic receptor)受到 paclitaxel 藥物 刺激後,能夠增加細胞色素P450 3A4 (cytochrome P450 3A4)與 P-gp 的表現,可能 對抗藥性的產生扮演更全面的角色(Synold et al., 2001)。
正常生理情況下,為了維持體內恆定或生理發展過程,細胞有一定的生命週期,
最後會進入受調控的程序性死亡(programmed cell death);然而,失序的細胞凋亡
3
(apoptosis)系統使得細胞能夠躲過死亡,藉此形成的抗藥性對傳統化學療法更是一 大挑戰。當細胞凋亡路經中重要的抑癌蛋白(tumor suppressor protein)發生突變或不
正常的調控,能使細胞免於正規藥物濃度對癌細胞造成的毒性,例如 p53 蛋白發
生突變或失去功能的時候,細胞無法經 p53 引起的路徑產生凋亡,因而對輻射線
(radiation)、5-fluorouracil、etoposide 及 doxorubicin 產生抗藥性(Lowe et al., 1993)。
Soengas et al.分析黑色素瘤(melanoma)患者的基因座(locus),發現 Apoptotic protease activating factor 1 (Apaf-1)的缺失多發生在轉移的黑色素瘤患者身上,並且對於 doxorubicin 的作用更具抗藥性(Soengas et al., 2001)。此外,細胞凋亡的外源性路經 (extrinsic pathway)中,死亡受體(death receptor)如 CD95/Fas、TRAIL-R1/R2 及下游 caspase-8 的異常,不但降低細胞凋亡路徑的完整性,進而減低化學療法的療效 (Muschen et al., 2000; Teitz et al., 2000; Shin et al., 2001)。致癌基因(oncogene)的異常 活化或過度表現,也參與調控細胞凋亡造成的抗藥性;inhibitor of apoptosis (IAP) 家族的過度表現會抑制由腫瘤壞死因子(tumor necrosis factor)、Fas、menadione、
staurosporin、etoposide 及 paclitaxel 引起的細胞凋亡(Deveraux and Reed, 1999)。其 他研究也指出,化療或放射線引起NF-κB 的活化,轉錄出多種不同功能性的下游 產 物 , 不 但 促 進 細 胞 增 殖(proliferation) 、 血 管 新 生 (angiogenesis) 、 癌 症 轉 移 (metastasis),也透過活化抗凋亡蛋白(anti-apoptotic)成員 bcl-2 或 IAP 抑制細胞凋亡,
降低癌症療法的效果(Baldwin, 2001)。在鱗狀細胞癌(squamous cell carcinoma)細胞 中,Roberg et al.發現對輻射較具抵抗力的細胞株相較於對輻射敏感的細胞株表現 出更多的促進細胞存活(pro-survival)蛋白如 survivin 與 Bcl-2;且受輻射處理後,
caspase-3 在有輻射抗性的細胞株中也顯出較低的活性(Roberg et al., 2007)。
數十年來,許多研究都提出了各種抗藥性產生的可能性與機制。然而,目前多 種伴隨多重抗藥性產生的機轉仍未完全明瞭,像是癌幹細胞(cancer stem cells)與上 皮-間葉轉化(epithelial-mesenchymal transition)近來也被認為是與抗藥性有關的現
4
象(Dean et al., 2005; Wang et al., 2010)。
1.2 上皮-間葉轉化
胚胎發育(embryogenesis)過程中,細胞的分化(differentiation)與身體組織及器 官的形成來自於不同胚層經一連串上皮細胞與間葉細胞相互轉型,由上皮-間葉轉 化或是間葉-上皮轉化(mesenchymal-epithelial transition)兩種過程演變而來(Thiery, 2002)。上皮-間葉轉化在生理上的功能包括原腸胚形成(gastrulation)、神經嵴層化 (neural crest delamination)、肌母細胞(myoblast)自肌節(myotome)的分化過程、內分 泌細胞(endocrine cell)自胰芽(pancreatic bud)遷移到間質(mesenchyme)的分化過程、
肝 母 細 胞(hepatoblast) 自 肝 憩 室 (liver diverticulum) 遷 移 到 橫 膈 間 質 (septum transversum mesenchyme) 的 分 化 過 程 及 心 內 膜 墊 (endocardial cushion) 的 形 成 (Nakajima et al., 2000; Ciruna and Rossant, 2001; Johansson and Grapin-Botton, 2002;
De Calisto, 2005; Gros et al., 2005; Tanimizu and Miyajima, 2007; Sauka-Spengler and Bronner-Fraser, 2008),多樣化的生理調節同時顯示了上皮-間葉轉化在生物正常發 育過程的重要性。
上皮細胞與間葉細胞在型態與分布上各具特色,上皮細胞與鄰近的上皮細胞 間透過tight junctions、adherence junctions、desmosomes 與 gap junctions 緊密維持 細胞間的聯繫,與組織間透過表皮基底層(basal lamina)所隔開,並且具有頂部-基 底極化(apical-basolateral polarization)特性。然而,間葉細胞之間則是透過細胞外基 質(extracellular matrix)與結締組織(connective tissue)不具極化特性且相對鬆散的聯 繫著。上皮-間葉轉化的過程中,上皮細胞失去細胞間用以維持細胞聯繫的蛋白,
像是E-cadherin、zonula occludens-1、claudin、cytokeratin 等蛋白,並且表現出間 葉細胞特性的蛋白,如 N-cadherin、vimentin、fibronectin 等蛋白,細胞型態也從 鵝卵石形狀轉變成類似纖維母細胞細長的形狀。上皮-間葉轉化除了參與正常的生
5
理發育過程,亦被認為是引起癌化(tumor progression)及多重抗藥性相關的一種現 象(圖 1-2)。
1.21 上皮-間葉轉化關鍵調控因子
調控上皮-間葉轉化的機轉不但非常多元,也隨著組織與器官的差異而有所不 同,由多種訊息傳遞路徑共同協調,最後匯流於誘導能抑制E-cadherin 的轉錄因子 產生,於細胞核中調控細胞黏附(cell adhesion)蛋白、間葉細胞分化(mesenchymal differentiation)、細胞轉移(migration)、侵襲(invasion)相關的多種基因,達成整個細 胞轉化過程。
E-cadherin,由 CDH1 基因編碼產生,失去此蛋白是上皮-間葉轉化過程中最具 代表性的改變。自2000 年開始,第一個被發現在上皮-間葉轉化分子機轉中扮演重 要角色的是鋅指轉錄因子(zinc-finger transcription factor) Snail。Snail 被認為能夠直 接作用於E-cadherin 啟動子(promoter)的 E-box 片段抑制轉錄過程(Batlle et al., 2000;
Cano et al., 2000),進而控制上皮-間葉轉化過程。隨後又被發現了數個負向調控 E-cadherin 表現的關鍵轉錄因子,例如同屬於 Snail 家族的 Slug (Bolos, 2002; Hajra et al., 2002),兩個 ZEB 家族的轉錄因子 ZEB1(δEF1) (Eger et al., 2005)與 ZEB2 (SIP1) (Comijn et al., 2001),basic helix-loop-helix (bHLH)家族的 Twist1 (Yang et al., 2004)。
這些主要的轉錄因子受到不同訊息傳遞鏈(signal transduction pathway)的誘導而產 生,並且都能夠驅動上皮-間葉轉化過程的進行。
促進上皮-間葉轉化程序的發生來自於多元的訊息傳遞鏈(Polyak and Weinberg, 2009) (圖 1-3),包括細胞外基質(ECM)的影響,例如玻尿酸(hyaluronic acid)驅動細 胞的非貼附性生長(anchorage-independent growth)及侵襲能力(Zoltan-Jones, 2003)。
近來的研究中也指出缺氧(hypoxia)環境不論是藉由誘導 Snail (Lester et al., 2007)或 是Twist1 (Yang et al., 2008)的產生,能夠引起癌細胞進行上皮-間葉轉化。成長因
6
子(growth factor),例如 transforming growth factor-β (TGF-β)家族、fibroblast growth factor (FGF)家族、epidermal growth factor (EGF)及 scatter factor/hepatocyte growth factor (SF/HGF) (Zavadil and Bottinger, 2005),與其他的訊息傳遞路徑如 Wnt、Notch 與NF-κB,都能夠誘導上皮-間葉轉化的發生。
TGF-β 家族的活化在胚胎發育過程中扮演驅使上皮-間葉轉化的角色,也能使 癌細胞侵襲到細胞外基質,並且促進癌細胞於小鼠身上擴散到其他器官(Oft et al., 1998; Janda, 2002)。在不同的癌細胞中,TGF-β 能夠引起 Snail、Slug、ZEB2 的產 生,進而抑制 E-cadherin,使細胞間失去黏附,並可能促進惡性上皮腫瘤的侵襲 (Comijn et al., 2001; Peinado, 2003)。
Glycogen synthase kinase 3β (GSK3β)能夠磷酸化 Snail,促使 Snail 從細胞核中 輸出至細胞質,接連受到ubiquitin 引起的降解,因此, Wnt pathway 或是 AKT/PKB (protein kinase B)透過使 GSK3β 失去活性,Snail 得以維持穩定並保持於核中維持 下游上皮-間葉轉化的進行(Polakis, 2000; Grille et al., 2003; Bachelder, 2004; Zhou et al., 2004) 。 典 型 與 非 典 型 的 Wnt pathway 分 別 包 含 了 神 經 嵴 細 胞 的 層 化 (delamination)與遷移(migration)的功能。以功能增加(gain of function)與功能喪失 (loss of function)的方法研究非洲爪蟾(Xenopus)中不同分子調控的 Wnt pathway,證 明β-catenin 的活化增強 Slug 的表現,並引起了神經嵴(neural crest)異位表現;同時,
以反義寡核苷酸(antisense oligonucleotide)抑制 β-catenin 基因表現也證明 Wnt pathway 的確負責神經嵴(neural crest)的起始發育(Wu et al., 2005a)。此外,經由 Wnt11/Frizzled7 所傳導的非典型的 Wnt pathway 則特別針對神經嵴細胞遷移的控 制(De Calisto, 2005)。
Notch signaling 一般在胚胎發育(embryogenesis)時期調控上皮-間葉轉化,像是 在斑馬魚(zebrafish)胚胎中可以看到,Notch signaling 能夠誘導 Snail 的表現,促使
7
心臟瓣膜(cardiac valve)的發育(Timmerman, 2004)。然而,不同於 TGF-β 與 Wnt pathway,Notch signaling 並非發生於胚胎發育(embryogenesis)中所有的上皮-間葉 轉化過程,因此Notch signaling 的活化需要與其他訊息傳遞路徑的協同作用才足以 催使整個上皮-間葉轉化過程。
NF-κB pathway 近來也被發現在癌細胞或是間皮細胞纖維化(mesothelial fibrosis)中能透過誘導 Snail 的產生(Julien et al., 2007; Strippoli et al., 2008),並穩定 Snail 的表現(Wu et al., 2009),促使上皮-間葉轉化的進行。藉由 inhibitor of κB (IκB) 阻斷NF-κB pathway,也能夠逆轉上皮-間葉轉化過程的發生,因此 NF-κB pathway 被認為對於誘導與維持上皮-間葉轉化都有相當的重要性(Huber, 2004)。
整體來說,這些研究顯示不同功能性的訊息傳遞路徑最後都能誘導上皮-間葉 轉化重要的調節因子產生,驅使細胞進行轉化,除了參與正常生理發育外,亦促 進癌細胞遷移、侵襲、轉移等惡化的情況產生。
1.22 上皮-間葉轉化在癌症中的角色
上皮-間葉轉化的調控已在許多癌症中被廣泛的討論,自從 Snail 表現在侵襲性 癌細胞(invasive carcinoma cells)之後,似乎有越來越多可偵測的標記蛋白,包含腫 瘤中相關的E-cadherin 抑制蛋白。Snail 在乳癌中除了為 E-cadherin 抑制蛋白(Zhou et al., 2004),同時也與癌症的轉移、腫瘤復發及不良預後相關(Blanco et al., 2002;
Elloul et al., 2005; Moody et al., 2005; Come et al., 2006)。同屬 Snail 家族的 Slug,在 乳癌及卵巢癌中也與不良的臨床結果相關(Elloul et al., 2005; Martin et al., 2005)。雖 然Snail 與 Slug 的表現在癌症中也與淋巴結狀態(lymph node status)有所關聯,但 Slug 可能參與了具分化特性的侵襲性腺管癌(invasive ductal carcinomas)的遷移能 力,顯示Snail 與 Slug 對於乳癌侵襲能力或許有不同的影響(Come et al., 2006; Elloul et al., 2006)。在大腸直腸癌(colorectal cancer)的研究中也指出,Snail 的過度表現能
8
夠抑制vitamin D receptor 及 E-cadherin 表現(Pálmer et al., 2004; Pena, 2005; Peña et al., 2006),因此,vitamin D 類藥物或許只在 Snail 陰性的腫瘤上有治療的潛力 (Gonzalez-Sancho et al., 2006)。此外,從臨床研究上的取樣也得知 Snail 在大腸癌 中同時也與癌症的轉移有關(Roy et al., 2005)。Slug 在大腸直腸癌中的表現不但與 轉移、Dukes stage 及病人的整體存活率有關,Slug 還被認為是一個預測不良預後 的獨立因子(Shioiri et al., 2006)。早期,Snail 的表現被認為與彌漫形胃癌(diffuse-type gastric tumors)中 E-cadherin 的低基因表現相關(Rosivatz et al., 2002),但從免疫組織 的研究結果中,似乎缺乏臨床上顯著的證據(Rosivatz et al., 2005)。
ZEB 家族與 Twsit1 的表現在許多不同的腫瘤中亦受到探討,對癌化的影響呈 現與Snail 家族類似的情況。早期研究 ZEB 家族(Comijn et al., 2001; Guaita, 2002),
大多只專注於其中一個因子探討。其中,ZEB2 的表現在卵巢癌、乳癌、胃癌、胰 臟癌都有相關的研究,被認為與癌症的侵襲相關(Rosivatz et al., 2002; Elloul et al., 2005; Elloul et al., 2006; Imamichi et al., 2006)。ZEB1 則主要在大腸直腸癌(Pena, 2005; Peña et al., 2006)與子宮癌中受到探討,也與癌症侵襲的行為相關(Spoelstra, 2006)。有些研究指出 ZEB 與 Snail 在特定的癌症類型中產生不同的影響情形,ZEB2 的表現在卵巢癌積水(ovarian carcinoma effusion)部分多於在實質腫瘤(solid tumor) 或轉移的部位(Elloul et al., 2006)。ZEB1 與 Snail 在大腸癌中抑制 E-cadherin 作用,
似乎也因為不同轉錄因子的協同作用而選擇性地經 Snail 或 ZEB1 之一發揮影響 (Peña et al., 2006)。Twist1 表現的增加與侵襲性乳腺管癌(invasive ductal carcinoma) (Mironchik, 2005)及臨床上乳癌的死亡結果呈正相關(Martin et al., 2005),許多文獻 也指出 Twist1 的表現在前列腺癌、食道鱗狀細胞癌及肝癌中都與癌症轉移有相關 性(Kwok, 2005; Kyo et al., 2006; Yuen et al., 2006),且與子宮內膜癌(Kyo et al., 2006) 及黑色素瘤(melanoma)病人的不良預後相關(Hoek, 2004)。
9
1.23 上皮-間葉轉化與多重抗藥性的關係
目前上皮-間葉轉化在癌症中主要被認為調控癌細胞轉移的過程,但可能也參 與其他與癌化相關的事件。許多具有上皮-間葉轉化型態的癌細胞表現出對傳統化 療的抵抗能力,像是具 oxaliplatin 抗藥性的大腸癌細胞同時表現象徵上皮-間葉轉 化的標誌,包括間葉標記蛋白vimentin 的增加,以及減少上皮標記蛋白 E-cadherin 的表現,並且具有更高的侵襲與轉移能力(Yang, 2006)。對 paclitaxel 有抗藥性的卵 巢癌細胞,除了表現上皮-間葉轉化標誌相關蛋白,Kajiyama et al.觀察到 Snail 及 Twist1 轉錄因子相較於不具抗藥性的親代細胞有更多蛋白表現量,同時在抗藥性 細胞株中表現出對於增強侵襲表現有關的蛋白matrix metalloproteinase 2 (MMP-2) (Kajiyama et al., 2007)。在 MCF-7 及 MDA-MB-453 兩株乳癌細胞中篩選出侵襲性 較強的群體,也觀察到上皮-間葉轉化的標誌相關蛋白的表現,包括其中關鍵的調 控因子Twist1,抑制 Twist1 下游基因 AKT2 可恢復由 Twist1 所造成 paclitaxel 的抗 藥性(Cheng et al., 2007)。在 MCF-7 乳癌細胞中,透過 RNA 干擾(RNA interference) 技術抑制 Twist1 的表現,可逆轉多重抗藥性及細胞的侵襲能力(Li et al., 2009)。
Mittal et al.發現在 MCF-7 過度表現 Slug 可增強對 4-hydroxytamoxifen 的抗藥性,
且間接增加cyclin D1 表現量而促進細胞增殖(Mittal et al., 2011)。同樣地,Snail 和 Slug 也被認為透過拮抗 p53 引起的細胞凋亡,使 MCF-7 乳癌細胞對於 doxorubicin (Kajita et al., 2004)及卵巢癌細胞對 paclitaxel 與放射治療(Kurrey et al., 2009)的抗藥 性。藉由基因剃除鼠動物試驗(in vivo)中觀察到 Slug 的表現,能夠保護造血祖細胞 (haematological progenitor cell)免於輻射所引起的細胞凋亡,產生較高的輻射抗性 (radioresistance) (Inoue et al., 2002; Pérez-Losada et al., 2003)。Wu et al.指出 Slug 在 造血祖細胞中透過抑制Puma 拮抗由 p53 所引起的細胞凋亡(Wu et al., 2005b)。在 Snail 過度表現的黑色素瘤細胞,上皮-間葉轉化過程也與免疫療法的抗藥性相關 (Kudo-Saito et al., 2009)。此外,透過增強上皮-間葉轉化負向調控因子 miR-200c
10
的表現,也能夠促進子宮內膜癌細胞對化療藥物的感受性(Cochrane et al., 2009)。
1.3 研究動機及目的
一直以來,癌細胞多重抗藥性產生會增加藥物治療的難度,傳統上認為抗癌藥 物長期使用而促使癌細胞 MDR1 mRNA 表現量增加,轉譯產生能夠排出藥物的 P-gp 而造成了抗藥性,但許多伴隨抗藥性產生的機轉仍未完全清楚。上皮-間葉轉 化除了增加癌細胞侵襲浸潤及轉移能力,同時上皮-間葉轉化也跟抗藥性的形成密 切相關。有文獻指出具 doxorubicin 抗藥性的 MCF-7 細胞株中,呈現出與上皮-間 葉轉化相關的蛋白與基因表現(Işeri et al., 2011),但對於上皮-間葉轉化與抗藥性的 相關機轉的理解仍有限。本研究主要藉由乳癌細胞MCF-7/WT 與對 doxorubicin 具 抗藥性的 MCF-7/ADR 探討 MDR 與上皮-間葉轉化的相關性,並針對其關鍵調控 因子Slug 探討如何調控細胞對藥物的感受性,透過 Slug siRNA 的作用,分析細胞 凋亡現象與相關因子包括caspase-3/7 與 caspase-8 活性,caspase-6、DFF40、Bcl-2 家族與p53 在 doxorubicin 作用下的基因表現,以期能夠藉此進一步了解抗藥性機 制與上皮-間葉轉化現象的相關性。
圖1--1. 細胞中引引起抗藥性性的因素(G
11
Gottesman ett al., 2002)。
圖
圖1-2. 上皮皮-間葉轉化化(Wang et al., 2010)。
12
圖1- ECM kinas miRN react facto
-3. 上皮-間 M: extracellu se-3β,H/E(
NA: microR tive oxygen or-β,WNT
間葉轉化訊息 ular matrix (Spl): hairy RNA,MMP n species,R TR: Wnt rec
息傳遞路徑
,ETAR: en and enhanc P: matrix me
RTK: recep eptor。
13
徑綜述圖(Po ndothelin A cer of split,
etalloprotei ptor tyrosine
olyak and W A receptor,
,HIF1α: hy inase,NF-κ e kinase,T
Weinberg, 20 GSK3β: gl poxia-induc κB: nuclear
TGFβ: trans
009)。
lycogen syn cible factor factor-κB,
sforming gr nthase
1α,
ROS:
rowth
14
第二章 材料及研究方法 2.1 實驗儀器
1. 12 孔乾浴器 Pantech Firefox Dry Bath 6100 2. 3D 旋轉振盪器 Sun Chion SH306
3. pH 值測定儀 Radiometer Copenhagen PHM-92
4. 二氧化碳培養箱 Sanyo MCO-17 AI
5. 水浴鍋 Yihder BH-230
6. 加熱電磁攪拌器 Corning PC-420
7. 冷凝器 Savant RT100
8. 流式細胞儀 BD FACSCalibur flow cytometer 9. 倒置顯微鏡 Nikon Diaphot 300
10. 核酸即時定量 PCR 偵測系統 Roche LightCycler 2.0
11. 核酸即時定量 PCR 專用離心機 Roche LC Carousel Centrifuge 2.0 12. 核酸定量 PCR 偵測系統 Applied Biosystems GeneAmp 13. 桌上型離心機 Eppendorf Centrifuge 5415 D 14. 真空乾燥離心機 Savant Speed Vac SC 110
15. 蛋白質電泳裝置 Bio-Rad Mini-PROTEAN Tetra Cell 16. 蛋白質轉漬裝置 Bio-Rad Mini Trans-Blot
17. 連續式多功能微孔盤偵測系統 Beckman Coulter PARADIGM 18. 超微量分光光度計 Thermo Scientific ND-1000 19. 落地式冷凍離心機 Hitachi CF 150
20. 電源供應器 Bio-Rad PAC 3000
21. 漩渦震盪混合器 Scientific industries Vortex-2 Genie 22. 影像分析照相系統 Pharmacia Biotech ImageMaster VDS 23. 盤式全光譜酵素免疫分析儀 BioTek Power Wave XS
24. 螢光顯微鏡 Carl Zeiss
25. 懸吊式桌上型離心機 Kubota 2010
15
2.2 細胞株的培養
試藥:
Antibiotic-antimycotic solution PAA
Doxorubicin Sigma Dulbecco's modified eagle medium (high glucose) Invitrogen
Fetal bovine serum Invitrogen
Potassium chloride (KCl) Sigma
Potassium dihydrogen phosphate (KH2PO4) Sigma
Sodium chloride (NaCl) Sigma
Sodium hydrogen carbonate (NaHCO3) Sigma
Sodium phosphate dibasic dodecahydrate (Na2HPO4.12H2O) Sigma
Steritop filter units Millipore
Trypsin-EDTA solution Sigma
D-MEM 培養液配置
將D-MEM 粉末加入內裝有 900 ml 滅菌之去離子水的 1 公升燒杯中,加入 3.7 克 NaHCO3,攪拌至完全溶解後調整pH 值至 7.2,補足去離子水至 1 公升,以 0.22 μm 過濾瓶(Steritop filter units)過濾,置於 500 ml 滅菌血清瓶中,加入 5 ml 抗生素 (Antibiotic-antimycotic solution),儲存於 2-8℃,培養液於使用前加入 50 ml 胎牛血 清(Fetal bovine serum)。
Phosphate buffered saline (PBS) 調整 pH 值至 7.4。
NaCl 137 mM
KCl 2.7 mM
Na2HPO4.12H2O 10 mM
KH2PO4 1.76 mM
16
實驗所用之細胞株為人類乳癌細胞株 MCF7/WT (wild type)、MCF7/ADR (doxorubicin-resistant),此兩株細胞是由台大醫院腫瘤醫學部楊志新醫師提供。各 細胞株培養於含有10%胎牛血清的 D-MEM 培養液於 37℃,5% CO2之恆溫培養箱 內培養。當細胞生長密度至80%時,吸去原培養液並以 PBS 沖洗二次,加入 1 ml 0.05% (w/v) trypsin-0.02% (w/v) EDTA 溶液,置於恆溫培養箱反應 3-5 分鐘,輕拍 培養皿,使細胞自盤底脫離,加入新鮮培養液中和 trypsin,收集細胞,移至無菌 離心管以轉速1,000 rpm,離心 3 分鐘。去除上清液,加入新的培養液均勻混合細 胞,計算細胞數,依照實驗設計不同,植入適當的細胞數至新的細胞培養皿中繼 續培養。MCF-7/ADR 細胞株培養於含有 0.1 μM doxorubicin 的 D-MEM 培養液中,
在試驗一周前移除藥物。
2.3 免疫螢光染色 (Immunofluorescence staining)
試藥:
Anti-rabbit IgG-FITC antibody Southern Biotechnology Associates Millicell EZ SLIDE 8-well glass Millipore
Paraformaldehyde Sigma ProLong Antifade Kit Invitrogen
Tween-20 BDH 將7×104 MCF-7/WT 與 MCF-7/ADR 細胞培養於 8-well 培養皿,以 PBS 洗滌 兩次,利用4% paraformaldehyde 進行細胞固定 15 分鐘。以 PBS 清洗三次,再以 0.1% tween-20 進行 cell permeabilization。以 PBS 清洗三次,加入一級抗體 (E-cadherin,vimentin,1:250,Cell Signaling)於 2-8℃反應一晚。以 PBS 清洗三次,
加入anti-rabbit IgG-FITC (1:1000)二級抗體室溫震搖 1.5 小時。以 PBS 清洗三次,
透過 DAPI (4',6-diamidino-2-phenylindole)染細胞核,以 mounting medium 與微量
17
antifade 均勻混合,蓋上蓋玻片,置放 2-8℃一晚,以 Carl Zeiss 螢光顯微鏡 (fluorescence microscope)拍照。
2.4 反轉錄-聚合酶連鎖反應法 (Reverse transcription-PCR)
試藥:
100 bp DNA Ladder BioKit
2.5 mM dNTP GeneTeks
Agarose Tablets Bioline
Chloroform Sigma Deoxyribonuclease I (Dnase I) Sigma
Diethylpyrocarbonate (DEPC) Sigma
Ethanol Sigma
Ethidium bromide (EtBr) Sigma GoTaq Green Master Mix Promega
Isopropanol Sigma M-MLV Reverse Transcriptase (M-MLV RT) Promega
M-MLV Reverse Transcriptase 5X Reaction Buffer Promega
Oligo d(T)18 GeneTeks
Primer Mission Recombinant RNasin Ribonuclease Inhibitor Promega
Rnase AWAY Molecular BioProducts
Trizol Reagent Invitrogen
UltraPure DNase/RNase-Free Distilled Water Invitrogen
Glacial acid acid Sigma
18
Ethylenediaminetetraacetic acid (EDTA) Sigma
Tris (Base) J.T.Baker
Tris-Acetate EDTA buffer (TAE buffer)
Tris-Acetate 40 mM
EDTA 1 mM
實驗開始前,將所有器具及桌面先以RNase AWAY 擦拭。
(1) 抽取全 RNA
細胞經藥物處理後,吸去原培養液,以PBS 洗滌兩次,加入 Trizol reagent (1 ml/10 cm2)於室溫培養五分鐘並移至微量離心管,再加入 chloroform (0.2 mL chloroform/1 mL TRIZOL reagent)激烈震盪 15 秒,靜置於室溫 3 分鐘,以轉速 12,000
× g,2-8℃離心 15 分鐘。取出上清液移至新微量離心管,加入 isopropanol (0.5 mL chloroform/1 mL TRIZOL reagent)沉澱 RNA,靜置於室溫 10 分鐘,以轉速 12,000 × g,2-8℃離心 10 分鐘。去除上清液,以 75% ethanol (稀釋於 0.01% DEPC-treated water, 1 mL ethanol/1 mL TRIZOL reagent)震盪清洗 RNA 沉澱物,以轉速 7,500 × g,2-8
℃離心5 分鐘。去除上清液,真空乾燥後以 20 μl Nuclease-free water 於 55℃水浴 10 分鐘重新溶解 RNA,再加入 0.3 μl DNase-I 於 37℃水浴 15 分鐘,68℃水浴 8 分鐘使DNase-I 失活。以 NanoDropND-1000 測定 RNA 濃度。
(2) 反轉錄酶法(Reverse transcription)
取5 μg RNA 補 nuclease-free water 至 35 μl,加入 1 μl oligo d(T)18,70℃水浴 5 分鐘打開模板(template)二級結構,置放冰上 5 分鐘避免二級結構復原,加入 M-MLV RT 5X Reaction Buffer 10 μl,2.5 mM dNTP 2 μl,RNasin Ribonuclease Inhibitor 1 μl (40 u/μl),M-MLV RT 1 μl,40℃水浴 10 分鐘,45℃水浴 50 分鐘,移至 95℃水浴
19
5 分鐘終止反應,cDNA 放置-20℃保存。
(3) 聚合連鎖酶反應法(Polymerase chain reaction)
根據GoTaq Green Master Mix (Promega) protocol。使用的核酸引子(primer)序列 如表2-1,除了β-actin (Yang et al., 2007)、N-cadherin and vimentin (Calcagno et al., 2010)、Snail (Wang et al., 2007)、Slug (Niessen et al., 2008)及ZEB1 (Casas et al., 2011) 核酸引子,其他引子透過LightCycler Probe Design Software 2 (Roche)設計。
將以下試劑加入PCR tube均勻混合後,短暫離心確認所有試劑在PCR tube底部,
進行聚合連鎖酶反應。
Reagent Volume Final concentration
Upstream primer, 10 μM 1 μl 0.4 μM
Downstream primer, 10 μM 1 μl 0.4 μM
DNA template 1-5 μl <250 ng
GoTaq Green Master Mix, 2X 12.5 μl 1×
Nuclease-Free Water 加至25 μl
Total 25 μl
Annealing Temperature 及 Cycles 實驗條件:
Gene Annealing Temperature (℃) Cycles
β-actin 57 23
Slug 52 30
Caspase-6、DFF40 52 27
20
聚合連鎖酶反應條件設定:
Temperature (℃) Time
Pre-incubation 94℃ 10 min
Denaturation 94℃ 30 sec
Annealing 52 or 57℃ 30 sec
Extension 72℃ 30 sec
Final Extension 72℃ 7 min
PCR 反應結束後,產物保存於 4℃。
(4) 洋菜膠體 (agarose gel) 電泳法
取2% agarose gel (2 g agarose/TAE buffer 100 ml) 於微波爐煮 2 分鐘,待溫度 下降至70℃倒入膠盤待冷卻凝固,加入 5 μl PCR 產物及 100 bp DNA Ladder,以 1
× TAE buffer 進行 100 伏特,30 分鐘的電泳分析,最後以 ethidium bromide 染色 3 分鐘,浸泡清水褪染後照相。
2.5 即時定量-聚合酶連鎖反應法 (Real-time PCR)
試藥:
LightCycler FastStart DNA masterPLUS SYBR green I Roche
Master mix
將vial 1a FastStart Enzyme 及 vial 1b FastStart DNA MasterPLUS Reaction Mix 置於 冰上溶化後,稍微離心。取14 μL vial 1a 加入 vial 1b。
準備樣品,將玻璃毛細管放入保溫盒以維持低溫,將下表樣品均勻混合後加入 毛細管。
21
Reagent Volume (μl) Final concentration H2O, PCR grade 12
Primer (forward and reverse) 1+1 0.5 μM Master Mix, 5× concentration 4 1×
Total 18 上述試劑混勻後,個別加入cDNA 2 μl,離心後準備進行反應。
即時定量-聚合連鎖酶反應條件設定:
Cycles ℃ Hold Ramp rate (℃/s)
Acquisition Mode
Analysis Mode Pre-incubation 1 95 10 min 20 None None
Amplification 45
95 10 sec 20 None
Quantification 62 10 sec 20 None
72 12 sec 20 Single
Melting
Curves 1
95 0 sec 20 None
Melting Curves 65 15 sec 20 None
95 0 sec 0.1 Continuous
Cooling 1 40 30 sec 20 None None
所得資料經由LightCycler software 4.05 分析。
22
2.6 西方墨點法 (Western blot)
試藥:
2-Mercaptoethanol Sigma 40% Acrylamide/Bis Solution 29:1 ratio Bio-Rad
Ammonium persulfate (APS) Sigma
Bio-Rad Protein Assay Dye Reagent Concentrate Bio-Rad Bovine serum albumin (BSA) Sigma
Bromophenol blue Sigma
Ethylenediaminetetraacetic acid (EDTA) Sigma GeneTeks PreBlue Orange Protein Ladder GeneTeks
Glycine J.T.Baker Goat anti-mouse IgG-HRP Santa Cruz
Goat anti-rabbit IgG-HRP Santa Cruz Immobilon Western Chemiluminescent HRP Substrate Millipore KODAK GBX Developer and Replenisher KODAK
KODAK GBX Fixer and Replenisher KODAK
Methanol Sigma N,N,N',N'-tetramethylethylenediamine (TEMED) Bio-Rad
Nitrocellulose membrane (NC membrane) Invitrogen
Potassium chloride (KCl) Sigma
Protease inhibitor cocktail tablets Roche
Restore Plus Western blot stripping buffer Thermo Scientific
Sodium chloride (NaCl) Sigma
Sodium dodecyl sulfate (SDS) Sigma
23
Tris (Base) J.T.Baker
Triton X-100 BDH
Tween-20 BDH
Radio Immuno Precipitation Assay buffer (RIPA buffer)
NaCl 150 mM
Triton X-100 1.0% (v/v) Sodium deoxycholate 0.5% (w/v)
SDS 0.1% (w/v)
Tris (pH 8.0) 50 mM
Laemmli 4× buffer
Tris-HCl buffer (pH 6.8) 250 mM
2-Mercaptoethanol 20% (v/v)
Glycerol 40% (v/v)
SDS 8% (w/v)
Bromophenol blue 0.016 % (w/v)
SDS Running buffer
Tris 25 mM
Glycine 190 mM
SDS 0.1% SDS (w/v)
以HCl 調整 pH 值至 8.3。
Transfer buffer
Tris 25 mM
24
Glycine 190 mM
MeOH 20% methanol (v/v)
Tris Buffered Saline (TBS buffer)
Tris (base) 25 mM
NaCl 137 mM
以HCl 調整 pH 值至 7.6。
TBS-Tween-20 (TBST)
將0.1 % (v/v) Tween-20 溶於 TBS buffer。
(1) 細胞全蛋白質之抽取
細胞經藥物處理後,吸去原培養液,以 PBS 洗滌兩次,加入 trypsin 作用,輕 拍培養皿,使細胞自盤底脫離,加入新鮮培養液中和 trypsin,收集細胞,移至無 菌微量離心管以轉速2,000 rpm,2-8℃離心 3 分鐘。去除上清液,加入 42 μl RIPA buffer 和 7 μl protease inhibitor 7× stock solution,置放冰上 30 分鐘,作用時間內至 少vortex 震盪五次。將微量離心管以轉速 12,000 rpm,2-8℃離心 15 分鐘,抽取上 清液移至事先預冷的微量離心管,細胞全蛋白質放置-80℃保存。
(2) 蛋白質之定量
根 據 Bio-Rad Protein Assay Dye Reagent Concentrate (Bio-Rad) 所 提 供 之 Microtiter Plate Protocols。將牛血清白蛋白(BSA)與二次蒸餾水稀釋成 0、0.1、0.2、
0.3、0.4 和 0.5 mg/ml 六個濃度。蛋白質樣品以二次蒸餾水稀釋 10~50 倍後,全部 加入200 μl 1× Dye reagent 均勻混合,於室溫反應 5 分鐘,以 595 nm 波長偵測吸 光值並繪製出標準曲線,以內差法計算蛋白質濃度。
25
(3) 蛋白質 SDS-PAGE 電泳法
膠體配方如下:
Stack Resolving Gel
4% X %
40% Acrylamide/Bis 0.3 ml 0.25 × X %=(A)* ml
Re-dH2O 1.91 ml (7.35─A) ml
1.0 M Tris-HCl, pH 6.8 0.756 ml
1.5 M Tris-HCl, pH 8.8 2.5 ml
10% SDS (w/v) 30 μl 100 μl
TEMED 3 μl 5 μl
10% APS (w/v) 15 μl 50 μl
Total volume 3 ml 10 ml
*字母 A 表示應加入 40% Acrylamide/Bis solution 的體積。
依上表試劑鑄適當濃度resolving gel,加入乙醇壓平膠體表面。當 resolving gel 凝固後,配置4% stacking gel,插入塑膠齒模,等待凝固進行電泳。將蛋白質(30 μg) 與Laemmli 4× buffer (3:1)混合均勻,以 95℃水浴 5 分鐘,置放冰上 5 分鐘避免蛋 白質結構還原,以70 V 電泳 0.5 小時,當蛋白質進入 resolving gel 以 140 V 電泳 1 小時。
(4) 蛋白質轉漬 (Transfer)
將電泳後的膠體裁成適當大小,依電流負極到正極方向分別將海綿、濾紙、電 泳膠體、nitrocellulose membrane、濾紙、海綿依序夾於卡匣中,放置於濕式轉漬裝 置,補滿transfer buffer,以 250 mA 於 2-8℃轉漬兩小時。
26
(5) 抗原-抗體交互作用
將轉漬完成後的nitrocellulose membrane 浸泡於 5% (w/v)脫脂奶粉中室溫震搖 1 小時。以TBST 清洗三次各 10 分鐘,加入一級抗體(E-cadherin、N-cadherin、vimentin、
Snail、Slug、ZEB1,1:1000,Cell Signaling。β-actin,1:3000,PARP,1:2000,Santa Cruz)於 2-8℃反應 12 小時。以 TBST 清洗三次各 10 分鐘,加入 HRP-conjugated 二級抗體室溫震搖1 小時。以 TBST 清洗三次各 10 分鐘,稍微吸乾膜上多餘的 TBST,
取適量的 Luminol Reagent and Peroxide Solution (1:1)混合均勻(1 mL/10 cm2 membrane area),等 HRP substrate 恢復到室溫,加到 nitrocellulose membrane 上,
反應 1 分鐘,覆蓋一層透光投影片,置放於壓片匣中攜至暗房。裁取適當尺寸底
片,蓋上壓片匣感光反應0.5 至 5 分鐘,取出底片浸泡於顯影劑中,待底片呈現訊 號,以水清洗數次,放入定影劑中作用,再以水清洗數次,完成壓片。將底片掃 描至電腦中,以Gel-pro Analyzer 4.0 軟體分析定量。
2.7 siRNA 轉染試驗 (siRNA transfection)
試藥:
Stealth RNAi SNAI2 siRNA Invitrogen Stealth RNAi negative control Invitrogen OPTI-MEM I reduced serum medium Invitrogen
Lipofectamine 2000 Invitrogen
將2.5×105 MCF-7/ADR 細胞培養於 60-mm 培養皿,隔天換新鮮培養液 2 ml。
分別將5 μl Lipofectamine 2000 與 250 μl Opti-MEM 及 5 μl siRNA (20 μM)與 250 μl Opti-MEM 在室溫下混勻等待五分鐘平衡,再將此兩試管溶液混勻後作用 20 分鐘,
加入60-mm 培養皿達總體積約 2.5 ml,siRNA 最終濃度為 40 nM,轉染作用 6 小 時候更換正常培養液,繼續培養18 小時進行後續試驗。siRNA 序列如表 2-2。
27
2.8 Propidium iodide 染色測定
試藥:
Propidium iodide solution (1mg/ml) Invitrogen
Ribonuclease A Sigma
Triton X-100 BDH
Propidium iodide staining buffer
Propidium iodide solution (1mg/ml) 8 ml
Ribonuclease A 100 mg
PBS 100 ml
Triton X-100 1.0% (v/v)
將2×105 MCF-7/ADR 細胞培養於 6-well 培養皿,隔天換新鮮培養液 1 ml。分 別將2.5 μl Lipofectamine 2000 與 100 μl Opti-MEM 及 2.5 μl siRNA (20 μM)與 100 μl Opti-MEM 在室溫下混勻等待五分鐘平衡,再將此兩試管溶液混勻後作用 20 分鐘,
加入6-well 培養皿達總體積約 1.2 ml,siRNA 最終濃度約為 40 nM,轉染作用 6 小 時候更換正常培養液。隔天加入30 μM doxorubicin 作用 48 小時。收取培養皿中 D-MEM 培養液於微量離心管,並將細胞以 trypsin 作用後收下,以轉速 2,000 rpm,
2-8℃離心 2 分鐘。吸去上清液,以 70%酒精固定,置放於-20℃冰箱 30 分鐘,以 轉速2,000 rpm,2-8℃離心 10 分鐘。吸去上清液,以 2-8℃ PBS 清洗細胞,以轉 速2,500 rpm,2-8℃離心 10 分鐘。吸去上清液,以 400 μl PI staining buffer 染色 30 分鐘,透過流式細胞儀(flow cytometer)分析。
2.9 Caspase-Glo 3/7 測定
試藥:
28
Caspase-Glo substrate Promega
Caspase-Glo buffer Promega
96-well white opaque tissue culture plate BD
將2.5×105 MCF-7/ADR 細胞培養於 60-mm 培養皿,分別以 40 nM 對照組 siRNA (si-scramble)及 Slug siRNA (si-Slug 2)轉染。隔天將已轉染的細胞 4×103 MCF-7/ADR si-scramble 與 MCF-7/ADR si-Slug 2 細胞培養於 96-well white opaque tissue culture plate。隔天待細胞貼附後,加入 30 μM doxorubicin 作用 48 小時,再加入 100 μl Caspase-Glo 試劑作用一小時,測定冷光值(luminescence)。實驗同時將相同細胞數 量培養於一般96-well 培養皿,以 MTT 測定值比例當作細胞存活率標準化冷光值。
2.10 Caspase-8 測定
試藥:
Cell lysis buffer Biovision
2X reaction buffer Biovision
IETD-pNA (4 mM) Biovision
DTT (1 M) Biovision
將 MCF-7/ADR 細胞培養於 60-mm 培養皿,分別以 40 nM 對照組 siRNA (si-scramble)及 Slug siRNA (si-Slug 2)轉染。隔天加入 30 μM doxorubicin 分別作用 0、
3、6、12、24 小時,再加入 cell lysis buffer 試劑作用十分鐘。將微量離心管以轉 速10,000 rpm,2-8℃離心 1 分鐘,取 150 μg 蛋白質,加入 50 μl 2X reaction buffer (10 mM DTT)及 5 μl IETD-pNA,37℃反應 90 分鐘,將反應物加入 96-well 培養皿。以 盤式全光譜酵素免疫分析儀 (Microplate Spectrophotometer) 讀取波長 400 nm 的吸 光值。
29
2.11 統計檢定
圖表上數值由平均數±標準差表示,樣本間的比較以學生氏 t 分布(Student's t-distribution)檢定,以*表示 P value<0.05 (**P value<0.01、*** P value<0.001)認為 數據間具有統計檢定上的顯著差異。
30
表2-1. RT-PCR 與 real-time PCR 所使用的核酸引子(primer)
Gene Position Forward and Reverse Oligonucleotide Sequence Size (bp) β-actin 1009-1158 F 5’-ATTGCCGACAGGATGCAGAA-3’
R 5’-GCTGATCCACATCTG CTGGAA-3’ 150
E-cadherin 1991-2164 F 5'- ACATCTCCCTTCACAGCA -3' R 5'- GGTGGTCACTTGGTCTTTA -3' 174
N-cadherin 1585-1794 F 5’-AATGACAATCCTCCAGAGTTTACTGCC-3’
R 5’-GGTGACTAACCCGTCGTTGCT-3’ 210
Vimentin 1615-1773 F 5’-GGAAGCTGCTGGAAGGCGA-3’
R 5’- CCTGTCCATCTCTAGTTTCAACCGTCTTA-3’ 159
Snail 536-784 F 5'- GAAAGGCCT TCAACTGCA AA-3' R 5'- TGACATCTGAGTGGGTCTGG -3' 249
Slug 688-945 F 5'- AGATGCATATTCGGACCCAC -3' R 5'- CCTCATGTTTGTGCAGGAGA -3' 257
ZEB1 668-753 F 5'-GATGATGAATGCGAGTCAGATGC-3' R 5'-ACAGCAGTGTCTTGTTGTTGTAG-3' 86
Caspase-6 589-753 F 5’-CCAGTCATTCCTTTGGATGTAGTAGAT-3’
R 5’-GCC GTT CAC AGT TTC CCG-3’ 165
DFF40 1118-1286 F 5’- ACGCACCATCATTCCTACAC-3’
R 5’- GATTCTGCTTGGGTCACAGTTG-3’ 169
31
續表2-1. RT-PCR 與 real-time PCR 所使用的核酸引子(primer)
Gene Position Forward and Reverse Oligonucleotide Sequence Size (bp) Bcl-2 5297-5455 F 5’-CAGAATAACCAGAACTAAGGGTATGAAGGA-3’
R 5’-CCAAACGGAGCTGCACT-3’ 159
Bcl-xL 986-1135 F 5’- AGGAACGCTTCAACCGC-3’
R 5’- GGCTGGACGGAGGATGT-3’ 150
Bax 657-811 F 5'- GCTGCCTTGGACTGTGTT -3' R 5'- TTGTGTCCCGAAGGAGGT -3' 155
Bak 547-699 F 5'- GACGACATCAACCGACGC -3' R 5'- GCCCAGAAGAGCCACCACA -3' 153
Bad 679-860 F 5'- CGGAGGATGAGTGACGAGTTT -3' R 5'- GGGATGTGGAGCGAAGGT -3' 182
Bik 321-474 F 5'- CCTGGGTCTGGCTTTCATCTAC -3' R 5'- CAGCAGCACCTGTTCGC -3' 154
Bid 610-762 F 5'-CAGTGGGAGGGCTACGA -3' R 5'-GCTACGGTCCATGCTGT-3' 153
Bim 684-871 F 5'- TTCCATGAGGCAGGCTGAAC -3' R 5'- ACACCAGGCGGACAATGTA -3' 188
Puma 702-853 F 5'-GGACGACCTCAACGCACAGTA -3' R 5'-GCACCTAATTGGGCTCCATC -3' 152
Total p53 1487-1639 F 5'-CAGAAGCACCCAGGACT -3'
R 5'-TACATCTCCCAAACATCCCTCAC -3 153
Mutant p53 363-604 F 5'- GAAGACCCAGGTCCAGATGA -3' R 5'- TGGCAAAACATCGTGCAAGTC -3 221
32
表2-2. Slug siRNA 序列
Slug siRNA Oligonucleotide Sequence
si-Slug 1 5'-CCGUAUCUCUAUGAGAGUUACUCCA-3' 3'-UGGAGUAACUCUCAUAGAGAUACGG-5'
si-Slug 2 5'-GGCUCAUCUGCAGACCCAUUCUGAU-3' 3'-AUCAGAAUGGGUCUGCAGAUGAGCC-5'
si-Slug 3 5'-CAGCUGCACUGCGAUGCCCAGUCUA-3' 3'-UAGACUGGGCAUCGCAGUGCAGCUG-5'
33
第三章 研究結果
3.1 MCF-7/WT 與 MCF-7/ADR 呈現不同的細胞型態與上皮-間葉轉化標記蛋白
為了理解上皮-間葉轉化現象是否在具 doxorubicin 抗藥性的 MCF-7/ADR 細胞 中 扮 演 與 抗 藥 性 相 關 的 功 能 。 首 先 , 藉 由 細 胞 型 態 上 觀 察 MCF-7/WT 與 MCF-7/ADR,並且利用免疫螢光染色分析上皮細胞標記蛋白 E-cadherin 及間葉細 胞標記蛋白vimentin 在細胞中的分布情況。透過顯微鏡觀察,可以看到 MCF-7/WT 細胞的型態屬於上皮細胞鵝卵石狀的外觀,細胞間緊密相鄰;然而MCF-7/ADR 的 細胞型態則呈現似纖維母細胞(fibroblast-like)的扁平細長型外觀(圖 3-1 A),且細胞 群聚也不像 MCF-7/WT 那麼緊密,細胞彼此間較為擴散,兩種細胞在型態上截然 不同。如圖3-1(B),免疫螢光染色的結果顯示上皮細胞標記蛋白 E-cadherin 分布在 MCF-7/WT 細胞中,於 MCF-7/ADR 細胞只有微量表現;間葉細胞標記蛋白 vimentin 的分布則正好相反,在 MCF-7/ADR 細胞中可以看到大量 vimentin 分布,然而,
MCF-7/WT 細胞中則無 vimentin 表現。
3.2 MCF-7/ADR 呈現上皮-間葉轉化特性
除了細胞型態的差異外,同時利用即時定量-聚合酶連鎖反應法與西方墨點法 比較上皮細胞標記蛋白 E-cadherin 及間葉細胞標記蛋白 N-cadherin 與 vimentin 在 MCF-7/WT 與 MCF-7/ADR 兩細胞中基因和蛋白質的表現。相較於 MCF-7/WT,上 皮細胞標記蛋白E-cadherin 在 MCF-7/ADR 中的基因表現降低了 1000 倍左右;間 葉標記蛋白N-cadherin 與 vimentin 在 MCF-7/ADR 中的基因表現相較於 MCF-7/WT,
分別增加了837 與 1093 倍(圖 3-2 A)。在兩株細胞中蛋白質表現也呈現與基因表現 一致的結果(圖 3-2 B),E-cadherin 只表現於 MCF-7/WT,而 N-cadherin 與 vimentin 只在MCF-7/ADR 中表現。
34
3.3 在 MCF-7/ADR 細胞中上皮-間葉轉化調控因子過度表現
為了釐清上皮-間葉轉化在 MCF-7/ADR 中與抗藥性的關係,在 MCF-7/WT 與 MCF-7/ADR 中,分析能夠驅使上皮-間葉轉化進行的主要轉錄因子,包括 Snail、
Slug 與 ZEB1 的基因及蛋白質表現。透過即時定量-聚合酶連鎖反應法分析,
MCF-7/ADR 的 Slug 與 ZEB1 的基因表現相較於 MCF-7/WT 細胞分別增加了 128 倍及30 倍,而 Snail 的基因表現在兩株細胞中無顯著差異(圖 3-3 A),Snail 蛋白表 現在MCF-7/WT 與 MCF-7/ADR 細胞中也無明顯差異(圖 3-3 B)。如同基因表現的 結果,而Slug 與 ZEB1 的蛋白質亦只表現在 MCF-7/ADR 中。由於上皮-間葉轉化 調控因子中Slug 相較於 ZEB1 在 MCF-7/WT 與 MCF-7/ADR 細胞中表現量差異更 大,過去文獻也報導了Slug 與抗藥性的相關性,因此後續試驗選定 Slug 為目標研 究MCF-7/ADR 抗藥性產生的可能原因。
3.4 Slug siRNA 抑制 Slug mRNA 與蛋白質表現
以 40 nM Slug siRNA (si-Slug 1、si-Slug 2、si-Slug 3)與對照組 siRNA (si-scramble)作用 MCF-7/ADR 細胞,於 48 小時後測試在 MCF-7/ADR 中對於 Slug mRNA 與蛋白質的抑制效果。如圖 3-4 (A)所示,可觀察到 si-Slug 1 相較於 si-scramble 對 Slug mRNA 表現可達 80%的抑制效果,si-Slug 2 對 Slug mRNA 能夠 達到85%的抑制效果,si-Slug 3 的抑制效果與 si-scramble 無顯著差異。透過 Slug siRNA 作用後,Slug 蛋白質受抑制情形也呈現與 mRNA 相符的情形(圖 3-4 B),其 中又以si-Slug 2 轉染能夠達到最好的抑制效果,因此選定 si-Slug 2 進行後續實驗。
3.5 抑制 Slug 促進 doxorubicin 引發 MCF-7/ADR 的細胞凋亡
在文獻報導中,Slug 能夠抑制細胞凋亡的相關分子,因此透過 siRNA 抑制 Slug mRMA 探討是否能夠促進細胞凋亡活性而增強 MCF-7/ADR 抗藥性細胞株對於 doxorubicin 的敏感性。如圖 3-5 所示,藉由西方墨點法分析 PARP 蛋白在 Slug
35
siRNA 及分別加入 1、3、10 及 30 μM doxorubicin 作用下的表現,發現對照組的 siRNA 與 Slug siRNA 單獨作用之下都沒有 cleaved PARP 的產生。在濃度 1、3、
10 μM doxorubicin 作用下不論是對照組或者是 Slug siRNA 共同作用下亦沒有產 生明顯的cleaved PARP。然而,當藥物濃度提高 30 μM,可以清楚看到 Slug siRNA 增強doxorubicin 所引起的 cleaved PARP 的產生,並經過定量分析,Slug siRNA 作用下cleaved PARP 的產生,相較於對照組增加 2 倍。
在Slug siRNA 作用下除了誘導 cleaved PARP 的增加,同時也利用流式細胞儀 分析細胞週期,進一步佐證細胞凋亡的情況。圖3-6 (A)顯示,在 doxorubicin 作用 前,對照組MCF-7/ADR 以及受到 Slug siRNA 作用後,細胞週期並無產生任何改 變。加入30 μM doxorubicin 作用 48 小時後,對照組 MCF-7/ADR 產生明顯的 G2/M 期停滯以及少量sub-G1 的產生。受 doxorubicin 藥物作用下,在 MCF-7/ADR 中抑 制Slug 表現相較於對照組產生更明顯的 sub-G1 細胞族群。將 sub-G1 的百分比統 計後(圖 3-6 B),對照組 MCF-7/ADR 與 Slug siRNA 單獨作用下的 sub-G1 分別為 0.47±0.11%與 0.56±0.14%,實驗顯示在 Slug siRNA 單獨作用下,並不會引起細胞 凋亡的產生。受doxorubicin 作用下的對照組 MCF-7/ADR 產生 2.66±0.72% sub-G1,
相較於藥物作用前,sub-G1 的細胞族群有顯著增加。抑制 Slug 基因表現並受到 doxorubicin 作用產生 9.53±0.56% sub-G1,相較於藥物作用下的對照組 MCF-7/ADR,
sub-G1 細胞族群亦有顯著增加。此結果顯示了 Slug siRNA 能夠增加由 doxorubicin 引起的sub-G1 細胞族群,促進細胞的死亡。
透過分析細胞凋亡下游分子caspase-3/7 的活性,可進一步確認抑制 Slug 與細 胞凋亡可能關聯性。未受到 doxorubicin 藥物作用下,Slug siRNA 作用前後的 caspase-3/7 活性並無差異。單獨以 doxorubicin 作用後,相較於未受藥物作用前的 對照組MCF-7/ADR 的 caspase-3/7 活性提升了 4.6 倍。Slug siRNA 與 doxorubicin 作用下caspase-3/7 活性相較於對照組 MCF-7/ADR 也上升了 7.8 倍(圖 3-7),並且
36
相較doxorubicin 單獨作用下的 caspase-3/7 活性顯著增加。
細胞凋亡可以透過外生性路徑(extrinsic pathway)或是經由內源性路徑(intrinsic pathway)所引起。因此,藉由 caspase-8 colorimetric assay 檢驗抑制 Slug 基因表現 並在 doxorubicin 作用下誘導的細胞凋亡是否經由外生性路徑。分別測定對照組 MCF-7/ADR 與抑制 Slug 表現的情況下經由 doxorubicin 作用 0、3、6、12、24 小 時的capsase-8 活性。實驗結果顯示 caspase-8 的活性在 doxorubicin 作用於不同時 間點以及是否受到Slug siRNA 的作用之下都沒有受到活化(圖 3-8),藉由此結果可 以排除抑制Slug 表現造成細胞凋亡活性的增加是透過外生性路徑所引起。
3.6 抑制 Slug 增加 Bad 與 p53 的基因表現量並降低 Bcl-2 基因表現量
文獻指出,過度表現Slug 的情況下,能夠降低 caspase-6 及 DFF40 在黑色素 瘤細胞內的表現,可能減少細胞凋亡的情況(Kajita et al., 2004)。因此,透過抑制 Slug 基因表現探討在 MCF-7/ADR 細胞中是否能夠藉由促進細胞凋亡相關分子 caspase-6 及 DFF40 表現而增進對 doxorubicin 的敏感性。以逆轉錄-聚合酶連鎖反 應法觀察基因變化情形,在doxorubicin 作用前後,Slug siRNA 作用於 MCF-7/ADR 都能夠產生對Slug 基因明顯的抑制效果(圖 3-9)。caspase-6 的基因表現不論在 Slug siRNA 及 doxorubicin 作用之下,都沒有明顯變化。DFF40 在 Slug siRNA 作用的情 形下提升了1.5 倍的基因表現量,受 doxorubicin 作用後,也提高了 1.4 倍的基因表 現量,然而,在Slug siRNA 與 doxorubicin 共同作用下,與對照組 MCF-7/ADR 亦 無明顯差異。
先前的報導中也指出 Slug 能保護細胞免於受到 Bcl-2 家族中抗細胞凋亡家族 與促細胞凋亡家族的調控所引起的細胞凋亡。因此,利用即時定量-聚合酶連鎖反 應法分析了抗細胞凋亡家族Bcl-2 及 Bcl-xL、促細胞凋亡因子 Bax 與 Bak、促細胞 凋亡BH3-only 蛋白(pro-apoptotic BH3-only proteins) Bad、Bik、Bid、Bim 及 Puma,
37
以及抑癌蛋白(tumor suppressor protein) p53 在抑制 Slug 基因及 doxorubicin 作用下 的基因表現。如圖3-10 所示,抗細胞凋亡家族的 Bcl-2 基因變化在 Slug siRNA 及 doxorubicin 單獨作用後有下降的趨勢,但並沒有顯著差異。然而當 Slug siRNA 與 doxorubicin 共同作用時,Bcl-2 基因表現量比對照組 MCF-7/ADR 降低 70%,且相 較於Slug siRNA 及 doxorubicin 單獨作用的 Bcl-2 表現量亦有顯著差異;另外檢測 Bcl-xL 的基因表現量,發現在 MCF-7/ADR 中受 Slug siRNA 與 doxorubicin 作用下 皆沒有產生明顯變化。促細胞凋亡蛋白Bax 與 Bak 在抑制 Slug 表現與 doxorubicin 作用下,基因表現量亦沒有產生顯著改變(圖 3-11)。促細胞凋亡 BH3-only 蛋白 Bad 的基因表現量在Slug siRNA 單獨作用後,相較於對照組 MCF-7/ADR,提升了 2.4 倍(圖 3-12)。Slug siRNA 與 doxorubicin 共同作用後,Bad 基因表現上升 3.9 倍,且 相較於doxorubicin 單獨作用的情況,Bad 基因表現量也有顯著增加。Bik 的基因表 現量在 Slug siRNA 作用的情形下,相較於對照組 MCF-7/ADR 上升 2.2 倍,受 doxorubicin 單獨作用也升高了 1.8 倍。在 Slug siRNA 與 doxorubicin 共同作用下則 提高了2.3 倍。其它促細胞凋亡 BH3-only 蛋白包括 Bid、Bim 及 Puma 在 Slug siRNA 及doxorubicin 單獨或共同作用下,基因表現量皆沒有產生顯著改變。
本實驗室先前的研究指出存在於MCF-7/ADR 中的抑癌蛋白 p53,是含有一段 21-bp 缺失(deletion)的突變型 p53 (Yu et al., 2007)。因此,我們觀察整體 p53 (total p53)與突變型 p53 (mutant p53)是否受到 Slug 作用下影響基因表現。在 doxorubicin 單獨作用下,相較於對照組 MCF-7/ADR,整體 p53 基因表現量增加為原本的 5.1 倍(圖 3-13)。在 Slug siRNA 與 doxorubicin 共同作用的情況下,整體 p53 基因表現 量增加上升34.9 倍,且相較於 doxorubicin 單獨作用於 MCF-7/ADR 的情況,也顯 著增加了6.8 倍。在抑制 Slug 下的突變型 p53 基因表現趨勢也如同整體 p53,抑制 Slug 基因表現或單獨使用 doxorubicin 都使突變型 p53 分別增加 4.5 倍及 7.3 倍。在 Slug siRNA 與 doxorubicin 共同作用下突變型 p53 基因表現,相較於對照組升高 72.6
38
倍。不論是否為突變型p53,Slug 能透過轉錄調控 p53 基因表現來加強 doxorubicin 的作用。
(A)
(B)
(C)
39
40
圖 3-1. MCF-7/WT 與 MCF-7/ADR 型態及上皮-間葉轉化標記蛋白在細胞中的表 現。
(A) MCF-7/WT 與 MCF-7/ADR 細胞型態上的變化。Nikon Diaphot 300 擷取影像,
比例尺=100 μm。(B)與(C)免疫螢光染色比較上皮標記蛋白 E-cadherin 間葉細胞標 記蛋白vimentin 在 MCF-7/WT 與 MCF-7/ADR 中的分布情形。Merge 影像包含 DAPI staining 與一級抗體。Carl Zeiss 螢光顯微鏡擷取影像,比例尺=10 μm。
(A)
(B)
圖3- 蛋白
藉由 E-cad 基因
-2. MCF-7/
白質表現。
由即時定量 dherin、N-c 因和(B)蛋白質
/WT 與 MC
量-聚合酶連 cadherin 與
質表現量。
CF-7/ADR
連鎖反應法 vimemtin 在
。實驗結果
41
中E-cadh
法與西方墨 在MCF-7/W 果以三重複平
erin、N-cad
墨點法比較 WT (WT)與 平均值±標準
dherin 與 v
上皮-間葉 與MCF-7/AD
準差表示(*
vimentin 基
葉轉化標記 DR (ADR)的
**P<0.001) 基因與
記蛋白 的(A) )。
(A)
(B)
圖3-
藉由 Slug 量。
-3. MCF-7/
由即時定量-聚 與ZEB1 在 實驗結果以
/ADR 較 M
聚合酶連鎖 在MCF-7/W
以三重複平
MCF-7/WT
鎖反應法與 WT (WT)與 平均值±標準
42
過度表現上
與西方墨點法 MCF-7/AD 準差表示(**
上皮-間葉轉
法比較上皮 DR (ADR)的
**P<0.001)
轉化調控因
皮-間葉轉化調 的(A)基因和
。
因子。
調控因子S 和(B)蛋白質
Snail、
質表現