doi:10.6342/NTU201803374
國立臺灣大學生物資源暨農學院生物產業機電工程學系 碩士論文
Department of Bio-Industrial Mechatronics Engineering College of Bioresources and Agriculture
National Taiwan University Master Thesis
以小型肝細胞培養技術應用於肝臟晶片的開發 Liver-on-chip: Primary rat small hepatocytes in a
microfluidic platform 吳嘉浚
Chia-Chun Wu
指導教授:侯詠德 博士 Advisor: Yung-Te Hou, Ph.D.
中華民國 107 年 7 月
July 2018
doi:10.6342/NTU201803374 i
誌謝
不知不覺也加入實驗室也滿四年了,承蒙侯詠德老師的細心教導,從一開始 連 Pipette 都未曾使用,到現在學會且能使用一些生物分析的技術,老師一路上也 用心的幫助我們找尋各種資源,使我們對一些問題的的想法能夠真正的去嘗試,
並且不分晝夜的解決我們研究、人生上的問題。同時也由衷的感謝陳力騏老師、
鄭宗記老師及謝博全老師一路的照顧與提點,讓學生在研究過程中能藉由老師們 的指點少走冤枉路。此外要感謝 MOC 團隊在實驗上給予的建議與協助。特別感
謝劉承賢老師、陳惠玲老師、陳林祈老師、盧彥文老師出席學生的口試並給予論文
上的指導,使學生的論文能更完整。
謝謝 Biolan 的大家:砢皞學長、夢汝學姐、嘉晏學姐、大剛學長、哲宇學長、
慶育學長、 生機蕭敬騰 Tony 大木博士、俊諺、智方、林延、健一、心慈,一路 上的同舟共濟 (一起玩耍、互相傷害) 。謝謝成傳 11 的博鈞、柏睿、秀俊、俊寬、
博亘、甫浩在週末陪我打球及一同抱怨實驗上的不順利。謝謝成大醫工所的林莉 芳在實驗方法上給予的幫助 (雖然很常不讀不回) 。謝謝李胡丞一路上以一直給我 中肯且切中要害的建議。謝謝 B01 的大家讓 306 充滿溫暖的氣息 (什麼是 396 之友?) 。
在此感謝柯 p 市長於 2018 年 7 月 11 日沒有放颱風假,讓我有機會完成 我的口試。
最後,感謝我的家人,沒有你們的支持與照顧就無法完成這本論文,也希望 遠在另一方的嫲嫲、爸爸、細姑姐,能看到我有一點點成長,並期望在未來的我 能成為讓你們大家都放心的小孩。
吳嘉浚 謹誌 台灣大學生物產業機電工程學研究所 中華民國一○七年八月十五日
doi:10.6342/NTU201803374 ii
摘要
肝臟具備合成代謝解毒等功能,然而肝臟的 in vitro study 常受限於無法完全 長期評估體內情況,因此如何建立一個能精準模擬體內肝臟環境且能進一步作為 藥物/毒物檢測的體外平台是所有肝臟研究者的共同願景。
本研究擬以微流道系統 (Microfluidic system) 建立一個新型的 Liver-on-chip 的培養平台,並使用大鼠的小型肝細胞 (Small hepatocyte) 作為細胞來源,小型肝 細胞是肝臟前驅細胞 (Liver progenitor cell) 的一種,具有良好的分化與生存能力。
由實驗結果得知小型肝細胞在 2D 培養環境下會形成大小約為 300-400 μm 的肝 細胞聚落 (Colony) ,且肝細胞生存活性會由原本的 5-7 天提升至 3-4 周;另一 方面,以 Quantitative real-time PCR (qPCR) 方式進行基因表現檢測也發現小型肝 細胞的白蛋白 (Albumin) 表現量隨著培養時間上升約 3 倍,且 Follistatin (小型肝 細胞的 Marker) 隨著培養時間降低約 0.4 倍;而以次世代定序 (Next generation sequencing,NGS) 來進行基因表現檢測亦發現 Cytokeratin 18 (CK 18 ,成熟肝細 胞的 Marker) 及 Cytokeratin 19 (CK 19 ,具膽管分化的肝細胞的 Marker) 表現量 隨著培養時間皆升約 2 倍,且 Cluster of designation 44 (CD 44 ,小型肝細胞的 Marker) 降低約 7 倍;我們以免疫染色方式亦發現 CK18 之表現隨著培養時間上 升。以上結果都證實了小型肝細胞除能分化為成熟肝細胞之外亦能於體外培養的 環境下長時間維持其肝機能。
除了小型肝細胞的培養技術開發之外,本研究亦利用聚甲基丙烯酸甲酯 [(Poly(methyl methacrylate) ,PMMA] 開發一套僅需利用市售微波爐及雷射加工即 可製作供細胞培養的微流道系統,其製作方式不但簡單容易,且比起傳統以聚雙 甲基矽氧烷 [Poly(dimethylsiloxane) ,PDMS] 需花費 1~2 天才能製備而成的微流 道而言約,PMMA 的微流道製程可以大幅度縮減至僅需 3~4 小時即可從微流道 設計到微流道晶片實體完成;此外,我們亦成功於 PMMA 之微流道上來培養小 型肝細胞,而細胞生存率更相較傳統 2D 培養提升約 27 % 。
doi:10.6342/NTU201803374 iii
利用小型肝細胞以及 PMMA 作為肝臟晶片 (Liver-on chip) 平台的開發不但 製作簡單、亦具有潛力做為肝臟晶片之開發平台,相信也更能模擬真正的器官功 能,因此能幫助我們能在體外建立藥物於肝臟代謝後的毒理數據。我們之後更將 進一步對藥物,化學藥品和農藥於此肝臟平台進行安全性評估。相信這樣的技術 對於未來肝臟晶片的研究開發有著拋磚引玉之效。
關鍵字:肝臟晶片、微流道、小型肝細胞。
doi:10.6342/NTU201803374 iv
Abstract
The liver is an organ with vital functions, including energy storage, secretion protein synthesis, and especially metabolism of pharmaceutical drugs. However, in vitro studies of drug test are usually limited to precisely evaluate the real influences on hepatic tissue because it is an obstacle to develop a platform which can sophisticatedly mimic in vivo hepatic environment.
Thus, in this study we established a microenvironment-mimicking liver-on-chip (LOC) platform for in vitro hepatotoxicity test. Small hepatocytes, which have been identified in primary hepatocyte cultures with high potential for proliferation and differentiation into mature hepatocytes, was used as cell source for LOC platform. The result shows that small hepatocytes can survive in 2D primary cultures, and form 300-400 μm colonies for maintaining hepatocyte functions. Compared to primary hepatocytes, which normally maintain their function for about 7 days, small hepatocytes can survive at least 4 weeks. We analyzed the gene expression of small hepatocytes by q-PCR. Expression of albumin and Tryptophan 2,3-dioxygenase (marker of primary hepatocytes) are 3 times and 120 times increase, whereas Follistatin (marker of small hepatocytes) expression is 0.4 times decrease, after 2 weeks of culture. We also analyzed the RNA expression by NGS. The expression of CK18 and CK19 increase 2 times whereas CD44 decreases 7 times, after 2 weeks of culture.
On the other hand, poly(methyl methacrylate) was utilized to fabricate microfluidic devices. The substrates are patterned using the laser cutter, and bonded in a commercial microwave.Compared to the traditional PDMS fabrication process (usually needs 1~2 days), this bonding process is very simple and can therefore save more time (only 3~4 hours)). Besides, the viability of small hepatocytes in poly(methyl methacrylate)-microfluidic devices is 27% higher than that in 2D primary cultures.
doi:10.6342/NTU201803374 v
In summary, the small hepatocytes-derived liver-on-chip platform was successfully developed and therefore can simulate the real environment in model animals, and also build toxicology database and make safety assessment of drugs, chemicals and pesticides in the future.
Keyword:Live-on-chip, Microfluidic system, Small hepatocytes
doi:10.6342/NTU201803374 vi
目錄
致謝 ... i
摘要 ... ii
Abstract ... iv
目錄 ... vi
圖目錄 ... ix
表目錄 ... xiv
第一章 前言 ... 1
1.1 背景 ... 1
1.2 研究目的 ... 2
1.3 研究架構 ... 3
第二章 文獻探討 ... 4
2.1 藥物研發工程 ... 4
2.2 動物福利 ... 5
2.3 器官晶片 ... 6
2.4 肝臟功能及 Liver-on chip ... 7
2.5 肝前驅細胞 ... 10
2.6 Poly(dimethylsiloxane) 微流道系統 ... 10
2.7 PDMS 微流道系統應用於細胞培養 ... 12
2.8 PDMS 微流道系統應用於肝細胞培養 ... 16
2.9 Poly(methyl methacrylate)微流道系統 ... 21
2.9.1 PMMA 微流道系統製作 ... 21
2.9.2 PMMA 微流道系統黏合 ... 25
第三章 試驗設備與方法 ... 27
3.1 實驗藥品、耗材、儀器設備與實驗動物 ... 27
doi:10.6342/NTU201803374 vii
3.1.1 實驗藥品 ... 27
3.1.2 儀器設備 ... 28
3.1.3 實驗耗材 ... 28
3.1.4 實驗動物 ... 29
3.2 細胞懸浮液組成分析 ... 29
3.3 膠原蛋白修飾培養皿製備 ... 29
3.4 肝細胞採取與培養 ... 30
3.5 肝細胞於經光固化膠處理的 PMMA 上進行培養 ... 32
3.6 PMMA 微流道晶片製程及細胞培養 ... 33
3.7 實驗相關檢測方法 ... 34
3.7.1 免疫螢光染色 ... 34
3.7.2 白蛋白 (Albumin) 分泌量檢測 ... 34
3.7.3 Quantitative real-time PCR (qPCR) ... 35
3.7.4 尿素 (Urea) 分泌量檢測 ... 38
3.7.5 次世代定序 (Next generation sequencing, NGS) ... 38
第四章 結果與討論 ... 40
4.1 細胞懸浮液組成分析結果 ... 40
4.2 肝細胞培養結果 ... 41
4.2.1 利用不同分離步驟來採取小型肝細胞之比較 ... 41
4.2.2 小型肝細胞與成熟肝細胞於體外培養之型態比較 ... 43
4.3 活體螢光染色 ... 46
4.4 Quantitative real-time PCR ... 49
4.5 次世代定序 (NGS) ... 51
4.6 肝細胞之白蛋白分泌量 ... 52
4.7 肝細胞之尿素分泌量 ... 54
4.8 PMMA 微流道製作結果 ... 55
doi:10.6342/NTU201803374 viii
4.8.1 肝細胞於經光固化膠處理的 PMMA 上進行培養之結果 ... 55
4.8.2 PMMA 微流道表面處理結果比較 ... 56
4.9 小型肝細胞於 PMMA 微流道培養結果 ... 57
4.9.1 於不同濃度膠原蛋白修飾的微流道之培養結果比較 ... 57
4.9.2 以膠原蛋白修飾的培養皿與微流道之培養結果比較 ... 59
第五章 結論與未來展望 ... 60
5.1 結論 ... 60
5.2 未來展望 ... 62
參考文獻 ... 63
doi:10.6342/NTU201803374 ix
圖目錄
圖 1-1 肝細胞培養技術應用於 PMMA 肝臟晶片的開發之示意圖 ... 3
圖 2-1 藥物研究及發展步驟 (Evaluate Pharma, 2016) ... 4
圖 2-2 2015 年全球發展中藥物之管制階段 (Evaluate Pharma, 2016) ... 5
圖 2-3 Difference between Prodrug and Active Drug (CEPMED) ... 8
圖 2-4 A representation of the diffusion-based membrane pumping method for (A) applied pressure and (B) an applied vacuum (Eddings and Gale, 2006) . ... 11
圖 2-5 Overview of advantages and challenges of both macroscopic and microfluidic cell culture (Kim et al., 2007) . ... 15
圖 2-6 Microfluidic endothelial-like barrier properties (Lee et al., 2007) . ... 16
圖 2-7 The flowchart of U-shaped microstructure fabrication, cell trapping and spheroid formation (Fu et al., 2010) . ... 18
圖 2-8 Liver-cell patterning Lab Chip: mimicking the morphology of liver lobule tissue (Liu et al., 2013) . ... 19
圖 2-9 Long-term maintenance of a microfluidic 3D human liver sinusoid (Prodanov et al., 2016) . ... 20
圖 2-10 Schematic drawing of the hot embossing equipment and Replication of this structure in PMMA (The channels are 0.8 mm wide.) (Becker and Heim, 2000) . ... 21
圖 2-11 Room-temperature imprinting of microfluidic channels using silicon template, microscopic images of top view and cross section of an imprinted PMMA device (Xu et al., 2000) . ... 22
圖 2-12 Configuration of a direct-write laser machining system and SEM image of the cross-section of an unsealed laser machined microchannel (Cheng et al., 2004) . .. 23
圖 2-13 Schematic of the etching process and representative analysis of an etched channel by SEM (Brister and Weston, 2005) . ... 24
doi:10.6342/NTU201803374 x
圖 2-14 Picture of the bonding setup (a) PMMA channels with clips and alcohol, (b) PMMA and water placed in a commercial microwave just before bonding, (c) bonded
microfluidics (ethanol, 90 s) showing over 90% bonded area (Rahbar et al., 2009) . ... 26
圖 3-1 Two-step collagenase perfusion 示意圖 ... 32
圖 3-2 在 Dish 上的標記來固定位置觀察小型肝細胞之實際情況。 ... 32
圖 3-3 PMMA 微流道之設計 (單位:mm) 。 ... 34
圖 3-4 RNA 萃取步驟示意圖 (Kopec et al., 2017) 。 ... 36
圖 3-5 NGS 流程示意圖。 (Wang, Gerstein, and Snyder, 2009) ... 39
圖 4-1 小型肝細胞分離步驟之細胞懸浮液經 Cytocentrifuge 後在螢光顯微鏡下 所觀察的結果; (A) 、 (B) 為 CK18 下之染色結果; (C) 、 (D) 為 CK19 下 之染色結果。藍色:DAPI 為細胞核之染劑,綠色:CK18 為成熟肝細胞之 Marker , 紅色:CK19 為肝前驅細胞之 Marker。 (Scale bar = 100 μm) ... 40
圖 4-2 利用不同分離步驟來採取小型肝細胞並培養於 Dish 上之比較; (A) 為 Chen, Q 及其團隊之採取方式 (150 g、5 分鐘、4 oC,取上清液) 下培養 1 天之 結果, (B) 為 Chen, Q 及其團隊之採取方式下培養 3 天之結果, (C) 為 Chen, Q 及其團隊之採取方式下培養 5 天之結果; (D) 為本研究將 Chen, Q 的方法進行 調整後之採取方式 (150 g、5 分鐘、4 oC,取 cell pellet) 下培養 1 天之結果, (E) 為調整後之採取方式下培養 3 天之結果, (F) 為調整後之採取方式下培養 6 天 之結果,以上皆使用相位差顯微鏡所觀察的結果 (Scale bar = 200 μm) 。 ... 42
圖 4-3 肝細胞在 Dish 培養下使用相位差顯微鏡所觀察的結果; (A) 為培養 1 天的成熟肝細胞, (B) 為培養 3 天的成熟肝細胞, (C) 為培養 5 天的成熟肝細 胞, (D) 為培養 7 天的成熟肝細胞; (E) 為培養 1 天的小型肝細胞, (F) 為培 養 3 天的小型肝細胞, (G) 為培養 6 天的小型肝細胞, (H) 為培養 9 天的小 型肝細胞。 (Scale bar = 200 μm) 。 ... 44 圖 4-4 小型肝細胞在 Dish 長時間培養下,在相近位置 (如圖 3-2 所示) 使用相 位差顯微鏡所觀察的結果; (A) 為培養 1 天的小型肝細胞, (B) 為培養 3 天的
doi:10.6342/NTU201803374 xi
小型肝細胞, (C) 為培養 6 天的小型肝細胞, (D) 為培養 9 天的小型肝細胞,
(E) 為培養 12 天的小型肝細胞, (F) 為培養 15 天的小型肝細胞, (G) 為培養 18 天的小型肝細胞, (H) 為培養 21 天的小型肝細胞, (I) 為培養 24 天的小型 肝細胞。(Scale bar = 500 μm) ... 45 圖 4-5 為小型肝細胞在 Dish 下培養 12 及 35 天,分別以相位差顯微鏡以及螢 光顯微鏡所觀察之結果; (A) 為培養 12 天的小型肝細胞在相位差顯微鏡下之觀 察結果, (B) 為培養 35 天的小型肝細胞在相位差顯微鏡下之觀察結果, (C) 為 培養 12 天的小型肝細胞在螢光顯微鏡下之觀察結果, (D) 為培養 35 天的小型 肝細胞在螢光顯微鏡下之觀察結果。藍色:DAPI,綠色:NucGreen® Dead reagent。
(Scale bar = 100 μm) 。 ... 47 圖 4-6 為小型肝細胞在 Dish 下培養 1、3、8、15 天後分別於相位差顯微鏡及 螢光顯微鏡所觀察的結果; (A) 為培養 1 天的小型肝細胞在相位差顯微鏡下之觀 察結果, (B) 為培養 3 天的小型肝細胞在相位差顯微鏡下之觀察結果, (C) 為 培養 8 天的小型肝細胞在相位差顯微鏡下之觀察結果, (D) 為培養 15 天的小型 肝細胞在相位差顯微鏡下之觀察結果; (E) 為培養 1 天的小型肝細胞在螢光顯微 鏡下之觀察結果, (F) 為培養 3 天的小型肝細胞在螢光顯微鏡下之觀察結果, (G) 為培養 8 天的小型肝細胞在螢光顯微鏡下之觀察結果, (H) 為培養 15 天的小型 肝細胞在螢光顯微鏡下之觀察結果; (I) 為培養 1 天的小型肝細胞於兩種顯微鏡 觀察結果之組合, (J) 為培養 3 天的小型肝細胞於兩種顯微鏡觀察結果之組合,
(K) 為培養 8 天的小型肝細胞於兩種顯微鏡觀察結果之組合, (L) 為培養 15 天 的小型肝細胞於兩種顯微鏡觀察結果之組合。藍色:DAPI,綠色:CK18。 (Scale bar = 100 μm) ... 48 圖 4-7 小型肝細胞於培養於 Dish 上 3、7、15 天後的 Quantitative real-time PCR 結果; (A) 為小型肝細胞隨著培養時間增加後 Albumin (肝機能) 的 RNA 表現之 結果, (B) 為小型肝細胞隨著培養時間增加後 Follistatin (小型肝細胞之 Marker) 的 RNA 表現之結果, (C) 為小型肝細胞隨著培養時間增加後 CYP1A2 (肝機能)
doi:10.6342/NTU201803374 xii
的 RNA 表現之結果, (D) 為小型肝細胞隨著培養時間增加後 Tryptophan 2,3-dioxygenase (小型肝細胞的 Marker) 的 RNA 表現之結果。 (*:p < 0.05,**:
p < 0.01,***:p<0.001 significant difference vs. Day3) ... 50 圖 4-8 小型肝細胞於培養於 Dish 上 7、14 天後的次世代定序的結果。 ... 51 圖 4-9 成熟肝細胞與小型肝細胞於 Dish 上隨著培養時間的白蛋白分泌量之變 化情況。 (*:p < 0.05,**:p < 0.01 significant difference vs. small hepatocyte at Day1;
++:p < 0.01,+++:p<0.001 significant difference vs Mature hepatocyte at Day1) . 53 圖 4-10 成熟肝細胞與小型肝細胞於 Dish 上隨著培養時間的增加,其尿素分泌 量之變化情況。 ... 54 圖 4-11 為成熟肝細胞在不同 PMMA 黏合材料下培養 1 天,以相位差顯微鏡所 觀察之結果; (A) 塗有光固化膠的 PMMA 上培養 1 天的小型肝細胞在相位差顯 微鏡下之觀察結果, (A) 無處理的 PMMA 上培養 1 天的小型肝細胞在相位差顯 微鏡下之觀察結果。 (Scale bar = 200 μm) ... 55 圖 4-12 為 PMMA 微流道表面處理前後,以相位差顯微鏡所觀察之結果; (A) 未經 Acetone/Ethanol 前處理的 PMMA 微流道在相位差顯微鏡下之觀察結果,
(B) 經 Acetone/Ethanol 前處理的 PMMA 微流道在相位差顯微鏡下之觀察結果。
(Scale bar = 500 μm) 。上述的結果均只有 PMMA 微流道的型態觀察而無任何細 胞種植於上。 ... 56 圖 4-13 為小型肝細胞在修飾不同濃度的膠原蛋白濃度 PMMA 流道下培養 1 天,分別以相位差顯微鏡以及螢光顯微鏡所觀察之結果; (A) 為修飾 0.1 mg/mL 的膠原蛋白的 PMMA 微流道上培養 1 天的小型肝細胞在相位差顯微鏡下之觀 察結果, (B) 為修飾 0.3 mg/mL 的膠原蛋白的 PMMA 微流道上培養 1 天的小 型肝細胞在相位差顯微鏡下之觀察結果, (C) 為修飾 0.1 mg/mL 的膠原蛋白的 PMMA 微流道上培養 1 天的小型肝細胞在螢光顯微鏡下之觀察結果, (D) 為修 飾 0.3 mg/mL 的膠原蛋白的 PMMA 微流道上培養 1 天的小型肝細胞在螢光顯 微鏡下之觀察結果。藍色:DAPI,綠色:NucGreen® Dead reagent。 (Scale bar = 200
doi:10.6342/NTU201803374 xiii
μm) 。 ... 58 圖 4-14 為小型肝細胞在 Dish 及 PMMA 流道下培養 1 天,分別以相位差顯微 鏡以及螢光顯微鏡所觀察之結果, (A) 為 Dish 上培養 1 天的小型肝細胞在相位 差顯微鏡下之觀察結果, (B) 為 PMMA 流道上培養 1 天的小型肝細胞在相位差 顯微鏡下之觀察結果, (C) 為 Dish 上培養 1 天的小型肝細胞在螢光顯微鏡下之 觀察結果, (D) 為 PMMA 流道上培養 1 天的小型肝細胞在螢光顯微鏡下之觀察 結果。藍色:DAPI,綠色:NucGreen® Dead reagent。 (Scale bar = 100 μm) 。 59
doi:10.6342/NTU201803374 xiv
表目錄
表 2-1 Historical background of animal cell culture (Nema and Khare, 2012) . ... 13 表 2-2 Basic requirements for cell culture, and improvements when microfluidic methods are used (Mehking et al., 2014) . ... 15 表 3-1 Quantitative real-time PCR 所使用之引子序列。 ... 37
doi:10.6342/NTU201803374 1
第一章 前言
1.1 背景
肝臟是人體最重要的器官之一,具備了蛋白質合成、營養物質的代謝及氨等 化合物的解毒功能 (Hou et al., 2012) ,然而肝臟的基礎研究往往受限於無法完全 模擬體內的情況,最終仍須進行大量的動物實驗來得以佐證,因此如何在減少動 物實驗及人體實驗的前提下,建立一個能精準模擬體內環境的藥物/毒物檢測平台 相信是所有人類的共同願景 (Rajendran et al., 2017) 。
現今發展的肝臟晶片 (Liver-on-chip,LOC) 已行之有年,有團隊利用微流道 系統 (Microfluidic system) 仿微血管結構以模擬肝臟細胞在體內所受流體壓力及 擴散狀態 (Lee et al., 2007) ,亦有另外的團隊利用 U-shape 的設計將肝細胞三次元 球 (Spheroid) 限制在流道內進行 3D 培養 (Yu et al., 2010) ,除此之外,也有研 究團隊在流道上進行肝細胞三次元球與內皮細胞的共培養 (Yamada et al., 2012) 。 而在 2016 年 Ljupcho P. 與團隊更進一步利用雙層微流道來模擬肝臟內不同種類 的細胞在體內的分佈情況 (Prodanov et al., 2016) ,這樣的創新做法使一般認知無 法在體外培養 (in vitro cultures) 中有辦法長時間生存的初代肝細胞 (Primary hepatocyte) ,有可能在適當的體外流道培養環境下仍能維持至少四週的生存活性 及機能。然而,微流道的多層設計及不同種類細胞的共培養都有其一定的製作及 培養上的困難性,應而侷限了肝臟生物晶片在學界及產業界被大力推廣的可能 性。
doi:10.6342/NTU201803374 2
1.2 研究目的
為了克服肝臟的基礎研究往往受限於無法完全模擬體內的情況、且多層微流 道製作之困難,本研究擬以單層微流道系統建立一個新型的 Liver-on-chip 的肝細 胞培養平台,期望能建立一個更能符合體內環境,且能長時間培養的生物測試平 台來提高藥物/毒物快篩靈敏度。
目前發展的肝臟生物晶片,所使用的細胞來源主要是肝癌細胞株 (Liver hepatocellular cells,HepG2) 及初代肝實質細胞 (Primary hepatocyte) ,然而肝癌 細胞株無法真實模擬肝臟機能 (Wilkening, Stahl and Bader, 2003) ;而初代肝實質 細 胞 在 體 外 培 養 亦 會 隨 著 時 間 而 逐 漸 失 去 其 肝 臟 細 胞 的 特 性 , 最 後 更 因 為 Epithelial-mesenchymal transition (EMT) 的機制,使初代肝細胞去分化而成為纖維 細胞 (Fibroblast) (Choi and Diehl, 2009; Zeisberg et al., 2007) ,因此初代肝細胞一 般認為無法在體外進行長時間的培養。小型肝細胞 (Small hepatocyte) 被認為是肝 臟前驅細胞 (Liver progenitor cell) 的一種,其分化過程介於肝臟卵母細胞 (Liver oval cell) 與初代肝細胞之間 (Chen et al., 2013; Shilbata et al., 2006; Mizuguchi et al., 1998) 。有文獻指出小型肝細胞在體外培養時,會先形成扁平的聚落 (Colony) 形式,之後細胞聚落會開始向上堆積並擁有初代肝細胞之外觀,且能在體外表現 類 似 於 體 內 所 見 的 肝 功 能 如 蛋 白 質 生 產 (Albumin synthesis) 和 膽 紅 素 代 謝 (Bilirubin metabolism) 等 (Ishii et al., 2017) 。小型肝細胞不但可以分化成具有膜極 性,分泌能力和運動性的初代肝細胞,亦能增殖且在體外的長時間培養環境下維 持機能,因此被認為是用於肝組織重建的合適細胞來源 (Avril et al., 2004; Mitaka et al., 1995) 。
因此,本研究希望就目前藥物研發及測試之需求,嘗試以小型肝細胞來建立 更貼近生理下肝臟功能之器官晶片。
doi:10.6342/NTU201803374 3
1.3 研究架構
本研究第一步先以小型肝細胞作為初步研究對象,確認以論文之方式採集之 細胞為小型肝細胞後,之後再進一步確認小型肝細胞相較於成熟肝細胞在進行體 外培養的機能及活性有較高的表現,且有更長的細胞機能的維持時間。另一方面,
我們擬嘗試以 PMMA 微流道,而非一般所使用的 PDMS 微流道系統,作為肝臟 細胞的培養平台,因 PMMA 製程步驟相較 PDMS 更來的簡單快速。此外,本研 究亦針對 PMMA 微流道之製作方式進行探討並測試 PMMA 之對細胞生長是否 有影響,最後將細胞於 PMMA 微流道上進行培養,並檢測其肝細胞生存率與肝 機能,並與其於 Dish 上培養之結果進行比較。
圖 1-1 肝細胞培養技術應用於 PMMA 肝臟晶片的開發之示意圖
doi:10.6342/NTU201803374 4
第二章 文獻探討
2.1 藥物研發工程
藥物研發工程一直在醫學及衛生安全上扮演著為目前已知疾病來研發預防和 治療的藥物及疫苗,進而改善病人的治療品質。而藥物研發工程的成效取決於為 了常見、複雜和被忽視的疾病來創新預防和治療的方式,並進一步修正現有治療 方法。但是其研發所需要的時間、金錢甚至承擔的風險都要較大多科技行業來得 高。有研究統計,研究人員平均需 5000-10,000 次的測試才有可能篩選出具有潛 力作為藥物的化合物 (Evaluate Pharma, 2016) ,之後要接著對該化合物不斷的在 動物及人體上進行測試,以確保其功效和安全性,然而這一過程可能耗費 10 至 15 年的時間 (圖 2-1) (Evaluate Pharma, 2016) 。事實上,從有潛力作為藥物的化 合物到最終真正能成為產品的成功率並不高,舉例而言,2015 年成功上市的新藥 物有 56 種,但同年有超過 7000 種的化合物在進行不同階段的藥物測試 (圖 2-2) (PhRMA, 2017) ,而這兩數字的差異凸顯了在有潛力作為藥物的化合物確認成為 安全有效的藥物之前,需要克服的許多研究障礙。
圖 2-1 藥物研究及發展步驟 (Evaluate Pharma, 2016)
doi:10.6342/NTU201803374 5
圖 2-2 2015 年全球發展中藥物之管制階段 (Evaluate Pharma, 2016)
另外一方面,動物模型 (Animal models) 一直在藥物研發中扮演重要的角色。
新藥在進行研發時,常利用動物模型建立其對特定部位疾病的評估並檢視其療效,
並進一步記錄安全劑量和致毒性在臨床上的反應,以預測臨床試驗時人體給藥和 藥物的安全性 (PhRMA, 2017) 。然而,動物模型之使用時機及方式隨動物福利之 觀念上漲而逐漸受到世人的重新審視。
2.2 動物福利
動物福利泛指動物的生活品質,其內涵包括:動物的健康、餵食是否足夠和 安全舒適的環境,使動物本身不會感受壓力、恐懼和痛苦。而大眾對動物福利的 關注從防止野生動物的濫捕、圈養動物被殘暴對待,慢慢擴大至於科學中動物模 型的使用,因此學界為改善動物模型之使用,明確採用一套指導動物使用時倫理 評估的原則。這就是「三Rs」原則:分別為取代 (Replacement) 、減少 (Reduction) 和優化 (Refinement) (McGonigle et al., 2014) 。其原則為當研究者在無法找出非動 物性替代物時,才能使用動物,並且當需要動物時,要採用人道的方法且能獲得
有效信息所需的最少數量的動物。「取代」的意義為避免或以其它替代方式來取代
doi:10.6342/NTU201803374 6
動物實驗,方法包括 (1) 絕對取代:用無生命系統取代動物模型,如計算機程序;
和 (2) 相對取代:以目前科學證據表明具有較低疼痛感知潛力的動物 (如某些無 脊椎動物) 取代較有知覺的意動物 (如脊椎動物) 。「減少」是指採用任何手段以 較少的動物使用而能獲得足夠的數據來回答研究問題,或最大限度地利用每隻動
物得到的信息,從而避免隨後使用額外的動物。「優化」是指修改實驗程序,以盡
量減少痛苦,且提高從出生至犧牲時的照護 (Fenwick et al., 2014) 。
2.3 器官晶片
隨著動物福利意識的抬頭,以及現有的動物模型及體外細胞測試往往與實際 臨床結果的不一致的情況之下,使得藥物研發工程最後常導致成本上漲以及效率 下降,因此各方研究者都對新的測試方法有迫切需求,以期能產生對人類藥物功 效和安全性的可靠預測。近年來,微製程細胞培養模型的建立開發提供了一種新 型的解決方案,這類模型利用微加工和微流道技術,以高三維精確度控制細胞微 環境來重現體內環境,以期待利用晶片來培養細胞時能重現多種細胞間的信號傳 遞。而這類微型培養模型的發展,我們統稱為器官晶片 (Organ-on-chip) ,目的是 在微型的晶片上能重現人體器官的複雜結構、微環境和生理功能 (Esch et al., 2015) 。器官晶片通常具有人類器官的關鍵功能,它們是以具透明性質之聚合物為 材料製作出微米等級之通道,並在此通道內排列體細胞以模仿活體器官的三個重 要特徵,包括: (1) 多種組織組成的立體微結構、 (2) 組織—組織之界面環境及 (3) 器官特異性之生化微環境 (Huh et al., 2011) 。近年來,這類仿生微系統模型已被 用於重現功能複雜性的人體器官如肝臟、心臟,肺和骨骼 (Huh et al., 2012) 。
而其較傳統的平面培養 (單層培養) 的相比,器官晶片由於是利用微製程來真 實模擬體內組織結構,因此可以增長細胞在體外培養之存活時間及增強其機能 (Halldrorsson et al., 2015) ,以下為一些利用微製程技術嘗試在體外環境下再現器 官結構之例子:如 Lee 的研究團隊利用流道壁上製造微小之通透孔使培養基僅能
doi:10.6342/NTU201803374 7
藉有小孔通過至細胞端,以模擬血管壁或細胞緊密排列使物質較不易傳輸造成屏 障 (Lee et al., 2007) ,此微流道晶片培養的方式較平面單層細胞培養更能準確地模 擬體內環境,這是因為藥物化合物在體內需經血管屏障才能遞送至目標組織 (Stella, 2004) 。另外一方面,亦有研究控制晶片內培養基之流動或腔室的收縮,
以在體外能夠再現由生理流動 (如血流) 或組織收縮 (如肺部、肌肉) 所造成的各 種類型之機械應力,這些應力包括流體剪切應力,張力,壓縮和扭矩等 (van der Meer et al., 2012; Esch et al., 2015) 。
此外,動物模型雖然比起在體外細胞層級下所進行的測試能更有效地模擬藥 物在實際生理上的反應情況,但由於疾病途徑和疾病誘導的基因變化存在著物種 間差異,使得人類疾病於實驗動物上的反應與其在人類上之反應之間,有著相當 的不一致性 (Seok et al., 2013) 。而現今的器官晶片研究之所以普遍受到重視,除 了因為晶片本身的透明性和容易從特定組織類型中進行採樣之外,微流道高通量 的設計更讓這個平台具備減低成本以及大量且即時檢測的優勢,這樣的方式相信 更能有助於鑑定新的藥物功效、毒性或了解藥物/毒物於特定部位之細胞代謝過程。
除此之外,為了讓器官晶片比起動物模型更能符合人體真實生理情況,人類初代 細胞為一最理想的細胞來源,因其能更精準的預測藥物在人體中的藥物動力學。
但其主要問題為缺少細胞捐贈者及培養所需的成本較高,因此目前細胞系 (Cell line) 及動物初代細胞 (Animal primary cells) 仍為主要的細胞來源 (Kimura, Sakai and Fujii, 2017) 。
2.4 肝臟功能及 Liver-on chip
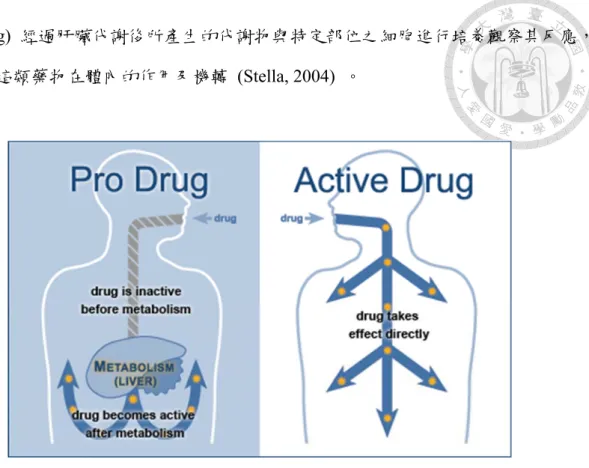
肝臟為一功能複雜的器官,具有儲存能量、合成分泌性蛋白等功能,也是人 體中大多藥物及毒物代謝之場所 (Park and Lee, 2005) 。因此對藥物開發而言,若 能在體外建立一套能精準模擬體內代謝系統之 Liver-on chip ,除了能初步了解一 般藥物 (Active drug) 對特定細胞是否具有毒性之外,更能進一步能了解前驅藥物
doi:10.6342/NTU201803374 8
(Prodrug) 經過肝臟代謝後所產生的代謝物與特定部位之細胞進行培養觀察其反應,
以瞭解這類藥物在體內的作用及機轉 (Stella, 2004) 。
圖 2-3 Difference between Prodrug and Active Drug (CEPMED)
不論是 Active drug 或是 Prodrug ,這些口服藥物進到體內後都會藉由肝門 循環進到肝臟 (Pang, 2007) 。而肝臟代謝最終目的為將親脂性化合物轉化為較為 親水性使其方便排出。其機轉可分為 Phase I、Phase II。Phase I 最常見的代表是 CYP450 家族,其重要的作用為親脂性化合物的甲基團經烴化作用後,轉化為較 溶於水之代謝物, (Almazroo et al., 2017) 其催化之反應式為:
NADPH H O RH ⎯⎯⎯⎯ NADP H O ROH
Phase II 又稱作接合反應,按照需代謝物之種類,將特定之化合物接合至需代 謝的物質上,使這些代謝物水溶性更高而且更容易被排泄。Phase II 反應包含:葡 萄糖醛酸接合 (Glucuronide conjugation) 、硫酸接合 (Sulfate conjugation) 、甲基 化 (Methylation) 、乙醯化 (Acetylation) 、氨基酸接合 (Conjugation with Amino Acids) 及穀胱甘肽接合 (Glutathione conjugation) (Almazroo et al., 2017) 。
為了達到與生理上的肝臟有相似之功能,Liver-on chip 擬利用微製程方式來
doi:10.6342/NTU201803374 9
模擬肝臟微環境,且按照體內實際情況之分布將肝實質細胞 (Parenchymal liver cells,Hepatocyte) 與非實質細胞 (Non-parenchymal liver cells) 在晶片上排列以達 到更好之共培養效果 (Lee et al., 2015) 。而目前 Liver-on chip 之研究除了圍繞著 (1) 如何將細胞排列,例如利用微製程做出柱狀結構並在柱頂上修飾特定材料,再 以蓋章 (Stamps) 的方式在同一平面不同位置上,來印上不同材料來使不同細胞貼 附 (Khetani et al., 2008) 、或是使細胞在緩衝液中使其帶電再利用外加電場使其貼 附排列 (Ho et al., 2006) ;及 (2) 模擬肝臟內之微結構如:仿微血管結構 (Lee et al., 2007) 、或利用雙層流道模擬肝臟內不同種類的細胞在體內的分佈情況 (Prodanov et al., 2016) ;此外,也嘗試 (3) 利用三次元細胞球以增加細胞間的交互溝通 (Yu et al., 2010) 。
由上段的既往文獻可知, Liver-on chip 主要目的是模仿人類肝臟功能,希望 能在不依賴於臨床試驗即可得知肝臟對內源性及外源性因素的反應。因此以人類 肝細胞作為晶片之細胞源是最終目的,因為只有人類肝細胞才能依賴於真正的人 類肝臟的反應,但人類正常肝細胞的來源取得不易也侷限了其應用性。另外一方 面,動物的初代肝細胞 (如 Rat primary hepatocytes) 和細胞系 (如 HepG2) 由於 取得容易且易於培養及觀察,這兩種細胞雖不能完全表現出與人類肝細胞相同的 特徵,但仍能表現一部份正常肝細胞的基因型特徵,且其表型亦較穩定 (Phenotypic stability) (Wilkening, Stahl and Bader, 2003) ,因此也普遍為研究者所使用。然而初 代肝細胞在體外的機能會隨培養時間而降低 (van der Meer et al., 2012);而細胞系 之細胞由於伴隨著某些基因缺陷,且與初代肝細胞相比代謝能力較低,使其僅適 用於對不需代謝即具有毒性之分子來進行劑量測試,但不適合 Prodrug 類藥物之 毒性測試,這些困難點都使得這兩種細胞在直接做為肝臟晶片的細胞來源時,會 造成研究進展的障礙 (Gerets et al, 2012) 。因此,幹細胞研究的蓬勃發展便有可能 為上述的問題提供了解決的方案,人類誘導性多能幹細胞 (Induced pluripotent stem cell,iPSCs) 及肝前驅細胞 (Liver progenitor cells) 為目前較有希望的幹細胞來源,
因它們可以大量的分化細胞而較不違反倫理學 (Yu et al, 2007) 。然而,從體細胞
doi:10.6342/NTU201803374 10
反轉化為 iPSCs 良率不高,此外,其分化過程亦需要良好控制否則可能在培養時 分化為非目標細胞,因此綜合而言效率仍低於一般肝前驅細胞 (Lee et al., 2015) 。 因此,本研究的一個重要途徑即為優化肝細胞來源,以作為 Liver-on chip 的潛在 細胞來源應用。
2.5 肝前驅細胞
由於目前肝前驅細胞分化的效率和功能仍高於 iPSCs (Lee et al., 2015) ,因而 是一個相對較優勢的潛在細胞來源。肝前驅細胞目前研究指出有卵圓細胞 (Oval cells) 和小型肝細胞兩種,兩者皆具有分化為成熟肝細胞及膽管細胞之能力 (Chen et al., 2013) ,其中有研究指出卵圓細胞在許多不同的損傷模型中, Canals of Hering 會被活化並開始遷移到肝葉 (Hepatic lobules) 中並分化 (Fausto et al., 2003) ;另外一方面,小型肝細胞目前被指出會出現於囓齒動物且亦具有增殖能力,
此外,與卵圓細胞不同的是,小型肝細胞在採集步驟中可不需先對肝臟進行損傷 處理 (Chen et al., 2007) ,而幾項證據也表明小型肝細胞不會從卵圓細胞中產生 (Gordon et al., 2000) 。小型肝細胞培養形態為細胞聚落 (Colony) ,聚落的形成是 起源於單細胞,並體外在培養 8-10 天後組成約 30-40 個細胞之堆疊。而其聚落 表現之細胞型態與成熟肝細胞相似,皆以多邊形形狀貼附於平面生長,但兩細胞 之間的大小仍有所不同 (Ishii et al., 2017) 。
因此,本研究欲利用囓齒動物中相較卵圓細胞易取得、且亦有肝前驅細胞特 性之小型肝細胞做為細胞源,來建立一套 Liver-on chip 測試平台,並確認其與體 內肝細胞之功能表現差異。我們之後會進一步證實以肝前驅細胞作為細胞來源之 Liver-on chip 的效用,期待能將肝前驅細胞應用於晶片上。
2.6 Poly(dimethylsiloxane) 微流道系統
微流道系統 (Microfluidic system) 根據 George Whitesides 將其定義為 “It is
doi:10.6342/NTU201803374 11
the science and technology of systems that process or manipulate small (10–9 to 10–18 liters) amounts of fluids, using channels with dimensions of tens to hundreds of micro meters.” (Whitesides, 2006) 。微流道系統應用於生化分析上的優勢為:只需少量的 樣品及反應試劑、具有高靈敏度、本體體積小且從發想設計到實際做出原型所需 的時間短 (可在 2 天內做出一原型晶片) (Whitesides, 2006) 。微流道系統最初製 作用之材料多為玻璃及矽,但其材料之特性如矽在可見光和紫外光波段下並不透 明,使得一般光學檢測方式較難進行;此外,由於玻璃及矽的材質質地較為堅硬,
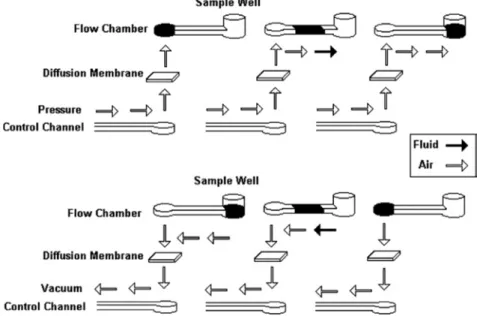
因此較難在其設計上做出一些微分析系統所需的彈性組件,如幫浦、閥門等。為 了克服上述缺失,有研究團隊開始使用高分子材料做為微流道系統之基材,又其 中以 Poly(dimethylsiloxane) (PDMS) 較被廣泛使用。其材料特性為光學透明,此 外,相較於傳統玻璃及矽材料更具有彈性,使其能藉微流道本身設計、多層結構 和導入流體的種類 (氣體或液體) 可組合建構出管道、幫浦、閥門及混合器等 (圖 2-4) ,使微型生化「工廠」濃縮在一片晶片上可行的。
圖 2-4 A representation of the diffusion-based membrane pumping method for (A) applied pressure and (B) an applied vacuum (Eddings and Gale, 2006) .
doi:10.6342/NTU201803374 12
而有足夠的製造方法和組件後,微流道系統的建立就有潛力為基礎/應用問題 尋找可能的解決方式,而不再僅僅是為了原理示範或是單純技術的展示。目前的 微流道技術已普遍應用如:篩選蛋白質結晶的條件 (如 pH,離子強度和組成,助 溶劑和濃度) 、高通量之方式篩選開發中的藥物、檢查和操作由單個細胞或單個分 子組成的樣品以及用於合成正電子發射斷層掃描所需之 18 F- 標記的有機化合物 等 (Whitesides, 2006) 。
2.7 PDMS 微流道系統應用於細胞培養
細胞培養是在實驗室的環境中模仿真實體內環境 (如 pH, CO2, 溫度等) ,使 得 細 胞 於 體 外 培 養 時 的 機 能 、 活 性 及 型 態 能 夠 重 現 如 體 內 的 生 長 狀 況 (Halldrorsson et al., 2015) 。而目前主流使用的體外培養平台為 Petri dish,這是於 1887 年由 J. R. Petri 將 Robert Koch 所使用之培養細菌之系統進行改良,Robert Koch 之系統架構為將細菌和明膠培養基一起倒在一玻璃板上後,再蓋上一玻璃鐘 型外罩,最後加熱整個系統以供培養菌落,但其缺點為在顯微鏡下不易觀察 (Roberts, 2014) ;因此 J. R. Petri 將原 Robert Koch 之培養系統改良為一直徑 10-11 cm,深約 1-1.5 cm 之玻璃圓盤,其上蓋為一尺寸稍大的玻璃圓盤,其優點 為操作時打開部份蓋子即可進行溶液的吸取,此外,玻璃圓盤加入溶液後相較玻 璃板可以更容易利用搖晃之方式使其溶液分佈更為均勻 (Perti, 1887) 。而 1907 年 R. G. Harrison 成功在體外利用無菌操作來培養蛙類旳胚胎神經組織,並以蛙類 自身之淋巴液作為培養基。培養方式是利用懸滴法 (將組織及培養基放置於蓋玻片 上,再其覆蓋於一有凹洞玻片之上,並封上蠟膜) ,在這樣的培養環境下,組織大 多能存活一至兩週,藉由觀察其神經突起發展過程奠定細胞體外培養的基礎。此 外,R. G. Harrison 亦發現在培養過程中胚胎神經組織有可能使其分化 (Harrison, 1910) 。另外, 1912 年 A. Carrel 在無菌操作之下培養心肌細胞及間質細胞,藉 由定時更換培養基方式成功繼代上述之初代細胞且觀察其型態 (Carrel, 1912) (表
doi:10.6342/NTU201803374 13
2-1) 。由上述過往的研究得知, (1) 靜止式培養; (2) 定時更換合適的培養基 (含 有固體或液體形式的混合物) ; (3) 於培養皿中能穩定保持細胞存活或分化,為 目前實驗性細胞生物學研究的主流 (Nema and Khare, 2012) 。
表 2-1 Historical background of animal cell culture (Nema and Khare, 2012) .
Year Significant work Scientist
1885 Maintained embryonic chick cells in a saline culture Roux 1897 Demonstrated the survival of cells isolated from blood and
connective tissue in serum and plasma
Loeb 1907 Cultivated frog nerve cells in a lymph clot held by the “hanging
drop” method and observed the growth of nerve fibers in vitro for several weeks
Harrisone
1911 First liquid media consisted of sea water, serum, embryo extract, salts and peptones
Lewis and Lewwis 1916 Proteolytic enzyme trypsin for the subculture of adherent cells Rous and
Jones 1923 T-flask as the first specifically designed cell culture vessel Carrel and
Baker 1948 Isolated mouse l fibroblasts which formed clones from single
cells
Earle 1949 Polio virus could be grown on human embryonic cells in culture Enders 1952 Continuous cell line from a human cervical carcinoma known as
hela (helen lane) cells
Gey
1955 Nutrient requirements Eagle
1964 Hat medium for cell selection Littlefield
而 PDMS 微流道系統亦開始用於細胞培養上,其應用和一般微流道系統相同,
是在微尺度下開發用於培養、維持、分析細胞實驗之設備和技術 (Hallforsson et al., 2015) 。相較一般以較宏觀方式 (Dish 培養方式) 進行細胞培養而言,微流道系統 能控制且改變微環境以影響其細胞之表型。微流道系統中可利用控制層流流速等,
使其改變微流道中細胞所受之剪切應力 (表 2-2) ;且不同層流間不具對流之特性,
使微流道系統可在細胞或亞細胞尺度下同時輸送多種可溶性分子,因此在體內有
doi:10.6342/NTU201803374 14
較高灌流 (Highly perfused) 之器官/組織,如肝臟和腎臟,在微流道系統下培養可 以更準確地模擬在其生物微環境中細胞與微血管網絡之緊密連結。而在微流道中 培養亦可藉由持續控制供應/移除培養液來確保微環境實驗因子和營養長期的穩定,
相比之下,靜態培養中可溶性實驗因子和營養等會隨著培養時間而被部份消耗,
因此無法提供細胞培養的長期穩定性 (圖 2-5) (Kim et al., 2007) 。
微流道系統的另一優勢為其設計具有較高之靈活性,可以根據個體細胞類型 的需求進行設計並測試;且以微流道系統來培養細胞,可將細胞的使用量大幅降 低至幾百個細胞甚至單個細胞 (一般培養皿下細胞培養大多含有 104-107 個細 胞) ,進而有可能捕獲單個細胞之資訊。例如,可通過控制單一細胞的附著和移動 更容易測量及觀察細胞運動中的動力學及機械特性 (Hallforsson et al., 2015) 。
在近幾年中,美國國家衛生研究院 (NIH) 、食品與藥品管理局 (FDA) ,歐 盟架構計畫 (FP7) ,及日本醫療研究開發機構 (AMED) 都開始針對微流道系統所 建立之細胞晶片的研究投入大量的研究經費,也顯示世界各國對這類晶片的發展 跟未來的應用具有高度之期望 (Wikswo et al., 2013) 。
doi:10.6342/NTU201803374 15
表 2-2 Basic requirements for cell culture, and improvements when microfluidic methods are used (Mehking et al., 2014) .
Requirements Conventional cell culture Microfluidic cell culture Control of temperature and
gasses
Large fluid volumes prevent fast changes
Small volumes allow dynamic control Addition of nutrients and
removal of metabolites
Infrequent, manual
exchange of large volumes
Precisely measured, continuous or transient exchange of media Stimulation with
drugs/proteins and simultaneous imaging
Mostly not feasible Feasible
Parallelization of cellular assays
Not feasible High capability for parallelization Automation of cell culture
tasks
Bulky, expensive
fluid-handling robots must be used
High capability for automation in compact, inexpensive format Single-cell manipulation
and analysis
Manually involved,
inaccurate, low throughput
Accurate and high-throughput
圖 2-5 Overview of advantages and challenges of both macroscopic and microfluidic cell culture (Kim et al., 2007) .
doi:10.6342/NTU201803374 16
2.8 PDMS 微流道系統應用於肝細胞培養
2007 年 Philip J. Lee 的團隊利用微流道結構來模擬體內養份的供給路徑: 養 分會先經過肝竇內皮細胞屏障後,才到達成熟肝細胞的情形 (圖 2-6) 。因此其微 流道之設計初代肝細胞培養通道為 50 × 30 × 300 μm,而屏壁間寬 2 μm,其供 培養基之擴散之孔隙為 1 × 2 μm,流速為 10 nL/min,此流動擴散系統可使初代 肝細胞即便在沒有修飾膠原蛋白之流道表面下培養 7 天後仍能維持 94 ± 15 % 之生存率。其後,P. J. Lee 團隊利用此微流道系統測試雙氯芬酸 (Diclofenac,為 一發炎抑制劑) 之肝毒性,結果顯示在加入藥品並培養 4 小時後對肝細胞並沒有 顯著的肝毒性,但在藥物作用 24 小時後其 IC50 為 334 ± 41 µM。此研究成功以 微米級培養系統來模擬肝血竇之質量傳遞性質,如組織和流體的運輸區域以及連 續的營養物交換等。此外,初代大鼠和人類肝細胞在此裝置皆能維持超過 7 天之 生存率 (Lee et al., 2007) 。而這平台使用之細胞量較傳統培養皿所需的細胞量少約 100 倍,因此在相同的細胞量下,可以使用此平台做更大量之藥物測試。
圖 2-6 Microfluidic endothelial-like barrier properties (Lee et al., 2007) .
doi:10.6342/NTU201803374 17
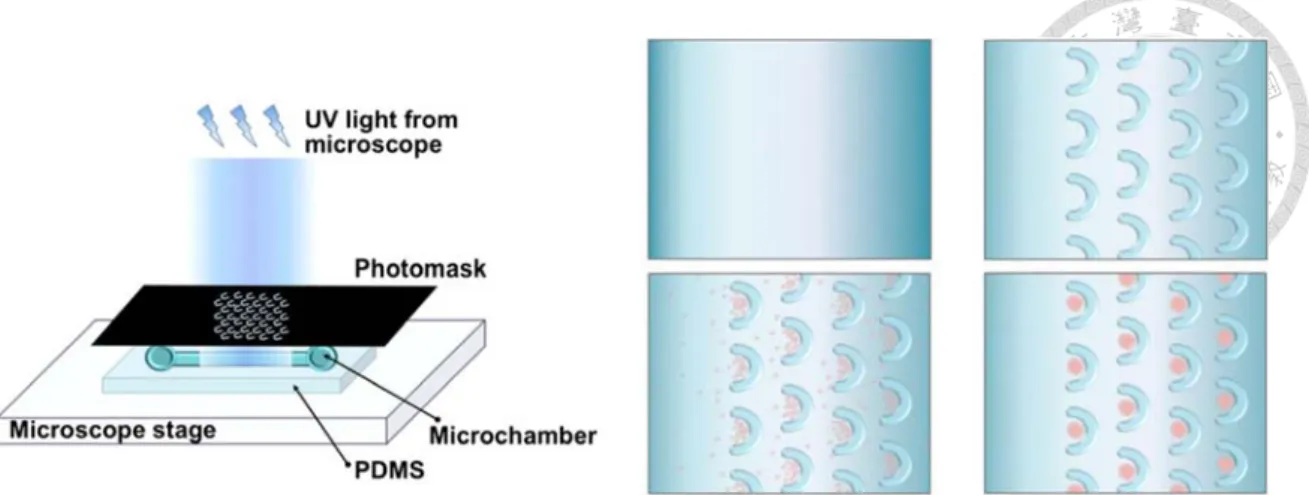
2010 年 Chien-Yu Fu 與其團隊在微流道上以 U-Shape 之設計將肝癌細胞三 次元球 (HepG2 Spheroid) 限制在流道內進行 3D 培養 (圖 2-7) ,因細胞三次元 球能提高 cell-cell interaction ,因此其功能和結構會與真實體內組織較為相似。而 一般製作細胞三次元球方式為利用細胞懸滴法、或透過在不易讓細胞黏附的培養 皿中培養細胞,進而產生此三次元球,然而三次元球由於是懸浮在培養液中,所 以容易在培養基交換時而一併流失。此研究利用 U-Shape 之設計來改善細胞三次 元球在微流道中會隨培養液交換而離開微流道系統的劣勢,藉由 U-Shape 的形狀 來固定住培養中的三次元球,因此相較於傳統的懸滴法能作更長時間培養,此外,
細胞三次元球之尺寸亦能根據 U-Shape 之大小來微調。 U-Shape 的厚度約為 100 μm,內部空間為 250 × 200 × 700 μm, 將肝癌細胞液 (HepG2 cell suspension) 以 8.4 × 106 cells/mL 之密度,2 μL/min 流速下注入此微流道系統中,
5 分鐘後將培養液注入,以洗脫未捕獲在 U-Shape 中之殘留於微流道中的 HepG2 。其系統最後流速為 2 μL/min。此研究接著利用阿黴素 (Doxorubicin,為 一種使 DNA 發生嵌入作用及為拓撲異構酶抑制劑) 來測試此平台是否可做藥物 測試平台,並由結果得知,相較 HepG2 在 2D 培養下結果 (以 3.0 μg/mL 作用 HepG2 兩天後即大多數凋亡) ,肝癌細胞三次元球在濃度 48 及 96 μg/mL 的藥 物環境下作用五天,其代謝活性仍然與藥物處理前相同,證明肝癌細胞三次元球 之耐藥物能力相較 2D 培養有所上升。這樣的結果表示 3D 培養系統在腫瘤藥物 篩選中的重要性,也證明常規藥物在此微流道系統中進行分析與探討是可行的,
並且由於此裝置能讓細胞簡易形成細胞三次元球,所以比起其他微流道的設計更 能長時間進行培養。
doi:10.6342/NTU201803374 18
圖 2-7 The flowchart of U-shaped microstructure fabrication, cell trapping and spheroid formation (Fu et al., 2010) .
doi:10.6342/NTU201803374 19
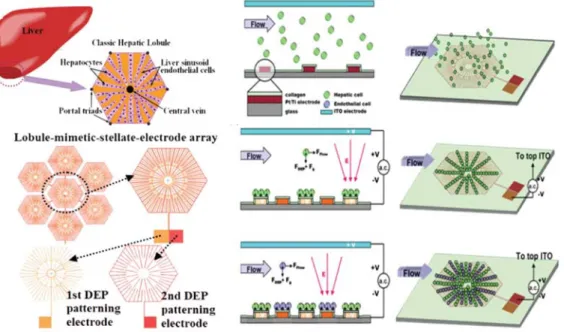
在 臺 灣 清 華 大 學 劉 承 賢 教 授 的 團 隊 以 介 電 泳 式 的 細 胞 分 離 技 術 (Dielectrophoresis Force,DEP) 應用於微流道晶片中之細胞排列,進一步模擬出肝 小葉中之細胞排列情況 (圖 2-8) 。此裝置是將 HepG2 及人類臍靜脈內皮細胞株 (Human Umbilical Vein Endothelial Cells,HUVECs) 於流道中進行共培養,在晶片 製作的過程中設計兩種不同圖樣的電極,在兩種不同之細胞注入時分別施加電場,
使其能分別吸附在微流道上原先所設計之位置,最後成功透過介電泳使細胞能分 別排列成為類肝小葉中細胞之分佈。而透過介電泳的排列後,細胞仍然 95 % 的 生存率,證明介電泳分離下對其生存率無顯著影響。實驗結果亦顯示利用介電泳 來模擬肝小葉排列,和未經排列的細胞相比之下,在培養兩天之後 CYP 1A1 的活
性提高了約80 %,此結果不僅證明細胞間分泌之物質會影響其生長及活性之外,
細胞的活性與機能在不同排列方式下亦會有不同的表現。
圖 2-8 Liver-cell patterning Lab Chip: mimicking the morphology of liver lobule tissue (Liu et al., 2013) .
doi:10.6342/NTU201803374 20
Ljupcho Prodanov 之哈佛團隊,成功透過雙層 PDMS 微流道系統來模仿肝臟 中不同細胞之分佈情形。於此系統下,肝細胞能夠維持 28 天的活性及機能,相 較於一般培養皿環境下培養的單層肝細胞只能維持 7 天之生長,肝細胞在此系統
培養後有顯著的活性及機能提升。此系統設計為雙層PDMS 結構,中間以聚對苯
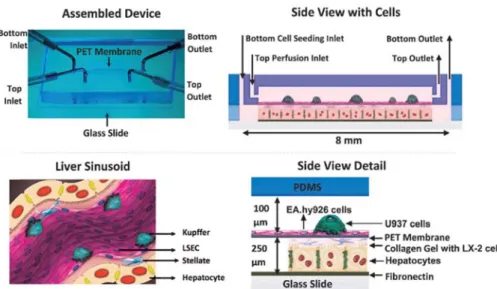
二甲酸乙二酯 (Polyethylene terephthalate,PET) 之多孔通透膜來區隔,同時將四 種細胞共培養於微流道上: 分別為人類初代肝細胞、人類臍靜脈內皮細胞株 (EA.hy926 cell) 、人類巨噬細胞株 (U937) 及人類肝臟星狀細胞株 (LX-2 cells) 。 其注入細胞之步驟為:先注入人類初代肝細胞靜置一天使其貼附於最下層微流道 之玻璃上,再接著注入與膠原蛋白水膠混合之 LX-2 於下層微流道中,並將晶片 翻轉放置一天,以增加 LX-2 於水膠中的分佈深度。之後再注入 EA.hy926 於上 層微流道中,在晶片培養七天後注入 U937 於前述相同的上層微流道中 (圖 2-9) 。 由結果可以發現: (1) 肝細胞在體外培養可長達 28 天; (2) 在流動的系統中可 維持良好的肝臟機能 (白蛋白和尿素之分泌量) ; (3) CYP3A4 的代謝活性可以維 持。由此研究結果可以確認 Liver-on chip 在體外長期培養的可能性,也使我們可 以更進一步了解藥物在人類肝臟系統中所產生的藥物代謝反應,也為 Liver-on chip 在藥物檢測平台的應用下有著極高的發展潛能。
圖 2-9 Long-term maintenance of a microfluidic 3D human liver sinusoid (Prodanov et al., 2016) .
doi:10.6342/NTU201803374 21
2.9 Poly(methyl methacrylate)微流道系統
聚甲基丙烯酸甲酯 (Poly(methyl methacrylate) ,PMMA) 亦是微流道系統中常 被用來當成基底的聚合物。其優點為價格相較低廉、具有優異的光學透明性和優 異之電及機械性質、且在外加電場條件下亦能在微流道中產生穩定的電滲流 (Electro-osmotic flow,EOF) (Becker and Locascio, 2002) 。除此之外,它亦是常用 的塑料材料中疏水性較低之聚合物 [接觸角為:66°-71° (Rinken, 2009) ] ,由於可 在高溫下分解成甲基丙烯酸甲酯 (Methyl methacrylate,MMA) ,因此 PMMA 可 重複使用,所以 PMMA 亦是製備「綠色晶片」之潛在材料。
2.9.1 PMMA 微流道系統製作 2.9.1.1 熱壓法 (Hot embossing)
熱壓法是用於 PMMA 微通道製作之最常使用方法。將一塊 PMMA 平板置 於熱壓系統,系統中以矽或金屬作為微流道結構模具之基材,將該系統加熱至 105
oC 以上 (105 oC 為 PMMA 玻璃化轉變之溫度) ,之後以壓印 (壓力大小為 20-30 kN) 之方式將設計之微流道結構壓印於 PMMA 上,再持續加壓 20-30 秒後停止 加熱,最後直到模具及 PMMA 之溫度下降到 105 oC 以下即可脫模完成微流道系 統製作 (圖 2-10) (Becker and Heim, 2000) 。
圖 2-10 Schematic drawing of the hot embossing equipment and Replication of this structure in PMMA (The channels are 0.8 mm wide.) (Becker and Heim, 2000) .
doi:10.6342/NTU201803374 22
2.9.1.2 室溫壓印 (Room-temperature imprinting)
此方法利用光阻於矽晶原上蝕刻出想要設計的微流道結構模具,並將有微流 道結構之矽模具固定於鋁板上,再將 PMMA 固定於另一上,利用液壓機在室溫 下施加 450 至 2700 psi 之壓力並持續約 5 分鐘即可完成 (圖 2-11) 。此方法可 以避免壓印過程中加熱模具造成模具形變,此外,每一模具能製作之工件產量亦 可從 10 個器件提高至 100 個工件以上,且工件間流道之尺寸變化小於 2 % (Xu et al., 2000) 。
圖 2-11 Room-temperature imprinting of microfluidic channels using silicon template, microscopic images of top view and cross section of an imprinted PMMA device (Xu et al., 2000) .
2.9.1.3 雷射雕刻 (Laser ablation)
此方法通常使用市售的雷射雕刻機來雕刻 PMMA 基板,它由準分子雷射 (Excimer Laser) 和放置 PMMA 基板的平台組成 (圖 2-12) 。平台在 2D 區域上 可進行 X 和 Y 方向之運動,並利用高能量之雷射以破壞 PMMA 聚合物分子間 的鍵結,並從消融區域中去除分解的碎片形成通槽,我們亦可調整雷射之強度以 改變刻出流道之深度。此平台可使用通用繪圖工具 (如 CorelDraw 或 AutoCAD) 設計圖案,然後將圖案發送到系統後於 PMMA 基底上直接加工 (Cheng et al., 2004) 。
doi:10.6342/NTU201803374 23
圖 2-12 Configuration of a direct-write laser machining system and SEM image of the cross-section of an unsealed laser machined microchannel (Cheng et al., 2004) .
doi:10.6342/NTU201803374 24
2.9.1.4 溶劑蝕刻 (Solvent etching)
使用已預先有微流道之 PDMS 作為模板,再將其與 PMMA 黏合後,在 PDMS 微流道中注入並充滿有機蝕刻溶劑 [有機蝕刻溶劑為丙酮和乙醇 (1:1) 之 混合) (圖 2-13) 。此方式能在數分鐘內將原 PDMS 設計之流道複製於 PMMA 上 形成平滑的通道表面,且 PMDS 模板可供多次使用。這種新穎的方法提供了另一 用於在 PMMA 基板上快速製造微流道的方法 (Brister and Weston, 2005) 。
圖 2-13 Schematic of the etching process and representative analysis of an etched channel by SEM (Brister and Weston, 2005) .
doi:10.6342/NTU201803374 25
2.9.2 PMMA 微流道系統黏合 2.9.2.1 熱黏合 (Thermal bonding)
將 PMMA 底板及上蓋與封裝在其內部的微結構組合在一起,並在對流烘箱 中加熱到高於 PMMA 的玻璃化轉變溫度 (105 oC) ,之後並接著施加正壓到上述 的底板及上蓋,以進一步來黏合兩 PMMA 。這些黏合過程需要約 1 小時才能完 成,並在 130-150 千帕範圍內之壓力下進行。但過程中由於會採用高於玻璃化轉 變溫度的條件,有可能導致通道造成形變進而影響其製程再現性 (Xu et al., 2000) 。
2.9.2.2 溶劑黏合 (Solvent bonding)
利用旋轉塗佈機以 4500 rpm (2.5 秒) 將 2,4- 戊二酮覆蓋於 PMMA 底板上,
之後將其與有微流道設計之 PMMA 上蓋進行組合,並用手在表面施加正壓 2 分 鐘 (Wang et al., 2007);另一方式為先將上下基板浸入丙酮中 10 秒以清潔它們的 表面,再以乾淨的空氣將基板吹乾,之後在加入 3-5 滴 DE-20 (20 %wt 之 1,2- dichloroethane 與 80%wt ethanol 混合) 於兩 PMMA 基底的接觸面上,並使溶劑 能均勻分佈在整個接觸表面區域,最後再以 C 型夾或壓印機在室溫下對此兩個需 結合的 PMMA 底板施加約 10 N/cm2 壓力 5 分鐘即可完成黏合 (Lin, Chao and Lan, 2007) 。
2.9.2.3 微波黏合 (Microwave bonding)
PMMA 由於對 2.4 GHz 頻帶附近之微波無明顯之吸收峰,因此可以在兩 PMMA 基板界面上覆蓋一薄膜金屬。由於在外加微波時大部分微波能量會被界面 處的薄膜金屬吸收,導致在兩 PMMA 界面中加熱高於 PMMA 的玻璃化轉變溫 度之後,再以加壓的方式使其黏合 (Lei et al., 2004) 。
doi:10.6342/NTU201803374 26
另一方式是將乙醇覆蓋於兩 PMMA 底板間使其均勻分佈而沒有殘留的空氣 後,用活頁夾夾緊兩 PMMA 板,之後再將多餘乙醇擦拭後,並進一步將緊密捲 起的 Kimwipe 放置在其中一個流道末端,最後藉由毛細作用吸出流道中之乙醇以 避免流道封死。PMMA 放置在通風櫥下的商用微波爐中以功率 700 W 下運行 30 至 90 秒即可完成黏合 (圖 2-14) (Rahbar et al., 2009) 。
圖 2-14 Picture of the bonding setup (a) PMMA channels with clips and alcohol, (b) PMMA and water placed in a commercial microwave just before bonding, (c) bonded microfluidics (ethanol, 90 s) showing over 90% bonded area (Rahbar et al., 2009) .
因此,本研究擬以利用能快速製程的 PMMA 微流道 (Rahbar et al., 2009) , 結 合 分 化 效 率 高 之 肝 前 驅 細 胞 (Lee et al., 2015) , 以 建 立 一 個 新 型 的 Liver-on-chip 做為肝細胞培養平台,並分於平台上培養的肝前驅細胞機能並生長 型態,與培養在 Dish 上的細胞進行比較。
doi:10.6342/NTU201803374 27
第三章 試驗設備與方法
3.1 實驗藥品、耗材、儀器設備與實驗動物 3.1.1 實驗藥品
Chloroform (288306) 、L-Ascorbic acid (A8960-5G) 、L-Proline (P0380-100G) 、 Dexamethasone (D4902-100MG) 、Picrylsulfonic acid solution (P2297-10ML) 、 Hydrochloric acid (30721-1L) 、Ethanol (32221-2.5L) 、Acetone ( 32201-2.5L)購於 Sigma-Aldrich。2-Propanol (29113-95) 、Nicotinamide (24317-72) 、Albumin, Bovine Serum (08587-42) 、NaCl (31320-05) 、KCl (28514-75) 、NaH2PO4-2H2O (317-18) 、 Na2HPO4-12H2O (31723-35) 、Phenol red (26807-21) 購於 Nacalai。Trypan blue 0.4%
(207-17081) 、Collagenase (034-22363) 購於 Wako。TRIzol® Reagent (15596018) 、 FBS (26140-079) 、Penicillin-Streptomycin (15140-122) 、ReadyProbes® Cell Viability Imaging Kit (Blue/Green) Protocol (R37609) 、Cytokeratin 18 Antibody (MA1-06326) 、 Goat anti-Mouse IgG Antibody (A-11001) 、UltraPure DNase/RNase-Free Distilled Water (10977-015) 、ITS (51500-056) 、Goat anti-Rabbit IgG Antibody (A11012) 、 ProLong™ Gold Antifade Mountant with DAPI (P36931) 、HEPES (172571000) 購於 Thermo Fisher Scientific。PrimeScriptTM1st stand cDNA synthesis kit (6110A) 購於 TaKaRa。Rotor-Gene® SYBR® Green PCR master mix 2×購於 QIAGEN。Cellmatrix type I-A 3 mg/mL (Collagen) (160222) 購於新田ゼラチン。透明藍光固化膠 (Liquid acrylic resin) (0916) 購於 BLUFIXX。QuantiChromTM Urea Assay Kit (DIUR-100) 購 於 BioAssay Systems 。 Rat Albumin ELISA Quantitation kit (E110-125) 購於 Bethyl。DMEM/F12 (CC113-0500) 、WE medium (CC901-0500) 、 DMEM (CC103-0500) 購於 Simply GeneDireX。EGF (354001) 購於 Corning。
Primer for qPCR 購 於 LGC Biosearch Technologies。Cytokeratin 19 Antibody (10712-1-AP) 購於 Proteintech。
doi:10.6342/NTU201803374 28
3.1.2 儀器設備
超音波震盪機 (Q125) 購於 QSONICA 公司。注射幫浦 (KDS230) 購於 KD Scientific® 公司。送液幫浦 (MP-2000; SMP-23s) 購於 EYELA 公司。離心機 (5840R) 、 8 噴 嘴 pipettes (3122000035, 3122000051) 、 Pipettes (310000046, 310000054, 3120000062) 購於 Eppendorf Researche 公司。 Microplate Absorbance Reader (Ref.16039400) 購於 TECAN 公司。倒立式相位差顯微鏡 (Axio Vert.A1) 購於Carl Zeiss。冷凍離心機 (5840R) 購於 Eppendorf Research。TurboCycler 梯度 核酸擴增PCR 儀 (TCST-9610) 購於 Blue-Ray Biotech。qPCR 機器 (Rotor-Gene Q) 購於 QIAGEN。微量盤式分光光度計 (Epoch) 、Take3TM Trio Micro-Volume plates 購於 BioTek。 Forma Steri-Cycle CO2 Incubators (370) 、Biological Safety Cabinet (1300A2) 、S1 Pipet Fillers (9501) 、純水製造裝置 (50132373) 、Compact Digital Microplate Shaker (88880023) 、Countess II FL Automated Cell Counter、Cytospin™ 4 Cytocentrifuge 購於 Thermo Fisher Scientific。超音波洗淨機 (T 840 DH) 購於 ELMA。HARRICK PLASMA Cleaner 氧電漿清洗機–基本型 (PDC-32G) 購於 HARRICK PLASMA。
3.1.3 實驗耗材
15 mL 滅菌離心管(339650) 、50 mL 滅菌離心管 (339652) 、Nunc™ Cell Scrapers (179693) 購 於 Thermo Fisher Scientific 。 96 孔 ELISA 盤 (Elisa-PS-96F-F-H) 購於 Advangene。Costar® Stripette® 10 mL Polystyrene Sterile Serological Pipets (4488) 、Costar® Stripette® 50 mL Polystyrene Sterile Serological Pipets (4490) 、Falcon® 70 µm Cell Strainer (352350) 、Falcon® 100 µm Cell Strainer (352360) 購於 Corning。載玻片 silane coating (5116) 購於 Muto Pure Chemicals。
Individual PCR Tubes (3220-00) 購於 SSI bio。
doi:10.6342/NTU201803374 29
3.1.4 實驗動物
Sprague Dawley 大鼠購於國家實驗動物中心。本研究涉及實驗動物使用由台 灣大學實驗動物照護及使用委員會所認可,而實驗者擁有台灣大學 A10、B10、
D4、E5、E6 的教育訓練合格證書。
3.2 細胞懸浮液組成分析
利用 Cytospin™ 4 Cytocentrifuge 以 500 rpm,4 分鐘之離心速度將細胞密度 為 1.5 × 104 cells/mL 之細胞懸浮液分佈在載玻片之固定區域後將其放置晾乾,再 以 -20 oC 之 Acetone 固定 5 分鐘,之後再將其浸泡在 PBS 中洗淨 5 分鐘。將 其拭乾後再以 1 % BSA (溶於 PBS 中) 滴在載玻片上 (約 0.1 mL) 放置於 37 oC 下反應 1 小時並拭乾。之後將 1 次抗體 (1:100 之稀釋倍率將抗體溶於 PBS 中) 滴在玻片上放置於 37 oC 下反應 1 小時,接著以 PBS 洗淨 10 分鐘並重覆 3 次,
拭乾後再將 2 次抗體 (1:100 之稀釋倍率將抗體溶於 PBS 中) 滴在載玻片上放 置於 37 oC 且避光之環境下反應 1 小時後,最後以 PBS 洗淨 10 分鐘並重覆 2 次,再接著以 PBS 洗淨 20 分鐘,將其拭乾後滴入 Mountant with DAPI 並以蓋 玻片蓋上完成封片。上述每個階段所使用的 PBS 都是一次性使用。
3.3 膠原蛋白修飾培養皿製備
利用 0.1 M HCl 將膠原蛋白原液稀釋 30 倍 (成為 0.1 mg/mL) 後,取出其中 的 2 mL 膠原蛋白稀釋溶液加入於 60mm Petri dish 內,確定溶液完全覆蓋培養皿 表面後置於 37 oC 下過夜。使用前將溶液抽出,以 PBS 沖洗 2 次後即可使用。
doi:10.6342/NTU201803374 30
3.4 肝細胞採取與培養
初代肝實質細胞 (成熟肝細胞) 及小型肝細胞的採取皆利用 Two-step collagenase perfusion (Seglen, 1976) (圖 3-1) 的方式取得。初代肝細胞及小型肝細 胞在分離過程中所使用的 Collagenase 量分別為 50 mg 及 66 mg,且皆溶於 50 mL Buffer B (NaCl 16.013 g,KCl 0.805 g,NaH2PO4-2H2O 0.156 g,
Na2HPO4-12H2O 0.301 g,HEPES 4.766 g,Phenol red 0.012 g,NaHCO3 0.353 g,
溶於 2 L 之二次水中,並用濃度為 1 N 的 NaOH 調整成 pH 7.5) 。
成熟肝細胞的分離步驟為:將肝臟取出,並置於 90 mm dish 裡再加入 WE medium (以下所示的 WE medium 皆有 5 % FBS 及 1 % Penicillin-Streptomycin) 來浸潤整個肝臟,之後用 2 隻解剖刀以平行下刀的方式將肝臟切碎,接著再以 適當的 Pipetting 將肝細胞懸浮液混合均勻,最後將此懸浮液以 7 cm × 7 cm 的消毒滅菌紗布濾過至 50 mL 的離心管中 (分注成兩管) ,再以 100 μm 的 Cell strainer 濾過肝細胞懸浮液至新的 50 mL 的離心管中 (分注成兩管) ,兩管 皆以 WE medium 裝滿至 30-40 mL,接著再以 50 g、1 分、4 oC 的條件下離 心,並將兩管上清液的部分吸出並放至於新的 50 mL 的離心管中 (供之後的小 型肝細胞採取所使用) 。上清液取出後留下的沉澱物即為成熟肝細胞的 Cell pellet,我們接著加入 30-40 mL 之 WE medium 至離心管與 Cell pellet 均勻混 合後以 50 g、1 分、4 oC 的條件下離心,離心完後再將上清液吸出保留於新的 50 mL 的離心管中 (供之後的小型肝細胞採取所使用) 。留下的成熟肝細胞 Cell pellet 再分別加入 20 mL WE medium 至兩個 50 mL 的離心管中均勻混和 後,將 2 管的懸浮液整合為 1 管,再進行第三次的 50 g、1 分、4 oC 離心,
離心完後將上清液吸出保留於新的 50 mL 的離心管中 (供之後的小型肝細胞 採取所使用) ,留下的成熟肝細胞 Cell pellet 再分別加入 10 mL WE medium 至 離 心 管 並 均 勻 混 合 , 最 後 即 可 得 到 初 代 肝 實 質 細 胞 的 懸 浮 液 (Cell suspension) 。