國立臺東大學生命科學系 碩士論文
Department of Life Science, National Taitung University Master Thesis
指導教授 : 林志輝 博士 Advisor: Chih-Hui Lin, Ph.D.
以 Escherichia coli BL21 (DE3) 生產
重組 Anoxybacillus flavithermus HY-TTH-D23
熱穩定 α-半乳糖苷酶與純化之研究
Studies on production and purification of recombinant Anoxybacillus flavithermus HY-TTH-D23 thermostable
α-galactosidase in Escherichia coli BL21 (DE3)
研究生:陳順達 撰
Graduate student: Shun-Da Chen 中華民國 107 年 7 月
July, 2018
謝誌
感謝林志輝博士六年來的指導與陪伴,縱使我能力有限,無法幫襯及協助您 完成學術與工作上的成就,您也不曾責難我的不是。感謝您始終能體諒並且包容 我的缺點,時刻關心並協助我解決許多心理與生活上的困難。能夠在您身邊一路 見證您工作上的晉升,生活上戀愛、買房、娶妻、生子與育兒等人生不同階段的 起伏變化,是我畢生難得的經驗與榮幸。特別感謝臺灣大學生化科技學系名譽教 授潘子明博士與輔仁大學食品科學系教授蔡宗佑博士能在百忙之中撥冗審閱論 文,除了給予許多研究與論文寫作上的寶貴意見外,還能包容我諸多不甚體面與 不足之處。在研究所的求學過程中,感謝臺東大學生命科學系教授李俊霖系主任 給予我許多嘗試新事物與展現自我的機會,雖然無法凡事盡善盡美,但過程中的 經驗都成為圓滿我臺東生活的重要回憶與提升自我的珍貴養分。
自大一暑假加入實驗室開始,轉眼六年之間經歷了許多次的迎接與道別,當 中唯一不變卻也改變最多的就屬姿杏師母,不變的是您一直以來的關心與陪伴,
改變的是從少女、人妻再到人母不同身分的轉換。感謝您總是不吝於分享生活中 發生的各種趣事與感受,並在我低落的時候給予鼓勵和支持,希望您能在不斷改 變的生活狀態中找到帄衡與新鮮感。感謝施狗學長與海綿學姊於不同階段對於實 驗上的指導與生活上的支持鼓勵,不但能包容並原諒我許多不是,還能寬解我面 臨的壓力與負面情緒。感謝柴魚學姊、小摺學長與無言學姊在實驗室與日常生活 上的照顧與陪伴,且在畢業後仍持續關心我的學習狀況。感謝丁丁學長總是能站 我的立場替我設想,並鼓勵我走出許多低潮的時光。感謝阿銓學長與維華學長在 工作之餘給予的鼓勵與提點。感謝八琪學妹的奉獻與犧牲,希望妳能在新的學習 階段大放異彩。感謝草草、小天、偉君、庭安、柯柯、仔仔、大手、東東、小圍、
磬孙、阿嬤、正宏、哈哈、阿貓、高可、子航、鳳英、中佑、嬿琳、珮珮、賴賴、
亮亮、阿母、紅茶、海狗、顥翰、仁夫…等一眾同學在求學階段的不同時刻給予 我方方面面的協助或精神上的鼓勵。感謝乃慈、羽蓮、熊貓、菜心、伊萱、潘潘、
博全、韻文、阿蘇、墨劍、啓軒、尹皓、妍慧、欽揚、毓逵、欣妤與婉瑋等實驗 室內眾多學弟妹給予我的關心、包容與協助。希望你們大家的生活都能過得愜意 順遂,遇到困難能逢凶化吉。
感謝怡菁學姊這四年來從課業、工作、生活到心理上不計代價的幫忙,雖然 表面上總說是合作關係,但是與您相處的感覺真的很像兄弟姊妹,祝福您能隨心 所欲的過理想的生活。感謝佑任、欣華、文靜、德潤、亞璇與榮吉等學弟妹陪我
度過大學畢業前最難熬的一段時光。對於未能提及姓名的家人、同學、師長、學 長姐、學弟妹、同事、上司與其他跨越年齡的界限的好友們,感謝你們能包容我 的缺點,並在人生中的不同面向給予我當下需要的警惕、協助與關心。
意外總是發生在每個抉擇人生方向的時刻,看似筆直的路途也總是埋藏著預 料之外的伏筆。在臺東經歷了許多轉折,感受到許多溫暖,邂逅了許多人事,也 認識了自己的極限與缺點。雖然從開頭直到結尾都充滿著遺憾,但過程中得到的 收穫,可能遠超出我感官可以乘載的份量。七年下來我能夠給予大家的實在太少,
但獲得的包容、協助與關心卻幸運地比別人多出許多。面對收穫到的諸多善意可 能無法實踐知恩圖報,但求能於此傳達對於各位的感謝與祝福。
陳順達 謹誌於 國立臺東大學生命科學系 中華民國一○七年七月
I
摘要
α-galactosidase 具有食品、製糖、飼料、造紙與醫藥應用價值。本研究由嗜 熱 性 溫 泉 菌 Anoxybacillus flavithermus HY-TTH-D23 選 殖 出 具 熱 穩 定 性 之 α-galactosidase (rAFGAL) 並進行異源表現與特性探討。rAFGAL-GFP 的分子量 為 112 kDa,為目前文獻中第一個從 Anoxybacillus spp. 中選殖並異源表現生產 的 α-galactosidase。研究結果顯示 E. coli BL21 (DE3) pET GFP rAFGAL 生產的 rAFGAL-GFP 同 時 以 包 涵 體 及 可 溶 性 蛋 白 的 形 式 存 在 。 包 涵 體 占 總 rAFGAL-GFP 產 量 的 95% 以 上 , 降 低 培 養 溫 度 雖 無 法 有 效 提 升 可 溶 性 rAFGAL-GFP 比例,但可提升總活性與比活性。包涵體雖能透過稀釋法與柱上 復性法成功生產出具有活性的 rAFGAL-GFP,但其效率太低可能不適合做為 rAFGAL-GFP 大量生產的策略。研究結果顯示,在不添加葡萄糖與 IPTG 的條 件下以 37°Ϲ 培養 12 小時,搭配添加 1% Trion X-100 的超音波破菌與 50°Ϲ 熱處理的純化方式具單位時間最高產量 (總活性 53.13 ± 8.39 U/L、比活性 11.18
± 1.33 U/mg,生產成本約 2.62 NTD/U)。相較於前人研究,以本研究開發之生產 條件最高約可降低 50% 之生產成本。本研究生產所得 rAFGAL-GFP 最適作用 溫度為 45 與 55ºC,最適 pH 值為 7-10。對於蜜二糖、棉子糖與水蘇糖皆具有 催化活性且對蜜二糖具有較高的專一性 (kcat/Km = 245.20/ mM·s)。研究結果除了 希望能對 Anoxybacillus spp. 的 α-galactosidase 基本特性有所描述與貢獻外,未 來還能將其應用在食品、飼料與造紙等高溫工業製程。
關鍵字:α-半乳糖苷酶、E. coli BL21 (DE3)、包涵體、柱上復性
II
Abstract
α-Galactosidase can be applied to food, sugur, fodder, paper and medicine. The thermostable α-galactosidase of Anoxybacillus flavithermus HY-TTH-D23 (rAFGAL) was cloned into E. coli BL21 (DE3) for heteroexpression.and characterization (rAFGAL-GFP). The rAFGAL-GFP is about 112 kDa, and is the first α-galactosisase cloned from Anoxybacillus flavithermus. This study demonstrates that rAFGAL-GFP produced from E. coli BL21 (DE3) pET GFP rAFGAL, both in the form of inclusion body (IB) and soluble protein. Over 95% of total rAFGAL-GFP was in IB form.
There is not obvious effect for reducing the ratio of IB by lowering the culturing temperature, but it was still beneficial to inhence the yeild and the specific activity of soluble rAFGAL-GFP. However, IB could be refolded with urea and Ni-NTA column by dilution or on-column refolding, but the producitivity too low to scale up. As the result shows, the condition of culturing at 37°Ϲ, without glucose and IPTG induction, for 12 hours following by sonication with 1% Triton X-100 and heating at 50°Ϲ for 30 min can achieve the highest producitivity (53.13 ± 8.39 U/L, 11.18 ± 1.33 U/mg, and 2.62 NTD/U). Compared to privious study, the cost has been reduced by 50%. As the product, rAFGAL-GFP keeps activity at pH 7-10 with optimal temperature range from 45-55 ° Ϲ, and can catalysis melibiose, raffinose and stachyose, espacially melibiose (kcat/Km = 245.20/ mM/ s). The results of this study could contribute to the knowledge of Anoxybacillus ssp. α-galactosidase and its application for industrial processes in food, fodder and paper.
Key words: α-galactosidase, E. coli BL21 (DE3), inclusion body, on-column refolding
III
縮寫表
縮寫 全名 中文
α-GAL α-galactosidase α-半乳糖苷酶
BSA Bovine serum albumin 牛血清白蛋白
β-ME β-Mercaptoethanol 2-巰基乙醇
CD Circular dichroism spectroscopy 圓二色光譜
DNS 3, 5-Dinitrosalicylic acid 3, 5-二硝基水楊酸
DTT Dithiothreitol 二硫蘇糖醇
EDTA Ethylenediaminetetraacetic acid 乙二胺四乙酸
GFP Green fluorescent protein 綠色螢光蛋白
GH Glycoside hydrolases 糖苷水解酵素
IB Inclusion body 包涵體
IMAC Immobilized metalion affinity chromategraphy 固定化金屬離子親和層析 IPTG Isopropyl-β-ᴅ-thiogalactoside 異丙基-β-ᴅ-硫代半乳糖苷
LB Luria-Bertani broth Luria-Bertani 培養基
NTA Nitrilotriacetic acid 次氮基三乙酸
oNP-α-GAL o-Nitrophenyl-β-D-Galactopyranoside 2-硝基苯-α-ᴅ-吡喃半乳糖苷
PMSF Phenylmethanesulfonyl fluoride 苯甲基磺醯氟
Pnp p-Nitrophenyl 4-硝基苯
pNP-α-Gal p-Nitrophenyl β-ᴅ-glucopyranoside 4-硝基苯-α-ᴅ-吡喃半乳糖苷
SDS Sodium dodecyl sulfate 十二烷基硫酸鈉
SDS-PAGE Sodium dodecyl sulfate polyacrylamide gel electrophoresis 十二烷基硫酸鈉聚丙烯醯胺 凝膠電泳
IV
目錄
中文摘要………I 英文摘要………...II 縮寫表………..III 目錄……….….……IV 圖目錄……….…….VI 表目錄………...VIII
一、 前言... 1
(一) 文獻回顧... 1
1. α -半乳糖苷酶 ... 1
2. 蛋白表現系統... 19
3. 蛋白純化... 30
4. 包涵體復性... 40
(二) 研究動機、目的與研究架構... 48
二、 材料方法... 50
(一) 材料... 50
1. 器材... 50
2. 藥品... 51
3. 菌株與載體... 51
(二) 方法... 53
1. E. coli BL21 (DE3) pET GFP rAFGAL 菌種活化與培養 ... 53
2. rAFGAL-GFP 表現與純化 ... 53
3. 培養溫度對於 E. coli BL21 (DE3) pET GFP rAFGAL 生長之影響 54 4. 葡萄糖對於 E. coli BL21 (DE3) pET GFP rAFGAL 生長之影響 .. 55
5. 誘導條件分析... 58
6. E. coli BL21 (DE3) pET GFP rAFGAL 破菌效率測試 ... 58
7. 熱處理步驟對可溶性 rAFGAL-GFP 純化效益評估 ... 58
8. rAFGAL-GFP 復性 ... 59
9. 酵素特性分析... 60
10. 統計分析... 64
三、 結果... 65
(一) 培養溫度對 E. coli BL21 (DE3) pET GFP rAFGAL 生長及蛋白質表 現之影響... 65
V
1. 培養溫度對 E. coli BL21 (DE3) pET GFP rAFGAL 生長曲線之影
響 ………...65
2. E. coli BL21 (DE3) pET GFP rAFGAL 於 20°Ϲ、28°Ϲ 與 37°Ϲ 培 養之可溶性蛋白比例與純化後產量... 65
3. 培養溫度對可溶性 rAFGAL-GFP 產量之影響 ... 65
(二) 葡萄糖對 E. coli BL21 (DE3) pET GFP rAFGAL 生長與之影響 ... 72
1. 葡萄糖濃度對 E. coli BL21 (DE3) pET GFP rAFGAL 生長曲線之 影響... ………...………72
2. 葡萄糖濃度對可溶性 rAFGAL-GFP 產量之影響 ... 72
(三) 誘導條件分析... 72
(四) 破菌效率分析... 72
(五) 熱處理步驟對可溶性 rAFGAL-GFP 純化效益評估 ... 77
(六) 復性條件分析... 77
(七) 酵素特性分析... 77
1. 溫度對酵素活性的影響... 77
2. pH 值對酵素活性的影響 ... 81
3. 金屬離子對酵素活性的影響... 81
4. 化學試劑對酵素活性的影響... 81
5. 酵素動力學分析... 81
6. 二級結構分析... 81
7. 酵素存放時間測試... 87
(八) 生產成本估算... 87
四、 討論... 92
(一) rAFGAL-GFP 最適培養條件探討 ... 92
(二) rAFGAL-GFP 最適純化策略探討 ... 94
(三) rAFGAL-GFP 生化特性分析: ... 95
(四) rAFGAL-GFP 生產效益與提升產率之可行策略 ... 97
五、 結論... 98
六、 參考文獻... 99
VI
圖目錄
圖一、α-半乳糖苷酶水解反應……….……..………..……..2
圖二、α-半乳糖苷酶的基質……….………..…….3
圖三、E. coli B strian 與 K-12 strian 之蛋白質體學特性比較………...……..21
圖四、細胞破碎方法與原則………..……..……….….…32
圖五、固定化金屬離子親和性作用模式….………..………..….38
圖六、蛋白正確摺疊、錯誤摺疊與絮聚的關係示意圖……...……..….…………..…42
圖七、提升包涵體活性蛋白回收率的純化策略……….……….………..………….43
圖八、柱上復性原理……….………….……….….………...……..…….45
圖九、研究架構……….…………....………..…..49
圖十、表現用載體……….………...52
圖十一、葡萄糖標準曲線……….………..…...57
圖十二、BSA 糖標準曲線……….….….………...….…61
圖十三、於 20°Ϲ、28°Ϲ 與 37 °Ϲ 培養 36 小時之 E. coli BL21 (DE3) pET GFP rAFGAL 生長曲線………...…….…....……...66
圖十四、E. coli BL21 (DE3) pET GFP rAFGAL 於 37°Ϲ 培養 12、21 與 30 小時 可溶性蛋白與破菌沉澱物電泳分析 ………...…………...…………....….67
圖十五、E. coli BL21 (DE3) pET GFP rAFGAL 於 28°Ϲ 培養 12、21 與 30 小時 可溶性蛋白與破菌沉澱物電泳分析………...….…...…....68
圖十六、E. coli BL21 (DE3) pET GFP rAFGAL 於 20°Ϲ 培養 12、21 與 30 小時 可溶性蛋白與破菌沉澱物電泳分析………....……...69
圖十七、E. coli BL21 (DE3) pET GFP rAFGAL 於 20、28 與 37°Ϲ 培養 12、21 與 30 小時可溶性 rAFGAL-GFP 占總 rAFGAL-GFP 比例….…...70
圖十八、不同培養溫度生產可溶性 rAFGAL-GFP 總活性與比活性差異…...71
圖十九、葡萄糖濃度對於 E. coli BL21 (DE3) pET GFP rAFGAL 生長曲線的影 響.………....…...…..…..….73
圖二十、不同葡萄糖起始濃度生產之可溶性 rAFGAL-GFP 總活性與比活性差 異….………..………....………...74
圖二十一、1 mM IPTG 誘導對於可溶性 rAFGAL-GFP 總活性與比活性之影 響….……….………..………...75
圖二十二、超音波破菌時間對於細胞外觀的影響………..…...…...76
圖二十三、熱處理對於可溶性 rAFGAL-GFP 總活性與比活性之影響……..…...78
VII
圖 二 十 四 、 稀 釋 法 與 柱 上 復 性 法 純 化 rAFGAL-GFP 之 總 活 性 與 比 活 性 差
異………..……….………79
圖二十五、溫度對 rAFGAL-GFP 酵素穩定性的影響……….….………80
圖二十六、pH 值對 rAFGAL-GFP 酵素活性的影響……….…82
圖二十七、金屬離子對 rAFGAL-GFP 酵素活性的影響………..….….….83
圖二十八、界面活性劑對 rAFGAL-GFP 酵素活性的影響………..………...84
圖二十九、化學試劑對 rAFGAL-GFP 酵素活性的影響……….…….85
圖三十、圓二色光譜背景值………..…………...88
圖三十一、復性產物可溶性 rAFGAL-GFP 之圓二色光譜…………..…….……..89
圖三十二、溫度對 rAFGAL-GFP 二級結構的影響………...………..90
圖三十三、存放時間對酵素活性的影響………..91
VIII
表目錄
表一、不同微生物來源之 α-galactosidase 生化特性……….…….…6
表二、各 GH 家族的 α-半乳糖苷酶特性………..……..…….…10
表三、市售 α-半乳糖苷酶產品之產品形式與來源……….………...12
表四、Anoxybacillus 酵素的生化特性……….…..…..18
表五、生產重組蛋白用宿主的組成份比較….…….……….….…….20
表六、常見蛋白標籤融合的特性………...….…..24
表七、常見用於以 E. coli 為表現宿主生產可溶性蛋白的載體………….….…...…25
表八、提高 E. coli 蛋白表現量的策略………..…….….…..…29
表九、依固定相及移動相成份所進行液相層析分類……….….…....34
表十、IMAC、免疫親和層析、離子交換層析 (IEC) 與疏水性作用層析的比 較....………..….…...…..36
表十一、利用固定化金屬離子親和性層析純化的蛋白………..37
表十二、市售固定化金屬離子親和性層析相關商品………..…..…...38
表十三、利用柱上復性生產蛋白之應用………....……..45
表十四、代表性蛋白質與多肽之不同二級結構估算方法比較………..…….……..47
表十五、rAFGAL-GFP 動力學常數分析………..……...…..…86
1
一、 前言 (一) 文獻回顧
1. α -半乳糖苷酶
(1) α-半乳糖苷酶的發現與特性
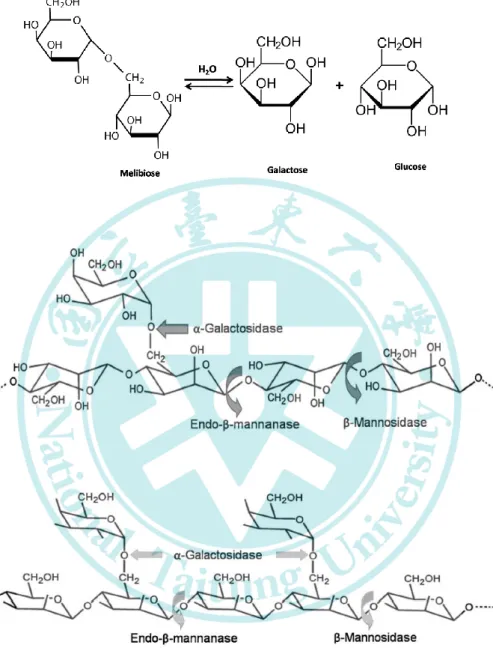
α-半乳糖苷酶 (α-galactosidase,EC 3.2.1.22,α-GAL) 為一種外切
型糖苷水解酵素,可催化水解α-1, 6 半乳糖苷鍵的非還原末端產生半乳
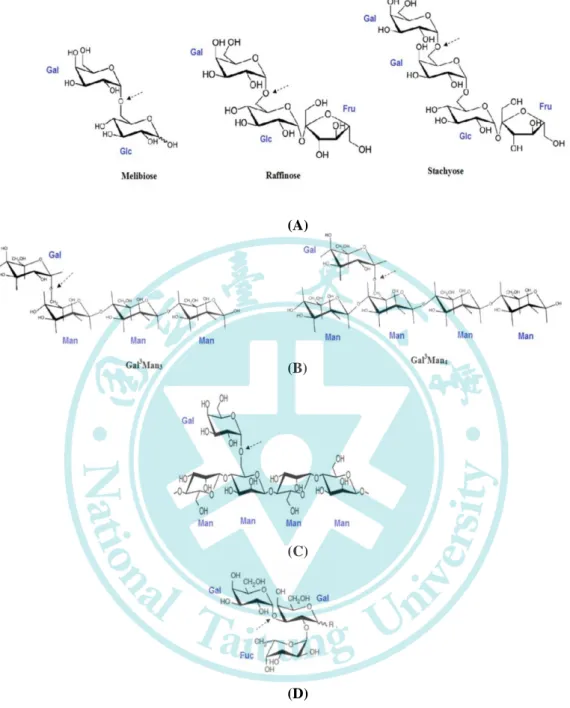
糖(圖一),主要作用於含有 α-1, 6 鍵結之雙醣 (蜜二糖)、短鏈醣類 (棉 子糖與水蘇糖)、半乳糖苷露聚醣 (刺槐豆膠與關華豆膠)、醣脂質與醣 蛋白 (圖二)。(Katrolia et al. 2014)
α-GAL 最早發現於 1895 年,由 Bau 與 Fisher 從底層酵母中 (通常為 Sacchromyces) 分離岀可水解蜜二糖的蜜二糖酶 (melibioase) (Melville 1954)。1928 年,Weidenhagen 發現蜜二糖酶可水解多種帶有 α-D-半乳糖基團的醣類,並將其改名為 α-galactosidase (Wolfrom et al.
1954)。
(2) α-半乳糖苷酶的來源與分類
α-GAL 廣泛存在於植物、動物與微生物 (包含細菌、真菌與酵母 菌) 中,並依據來源不同而具備不同的結構與催化性質。(Bakunina et al.
2016)
(a) 植物來源
最早發現含有 α-GAL 的植物為扁桃 (sweet almond, Prunus dulcis) (Helferich and Appel 1932)。植物中的耐酸性 α-GAL 會影響 種子的發芽與生長 (Keller 1996),耐鹼性 α-GAL 則與葉子的發育 有關 (Chrost et al. 2007)。目前已知 α-GAL 的植物來源包含:豆科 植物種子、甜瓜果實、甜杏仁、椰子胚乳、向日葵種子、南瓜成熟
2
(A)
(B)
(C)
圖一、α-半乳糖苷酶水解反應 (Anisha 2017)
Figure 1. Hydrolysis of (A) melibiose, (B) locust bean gum and (C) guar gum by α-galactosidase.
3
圖二、α-半乳糖苷酶的基質 (Katrolia et al. 2014)
Figure 2. Substrates of α-galactosidases: (A) oligosaccharides, (B)
galactomanno-oligosaccharides, (C) galactomannan polysaccharides and (D) α-1,3-linked ᴅ-galactose from immunodominant B trisaccharide antigen in blood-group B conversion.
(A)
(B)
(C)
(D)
4
葉、未成熟的甘蔗莖、花生、木瓜、葡萄、番茄、水稻與咖啡豆種 子 (Ahmed and Cook 1964; Carchon and DeBruyne 1975; Chinen et al. 1981; Dey 1984; Feurtado et al. 2001; Gao and Schaffer 1999; Itoh et al. 1986; Kandiah Balasubramaniam 1985; Kang and Lee 2001; Kim et al. 2003; Lazan et al. 2004; Lee et al. 2004)。咖啡豆是最早純化並 實際應用於工業生產的 α-GAL 來源,而從甜瓜果實中發現了對於 多 種 基 質 ( 特 別 是 水 蘇 糖 ) 皆 有 催 化 活 性 的 鹼 性 α-ᴅ-GAL 。 Bayraktar 與 Onal (2013) 成 功 透 過 三 相 分 離 法 (three-phase partitioning) 以 2.4 倍的純化倍率與 76.7% 的產率純化出源自西 瓜 (Citrullus vulgaris) 的 α-GAL (Bayraktar and Ö nal 2013)。
(b) 動物來源
動物來源包含脊椎與無脊椎動物,最早發現含有 α-GAL 的動 物為蝸牛 (Barnett 1971),此外在綿羊的胰臟 (Bajwa and Sastry 1974)、
小鼠的胚胎 (Adler et al. 1977),與倉鼠腎臟 (Chang 1978) 也陸續發 現 α-GAL 的存在。人體則存在於脾臟、肝臟、血液與胎盤等器官 中,但不存在於消化道中 (Bishop and Desnick 1981; Dean and Sweeley 1979)。動物來源的 α-GAL 可水解醣脂結構,人體若缺乏 α-GAL 或其活性不足時,會產生法布瑞氏症 (fabry disease) (Kint 1970)。
5
(c) 微生物來源
微生物是良好的 α-GAL 來源,無論細菌、真菌、絲狀真菌或 酵母菌均有發現 α-GAL 的存在 (表一)。
α-GAL 的細菌來源包含 Geobacillus stearothermophlius (Ganter et al. 1988)、乳酸菌中的 Lactobacillus acidophilus (Altermann et al.
2005)、L. fermentum (Carrera-Silva et al. 2006)、雙岐桿菌中的 Bifidobacterium adolescentis (Leder et al. 1999) 和 Bif. breve (Zhao et al. 2008)、絲狀放線菌中的 Streptomyces erythrus (Post and Luebke 2005)、Strep. colicolor A3 (2) (Kondoh et al. 2005)、Saccharopolyspora erythraea (Post and Luebke 2005) 與 Strep. griseoloalbus (Anisha et al. 2008)。此外在乳酸菌 Carnobacterium piscicola (Coombs and Brenchley 2001)、極端嗜熱菌 Rhodothermus marinus (Blücher et al.
2000) 與海洋細菌 Pseudoalteromonas sp. (Bakunina et al. 1998) 中 也都發現了 α-GAL 的存在。存活於酸性火口湖中的好氣性古細菌 Sulfolobus solfataricus 亦分離出胞內熱穩定性 α-GAL,該酵素是第 一個從古細菌分離出來具熱穩定性的罕見 α-GAL (Brouns, S. J. J.
et al. 2006)。
α-GAL 的真菌來源包含 Trichoderma reesei (Margolles-Clark et al. 1996)、Aspergillus oryzae (Iwashita and Egami 1973)、A. fumigatus (Puchart et al. 1999)、Gibberella fujikuroi (Mulimani and Ramalingam 1995) 、 Mortierella vinacea (Shibuya et al. 1997) 、 Penicillium simplicissimum (Luonteri et al. 1998)、Humicula sp. (Kotwal et al.
1999) 、 Thermomyces lanuginosus (Puchart et al. 2001) 與 Neosartorya fischeri P1 (Wang et al. 2014)。目前已生產的 α-GAL 多 分離自 Aspergillus 與 Penicillium 屬菌株 (Anisha 2017)。
6
表一、不同微生物來源之 α-galactosidase 生化特性 (Katrolia et al. 2014) Table 1. Biochemical properties of α-galactosidases from different microbial sources
6
7
7
8
(d) 基質專一性
Dey 等 (1984) 將 α-GAL 分為兩類,一類為僅能作用在小分 子基質 (如合成基質 pNP-α-Gal、天然低聚寡醣、蜜二糖與棉子糖) 的 α-GAL,當中包含了能催化水解 α-1, 2、α-1, 3 和 α-1, 4 糖苷 鍵的酵素。另一類則為可從刺槐豆膠與關華豆膠這類大分子半乳糖 甘露聚醣分解出乳糖的α-GAL (Dey et al. 1993)。
(e) 胺基酸序列同源性
糖苷水解酶 (GH) 依據催化機制差異、胺基酸序列同源性、親 核性與質子受體等特性共分為 145 個家族 (family),且依序列摺 疊方式不同分成 15 個 clan。根據 Carbohydrate-Active Enzymes Database (CAZy) 線上數據庫資料顯示,α-GAL 主要分布於 GH 4、
GH 27、GH 36、GH 57、GH 97 與 GH 110 家族中 (Cantarel et al.
2009; Lombard et al. 2014)。多數真核生物與少數原核生物 (如:
Clostridium josui Aga27A 、 Pseudomonas fluorescens subsp.
cellulosa Aga27A 與 Streptomyces coelicolor) 分離出的 α-GAL 屬於 GH 27 家族,而屬於 GH 36 家族的來源則以細菌為主 (Bakunina et al. 2016; Merceron et al. 2012; Rigden 2002)。在目前已
發現的 α-GAL 中,僅少數物種分離出來的酵素隸屬於其他家族,
如 GH 4 家族的 Bacillus halodurans 的 α-GAL、GH 57 家族的 Pyrocossus furiosus 的 α-GAL (Anggraeni et al. 2008; van Lieshout et al. 2003)、GH 97 家族的 Bacteroides thetaiotaomicron 的 α-GAL (Okuyama et al. 2009) 與 GH 110 家 族 的 Streptomyces griseoplanus、Bacteroides fragilis 及 Bacteroides thetaiotaomicron 的 α-GAL (Liu et al. 2008) (表二) 。
(3) α-半乳糖苷酶的催化機制與立體結構特性
GH 的 催 化 反 應 主 要 透 過 retention ( 又 稱 雙 取 代 反 應 , double-displacement) 或 inversion 兩種機制進行 (Zechel and Withers 2000)。α-GAL 基本上以 retention 的方式催化,但在 GH 110 家族中
9
表二、各 GH 家族的 α-半乳糖苷酶特性 (Katrolia et al. 2014) Table 2. Some characteristic of α-galactosidase of all CAZy families
9
10
也有利用 inversion 機制催化的 α-GAL (Liu et al. 2008)。
目前與 α-GAL 立體結構有關的研究以 GH 27 與 GH 36 為主 (表三)。GH 27 通常包含兩個 domains,GH 36 與 GH 97 則包含三個 domains。GH 36 與 GH 97 中皆含有一段 N-terminal β-supersandwich domain , GH 36 中 的 β-supersandwich 由 16-20 個 anti-parallel β-strands 與一些 α-helicese 構成,GH 97 則由 21 個 anti-parallel β-strands 與兩個 short 310-helices 組成。GH 27 與 GH 36 的 α-GAL 中 心的 triosephosphateisomerase (TIM) barrel 催化結構域 ((β/α)8 barrel catalytic domain) 與 GH 27 N 端的催化結構域具有高度同源性,在 GH clan-D 中為一段代表催化功能的常見 motif,而此一具有代表性的結構 在 GH 97 中則轉化成在連結 parallel β-strands 和 parallel α-helices 的 loops 中含有與數個 310-helices 的結構,且 β-strand 7 替換成 loop 結 構 (Merceron et al. 2012; Okuyama et al. 2009)。
GH 27 與 GH 36 兩個家族的酵素催化,主要由兩個位於 (β/α)8 barrel 底部的 Asp 分別做為親核基質與質子供應者共同協助進行,而 GH 97 則由 Glu 取代一個 Asp 做為質子供應者進行。GH 27、GH 36 與 GH 97 三個家族的 C 末端結構域都有類似 Greek motif 的 β-sandwich 結構 (Bakunina et al. 2016)。
催化活性位的立體結構依酵素與基質鍵結方式的不同,可分為口袋 型 (pocket)、裂縫型 (cleft) 與隧道型 (tunnel) 三類。分析酵素與基質 形成之複合體的立體結構可得知酵素的催化機制 (Bakunina et al. 2016)。
分離自 Trichoderma reesei 與 Thermotoga maritima 的單體酵素有較淺 的催化活性位,而源自 Lactobacillus acidophilus 與 Rumicoccus gnavus 的四聚體酵素之催化活性位則為較深窄的口袋型 (Fredslund et al. 2011)。
近期針對 GH 36 家族之 AgaA 與 AgaB 兩種熱穩定性 α-GAL 的立 體構型與定點突變研究中發現,兩酵素的熱穩定性與催化專一性差異是 由一個可影響活性位構型的胺基酸決定 (Merceron et al. 2012)。
11
(4) α-半乳糖苷酶的產業價值與應用
α-GAL 可應用在食品、飼料、造紙與醫療等工業領域中。並已開 發出許多商業酵素 (表三)。若能發現並生產符合產業需求的 α-GAL,
將有助於相關產業的推進與突破 (Katrolia et al. 2014)。
(a) 食品
人類與單胃動物因胰腺無法產生 α-GAL,使帶有 α-1,6 半乳 糖苷鍵的低聚半乳糖苷寡醣 (如:棉子糖與水蘇糖) 進入腸道後無 法於小腸分解吸收,而在進入大腸後,被腸道微生物分解而產生脹 氣及胃腸不適的徵狀。由於含有大量的半乳糖苷寡醣的豆類植物 (legume) 是人類日常飲食中重要的食品原料,現今食品工業已開始 著手利用 α-GAL 降低半乳糖苷寡醣含量以改善此一問題。
Anisha 與 Prema (2008) 發現利用 α-GAL 進行酵素法處理硬 皮豆 (Macrotyloma) 與綠豆粉末,可去除 90% 以上的棉子糖與水 蘇糖。相較於傳統上浸泡與烹煮的方式,可更有效地去除豆類食材 中的半乳糖苷寡醣。α-GAL 可利用酵素固定化技術,包埋於鹿角 菜膠、明膠、聚乙烯醇或海藻酸鈣,在大豆豆奶或鷹嘴豆奶製造過 程中有效地清除其中的低聚半乳糖苷寡醣,避免人體攝取後產生腸 道不適的徵狀 (Patil et al. 2009)。GRAS (generally recognized as safe) 微生物生產之 α-GAL 可藉由膳食補充品的形式促進消化,並減輕 脹氣 (Patel et al. 2013)。
α-GAL 也適用於協助生產各種寡醣,van Laere 等 (1999) 利 用 源 自 Bif. adolescentis 的 α-GAL , 經 半 乳 糖 轉 醣 作 用 (transgalactosylation) 合成出一種可被多種益生菌代謝並具有益生 源潛力的新形態寡醣。Goulas 等 (2009) 則利用了源自 L. reuteri 的 α-GAL,透過糖基轉移作用 (transfer reaction) 以蜜二糖與水蘇 糖生產出同樣具有益生原潛力的寡醣。在近期的相關的研究中 Nakai 等 (2010) 利用 E. coli 生產屬於 GH 36 的重組 α-GAL (AglC),藉糖基轉移作用生產出多達 13 種的 α-半乳糖苷寡醣。
Zhao 等 (2008) 發現了源自 Bif. breve 203 的重組 Aga2,除了將蜜
12
表三、市售 α-半乳糖苷酶產品之產品形式與來源 (Katrolia et al. 2014) Table 3. Commercially available α-galactosidase products and its source
13
二糖合成出帶有 Gal-α-1, 4 鍵結的三醣結構 (Gal-α-1, 4-Gal-α-1, 6-Glc) 外,還能利用 pNP-α-Gal 做為 donor,對於單醣、雙醣與糖 醇皆具有轉醣活性。相較於傳統上利用有機合成的方式生產機能性 寡醣,α-GAL 具有能大幅度地降低生產成本,進而擴大生產規模 的潛力。
(b) 飼料生產
大豆為多數禽畜類的飼料的主要成分。非反芻類動物的腸道中 缺乏 α-GAL,飼料中若含有半乳糖苷寡醣可能會使動物食用後產 生腸胃不適的現象,進而降低飼料的利用率。α-GAL 能有效去除 飼料中的棉子糖與水蘇糖,藉此提高動物的養分吸收率並降低消化 物的黏稠度 (Cao et al. 2009a)。因此生產飼料時可利用耐高溫的 α-GAL 進行處理,或將 α-GAL 做為飼料添加劑使用 (Cao et al.
2010)。研究證實在飼料中補充 α-GAL 能促進小豬 (piglets) 及禽 類的生長表現、養分攝取與腸道中大豆寡醣的消化率 (Ghazi et al.
2003; Pan et al. 2002)。
(c) 製糖
甜菜的製糖過程中,棉子糖的存在會影響產物結晶。α-GAL 可 移除甜菜糖蜜中的棉子糖,進而大幅促進蔗糖的晶體形成,提高製 糖產率 (Ganter et al. 1988)。
(d) 造紙
軟木中含有大量木質纖維素,半乳葡萄甘露聚醣是木質纖維素 中半纖維素的主要成分。半乳葡萄甘露聚醣上的半乳糖側支會阻礙 主要結構的水解,α-GAL 可催化水解半乳葡萄甘露聚醣側支上的 半乳糖切除 (Rättö et al. 1993)。紙漿工業中,經硫酸製漿法生產的 紙漿可利用 α-GAL、木聚醣酶與 β-甘露聚醣酶等酵素提升紙漿的 漂白效率 (Clarke et al. 2000)。
14
(e) 醫療
法布瑞氏症 (Fabry disease) 是一種 X 染色體上基因出現異常 產生的性聯遺傳疾病,患者細胞內的溶小體無法製造出正常具有活 性的 α-glactosidase A (α-GAL A),使體內以 globotriaosylceramide GL-3 為主的 neutral glycosphingolipids 無法被正常代謝,蓄積於 人體多處細胞的溶小體與細胞質中,進而引發腎臟、心臟、皮膚、
心血管與腦血管等器官病變,嚴重者有死亡風隩 (Schiffmann 2015)。
現行以注射 α-GAL A 進行酵素替代療法為主要治療方式。目前已 核可的兩種的用藥分別由中國倉鼠卵巢細胞 (CHO) 與人體纖維 母細胞做為宿主生產重組 α-GAL A 而得 (Eng et al. 2001; Morel and Clarke 2009)。
α-GAL 除了能催化寡醣、多醣、醣脂或醣蛋白中非還原末端 的半乳糖水解外,還能改變紅血球細胞的免疫專一性 (Chern et al.
2012)。細菌與植物生產之 α-GAL 已證實能催化移除 B 型紅血球 抗原中 α-1,3 鍵結的半乳糖,使 B 型血液轉變成 O 型 (Varbanets et al. 2001)。藉此,將有機會解決目前醫療上出現的缺血問題,與 器官移植產生的排斥現象 (Katrolia et al. 2014)。
(5) 微生物來源的 α-半乳糖苷酶
目前已應用於產業的 α-GAL 多源自於微生物。不同物種的微生物 因應其生長環境,演化出具有不同生化特性與催化機制的 α-GAL。掌 握物種與 α-GAL 生化性質的關連,將有助於篩選出適合特定用途的 α-GAL (Katrolia et al. 2014)。微生物來源之 α-半乳糖苷酶的特性如下:
(a) 反應 pH
一般細菌來源的 α-GAL 在中性 pH 值範圍 (pH 6.0-7.5) 具 有最佳的活性,部分細菌來源的 α-GAL 具有較廣泛的 pH 值耐受 性 (pH 值介於 5.5-12 之間),有利於產業上的應用 (Gote et al.
2006; Xiao et al. 2000)。通常真菌來源的 α-GAL 在酸性環境下 (pH 4.5-5.5) 有最佳的活性,部分真菌來源的 α-GAL 甚至可耐受腸胃
15
道中的極酸環境 (Wang et al. 2010)。僅少數真菌來源的 α-GAL 具 有大範圍 pH 值的耐受性 (Katrolia et al. 2012; Simila et al. 2010)。
(b) 反應溫度
真菌來源的 α-GAL,最適反應溫度大多介於 50-60 °Ϲ,少數 源自嗜 熱 性真菌 的 熱穩定 α-GAL 可耐受 65 °Ϲ 以上的高溫 (Kotwal et al. 1999; Naganagouda et al. 2007; Svastits-Dücső et al.
2009)。酵母菌來源的 α-GAL 對於溫度的耐受性相當於多數真菌,
可耐受約 50 °Ϲ 的中高溫度 (Murphy and Power 2002; Viana et al.
2006)。相較於真菌,細菌來源的熱穩定性 α-GAL 可耐受 70 °Ϲ 以 上的高溫 (Pessela et al. 2007),部分細菌來源的熱穩定性 α-GAL 在 極高溫下 (> 90°Ϲ) 仍具有活性。在食品、飼料、紙漿與製糖等工 業中,熱穩定性可大幅提升 α-GAL 處理效率並降低生產成本 (Brouns, S. J. et al. 2006; Fridjonsson et al. 1999)。
(c) 金屬離子、醣類與蛋白酶
各種來源的 α-GAL 具有不一樣的化學耐受性。許多金屬離子 會抑制 α-GAL 的活性,Ag2+、Cu2+ 與 Hg2+ 會與位於酵素活性位 中的特定胺基酸鍵結,阻礙基質與酵素的反應 (Gote et al. 2006;
Kondoh et al. 2005; Liu et al. 2009)。然而部分金屬離子則為 α-GAL 的 輔 酶 , 如 Cu2+、 Mn2+、 Mg2+ 與 K+ (El shafei et al. 1993;
Rezessy-Szabó et al. 2007; Scigelova and Crout 2000; Sripuan et al.
2003)。少數真菌來源的 α-GAL 則具有金屬離子抗性 (Kondoh et al.
2005)。
某些微生物來源的 α-GAL 活性會受到半乳糖、蜜二糖、棉子
糖與水蘇糖等醣類抑制,其中半乳糖是已知最強的醣類抑制劑 (Anisha et al. 2009; Chen et al. 2008; El shafei et al. 1993)。目前推測
抑制活性的原因可能是同樣帶有α-半乳糖苷鍵的醣類,會彼此競爭
α-GAL 上的催化活性位,進而影響活性。此外半乳糖為催化反應 的最終產物,如同許多酵素一樣,α-GAL 也會受到 end-product inhibition 影響,然而 Strep. griseoloalbus 與 R. miehei 生產的
16
α-GAL 可耐受濃度高達 100 mM 的半乳糖 (Anisha et al. 2009;
Katrolia et al. 2012)。
少數真菌來源的 α-GAL 具有蛋白酶 (包含 trypsin、pepsin、
subtilusin A 、 proteinase K 、 alkaline protease, collagenase 或 a-chymotrypsin) 抗性 (Katrolia et al. 2012)。
(d) 基質專一性
雖然α-GAL 對於不同鍵結方式的基質 (如:α-1, 2、α-1, 3、α-1, 4 或 α-1, 6) 具有相當高的專一性,但是對於不同苷元 (如烷基糖 苷、芳香糖苷或雙萜糖苷等) 則較具彈性。多數微生物來源的 α-GAL 對於 pNP-α-Gal 或 oNP-α-GAL 的水解活性高於蜜二糖、
棉子糖與水蘇糖等帶有 α-半乳糖苷鍵的天然醣類,顯示微生物來 源的 α-GAL 相較於烷基更易於與含有芳香基的糖苷作用。多數 GH 27 的 α-GAL 可水解含有 α-1, 6 鍵結之寡醣與聚醣,多數 GH 36 為分子量較大的四級結構,僅可水解寡醣 (Anisha 2017)。
(6) 微生物 α-半乳糖苷酶的選殖與表現
近年來許多微生物的 α-GAL 基因已成功地選殖並利用適合的宿 主進行表現。所生產出來的重組 α-GAL 相較於來源微生物有較低的生 產成本或更高的產率 (Ferreira et al. 2011)。多數真菌來源的 α-GAL 大 多以酵母菌進行胞外表現,其中利用 Pichia pastoris 系統表現可獲得較 高的比活性與產量 (Cao et al. 2009a; Mi et al. 2007; Simila et al. 2010)。
部分利用 S. cerevisiae 系統進行表現的 α-GAL 有較好的外泌效果 (Margolles-Clark et al. 1996; Shibuya et al. 1997)。受限於食品領域的應用,
源自於機會性病原真菌的 α-GAL,則會以 A. sojae 這類 GRAS 的菌株 進行表現 (Hashimoto et al. 1993)。相較於真菌,僅少數酵母菌發現並選 殖出 α-GAL (Murphy and Power 2002)。
許多細菌來源之 α-GAL 已利用 E. coli 進行異源表現,基因來源 包含具有食品應用潛力的乳酸菌 (Carrera-Silva et al. 2006; Silvestroni et al. 2002)、可生產熱穩定性酵素或生長需求較高的嗜熱菌 (King et al.
1998; Pessela et al. 2007) 以及嗜極高溫菌或古細菌 (Brouns, S. J. et al.
17
2006) 等。
(7) Anoxybacillus spp. 的 α-GAL
最早公開發表的 Anoxybacillus flavithermus 發現於紐西蘭的溫泉 中,起初命名為 Bacillus flavothermus,為生長溫度介於 30-70°Ϲ,可 產生黃色色素的兼性厭氧菌 (Heinen et al. 1982)。Pikuta 等學者於 2000 年時,依據菌株之 16S rRNA 序列與 DNA-DNA hybridization 的 結果提出 Anoxybacillus 為 Bacillaceae 科中的一個屬。Bacillaceae 科 的菌種屬於革蘭氏陽性菌,因富含具實用價值的蛋白與酵素,而成為 重要的工業微生物來源 (表四) (Goh et al. 2013)。
施 (2015) 從臺灣紅葉溫泉中分離出一株具有 α-GAL 活性的新種 嗜熱性溫泉菌 Anoxybacillus flavithermu HY-TTH-D23,並利用 E. coli 成功表現出首個從 Anoxybacillus spp. 選殖出的 α-GAL (rAFGAL),經 初步測試後發現,rAFGAL 不僅能耐受高達 65°Ϲ 的高溫,在 55°Ϲ 環 境中還具有活化的現象,此外 rAFGAL 還具有相當大的 pH 值耐受範 圍 (pH 5-10) 對於多數金屬離子 (Ca2+、Fe2+、K+、Mg2+、Mn2+、Na+、 Ni2+ 與 Zn2+) 與化學試劑 (Tween 80、Triton X-100、DTT、EDTA 與 PMSF) 皆具有良好的耐受性。
雖然 rAFGAL 是具有商業潛力的重要酵素,但是目前尚未針對產 率與生化相關特性有更進一步的研究,若能獲得更多與生產及特性有 關的資訊,將有助於 rAFGAL 實際的生產應用。
18
表四、Anoxybacillus 酵素的生化特性 (Goh et al. 2013)
Table 4. Summary of biochemical properties of enzymes from various Anoxybacillus species
19
2. 蛋白表現系統
隨著基因異源表現的技術日趨成熟,以重組蛋白的形式生產酵素已成 為主流。理論上只要將目標基因選殖到表現載體中,轉入選定的宿主細胞內,
經過宿主細胞的培養與蛋白的純化,就能取得理想的目標蛋白。但實際上每 個環節都有著數種影響最終蛋白產率的因素。宿主生長不良、包涵體的形成、
目標蛋白失去活性或不產生任何目標蛋白,都有機會出現在異源表現蛋白的 過程中(Rosano and Ceccareli 2014)。
(1) 宿主與載體的選擇
宿主細胞的選擇是生產步驟的核心,決定生產過程中所使用的技術、
分子工具、設備與試劑。相較於植物和動物,以微生物做為宿主除了生 產與純化成本較低外,還有易於控制生長與純化條件,以及利於調整生 產參數等優點。微生物的宿主包含細菌、真菌、酵母菌、絲狀真菌與單 細胞藻類等 (表五) (Carta and Jungbauer 2010; Demain and Vaishnav 2009) E. coli 是最常使用的宿主,其優點包含生理與分子特性等相關研 究深入、生長速率高、容易進行高細胞密度培養、可使用全合成培養基、
容易進行遺傳工程操作和已具備成熟的生產技術等。E. coli 在適當生長 條件下生長,世代時間僅約 20 分鐘,且以 1% 接種量開始培養,可 在幾個小時內達對數生長期 (Bentley et al. 1990; Sezonov et al. 2007)。
E. coli 表現系統主要缺陷為缺乏轉譯後修飾能力與蛋白外泌系統,且不 具有雙硫鍵修正機制,因而不利於許多胞外與結構複雜的真核生物蛋白 生產, 容 易 使蛋白 摺疊錯誤 產生不可溶且不具活性的 蛋白 包涵體 (inclusion body, IB) (Schumann and Ferreira 2004)。
常用的 E. coli 包含 BL21 品系與 K-12 品系 (Han 2016) (圖三)。
BL21 於 1986 年由 Studier 針對 B 品系的 E .coli (E. coli B cell) 改 造而成。BL21 除了保留 B 品系 E. coli 缺乏 lon 蛋白酶 (可水解多數 外源蛋白) 與 OmpT (會分解胞外蛋白,以釋放出胺基酸供細胞攝取),
利於外源蛋白的生產外,還保留了親代 (E. coli B834) 的 hsdSB 突變,
因 此 缺 乏 DNA 降 解 與 甲 基 化 修 飾 作 用 , 減 輕 質 體 佚 失 的 現 象 (Daegelen et al. 2009)。
20
表五、生產重組蛋白用宿主細胞的組成份比較 (Carta and Jungbauer 2010) Table 5. Composition of common host cells for expression of recombinant proteins
21
圖三、E. coli B strian 與 K-12 strian 之蛋白質體學特性比較。 (Han 2016) Figure 3. A summary of the distinctive proteomic features of both E. coli B and K-12.
22
噬菌體 T7 RNA 聚合酶可專一性辨識噬菌體的啟動子 (T7 啟動 子) 並以高於宿主 RNA 聚合酶的效率快速合成 RNA。透過將潛溶性 噬菌體 λDE3 與突變啟動子 lacUV5 嵌入 BL21 染色體中,使染色體 擁有受 lacUV5 啟動子調控的 T7 RNA 聚合酶基因,形成 BL21 (DE3)。
BL21 (DE3) 與其衍生菌株是目前為止最常用於蛋白表現的菌株之一,
可配合帶有 T7 啟動子的載體大幅提高外源蛋白的表現效率 (Studier and Moffatt 1986)。一般會先將選殖後的載體保存於不含 λDE3 潛溶性 噬菌體的菌株中 (如 E. coli DH5α),當需要表現時在轉入 E. coli BL21 等表現菌株中 (Bao et al. 2017; Hazari et al. 2017; Song et al. 1993)。
現代的蛋白質異源表現質體是由多重選殖切位、啟動子、篩選標記、
標籤蛋白與融合蛋白組合而成。載體中的 origin (複製起點) 會影響載 體在細胞中的複本數,常用的 E. coli 載體包含帶有 ColE1 origin (wild type) 的 pQE 系 列 ( 每 個 細 胞 約 15-20 copies) (Lee et al. 2006;
Lin-Chao and Bremer 1986)、擁有 pMB1 origin (ColE1 ori 衍生型) 的 pET 系列 (每個細胞約 15-60 copies) (Bolivar et al. 1977)、擁有 pMB1 ori 突變型的 pUC 系列(每個細胞約 500-700 copies) (Minton 1984)、擁 有 p15A ori 可同時使用兩種載體於同一宿主下共同表現不同基因的 pACYC 和 pBAD 系列 (每個細胞約 10-12 copies) (Chang and Cohen 1978; Guzman et al. 1995),與能夠使用三種載體於同一宿主下同時表現 的 pSC101 系列 (每個細胞含有 < 5 copies) (Nordstrom 2006)。
除了 copy number 外,啟動子也是外源蛋白表現效率的關鍵,高轉 錄效率的啟動子表現系統 (如前述 T7 啟動子表現系統) 可以在宿主 體內快速大量合成 mRNA,提高外源蛋白的整體產量。然而過高的外 源蛋白表現效率可能會阻礙宿主生長,反而不利於蛋白表現 (Jana and Deb 2005)。有鑑於此乳糖操縱子系統的運用可有效分隔宿主的繁殖與 外源蛋白表現兩個階段。配合宿主細胞的生長,於適當的時機添加適量 的誘導劑,可提升外源蛋白的產量。目前已開發出許多具誘導性的啟動 子表現系統,以乳糖與 isopropyl β-ᴅ-1-thiogalactopyranoside (IPTG) 誘 導的 lacUV5 啟動子可降低葡萄糖對乳糖誘導的抑制作用 (Jensen et al.
1993)。lacIQ則強化 represser 的抑制作用避免在尚未添加誘導劑時,微 量的外源蛋白表現 (啟動子滲漏,promoter leak) (Müller-Hill 1996;
Moffatt and Studier 1987)。運用色胺酸操縱子機制的 Trp 啟動子,與運 用阿拉伯糖操縱子機制的 araPBAD 啟動子,皆可有效改善 leak 現象
23
(Bass and Yansura 2000; Guzman et al. 1995)。結合 lac 與 trp 的 tac 啟 動子則接近理想保孚序列 (tac 位於序列上 -35 處,lac 位於序列上 -10 處),利於誘導後大量表現,並搭配源自於 λ 噬菌體的終止子防止過量 轉錄 (de Boer et al. 1983)。另有以溫度誘導的 p-L 啟動子與 csp A 啟 動子,可透過改變溫度的方式誘導蛋白大量表現 (Dodd et al. 2005;
Vasina et al. 1998)。
除了提高基礎表現量外,篩選標記 (selection marker) 的使用也可 提高外源蛋白產率。常用的篩選標記就是在載體中加入抗生素抗性基因,
如 amplicillin、kanamycine、chlorophenicol 與 tetracycline 等抗性基因。
值得注意的是,bla 這類產生分解酵素的抗生素抗性基因,會在抗生素 被分解殆盡後失去篩選含質體細胞的能力 (Korpimaki et al. 2003)。另外 以 plasmid-addition 概念開發的各種免抗生素系統,也逐漸應用於解決 質體佚失的問題,這類系統是先將宿主細胞染色體中影響生長的重要基 因剔除,再添加到質體中使不含質體的細胞無法生長,在不使用抗生素 的情況下汰選出含質體的細胞 (Kroll et al. 2010)。
為了能在表現或純化蛋白的過程中監測目標蛋白、提高蛋白純化的 便利性或提升目標蛋白的溶解度,可在設計重組蛋白時串聯一段功能性 肽鏈 做為 標籤 (Nilsson et al. 1997) 。常見的標籤蛋白如表 六所述 (Rosano and Ceccareli 2014),分子量小的蛋白標籤不太會對蛋白質功能 產生干擾,但在某些情況下會對目標蛋白的三級結構與生物活性產生負 面影響。若能掌握目標蛋白的摺疊結構,將有助於串聯位置的選擇 (Bucher et al. 2002; Khan et al. 2012; Klose et al. 2004)。
pET 載體系統是一類可供 E. coli 表現重組蛋白的強力載體系統。
載體中帶有 pMB1 ori 與受 T7 RNA 聚合酶專一性辨識與作用的 T7 啟動子 (Baneyx 1999)。將重組基因嵌入 T7 啟動子的下游,通過誘導 劑的控制,便可於染色體中含有 λDE3 潛溶性噬菌體的宿主細胞內,
大量轉錄重組基因,快速生產目標蛋白。在成功表現的情況下,目標蛋 白可達總蛋白量的 50% (Graumann and Premstaller 2006)。目前已有許 多帶有親和性標籤的重組蛋白成功利用 pET 載體系統於 E . coli 中生 產 (見表七)。
24
表六、常見蛋白標籤融合的特性 (Rosano and Ceccareli 2014) Table 6. Main characteristics of protein fusion tags
25
表七、常見用於以 E. coli 為表現宿主生產可溶性蛋白的載體 (Peti and Page 2007) Table 7. Subset of expression vectors typically used for the production of soluble
protein in E. coli
26
(2) 影響 E. coli 表現外源蛋白效率的因素
(a) 載體的結構
影響外源蛋白表現的基因元件包含轉錄相關的啟動子、終止子 與 RNA 聚合酶,轉譯相關的 Shine-Dalgarno 序列、起始密碼子 與促轉譯因子。其他包含副本數控制相關的 replication origin、篩 選標記與標籤蛋白等。構築或選用載體時需審慎考慮宿主與目標蛋 白 的 特 性 , 並 針 對 蛋白 生 產 與 純 化 相 關 流程 進 行 縝 密 的 規 劃 (Fakruddin et al. 2013)。
(b) 目標基因密碼子的使用
由於一種胺基酸可以對應不只一組密碼子,當外源編碼 DNA 的同義密碼子出現頻率明顯低於宿主時,就容易出現密碼子偏差的 現象 (Angov et al. 2008)。在大量合成目標蛋白胺基酸序列的過程 中,稀有密碼子對應的 tRNA 缺乏或供應不足,影響核糖體合成 胺基酸序列的效率,甚至造成目標蛋白合成中斷,生產出來的蛋白 因 而結 構不完 整或 無 法摺疊 出具有 活性 的 構形 (Sørensen and Mortensen 2005)。
目前可透過外源序列的密碼子最適化,以定點突變改變序列上 特定鹼基,將稀有密碼子修飾成適合宿主的密碼子或增加稀有密碼 子對應之 tRNA 的生產來解決密碼子不相容的問題 (Gao et al.
2004)。
(c) 目標基因套數與質體穩定性
質體的複本數會影響存在於宿主細胞中目標基因的套數,在能 量充足的情況下,單位細胞中質體數量越多,生產出來的蛋白也會 越多,但實際情況須視宿主與載體間的相容性及宿主培養條件而定 (Paulsson and Ehrenberg 2001)。經由轉形進入宿主的質體載體,會 因為質體與宿主基因型不相容、外源目標基因太大、宿主分裂期間 質體分配不均、維持質體耗損能量過大或不利宿主的生長條件 (如
27
pH 值、溫度、通氣量、培養基成分組成或產物蛋白過度累積),而 產生宿主丟失質體的現象 (Friehs 2004)。目前可透過抗生素或使用 runaway-replication 質體來維持宿主的質體穩定性 (Nordstrom and Uhlin 1992)。
(d) 目標蛋白的穩定性與包涵體的形成
當外源基因在 E. coli 表現時,細胞環境與其原生細胞可能差 異極大,新生的重組多肽必須在 pH 值、滲透壓、氧化還原電位、
摺疊輔助因子與摺疊機制可能完全改變的情況下,累積於不具外泌 系統的 E. coli 細胞內。因此當 E. coli 快速大量生產外源蛋白時,
常產生未正確摺疊的新生多肽,其疏水性結構彼此相互作用,產生 絮 聚 現 象 (aggregation) , 形 成 不 溶 於 水 且 不 具 活 性 的 包 涵 體 (inclusion body,IB) (Betts and King 1999)。此外 E. coli 的細胞質屬 於不利於雙硫鍵形成的還原環境,然而形成正確的雙硫鍵對於蛋白 質立體結構與生理活性至關重要,雙硫鍵的錯誤鍵結也會造成錯誤 摺疊而產生絮聚現象 (Mahalik et al. 2014; Ramón et al. 2014)。
雖然 IB 的形成有利於表現對宿主帶有細胞毒性的外源蛋白,
但 維 持 蛋 白 的 活 性 則 能 減 少 額 外 的 蛋 白 純 化 成 本 (Dumon-Seignovert et al. 2004; Ramón et al. 2014)。工業上除了針對 IB 形成原因發展出許多減少 IB 產生、並提高可溶性蛋白產量的 方法外,也常透過胞外復性的方式重新摺疊蛋白。
(e) 宿主細胞的生長
外源蛋白的整體產量常與宿主細胞總量呈正比,轉入外源質體 並表現外源基因會大幅度消耗宿主的能量,影響宿主的代謝作用,
並降低宿主的生長速率 (Saraswat et al. 1999)。產物蛋白的累積、培 養基的組成、pH 值、溫度、通氣量和傳質效率都會影響細胞的生 長與外源蛋白的合成速率 (Choi et al. 2006; Studier 2005)。有些表現 宿主如,E. coli K-12 以提高細胞生長密度的方式大量生產外源蛋 白時,一旦環境中碳源或氧氣耗盡,會增加內毒素的累積,並改變 醱酵液的 pH 值進而影響宿主生長 (Negrete et al. 2013)。監測宿主
28
的生長情形、以饋料形式補充碳源與氮源,或以可誘導式的表現系 統調控蛋白表現時機,皆可有效改善宿主生長狀態 (Fakruddin et al.
2013)。
(3) 改善蛋白表現量的策略
即使針對蛋白仔細挑選了載體與宿主,也不能確保所有轉形成功的 基因都能在選定的宿主中成功大量表現。無或低產量、promoter leak 現 象、質體不穩定,與 IB 的形成等,都是可能產生的負面情況。因應不 同的表現狀況,可選擇不同的策略改善蛋白生產 (表八) (Sørensen and Mortensen 2005)。除了考慮更換載體、宿主或密碼子最適化之外,降低 宿主培養和生產時的溫度、改變誘導條件、 chaperones 與目標蛋白共表 現或改變起始培養基的組成 (添加輔助蛋白摺疊的試劑或影響蛋白生產 的醣類) 等,都能有效改善蛋白表現情形 (Fakruddin et al. 2013)。
29
表八、提高 E. coli 蛋白表現量的策略 (Rosano and Ceccareli 2014)
Table 8. Strategies for overcoming common problems during recombinant protein expression in E. coli
30
3. 蛋白純化
蛋白純化技術的發展是過去數十年生物應用科技領域進展的重要推手,
材料的改進、儀器的開發與標籤蛋白的使用,為蛋白純化的方式提供了許 多選擇。純化效率會受到純化過程中溫度、pH 值、設備種類、時間、純化 用介質與試劑等影響。蛋白變性、水解或污染 (包含熱原、核酸、細菌與 病毒等) 更是純化過程中經常出現的問題。利用 E. coli 等宿主生產功能性 蛋白時,除了要注意影響蛋白表現的相關因素外,提高目標蛋白純化效率、
降低純化成本、減少純化過程中蛋白的耗損並維持活性,同樣是影響目標 蛋白生產的重要關鍵。若能正確選擇純化技術並妥善控制純化相關參數,
將能更進一步提高蛋白生產效率 (Janson 2012; Lee 2017)。
(1) 細胞破碎方法
多數異源表現的蛋白位於細胞內,純化胞內蛋白就必須破碎細胞。
細胞破碎可分為物理性與非物理性兩類。非物理性細胞破碎方法包含滲 透壓法、凍融法、化學處理與酵素法等 (Middelberg 1995)。滲透壓法是 將細胞懸浮於特定濃度範圍的蔗糖或甘油,並迅速降低溶液的滲透壓,
使細胞內的滲透壓提高進而脹破細胞壁。凍融法則是透過反覆冷凍與解 凍,使細胞內的水分形成冰晶脹破細胞,並破壞細胞膜上的疏水性作用 力增加細胞膜的通透性,此成本低廉但不適用於純化對溫度敏感的蛋白。
上述兩種方式僅適用於較脆弱的細胞結構。另一方面以酸、鹼、有機溶 劑、界面活性劑或金屬離子螯合劑等化學試劑處理可能會影響目標蛋白 的活性,或造成後續純化上的不便 (如 EDTA 會影響 Ni2+ 親和性層析)。
然而酵素成本較高,不利於大量操作。因此若要大量破碎細胞,會傾向 使用物理性的破菌方式 (Harrison 1991; Hopkins 1991)。
物理性方法包含顆粒研磨、高壓均質與超音波處理等。顆粒研磨是 透過玻璃、氧化鋁或石英砂等顆粒與細胞共同攪拌或震盪,藉此形成剪 切力破碎細胞,破菌效果良好但操作時間較長 (Ramanan et al. 2008)。高 壓均質的方式利用壓力迫使細胞懸浮液通過狹窄的孔閥,藉此形成壓力 與剪切力破壞細胞,此方法操作時間短,利於大規模操作,但其功率轉 換效率較差且蛋白耗損率較高,不利於少量製備時使用。超音波破菌是 利用 15-25 kHz 的高頻率音波,使細胞懸浮液產生微小空泡,並藉由空泡
31
破裂時所產生的剪切力破壞細胞壁,同時使細胞中的核酸斷裂,減少均 質液的黏性。超音波破菌效率高,但功率轉換效率較差,且不利於放大 操作規模,較適合實驗室使用 (Carta and Jungbauer 2010; Middelberg 1995)。
細胞破碎方式的選用除成本的考量外,還需考慮整體操作規模與後 續純化方式而定 (有關於細胞破碎的原則如圖四所示),亦可結合非機械 與機械兩種破碎方法來增加效率,通常先以非物理性方法 (如:改變 pH 值或使用溶菌酶) 增加細胞通透性再以物理方法破碎細胞,縮短處理時間 (De Mey et al. 2008)。
32
圖四、細胞破碎方法與原則 (Janson 2012) Figure 4. Principles and methods for cell breakage.
33
(2) 蛋白的專一性純化技術
細胞破碎後的均質液經離心或過濾後可得到含有大量雜質的蛋白粗 萃物 (crude),粗萃物需透過更進一步的濃縮純化,才能去除雜質或溶劑 以獲得理想純度的目標蛋白。已知的濃縮純化方法包含:液相層析、沉 澱、透析、超濾 (ultrafiltration) 與冷凍乾燥等 (Carta and Jungbauer 2010)。
(a) 液相層析
液相層析是透過物質對於固定相 (膠體或吸附劑) 與移動相 (緩衝溶液) 之間作用力的差異來分離目標蛋白與雜質。一般將做為 固定相的膠體裝於塑膠、玻璃或不鏽鋼材質的管柱中,再將做為移 動相的緩衝液以幫浦注入管柱。藉由改變緩衝液,可改變管柱內部 的 pH 值與鹽類、界面活性劑、還原劑、金屬離子和螯合劑等濃度。
影響管柱內物質間的氫鍵、離子鍵、凡得瓦力與疏水性作用力等作 用。常用於純化蛋白的層析方式,依作用性質差異可分為:以分子 大小分離蛋白的凝膠過濾層析 (size exclusion chromatography, SEC)、
透 過 電 荷 的 改 變 進 行 蛋 白 分 離 的 離 子 交 換 層 析 (ion exchange chromatography, IEC)、利用分子表面疏水性作用力的疏水性作用層 析 (hydrophobic interaction chromatography, HIC) 及 逆 相 層 析 (reverse chromatography, RPC)、利用生物專一性作用力 (biospecific chromatography, BIC) 或金屬離子專一性螯合 (metal chelate, MIC 又稱 immobilized metalion affinity chromatography, IMAC) 的親和性 層 析 (affinity chromatography) 等 ( 表 九 ) (Carta and Jungbauer 2010)。
i. 親和性層析
親和性層析法是利用蛋白表面特定基團與固定相間的專一 性作用力,純化目標蛋白。將專一性配體 (ligand) 共價鍵結在 固定相膠體上,當樣本通過管柱時,與配體作用力較強的蛋白與 固定相結合,不具專一性作用力的分子則隨流動相洗出管柱,隨
34
表九、依固定相及移動相成份所進行液相層析分類 (Carta and Jungbauer 2010) Table 9. Branches of chromatography defined by the nature of the stationary phase
ligate and mobile phase composition
35
後再透過改變 pH 值或提高特定化合物濃度的方式破壞專 一性作用力而流洗出目標蛋白。常見的專一性作用組合包含抗體 與抗體、酵素與基質、酵素與抑制因子、賀爾蒙與受體等 (Burgess and Deutscher 2009)。
ii. 固定化金屬離子親和性層析
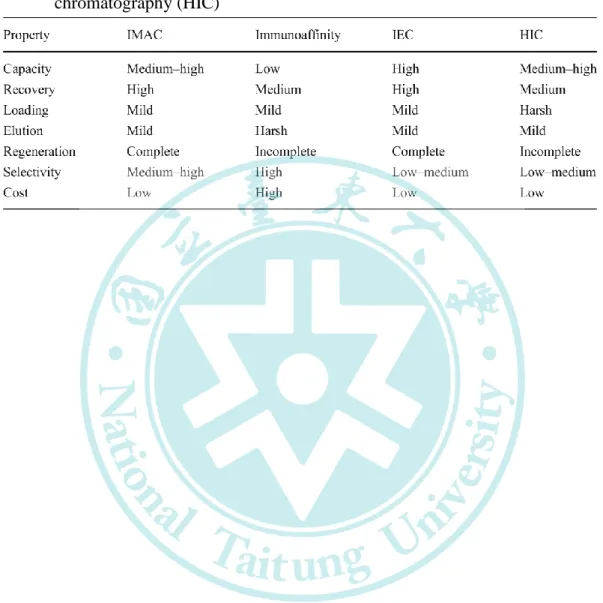
固定化金屬離子親和性層析 (immobilized metalion affinity chromatography, IMAC) 的概念最早由 Porath 等人 (1975) 提 出,是以過渡金屬離子 (如 Zn2+、Cu2+、Ni2+ 與 Co2+) 對於特 定胺基酸 (cysteine、histidine 與 tryptophan) 在水溶液中的親和 力為基礎所發展出來的技術。相較於其他液相層析方式 (表十),
IMAC 法除了具有便捷、專一性高與成本低廉等優勢外,工業 上亦開始 IMAC 法來生產蛋白 (表十一),其生產規模可從毫升 線性放大到公升層次 (Randy, 2012)。
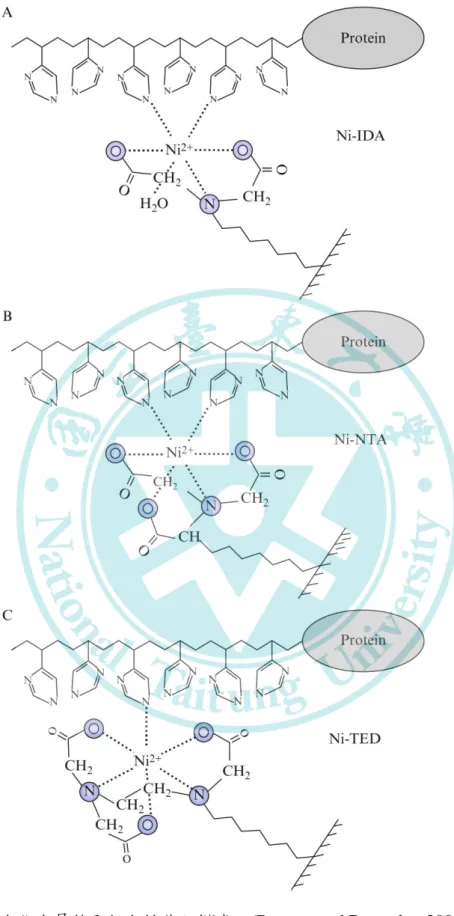
NTA (nitrilotriacetic acid) 為一有機金屬螯合劑,可與 Cu2+、 Mg2+ 與 Ni2+ 等二價金屬離子螯合。螯合 Ni2+ 離子的 NTA 可 專一性吸附帶有 His 基團的分子,利用此結構進行 6X-His 標 籤 (His-tag) 蛋白的純化 (圖五),可單步大幅提高蛋白的純度 (從 < 1% 純化至 > 98%) (Janknecht et al., 1991)。隨著 IMAC 廣泛應用,以 NTA 做為配體運結合親和性層析法來純化蛋白的 方式,已大量運用於重組蛋白生產中 (表十二)。
36
表十、IMAC、免疫親和層析、離子交換層析 (IEC) 與疏水性作用層析的比較 (Cheung et al. 2012)
Table 10. Comparison between IMAC, immunoaffinity chromatography, ion-exchange chromatography (IEC), and hydrophobic interaction chromatography (HIC)
37
表十一、利用固定化金屬離子親和性層析純化的蛋白 (Janson 2012)
Table 11. Purification of proteins by immobilized metalion affinity chromatography
38
圖五、固定化金屬離子親和性作用模式 (Burgess and Deutscher 2009)
Figure 5. Model of the interaction between residues in the His-tag and the metal ion In A. tri- (IDA), B. tetra- (NTA), and C. pentadentate immobilized metalion affinity chromatography ligands (TED)
39
表十二、市售固定化金屬離子親和性層析相關商品 (Janson 2012)
Table 12. Commercially available chromatographic supports for immobilized metalion affinity chromatography
40
4. 包涵體復性
使用 E. coli 高效率地表現重組蛋白時,會因疏水性作用力的影響或 蛋白的不正確摺疊而產生包涵體 (inclusion body, IB) (圖六) (Vallejo and Rinas 2004)。儘管在多數情況下,IB 的產生並不利於重組蛋白的生產,但 使用 IB 的形式來生產重組蛋白仍具有許多優點,例如:因 IB 不具活性 故利於具有生物毒性的蛋白表現,體積與密度較其他胞內蛋白和細胞碎片 大而利於分離,IB 同時不被蛋白酶水解,利於易分解蛋白生產。IB 結構 均一性高,因此目標蛋白在生產過程中維持較高純度,減少分離所需步驟 等。為了提高重組蛋白的產量,除了針對 IB 形成機制,透過降低生產溫 度、改變誘導條件、以及添加或共表現 chapherones 來減少 IB 的產生外,
目前已發展出許多利用 IB 純化出活性蛋白的技術並應用於工業生產中 (Englander and Mayne 2014; Jungbauer and Kaar 2007)。
(1) 常用的 IB 復性技術
利用 IB 生產重組蛋白的流程主要包括 IB 的分離、溶解 (或稱變 性 denature)、重新摺疊 (或稱復性 renature) 與摺疊後蛋白的純化步驟 (圖七)。回溶步驟時蛋白二級結構解開,與重新摺疊過程中變性蛋白的 絮聚沉澱,是影響 IB 復性效率的主要原因。因此如何將不可溶且不具 活性的 IB 更有效率地轉換成摺疊正確的可溶蛋白,是利用 IB 生產重 組蛋白的主要挑戰 (Clark 2001)。有關 IB 復性步驟細節分述如下:
(a) IB 的分離與回溶
因 IB 的密度較高,在細胞破碎後會先以低速離心的方式分離。
分離後較低純度的 IB 會更進一步以高濃度 (6-8 M) 的變性劑,如:
尿素或胍鹽酸 (guanidine hydrochloride) 合併添加 SDS、N-cetyl trimethyl ammonium chloride 或 sarkosyl (sodium N-lauroyl sarcosine) 等界面活性劑進行 IB 回溶。這些試劑的主要作用是破壞蛋白間的 氫鍵、雙硫鍵與疏水性作用力,使絮聚的蛋白分離變性成一級結構。
隨後逐步降低試劑濃度,使變性後的 IB 自然摺疊出正確的構形。
此外可透過添加金屬離子螯合劑 (如 EDTA)、還原劑 (如
41
圖六、蛋白正確摺疊、錯誤摺疊與絮聚的關係示意圖 (Vallejo and Rinas 2004) Figure 6. Simplified model of correct folding versus misfolding and aggregation. The
correct protein folding pathway (1) often competes with misfolding (2) and aggregation (3). Aggregation occurs among intermediates with exposed hydrophobic patches, which are buried in the correctly folded protein (dark lines, hydrophilic solvent-exposed parts of the protein; gray lines:
hydrophobic patches).
42
圖七、提升包涵體活性蛋白回收率的純化策略 (Clark 2001)
Figure 7. Purification strategy for improved recovery of bioactive protein from inclusion bodies.
43
β-mercaptoethanol 或 dithiothreitol) 以及半胱胺酸,控制氧化還 原電位,避免形成錯誤的雙硫鍵 (Clark 2001; Eiberle and Jungbauer 2010)。
(b) IB 的復性與純化
在小規模的研究中,復性主要透過稀釋法 (dilution) 進行。稀釋 法 包 括 將 復 性 用 的 緩 衝 液 加 入 已 變 性 的 蛋 白 溶 液 中 (reverse dilution)、快速將蛋白溶液直接加入復性用緩衝溶液 (flash dilution),
與將蛋白溶液緩慢滴入復性用緩衝液 (drip dilution) (Jungbauer and Kaar 2007)。稀釋復性的操步驟十分簡單,但過程費時且緩衝液需求 量大。此外在復性過程中還需要謹慎控制蛋白濃度,避免蛋白的絮 聚現象。利用稀釋法復性的產物,後續仍需借助透析或管柱層析等 方式純化已復性的蛋白。稀釋法結合 SEC 與透析等技術,或利用 pulse renaturation 與 fed-batch dilution 等方法為目前工業上常使用 的復性方式 (Eiberle and Jungbauer 2010; Yamaguchi and Miyazaki 2014)。
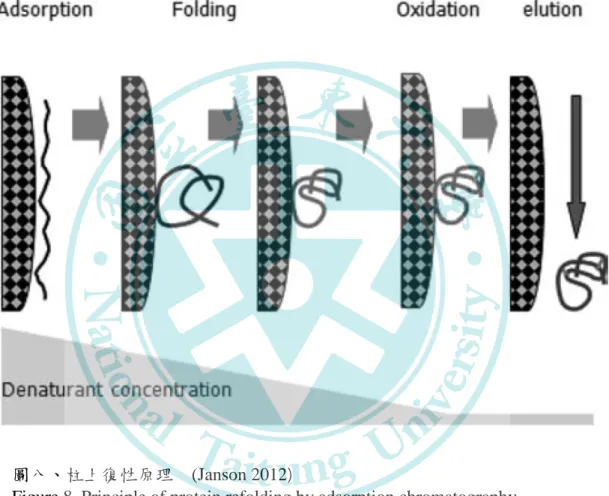
其他復性技術還有利用壓力反應槽搭配低濃度變性劑,在 1-3 kbar 高靜液壓力的環境下復性的高壓復性法、利用改變溶液 pH 值 (pH 8-12),影響 IB 溶解度以協助復性的鹼性 pH 復性法,與利用 chaperones 進行體外復性等方式 (Jungbauer and Kaar 2007)。在眾多 選擇當中,柱上復性技術 (on-column refolding) 是目前最常使用的 復性方法。該方法是先將變性後蛋白鍵結在管柱中的固定相,再逐 步降低做為移動相的變性劑濃度來達到復性的目的 (圖八)。隨著研 究上的進展,柱上復性技術配合不同類型的層析方式 (包含 SEC、
IEC、HIC 與 IMAC),已開發出許多具有實用價值的復性方法並大 量應用於重組蛋白的生產中 (表十三)。有關柱上復性的過程十分複 雜,涵蓋的範圍包含蛋白本身的摺疊、變性蛋白與固定相配體間的 作用機制以及管柱的操作等,目前對於其背後機制的了解仍相當有 限,尚未能為完全解釋柱上復性的作用原理 (Burgess and Deutscher 2009; Janson 2012; Zhai et al. 2016)。
44
圖八、柱上復性原理 (Janson 2012)
Figure 8. Principle of protein refolding by adsorption chromatography
45
表十三、利用柱上復性生產蛋白之應用 (Janson 2012) Table 13. Chromatographic refolding applications