國立交通大學
影像與生醫光電研究所
碩士論文
聚(7,10-仲苯并
苊基乙烯)衍生物之合成及光學性
質研究
Synthesis and Optical Properties of Poly(7,10-
benzacenaphthene vinylene) Derivatives
研 究 生:林建弘 Jian-Hung Lin
指導教授:楊勝雄 博士 Dr. Sheng-Hsiung Yang
聚(7,10-仲苯并苊基乙烯)衍生物之合成及光學性質研究
Synthesis and Optical Properties of Poly(7,10-benzacenaphthene vinylene) Derivatives
研究生:林建弘 Student:Jian-Hung Lin
指導教授:楊勝雄 博士 Advisor:Dr. Sheng-Hsiung Yang
國立交通大學 影像與生醫光電研究
所碩士論文
A Thesis
Submitted to Institute of Imaging and Biomedical Photonics College of Photonics
National Chiao Tung University in partial Fulfillment of the Requirements
for the Degree of Master
in
Imaging and Biomedical Photonics April 2012
Tainan, Taiwan, Republic of China
聚(7,10-仲苯并苊基乙烯)衍生物之合成及光學性質研究 研究生:林建弘 指導教授:楊勝雄 博士 國立交通大學影像與生醫光電研究所 摘要 本研究之目的在於合成兩種不同側鏈取代基團之聚(7,10-苯并苊 基乙烯)衍生物,取代基為癸基及雙苯環液晶基。為了增加分子量並 調控光色,亦與 MEH-PPV 單體進行共聚。除了化學結構鑑定外,亦 探討其光學、電化學及熱性質,並製作雙層高分子有機發光二極體, 評估其在電激發光元件之應用潛力。 所有聚合物均採用 Glich 路徑聚合。聚合物 1P 僅為寡聚物,其玻 璃轉移溫度為 157 o C;聚合物 2P 之分子量則增為 2.04×105 g/mol,其 玻璃轉移溫度亦提昇為 207 o C。此乃雙苯環液晶基導入之結果。 聚合物 1P 薄膜態之紫外-可見光最大吸收及螢光最大放射波長分 別位於 370 及 482 nm,聚合物 2P 薄膜態之紫外-可見光最大吸收及 螢光最大放射波長分別位於 365 及 508 nm,兩者皆具有藍綠色的螢 光。CV 結果顯示聚合物 1P 之 HOMO、LUMO 及能隙分別為-5.99, -3.05 及 2.94 eV,而 2P 則為-5.63, -3.05 及 2.94 eV。HOMO 大小不同 是由於聚合物 2P 所連接液晶基所導致。
聚合物 3P 之薄膜態最大吸收波長為 368 nm,氧化電位為 1.54
eV,其性質類似於 1P;共聚物 4P 及 6P 之光學性質類似。這些材料
以 5P 元件表現較佳,在 ITO/PEDOT/polymer/Al 元件結構下,亮度及 電流效率分別達到 202 cd/m2及 0.009 cd/A。
Synthesis and Optical Properties of Poly(7,10-benzacenaphthene vinylene) Derivatives
Student: Jian-Hung Lin Advisor: Dr. Sheng-Hsiung Yang Institute of Imaging and Biomedical Photonics
National Chiao Tung University
Abstract
The aim of this research is to synthesize two kinds of poly(7,10- benzacenaphthene vinylene) derivatives with two different side substituents, including n-decyl group and biphenyl liquid crystalline mesogen. In order to increase molecular weights and tune emitting colors, copolymerization was also carried out with the monomer of MEH-PPV. In addition to the identification of chemical structures, the optical, electrochemical, and thermal properties of all polymers were investigated as well. Double-layer polymer light-emitting diodes were fabricated, and their potential use in electroluminescent devices were evaluated.
All polymers were synthesized via the Gilch polymerization. Polymer 1P is an oligomer with a glass transition temperature of 157 oC. The
molecular weight of polymer 2P is increased to 2.04×105 g/mol; its glass
transition temperature is also increased to 207 oC, as a result of
incorporating biphenyl liquid crystalline mesogen.
The maximum absorption and PL emission wavelengths of 1P thin film are located at 370 and 510 nm, respectively. The maximum absorption and PL emission wavelengths of 2P thin film are located at 365 and 508
nm, respectively. Both of them show bluish-green fluorescence. The CV analysis shows that the HOMO, LUMO, and bandgap of polymers 1P and 2P are -5.99, -3.05, 2.94 eV, and -5.63, -3.05, 2.94 eV, respectively. The difference in HOMO is due to the liquid crystalline mesogen attached to 2P chains.
The maximum absorption wavelength of 3P thin film is found at 368
nm, while its oxidation potentialis 1.54 eV, which are similar to 1P. The
optical properties of copolymers 4P and 6P are similar. Among these materials 5P shows better device performance. The brightness and current
efficiency of 5P were reached 202 cd/m2 and 0.009 cd/A, respectively,
誌 謝 這本論文之完成,首先要特別感謝論文指導教授楊勝雄博士的指 導與鼓勵,不論是研究方向的指引或是為人處世的指導,都讓我受益 良多。論文口試期間,承蒙蘇海清教授及張書文教授之撥冗指正,並 提供寶貴意見,使本論文更加充實。 我要感謝實驗室夥伴譔憲、永俊及冠達,在我學習過程中提供我 建議與實驗技巧,彼此間互相打氣與加油,幫助我解決許多問題。我 祝福譔憲及永俊,你們在事業上能夠闖出屬於自己的一片天。由衷的 感謝實驗室的學長給我的指導,特別是實驗室博班學長凱鈞及蘇海清 實驗室廖志騰學長於實驗上的指導與製程上的幫忙。另外,亦要感謝 實驗室的學弟們佳昇、國志、予強、力中、維勝、子軒、國兼、彥廷、 于聖、徐雍、建威、建璋等人互相打氣與加油,為苦悶的研究生涯注 入不少歡樂的氣氛。 最後,謹以此論文獻給摯愛的父母、哥哥及朋友們,你們的支持 和關心,使我可以順利完成學業。
目錄 頁次 摘要(中文) ……… i 摘要(英文) ……… iii 誌謝 .……….... v 目錄 .……….... vi 流程目錄 ………. ix 圖目錄 ………. x 表目錄 ………. xi 第一章 緒論………. 1 1-1前言……….. 1 1-2共軛高分子的電激發光原理……….. 3 1-2-1 發光機制………... 3 1-2-2 光激發光(Photoluminescence, PL)原理………... 6
1-3高分子發光二極體(Polymer Light Emitting Diode, PLED)材料 1-3-1 簡介………. 7
1-3-2 PPV 系列聚合物之合成……….. 11
1-4研究動機………... 13
2-1 試藥………... 17 2-2 鑑定儀器………... 17 2-3 PLED 元件製作………... 19 2-3-1 ITO 基板清洗步驟………... 19 2-3-2 元件製作流程………..19 2-4 聚合物單體 1M 和 2M 之合成………. 20 2-5 聚合物及共聚物 1P~6P 之合成……….. 28 第三章 結果與討論………... 35 3-1 單體 1M 及 2M 之合成與鑑定………... 35 3-2 聚合物 1P~6P 之合成與鑑定………. 36 3-3 熱性質分析... 39 3-4 UV-Vis 與 PL 之分析………. 45 3-4-1 UV-Vis 光譜分析………. 45 3-4-2 PL 光譜分析………. 46 3-5 電化學分析………..…….. 53 3-6 元件光電性質之量測……….... 56 第四章 結論………64 第五章 參考文獻………...….65
流程 目錄
Scheme 1. Synthesis of monomer 1M……….. 31
Scheme 2. Synthesis of monomer 2M... 32
Scheme 3. Synthesis of polymers 1P and 2P……… 33
表 目錄
Table 1-1. The work function of electron injection electrodes……….. 5
Table 3-1. The Mn, Mw, and PDI values of polymers 1P~6P…….. 37
Table 3-2. (a) UV-Vis absorption λmax and (b) PL emission λmax of
polymers 1P~6P……….. 53 Table 3-3. The electrochemical properties of all polymers………….. 56 Table 3-4. Device characteristics of all polymers……….58
圖 目錄
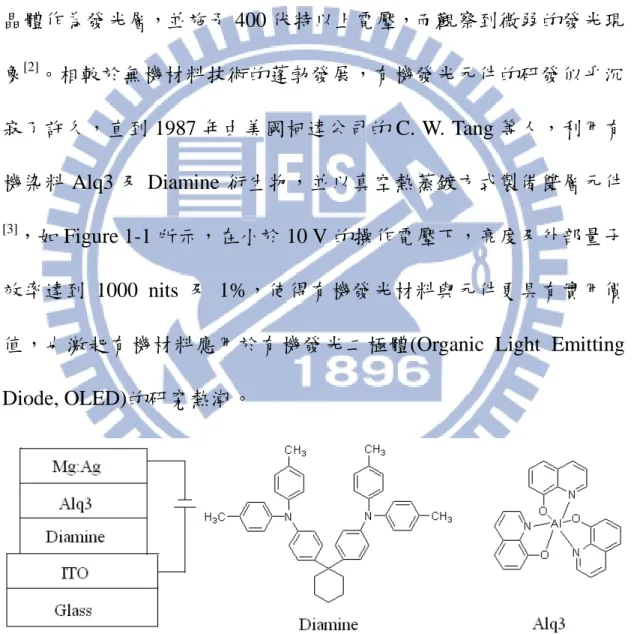
Figure 1-1 Device of ITO/Diamine/Alq3/Mg:Ag………1
Figure 1-2 Device of ITO/PPV/Al……….……. 2
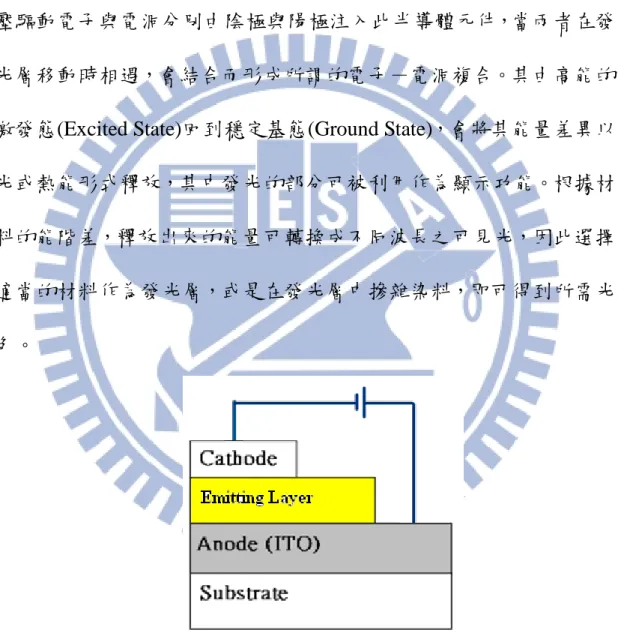
Figure 1-3 Illustration of OLED Devices………... 3
Figure 1-4 Schematic illustration of OLED energy level diagram……..5
Figure 1-5 Illustration of PL…... 6
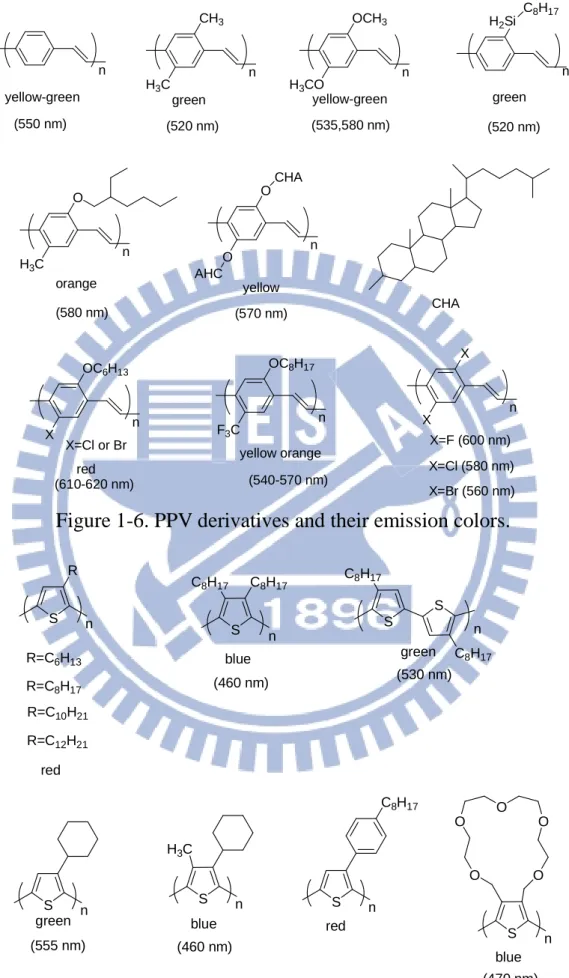
Figure 1-6 PPV derivatives and their emission colors…...…... 8
Figure 1-7 Poly(alkylthiophene) derivatives and their emission colors. 8 Figure 1-8 Examples of blue-emitting materials………... 9
Figure 1-9 Examples of copolymer materials ……….. 10
Figure 1-10 Wessling procedure and chlorine precursor route to PPVs 12 Figure 1-11 Gilch route and Wittig routes to PPVs……….... 13
Figure 1-12 The structure of PBV and PBV derivatives……… 14
Figure 1-13 The structure of PBV derivatives……… 15
Figure 3-1 The 1H-NMR spectra of 1M and 1P………...37
Figure 3-2 The 1H-NMR spectra of 2M and 2P………...38
Figure 3-3 The 1H-NMR spectra of 2M and 5P………....39
Figure 3-4 TGA thermograms of polymers (a) 1P, 3P, 4P and (b) 2P, 5P, 6P………..…………..… 41
Figure 3-6 DSC thermograms of polymers (a) 3P (b) 4P.…………... 43
Figure 3-7 DSC thermograms of polymers (a) 5P (b) 6P.…………... 44
Figure 3-8 UV-Vis absorption spectra of polymer 1P………..….47
Figure 3-9 UV-Vis absorption spectra of polymer 2P………..… 48
Figure 3-10 UV-Vis absorption spectra of polymer 3P………..… 48
Figure 3-11 UV-Vis absorption spectra of polymer 4P…………..…… 49
Figure 3-12 UV-Vis absorption spectra of polymer 5P……….. 49
Figure 3-13 UV-Vis absorpiton spectra of polymer 6P……….. 50
Figure 3-14 PL spectra of polymer 1P……….50
Figure 3-15 PL spectra of polymer 2P……….51
Figure 3-16 PL spectra of polymer 3P……….51
Figure 3-17 PL spectra of polymer 4P……….52
Figure 3-18 PL spectra of polymer 5P……….52
Figure 3-19 PL spectra of polymer 6P……….53
Figure 3-20 Cyclic voltammograms of polymers 1P, 3P, and 4P……... 56
Figure 3-21 Cyclic voltammograms of polymers 2P, 5P, and 6P……... 57
Figure 3-22 The EL spectra of polymers 1P and 2P………....59
Figure 3-23 The EL spectra of polymers 3P and 5P.………...…...59
Figure 3-25 The I-L-V curves of polymer 1P.………60
Figure 3-26 The I-L-V curves of polymer 2P………..61
Figure 3-27 The I-L-V curves of polymer 3P………..61
Figure 3-28 The I-L-V curves of polymer 4P………..62
Figure 3-29 The I-L-V curves of polymer 5P………..62
第一章 緒論
1-1前言
有機材料的電激發光(Organic Electroluminescence, OEL)現象始於
1963 年由 Pope 等人所發現[1],利用 10 到 20 µm 的單層蒽(Anthracene) 晶體作為發光層,並施予 400 伏特以上電壓,而觀察到微弱的發光現 象[2]。相較於無機材料技術的蓬勃發展,有機發光元件的研發似乎沉 寂了許久,直到 1987 年由美國柯達公司的 C. W. Tang 等人,利用有 機染料 Alq3 及 Diamine 衍生物,並以真空熱蒸鍍方式製備雙層元件 [3],如 Figure 1-1 所示,在小於 10 V 的操作電壓下,亮度及外部量子 效率達到 1000 nits 及 1%,使得有機發光材料與元件更具有實用價 值,也激起有機材料應用於有機發光二極體(Organic Light Emitting
Diode, OLED)的研究熱潮。
1990 年英國劍橋大學 J. H. Burroughese et al.利用旋轉塗佈方式製
備有機共軛高分子薄膜,並應用於發光二極體,發表了第一個利用共 軛高分子 poly(p-phenylene vinylene) (PPV)為發光層之黃綠色發光二 極體,其元件結構為 ITO/PPV/Al[4],如 Figure 1-2 所示,其量子效率
(Quantum Efficiency, QE)為 0.05%,使得共軛高分子材料繼導電聚合
物應用之後,再向顯示器的領域邁進,也使得 OLED 之未來發展與 市場更形寬廣。
Figure 1-2. Device of ITO/PPV/Al.
近年來由於市場對全彩平面顯示器巨大需求的潛力,OLED 擁有 良好的特質,例如:自發光、發光效率高、輕薄可撓、廣視角等,因 此被譽為平面顯示器的明日之星。
1-2 電激發光(Electroluminescence, EL) 1-2-1 發光機制 有機發光二極體的發光機制和無機發光二極體原理相似。Figure 1-3 為 OLED 元件構造示意圖。對此元件施予一順向偏壓時,外加電 壓驅動電子與電洞分別由陰極與陽極注入此半導體元件,當兩者在發 光層移動時相遇,會結合而形成所謂的電子-電洞複合。其由高能的 激發態(Excited State)回到穩定基態(Ground State),會將其能量差異以 光或熱能形式釋放,其中發光的部分可被利用作為顯示功能。根據材 料的能階差,釋放出來的能量可轉換成不同波長之可見光,因此選擇 適當的材料作為發光層,或是在發光層中摻雜染料,即可得到所需光 色。
Figure 1-3. Illustration of OLED Device.
值得注意的是,固態有機分子因電子與電洞再結合而產生的電激 發光,其最大的內發光效率為25%;換言之大約有75%的能量,因電
子正反自旋的關係,被消耗在產生磷光的三重態能階,其發光強度甚 弱,或因為生命期過長而不發光。此外還可以經由摻雜客分子的方 法,轉換成能量能較低的可見光。 為了增加發光效率,必須增加電子及電洞的注入。陰極通常選擇 低功函數之金屬,例如鎂或鈣,以利電子的注入。然而低功函數之金 屬相對地活性也較大,容易跟水氣作用或氧化,造成陰極的崩解;上 述缺點的解決方法可採用複合金屬陰極(如鎂:銀,鋁:鋰),或是 在陰極和有機層之間加入一層極薄的氟化鋰,可有效地降低電子從陰 極注入到有機層的能障。在陽極部分,則使用高功函數的金屬材料, 目前皆採用氧化銦錫透明導電膜,其具有良好的導電性及在可見光範 圍的高透光性,而被廣泛應用於影像技術上當作顯示器之電極。 一般有機發光元件之能階如 Figure 1-4 所示,其中 Ionization Potential (IP)代表主動層之游離能,定義為一個電子到無窮遠處所需
的能量;Electron Affinity (EA)則代表主動層之電子親和力,即由無窮
遠處加入一個電子到 LUMO 能階所需的能量。WA和 WC分別為 ITO
及陰極的功函數。選擇功函數較低之金屬有利於電子注入,可提升
Figure 1-4. Schematic illustration of OLED energy level diagram.
Table 1-1. The work function of electron injection electrodes.
Electrode Work Function (eV)
Ba 2.7
Ca 2.9
Mg 3.7
1-2-2 光激發光(Photoluminescence, PL)原理 有機共軛高分子的發光行為,可分為光激發光和電激發光兩種, 光激發光是指分子因吸收紫外光或可見光能量而將電子從基態激發 到激發態,此時許多分子可以將所吸收的能量以輻射衰退(Radiative decay )的方式放光而回到基態,此過程便稱為光激發光,如 Figure 1-5 所示。 Figure 1-5. Illustration of PL. 大多數高分子發光二極體的電激發光光譜(EL)會與該發光聚合物 的螢光光譜(PL)相似,這是因為兩者分別藉由光及電來激發基態的電 子,使其形成激子後衰退回基態而放光,因此兩者會有相似的放光機 制。
1-3 高分子發光二極體(Polymer Light Emitting Diode, PLED)材料 1-3-1 簡介 高分子螢光材料的優點就是可經由結構修飾,改變材料能隙,進 而發出不同波長的光。PPV 是第一個被應用在 PLED 的共軛高分子材 料,隨後化學家針對 PPV 的結構進行修飾,發展出各種不同取代基 的 PPV 衍生物,其光色可由原來的黃綠色轉變為紅色或綠色[6-13],以 往 文 獻 報 導 PPV 衍 生 物 如 Figure 1-6 所 示 。 另 一 種 聚 噻 吩 (polythiophene)系列之光色範圍比較廣泛,可由紅光到藍光[14-20],見 Figure 1-7。其它發藍光的材料列於 Figure 1-10 [21-28]。為改變材料之 發光波長及發光效率,各種共聚合物亦被合成出來[29-34],如 Figure 1-8 所示。
yellow-green (550 nm) n n CH3 H3C green (520 nm) n OCH3 H3CO yellow-green (535,580 nm) n H2Si C8H17 green (520 nm) n O H3C orange (580 nm) n O O CHA AHC yellow (570 nm) CHA n OC6H13 X n OC8H17 F3C n X X X=Cl or Br red (610-620 nm) yellow orange (540-570 nm) X=F (600 nm) X=Cl (580 nm) X=Br (560 nm) Figure 1-6. PPV derivatives and their emission colors.
S n R=C6H13 R=C8H17 R=C10H21 red R S C8H17 C8H17 n blue (460 nm) S C8H17 S n green (530 nm) S n green (555 nm) S n blue (460 nm) H3C S n C8H17 red S n O O O O O blue (470 nm) C8H17 R=C12H21
R R R=C6H13 R=C8H17 N x y n n H17C8 C8H17 C8H17 H13C6C6H13 N N N S N n C8H17 N N O H13C6 C6H13 N H13C6 C6H13 N x y n S R N N O N N O n R=H R=n-Butyl R=n-Octyl n H13C6 C6H13 N N N N C6H13 H13C6 CN NC m n
OCH3 H3CO OC7H15 C7H15O red R' R
R=R'=2-ethylhexyloxy deep red
R=R'=OMe red R=Ph, R'=H deep red OCH3 H3CO m n orange OC6H13 C6H13O OC6H13 C6H13O NC CN n red OCH3 H3CO S S green OC6H13 C6H13O NC CN n green n n n
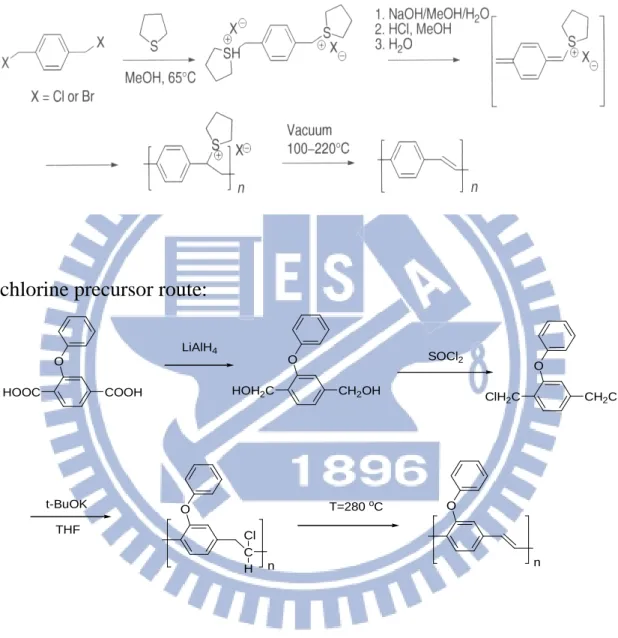
1-3-2 PPV 系列聚合物之合成 PLED是以高分子為發光層之元件,PPV為常見的發光共軛高分子 材料,其能隙(Bandgap, Eg)大約是2.5 eV,最大放射波長為551 nm (2.25 eV),並位於520及596 nm有兩個側峰,是屬於黃綠光的螢光材 料。目前PPV衍生物發出的黃光與橘紅光材料已達到商業化水準,而 綠光與紅光材料亦逐漸開發出來。PPV因其共軛主鏈上的碳-碳雙鍵 (C=C)易受環境影響而氧化導致穩定性下降,所以需要很好的封裝技 術來隔離空氣中水及氧,以增加元件使用壽命及發光效率。 無任何取代之PPV由於其主鏈之共軛結構[35],使其具有電激發光 特性。但因主鏈上苯基及乙烯基的剛硬性又使其無法溶解於一般有機 溶劑中,造成加工成膜性困難。為了改善此缺點,化學家發展出許多 不同聚合方法及可溶性的PPV衍生物,常見的方法有Wessling[36,37]、
chlorine precursor route(CPR)[38,39]、Gilch[40]及Wittig[41,42]等方法,如
Figure 1-10及Figure 1-11所示。其中Wessling和CPR合成方法,是先形
成一可溶性前驅聚合物(precursor polymer),塗佈於基材上,再於真空 或惰性氣體下加熱至200~300 o C形成共軛結構。Gilch方法則是先利用 有機合成法製備含側取代基之單體,在鹼性試劑作用下聚合而形成可 溶性之共軛高分子。由於多個不同側鏈取代基效應,除了大幅提昇聚 合物溶解度及成膜性,還可利用側取代基之推、拉電子效應來調控其
發光顏色。
Wessling procedure:
chlorine precursor route:
COOH HOOC O LiAlH4 CH2OH HOH2C O SOCl2 CH2Cl ClH2C O t-BuOK THF O C Cl H n T=280 oC O n
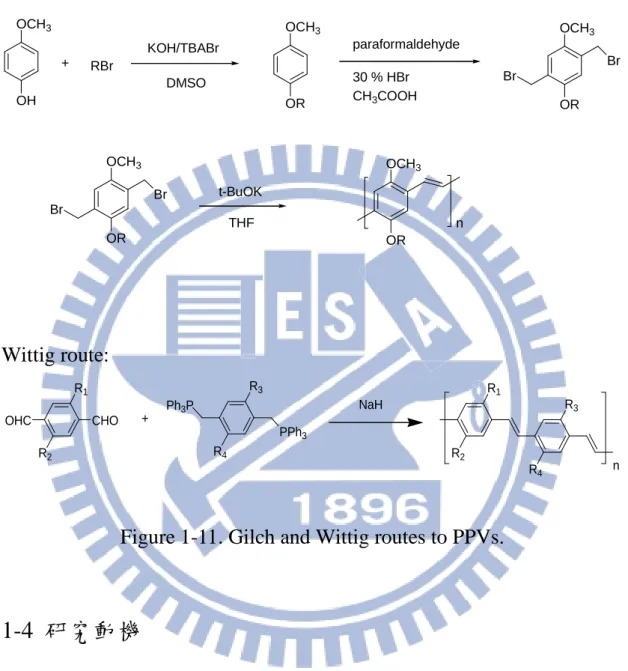
Gilch route: OCH3 OH + RBr OCH3 OR KOH/TBABr DMSO paraformaldehyde 30 % HBr CH3COOH OCH3 OR Br Br OCH3 OR Br Br t-BuOK THF OCH3 OR n Wittig route: R1 R2 CHO OHC R3 R4 PPh3 Ph3P + R1 R2 R3 R4 n NaH
Figure 1-11. Gilch and Wittig routes to PPVs.
1-4 研究動機
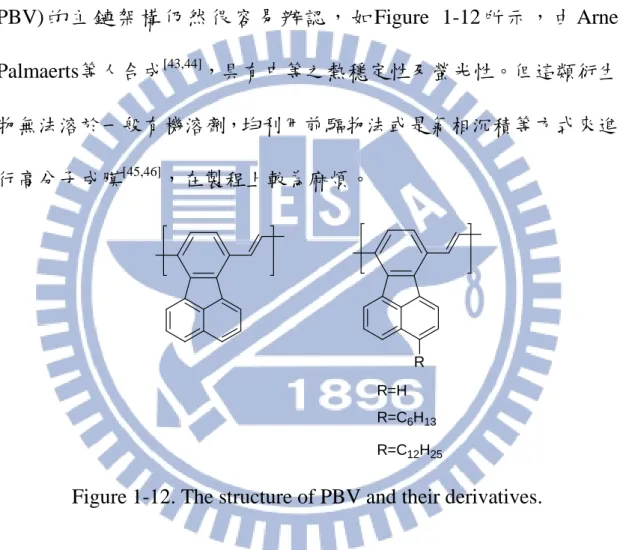
共軛高分子持續吸引愈來愈多關注,乃由於他們在光電領域的應 用例如:發光二極體、太陽能電池、感應器和場效應電晶體等。藉由 引入官能基改變材料的特性,並選擇在光電領域上的應用,尋求新的 共軛高分子改變其特性不斷進行著。 可溶性PPV衍生物其應用發展性頗受業界及學術界重視,是因為可利用PPV苯環上取代基釋放或拉引電子效應,或改變其共軛鏈長度來 控制發光顏色,同時也具有良好的成膜加工特性,所以在單體上做一 些取代基的變化後,再以Gilch方法合成出PPV衍生物。 聚 (7,10- 苯 并苊 基 乙 烯 ) (Poly(7,10-benzacenaphthene vinylene), PBV) 的 主 鏈 架 構 仍 然 很 容 易 辦 認 , 如 Figure 1-12 所 示 , 由 Arne Palmaerts等人合成[43,44],具有中等之熱穩定性及螢光性。但這類衍生 物無法溶於一般有機溶劑,均利用前驅物法或是氣相沉積等方式來進 行高分子成膜[45,46],在製程上較為麻煩。 R=H R=C6H13 R=C12H25 R
Figure 1-12. The structure of PBV and their derivatives.
本研究希望能夠合成出具可溶性之PBV衍生物,期能將發光聚合 物溶於溶劑後直接旋轉塗佈於基材上,再進行元件的製作,可簡化元
件製備的過程。結構設計上,將苯并苊接上癸基或雙苯環液晶基,其
n
O O
n
Figure 1-13. The structure of PBV derivatives.
PBV 合 成 方 法 允 許 引 進 各 種 取 代 基 , 此 外 環 戊 二 烯 - 熔 合 (cyclopenta-fused)結構預期將導致顯著的電子親和力,這會使得它們 形成n-type材料[47],在傳輸特性方面能夠有相當大的影響[48]。 本研究合成出六個聚合物。第一個聚合物1P乃是在PBV側面接上 柔軟的長碳鏈,由於此柔軟的側基可增加高分子的溶解度,使其溶於 一般有機溶劑。第二個聚合物2P乃是在PBV側取代基接上一個雙苯環 (Biphenyl)液晶基團,希望藉由此側取代基來繼續增加聚合物的溶解 度,也藉此側取代基的導入,造成立體阻礙而達到破壞共軛平面,進 而達到往藍光偏移(blue-shift)之目的。另外此巨大基團或許能降低分
子鏈之間堆疊 (aggregation),可因此提高發光效率。
為 了 增 加 分 子 量 並 調 控 光 色 , 亦 與 MEH-PPV 單 體 進 行 共 聚
(3P~6P)。本研究除了基本結構鑑定外,亦探討其光學、電化學及熱
性質,並製作雙層高分子有機發光二極體,評估其在電激發光元件之 應用潛力。
第二章 實驗部份 2-1 試藥 本實驗試藥及溶劑皆自聯工、Merck、Aldrich、Alfa Aesar 購入, 不經純化直接使用。反應用之無水四氫呋喃(THF)於氮氣環境下加入 鈉除水,並以 Benzophenone 作為指示劑,經除水 2 天後蒸出使用。 2-2 鑑定儀器
1. 核磁共振光譜儀(Nuclear Magnetic Resonance Spectrometer, NMR) 係使用 BRUKER AVANCE 600 MHz NMR,並使用 d-DMSO 與
d-Chloroform 作為溶劑,Tetramethylsilane (TMS)作為標定基準。在光
譜中 s 表示單峰(singlet),d 表示雙重峰(doublet),t 表示三重峰
(triplet),q 表示四重峰(quartet),quin 表示五重峰(quintet),m 表示多
重峰(multiplet)。
2. 微差掃描卡計(Differential Scanning Calorimeter, DSC)
係使用 TA Q200 DSC 及液態氮冷卻系統,測量樣品之相轉移溫度 及其熱焓值,熔點取其極值,玻璃轉移溫度(glass transition temperature,
Tg)則取其反曲點。溫度以 indium 及 tin 作校正,取樣品 5-10 mg,樣
品之加熱及冷卻速率均為 10 o
3. 熱重分析儀 (Thermal Gravimetric Analyzer, TGA)
係使用 Perkin-Elmer Diamond 1 TGA。實驗時秤取樣品 5-10 mg, 加熱速率為 10 o
C/min,在氮氣流量 20 ml/min 下測量其熱裂解情形。 4. 凝膠滲透層析儀(Gel Permeation Chromatography, GPC)
係使用 Viscotek VE3580 GPC,並使用 polystyrene (PS)標準品製作
分子量檢量線,THF 為沖提液,管柱保持在 32 o
C 之恆溫槽內。樣品
溶液配置濃度為 4 mg/2 ml。
5. 紫外-可見光譜儀(Ultraviolet-visible Spectrophotometer)與螢光光譜
儀(Fluorescence Spectrophotometer)
此兩種光譜儀皆採用 Princeton Instruments Acton 2150 機型。薄膜 樣品的製備步驟:聚合物以濃度 0.5 wt%配製溶液,並以旋轉塗佈法 成膜於已清洗之玻璃基板上。溶液樣品的製備:將聚合物以 0.1 mg/20
ml 之濃度分別溶在 Toluene、Dichloromethane (DCM)及 THF 中,並
將溶液滴入石英槽中量測。
6. 循環伏安計量法(Cyclic Voltammetry, CV)
係 使 用 AUTOLAB PGATAT3 機 型 。 配 製 0.1 M Tetrabutyl
ammonium tetrafluoroborate/acetonnitrile 之電解液,另準備兩片面積相
同之 ITO 基板作為工作電極與對應電極。將待測高分子溶液以滴乾成 膜法(Drop-casting)塗佈於 ITO 工作電極上,測量電壓範圍從 3V 到
-3V。 2-3 PLEDs 元件製作 2-3-1 ITO 基板清洗步驟 1.將 ITO 基板切割為 1.9 cm ×1.9 cm。 2.配製 Detergent 與去離子水(體積比 1:5)的溶液。 3.以牙刷沾上述溶液清潔 ITO 基板。 4.將 ITO 基板置入 Detergent 溶液中施以超音波震洗 20 分鐘。 5.取出 ITO 基板置入去離子水以超音波震洗 20 分鐘。 6.依此類推,將溶液依序換為丙酮與異丙醇震洗之。 7.取出 ITO 基板置入真空烘箱以 90 oC 烘烤 30 分鐘。 8.待其冷卻後施以 UV-ozone 照射 30 分鐘。 2-3-2 元件製作流程
1.將 PEDOT 溶液以 4000 rpm/30 sec 之參數設定塗佈於 ITO 基板
上,再放入真空烘箱中以 120 o C 烘烤 30 分鐘。 2.將發光材料溶液(濃度為 0.5 wt%)以 2000 rpm/30 sec 的參數設定 塗佈於 PEDOT/ITO 上,再放入真空烘箱中以 60 o C 烘烤 30 分鐘。 3.以熱蒸鍍方式蒸鍍鋁電極(腔體壓力在 6 × 10-6 torr 以下)。
2-4 聚合物單體 1M 和 2M 之合成 單體 1M 及 2M 之合成流程詳列於 Scheme 1 及 Scheme 2 中。 Diethyl 8-oxocyclopent[a]acenaphthylene-7,9-dicarboxylate (1) 將 Acenaphthenequinone (10.0 克 , 55 毫 莫 耳 ) 與 Diethyl 1,3-acetonedicarboxylate (10.8 克,53 毫莫耳)置入 250 毫升雙頸瓶中, 加入 90 毫升甲醇做為溶劑。另取 Triethylamine (5.5 ml,55 毫莫耳) 倒入上述溶液中,於室溫下攪拌 6 小時。反應結束後抽氣過濾收集固 體,再以乙酸乙酯再結晶,得紫色針狀晶體 15.9 克,產率 83%。1 H-NMR (600 MHz, CDCl3, ppm): 8.648-8.636 (d, 2H, J=7.2 Hz, aromatic
protons), 8.058-8.045 (d, 2H, J=8.22 Hz, aromatic protons), 7.768-7.742 (t, 2H, J=7.74 Hz, aromatic protons), 4.474-4.438 (q, 4H, J=7.14 Hz, -COO-CH2CH3), 1.476-1.453 (t, 6H, J=7.14 Hz, -COO-CH2CH3). 13 C-NMR (600 MHz, CDCl3, ppm): 165.7, 162.29, 146.3, 131.38, 130.59, 129.18, 129.01, 127.92, 112.22, 61.09, 14.37. Mass (EI): m/z 348. Diethyl 8-decylbenzacenaphthene-7,10-dicarboxylate (2) 取化合物(1) (10.0 克,28 毫莫耳)、1-Dodecyne (5.26 克,32 毫莫 耳)與 150 毫升 Toluene 置入 250 毫升雙頸瓶內,升溫至 120 o C 迴流 30 小時。反應結束後直接減壓濃縮,再以凝膠管柱層析分離產物(正 己烷:乙酸乙酯=16:1 為沖提液)。得淡黃色液體 10.1 克,產率 72%。
1
H-NMR (600 MHz, CDCl3, ppm): 8.763-8.751 (d, 1H, J=7.26 Hz,
aromatic proton), 7.886-7.881 (d, 1H, J=3.18 Hz, aromatic protons), 7.873-7.867 (d, 1H, J=3.6 Hz aromatic proton), 7.843-7.831 (d, 1H, J=7.2 Hz, aromatic proton), 7.805 (s, 1H, aromatic proton), 7.677-7.652 (t, 1H, J=7.8 Hz, aromatic proton), 7.591-7.616 (t, 1H, J=7.8 Hz, aromatic
proton), 4.646-4.538 (m, 4H, J=6.6 Hz, -COO-CH2CH3), 2.781-2.755 (t, 2H, J=7.8 Hz, -Ph-CH2(CH2)8CH3), 1.711 (m, 2H, -Ph-CH2CH2 (CH2)7CH3), 1.553-1.365 (m, 14H, -Ph-CH2CH2(CH2)7CH3), 0.914-0.890 (m, 9H, -Ph-(CH2)9CH3, -COO-CH2CH3). 13C-NMR (600 MHz, CDCl3, ppm): 169.17, 167.24, 138.26, 137.02, 136.89, 134.20, 133.64, 132.92, 131.68, 129.99, 129.72, 128.14, 127.73, 127.31, 126.77, 121.93, 84.69, 67.98, 61.62, 61.28, 33.36, 31.84, 31.39, 29.56, 29.51, 29.43, 29.26, 29.05, 28.70, 28.45. Mass (EI): m/z 486. 8-Decyl-7,10-bis(hydroxymethyl)benzacenaphthene (3) 將 LiAlH4 (2.5 克,48 毫莫耳)置於 250 毫升雙頸瓶中,在氮氣環 境下以針筒打入 25 毫升無水四氫呋喃。另取化合物(2) (2.0 克,4 毫 莫耳)溶於 5 毫升無水四氫呋喃,並緩慢注入上述之雙頸瓶中。反應 混合物於氮氣及室溫環境反應 3 小時。反應結束後於冰浴下緩慢滴入 飽和硫酸鈉水溶液後,攪拌 2 小時後過濾並以乙酸乙酯清洗白色黏稠 體,濾液以無水硫酸鎂乾燥後濃縮,得淡黃色固體 1.48 克,產率 89%。 1 H-NMR (600 MHz, CDCl3, ppm): 8.280-8.268 (d, 1H, J=7.2 Hz,
aromatic proton), 8.038-8.026 (d, 1H, J=7.2 Hz, aromatic proton), 7.885-7.872 (d, 1H, J=7.8 Hz, aromatic proton), 7.861-7.848 (d, 1H,
J=7.8 Hz, aromatic proton), 7.696-7.671 (t, 1H, J=7.2 Hz, aromatic proton), 7.667-7.642 (t, 1H, J=7.8 Hz, aromatic proton), 7.302 (s, 1H,
aromatic proton), 5.226 (s, 2H, -Ph-CH2OH), 5.191 (s, 2H, -Ph-CH2OH),
2.881-2.854 (t, 2H, J=8.4 Hz, -Ph-CH2(CH2)8CH3), 1.706-1.654 (q, 2H, J=7.8 Hz, -Ph-CH2CH2(CH2)7CH3), 1.466-1.270 (m, 14H, -Ph-CH2CH2(CH2)7CH3), 0.891-0.868 (m, 3H, -Ph-(CH2)9CH3). 13 C-NMR (600 MHz, CDCl3, ppm): 141.76, 139.57, 137.66, 136.29, 136.22, 135.95, 135.45, 133.47, 129.90, 128.51, 128.15, 128.02, 127.09, 126.68, 123.93, 123.31, 63.79, 59.00, 33.22, 32.67, 31.89, 29.68, 29.62, 29.55, 29.32, 24.11, 22.67, 14.09. Mass (EI): m/z 402. 8-Decyl-7,10-bis(chloromethyl)benzacenaphthene (1M) 取化合物(3) (20.0 克,5 毫莫耳)置入 50 毫升雙頸瓶中,再加 5 毫 升 Thionyl chloride,於室溫攪拌 12 小時。之後加入乙酸乙酯,再分 別以水及飽和食鹽水清洗。有機層以無水硫酸鎂除水後過濾濃縮,以 凝膠管柱層析分離產物(正己烷為沖提液)。得白色固體 1.9 克,產率 86%。1H-NMR (600 MHz, CDCl3, ppm): 8.224-8.212 (d, 1H, J=7.2 Hz,
aromatic proton), 8.115-8.103 (d, 1H, J=7.2 Hz, aromatic proton), 7.908-7.894 (d, 1H, J=8.4 Hz, aromatic proton), 7.888-7.875 (d, 1H, J=7.8 Hz, aromatic proton), 7.716-7.694 (t, 1H, J=7.2 Hz, aromatic proton), 7.691-7.669 (t, 1H, J=7.8 Hz, aromatic proton), 7.223 (s, 1H,
aromatic proton), 5.139 (s, 2H, -Ph-CH2Cl), 5.041 (s, 2H, -Ph-CH2Cl),
-Ph-CH2(CH2)8CH3), 1.764-1.712 (q, 2H, J=7.8 Hz, -Ph-CH2CH2- (CH2)7CH3), 1.486-1.248 (m, 14H, -Ph-CH2CH2(CH2)7CH3), 0.902-0.879 (m, 3H, -Ph-(CH2)9CH3). 13C-NMR (600 MHz, CDCl3, ppm): 142.92, 139.63, 136.24, 135.57, 135.15, 133.08, 132.76, 131.70, 130.47, 129.92, 128.12, 128.05, 127.41, 127.08, 124.37, 123.74, 44.65, 40.41, 32.49, 31.90, 31.61, 30.89, 29.73, 29.60, 29.51, 29.33, 22.68, 14.10. Mass (EI): m/z 438. 4-[2-(Ethylhexyloxy)]-4’-hydroxybiphenyl (4)
取 4,4-Biphenol (20 克,107 毫莫耳)、2-Ethylhexyl bromide (6.86 克,35 毫莫耳)、Potassium carbonate (22.2 克,160 毫莫耳)和 Potassium
iodide (0.267 克,1.6 毫莫耳)溶於 100 毫升 DMSO 中,在 80 oC 下反
應 5 小時。反應完之後倒入煮沸之飽和 K2CO3水溶液,過濾之後取
濾液以乙酸乙酯萃取,有機層用無水硫酸鎂乾燥後濃縮,粗產物再以 凝膠管柱層析純化(正己烷:乙酸乙酯=4:1 為沖提液)。得白色固體
7.37 克,產率 23%。1H-NMR (600 MHz, CDCl3, ppm): 7.453-7.438 (d,
2H, J=9 Hz, aromatic protons), 7.430-7.416 (d, 2H, J=8.4 Hz, aromatic protons), 6.956-6.942 (d, 2H, J=8.4 Hz, aromatic protons), 6.886-6.872 (d,
2H, J=8.4 Hz, aromatic protons), 3.895-3.851 (m, 2H, -Ph-O-CH2CH(CH2CH3)(CH2)3CH3), 1.774-1.712 (m, 1H, -Ph-O-CH2CH(CH2CH3)(CH2)3CH3), 1.546-1.322 (m, 8H, -Ph-O-CH2CH(CH2CH3)(CH2)3CH3), 0.953-0.90 (t, 6H, J=3.6 Hz,-Ph-O-CH2CH(CH2CH3)(CH2)3CH3). 13 C-NMR (600 MHz, CDCl3,
ppm): 158.56, 154.57, 133.82, 133.12, 127.93, 127.64, 115.56, 114.78, 70.61, 39.40, 30.54, 29.70, 29.08, 23.88, 23.05, 14.08. Mass (EI): m/z 298.
4-[2-(Ethylhexyloxy)]-4’-(5-hexynyloxy)biphenyl (5)
取化合物(4) (5 克,16 毫莫耳)、6-Chloro-1-hexyne (2.06 克,17 毫 莫耳)、Potassium hydroxide (1.35 克,24 毫莫耳)與 30 毫升 DMSO 置
入 100 毫升雙頸瓶內,升溫至 70 o C 迴流 3 小時。反應結束後加入 30 毫升乙酸乙酯,再分別以水及飽和食鹽水清洗,有機層利用無水硫酸 鎂乾燥後濃縮,粗產物再以凝膠管柱層析純化(正己烷:乙酸乙酯 =12:1),得產物 4.75 克,產率 75%。1H-NMR (600 MHz, CDCl3, ppm): 7.471-7.454 (dd, 4H, J1=8.6 Hz, J2=1.9 Hz, aromatic protons), 6.961-6.950 (d, 2H, J=8.4 Hz, aromatic protons), 6.947-6.936 (d, 2H, J=8.4 Hz, aromatic protons), 4.036-4.015 (t, 2H, J=6.6 Hz, -Ph-OCH2(CH2)3CC≡H), 3.883-3.869 (dd, 2H, J1=6 Hz, J2=5.4 Hz, -Ph-O-CH2CH(CH2CH3)(CH2)3CH3), 2.310-2.282 (td , 2H, J1=7.2 Hz, J2=2.4 Hz, -Ph-OCH2CH2CH2CH2CC≡H), 1.984-1.975 (t, 1H, J=2.4 Hz, -Ph-O(CH2)4CC≡H), 1.960-1.913 (quin, 2H, J=6.6 Hz, -Ph-OCH2CH2(CH2)2CC≡H), 1.773-1.725 (quin, 2H, J=7.2 Hz, -Ph-OCH2CH2CH2CH2CC≡H), 1.551-1.328 (m, 8H, -Ph-O-CH2CH(CH2CH3)(CH2)3CH3), 0.958-0.906 (t, 6H, J=7.2 Hz, -Ph-O-CH2CH(CH2CH3)(CH2)3CH3). 13 C-NMR (600 MHz, CDCl3, ppm): 158.31, 157.83, 133.32, 132.98, 127.45, 127.41, 114.54, 114.50, 83.88, 70.36, 68.40, 67.13, 39.19, 30.32, 29.48, 28.87, 28.10, 24.84, 23.66,
22.84, 17.95, 13.86, 10.89. Mass (EI): m/z 378. Diethyl 8-{4-[4’-(2-ethylhexyloxy)biphenyl]butoxy]} benzacenaphthene-7,10-dicarboxylate (6) 取化合物(1) (10.1 克,29 毫莫耳)、化合物(5) (10 克,26 毫莫耳) 置入 100 毫升雙頸瓶內,升溫至 120 o C 迴流 30 小時。反應結束直接 以凝膠管柱層析分離產物(正己烷:乙酸乙酯=6:1 為沖提液)。得淡 白色固體 13.2 克,產率 72%。1 H-NMR (600 MHz, CDCl3, ppm): 8.759-8.747 (d, 1H, J=7.2 Hz, aromatic proton), 7.922-7.919 (d, 1H, J=1.8 Hz, aromatic proton), 7.909-7.905 (d, 1H, J=2.4 Hz, aromatic proton), 7.839-7.827 (d, 1H, J=7.2 Hz, aromatic proton), 7.820 (s, 1H, aromatic proton), 7.698-7.672 (t, 1H, J=7.2 Hz, aromatic proton), 7.634-7.609 (t, 1H, J=7.8 Hz, aromatic proton), 7.468-7.462 (d, 2H, J=3.6 Hz, aromatic protons), 7.454-7.448 (d, 2H, J=3.6 Hz, aromatic protons), 6.958-6.944 (d, 4H, J=8.4 Hz, aromatic protons), 4.623-4.587 (q,
2H, J=7.2 Hz, -COO-CH2CH3), 4.570-4.535 (q, 2H, J=6.6 Hz, -COO-CH2CH3), 4.059-4.041 (t, 2H, J=6.6 Hz, -Ph-(CH2)3CH2O-Ph), 3.881-3.867 (dd, 2H, J1=6 Hz, J2=5.4 Hz, -Ph-O-CH2CH(CH2CH3)(CH2)3CH3), 2.868-2.844 (t, 2H, J=7.2 Hz, -Ph-CH2(CH2)3O-Ph), 1.983-1.930 (m, 2H, -Ph-CH2CH2CH2CH2O-Ph), 1.765-1.714 (m, 1H, -Ph-O-CH2CH(CH2CH3)(CH2)3CH3), 1.522-1.498 (t, 3H, J=7.2 Hz, -COO-CH2CH3), 1.482-1.458 (t, 3H, J=7.2 Hz, -COO-CH2CH3), 1.458-1.407 (m, 2H, -Ph-O-CH2CH(CH2CH3)(CH2)3CH3), 1.394-1.326 (m, 4H,
-Ph-O-CH2CH(CH2CH3)CH2CH2CH2CH3), 0.956-0.904 (t, 6H, J=7.2 Hz, -Ph-O-CH2CH(CH2CH3)(CH2)3CH3). 13 C-NMR (600 MHz, CDCl3, ppm): 169.21, 167.27, 158.51, 158.06, 137.63, 137.14, 134.19, 133.62, 133.52, 133.18, 132.99, 131.74, 130.02, 129.79, 128.25, 127.88, 127.65, 127.61, 127.42, 126.89, 122.04, 114.74, 70.57, 67.67, 61.81, 61.42, 39.40, 33.06, 30.53, 29.68, 29.14, 29.07, 27.90, 23.87, 23.04, 14.37, 14.22, 14.07, 11.10. Mass (EI): m/z 698. 7,10-Bis(hydroxymethyl)-8-{4-[4’-(2-ethylhexyloxy)biphenyl]butoxy]} benzacenaphthene (7) 反應步驟可參照化合物(3)之實驗步驟。反應物秤取量分別為: LiAlH4 (1.74 克,45 毫莫耳)、化合物(6) (2.0 克,2.8 毫莫耳),以無 水四氫呋喃 50 ml 為溶劑。產物為黃色固體 1.53 克,產率 87%。 1 H-NMR (600 MHz, CDCl3, ppm): 8.262-8.251 (d, 1H, J=6.6 Hz,
aromatic proton), 7.992-7.981 (d, 1H, J=6.6 Hz, aromatic proton), 7.877-7.863 (d, 1H, J=8.4 Hz, aromatic proton), 7.853-7.839 (d, 1H, J=8.4 Hz, aromatic proton), 7.685-7.659 (t, 1H, J=7.2 Hz, aromatic proton), 7.649-7.624 (t, 1H, J=7.8 Hz, aromatic proton), 7.451-7.434 (dd,
4H, J1=8.4 Hz, J2=1.8 Hz, aromatic protons), 7.304 (s, 1H, aromatic
proton), 6.948-6.934 (d, 4H, J=8.4 Hz, aromatic protons), 5.217 (s, 2H,
-Ph-CH2OH), 5.150 (s, 2H, -Ph-CH2OH), 4.055-4.036 (t, 1H, J=5.4 Hz,
-Ph-(CH2)3CH2O-Ph), 3.876-3.862 (dd, 4H, J1=6 Hz, J2=5.4 Hz
-Ph-O-CH2CH(CH2CH3)(CH2)3CH3), 2.961-2.939 (t, 2H, J=7.2 Hz,
-Ph-CH2(CH2)3O-Ph), 1.936-1.899 (m, 4H, -Ph-CH2CH2CH2CH2O-Ph),
(m, 8H, -Ph-O-CH2CH(CH2CH3)(CH2)3CH3), 0.953-0.901 (t, 6H, J=7.8 Hz, -Ph-O-CH2CH(CH2CH3)(CH2)3CH3). 13 C-NMR (600 MHz, CDCl3, ppm): 158.51, 158.01, 140.98, 139.60, 136.37, 136.15, 135.87, 135.51, 133.44, 133.15, 132.69, 129.87, 128.37, 128.14, 127.99, 127.66, 127.61, 127.10, 126.69, 123.94, 123.35, 114.75, 70.58, 67.73, 63.67, 58.95, 39.40, 32.77, 30.53, 29.68, 29.08, 28.78, 23.87, 23.05, 14.07, 11.10. Mass (EI): m/z 614. 7,10-Bis(chloromethyl)-8-{4-[4’-(2-ethylhexyloxy)biphenyl]butoxy]} benzacenaphthene (2M) 反應步驟可參照單體 1M 之實驗步驟。反應物秤取量分別為: Thionyl chloride (2.4 毫升,16.2 毫莫耳)及化合物(7) (2.0 克,1.62 毫 莫耳),得白色固體 1.58 克,產率 75%。1 H-NMR (600 MHz, CDCl3, ppm): 8.244-8.232 (d, 1H, J=7.2 Hz, aromatic proton), 8.139-8.127 (d, 1H, J=7.2 Hz, aromatic proton), 7.927-7.913 (d, 1H, J=8.4 Hz, aromatic proton), 7.909-7.895 (d, 1H, J=8.4. Hz, aromatic proton), 7.732-7.706 (t, 1H, J=7.8 Hz, aromatic proton), 7.458-7.448 (t, 1H, J=7.2 Hz, aromatic proton), 7.472-7.462 (d, 2H, J=8.4 Hz, aromatic protons), 7.458-7.448 (d, 2H, J=8.4 Hz, aromatic protons), 7.267 (s, 1H, aromatic proton), 6.976-6.961 (d, 2H, J=9 Hz, aromatic protons), 6.954-6.940 (d, 2H, J=8.4 Hz, aromatic protons), 5.179 (s, 2H, -Ph-CH2Cl), 5.057 (s, 2H, -Ph-CH2Cl), 4.090-4.081 (t, 1H, J=5.4 Hz, -Ph-(CH2)3CH2O-Ph), 3.878-3.864 (dd, 2H, J1=6 Hz, J2=5.4 Hz -Ph-O-CH2CH(CH2CH3)(CH2)3CH3), 2.979-2.956 (t, 2H, J=7.2 Hz, -Ph-CH (CH ) O-Ph), 1.989-1.979 (m, 4H, -Ph-CH CH CH CH O-Ph),
1.762-1.711 (m, 1H, -Ph-O-CH2CH(CH2CH3)(CH2)3CH3), 1.546-1.30 (m, 8H, -Ph-O-CH2CH(CH2CH3)(CH2)3CH3), 0.953-0.901 (t, 6H, J=7.2 Hz, -Ph-O-CH2CH(CH2CH3)(CH2)3CH3). 13C-NMR (600 MHz, CDCl3, ppm): 158.52, 158.05, 141.23, 139.74, 136.46, 135.52, 135.08, 133.58, 133.18, 132.78, 131.79, 130.47, 129.94, 128.16, 128.09, 127.70, 127.63, 127.50, 127.19, 124.44, 123.86, 114.77, 70.59, 67.69, 44.62, 40.40, 39.41, 32.11, 31.92, 30.55, 29.69, 29.35, 29.20, 29.09, 27.99, 23.88, 23.06, 22.68, 14.09, 11.11. Mass (EI): m/z 650. 2-5 聚合物及共聚物 1P~6P 之合成 聚合物 1P 及 2P 之合成流程詳列於 Scheme 3 中。聚合物 3P~6P 之合 成流程詳列於 Scheme 4 中。 Poly(8-decyl-7,10-benzacenaphthene vinylene) (1P) 將單體 1M (0.5 克,1.14 毫莫耳)置於 100 毫升雙頸瓶中,在氮氣 下以針筒打入 90 毫升的無水四氫呋喃。另取叔丁醇鉀(Potassium tert-butoxide, t-BuOK) (0.53 克,4.85 毫莫耳)溶於 10 毫升的無水四氫 呋喃,並以針筒注入單體溶液中,於室溫下攪拌 24 小時。反應結束 後將溶液逐滴滴入 300 毫升甲醇中進行再沉澱,並重複一次。過濾抽 乾得黃色固體 0.37 克,產率 79%。 Poly(8-{4-[4’-(2-ethylhexyloxy)biphenyl]butoxy]}-7,10-
benzacenaphthene vinylene) (2P) 反應步驟可參照單體 1P 之實驗步驟。反應物秤取量分別為:單體 2M (0.5 克,0.77 毫莫耳)及 t-BuOK (0.36 克,3.6 毫莫耳),以無水四 氫呋喃 100 ml 為溶劑。得黃色固體 0.28 克,產率 59%。 Poly(8-decyl-7,10-benzacenaphthene vinylene)-co-poly[2-methoxy-5- (2’-ethylhexyloxy)-1,4-phenylene vinylene] (3P, 4P) 聚合物 3P 反應步驟可參照聚合物 1P 之實驗步驟。反應物秤取量 分別為:單體 1M (0.5 克,1.14 毫莫耳)、單體 3M (0.029 克,0.126 毫莫耳)及 t-BuOK (0.53 克,4.85 毫莫耳),並以無水四氫呋喃 100 ml 為溶劑。得黃色固體 0.25 克,產率 30%。 聚合物 4P 反應步驟可參照單體 1P 之實驗步驟。反應物秤取量分 別為:單體 1M (0.5 克,1.14 毫莫耳)、單體 3M (0.26 克,1.14 毫莫 耳)及 t-BuOK (0.53 克,4.85 毫莫耳),並以無水四氫呋喃 100 ml 為溶 劑。得紅色固體 0.26 克,產率 20%。 Poly(8-{4-[4’-(2-ethylhexyloxy)biphenyl]butoxy]}-7,10- benzacenaphthene vinylene)-co-poly[2-methoxy-5-(2’-ethylhexyloxy)- 1,4-phenylene vinylene] (5P, 6P) 聚合物 5P 反應步驟可參照單體 1P 之實驗步驟。反應物秤取量分 別為:單體 2M (0.5 克,0.77 毫莫耳)、單體 3M (0.02 克,0.085 毫莫 耳)及 t-BuOK (0.36 克,3.6 毫莫耳),並以無水四氫呋喃 100 ml 為溶
劑。得黃色固體 0.15 克,產率 20%。
聚合物 6P 反應步驟可參照單體 1P 之實驗步驟。反應物秤取量分 別為:單體 2M (0.5 克,0.77 毫莫耳)、單體 3M (0.18 克,0.77 毫莫 耳)及 t-BuOK (0.36 克,3.6 毫莫耳),並以無水四氫呋喃 100 ml 為溶 劑。得紅色固體 0.28 克,產率 24%。
O O COOEt O COOEt + Et3N MeOH O COOEt COOEt 1 Toluene COOEt COOEt 2 LiAlH4 THF CH2OH CH2OH 3 SOCl2 CH2Cl CH2Cl 1M
CH2Cl CH2Cl 2M O O OH HO K2CO3 / KI DMSO Br O HO KOH DMSO O COOEt COOEt 4 1 Cl O O 5 COOEt COOEt O O CH2OH CH2OH O O 6 THF LiAlH4 7 SOCl2 ∆
CH2Cl ClH2C 1M THF t-BuO-+K n 1P CH2Cl ClH2C 2M O O THF 2P O O n t-BuO-+K
CH2Cl ClH2C 1M + O H3CO 3M THF O H3CO m n O O H3CO x y O 2M CH2Cl ClH2C O O 3M THF + 3P: n=90; m=10 4P: n=50; m=50 5P: y=90; x=10 6P: y=50; x=50 t-BuO-+K t-BuO-+K CH2Cl ClH2C O H3CO CH2Cl ClH2C
第三章 結果與討論
3-1 單體 1M 及 2M 之合成與鑑定
在單體 1M 之合成方面,首先利用 Acenaphthenequinone 及 Diethyl 1,3-acetonedicarboxylate 進行鹼催化 Aldol condensation 得到化合物
(1),再與 1-Dodecyne 進行 Diels-Alder 反應合成出化合物(2),接著以 LiAlH4進行還原反應得到化合物(3),最後再以 SOCl2將 OH 基氯化成 Cl 得到單體 1M。中間化合物及單體 1M 經 NMR、Mass 確認無誤。 在單體 2M 之合成方面,首先利用 4,4-Biphenol 及 2-Ethylhexyl bromide進行非對稱醚化反應得到化合物(4),再與 6-Chloro-1-hexyne 進行醚化反應合成出化合物(5)。為了使反應性提高,化合物(5)與化 合物(1)在無溶劑的情形下,於 120 o C 加熱攪拌進行 Diels-Alder 反應 合成出化合物(6),再利用 LiAlH4進行還原反應得到化合物(7),最後 利用 SOCl2將 OH 基氯化成 Cl 得到單體 2M,中間化合物及單體 2M 經 NMR、Mass 確認無誤。 3-2 聚合物 1P ~ 6P 之合成與鑑定 所有聚合物均採用 Gilch route 聚合方式,以聚合物 1P 為例,將單 體 1M 加入 5 倍的過量鹼 t-BuOK 進行聚合反應,脫去 HCl 形成苯環 -雙鍵之共軛結構。聚合物 2P 亦採用 Gilch route 聚合,由於 2P 在側
基上接了一較大 Biphenyl 液晶基,可預期提高溶解度,並防止凝膠 化產生。
聚合物 1P 之重量平均分子量(Mw)為 2.69 ×103 g/mol,數目平均分
子量 (Mn) 為 1.75 ×103 g/mol , 分 子 量 分 佈 (polydispersity, PDI) 為
1.54,由Mn計算得到高分子鏈僅為 5~6 個單體所組成,顯示聚合物 1P 為寡聚物。聚合物 2P 之Mn、Mw及 PDI 分別為 2.04×105 g/mol、 3.95×105 g/mol 及 1.94。由於聚合物 2P 之側鏈液晶基能增加溶解度, 聚合物 2P 之分子量較 1P 大幅增加。在共聚物的製備方面,3P 仍為 寡聚物,4P 則成長為高分子量產物,Mn及Mw分別為 5.96×104 及 1.13×105 g/mol,顯示含有分岔碳鍵之 3M 引入,可增加其分子量。聚 合物 5P 之分子量與 2P 相近,然而聚合物 6P 之分子量反而下降,可 能是 MEH-PPV 之分岔鏈帶來溶解度影響比不上 Biphenyl 液晶基。聚 合結果如 Table 3-1 所示。
Table 3-1. The Mn,Mw, and PDI values of polymers 1P~6P.
單體 1M 及聚合物 1P 之1
H-NMR 光譜如 Figure 3-1 所示,單體之
-CH2Cl 團基在聚合後已經消失,而聚合物 1P 主鏈上反式雙鍵之氫訊
號推測在 6.8 ppm。
Figure 3-1. The 1H-NMR spectra of 1M and 1P.
Polymer Mn×10 3 (g/mol) Mw×103 (g/mol) PDI 1P 1.75 2.69 1.54 2P 204.21 395.45 1.94 3P 1.79 2.62 1.47 4P 59.60 113.95 1.91 5P 221.64 324.69 1.47 6P 82.61 222.34 2.69 H CH2Cl
單體 2M 及聚合物 2P 之 1
H-NMR 光譜如 Figure 3-2 所示,單體
-CH2Cl 團基在聚合後已經大幅消失,而聚合物 2P 主鏈上反式雙鍵之
氫訊號被包埋在苯環的氫訊號之中,不易觀測。
Figure 3-2. The 1H-NMR spectra of 2M and 2P.
單體 2M 及 5P 聚合物之1 H-NMR 光譜如 Figure 3-3 所示,單體中 之-CH2Cl 團基在聚合後已經消失,而聚合物 5P 主鏈上反式雙鍵之氫 訊號推測在 6.8 ppm。 H CH2Cl CH2Cl
Figure 3-3. The 1H-NMR spectra of 2M and 5P.
3-3 熱性質分析
首先利用 TGA 檢測高分子之熱穩定性,聚合物 1P 及 2P 之 TGA 曲線如 Figure 3-4 所示。裂解溫度(Decomposition temperature, Td)定義
為產生 5%重量損失之溫度。相較於一般高分子,本研究製備之高分 子均具有中等之熱穩定性。1P 與 2P 之 Td分別為 307 及 343 o C,聚 合物 2P 之熱穩定性較高,除了分子量較大之因素外,側鏈上剛硬 Biphenyl 液晶基亦帶來部份影響。聚合物 3P 與 5P 之 Td分別為 387 及 361 o C。聚合物 4P 與 6P 之 Td分別為 385 及 381 oC,這四種聚合 H CH2Cl
物熱穩定性相差不大。 Figure 3-5~Figure 3-7 顯示所有聚合物之 DSC 曲線,其 Tg分別為 162、209、228、234、209 及 201 oC。聚合物 1P 側鏈僅連接柔軟長 碳鏈而且分子量很小,分子鏈較容易受熱而撓動,故其 Tg 最低;聚 合物 2P 之 Tg較高,主因來自較高的分子量,側鏈巨大團基亦會影響 分子鏈之撓動。由 Figure 3-5 觀察到 2P 於 90 o C 有一明顯吸熱峰,表 示側鏈 Biphenyl 液晶基之熔解行為,此乃主鏈與側鏈團基之微分離 (Microseparation)現象。另於 157 oC 觀察到一小放熱峰,可能是側鏈 基之再結晶或不純物造成。相較於聚合物 1P,聚合物 3P 之 Tg高出 1P 甚多,其原因不明。聚合物 5P 與 2P 之 Tg 相近,雖然有加入 MEH-PPV 單體進行共聚,但是 Tg沒有太大變動。
Figure 3-4. TGA thermograms of polymers (a) 1P, 3P, 4P and (b) 2P, 5P, 6P. 0 100 200 300 400 500 600 700 0 20 40 60 80 100 1P 3P 4P W e ig h t R e s id u e ( % ) Tem perature (OC) (a) 0 100 200 300 400 500 600 700 0 20 40 60 80 100 2P 5P 6P W e ig h t R e s id u e ( % ) Temperature (OC) (b)
140 160 180 -1.8 -1.7 -1.6 -1.5 Temperature (OC) 162 oC 1P E N D O E X O (a) 80 120 160 200 240 -2.2 -2.0 -1.8 -1.6 -1.4 -1.2 Temperature (oC) 209 oC 2P 90 oC E N D O E X O (b)
198 216 234 252 270 -1.5 -1.4 -1.3 -1.2 -1.1 E N D O E X O Temperature (oC) 228 oC 3P (a) 180 195 210 225 240 255 270 -1.68 -1.60 -1.52 -1.44 -1.36 Temperature (oC) 234 oC 4P E N D O E X O (b)
180 195 210 225 240 255 -1.80 -1.68 -1.56 -1.44 -1.32 Temperature (oC) 5P E N D O E X O 209 oC (a) 165 180 195 210 225 240 255 -2.2 -2.0 -1.8 -1.6 -1.4 Temperature (oC) E N D O E X O 6P 201 oC (b)
3-4 UV-Vis 與 PL 之分析 3-4-1 UV-Vis 光譜分析
Figure 3-8 顯示 1P 之 UV-Vis 吸收光譜,其於 Toluene、THF 及 DCM
測得之最大吸收波長分別為 361、359 及 362 nm,當以薄膜進行量測 時其最大吸收波長為 370 nm,與溶液態相比產生約 10 nm 之紅位移, 此乃薄膜態下高分子鏈彼此靠近,較容易堆疊所導致。另於 290 nm 左右觀察到一吸收峰,為 benzacenaphthene 之吸收。Figure 3-9 顯示 2P 之 UV-Vis 吸收光譜,其於 Toluene、THF 及 DCM 最大吸收波長 分別為 369、361 及 360 nm,當以薄膜進行量測時其最大吸收波長為 366 nm。 共聚物 3P 之 1M 與 3M 加入比例為 9:1,Figure 3-10 顯示 3P 於不 同溶液中之最大吸收波長位於 364~365 nm 左右,當以薄膜進行量測 時其最大吸收波長為 368 nm,與溶液態相比僅產生約 4 nm 之紅位 移,吸收的特性不依溶劑極性或狀態而改變。 共聚物 4P 之 1M 與 3M 加入比例為 1:1。Figure 3-11 顯示 4P 於溶 液態測得之最大吸收波長分別為 488、485 及 490 nm,當以薄膜進行 量測時其最大吸收波長為 489 nm。此乃跟 MEH-PPV 之吸收相似[12]。 聚合物 5P 之吸收光譜如 Figure 3-12 所示,溶液態中 Toluene、THF 及 DCM 測得之最大吸收波長分別為 369、366 及 367 nm,薄膜態之
最大吸收波長為 369 nm,與 2P 相似。聚合物 6P 之吸收光譜如 Figure 3-13 所示,於溶液態中 Toluene、THF 及 DCM 測得之最大吸收波長 分別為 488、485 及 483 nm,薄膜態之最大吸收波長為 493 nm。 3-4-2 PL 光譜分析 聚合物 1P 之 PL 光譜如 Figure 3-14 所示,分別以其最大吸收波長 為激發波長,其於三種不同溶劑 Toluene、THF 及 DCM 所得最大放 光波長分別在 483、487 及 485 nm;當以薄膜測試時,其最大放射波 長為 510 nm,顯示紅位移現象。 聚合物 2P 之 PL 光譜如 Figure 3-15 所示,其在 Toluene、THF 及 DCM 三種不同溶劑所得最大放光波長分別在 481、480 及 483 nm, 當以薄膜測試時,其最大放射波長為 508 nm,顯示紅位移現象,然 而於 620 nm 左右發現放光,推測因 2P 分子量較大,主鏈彼此間形成 堆疊所致。 聚合物 3P 之 PL 光譜如 Figure 3-16 所示,其放光波長在 490~517 nm 之間;聚合物 4P 之 PL 光譜如 Figure 3-17 所示,其放光波長在 558~571 nm 之間。 由 Figure 3-18 及 Figure 3-19 所示,聚合物 5P 及 6P 之最大放光波 長分別在 492~523 nm,以及 553~570 nm 之間。另外聚合物 4P 及 6P 分別在 615 及 620 nm 有一個肩峰,此乃主鏈和主鏈之間緊密的堆疊
所造成的能量轉移現象。所有聚合物之詳細 UV-Vis 及 PL 光譜數據 整理於 Table 3-2 中。 300 400 500 0.0 0.2 0.4 0.6 0.8 1.0 A b s o rb a n c e ( a .u .) Wavelength (nm) film solu. (Toluene) solu. (THF) solu. (DCM)
Figure 3-8. UV-Vis absorption spectra of polymer 1P.
300 400 500 0.0 0.2 0.4 0.6 0.8 1.0 A b s o rb a n c e ( a .u .) Wavelength (nm) film solu.(in Toluene) solu.(in THF) solu.(in DCM)
250 300 350 400 450 500 0.0 0.2 0.4 0.6 0.8 1.0 film solu.(in Toluene) solu.(in THF) solu.(in DCM) A b s o rb a n c e ( a .u .) Wavelength (nm)
Figure 3-10. UV-Vis absorption spectra of polymer 3P.
300 400 500 600 700 0.0 0.3 0.6 0.9 1.2 A b s o rb a n c e ( a .u .) Wavelenghth (nm) film solu.(Toluene) solu.(THF) solu.(DCM)
250 300 350 400 450 500 0.0 0.2 0.4 0.6 0.8 1.0 film solu.(in Toluene) solu.(in THF) solu.(in DCM) A b s o rb a n c e ( a .u .) Wavelength (nm)
Figure 3-12. UV-Vis absorption spectra of polymer 5P.
250 300 350 400 450 500 550 600 650 700 -0.2 0.0 0.2 0.4 0.6 0.8 1.0 film solu.(in Toluene) solu.(in THF) solu.(in DCM) A b s o rb a n c e ( a .u .) Wavelength (nm)
400 500 600 0.0 0.2 0.4 0.6 0.8 1.0 P L I n te n s it y ( a .u .) Wavelength (nm) film solu.(in Toluene) solu.(in THF) solu.(in DCM)
Figure 3-14. PL spectra of polymer 1P.
400 500 600 700 0.0 0.2 0.4 0.6 0.8 1.0 P L I n te n s it y ( a .u .) Wavelenghth (nm) film solu.(in Toluene) solu.(in THF) solu.(in DCM)
400 450 500 550 600 650 700 0.0 0.2 0.4 0.6 0.8 1.0 P L I n te n s it y ( a .u .) Wavelenghth (nm) film solu.(in Toluene) solu.(in THF) solu.(in DCM)
Figure 3-16. PL spectra of polymer 3P.
550 600 650 0.0 0.2 0.4 0.6 0.8 1.0 P L I n te n s it y ( a .u .) Wavelenghth (nm) film solu.(in Toluene) solu.(in THF) solu.(in DCM)
400 450 500 550 600 650 0.0 0.2 0.4 0.6 0.8 1.0 film solu.(in Toluene) solu.(in THF) solu.(in DCM) P L I n te n s it y ( a .u .) Wavelength (nm)
Figure 3-18. PL spectra of polymer 5P.
500 550 600 650 0.2 0.4 0.6 0.8 1.0 film solu.(in Toluene) solu.(in THF) solu.(in DCM) P L I n te n s it y ( a .u .) Wavelength (nm)
Table 3-2. (a)UV-Vis absorption λmax and (b) PL emission λmax of
polymers 1P~6P.
(a) UV-Vis λmax (nm)
Polymer Toluene THF DCM Film
1P 361 359 362 370 2P 364 361 359 366 3P 364 365 365 368 4P 488 485 490 489 5P 369 366 367 369 6P 488 485 483 493 (b) PL λmax (nm)
Polymer Toluene THF DCM Film
1P 483 487 485 510 2P 481 480 483 508 3P 490 498 496 517 4P 567 560 557 571 5P 492 506 515 523 6P 553 551 555 570 3-5 電化學分析 聚合物之 Eg大小會直接影響 UV-Vis 吸收、螢光放射光譜及電激發
光光色。由 CV 曲線中之氧化起始電位(Eox)及還原起始電位(Ered),聚
合物之 LUMO 與 HOMO 由下列半經驗式計算之 [49]:
HOMO = -| 4.4 + Eox |
LUMO = -| 4.4 + Ered |
Eg = LUMO - HOMO
LUMO 及 Eg之單位均為電子伏特(eV)。由於聚合物在 CV 量測中還 原電位曲線會因水及不純物等干擾而變得非常雜亂,導致聚合物還原 曲線不明顯,因而無法直接以半經驗公式取得正確的 LUMO 值,故 對於聚合物能隙數據取得,一般可藉由 UV-Vis 光譜中最大吸收峰之 起始吸收波長(λonset)來計算得到 Eg,再利用 CV 測得聚合物之 HOMO 值即可推得 LUMO 值。公式如下: Eg = 1240/λonset
LUMO = Eg-| HOMO |
所有聚合物之氧化及還原電位、HOMO、LUMO 及 Eg如 Table 3-3 所示。聚合物 1P、、、、3P 及 4P 之 CV 曲線圖如 Figure 3-20 所示,其 Eox 分別為 1.59、1.54 及 1.06 V,因此其 HOMO 經計算為-5.99、-5.94 及 -5.46 eV,顯示出 3M 單體引入進行共聚可增加其 HOMO 值,使電洞 更容易注入。三者之 UV-Vis 吸收光譜的起始位置分別在 422、441 及 575 nm,因此其 Eg分別為 2.94、2.81 及 2.16 eV,經計算後 LUMO 分別為-3.05、-3.13 及-3.3 eV。聚合物 4P 引入 3M 單體(50%),其聚 合物鏈存在部份 MEH-PPV 之鏈段,其主鏈之 π-π*躍遷與純的
MEH-PPV 相同,故其 Eg與 MEH-PPV 相同,約為 2.2 eV。
別為 1.23、1.41 及 1.17 V,因此其 HOMO 經計算為-5.63、-5.81 及-5.57 eV,同樣顯示 3M 單體引入進行共聚及可增加其 HOMO 值,使電洞 更容易注入。三者之 UV-Vis 吸收光譜的起始位置分別在 427、427 及 575 nm,因此其 Eg分別為 2.90、2.90 及 2.16 eV,經計算後 LUMO 分別為-3.1、-3.13 及-3.3 eV。 比較聚合物 1P 與 2P 能階,聚合物 2P 之 HOMO 能階(-5.63 eV) 較 1P 的 HOMO 能階(-5.99 eV)為高,這是因為聚合物 2P 在側基所連接 的 Biphenyl 基團具有電洞傳輸效果所導致。
Table 3-3. The electrochemical properties of all polymers 1P~6P.
Polymer Eox(V) Ered (V) HOMO (eV) LUMO (eV) Eg (eV) 1P 1.59 -1.35 -5.99 -3.05 2.94 2P 1.23 -1.3 -5.63 -3.1 2.89 3P 1.54 -1.27 -5.94 -3.13 2.81 4P 1.06 -1.1 -5.46 -3.3 2.16 5P 1.41 -1.27 -5.81 -3.13 2.81 6P 1.17 -1.1 -5.57 -3.3 2.16
0.0 0.5 1.0 1.5 2.0 2.5 3.0 0.0 0.2 0.4 0.6 0.8 1.0 C u rr e n t (m A ) Potential (V) 1P 3P 4P
Figure 3-20. Cyclic voltammograms of polymers 1P, 3P, and 4P.
0.0 0.5 1.0 1.5 2.0 2.5 3.0 0.0 0.1 0.2 0.3 0.4 0.5 0.6 2P 5P 6P C u rr e n t (m A ) Potential (V) Figure 3-21. Cyclic voltammograms of polymers 2P, 5P, and 6P.
3-6 元件光電性質之量測
本 研 究 採 用 雙 層 元 件 之 結 構 為 ITO/PEDOT/polymer/Al , 其 中
元件之驅動電壓為 8 V,其 EL 放射光譜如 Figure 3-22 所示,其最大 放射波長在 506 nm,屬於藍綠光範圍。比較其 EL 與 PL 的光譜後發 現,兩者光譜非常類似,可見此兩者的放光機制應該是相似的。2P 元件之驅動電壓為 7 V,通以正向偏壓後亦可得藍綠色之電激發光, 其 EL 放射光譜如 Figure 3-22 所示,其最大放射波長為 503 nm。 3P 元件之驅動電壓為 8 V,通以正向偏壓後可得綠色之電激發光, 其 EL 放射光譜如 Figure 3-23 所示,其最大放射波長為 513 nm。5P 元件之驅動電壓為 6 V,通以正向偏壓後亦可得綠色之電激發光,其 EL 放射光譜如 Figure 3-23 所示,其放射最大波長為 521 nm。 4P 和 6P 元件之驅動電壓為 3V,通以正向偏壓後均可得橘紅色之 電激發光,其 EL 放射光譜如 Figure 3-24 所示,其最大放射波長分別 為 576 和 578 nm。和純 MEH-PPV 元件光譜相比較,4P 和 6P 在 620 nm 的肩峰較不明顯,可見側取代基和并苊基會影響鍵的堆疊,阻礙 載子經由此方式傳遞。
1P 與 2P 元件之 I-L-V 曲線如 Figure 3-25 及 Figure 3-26 所示,可
看出 2P 元件亮度較高。聚合物 2P 在側基接上具有電洞傳輸特性的 液晶基團,使其 HOMO 能階較低,電洞較易注入;然而其 LUMO 能 階與陰極金屬的工作函數相差較遠,因而導致了電子較難由陰極注入 發光層[51]。
4P 及 6P 元件驅動電壓相對較低,因為聚合物 4P 及 6P 的 LUMO 能階較低,HOMO 能階較高,進而使得電子及電洞更容易注入。如 Figure 3-32 所示,4P 及 6P 元件最大亮度分別為 156 和 164 cd/m2, 效率分別為 0.017 和 0.018 cd/A。 所有元件當中 5P 元件亮度表現較佳,達到 202 cd/m2,效率則為 0.009 cd/A,可歸因於聚合物 5P 在側基接了含有電洞傳輸特性的液晶 基團,而且分子量也是最高。所有材料之元件數據皆整理於 Table 3-4 中。
Table 3-4. Device Characteristic of all polymers.
Polymer Threshold voltage (V) Max Luminance (cd/m2) Max Current efficiency (cd/A) λmaxEL (nm) 1P 8 11 0.0002 506 2P 7 176 0.005 503 3P 8 12 0.00023 513 4P 3 156 0.017 576 5P 6 202 0.009 521 6P 3 165 0.018 578
400 500 600 700 0.0 0.2 0.4 0.6 0.8 1.0 1P 2P E L I n te n s it y ( a .u .) Wavelength (nm)
Figure 3-22. The EL spectra of polymers 1P and 2P.
400 500 600 700 0.0 0.2 0.4 0.6 0.8 1.0 3P 5P E L I n te n s it y ( a .u .) Wavelength (nm)
500 550 600 650 700 750 0.0 0.2 0.4 0.6 0.8 1.0 4P 6P E L I n te n s it y ( a .u .) Wavelength (nm)
Figure 3-24. The EL spectra of polymers 4P and 6P.
0 2 4 6 8 10 12 0 2000 4000 6000 Current density Brightness Voltage (V) C u rr e n t d e n s it y ( m A /c m 2 ) 0 2 4 6 8 B rig h tn e s s ( c d /m 2 )
0 3 6 9 12 0 800 1600 2400 3200 Current density Brightness Voltage (V) C u rr e n t d e n s it y (m A /c m 2 ) 0 50 100 150 200 B rig h tn e s s (c d /m 2 )
Figure 3-26. The I-L-V curves of polymer 2P.
0 2 4 6 8 10 12 0 1500 3000 4500 6000 Current density Brightness Voltage (V) C u rr e n t d e n s it y ( m A /c m 2 ) 0 4 8 12 B rig h tn e s s ( c d /m 2 )
0 2 4 6 8 10 0 300 600 900 1200 Current density Brightness Voltage (V) C u rr e n t d e n s it y ( m A /c m 2 ) 0 40 80 120 160 B rig h tn e s s ( c d /m 2 )
Figure 3-28. The I-L-V curves of polymer 4P.
0 3 6 9 12 0 1000 2000 3000 4000 Current density Brightness Voltage (V) C u rr e n t d e n s it y (m A /c m 2 ) 0 50 100 150 200 250 B rig h tn e s s ( c d /m 2 )
0 2 4 6 8 0 300 600 900 1200 1500 Current density Brightness Voltage (V) C u rr e n t d e n s it y ( m A /c m 2 ) 0 50 100 150 200 B rig h tn e s s ( c d /m 2 )
第四章 結論 1. 本研究合成出兩種不同側鏈取代基團之聚(7,10-苯并苊基乙烯)衍 生物,取代基分別為癸基及雙苯環液晶基。所有聚合物均採用 Glich 路徑聚合。聚合物 1P 僅為寡聚物;聚合物 2P 之分子量則達 到 2.04 × 105 g/mol,熱性質亦有所提昇,此乃雙苯環液晶基導入 之結果。 2. CV 結果顯示聚合物 2P 之 HOMO 較 1P 高。HOMO 值不同主要是 由於聚合物 2P 側鏈所連接液晶基所導致。推測側鏈液晶基會使得 分子排列更整齊,因此在側鏈基所連接液晶基有助於電洞傳輸的 效果。 3. 聚合物 1P 及 3P 之薄膜態最大吸收波長、分子量、氧化電位均相 當接近;共聚物 4P 及 6P 之光學及電化學性質類似。 4. 所有元件當中 5P 元件表現較佳,具有發光元件的應用潛力。
第五章 參考文獻
[1] Pope, M.; Kallmann, H. P.; Magnante, P. J. Chem. Phys. 1963, 38, 2042.
[2] Helfrich, W.; Schneider, W. G. Rev. Lett. 1965, 14, 229. [3] Tang, C. W.; Vanslyke, S. A. Appl. Phys. Lett. 1987, 51, 913.
[4] Tang, C. W.; Vanslyke, S. A.; Chen, C. H. J. Appl. Phys. 1989, 65, 3610.
[5] Brütting, W.; Buchwald, E.; Egerer, G.; Meier, M.; Zuleeg, K.;Schwoerer, M. Synth. Met. 1997, 84, 677.
[6] Kraft, A.; Grimsdale, A. C.; Holmes, A. B. Angew. Chem. Int. Ed. 1998, 37, 402.
[7] Hwang, D. H.; Kim, S. T.; Li, X. C.; Chuah, B. S.; DeMello, J. C.; Friend, R. H.; Moratti, S. C.; Holmes, A. B. Abstr. Pap. Am. Chem. S. 1997, 213, 319.
[8] Koch, F.; Heitz, W. Macromol. Chem. Phys. 1997, 198, 1531.
[9] Pfeiffer, S.; Hörhold, H. H. Macromol. Chem. Phys. 1999, 200, 870. [10] Sarnecki, G. J.; Burn, P. L.; Kraft, A.; Friend, R. H.; Holmes, A. B.
Synth. Met. 1993, 55, 914.
[11] Wudl, F.; Hoger, S.; Zhang, C.; Parbz, K.; Heeger, A. J. Polym. Prepr. 1993, 34, 197.
[12] Gurge, R. M.; Sarker, A.; Lahti, P. M.; Hu, B.; Karasz, F. E. Macromolecules 1996, 29, 4287.
[13] Gowri, R.; Mandal, D.; Shivkumar, B.; Ramakrishnan S. Macromolecules 1998, 31, 1819.
[14] Leclerc, M.; Diaz, F. M.; Wegner, G. MaKromol. Chem. 1989, 190, 3105.
[15] Mao, H.; Holdcroft, S. Macromolecules 1992, 25, 554.
[16] Gill, R. E.; Malliaras, G. G.; Wildeman, J.; Prof. Hadziioannou, G. Adv. Mater. 1994, 6, 132.
[17] Berggren, M.; Inganäs, O.; Gustafsson, G.; Rasmusson, J.; Andersson, M. R.; Hjertberg, T.; Wennerström, O. Nature 1994, 372, 444.
[18] Andersson, M. R.; Berggren, M.; Inganäs, O.; Gustafsson, G.; Gustafsson-Carlberg J. C.; Selse, D.; Hjertberg, T.; Wennerström, O. Macromolecules 1995, 28, 7525.
[19] Miyazaki, Y.; Yamamoto, T. Chem. Lett. 1994, 41, 1.
[20] Berggren, M.; Gustafsson, G.; Inganäs, O.; Andersson, M. R.; Hjertberg, T.; Wennerström, O. J. Appl. Phys. 1994, 76, 7530.
[21] Uchida, M.; Ohmori, Y.; Morishima, C.; Yoshino, K. Synth. Met. 1993, 57, 4168.
[22] Yuning, L.; Jianfu, D.; Michael D.; Ye T.; Jianping L.; Marie D. Chem. Mater. 2004, 16, 2165.
[23] Grem, G.; Leditzky, G.; Ullrich, B.; Leising G. Adv. Mater. 1992, 4, 36.
[24] Lin, Y.; Chen, Z. K.; Ye, T. L.; Dai, Y. F.; Ma, D. G.; Ma, Z.; Liu,
Q. D.; Chen, Y. J. Polym. Sci. Polym. Chem. 2010, 48, 292.
[25]Chen, H.; Xu, X.; Yan, H. G.; Cai, X. R.; Li, Y.; Jiang, Q.;Xie, M. G.
Chin. Chem. Lett. 2007, 18, 1496.
[26] Huang, W.; Yu, W. L.; Meng, H.; Pei, J.; Li, Y. S. F. Chem. Mater. 1998, 10, 3340.
[27] Lin, Y.; Chen, Y.; Ye, T.; Ma, D.; Li, Y. Eur. Polym. J. 2012, 48, 416.
[28] Park, H.; Shin, D. C.; Kim, J. H.; Kwon, S. K.; Kim, Y. H.
Macromol. Res. 2011, 19, 965.
[29] Burn, P. L.; Holmes, A. B.; Kraft, A.; Bradley, D. D. C.; Brown, A. R.; Friend, R. H.; Gymer, R. W. Nature 1992, 356, 47.
[30] Moratti, S. C.; Cervini, R.; Holmes, A. B.; Baigent, D. R.; Friend, R. H.; Greenham, N. C.; Grüner, J.; Hamer, P. J. Synth. Met. 1995, 71, 2117.
[31] Pang, Y.; Li, J.; Hu, B.; Karasz, F. E. Macromolecules 1999, 32, 3946.
[32] Greenham, N. C.; Moratti, S. C.; Bradley, D. D. C.; Friend, R. H.; Holmes, A. B. Nature 1993, 365, 628.
[33] Moratti, S. C.; Cervini, R.; Holems, A. B.; Baigent, D. R.; Friend, R.H.; Greenham, N. C.; Grüner, J.; Hamer, P. J. Synth. Met. 1995, 71, 2117.
[34] Pei, Q.; Yang, Y. J. Am. Chem. Soc. 1996, 118, 7416.
[35] Grell, M.; Bradley, D. D. C.; Inbasekaran, M.; Woo, E. P. Adv. Mater. 1997, 9, 798.
[36] Yang, Z.; Hu, B.; Karasz, F. E. Macromolecules 1995, 28, 6151. [37] Burn, P. L.; Holmes, A. B.; Kraft, A.; Bradley, D. D. C.; Brown, A.
R.; Friend, R. H.; Gymer, R. W. Nature 1992, 356, 47.
[38] Moratti, S. C.; Cervini, R.; Holmes, A. B.; Baigent, D. R.; Friend, R. H.; Greenham, N. C.; Grüner, J.; Hamer, P. J. Synth. Met. 1995, 71, 2117.