國
立
交
通
大
學
影像與生醫光電研究所
碩
碩
碩
碩
士
士
士
士
論
論
論
論
文
文
文
文
含多環咪唑團基聚
噻
吩衍生物之合成、性質分析
及其有機光電應用
Synthesis, Characterization, and Organic Optoelectronic
Applications of Polythiophene Derivatives Containing
Polycyclic Aromatic Imidazolyl Substituents
研 究 生:李國志 Guo-Chih Lee
指導教授:楊勝雄 博士 Dr. Sheng-Hsiung Yang
中
中
中
中
華
華
華
華
民
民
民
民
國
國
國
國
一
一
一
一
百
百
百
百
零
零
零
零
一
一
一
一
年
年
年
年
七
七
七
七
月
月
月
月
含多環咪唑團基聚
噻
吩衍生物之合成、性質分析
及其有機光電應用
Synthesis, Characterization, and Organic Optoelectronic
Applications of Polythiophene Derivatives Containing
Polycyclic Aromatic Imidazolyl Substituents
研 究 生:李國志 Guo-Chih Lee 指導教授:楊勝雄 博士 Dr. Sheng-Hsiung Yang 國 立 交 通 大 學 影像與生醫光電研究所 碩 士 論 文 A Thesis
Submitted to Institute of Imaging and Biomedical Photonics College of Photonics
National Chiao Tung University in partial Fulfillment of the Requirements
for the Degree of Master
in
Imaging and Biomedical Photonics July 2012
Tainan, Taiwan, Republic of China
含多環咪唑團基聚噻吩衍生物之合成、性質分析及其有機光電應用 學生:李國志 指導教授:楊勝雄 博士 國立交通大學影像與生醫光電研究所 摘要 本研究之目的在於合成含多環咪唑團基之聚噻吩衍生物,並探討不同 多環咪唑團基在熱性質、光學及電化學性質之影響。這些材料可作為主動 層材料以製作高分子太陽能元件。本研究同時製備聚(3-己基噻吩) (P3HT) 以作為對照之用。 利用 GRIM 途徑合成之高分子其立體規則度皆達 95 %以上。所有高分 子之數量平均分子量經測定為 0.63-1.16×104 g/mol,重量平均分子量則為 1.07-2.06×104 g/mol,PDI 在 1.53-1.84 之間。引入咪唑團基之聚噻吩分子量 較 P3HT 為小,乃因聚合時加入巨大的剛硬團基所致。所有高分子的熱裂解 溫度皆達 300 o C 以上,引入剛硬咪唑團基之高分子經高溫加熱後,相較於 P3HT 有更多的殘留重量,確實可增強材料的熱穩定性。 含有咪唑團基之高分子薄膜態的最大吸收峰相較於 P3HT 產生藍位移。 吸光範圍變大,且出現類似於 P3HT 之肩峰,顯示引入較巨大的咪唑團基仍 具有主鏈間的堆疊及較強的吸收。所有高分子之螢光放射波長差異不大,
但衰減的放射強度顯示這些材料中激子不易經由再結合而放光,暗示載子 有更多機會傳遞至兩端電極。電化學分析顯示主鏈引入拉電子咪唑團基致 使 HOMO 能階下降,且其還原起始電位均低於 P3HT,顯示其注入電子的 能力較佳。 本研究意外得到寡聚物 O4 與 O5 且其具有螢光特性,故製作三層式 OLED 元件以探討其光電應用。O4 元件可發出綠光,最高亮度與效率達到 238 cd/m2與 0.12 cd/A,而 O5 元件則發出橘紅光,最高亮度與效率達到 260 cd/m2與 0.13 cd/A,說明這兩種寡聚物材料具有應用於發光元件之潛力。
Synthesis, Characterization, and Organic Optoelectronic Applications
of Polythiophene Derivatives Containing Polycyclic Aromatic
Imidazolyl Substituents
Student: Guo-Chih Lee Advisor: Dr. Sheng-Hsiung Yang
Institute of Imaging and Biomedical Photonics
National Chiao Tung University
Abstract
The goal of this research is to synthesize polythiophene derivatives containing polycyclic aromatic imidazolyl substituents and to study the influence of different imidazolyl substituents on thermal, optical, and electrochemical properties. Those materials can be used as active layer for fabrication of organic solar cells. Poly(3-hexylthiophene) (P3HT) were also synthesized for comparison in this study.
Polymers with high regioregularity > 95% were synthesized via the Grignard metathesis. The number-average molecular weights of polymers are in the range of 0.63-1.16×104 g/mol, while their weight-average molecular weights are in the range of 1.07-2.06×104 g/mol, with PDI in between 1.53 and 1.84. The molecular weights of polythiophene derivatives containing imidazolyl
substitutes are lower than P3HT because of introducing bulky and rigid groups. The decomposition temperatures of all polymers exceed 300 oC. Polythiophene derivatives containing imidazolyl substituents possess more weight residues than P3HT after heating, indicative of enhanced thermal stabilities.
The maximum UV-vis absorption of polythiophene derivatives containing imidazolyl substitutes show blue-shifted compared to P3HT in film state. Broader absorption range and shoulder bands of polythiophene derivatives analogous to P3HT indicate preserved stacking between backbones and enhanced absorption after introducing imidazolyl groups. All polymers show insignificant difference in PL emission wavelength; however, attenuation of fluorescent intensity demonstrates that excitons are not easy to recombine to emit light in those materials, implying more opportunity for carrier to transport to both electrodes. Electrochemical analysis shows that introducing imidazolyl groups onto main chains results in decreasing HOMO level, and the onset of reduction potentials of those derivatives are lower than P3HT, revealing the ease of electron injection.
In this research, oligomers O4 and O5 were unexpectedly obtained and found to be fluorescent, thus triple-layer OLED devices were fabricated to evaluate their optoelectronic applications. O4 device emitted green light, and its highest brightness and current efficiency reached 238 cd/m2 and 0.12 cd/A, respectively. O5 device emitted red light, and its highest brightness and current efficiency reached 260 cd/m2 and 0.13 cd/A, respectively. The above results indicate that these two materials are potential candidates for the application in light-emitting devices.
誌謝 首要感謝指導老師楊勝雄教授在我的碩士求學當中,於學業與生活上皆 有寶貴的指導與幫助,使得本論文可以順利完成。同時感謝口試教授蘇海 清老師與趙宇強老師對本論文的指導與修正,使其內容更加完善。 感謝老師不定期地舉辦聚餐,讓我們常常可以吃到台南特有的餐廳與美 食;感謝畢業學長譔憲、建弘與永俊對於我的實驗總是不厭其煩地指導, 也很懷念當時我們定期的聚餐;感謝同學佳昇、予強及中途脫隊的力中, 下次再一起登上玉山吧;感謝學弟國兼、子軒、維勝、彥廷、于聖與徐雍, 有你們的陪伴在實驗中或生活上皆有許多樂趣發生,還有阿莎力的建威與 建璋希望你們可以順利地突破難關並得到好結果;同時感謝光電學院一起 打球的同學,期望有一天還可以在職場中或者球場上相遇。 最後感謝我的父母提供一個衣食無缺的環境,讓我可以無後顧之憂的取 得碩士學位。 謝謝你們,我生命中的貴人。
目錄 頁次 摘要 ... i Abstract ...iii 誌謝 ... v 目錄 ... vi 流程目錄 ... ix 圖目錄 ... x 表目錄 ...xiii 第一章 緒論 ... 1 1-1 太陽能電池簡介... 1 1-2 有機太陽能電池原理... 2 1-2-1 工作原理 ... 2 1-2-2 元件設計 ... 4
1-2-2-1 單層結構 (Single Layer Devices) ... 4
1-3-2-2 雙層結構 (Bilayer Devices)... 4
1-2-2-3 塊狀異質接面 (Bulk Heterojunction Devices)... 4
1-2-3-2 開路電壓 (Voc)... 7
1-2-3-3 短路電流 (Jsc)... 7
1-2-3-4 填充因子(Fill Factor, FF) ... 7
1-2-3-5 光電轉換效率 (Power Conversion Efficiency, PCE)... 8
1-3 共軛高分子... 9 1-4 低能隙高分子... 10 1-4-1 聯環系統 ... 10 1-4-2 施體-受體系統 ... 12 1-5 高效率高分子材料... 14 1-5-1 聚對苯乙烯(Poly-(p-phenylenevinylene), PPV)與其衍生物 ... 14 1-5-2 聚芴(Polyfluorine, PF)與其衍生物 ... 15 1-5-3 聚噻吩(Polythiophene, PT)與其衍生物... 16 1-6 聚合方法... 20 1-7 研究動機... 22 第二章 實驗方法與步驟... 25 2-1 試藥... 25 2-2 鑑定儀器... 25 2-3 元件製作... 27 2-3-1 ITO 基板清洗步驟... 27
2-3-2 OLED 元件製作流程... 28 2-4 單體之合成... 29 2-5 聚合物之合成... 37 第三章 結果與討論... 42 3-1 聚合... 42 3-2 1H-NMR 分析 ... 44 3-3 FTIR 分析 ... 48 3-4 熱性質分析... 50 3-5 光學性質分析... 53 3-5-1 吸收光譜分析 ... 53 3-5-2 螢光光譜分析 ... 58 3-6 電化學分析... 64 3-7 溶解度測試表... 67 3-8 OLED 元件表現 ... 68 第四章 結論 ... 73 第五章 參考文獻... 75 附錄 ... 80
流程目錄
頁次 Scheme 1. 單體 M1-M3 之合成途徑... 39 Scheme 2. 單體 M4-M5 之合成途徑... 40 Scheme 3. 高分子 P3HT、P1-P3 及寡聚物 O4-O5 之合成途徑 ... 41
圖目錄 頁次 Fig. 1-1 常見有機太陽能電池元件結構 ... 2 Fig. 1-2 有機太陽能電池操作原理示意圖:(a)高分子吸光形成激子;(b)激 子擴散至接面並拆解成電子電洞;(c)載子游移;(d)電子、電洞 分別往陰極、陽極移動 ... 3 Fig. 1-3 塊狀異質接面結構 ... 5 Fig. 1-4 太陽能電池等效電路圖 ... 5 Fig. 1-5 太陽能電池 J-V 曲線圖 ... 8 Fig. 1-6 常見的共軛高分子 ... 9
Fig. 1-7 Donor 與 Acceptor 的內建能階示意圖 ... 10
Fig. 1-8 各種聯環分子 ... 11
Fig. 1-9 高分子的芳香型(Aromatic Form)及醌型(Quinoid Form)共振式... 11
Fig. 1-10 施體與受體交互作用產生低能隙 Eg... 12
Fig. 1-11 施體-受體共聚高分子 ... 13
Fig. 1-12 常見推電子團基 ... 13
Fig. 1-13 常見拉電子團基 ... 14
Fig. 1-15 聚芴衍生物 PFOTBT 及 PFDTBT ... 16 Fig. 1-16 以 Grignard 合成法製備具立體規則度之 P3HT... 16 Fig. 1-17 P3HT-co-PDHT 之化學結構 ... 17 Fig. 1-18 含架橋之聚噻吩衍生物 ... 17 Fig. 1-19 rr-P3HT 與 rr-P3HT-co-EHT ... 18 Fig. 1-20 聚噻吩衍生物 PHPIT ... 19 Fig. 1-21 P3HTT-DPP 之化學結構及吸收光譜... 20 Fig. 1-22 四種不同聚噻吩主鏈結構 ... 20
Fig. 1-23 McCullough 途徑製備 rr-P3AT... 21
Fig. 1-24 Rieke 途徑製備 rr-P3AT... 21
Fig. 1-25 GRIM 之反應機制... 22 Fig. 1-26 本研究之單體 M1-M5 結構... 23 Fig. 3-1 高分子 P3HT、P1-P3 及寡聚物 O4-O5 之化學結構 ... 42 Fig. 3-2 寡聚物 O4-O5 可能結構 ... 44 Fig. 3-3 rr-P3HT 結構圖... 45 Fig. 3-4 單體 M2、高分子 P3HT 與 P2 之1H-NMR 光譜 ... 47 Fig. 3-5 高分子 P3HT 側鏈 α 碳上的 Hb、Hh、Hh’訊號... 48
Fig. 3-6 高分子之 FTIR 光譜 (a) P3HT ; (b) P1 ... 49
Fig. 3-8 高分子 P1 之 DSC 曲線圖 ... 52
Fig. 3-9 高分子 P3HT 及 P1-P3 溶液態之吸收光譜(a) in CB (b) in CHCl3.. 54
Fig. 3-10 高分子 P3HT 及 P1-P3 薄膜態之吸收光譜... 56
Fig. 3-11 寡聚物溶液態之吸收光譜(a) O4、M4 於 DMF 中 (b)O5、M5、M6 於 CB 中... 57 Fig. 3-12 寡聚物 O4 與 O5 於薄膜態之吸收光譜 ... 58 Fig. 3-13 高分子 P3HT 及 P1-P3 溶液態之螢光光譜(a) in CB (b) in CHCl360 Fig. 3-14 高分子 P3HT 及 P1-P3 薄膜態之螢光光譜... 61 Fig. 3-15 寡聚物 O4 與 O5 溶液態之螢光光譜 ... 62 Fig. 3-16 寡聚物 O4 與 O5 薄膜態之螢光光譜 ... 62 Fig. 3-17 高分子 P3HT、P1-P3 之(a)氧化及(b)還原曲線 ... 65 Fig. 3-18 元件使用材料之能階示意圖 ... 66 Fig. 3-19 寡聚物 O4-O5 之氧化曲線圖... 66 Fig. 3-20 TFB 與 P2-BF4之化學結構 ... 69
Fig. 3-21 寡聚物 O4 之(a) J-V-B 曲線、(b) E-J 曲線與(c) EL 光譜圖... 70
表目錄 頁次 Table 1 高分子 P3HT 及 P1-P3 之聚合結果 ... 43 Table 2 噻吩環上之氫在不同位置鍵結方式下之化學位移... 45 Table 3 高分子 P3HT、P1-P3 之氫訊號積分值及立體規則度 ... 47 Table 4 高分子 P3HT、P1-P3 之 FTIR 訊號... 50 Table 5 高分子 P3HT、P1-P3 與寡聚物 O4-O5 之熱性質 ... 52 Table 6 高分子 P3HT 及 P1-P3 之(a)吸收峰值(b)螢光放射峰值 ... 63
Table 7 寡聚物 O4-O5 之(a)吸收峰值(b)螢光放射峰值 ... 63
Table 8 各材料之之氧化起始電位、HOMO、LUMO 及 Eg值 ... 67
Table 9 高分子之溶解度比較表 ... 67
第一章 緒論 1-1 太陽能電池簡介 由於 1970 年代爆發石油危機,並且隨著氣候變遷加劇和能源安全疑 慮,使得世界各國警覺開發新能源的重要性,在兼具環境保護與供給能源 的考量下,再生能源如太陽能光電、風力、水力、地熱等開始蓬勃發展, 而其中太陽能取之不盡、用之不竭,使其成為未來能源的新主力。太陽能 電池種類繁多,目前為止可分為四個世代:第一代基板矽晶 (Silicon)可分 為單晶矽(Monocrystalline Silicon)、多晶矽(Polycrystalline Silicon)與非晶矽 (Amorphous Silicon);第二代以薄膜製程來製造電池,種類可分為碲化鎘 (Cadmium Telluride, CdTe)、銅銦硒化物(Copper Indium Selenide, CIS)、銅銦 鎵硒化物(Copper Indium Gallium Selenide, CIGS)、砷化鎵(Gallium Arsenide, GaAs);第三代為製程中導入有機物和奈米科技,種類有光化學太陽能電池 (Photochemical Solar Cell)、染料光敏化太陽能電池(Dye-Sensitized Solar
Cells) 、 高 分 子 太 陽 能 電 池 (Polymer Solar Cell) 、 奈 米 結 晶 太 陽 能 電 池
(Nanocrystalline Solar Cell)。而第四代則是針對電池吸收光的薄膜製作多層
結構以增進吸光效率。以矽和化合物半導體等無機物製作而成的太陽能電 池通稱無機太陽能電池,效率高且性能穩定,但製作過程複雜、製作成本 高等缺點,不利於推廣為民生使用。
相較於無機太陽能電池,有機太陽能電池(Organic Solar Cell, OSC)具有 製程容易、低製作成本、大面積與可撓性等優點,但光電轉換效率較差且 性能不穩定,未來若能克服效能問題,可望取代矽基太陽能電池成為市場 主力。 1-2 有機太陽能電池原理 1-2-1 工作原理 一般常見的有機太陽能電池元件結構如 Fig. 1-1 所示,最底層為基板, 其上為具導電性的氧化銦錫(Indium Tin Oxide, ITO)作為陽極,接著旋轉塗
佈聚 (3,4- 乙 烯 二 氧 噻 吩 ): 聚 苯 乙 烯 磺 酸(Poly(3,4-ethylenedioxythiophene)
poly(styrenesulfonate), PEDOT:PSS)作為電洞傳輸層,之後再旋轉塗佈主動
層 (Active Layer) , 由 共 軛 高 分 子 (Conjugated Polymer) 與 碳 六 十 衍 生 物
[6,6]-phenyl-C61-butyric acid methyl ester (PCBM)所組成,最後蒸鍍低功函數
之金屬電極作為元件陰極,通常為鋁或鈣。
有機太陽能電池操作原理如 Fig. 1-2 所示,高分子吸光後產生激子 (Exciton),經擴散而游移至施體(Donor)–受體(Acceptor)接面,藉由接面的位 能差而拆解成自由電子與電洞,以位能階梯的方式分別傳遞至陰極和陽 極,藉此產生外部電壓與擴散電流。激子擴散距離(Diffusion Length)平均為 10 nm [1],須在該長度內解離成電子電洞對,而電荷傳遞往往伴隨著電子電 洞對的再結合(Recombination),為了有效形成光電流,必須避免上述情況發 生。 hν LUMO HOMO LUMO LUMO LUMO HOMO HOMO HOMO Donor Donor Acceptor Acceptor Acceptor Acceptor Donor Donor (a) (b) Donor (c) (d) Fig. 1-2 有機太陽能電池操作原理示意圖:(a)高分子吸光形成激子;(b)激子 擴散至接面並拆解成電子電洞;(c)載子游移;(d)電子、電洞分別往陰極、
1-2-2 元件設計
1-2-2-1 單層結構 (Single Layer Devices)
由單層材料所構成,激子在材料與電極間的蕭特基能障而分離,且在相 同的材料中容易使分離的電子、電洞對產生再結合,因此光電轉換效率不 佳。 1-3-2-2 雙層結構 (Bilayer Devices) 由單層結構改良,有機層由電子施體與受體構成,其接面的位能差可以 有效地使電荷分離,且分離後的電子與電洞分別藉由不同遷移率的材料傳 導,可降低再結合的機率,使得光電轉換效率較好,但是唯有在接面附近 生成的激子才有機會分離成電子-電洞對。
1-2-2-3 塊狀異質接面 (Bulk Heterojunction Devices)
有機層的電子施體與受體互相摻雜為單一層,如 Fig. 1-3 所示,具有大 面積的異質接面可以更有效地使激子分離成電子與電洞,但是傳輸路徑不 定且不明確,載子是否能有效地傳遞至電極仍待釐清與克服。此方法目前 被廣泛運用且效率頗高。
Fig. 1-3 塊狀異質接面結構 1-2-3 特性分析 1-2-3-1 等效電路 (Equivalent circuit) Fig. 1-4 為太陽能電池等效電路圖[2],V 為外部提供電壓,Jph為光電流 密度,串聯電阻與並聯電阻分別存在實際元件中,串聯電阻(Series Resistance, Rs)是載子傳遞至電極之間的阻抗,並聯電阻(Parallel Resistance, Rp)為材料接 面接觸的阻抗,接面越密合則 Rp越大,理想狀況為無窮大。
太陽能電池中電壓 V 與電流 J 之間的關係如式(1)所示:
(1)
其中 n 為二極體理想因子(Diode Ideality Factor),q 為基本電荷。激子因 接面能障解離成電子-電洞對,經再結合產生電流 Js,呈負指數變化,如式 (2)所示,並由文獻上指出暗電流 Jso的大小視高分子與 PCBM 之間的摻混程 度而定[3],為載子生成與再結合的比值。 (2) 當元件於開路條件下(J=0, V=Voc),假設 Rp上的漏電流(Leakage Current) 極小(Rp >> Rs),且忽略再結合機制發生的機率,使得短路電流(Short-circuit
Current, Jsc)等於光電流(Jsc=Jph >> Js),則開路電壓(Open-circuit Voltage, Voc)
與短路電流 Jsc可改寫為式(3)與式(4)。
(3)
由式(3)得知欲增加開路電壓 Voc,則 Jso 必須減少,同樣地由式(4)可判 斷減少 Jso同時將降低短路電流 Jsc;然而施體-受體排列的型態(Morphology) 或實際再結合的發生等情況將嚴重影響短路電流 Jsc的大小,計算上將更加 複雜。 1-2-3-2 開路電壓 (Voc) 當太陽能元件經照光後產生逆向光電流 Jph,此時外部偏壓逐漸加大,將 慢慢抵銷光電流,而偏壓達到一定值時整體元件的靜電流為零,此偏壓稱 開路電壓 Voc,一般由施體的最高填滿分子軌域(Highest Occupied Molecular
Orbital, HOMO) 與 受 體 的 最 低 未 填 滿 分 子 軌 域 (Lowest Unoccupied Molecular Orbital, LUMO)以及內建電場所決定[4]。
1-2-3-3 短路電流 (Jsc) 當太陽能元件照光後不施加外部偏壓,此時的逆向光電流稱為短路電流 Jsc,與光強度成正比關係 [5],一般受到材料的載子遷移率(Carrier Mobility)、 載子生命週期(Carrier Lifetime)和載子擴散長度所影響,亦即載子能否成功 地傳遞至兩端電極,為決定 Jsc之重要因素。 1-2-3-4 填充因子(Fill Factor, FF)
為該點所對應的電流與電壓的乘積,其中一點(Vmax, Jmax)可得到最大輸出功 率 Pmax,其值除以 Voc與 Jsc的乘積比,稱為填充因子 FF,以式(5)表示,其 值越接近 1,表示最大輸出功率 Pmax越接近 Voc與 Jsc乘積,電壓-電流曲線 越呈現矩形。 (5) Fig. 1-5 太陽能電池 J-V 曲線圖
1-2-3-5 光電轉換效率 (Power Conversion Efficiency, PCE)
根據 Voc、Jsc與 FF 可以計算出光電轉換效率,如式(6)所示,其中 Pin為
照光強度,測量標準光源採取距離地球表面仰角 48.2o的太陽光譜分布,在
標準情況下(AM 1.5G)其強度為 1000 W/m2。
1-3 共軛高分子
共軛高分子(Conjugated Polymer)係指高分子主鏈由單鍵-雙鍵交替組成 共軛鍵結(Conjugated Bonding),π 電子可以沿著高分子鏈間躍遷(Hopping), 因此具有導電性質。1976 年 A. J. Heeger、A. G. MacDiarmid 與 H. Shirakawa 等人在聚乙炔(Polyacetylene, PA)薄膜中摻雜少量的碘[6],發現該薄膜由具韌
性的銀白色變成帶金屬光澤的銀黑色,同時導電度提升 109倍, 開啟了共
軛高分子在光電上的應用。
常 見 的 共 軛 高 分 子 有 聚 對 位 苯 基 乙 烯 (Poly(p-phenylene vinylene), PPV)、聚芴(Polyfluorene, PF)、聚噻吩(Polythiophene, PT)、PA、聚吡咯 (Polypyrrole, PPy)、聚對位苯(Poly(p-phenylene), PPP),結構如Fig. 1-6所示, 利用其光電性質可應用於有機發光二極體(Organic Light Emitting Diode, OLED) [7-11]、有機場效電晶體(Organic Field Effect Transistor, OFET) [12-15]、
有機感應器(Organic Sensor) [16],與有機太陽能電池等[17-18]。 n S H N n n n
Poly(p-phenyl vinylene) (PPV) Polythiophene (PT)
Polyacetylene (PA) Polypyrrole (PPy)
n
Poly (p-phenylene) (PPP)
R R
Polyfluorene (PF) n
1-4 低能隙高分子
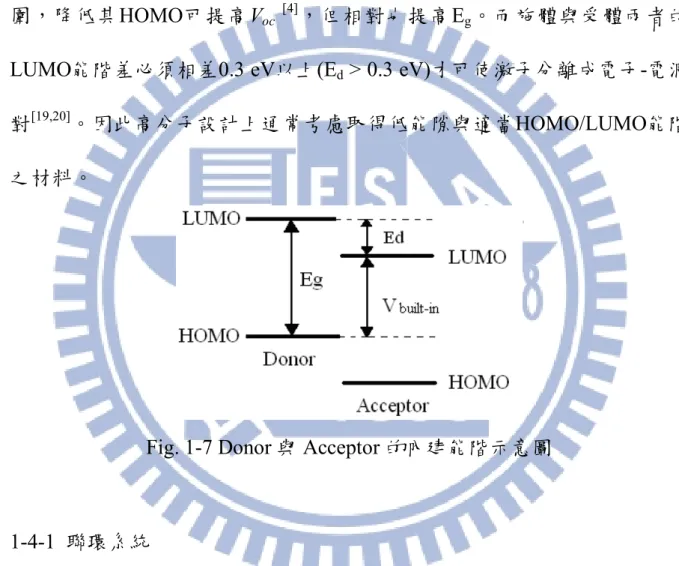
太陽光譜約在700~800 nm附近 (能隙約1.77 eV)有最大光流量密度,為 了吸收更多的光子,共軛高分子的吸收光譜必須儘可能紅位移以涵蓋紅光 與遠紅外光區。由Fig. 1-7所示,施體的能隙(Energy Gap, Eg)決定其吸光範
圍,降低其HOMO可提高Voc
[4],但相對也提高E
g。而施體與受體兩者的
LUMO能階差必須相差0.3 eV以上(Ed > 0.3 eV)才可使激子分離成電子-電洞
對[19,20]。因此高分子設計上通常考慮取得低能隙與適當HOMO/LUMO能階
之材料。
Fig. 1-7 Donor 與 Acceptor 的內建能階示意圖
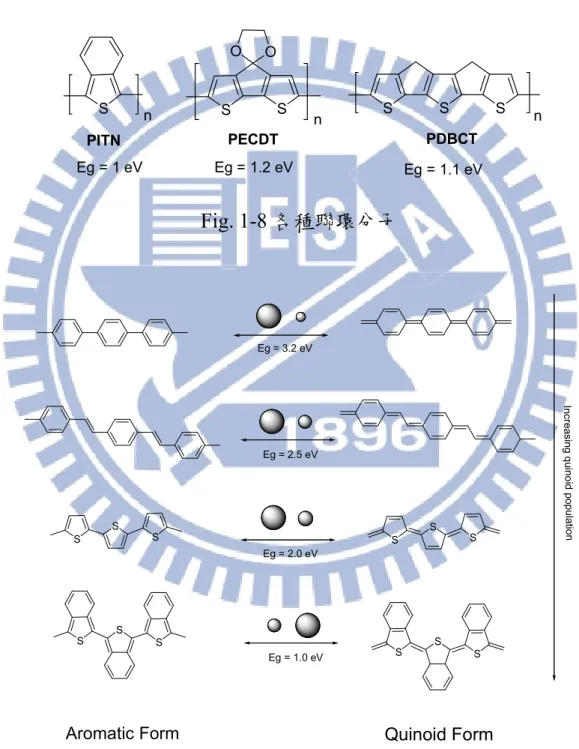
1-4-1 聯環系統 聯環系統之高分子具低能隙的特性,如 Fig. 1-8 之 Polyisothianaphthene (PITN) [21,22]、Poly(4,4-ethylenedioxy-4H-cyclopenta[2,1-b;3,4-b’]dithiophene) [23,24] 、 Poly(4,5-dihydro-Bisthieno[3',2':4,5]cyclopenta[1,2-b:2',1'-d]thiophene) [25] ,因主鏈上之聯環具有較高共振穩定態,容易形成醌型(Quinoid Form)結
構,如 Fig. 1-9 所示,共軛高分子主鏈的聯環單體其芳香性(Aromaticity)愈 小,則 π 電子不定域化(Delocalization)愈明顯,Quinoid Form 形成的機率愈 大。 S S O O S PITN Eg = 1 eV PECDT Eg = 1.2 eV S S S Eg = 1.1 eV n n n PDBCT Fig. 1-8 各種聯環分子 S S S S S S S S S S S S In c re a s in g qu in o id p o pu la tio n Eg = 3.2 eV Eg = 2.5 eV Eg = 2.0 eV Eg = 1.0 eV
Aromatic Form Quinoid Form
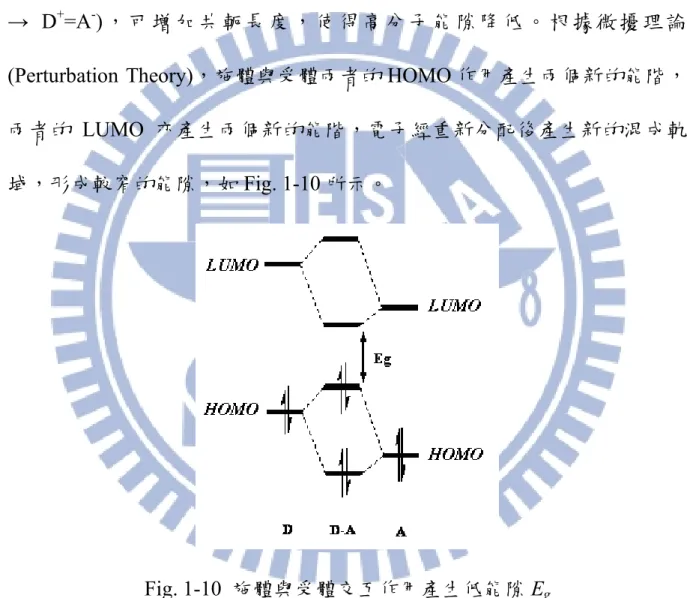
1-4-2 施體-受體系統
製 備 低 能 隙 共 軛 高 分 子 更 簡 單 有 效 的 方 法 是 設 計 含 推 電 子 (Electron-donating)團基與拉電子(Electron-withdrawing)團基的共聚物,藉由 推拉效應(Push-pull Effect)驅使電子更易產生不定域化並產生共振型態(D-A → D+=A-) , 可 增 加 共 軛 長 度 , 使 得 高 分 子 能 隙 降 低 。 根 據 微 擾 理 論 (Perturbation Theory),施體與受體兩者的 HOMO 作用產生兩個新的能階, 兩者的 LUMO 亦產生兩個新的能階,電子經重新分配後產生新的混成軌 域,形成較窄的能隙,如 Fig. 1-10 所示。
Fig. 1-10 施體與受體交互作用產生低能隙 Eg
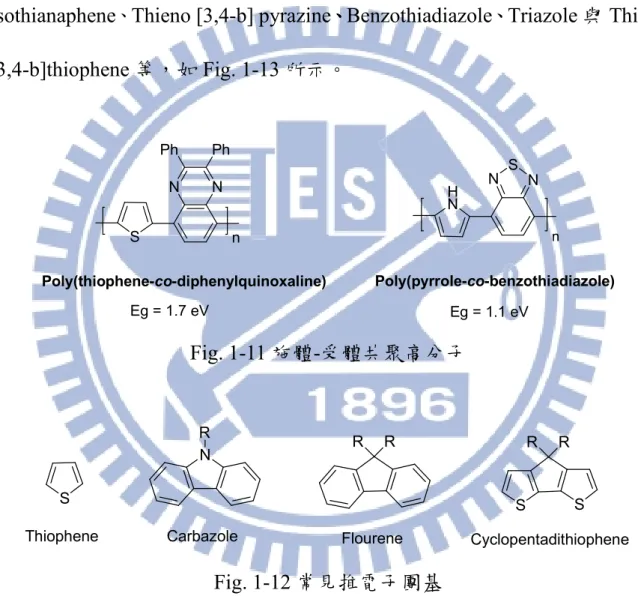
Fig. 1-11 為兩種 Donor-Acceptor (D-A)共聚物,由推電子的 Thiophene 與 拉 電 子 的 Quinoxaline 共 聚 所 形 成 的 Poly(thiophene-co- diphenylquinoxaline) [26],其 Eg為 1.7 eV;Poly(pyrrole-co-benzothiadiazole)
由更強的推電子基 Pyrrole 與拉電子基 Benzothiadiazole 所組成[27],此外分
子間具氫鍵作用力,使得高分子鏈之間排列更加規則,展現更小的 Eg (1.1
eV) 。 一 般 常 見 的 推 電 子 團 基 有 Thiophene 、 Fluorene 、 Carbazole 、 Cyclopentadithiophene 等 , 如 Fig. 1-12 所 示 ; 而 拉 電 子 團 基 則 有 Isothianaphene、Thieno [3,4-b] pyrazine、、、、Benzothiadiazole、Triazole 與 Thieno [3,4-b]thiophene 等,如 Fig. 1-13 所示。 S N N Ph Ph H N N N S Poly(thiophene-co-diphenylquinoxaline) Poly(pyrrole-co-benzothiadiazole) n n Eg = 1.7 eV Eg = 1.1 eV Fig. 1-11 施體-受體共聚高分子 S N R R R S S R R
Thiophene Carbazole Flourene Cyclopentadithiophene
N S N N H N N Triazole Benzothiadiazole N N S Thieno [3,4-b] pyrazine S S Thieno [3,4-b]thiophene S Isothianaphthene Fig. 1-13 常見拉電子團基 1-5 高效率高分子材料 1-5-1 聚對苯乙烯(Poly-(p-phenylenevinylene), PPV)與其衍生物 PPV 是第一個被用來製作 PLED 元件的共軛高分子,側鏈含烷氧基之 PPV 衍生物具備良好的光電性質及高分子量,常被應用於光電元件製作。 Shaheen 等人首先將 Poly(2-methoxy-5-(3,7-dimethyloctyloxy)-1,4-phenylene vinylene) (MDMO-PPV):PCBM (1:4, w/w)作為有機太陽能電池的主動層 [28] ,化學結構如 Fig. 1-14 所示,以氯苯(Chlorobenzene, CB)作為溶劑進行塗 佈,可使兩者產生良好的相分離(Phase Segregation),並提高電子、電洞的 載子遷移率,元件的 Jsc為 5.23 mA/cm 2 ,Voc達 0.82 V,而 PCE 值為 2.5 %。
Tajima 等人以 Wittig-Hornor 法製備具立體規則度之 MDMO-PPV [29],元件 效率達 3.1 % (Jsc = 6.2 mA/cm
2
, Voc = 0.71 V, FF = 70 %),而隨機排列
子的立體規則度(Regioregularity),可提高材料的結晶性,有助於提升載子 移動率與元件的 PCE 值。 O MeO MDMO-PPV n Fig. 1-14 MDMO-PPV 與 PCBM 之化學結構 1-5-2 聚芴(Polyfluorine, PF)與其衍生物 聚芴高分子擁有低 HOMO 能階與高電洞遷移率的特性,被期待可以達 到高 Voc與 Jsc,然而因 Eg過大(約 3.0 eV),無法有效地吸收太陽光子,故常 在主鏈上加入拉電子團基形成 D-A 系統以獲得較小的 Eg。例如聚芴高分子 主 鏈 導 入 強 拉 電 子 、 堆 疊 性 佳 的 2,1,3-Benzothiadiazole 與 推 電 子 的
Thiophene 以改善 Eg與載子遷移率,化學結構如 Fig. 1-15 所示,PFOTBT
的元件效率為 2.84 % (Jsc = 6.3 mA/cm 2 ,Voc = 1.01 V,FF = 44 %) [30] ,將芴 環 9 號位置的碳鏈由 8 個碳改成 10 個碳,形成的 PFDTBT 元件效率為 4.2 % (Jsc = 7.7 mA/cm 2 ,Voc = 0.99 V,FF = 54 %) [31] 。
S S N S N C8H17 C8H17 S S N S N C10H17 C10H17 PFOTBT PFDTBT n n Fig. 1-14 聚芴衍生物 PFOTBT 及 PFDTBT 1-5-3 聚噻吩(Polythiophene, PT)與其衍生物 聚噻吩擁有良好的光電性質、熱穩定與化學穩定性,常運用在各式有機 光 電 元 件 上 。 McCullough 等 人 合 出 立 體 規 則 度 95 % 以 上 之 Poly(3-hexylthiophene) (P3HT) [32,33],其合成途徑如 Fig. 1-16 所示,主鏈結 構因頭對尾(Head-to-Tail)而具共平面,使其 Eg降低(約 2 eV),且吸收波長 產生紅位移,同樣地提高其吸收係數與載子移動率,元件效率為 4.3 % [34]。 Fréchet 等人發現稍微降低立體規則度之衍生物 P3HT-co-PDHT [35],其熱穩 定性以及與 PCBM 的相分離程度都比立體規則度過高之 P3HT 來的佳,其 結構如 Fig. 1-17 所示,元件效率為 4.4 %,於 150 oC 退火 300 分鐘後效率 降為 3.5 %,相較之下 P3HT 僅餘 2.6 %。 S C6H13 Br Br RMgX S C6H13 Br XMg S C6H13 MgX Br Ni(dppp)Cl2 S C6H13 P3HT n Fig. 1-15 以 Grignard 合成法製備具立體規則度之 P3HT
S S C6H13 C6H13 C6H13 P3HT-co-PDHT (m/n=96/4) m n Fig. 1-16 P3HT-co-PDHT 之化學結構 Li 等人設計新的聚噻吩衍生物 PT-VTThV,由雙鍵與三噻吩環組成共軛 架橋以延長共軛[36],化學結構如 Fig. 1-18 所示,載子傳遞路徑不僅侷限於 主鏈,亦可經架橋而傳遞至另一條共軛主鏈,經由增加分子量與控制架橋 比例以維持立體規則度,可增加電洞遷移率,其元件效率為 1.72 %。 S S S S S S S S S S S C6H13 C6H13 PT-VTThV n m x y Fig. 1-17 含架橋之聚噻吩衍生物 Thompson 等人探討烷基側鏈對於排列及效率的影響[37],製備材料 rr-P3HT 及 rr-P3HT-co-EHT 如 Fig. 1-19所示,藉由逐步增加 2-乙基己基的
因是分岔的 2-乙基己基對於 PCBM 的混合均勻度相較於己基來得差,導致 Donor-Acceptor 之間的相分離過大,使得激子拆解為電子、電洞的機會降 低。其最佳效率為 3.85 %,含己基與 2-乙基己基的單體比例為 3:1。 S S S 75 25 rr-P3HT rr-P3HT-co-EHT n Fig. 1-18 rr-P3HT 與 rr-P3HT-co-EHT 聚噻吩含側取代感光團基的開發如 Fig. 1-20 所示,Wei 等人於側鏈導入 拉電子的咪唑(Imidazole)團基[38],激子除可在 D/A 接面進行電子、電洞分
離,亦可藉由分子內的電荷轉移(Intramolecular Charge Transfer)產生電荷分
離,使得該元件具良好的 PCE 值(4.1 %)。此外 Li 等人於噻吩側鏈引入噻吩
乙烯基(Thienylvinyl) [39],訴求增加紫外光區的吸收,元件之 PCE 值為 3.18
S N N C6H13 C6H13 C6H13 PHPIT n S S S S S C6H13 PT-VTVTC12 S C12H25 n m Fig. 1-19 聚噻吩衍生物 PHPIT OSC 除了利用高分子與富勒烯(Fullerene)衍生物作二元共混(Binary Blend)之外,亦有探討三元共混物(Ternary Blend)作為主動層,即兩個 Donor 加上一個 Acceptor,或一個 Donor 加上兩個 Acceptor 作不同比例摻雜,期 望增加對太陽光的吸收範圍,以獲得更佳之 PCE 值,同時避免製程困難的 串疊型電池(Tandem Cell)。 Thompson 等人利用較高能隙之 P3HT-co-EHT 和低能隙之 P3HTT-DPP 作為 Donor,以 PCBM 作為 Acceptor 進行摻混[40],化學結構及吸收光譜如 Fig. 1-19 及 Fig. 1-21 所示,吸收範圍從 300 nm 延伸到 830 nm,並發現 P3HT-co-EHT 比例越多,使得 Voc越大(由 0.574 V 增加至 0.675 V),主動層 之 HOMO 亦 可 藉 由 摻 混 比 例 而 改 變 , 當 比 例 為 P3HTT-DPP : P3HT-co-EHT:PCBM = 0.9:0.1:1.1 時,獲得最佳元件效率為 5.51 %,其 結果相較於個別製作元件為佳(P3HTT-DPP:PCBM = 1:1.3,PCE = 5.07 %;
S S S N N O O S C6H13 80 10 10 P3HTT-DPP Fig. 1-20 P3HTT-DPP 之化學結構及吸收光譜 1-6 聚合方法 早期聚噻吩的合成以電化學聚合、氯化鐵聚合法為主,其缺點為分子量 分布廣且結構不具立體規則度,使得光電性質不佳。四種不同聚噻吩主鏈 結構如 Fig. 1-22 所示。 S S S S S S S S S S S S R R R R R R R R R R R R HT-HT TT-HT HT-HH TT-HH n n n n Fig. 1-21 四種不同聚噻吩主鏈結構 1992 年 McCullough 等 人 於 -78 oC 下 以 有 機 鋰 化 合 物 Lithium Diisopropylamide (LDA)、2-Bromo-3-alkylthiophene 與 MgBr2進行金屬置換
反應(Transmetalation) [41],再以催化劑 Ni(dppp)Cl 2進行聚合反應,此方法所 得之碳鏈取代聚噻吩(P3AT)其立體規則度可達 90 %以上,反應流程如 Fig. 1-23 所示。 S R Br (1) LDA (2) MgBr2 S R Br BrMg Ni(dppp)Cl2 S R P3AT n
Fig. 1-22 McCullough 途徑製備 rr-P3AT
Rieke 等人利用具高活性的鋅催化劑對 2,5-Dibromo-3-alkylthiophene 進 行氧化加成反應(Oxidative Addition) [42],再以催化劑 Ni(dppe)Cl2進行聚合,
反應流程如 Fig. 1-24 所示,經由此途徑所得到的高分子能隙為 1.7 eV,低 於 McCullough 途徑之 2.1 eV。 S R Br Rieke Zn S R Br BrZn Ni(dppe)Cl2 S R P3AT Br n
Fig. 1-23 Rieke 途徑製備 rr-P3AT
1999 年 McCullough 等 人 發 展 出 可 商 業 化 生 產 之 GRIM (Grignard metathesis)途徑[32,33],去除低溫反應與高活性金屬需求,將 2,5-Dibromo- 3-alkylthiophene 與格林納試劑反應產生金屬置換之中間物,其比例由反應 時間、溫度與使用之格林納試劑所決定,再加入催化劑 Ni(dppp)Cl2進行聚
如下:噻吩先進行鹵鎂置換反應(Magnesium-halogen Exchange Reaction),如 Fig. 1-25 所示,於 2 號或 5 號位置產生取代,因為 5 號位置的立體障礙較 小,其產物較多,而且僅 5 號位置取代的噻吩能繼續與觸媒反應[33];之後 脫去溴化鎂,接著進行還原反應以形成雙聚物(Dimer)與觸媒共存之中間 物,再進行氧化加成與還原消去反應,形成三聚物(Trimer)與觸媒之中間 物;如此重複下去形成高分子產物。 S Br Br R RMgBr S BrMg Br R S Br MgBr R 1 1' S BrMg Br R Ni(dppp)Cl2 -RBr -MgBr2 S Br Ni R S MgBr R L L reductive elimination Ni(0) L L S S Br Br R R 3 4 Associated pair [ 3 + 4 ] Oxidative addition after several catalytic cycles
S R S S Ni L Br L R R Br n S R S S Ni L L R R Br n S Br R Ni(0) L L 3 S R S R Br n S Br R 7 oxidative reductive elimination S BrMg Br R 1 Associated pair [ 3 + 7 ] [1] : [1'] = 85 : 15 to 75 : 25 Fig. 1-24 GRIM 之反應機制 1-7 研究動機 高分子太陽能電池所開發的材料絕大多數以主鏈型共軛高分子為主, 並引入側取代碳鏈以增加溶解度,合成側取代感光基的研究仍屬少數。P3HT
導入含咪唑的感光側取代基,由韋光華教授團隊首先探討發表,本研究欲 進一步拓展咪唑團基其上稠環的導入,設計五種單體化學結構如 Fig. 1-26 所 示 , 包 含 Triphenyl-imidazole (M1) 、 Phenanthrenyl-imidazole (M2) 、
Pyrenyl-imidazole (M3)、Phenanthroline- imidazole (M4),及 Acenaphthenyl-
imidazole (M5),為此系列做完整的開發,引入剛硬多環團基亦可期待增加 高分子材料的熱穩定性。 N N S Br Br M1 N N S Br Br M2 N N S Br Br M3 N N S N N Br Br M4 N N S Br Br O M5 Fig. 1-25 本研究之單體 M1-M5 結構 上述咪唑衍生物之中,M1帶有三個可自由旋轉之苯基取代;M2及M3 限制側邊苯環的轉動,可提高平面性;M4引入氮原子,除探討雜原子的影 響外,未來亦可做為配位基引入磷光材料;M5的環張力比M2更大,平面性
圍 的 芳 香 環 結 構 不 同 , 而 產 生 很 大 的 差 異 性 。 各 單 體 將 與 2,5-Dibromo-3-hexylthiophene共聚以形成Donor-Acceptor的共軛高分子,研 究其在光學及熱性質、元件表現上有何種影響。本研究利用核磁共振儀及 紅外線光譜探討化學結構、以吸收光譜及螢光光譜量測光學性質、以循環 電位儀偵測氧化還原電位與能階、以熱重分析儀與示差掃瞄卡計決定熱性 質,並製作有機光電元件探討其光電應用。
第二章 實驗方法與步驟
2-1 試藥
本實驗試藥及溶劑皆自聯工、Merck、Aldrich 與 Alfa Aesar 購入,不經 純化直接使用。反應用之無水四氫呋喃(Tetrahydrofuran, THF)是在氮氣環境 下加入鈉除水,並加入 Benzophenone 作為指示劑,經除水 2 天後蒸出使用。
2-2 鑑定儀器
1. 核磁共振光譜儀(Nuclear Magnetic Resonance Spectrometer, NMR)
係 使 用 BRUKER AVANCE 600 MHz NMR , 並 使 用 d-DMSO 與 d-Chloroform 作為溶劑,Tetramethylsilane (TMS)作為標定基準點。在光譜 中 s 代表單峰(Singlet),d 代表雙重峰(Doublet),t 代表三重峰(Triplet),m 代表多重峰(Multiplet)。
2. 示差掃描卡計(Differential Scanning Calorimeter, DSC)
係使用SII DSC 6200及液態氮冷卻系統,測量樣品之相轉移溫度及其焓 熱值,熔點(Melting Point, Tm)取其極值,玻璃轉移溫度(Glass Transition
Temperature, Tg)則取其反曲點。溫度以Indium及Tin作校正。秤取樣品5-10
3. 熱重分析儀(Thermogravimetric Analyzer, TGA)
係使用SII TG/DTA 7200型。實驗時取樣品5-10 mg,於氮氣流量100 mL/min下測量其熱裂解溫度(Decomposition Temperature, Td),溫度範圍為
100 ~ 600 oC,加熱速率為10 oC/min。
4. 凝膠滲透層析儀(Gel Permeation Chromatography, GPC)
係使用 Viscotek VE3580 GPC 型。使用 Polystyrene (PS)標準品製作分子 量檢量線,THF 為沖提液,流速為 1 mL/min,管柱保持在 32 oC 之恆溫槽 內。樣品溶液配置濃度為 4 mg/2 mL。
5. 紫外-可見光吸收光譜儀(Ultraviolet-visible Spectrophotometer)與螢光光 譜儀(Fluorescence Spectrophotometer)
此兩種光譜儀皆採用 Princeton Instruments Acton 2150 機型。薄膜樣品 的製備步驟:將高分子以濃度 1 wt% 配製溶液,再以滴乾成膜法旋轉塗佈 法成膜於已清洗之玻璃基板上。溶液樣品的製備:將高分子以 1 mg/20 mL 之濃度分別溶在氯苯(Chlorobenzene)、三氯甲烷(Chloroform)、二甲基甲醯 胺(N,N’-Dimethylformamide, DMF),並將溶液滴入石英槽中量測。
6. 循環伏安計量法(Cyclic Voltammetry, CV)
tetrafluoroborate/乙腈之電解液,參考電極為 Ag/AgCl 之玻璃電極,另準備 兩片面積相同之 ITO 玻璃基板作為工作電極與對應電極。將待測高分子溶 液以滴乾成膜法(Drop Casting)塗佈於 ITO 工作電極上,測量範圍從 3 V 到 -3 V。
7. 氣相層析質譜儀(Gas Chromatography-Mass Spectrophotometer, GC-MS) 係使用Micromass TRIO-2000 GC-MS。氣相層析質譜儀係經由氣相層析 之高分離效果與質譜之高辨別性的機器,將氣相層析分離之成分蒸氣進入 質譜儀分析獲得分子結構之資訊。
8. 傅立葉紅外線光譜儀(Fourier Transform Infrared Spectrometer, FTIR) 係使用Perkin Elmer instruments Spectrum One光譜儀。利用干涉波照射 至樣品後,將干涉光譜座富利葉轉換可得材料之紅外線光譜,使用於有機 材料中可用來鑑定化學鍵。將待測高分子使用滴乾成膜法均勻分佈在KBr 壓片上,並使用氮氣緩慢吹乾KBr樣品行程薄膜量測。 2-3 元件製作 2-3-1 ITO 基板清洗步驟 1.將 ITO 基板切割為 1.7 cm×1.7 cm。
3.以牙刷沾上述溶液清潔 ITO 玻璃基板。
4.將 ITO 板置入 Detergent 溶液中施以超音波震洗 20 分鐘。 5.取出 ITO 基板置入去離子水以超音波震洗 20 分鐘。
6.依此類推,將溶液依序換為丙酮與異丙醇(Isopropyl alcohol, IPA)震洗。 7.取出 ITO 基板置入真空烘箱以 90 oC 烘烤 30 分鐘。
8.待其冷卻後施以 UV-ozone 照射 30 分鐘。
2-3-2 OLED 元件製作流程
1.首先將電洞傳輸材料 PEDOT 或 PF 衍生物 TFB 塗佈於 ITO 基板上。 塗 佈 PEDOT 之 參 數 設 定 如 下 : 配 置 溶 液 (PEDOT CH8000:DI Water:IPA:Detergent = 1:0.6:0.2:0.2 重量比)並以 6000 rpm/30 sec 塗佈於 ITO 基板上,再放入真空烘箱中以 120 oC 烘烤 30 分鐘。塗佈 TFB(由本 實驗室林子軒同學提供)之參數設定如下:配置溶液(濃度為 0.5 wt%溶 於 CB 中)並以 2000 rpm/30 sec 塗佈於 ITO 基板上,再放入真空烘箱中 以 120 oC 烘烤 30 分鐘。 2.將發光材料溶液(濃度為 3 wt%溶於 CB 中)以 2000 rpm/30 sec 的參數 設定塗佈於 PEDOT/ITO 上,再放入真空烘箱中以 90 oC 烘烤 30 分鐘。 3.將電子傳輸層溶液(濃度為 0.05 wt %溶於乙腈,材料 P2-BF4由本實驗 室蔡佳昇同學提供)以 2000 rpm/30 sec 的參數設定塗佈於發光層之上,
再放入真空烘箱中以 90 o C 烘烤 30 分鐘。 4.以熱蒸鍍方式蒸鍍鋁電極(腔體壓力為 6.3×10-6 torr)。 2-4 單體之合成 各 中 間 物 及 單 體 M1-M5 之 合 成 流 程 如 Schemes 1-2 所 示 。 單 體 2,5-Dibromo-3-hexylthiophene (M6)之合成參照文獻[35]。 2,5-Dibromo-3-thiophenecarboxaldehyde (1)
取 3-Thiophenecarboxaldehyde (2.0 g, 17.83 mmol)與 N-Bromosuccinimide (7.0 g, 39.33 mmol)溶於 DMF (30 mL),於室溫下攪拌一天。接著以大量乙 酸乙酯(Ethyl acetate, EA)與飽和食鹽水萃取,有機層以無水硫酸鎂除水並濃 縮,再以管柱層析法純化(沖提液 EA:正己烷(Hexane)=1:10),得黃色固體 3.0 g,產率 62 %。 1 H-NMR (600 MHz, CDCl3, ppm): 9.78 (s, 1H, aromatic proton), 7.32 (s, 1H, aromatic proton). 13C-NMR (600 MHz, CDCl3, ppm): 183.10, 139.27, 128.62, 124.17, 113.33. Mass (EI): m/z 269. Tm = 48 o C. 2-(2,5-Dibromothiophen-3-yl)-1,4,5-triphenyl-1H-imidazole (M1) 取化合物(1) (2.0 g, 7.43 mmol)、Aniline (0.692 g, 7.43 mmol)、Benzil (1.56 g, 7.43 mmol)、Ammonium acetate (3.67 g, 47.66 mmol)與醋酸(20 mL),於 120
析法純化(沖提液 DCM:Hexane=1:1),得黃色固體 3.6 g,產率 91 %。
1
H-NMR (600 MHz, CDCl3, ppm): 7.58-7.57 (d, J=7.5 Hz, 2H, aromatic
protons), 7.28-7.23 (m, 8H, aromatic protons), 7.20-7.18 (t, J=7.26 Hz, 1H, aromatic proton), 7.15-7.14 (d, J=6.48 Hz, 1H, aromatic proton), 6.99-6.97 (d, J=7.38, 1H, aromatic proton), 6.77 (s, 1H, aromatic proton). 13C-NMR (600 MHz, CDCl3, ppm): 140.23, 138.42, 136.03, 134.09, 132.45, 131.92, 130.97, 130.24, 130.18, 128.87, 128.45, 128.27, 128.14, 127.76, 127.33, 126.75, 113.52, 111.12. Mass (EI): m/z 535. Tm = 230 o C. 2-(2,5-Dibromothiophen-3-yl)-1-phenyl-1H-phenanthro[9,10-d]imidazole (M2)
取 化 合 物 (1) (2.0 g, 7.43 mmol) 、 Aniline (0.692 g, 7.43 mmol) 、 Phenanthrenequinone (1.54 g, 7.43 mmol)、Ammonium acetate (3.67 g, 47.66 mmol)與醋酸(20 mL),於 120 oC 進行迴流 6 小時。待反應完成後加入大量 蒸餾水,收集固體再以管柱層析法純化(沖提液 DCM:Hexane=1:1),得白 色固體 3.0 g,產率 76 %。
1
H-NMR (600 MHz, CDCl3, ppm): 8.83-8.82 (dd, J1=7.92 Hz, J2=0.9 Hz, 1H,
aromatic proton), 8.77-8.76 (d, J=8.4 Hz, 1H, aromatic proton), 8.71-8.69 (d, J= 8.28, 1H, aromatic proton), 7.75-7.72 (t, J=7.56 Hz, 1H, aromatic proton), 7.67-7.64 (t, J=8.1 Hz, 1H, aromatic proton), 7.59-7.55 (m, 3H, aromatic protons), 7.54-7.51 (t, J=6.84 Hz, 1H, aromatic proton), 7.47-7.46 (dd, J1=7.02
Hz, J2=1.62 Hz, 2H, aromatic protons), 7.29-7.27 (t, J=8.16 Hz, 1H, aromatic
proton), 7.24-7.23 (dd, J1=8.34 Hz, J2=0.78 Hz, 1H,aromatic proton), 6.76 (s,
132.32, 131.52, 129.89, 129.40, 128.36, 128.30, 127.49, 127.41, 127.08, 126.34, 125.78, 125.27, 124.10, 123.09, 122.73, 120.97, 114.81, 111.31. Mass (EI): m/z 533. Tm = 182 o C. 4,5-Phenanthrenedicarboxylic Acid (2)
取 Pyrene (20.0 g, 98.88 mmol)與 Tungstic acid (1.02 g, 4.08 mmol)溶於 CB (80 mL)中。另取 Aliquat 336 (2 mL, 4.37 mmol)、Phosphoric acid (1 mL, 19.2 mmol)溶於 CB (10 mL)中,緩慢滴入上述溶液,接著緩慢倒入 35 % Hydrogen peroxide (80 mL),維持在 80 oC 反應一天。待冷卻至常溫後,加 入大量蒸餾水並攪拌 2 小時,收集之固體以大量 EA 攪拌清洗後,得棕黑色 固體 21.0 g,產率 80 %。 1 H-NMR (600 MHz, d6-DMSO, ppm): 8.09-8.08 (dd, J1=7.86 Hz, J2=0.78 Hz,
2H, aromatic protons), 7.96-7.95 (dd, J1=7.2 Hz, J2=1.14 Hz, 2H, aromatic
protons), 7.87 (s, 2H, aromatic protons), 7.65-7.63 (t, J=7.56 Hz, 2H, aromatic protons), 3.36 (s, 2H, Ar-COOH). 13C-NMR (600 MHz, d6-DMSO, ppm):
169.33, 134.13, 133.81, 131.27, 127.99, 127.34, 126.38. Mass (EI): m/z 266. Tm
= 246 oC.
Dimethyl 4,5-phenanthrenedicarboxylate (3)
取化合物(2) (10.0 g, 37.59 mmol)溶解於 N,N’-Dimethyl sulfoxide (DMSO) (50 mL)與甲醇(60 mL)之混合溶液中,緩慢滴入濃硫酸(15 mL),維持 80 oC 反應一天。待反應結束後,於冰浴下加入大量 EA 及蒸餾水,抽氣過濾後收
集濾液,再以飽和食鹽水萃取,有機層以無水硫酸鎂乾燥並濃縮,粗產物 再以 Hexane 攪拌清洗,得棕色固體 3.84 g,產率 35 %。
1
H-NMR (600 MHz, CDCl3, ppm): 8.03-8.02 (d, J=7.2 Hz, 2H, aromatic
protons), 7.99-7.97 (d, J=7.86 Hz, 2H, aromatic protons), 7.74 (s, 2H, aromatic protons), 7.62-7.60 (t, J=7.5 Hz, 2H, aromatic protons), 3.80 (6H, s, COOCH3). 13 C-NMR (600 MHz, CDCl3, ppm): 169.29, 134.00, 132.51, 131.68, 128.70, 127.44, 127.36, 126.24, 52.25. Mass (EI): m/z 294. Tm = 248 o C. Pyrene-4,5-dione (4) 取化合物(3) (8.0 g, 34.48 mmol)溶於 anhydrous THF (60 mL),再加入鈉 片 (3.15 g, 136.95 mmol)後,於氮氣及室溫環境下攪拌一天。待反應結束後 緩慢加入大量水以除去多餘的鈉片,接著以大量 EA 與飽和食鹽水萃取,有 機層以無水硫酸鎂乾燥並濃縮,再以 Hexane 攪拌清洗,得橘色固體 3.2 g, 產率 49 %。 1 H-NMR (600 MHz, CDCl3, ppm): 8.40-8.38 (d, J=7.38 Hz, 2H, aromatic
protons), 8.10-8.08 (d, J=7.86 Hz, 2H, aromatic protons), 7.76 (s, 2H, aromatic protons), 7.69-7.67 (t, J=7.62 Hz, 2H, aromatic protons). 13C-NMR (600 MHz, CDCl3, ppm): 180.28, 135.65, 131.94, 130.06, 129.98, 128.26, 127.90, 127.19. Mass (EI): m/z 232. Tm = 161 o C. 2-(2,5-Dibromothiophen-3-yl)-1-phenyl-1H-pyreno[9,10-d]imidazole (M3) 取化合物(1) (3.5 g, 12.96 mmol)、Aniline (1.21 g, 12.99 mmol)、化合物(4) (3.0 g, 12.93 mmol)、Ammonium acetate (4.0 g, 51.94 mmol)與醋酸(30 mL),
於 120 o C 進行迴流 6 小時。待反應完成後加入大量蒸餾水,收集固體再以 管柱層析法純化(沖提液 DCM:Hexane=1:1),得黃色固體 5.0 g,產率 69 %。 1 H-NMR (600 MHz, CDCl3, ppm): 9.07-9.06 (d, J=7.5 Hz, 1H, aromatic proton), 8.21-8.19 (d, J=7.5 Hz, 1H, aromatic proton), 8.15-8.12 (t, J=7.68 Hz, 1H, aromatic proton), 8.11-8.10 (d, J=8.88 Hz, 1H, aromatic proton), 8.07-8.05 (d, J=7.62 Hz, 1H, aromatic proton), 8.04-8.03 (d, J=8.88, 1H, aromatic proton), 7.68-7.65 (t, J=7.86 Hz, 1H, aromatic proton), 7.64-7.63 (dd, J1=7.08 Hz,
J2=0.96 Hz, 1H, aromatic proton), 7.62-7.60 (t, J=7.62 Hz, 2H, aromatic
protons), 7.55-7.54 (d, J=6.9 Hz, 2H, aromatic protons), 7.47-7.45 (d, J=7.92 Hz, 1H, aromatic proton), 6.83 (s, 1H, aromatic proton). 13C-NMR (600 MHz, CDCl3, ppm): 144.56, 137.90, 137.46, 131.59, 129.94, 128.50, 128.00, 127.52, 126.50, 125.34, 124.73, 124.63, 119.85, 118.09, 114.91, 111.40. Mass (EI): m/z 558. Tm = 195 o C. 1,10-Phenanthroline-5,6-dione (5)
取化合物 1,10-Phenanthroline (5.0 g, 27.74 mmol)與 Potassium bromide (5.0 g, 42.02 mmol)於冰浴下加入硫酸和硝酸的混合溶液(50 mL/25 mL),接 著加熱至 70 oC 反應 6 小時。待反應結束後於冰浴下將溶液緩慢滴入蒸餾水 (300 mL)中,再緩慢滴入 50 %氫氧化鈉水溶液直至 pH 呈中性,之後以氯仿 (Chloroform)萃取,有機層以無水硫酸鎂乾燥並濃縮,粗產物再以 EA 攪拌 清洗,得黃色固體 3.56 g,產率 61 %。 1 H-NMR (600 MHz, CDCl3, ppm): 9.11-9.10 (dd, J1=4.68 Hz, J2=1.5 Hz, 2H,
7.59-7.57 (dd, J1=7.8 Hz, J2=4.62 Hz, 2H, aromatic protons). 13 C-NMR (600 MHz, CDCl3, ppm): 156.39, 152.90, 137.29, 128.07, 125.58. Mass (EI): m/z 210. Tm = 261 o C. 2-(2,5-Dibromothiophen-3-yl)-1-phenyl-1H-phenanthro[9,10-d]imidazole (M4) 取化合物(1) (2.0 g, 7.43 mmol)、Aniline (0.692 g, 7.43 mmol)、化合物(5) (1.56 g, 7.43 mmol)、Ammonium acetate (3.67 g, 47.66 mmol)與醋酸(20 mL),於 120 oC 進行迴流 6 小時。待反應完成後加入大量蒸餾水,收集固 體後分別以甲醇與 EA 攪拌清洗,得灰白色固體 1.86 g,產率 47 %。
1
H-NMR (600 MHz, CDCl3, ppm): 9.17-9.16 (dd, J1=4.5 Hz, J2=1.8 Hz, 1H,
aromatic proton), 9.10-9.08 (dd, J1=7.98 Hz, J2= 1.44 Hz, 1H, aromatic proton),
9.04-9.03 (dd, J1=4.2 Hz, J2=1.32 Hz, 1H, aromatic proton), 7.75-7.73 (dd,
J1=7.98 Hz, J2=4.2 Hz, 1H, aromatic proton), 7.64-7.59 (m, 3H, aromatic
protons), 7.52-7.50 (dd, J1=8.46 Hz, J2=1.56 Hz, 1H, aromatic proton),
7.48-7.47 (dd, J1=7.14 Hz, J2=1.38 Hz, 2H, aromatic protons), 7.31-7.29 (dd,
J1=8.46 Hz, J2=4.44 Hz, 1H, aromatic proton), 6.76 (s, 1H, aromatic proton). 13 C-NMR (600 MHz, CDCl3, ppm): 149.17, 148.32, 145.65, 145.07, 144.43, 136.60, 136.09, 131.53, 131.25, 130.54, 130.43, 130.30, 128.17, 128.09, 126.27, 123.91, 123.67, 122.21, 119.52, 115.06, 111.78. Mass (EI): m/z 535. Tm = 335 o C. 1-(2-Ethylhexyloxy)-4-nirtobenzene (6)
mmol)溶解於 DMSO,另取氫氧化鉀(6.05 g, 107.82 mmol)加入上述溶液,於 室溫下攪拌 24 小時。待反應完成後以大量 EA 與飽和食鹽水作萃取,有機 層 以 無 水 硫 酸 鎂 乾 燥 並 濃 縮 , 再 以 管 柱 層 析 法 純 化 ( 沖 提 液 EA : Hexane=1:20),得到無色液體 4.15 g,產率 46 %。 1 H-NMR (600 MHz, CDCl3, ppm): 8.18-8.17 (d, J=9.18 Hz, 2H, aromatic
protons), 6.94-6.93 (d, J=9.18 Hz, 2H, aromatic protons), 3.93-3.92 (d, J=1.8 Hz, 2H, Ph-O-CH2CH(CH2CH3)(CH2-(CH2)2CH3)), 1.78-1.72 (m, 1H, Ph -O-CH2CH(CH2CH3)(CH2-(CH2)2CH3)), 1.52-1.38 (m, 4H, Ph -O-CH2CH(CH2CH3)(CH2-(CH2)2CH3)), 1.32-1.31 (m, 4H, Ph -O-CH2CH(CH2CH3)(CH2-(CH2)2CH3)), 0.94-0.89 (m, 6H, Ph -O-CH2CH(CH2CH3)(CH2-(CH2)2CH3)). 13 C-NMR (600 MHz, CDCl3, ppm): 164.43, 141.23, 125.83, 114.36, 71.31, 39.18, 30.35, 28.97, 23.71, 22.94, 13.98, 11.91. Mass (EI): m/z 252. 4-(2-Ethylhexyloxy)phenylamine (7)
取化合物(6) (3.0 g, 11.93 mmol)、鐵粉(2.0 g, 35.81 mmol)與 Ammonium chloride (1.3 g, 24.3 mmol)溶於 Ethanol 和蒸餾水的混合溶液(12 mL/3 mL), 於 70 oC 下反應 6 小時。待反應完成後減壓濃縮除去 Ethanol,加入 EA 與 飽和食鹽水作萃取,有機層以無水硫酸鎂乾燥並濃縮,再以管柱層析法純 化(沖提液 EA:Hexane=1:4),得到棕色液體 1.88 g,產率 71 %。
1
2H, NH2- Ph), 1.71-1.65 (m, 1H, Ph-O-CH2CH(CH2CH3)(CH2-(CH2)2CH3)), 1.51-1.36 (m, 4H, Ph-O-CH2CH(CH2CH3)(CH2-(CH2)2CH3)), 1.34-1.29 (m, 4H, Ph-O-CH2CH(CH2CH3)(CH2-(CH2)2CH3)), 0.93-0.89 (m, 6H, Ph-O-CH2CH (CH2CH3)(CH2-(CH2)2CH3)). 13 C-NMR (600 MHz, CDCl3, ppm): 152.64, 139.68, 116.37, 115.65, 71.27, 39.44, 30.50, 29.06, 23.82, 23.04, 14.05, 11.06. Mass (EI): m/z 221. 2-(2,5-Dibromothiophen-3-yl)-1-[4-(2-Ethylhexyloxy)]phenyl-1H- acenaphthro[9,10-d]imidazole (M5) 取化合物(1) (0.5 g, 1.85 mmol)、化合物(7) (0.41 g, 1.85 mmol)、 Acenaphthenequinone (0.39 g, 2.14 mmol)、Ammonium acetate (0.57 g, 7.40 mmol)與醋酸 (10 mL),於 120 oC 進行迴流 6 小時。待反應完成後加入大量 蒸餾水,再以 EA 與飽和食鹽水做萃取,濃縮後以管柱層析法純化(沖提液 EA : Hexane = 1 : 10),得白色固體 0.54 g,產率 46 %。
1
H-NMR (600 MHz, CDCl3, ppm): 8.81-8.80 (d, J=7.86 Hz, 1H, aromatic
proton), 8.77-8.76 (d, J=8.4 Hz, 1H, aromatic proton), 8.71-8.69 (d, J=8.34 Hz, 1H, aromatic proton), 7.74-7.71 (t, J=7.56 Hz, 1H, aromatic proton), 7.66-7.63 (t, J=7.98 Hz, 1H, aromatic proton), 7.55-7.52 (m, 1H, aromatic proton), 7.35-7.34 (d, J=8.64 Hz, 2H, aromatic protons), 7.32-7.32 (d, J=3.36 Hz, 2H, aromatic protons), 7.04-7.03 (d, J=8.64 Hz, 2H, aromatic protons), 6.80 (s, 1H, aromatic proton), 3.96-3.95 (d, J=5.88Hz, 2H, Ph-O-CH2CH(CH2CH3)(CH2-(CH2)2CH3)), 1.82-1.78 (m, 1H, Ph-O-CH2CH(CH2CH3)(CH2-(CH2)2CH3)), 1.53-1.36 (m, 8H, Ph-O-CH2CH(CH2CH3)(CH2-(CH2)2CH3)), 1.00-0.93 (m, 6H, Ph-O-CH2CH (CH2CH3)(CH2-(CH2)2CH3)). 13 C-NMR (600 MHz, CDCl3, ppm): 160.18,
144.65, 137.22, 132.53, 131.61, 129.33, 128.28, 127.72, 127.38, 127.14, 126.38, 125.71, 125.21, 124.06, 123.10, 122.88, 122.71, 121.01, 115.54, 114.73, 111.26, 71.14, 39.42, 30.53, 29.69, 29.15, 23.87, 23.04, 14.01, 11.17. Mass (EI): m/z 636. Tm = 138 o C. 2-5 聚合物之合成 聚合物合成之詳細流程如 Scheme 3 所示。所有高分子皆使用 GRIM 途 徑進行聚合,單體 M1-M5 與 2,5-Dibromo-3-hexylthiophene (M6)之當量比為 1:9,Methyl magnesium bromide (CH3MgBr)與單體總量之當量比則為 6:1。
詳細聚合步驟以高分子 P2 為例,說明如下:
取 M2 (273.5 mg, 0.51 mmol)與 M6 (1.5 g, 4.59 mmol)置入 50 mL 雙頸瓶 中,於氮氣環境下依序注入無水 THF (25 mL)及 3M CH3MgBr (3.53 mL,
30.66 mmol) , 再 加 熱 至 60 oC 攪 拌 70 分 鐘 。 另 取 1,2-Bis(diphenyl
phosphinoethane)nickel(II) chloride (Ni(dppp)Cl2)(22.1 mg, 4.08×10
-2 mmol)均 勻分散於無水 THF (5 mL),再注入雙頸瓶中,持續於 60 oC 下迴流反應 3 天。反應結束後,將溶液緩慢滴入甲醇(200 mL)中攪拌 1 小時,過濾收集固 體再以正己烷清洗,得紫黑色固體 0.129 g,產率 8 %。 P3HT: 取 M6 (1.0 g, 3,07 mmol)、CH3MgBr (2.12 mL, 18.39 mmol)、 Ni(dppp)Cl2 (2.45×10 -2 mmol),反應步驟參照 P2,得紫黑色固體 32.09
P1: 取 M1 (0.219 g, 0.41 mmol)、M6 (1.2 g, 3.68 mmol)、CH3MgBr (2.83 mL, 24.53 mmol)、Ni(dppp)Cl2 (17.7 mg, 2.72×10 -2 mmol),反應步驟參照 P2, 得紫黑色固體 85.6 mg,產率 5 %。 P3: 取 M3 (0.228 g, 0.41 mmol)、M6 (1.2 g, 3.68 mmol)、CH3MgBr (2.83 mL, 24.53 mmol)、Ni(dppp)Cl2 (17.7 mg, 2.72×10 -2 mmol),反應步驟參照 P2, 得紫黑色固體 106 mg,產率 6 %。 O4 (寡聚物): 取 M4 (0.109 g, 0.204 mmol)、M6 (0.6 g, 1.84 mmol)、CH3MgBr (1.41 mL, 12,27 mmol)、Ni(dppp)Cl2 (8.86 mg, 1.64×10 -2 mmol),反應步 驟參照 P2,得黃色固體 0.31 g,產率 17 %。 O5 (寡聚物): 取 M5 (0.109 g, 0.204 mmol)、M6 (0.6 g, 1.84 mmol)、CH3MgBr (1.41 mL, 12,27 mmol)、Ni(dppp)Cl2 (8.86 mg, 1.64×10 -2 mmol),反應步 驟參照 P2,得紅色固體 0.395 g,產率 13 %。
NH2 O O N N S Br Br AcOH, 4h, 140 oC NH4OAc S CHO S CHO Br Br NBS DMF 1 M1 NH2 O O N N S Br Br M2 AcOH, 4h, 140 oC NH4OAc 1. H2WO4, Chlorobenzene 2. Aliquat 336, H3PO4 H2O2, 80 oC COOH COOH COOMe COOMe MeOH H2SO4 Na THF O O NH2 N N S Br Br NH4OAc, I2 EtOH 2 3 4 M3 (1) (1) (1) (4) DMSO Scheme 1. 單體 M1-M3 之合成途徑
NH2 N N S N N Br Br NH4OAc, I2 EtOH O O N N N N 1. HNO3, H2SO4 KBr, O oC M4 5 (1) (5) O2N OH Br O2N O KOH, DMSO Fe, NH4Cl EtOH, H2O 6 7 O O N N S Br Br O M5 NH4OAc, I2 EtOH (1) (7) 2. 70 oC H2N O + + + + Scheme 2. 單體 M4-M5 之合成途徑
S Br Br C6H13 1. CH3MgBr, THF 2. Ni(dppp)Cl2, THF S C6H13 P3HT n 1. CH3MgBr, THF 2. Ni(dppp)Cl2, THF S S n m M6 M6 N N N N N N N N N N N N OC8H17 M1 M2 M3 M4 M5 P1 P2 P3 O4 O5 C6H13 R = R Scheme 3. 高分子 P3HT、P1-P3 及寡聚物 O4-O5 之合成途徑
第三章 結果與討論 3-1 聚合 本研究旨在探討導入 5 種多環咪唑團基於聚噻吩的側鏈上,探討其在光 學及熱性質、元件表現上有何種影響。本研究所合成之高分子結構如 Fig. 3-1 所示: S P3HT n S S n m P1 N N S S n m P2 N N S S n m N N P3 S S n m O4 N N N N S S n m N N O5 OC8H17 Fig. 3-1 高分子 P3HT、P1-P3 及寡聚物 O4-O5 之化學結構 高分子 P3HT 及 P1-P3 之聚合結果整理於Table 1,可知 P3HT 的聚合效
平均分子量(Weight-average Molecular Weight, Mw)分別為 1.16×104 g/mol 與 2.06×104 g/mol,分子量分佈(Polydispersity Index, PDI)為 1.77,乃因為具溶 解度之正己基側鏈比例最高;而 P1-P3 之Mn為 6.3-8.0×103 g/mol,Mw為 1.07-1.40×104 g/mol,分子量均較 P3HT 為小,乃因聚合時加入剛硬之咪唑 團基單體,使得高分子產物溶解度降低,但 PDI 值仍在 2 以下(介於 1.53-1.84 之 間 ) 。 所 有 高 分 子 均 可 溶 解 於 氯 仿 (Chloroform, CHCl3) 及 氯 苯 (Chlorobenzene, CB),並藉以配置溶液以進行光學性質量測,以及製備高分 子薄膜。 由聚合經驗得知,影響 GRIM 聚合結果有:(1) CH3MgBr 的當量比:本 研究採用單體與試劑 CH3MgBr 之當量比為 1:6,相較於文獻之比例(1:1)大 許多[43],乃為了防止 CH 3MgBr 注入反應瓶的過程中,因夾雜空氣導致部分 試劑與水反應而失效,而此比例對聚合來說實屬過高;(2)反應時間與溫度: 本研究發現 CH3MgBr 加入後溫度需維持於 70 o C,且需於一小時後立即加 入 觸 媒 Ni(dppp)Cl2 才 可 成 功 聚合 ,於 常 溫 下 攪拌 並無 聚 合 效 果; (3) Ni(dppp)Cl2 的當量比:文獻指出該觸媒的角色類似於一般陰離子聚合反應 用之起始劑[44],反應的聚合度(Degree of Polymerization)正比於單體消耗量 與觸媒的比值,因此可藉由調控單體與觸媒的當量比,以合成各種分子量 之高分子產物。
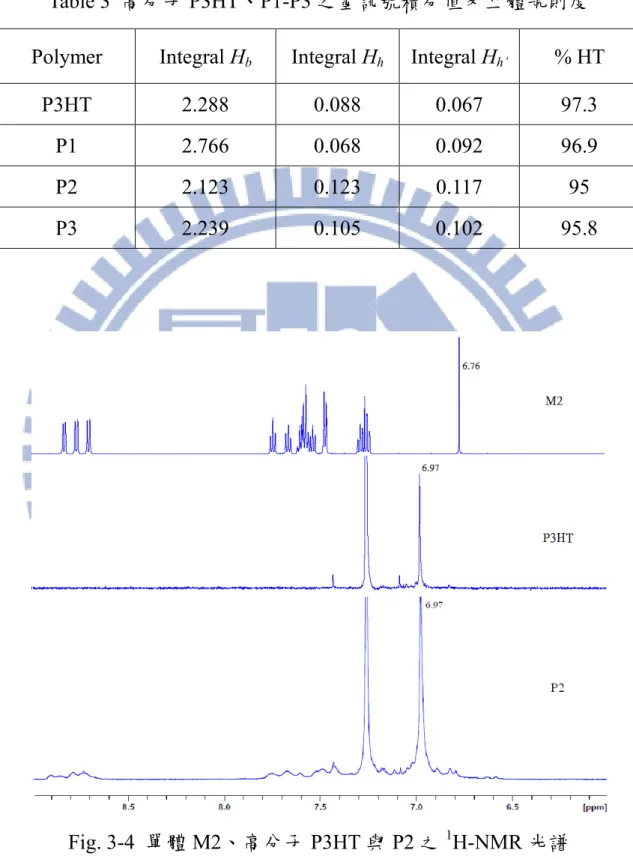
Polymer Mn×103 (g/mol) Mw×104 (g/mol) PDI P3HT 11.6 2.06 1.77 P1 6.3 1.17 1.84 P2 8.0 1.40 1.73 P3 7.0 1.07 1.53 M4、M5 分別與 M6 共聚之效果皆不佳,產物 O4 與 O5 分子量經 FAB 量測僅為 894 與 1489 g/mol,顯示均為寡聚物,推測可能結構如 Fig. 3-2 所 示。外觀為黃色與紅色固體,具有螢光性質。O4 可溶於 DMF 中,而 O5 可溶於 CHCl3、CB 及 Toluene,可配置溶液並製作有機分子薄膜。 S S S C6H13 C6H13 N N N N S C6H13 H H S S S S S N N C8H17O H H N N C8H17O C6H13 C6H13 C6H13 O4 O5 Fig. 3-2 寡聚物 O4-O5 可能結構 3-2 1H-NMR 分析 噻吩環上 4 號碳與側鏈 α 碳上的氫譜訊號位置,可用以判斷聚噻吩的立 體規則度(Regioregularity, % HT) [45,46],如 Fig 3-3 所示。
S S S n Head Tail a h a b a h' Fig. 3-3 rr-P3HT 結構圖 具有立體規則度的 rr-P3HT 於 δ=6.98 ppm (Ha)與 δ=2.8 ppm (Hb)訊號峰 強度,相較於 δ=7.0 ppm 與 δ=2.6 ppm (Hh及 Hh’皆屬於非規則排列 P3HT) 的訊號峰強度明顯許多;噻吩環上之氫在不同位置鍵結方式下之化學位移 整理於 Table 2 中。藉由各訊號峰之積分值可推算出高分子的立體規則度, 計算方法如式(7)所示: (7) Table 2 噻吩環上之氫在不同位置鍵結方式下之化學位移
Configuration Chemical shift δ (ppm) HT - HT 6.98
TT - HT 7.00 HT - HH 7.02 TT - HH 7.05
Fig. 3-4 為單體 M2、高分子 P3HT 與 P2 之氫譜,圖中顯示 P3HT 與 P2 均在 δ = 6.97 ppm 出現立體規則的噻吩環4 號氫訊號,且此訊號強度頗高, 表示所合成之聚噻吩具有高度立體規則度;此外 P2 在 δ = 6.5 ~ 9 ppm 之間 出現微弱咪唑團基的氫訊號,而原本含咪唑團基之噻吩單體 M2 之 4 號氫訊 號(δ = 6.76 ppm)經聚合後消失,顯示單體 M2 確實導入高分子主鏈中,形成 共聚物 P2。聚合物 P1 與 P3 之氫譜亦顯現相同結果。 Fig. 3-5 為高分子 P3HT 之氫譜,其側鏈 α 碳上的 Hb位於 δ = 2.803 ppm, 具有立體規則且訊號為標準三重峰分裂,符合(N+1)規則;Hh、Hh’代表不規 則排列之側鏈 α 碳上的氫訊號,分別位於 δ = 2.563、2.556 ppm,因訊號的 強度太弱,導致其分裂狀態並不明顯。針對 Hb、Hh、Hh’訊號作積分,其積 分值分別為 2.288、0.088、0.067,根據式(7)計算得其立體規則度% HT = 97.3 %,表示所聚合出之 P3HT 具高度結構規則性,亦符合 Fig. 3-4 的結果。根 據以上原則,計算所有高分子 P3HT、P1-P3 之立體規則度分別為 97.3 %、 96.9 %、95 %、95.8 %,其結果整理於 Table 3 中。歸納以上結果,本研究 所合成之高分子均能形成規則排列結構,立體規則度達 95 %以上。高分子 P1-P3 因引入巨大的咪唑團基,其立體阻礙導致高分子鏈的排列規則度相較 於 P3HT 為低。進一步比較高分子 P1-P3 的結構,聚合來源單體 M1 之側咪 唑團基帶有可自由旋轉之三苯環取代,而單體 M2 與 M3 之側團基結構則具 有平面性,立體阻礙較大,故相對應之高分子 P2 與 P3 規則度降低。
Table 3 高分子 P3HT、P1-P3 之氫訊號積分值及立體規則度 Polymer Integral Hb Integral Hh Integral Hh’ % HT
P3HT 2.288 0.088 0.067 97.3 P1 2.766 0.068 0.092 96.9 P2 2.123 0.123 0.117 95 P3 2.239 0.105 0.102 95.8
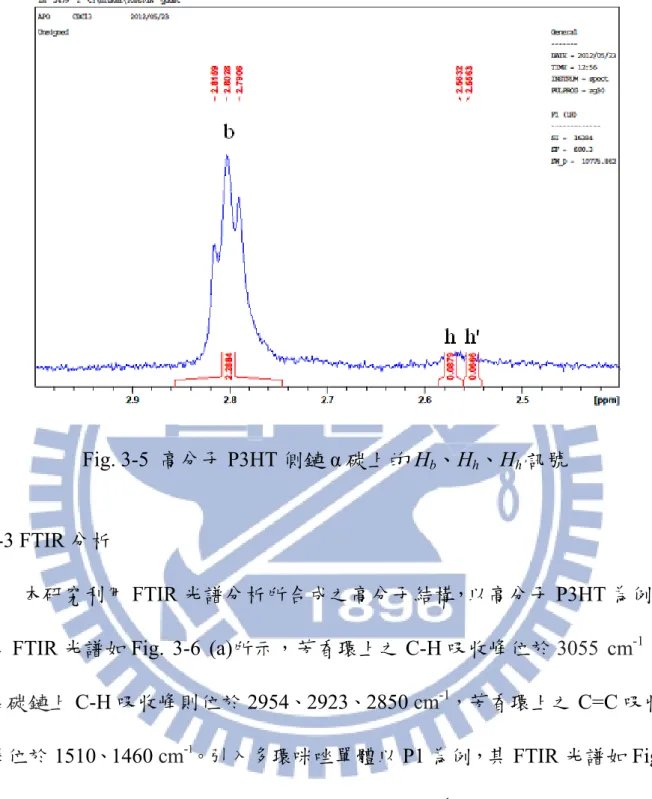
Fig. 3-5 高分子 P3HT 側鏈 α 碳上的 Hb、Hh、Hh’訊號
3-3 FTIR 分析
本研究利用 FTIR 光譜分析所合成之高分子結構,以高分子 P3HT 為例, 其 FTIR 光譜如 Fig. 3-6 (a)所示,芳香環上之 C-H 吸收峰位於3055 cm-1, 長碳鏈上C-H 吸收峰則位於 2954、2923、2850 cm-1,芳香環上之 C=C 吸收 峰位於 1510、1460 cm-1。引入多環咪唑單體以 P1 為例,其 FTIR 光譜如 Fig. 3-6 (b)所示,芳香環上之 C-H 吸收峰位於3059 cm-1,長碳鏈上 C-H 吸收峰 則位於 2955、2923、2851 cm-1,芳香環上之 C=C 吸收峰位於 1510、1456 cm-1,而咪唑團基之 C=N 吸收峰亦出現於 1660、1633 cm-1,印證多環咪唑 單體確實導入高分子主鏈中。所有高分子之特定 FTIR 訊號值列表於 Table 4
中,其中 P3HT 之 FTIR 訊號與文獻報導之數值接近[47]。 4000 3000 2000 1000 50 60 70 80 90 100 T ra n s m it ta n c e ( % ) Wavenumber (cm-1) Ar C-H C-H Ar C=C (a) 4000 3000 2000 1000 60 70 80 90 100 T ra n s m it ta n c e ( % ) Wavenumber (cm-1) Ar C-H C-H C=N Ar C=C (b)
Table 4 高分子 P3HT、P1-P3 之 FTIR 訊號 Polymer Ar C-H Aliphatic C-H Ar C=C -CH3 Ar C=N P3HT 3055 2954, 2923, 2850 1510, 1460 1384 N/A P1 3059 2955, 2923, 2851 1510, 1456 1384 1660, 1633 P2 3056 2955, 2922, 2853 1529, 1440 1385 1659, 1635 P3 3055 2957, 2922, 2852 1510, 1467 1384 1663, 1632 3-4 熱性質分析 本研究利用 TGA 及 DSC 探討所有材料之熱性質。Fig. 3-7 為高分子 P3HT、P1-P3 之 TGA 曲線圖,約在 150 oC 有些許重量損失,可能是末端溴 原子或寡聚物裂解所造成[48];升溫至 300 o C 之後高分子主鏈開始斷裂,分 析圖譜得知 P3HT、P1-P3 的熱裂解溫度(Td)分別為 367、318、334 與 333 o C, 其中 P3HT 的分子量最高,故有較高的 Td,文獻亦指出若分子量達 15000 g/mol 以上,則 Td可達 456 o C [49];而高分子 P1 的 Td最低,也可歸因於較 低的分子量,至於高分子 P2 與 P3 則介於上述兩者之間。一般而言,高分 子的分子量愈大,則熱穩定性愈佳。再比較各材料升溫至 550 o C 時的殘留 重量比率,P3HT 之殘留值最低,為 43 %;P1-P3 則分別為 53 %、49 %、 71%,顯示引入了剛硬咪唑團基確實可增強材料的熱穩定性。此外,寡聚 物 O4-O5 的 Td僅為 224、240 o C,升溫至 600 oC 時尚有 42 %與 55%之殘留 重量比率,甚至高於 P3HT 的殘留值。所有材料之 Td整理於 Table 5 中。
在 DSC 量測方面,所有材料皆無法測得玻璃轉換溫度(Tg),推測原因為 聚噻吩主鏈間的平面堆疊性(π-π Stacking)高,使得材料具半晶或結晶型態, 難以產生主鏈的自由擾動型態[50,51],因此 T g較不明顯。相對來說,熔點(Tm) 的量測較為容易,Fig. 3-8 顯示高分子 P1 之 DSC 曲線圖,其 Tm出現在 153 o C 附近,其餘材料之 Tm亦列表於 Table 5 中。本研究雖無法量測得到 P3HT 之 Tm,然而參考文獻得知一般 P3HT 之 Tm在 230 o C 左右[52],相較之下高 分子 P1-P3 之 Tm在 150~153 o C 之間,顯然引入咪唑團基後降低材料之 Tm, 乃由於共聚物高分子鏈結構較為散亂與較低的規則度,導致分子間作用力 減弱,Tm因此而降低。 100 200 300 400 500 40 60 80 100 W e ig h t R e s id u e ( % ) Temperature (oC) P3HT P1 P2 P3 Fig. 3-7 高分子 P3HT、P1-P3 之 TGA 曲線圖
Table 5 高分子 P3HT、P1-P3 與寡聚物 O4-O5 之熱性質 Material Td ( o C) Tg ( o C) Tm ( o C) P3HT 367 N/A P1 318 153 P2 334 150 P3 333 152 O4 224 N/A O5 240 N/A N/A 130 140 150 160 170 -600 -300 0 300 H e a t F lo w ( u W ) Temperature (oC) T m = 153 o C Fig 3-8. 高分子 P1 之 DSC 曲線圖
3-5 光學性質分析 3-5-1 吸收光譜分析 Fig. 3-9 為高分子 P3HT、P1-P3 溶液態之吸收光譜,溶劑為 CB 時最大 吸收峰位於 450~452 nm,所有高分子相比較並無特別明顯之位移,顯示咪 唑團基在 CB 中對吸收光譜無明顯影響。當溶劑為 CHCl3時最大吸收峰藍 位移至 445 nm,高分子 P1 之最大吸收峰甚至位移至 437 nm,乃因這些高 分子對 CHCl3的溶解度較高,溶劑分子包圍高分子主鏈防止鏈堆疊的發生, 因此產生藍位移現象;再者 P1 的分子量最低,暗示其共軛長度在四者之中 為最短,故其溶液態之吸收峰最為藍位移。
300 400 500 600 700 0.0 0.2 0.4 0.6 0.8 1.0 A b s o rb a n c e ( a .u .) Wavelength (nm) P3HT P1 P2 P3 452 (a) 300 400 500 600 700 0.0 0.2 0.4 0.6 0.8 1.0 A b s o rb a n c e ( a .u .) Wavelength (nm) P3HT P1 P2 P3 445 437 (b) Fig. 3-9 高分子 P3HT 及 P1-P3 溶液態之吸收光譜(a) in CB (b) in CHCl3
Fig. 3-10 為高分子 P3HT、P1-P3 薄膜態之吸收光譜,P3HT 的最大吸收 峰位於 556 nm,為高分子主鏈之 π-π* Transition,而肩峰 604 nm 則為高分 子鏈之間的堆疊所產生[53],立體規則度越高,此肩峰的形狀與強度越明顯。 高分子 P1-P3 的最大吸收峰皆位於 508 nm,相較於 P3HT 產生很大的藍位 移(49 nm),顯示其共軛長度均縮短,推測原因為側取代之咪唑團基屬於拉 電子基,π 電子雲密度高,拉走部分主鏈上的 π 電子,因此減少主鏈的共軛 長度。從該吸收光譜進一步發現,P1-P3 在 556 nm 附近皆出現類似 P3HT 主鏈的吸收肩峰,代表規則聚噻吩鏈段的存在,而且 604 nm 附近之肩峰亦 相當明顯,可見引入較巨大的咪唑團基不致於影響主鏈間的堆疊。當然 P3HT 具有立體規則度最高之主鏈結構,其肩峰之吸收度最高且峰型最為明 顯[54]。另外觀察到 P1-P3 的半高寬(Full Width at Half Maximum, FWHM)皆
大於 P3HT,表示吸光範圍更廣,有助於太陽能元件之應用。 本研究同時由薄膜態吸收譜線右端之起始值,計算出高分子之 Eg,其 計算方式如式(8)所示: Eg (eV) = 1240 λonset (nm) (8) 經計算得 P3HT、P1-P3 之 Eg分別為 1.91、1.90、1.92 與 1.86 eV,其中
300 400 500 600 700 0.0 0.2 0.4 0.6 0.8 1.0 A b s o rb a n c e ( a .u .) Wavelength (nm) P3HT P1 P2 P3 556 508 604 Fig. 3-10 高分子 P3HT 及 P1-P3 薄膜態之吸收光譜 在寡聚物的光學性質方面,Fig. 3-11 (a)為寡聚物 O4 與單體 M4 於溶液 態之吸收光譜,溶劑為 DMF,可發現形成寡聚物 O4 後,其吸收曲線之 FWHM 明顯增加,最大吸收峰值為 288 nm。一般來說單體的共軛長度較短, 聚合後因共軛長度增加常導致紅位移,然而本研究卻發現 O4 其最大吸收峰 相較於單體產生藍位移;由於實驗過程中,吾人觀察到相同濃度條件下, 單體 M4 於 DMF 中溶解度較低,推測其易於形成堆疊,導致最大吸收峰產 生紅位移至 294 nm。Fig. 3-11 (b)為寡聚物 O5 與單體 M5、M6 於溶液態之 吸收光譜,溶劑為 CB,明顯發現形成寡聚物 O5 後,吸收範圍擴大為 280~600 nm,吸收峰 296 與 362 nm 分別來自於單體 M6 與 M5,而最右端 473 nm 吸
收峰代表整個寡聚物之吸收。 250 300 350 400 450 500 550 0.0 0.2 0.4 0.6 0.8 1.0 A b s o rb a n c e ( a .u .) Wavelength (nm) O4 M4 288 296 (a) 300 400 500 600 700 0.0 0.2 0.4 0.6 0.8 1.0 A b s o rb a n c e ( a .u .) Wavelength (nm) O5 M6 M5 296 362 473 350 (b)
Fig. 3-11 寡聚物溶液態之吸收光譜(a) O4、M4 於 DMF 中 (b)O5、M5、M6 於 CB 中
Fig. 3-12 為寡聚物 O4、O5 薄膜態之吸收光譜,O4 最大吸收峰位於 309 nm,相較於溶液態產生 18 nm 的紅位移,乃因堆疊造成能量轉移,O5 的最大吸收峰亦紅位移至 309 nm,肩峰 364 nm、474 nm 相較於溶液態時僅 有些微的紅位移現象,顯示單體 M5 上之咪唑團基接上烷氧基後,形成更大 的立體阻礙,整個分子處於薄膜態下之共軛性與溶液態相差無幾。 300 400 500 600 700 0.0 0.2 0.4 0.6 0.8 1.0 A b s o rb a n ce ( a .u .) Wavelength (nm) O4 O5 309 364 474 Fig. 3-12 寡聚物 O4 與 O5 於薄膜態之吸收光譜 3-5-2 螢光光譜分析 Fig. 3-13 為高分子 P3HT、P1-P3 溶液態之螢光放射光譜,溶劑為 CB 時 最大吸收峰位於 579 nm,所有高分子相比較並無特別明顯之位移,顯示咪 唑團基在 CB 中對螢光放射光譜無明顯影響;以 CHCl3作為溶劑時,P3HT 之螢光性質並無太大變化,然而高分子 P1-P3 之螢光最大放射峰卻紅位移

![Fig. 1-3 塊狀異質接面結構 1-2-3 特性分析 1-2-3-1 等效電路 (Equivalent circuit) Fig. 1-4 為太陽能電池等效電路圖 [2] ,V 為外部提供電壓,J ph 為光電流 密度,串聯電阻與並聯電阻分別存在實際元件中,串聯電阻(Series Resistance, R s )是載子傳遞至電極之間的阻抗,並聯電阻(Parallel Resistance, R p )為材料接 面接觸的阻抗,接面越密合則 R p 越大,理想狀況為無窮大。](https://thumb-ap.123doks.com/thumbv2/9libinfo/8362288.176911/20.892.131.802.113.1112/Fig與並聯電阻分別存在實際元件中串聯電阻SeriesR是載子傳遞極之間.webp)