生物感應器BIAcore X在生物醫學上之應用; The application of the biosensor, BIAcore X, in biomedical research
73
0
0
全文
(2) 輔脢 B12 類似物之結合測試,從其分子的層次,了解此酵素與輔脢 B12 結合之反應機制。 以上實驗結果,充分說明了 BIA 的 SPR 技術,可廣泛的應用於各項生 化分析。. 2.
(3) Abstract. The objective of our research is to analyze the biomolecular interaction between protein and its binding partners by BIAcore X instrument using surface plasmon resonance (SPR). SPR detection does not require any label and can monitor interaction between the target protein and its binding partners. We have applied this technology to three experiments in our collaborative research projects. The first experiment is to screen potential peptide inhibitors to the MAT complex. Our experimental design detects interaction between peptide derivatives and MAT enzyme complex by BIAcore X, and then confirm the inhibitory effect of potential compounds by conventional radiolabeled method. The second experiment is to detect the peptide inhibitor of the Grb2 SH2 domain. Peptides were synthesized manually by standard solid phase peptide synthesis method using FastMoc chemistry. The inhibitory effect of these designed peptide analogs were assayed by SPR detection. Finally, in the third experiment, the interaction between cobalamin-binding domain, glutamate mutase S component, and coenzyme B12 was investigated. With the use of coenzyme B12 analogue, adenosylcobinamide (AdoCbi) and mutants of glutamate mutase S component, the result obtained from BIAcore analysis were helpful to understand the mechanism of the binding of cobalamin to proteins on a molecule level. Results of these studies demonstrated that SPR technology is powerful for research work in Biochemistry, Molecular biology, Medicinal chemistry…etc fields.. 3.
(4) 目錄. 頁數. 中文摘要 … … … … … … … … … … … … … … … … … … … … … … … … … 1 英文摘要 … … … … … … … … … … … … … … … … … … … … … … … … … 3 目錄 … … … … … … … … … … … … … … … … … … … … … … … … … … … 4 表目錄 … … … … … … … … … … … … … … … … … … … … … … … … … … 6 圖目錄 … … … … … … … … … … … … … … … … … … … … … … … … … … 7 第一章 生物感應器-BIAcore X 之原理與其應用……………………...8 第一節 前言 … … … … … … … … … … … … … … … … … … … … … … … … … … . .8 1-1 生物分子之間交互作用的技術 … … … … … … … … … … … … … … … ..8 1-2 即時系統 BIA 的優點 … … … … … … … … … … … … … … … … … … … . .9 第二節 BIA 之光學原理-表面薄膜共振技術(SPR)… … … … … … … … … … 10 第三節 BIAcore 之基本組成 … … … … … … … … … … … … … … … … … … … ..12 3-1 感應晶片表面系統 … … … … … … … … … … … … … … … … … … … … 1 3 3-1-1 鍵合物的選擇 … … … … … … … … … … … … … … … … … … … … .14 3-1-2 感應晶片 … … … … … … … … … … … … … … … … … … … … … … .14 3-2 SPR 光學系統 … … … … … … … … … … … … … … … … … … … … … … 1 7 3-3 液體傳送系統 … … … … … … … … … … … … … … … … … … … … … … 1 7 第四節 典型感應圖(sensorgram)之介紹 … … … … … … … … … … … … … … ...18 第五節 BIA 之應用……………………………………………………………20. 第二章 BIA 應用於癌細胞酵素-MAT 抑制活性之篩選……………..21 第一節 研究動機與目的………………………………………………………21 第二節 實驗儀器與材料………………………………………………………22 2-1 儀器 … … … … … … … … … … … … … … … … … … … … … … … … … … 2 2 2-2 材料與試劑 … … … … … … … … … … … … … … … … … … … … … … … 2 2 第三節 MAT 抑制活性測試實驗設計一 … … … … … … … … … … … … … … . ..23 3-1 實驗方法 … … … … … … … … … … … … … … … … … … … … … … … … 2 3 3-1-1 感應晶片與標的化合物(HP1,HP2)間結合反應測試 … … … … ...23 3-2 實驗結果與討論 … … … … … … … … … … … … … … … … … … … … … 2 4 第四節 MAT 抑制活性測試實驗設計二 … … … … … … … … … … … … … … ...25 4-1 實驗方法 … … … … … … … … … … … … … … … … … … … … … … … … 2 5 4.
(5) 4-1-1 固定有 Met 之感應晶片之製備 … … … … … … … … … … … … … 2 5 4-1-2 固定有 Met 之感應晶片與 Met,標的化合物(HP1~HP6)結合反應 測試 … … … … … … … … … … … … … … … … … … … … … … … … 2 6 4- 2 實驗結果與討論 … … … … … … … … … … … … … … … … … … . 2 7. 第三章 BIA 應用於 Grb2SH2 domain 抑制物之篩選 … … … … … … … … 3 4 第一節 研究動機與目的 … … … … … … … … … … … … … … … … … … … … ...34 第二節 胜月太衍生物之設計 … … … … … … … … … … … … … … … … … … … . ..35 第三節 實驗原理 … … … … … … … … … … … … … … … … … … … … … … … … 3 7 第四節 實驗儀器,材料與方法 … … … … … … … … … … … … … … … … … … . ..38 4-1 儀器 … … … … … … … … … … … … … … … … … … … … … … … … … … 3 8 4-2 材料與試劑 … … … … … … … … … … … … … … … … … … … … … … … 3 8 4-3 實驗方法 … … … … … … … … … … … … … … … … … … … … … … … … 3 9 4-3-1 固定有 Biotin SHC-pY之感應晶片製備 … … … … … … … … … ...39 4-3-2 固定有 Biotin SHC-pY 之感應晶片與胜月太衍生物間結何反應 39 第五節 實驗結果與討論 … … … … … … … … … … … … … … … … … … … … … 4 0. 第四章 BIA 應用於 Glutamate mutase 之 MutS 次單元與輔脢 B12 間交 互作用之探討…………………………………………………..45 第一節 研究動機與目的………………………………………………………45 第二節 MutS 及 MutS 變異蛋白的生產與純化 … … … … … … … … … … … … . 47 2-1 儀器 … … … … … … … … … … … … … … … … … … … … … … … … … … 4 7 2-2 材料與試劑 … … … … … … … … … … … … … … … … … … … … … … … 4 7 2-3 實驗方法 … … … … … … … … … … … … … … … … … … … … … … … … 4 8 第三節 以 BIA 的技術偵測 MutS 及 MutS 變異蛋白與 AdoCbl 及 AdoCbi 間 結合反應之研究 … … … … … … … … … … … … … … … … … … … … … … 5 2 3-1 儀器 … … … … … … … … … … … … … … … … … … … … … … … … … … 5 2 3-2 材料 … … … … … … … … … … … … … … … … … … … … … … … … … … 5 2 3-3 實驗方法 … … … … … … … … … … … … … … … … … … … … … … … … 5 3 3-3-1 將 MutS 固定於感應晶片 CM5… … … … … … … … … … … … … . 53 3-3-2 MutS 與 AdoCb1 之結合反應測試 … … … … … … … … … … … . .53 3-3-3 MutS 與 AdoCbi之結合反應測試 … … … … … … … … … … … ...54 3-3-4 MutS 變異蛋白與 AdoCbi之結合反應測試 … … … … … … … . .54 第四節 實驗結果與討論 … … … … … … … … … … … … … … … … … … … … . ..55. 第五章 結論………………………………………………………………………66 參考文獻 … … … … … … … … … … … … … … … … … … … … … … … … . . . 67 5.
(6) 表目錄. 頁數. 表 2-1 HP1 不同濃度與 MAT、Met、ATP 混合後注入感應晶片表面 之反應結果 … … … … … … … … … … … … … … … … … … … … … … … … … ..29 表 2-2 HP2 不同濃度與 MAT、Met、ATP 混合後注入感應晶片表面 之反應結果 … … … … … … … … … … … … … … … … … … … … … … … … … ..29 表 2-3 Met 不同濃度與 MAT、ATP 混合後注入 Met 之感應晶片之反 應結果 … … … … … … … … … … … … … … … … … … … … … … … … … … .30 表 2-4 不同反應物 HP1~HP6 與癌細胞酵素 MAT、ATP 混合後注入 Met 之感應晶片之反應結果 … … … … . . … … … … … … … … … … … … 3 0 表 3-1 Grb2SH2 與胜月太抑制物 E-Y-Aib-N 之結合反應測試結果 … … … … … ..42 表 3-2 Grb2SH2 與胜月太抑制物 E-pY-Aib-N 之結合反應測試結果 … … … … … 4 2 表 4-1 MutS 與 AdoCbl、AdoCbi 結合反應之測試結果 … … … … … … … … … ..58 表 4-1 MutS、MutS 變異蛋白與 AdoCbi 分別在 pH 7.0 以及 pH 8.5 結合反應之測試果 … … … … … … … … … … … … … … … … … … … … … ..58. 6.
(7) 圖目錄. 頁數. 圖 1-1 SPR 之光學原理……………………………………………………………..11 圖 1-2 BIAcore X 三大主要系統 … … … … … … … … … … … … … … … … … … … … .12 圖 1-3 感應晶片解剖圖 … … … … … … … … … … … … … … … … … … … … … … … . 13 圖 1-4 典型 BIA 感應圖 … … … … … … … … … … … … … … … … … … … … … … … . 19 圖 1-5 Bulk effect 圖示 … … … … … … … … … … … … … … … … … … … … … … … … 1 9 圖 2-1 Met 固定於 CM5 感應晶片之感應圖 … … … … … … … … … … … … … … … 3 1 圖 2-2 固定有 Met 之感應晶片與不同濃度之 Met 作用結果 … … … … … … … … ..32 圖 2-3 固定有 Met 之感應晶片與不同濃度之 HP1 作用結果 … … … … … … … … .33 圖 3-1 SHC-pY 固定於 SA 感應晶片之感應圖 … … … … … … … … … … … … … … 4 3 圖 3-2 Grb2SH2 與不同濃度之胜月太抑制物之結合反應 … … … … … … … … … … 4 4 圖 4-1 維生素 B12 -AdoCbl與維生素 B12 類似物-AdoCbi之結構圖 … … … … … … 5 9 圖 4-2 glutamate mutase 之結構圖 … … … … … … … … … … … … … … … … … … ...60 圖 4-3 離子交換之結果,以 MutS 為例 … … … … … … … … … … … … … … … … ..61 圖 4-4 膠體過濾之結果,以 MutS 為例 … … … … … … … … … … … … … … … … ..61 圖 4-5 MutS 蛋白質純化。SDS-PAGE 之圖示 … … … … … … … … … … … … … … 6 2 圖 4-6 MutS 固定於感應晶片 CM5 之感應圖 … … … … … … … … … … … … … … .63 圖 4-7 MutS 蛋白質與不同濃度 AdoCb1 之結合反應 … … … … … … … … … … … 6 4 圖 4-8 MutS 蛋白質與不同濃度 AdoCbi 之結合反應 … . … … … … … … … … … … 6 4 圖 4-9 MutS-H16G蛋白質與不同濃度 AdoCbi之結合反應(pH 7.0) … … … ..65 圖 4-10 MutS-D14N 蛋白質與不同濃度 AdoCbi之結合反應( pH 7.0). … … … ..65 圖 4-11 MutS-D14A蛋白質與不同濃度 AdoCbi 之結合反應( pH 7.0). … … . . … 65. 7.
(8) 第一章 生物感應器-BIAcore X 之原理與其應用. 第一節 前言 生物感應器-BIAcore X 為探測分子間相互作用之系統儀器,主要 的特色就是運用表面薄膜共振技術(1~7)(Surface Plasmon Resonance, SPR) ,在不需要任何標定物的真實狀態下,可以對於 10-6 g/ml 到 10-11 g/ml 低濃度下的任何兩種生物分子間之相互結合,解離的情形進行 即時(8)之偵測。. 1 - 1 生物分子之間相互作用的分析 生物感應器即是作為辨識特定反應之用的儀器。即時感應生物分 子間相互作用(Biomolecular Interaction Analysis, BIA),其偵 測原理基本建立在 SPR 的技術上(2),利用光線反線及入設量能之差異 性測量生物在感應晶片表面上質量濃度的變化。當無任何標示物時所 顯示之基本量能與反應於生物分子的相互分析作用時顯示之量能其 差異性遵行一個可量化之標準的規範。目前應用的範圍很廣,包括: 生化上的基本研究(9)、生物分子應用於藥物的設計研發(10)、蛋白質 之間的相互作用(11’12)、親合力(13)以及濃度的測量(14),便於篩選使用 者追求物質間之效應。. 8.
(9) 1 - 2 即時系統 B I A 的優點 BIAcore X 為一半自動生物感測系統,符合樣品數量大、分析快 速、精準的研究需求。它有著以下幾個優點: 即時監測(8);也就是立即顯示反應分子結合和解離的情形,另外 追尋它們之間發生的相互作用,對於引導實驗條件的建立是很有用 不需任何標定物的分析方法(15);BIAcore X 利用 SPR 的光學原理, 直接偵測反應表面上生物分子因相互作用而結合、解離所導致的質量 改變,不需先做分子純化及標定的繁雜過程。 自訂的生物特異性反應表面(16);因為具備多種的反應片,可以針 對反應分子的種類選擇適當的感應片,在利用系統內建立的表面固定 程序,制定出具有生物特異性的結合表面。 超微量樣品需求(17);BIAcore X 利用獨特設計的超微量液體匯流 卡匣(Integrated Fluidic Cartridge, IFC),所需的樣品體積極少, 同時由電腦控制能精確的控制反應的接觸時間與流速。 快速分析(17);即時的分析相互作用,一般分析的時間為 2~10 分 鐘即可,晶片表面的再生也是同樣的快速。. 9.
(10) 第二節. B I A 之光學原理- 表面薄膜共振技術 (Surface Plasmon Resonance technology). BIAcore X 的測定原理所運用的是表面薄膜共振技術(1~7),係為一 種光學現象。當光束於玻璃稜鏡內傳導時,在整個光束傳導路徑上遇 到金屬箔層界面時會有全反射的發生,但是其能量並非全部侷限在金 屬箔層介質內,此時一種稱為漸逝波(evanescent wave)的電磁場會 以垂直於光纖軸心的方向,將部分能量傳遞進入非照射端的介質中, 穿過距離大約 1 個波長左右。當非照射面因介質組成、濃度或成分改 變時而導致折射係數有變化的情況下,會藉由漸逝波的光動能變化反 應到共振角度的變化上,而共振角的產生是由於光束的電子振盪與金 屬箔層內金屬原子產生共振作用時,在特定的反射角範圍內會引起反 射強度的急遽變化,SPR 一詞因此而得,而此反射角又稱為共振角 (resonance angle) 。使用漸逝波的好處在於光穿透深度只及於表面 附近,即產生訊號的光線並未穿過全部檢體溶液,由於試劑僅圍著於 光學感測器表面,生化反應亦只需在此表面進行,檢體溶液遠離光線 的部分並沒有發生反應,因此可避免大部分溶液(bulk)之訊號。與金 屬面鄰接的介質部分之有效回應距離約距金屬表面 300 nm 左右,又 由於折射係數值隨該有效距離內之溶液的濃度而改變,因此 SPR 技術 可以用來定量靠近感測面表面之待測物濃度,而不需預先做任何的標. 10.
(11) 示(labelling)。 影響 SPR 的共振角度變化的原因最主要是由於非照射面,即反應 層介質的折射係數的不同,在即時系統的 BIA 中,介質的反射係數 又隨著其溶液的濃度而發生變化。反應作用發生時電子吸收能量,導 致在特定的反射角範圍內,反射強度急劇驟減,達到最小。這種最小 化發生時的共振角度(圖 1-1-A)隨著非照射面金屬箔層鄰近介質的 折射係數(refractive index)之不同而有所變化(圖 1-1-B),因此, 當環境介質因組成、濃度或組成改變時,例如,待測物結合到感應晶 片上之配體時,所導致的折射係數變化則可以藉由共振角度位移變化 偵測出。所得的曲線為感應曲線圖。(圖 1-1-C) Reflected intensity Light source. Detection unit Prism. A. Polarized light. Reflected light. Sensor chip Angle Flow cell Reflected intensity. B. Angle. Resonance signal (RU). C. Time (S). 圖 1-1 SPR 之光學原理 11.
(12) 第三節 B I A 儀器之基本組成 BIAcore X 是一種以親和性(affinity)為主體的生物感應器(19), 利用固定化的方式,選擇具有生物特異性的鍵合物(ligand)以共價結 合的方式結合在感應晶片聚葡萄糖間質(dextran)的表面上,靠著系 統流體的循環下,以控制流速將待測物注射到感應表面。當分析物與 鍵合物有相互作用發生時,形成表面質量濃度的改變,進而影響入射 光線折射率的變化,而 SPR 的光學反應也即時感應,並且表現於感應 圖(sensorgram)上,上述這些反應必須依賴著 BIAcore X 三大主要的 基本系統(18)(圖 1-2 所示)之運作:1.感應晶片表面系統 2.SPR 之光 學系統 3.液體傳送之微射流系統,茲分述如後:. SPR deyection system. Microfluidic system Gold-dextran surfaces. 圖 1-2 BIAcore X 三大主要系統. 12.
(13) 3 - 1 感應晶片表面系統 感應晶片是即時 BIA 訊號的傳遞者,其構造大概可以分為四個主 要部分(11),包括玻璃稜鏡層(glass prism layer)、金箔層(glod film layer)、連接層(linker layer)和專一感應層(specific layer)。(如 圖 1-3 所示). Specufic layer Linker layer Glod film layer Glass layer. 圖 1-3 感應晶片解剖圖. 選擇金箔的原因是在於活潑性低之化學特性和良好的 SPR 反應組 合。另外專一反應層則提供四個主要功能: i. ii. iii. iv.. 可以固定具有生物特異性的鍵合物 藉由表面結合的能力增加敏感性 提供親水環境,適合於大多數生物反應時的相互作用 有著專一性的結合能力. 當感應晶片的非照射面與溶液接觸後開始相互作用,透過 SPR 的. 13.
(14) 運作來偵測生物分子在晶片表面的濃度變化。 實驗的成功與否和選擇適合的鍵合物(ligand)以及該物與感應晶 片固定程度有很大的相關性。. 3-1-1 鍵合物的選擇 鍵合物之選擇應注意下列條件,1.專一性(specificity) :專一 性高的鍵合物對於溶液中眾多的分子具有篩選的功能。2.再生的穩定 性(regeneration stability) (19):反應作用完成後,需將分析物去 除,以備另一樣品做另一測試循環,鍵合物需有穩定之再生性繼續保 持本身原來的活性。3 純度(purity):減少發生非專一性的結合 (non-specificity binding) 。4.大小(size) :鍵合物的感應圖反 應與本身的質量成正比,鍵合物較大時,敏銳度差,會降低 RU 值可 靠性。. 3-1-2 感應晶片 (sensor chip) 除了鍵合物外,需選擇適當的感應晶片,不同的感應晶片表面適 合不同的目的,亦有不同之固定模式。本研究中使用了兩種感應晶 片:CM5 chip、SA chip:. 14.
(15) C M 5 感應晶片 CM5 chip 是 研 究 所 廣 泛 應 用 的 晶 片 , 其 專 一 反 應 層 是 由 carboxymethyl dextran 所組成,提供了相當好的親水性環境,再根 據 鍵 合 物 性 質 和研 究 要 求 , 可 選 擇 不 同 的 化 學 方 法 進 行 偶 聯 (coupling)。在固定的方式上,多以胺類偶合法(amino coupling) (20). 被利用的最多,尤其在蛋白質的應用方面(21),因為大部分的蛋白. 質 都 少 不 了 有 胺 類 的 官 能 基 。 首 先 利 用 0.05 M NHS (N-hydroxysuccinimide) / 0.2 M EDC(N-ethyl-N-(dimethylaminopropyl) carbodiimide hydrochloride)活化晶片表面,當感應晶片表面活化後 接下來就是固定化的步驟,胺類偶合法是利用胺基的氮原子未配位電 子進行所謂的親核性取代反應。使用胺類偶合法有幾個變數要注意 的:pH 值、鍵合物的濃度、反應時間,若鍵合物是酸性蛋白質,則 氮原子質子化的結果會降低結合時的效率;如果被固定的胺基剛好是 鍵合物的活性區(active site),則會導致整個作用反應的降低。 在本研究中,是以此種感應晶片用於實驗一與實驗三,偵測標的 物(target compound)和蛋白質與輔脢 B12 之間的相互作用。. 15.
(16) S A 感應晶片 SA chip 表面是由一層類似卵白素(avidin)的蛋白質-鍊霉菌卵 白素所構成(streptavidin),做為捕捉分子之用。而這種晶片通常 只用來固定有生物素修飾的鍵合物(22)(biotinylated ligand) ,因為 鍊霉菌卵白素與生物素(biotin)之間有相當好的親合性與專一性, 但它們之間雖然結合相當緊密,但並非以共價鍵結合的方式鍵合在一 起。 在使用 SA chip 之前,必須先將鍵合物經過生物素的修飾,形成 生物素修飾鍵合物,才能繼續進行後續的固定化反應與分析的工作。 當生物素鍵合物以一端固定於 SA chip 後,其它部分將以動態的方式 懸浮於晶片表面,可增加分析物與鍵合物的結合敏感度,有助於分析。 在本研究中,實驗二以此種感應晶片來偵測 Grb2 SH2 的胜月太 衍 生物之抑制效力。. 16.
(17) 3 - 2 S P R 光學系統 BIAcore 的光線來源是一個波長接近紅外線光的兩極真空管發射 出來,以一定入射角的楔形(wedge-shaped) 光束直射焦點落於感應 晶片上。當監測到 SPR 的反應時,電腦內附的程式軟體會自動的計算 角度,也就是共振角度,其原理已在本章第二節中做了詳細的描述。. 3 - 3 液體傳送系統 液體傳送系統 ( 18 ) 具有精確的幫浦與微射流卡匣(integrated fluidic cartridge)簡稱 IFC。預分析之樣品是以人工的方式注射進 入,並滯留在一標準的微射流盤的 sample loop 內,溫度控制在一定 範圍後,機器軟體即自動式控制 IFC 的瓣膜閥,使液體流動經過管路 到達感應晶片的表面。IFC 的表面有精密正確的凹槽,藉由機器的幫 助使它與感應晶片的流路(Flow cell,Fc)接觸,Fc 是被設計只需少 量的樣品傳送於感應晶片的表面。IFC 和辦膜的操作可以很快的改變 樣品與緩衝液交替於感應晶片表面和有能力去控制樣品接觸於表面 時間的正確性與再生性。. 17.
(18) 第四節 典型感應圖( s e n s o r g r a m ). (2). 之說明. BIA 的感應圖是 SPR 共振角度回應的訊息,連續對時間作圖而得。 其縱軸單位為 SPR 回應的訊號,為量測共振角度的變化所獲得之度量 單位,稱之為共振單位(resonance unit,RU);橫軸為時間,以秒為 單位(s)。 感應圖可即時的紀錄流動狀態下的標的物(analyte)與感 應晶片(sensor chip)上的固相鍵合物整個結合、解離的完整過程, 如圖 1-4 所示。 在開始的狀態,感應晶片表面已固定有某一鍵合物的存在,但並 未與任何待測物反應,故在緩衝溶液(buffer)下,感應圖形顯示平緩面 而無變化狀態,亦即在 t=0~100 秒時,RU 值是維持在基礎的狀態; 在 t=100~350 秒,開始注入待測分子,而待測分子與表面鍵合物結合 後 RU 值隨著兩者的結合而急劇上升,當曲線上升到一穩定狀態即表 示表面鍵合物接受分子的結合已趨於飽和,因此可以研究即時的結合 反應;其後在 t=350~430 秒,整個待測物注射結束後,系統會自動切 換至緩衝溶液的流動狀態,此時感應圖上 RU 值下降是表示整個結合 分子已由溶液沖洗,因此可以研究即時解離反應之過程;在 t=430~520 秒,注入解離劑,解離劑會在不影響表面鍵合物活性的情況下,完全 而快速移除感應晶片表面上與鍵合物作用的結合物:而 t=520 秒以後 是經過解離劑作用後的感應晶片,反應恢復於緩衝溶液中,RU 值也. 18.
(19) 回到起始平衡狀態,即表示感應晶片可以進入另一循環樣品分析的開 始。. Resonance signal ( kRU ). Association Dissociation. Kinetic Regeneration. Concentration. 圖 1-4 典型 BIA 感應圖. 另外在整個反應的開始與結束時常伴隨著一個溶液背景值不同 造成之影響特稱為 Bulk effect(23)(如圖 1-5),這樣 Bulk effect 的產生 是由於系統從緩衝溶液狀態轉換至待測物注射反應時,因為整個晶片 表面溶液的突然變換而發生的瞬間變化,故實驗時應入考慮。. 圖 1-5 Bulk effect 圖示. 19.
(20) 第五節 B I A 之應用 BIAcore 是用來探討分子之間相互作用的感應器,BIA 的技術可 在無標記的條件下快速的從樣品中將適用之分子鑑定出來,因此可以 廣泛運用於藥物的篩選作用、細胞訊息傳遞上的抑制效應、以及分子 結構及功能的關聯性分析等等,總之,在生物分子研究領域中,BIA 技術運用於篩選,分析已成為極佳之利器。 本研究對於 BIA 應用於不同試驗之實驗設計與結果,分別詳述於 第二、三、四章。. 20.
(21) 第二章 BIA 應用於癌細胞酵素-MAT 抑制活性之篩選. 第一節 研究動機與目的 MAT(Methionine adenosyl transferase)具有生物催化的功能, 會幫助 Met(Methionine, 甲硫胺酸)和 ATP 形成 SAM(S-adenosyl methionine)(24~26)。SAM 在細胞內具有甲基化的功能,進行核酸甲基 化。甲基化的異常與許多疾病有關 (27~28),尤其與癌症的關係最為密 切。由於 MAT 複合物之異常與癌症有密切關係,因此抑制異常 MAT 複 合物或許能提供治療癌症的途徑(29~30)。 Paukovitis ( 31 ) 等人由成熟的顆粒細胞中所分離出來的酸性 peptides-Hemovegulatory peptide(HP)可抑制細胞增生的作用, 因此,設計合成一系列 HP 衍生物,並測試其生物活性以從事結構活 性的研究,而我們期望的是可以建立一初步篩選的方式,也就是運用 表面薄膜共振的技術(SPR technology)來研究抑制物與癌細胞酵素 MAT 之分子間相互作用(32)。. 21.
(22) 第二節. 實驗儀器與材料. 2-1 儀器: 1. BIACORE X ,Pharmacia 公司 2. 振動混合器(votex),BoEco Germany 公司 3. 乾浴加熱器,真興實業有限公司. 2-2 材料與試劑: 1. sensor chip CM5 2. HBS buffer 3. N-hydroxy succinimide (NHS) 4. N-ethyl-N-(3-diethlaminopropyl)carbodimide(EDC) 5. Ethanolamine hydrochloride 6. Met(甲硫胺酸, Methionine) 以上材料、試劑均購自 Pharmacia 公司 7. 緩衝溶液 pH 7.0(TES, MgCl2, DTT, KCl) 8. ATP,購自美國 Sigma 公司 9. 癌細胞 MAT 酵素,由本校郭盛助教授之實驗室製備 10.. HP 類緣化合物(HP1~HP6),由本校藥化所涂源善博士所合成. 22.
(23) 第三節 MAT 抑制活性測試實驗設計一 在 BIAcore 感應晶片上並固定有任何分子的情況下,來觀察不同 分子與感應晶片上 dextran 之間的非特異性分子相互作用. 3-1 實驗方法 3-1-1 感應晶片與標的化合物(HP1、HP2)間結合反應測試: 將 BIAcore 定溫於 25℃且維持在恆定流速 10 ìl/min 的緩衝溶液 中,將含有 10 ìl 100 ìM ATP,10 ìl X/2 濃度的癌細胞 MAT 酵素, 10 ìl 100 ìM Met 及 30 ìl dH2O 之反應混合液用 votex 混合器混合均 勻,並且放在 37℃的乾浴加熱器中培養 10 分鐘中,注入 CM5 感應 晶片的表面,作為控制組。 另外再配製各種不同濃度的標的化合物(HP1 或 HP2)分別加入 上述同樣混合液中用 votex 混合器混合均勻,並且放在 37℃的乾浴加 熱器中培養 10 分鐘中,再注入 CM5 感應晶片表面。 觀察 RU 值變化,將各種濃度標的物所顯示之 RU 值除以控制組 之 RU 值所得之百分率作為評估其抑制之效應。. 23.
(24) 3-2 實驗結果與討論 兩種經設計合成之胜月太衍生物 HP1、HP2 不同濃度在感應晶片尚 未固定有任何分子的情況測試結果,由表 2-1、2-2 中,比較 RU 百分 率,發現這兩種標的物與感應晶片的表面之間的反應無劑量相關性, 沒有很強的非特異性結合,反應訊號無線性關係,因此無法用此未處 理過之晶片來偵測標的物真正抑制 MAT 之效果,所以實驗二的設計 為將 Fc1 之表面作為控制組表面,而 Fc2 之表面固定上特殊設計的鍵 合物使成為具有專一性的表面。從三個主要反應物:ATP、癌細胞 MAT 酵素、Met 中,選擇具有 –COOH 與-NH2 官能基的 Met 當作固 定於感應晶片表面之鍵合物,如此一來即能監測癌細胞 MAT 酵素複 合物與固定在感應晶片上 Met 之間相互作用,並進一步測試任何合成 的化合物對於癌細胞 MAT 酵素之抑制活性。. 24.
(25) 第四節 MAT 抑制活性測試實驗設計二 利用生物分子之間相互作用的技術(Biomolecular interaction analysis;BIA),來觀察 MAT 酵素與固定有 Met 的感應晶片之間相互 作用。. 4-1. 實驗方法. 4-1-1 固定有 Met 之感應晶片之製備: 將 BIAcore 定溫於 37℃且維持在恆定流速為 5 ìl/min 的 HBS 緩 衝溶液中。再將比例為 1:1(v/v)的 0.05M N-hydroxy succinimide (NHS)和 0.2M N-ethyl-N-(3-diethlaminopropyl)carbodimide(EDC) 混合液用 votex 混合器混合均勻,注入感應晶片達 7 分鐘,以使晶片 上面的-COOH 基活化,完成活化後必須在 3 分鐘內注入 2mM 的 Met,經 13 分鐘後即可獲得表層固定有 Met 之感應晶片。此時可以視 RU 的上升值而決定是否需再注入 Met,否則就必須做覆蓋的動作, 即注入 0.1M Ethanolamine hydrochloride 7分鐘來覆蓋住未與 Met結合 之具有活性的-COOH 基,如此固定有 Met 之感應晶片即完成。 (如圖 2-1 所示). 25.
(26) 4-1-2 固定有 Met 之感應晶片與 Met、標的化合物( HP1~HP6)結合 反應測試: 將 BIAcore 定溫於 37℃且維持在恆定流速為 5 ìl/min,pH 7.0 的 緩溶液中,為了模擬藥物在人體中的情形,所以實驗設計的條件盡量 模擬體內的環境。另外,在做每一管樣品之前都必須做固定 Met 於感 應晶片的動作,之後再將含有將含有 10μl 1mM ATP,10μl X 濃度的 癌細胞 MAT 酵素及 80 ìl buffer 之反應混合液,總體積為 100μl,用 votex 混合均勻,並且放在 37℃的乾浴加熱器中培養 10 分鐘中,注入 已經固定有 Met 的感應晶片之 Fc1,作為不含有抑制物之控制組。 另外分別取含有各種不同濃度的 Met 10μl(2mM、1mM、1/2mM、 1/4mM) 、各種不同的標的化合物( HP1~HP6)1mM 加入上述同樣混 合液中,此時 buffer 取 70 ìl,使得總體積仍維持 100 ìl,用 votex 混 合均勻,並且放在 37℃的乾浴加熱器中培養 10 分鐘中,注入感應晶 片之 Fc2,作為含有外加待測抑制物之實驗組。 每次測試完畢,為了去除殘留於晶片上的未結合試劑或一些其他 物質的非特異性結合,必須注入 1.2mM HCl清洗,再用 pH 7.0 的緩 衝溶液以 5 ìl/min 的恆定流速清洗 10 分鐘。. 26.
(27) 4-2 實驗結果與討論 (一)固定 Met 之感應晶片與 Met、ATP 及癌細胞 MAT 酵素之作用 反應 固定有 Met 之感應晶片與 ATP、癌細胞 MAT 酵素混合液且包含 有不同濃度之 Met 作用,結果如表 2-3 所示,其中 Fc1 的數據是表示 未加入 Met,單獨只有 ATP 與癌細胞 MAT 酵素及緩衝溶液的反應混 合液做為對照組,而 Fc2 數據表示反應混合液再加上不同濃度的 Met 反應的結果。以 Met 1mM 為例,如圖 2-2 所示,則 Fc2/Fc1(RU%) 百分率就代表該 Met 對癌細胞 MAT 酵素的反應作用。從表 2-3 中可 以看出隨著 Met 濃度的增加,RU%的值下降,這樣的結果說明了 ATP、癌細胞 MAT 酵素、Met 三者之間是有相互結合的反應。癌細胞 酵素中若是因有其他物質的非特異性結合而引起 RU 值之上升,則數 值應呈現出不規則之跳動,也就是並不會隨濃度的變化而有一致相關 性,相對地從結果中卻發現隨 Met 濃度的增加而 RU%下降,顯示外 加之 Met 會競爭掉感應晶片上 Met 與 ATP 和癌細胞 MAT 酵素的結合 能力。因此,如果測試其它可能有抑制效應的物質,若有著隨著抑制 物濃度的上升,RU%下降之結果,即可說明此抑制物有與癌細胞酵 素 MAT 作用抑制癌細胞 MAT 酵素之潛力。. 27.
(28) (二)癌細胞 MAT 酵素抑制活性篩選 HP1~HP6 等受測試樣品對 MAT 之抑制活性之評估乃利用同樣實 驗流程。只是換成 HP1~HP6 等樣品加入反應混合液中以測試其抑制 活性,其結果以 HP1 為例,如圖 2-3 所示。單獨使用反應混合液即 ATP 與癌細胞 MAT 酵素及 buffer 與另外加入 HP1~HP6等受測試樣品 的反應混合液之 RU 值變化分別以 RU1 和 RU2 表示,則 RU2/RU1 百分率就代表 HP 對癌細胞 MAT 酵素之抑制活性。全部 HP1~HP6 樣 品都以此方式評估,其結果整理於表 2-4。百分比越小表示受試的樣 品與癌細胞 MAT 酵素與 Met 之間相互作用影響越明顯,結果為: HP6>HP3>HP1>HP4>HP5>HP2,顯示出 HP6 有較好的抑制活性。由 於利用 BIA 的 SPR 技術做為評估 MAT 抑制活性的篩選迄今尚未有文 獻報導,但是我們成功的利用 Met 固定於感應晶片的設計,篩選出具 有抑制效應的物質,再進一步做傳統 MAT 抑制活性試驗(33)以確認其 與癌細胞酵素 MAT 之間的交互作用。 這個實驗能夠證明我們可以利用BIA之技術來輔助傳統測試藥理 的方法,減少傳統的放射線方法較費時以及潛在之危險性,快速的篩 選出有潛力的藥物。. 28.
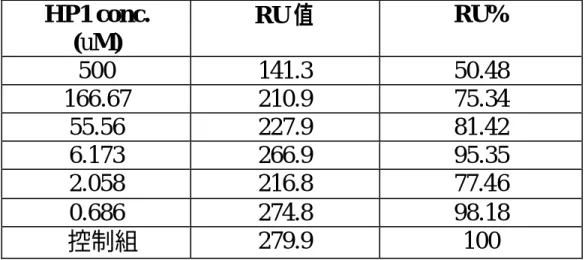
(29) 表 2-1 HP1 不同濃度與 MAT、Met、ATP 混合後注入感應晶片表面 之反應結果. HP1 conc. (uM) 500 166.67 55.56 6.173 2.058 0.686 控制組. RU 值. RU%. 141.3 210.9 227.9 266.9 216.8 274.8 279.9. 50.48 75.34 81.42 95.35 77.46 98.18 100. 註 控制組之 RU 值代表反應混合液(MAT、ATP、Met)均勻混合後與未固定 上特殊設計鍵合物之感應晶片反應結果 註 RU%為標的物每一濃度之 RU 值除以控制組 RU 值. 表 2-2 HP2 不同濃度與 MAT、Met、ATP 混合後注入感應晶片表面 之反應結果. HP2 conc. (uM) 500 166.67 55.56 18.52 6.173 2.058 0.686 控制組. RU 值. RU%. 289.6 238 264 336.6 300.5 250 290 298.5. 97.02 79.73 88.44 112.76 100.67 83.75 97.15 100. 註 控制組之 RU 值代表反應混合液(MAT、ATP、Met)均勻混合後與未固定 上特殊設計鍵合物之感應晶片反應結果 註 RU%為標的物每一濃度之 RU 值除以控制組 RU 值 29.
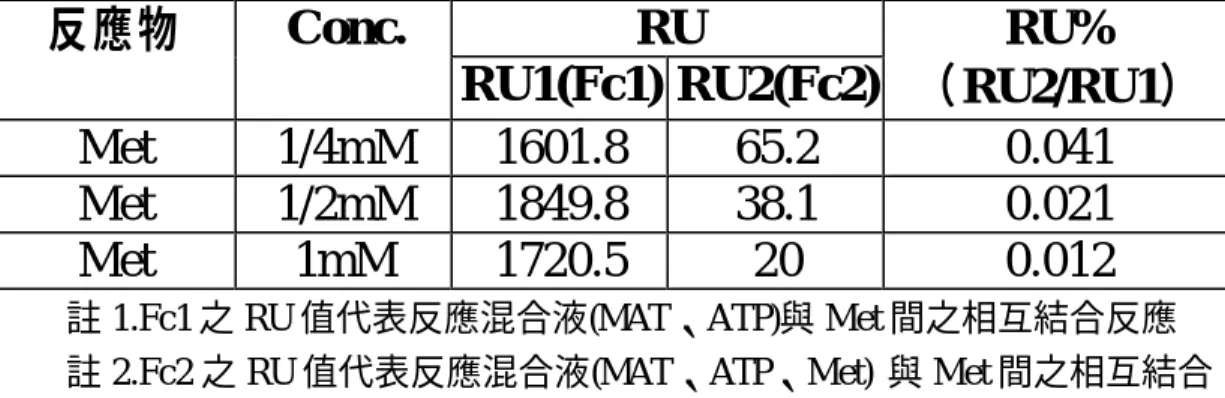
(30) 表 2-3. Met 不同濃度與 MAT、ATP 混合後注入 Met 之感應晶片之反 應結果. 反應物 Met Met Met. Conc.. RU RU% RU1(Fc1) RU2(Fc2) (RU2/RU1) 1/4mM 1601.8 65.2 0.041 1/2mM 1849.8 38.1 0.021 1mM 1720.5 20 0.012. 註 1.Fc1 之 RU 值代表反應混合液(MAT、ATP)與 Met 間之相互結合反應 註 2.Fc2 之 RU 值代表反應混合液(MAT、ATP、Met) 與 Met 間之相互結合 反應 註 3 RU2/RU1 百分率代表 Met 對癌細胞 MAT 酵素之競爭性抑制. 表 2-4. 不同反應物 HP1~HP6 與癌細胞酵素 MAT、ATP 混合後注入 Met 之感應晶片之反應結果. 反應物 HP1 HP2 HP3 HP4 HP5 HP6. RU RU1(Fc1) 1935.8 1527 1889.9 1802 1823.9 2140.1. RU2(Fc2) 115.8 146.4 89.2 114.1 162.7 74.1. RU% (RU2/RU1) 5.982 9.587 4.720 6.332 8.920 2.462. 註 1.Fc1 之 RU 值代表反應混合液(MAT、ATP)與 Met 間之相互結合反應 註 2.Fc2 之 RU 值代表反應混合液(MAT、ATP、HP 反應物) 與 Met 間之相 互結合反應 註 3 RU2/RU1 百分率代表 HP 對癌細胞 MAT 酵素之抑制活性. 30.
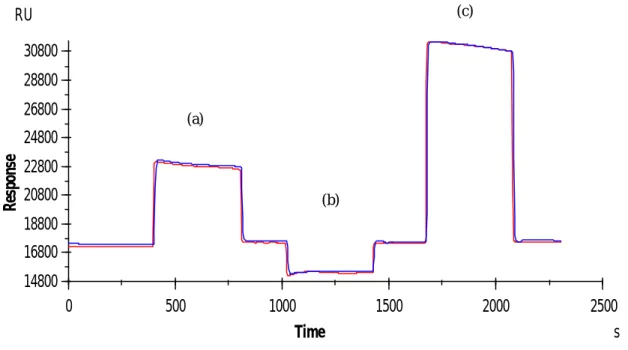
(31) (c). RU 30800 28800 26800. (a). Response. 24800 22800 20800. (b). 18800 16800 14800 0. 500. 1000. 1500. Time. 2000. 2500 s. 圖 2-1 Met 固定於 CM5 感應晶片之感應圖。(a)階段活化,注入 EDC/NHS 活化晶片表面,(b)階段固定 Met,(c)階段去活化,注入 Ethanolamine hydrochloride。. 31.
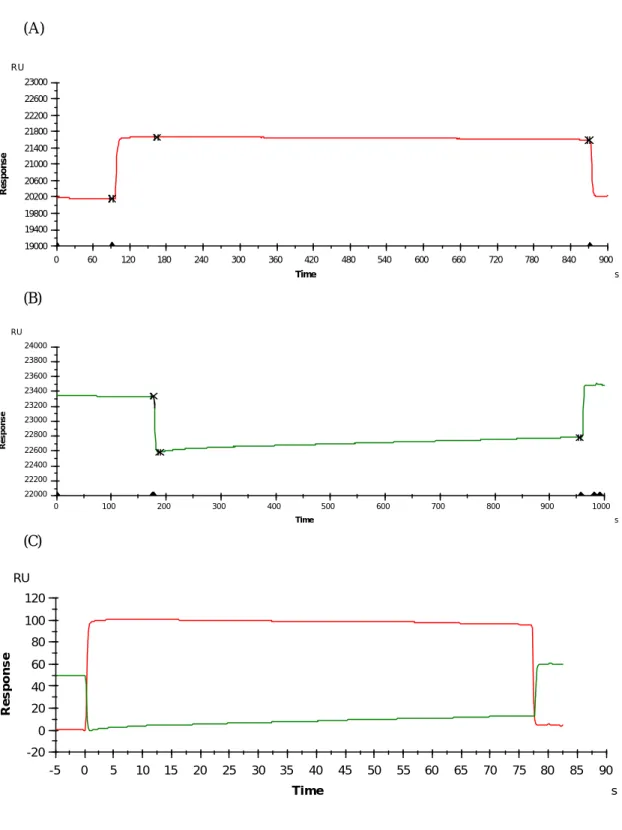
(32) (A) RU 23000 22600 22200 21800 Response. 21400 21000 20600 20200 19800 19400 19000 0. 60. 120. 180. 240. 300. 360. 420. 480. 540. 600. 660. 720. 780. 840. 900. Time. s. (B) RU 24000 23800 23600 23400 Response. 23200 23000 22800 22600 22400 22200 22000 0. 100. 200. 300. 400. 500. 600. 700. 800. 900. 1000. Time. s. (C) RU 120 100 Response. 80 60 40 20 0 -20 -5. 0. 5. 10. 15. 20. 25. 30. 35. 40. Time. 45. 50. 55. 60. 65. 70. 75. 80. 85. 90 s. 圖 2-2 固定有 Met 之感應晶片與不同濃度之 Met 作用結果。A 圖顯示 ATP 與癌細胞 MAT 酵素混合液注入感應晶片之 Fc1 後與 Met 結合反應, B 圖顯示 ATP、癌細胞 MAT 酵素與 Met 混合液注入感應晶片之 Fc2 後與 Met 結合反應,C 圖為 A 與 B 之結合圖。. 32.
(33) (A) RU 21000 20700 20400 20100 Response. 19800 19500 19200 18900 18600 18300 18000 450. 500. 550. 600. 650. 700. 750. 800. 850. 900. 950. 1000. 1050. 1100. 1150. 1200. 1250. 1300. 1350. 1400. Time. s. (B) RU 21000 20800 20600. Response. 20400 20200 20000 19800 19600 19400 19200 19000 500. 600. 700. 800. 900. 1000. 1100. 1200. 1300. 1400. 1500. Time. s. (C) RU 120 100. Response. 80 60 40 20 0 -20 -5. 0. 5. 10. 15. 20. 25 Time. 30. 35. 40. 45. 50. 55. 60 s. 圖 2-3 固定有 Met 之感應晶片與不同濃度之 HP1 作用結果。A 圖顯示 ATP 與癌細胞 MAT 酵素混合液注入感應晶片之 Fc1 後與 Met 結合反應, B 圖顯示 ATP、癌細胞 MAT 酵素與 HP1 混合液注入感應晶片之 Fc2 後與 Met 結合反應,C 圖為 A 與 B 之結合圖,顯示 HP1 對於酵素之 抑制效應。. 33.
(34) 第三章 BIA 應用於 Grb2 SH2 domain 抑制物之篩選. 第一節 研究動機與目的 Src homology-2(SH2)domain 對於細胞訊息的傳導扮演了一個 重要的角色 (34),它能夠辨識一段直線形且含有 pTyr 的蛋白質(35),因 此會與磷酸化的生長因子或磷酸化的蛋白質結合,負責調節細胞內的 訊息。生長因子接受器結合蛋白(Growth factor receptor-bound protein, Grb2)是一個 25 KDa 的細胞內連結蛋白(adaptor protein), 包含一個 SH2 domain 以及兩個 SH3 domain(36)。其中 Grb2 SH2 domain 會辨識包含有 pTyr 的連結蛋白 SHC(36)以及生長因子接受器(例如 Receptor Tyrosine Kinase, RTK)(37)。當 RTK 被活化之後,接受器上 的 Tyr 殘基會自動磷酸化(autophosphorylation)(38),而 Grb2 SH2 即能辨識此磷酸化的 RTK 進而與之結合,SH2 domain 與 RTK 的結合親 合力,約 KD=10~100nM(35)。SH2 domain 與 RTK 的結合後,會造成整個 蛋白質構形的改變,進而與其他的蛋白連接(39),活化下游 Ras 訊號 的傳導,造成細胞的有絲分裂 (40)。RTK 之變異或是過度表現被發現和 多種癌症或細胞增生方面的疾病有關(41)。因此若能阻斷 SH2 domain 與包含 pTry 殘基的區塊之間之相互作用或許能抑制活化後即磷酸化. 34.
(35) 的 RTK 接受器與 Grb2 SH2 的結合,進而阻斷 Ras 訊號的傳導。如此 將可針對因 Ras 路徑所引起之癌症並探討其反應機轉,以研發治療用 的藥物。. 第二節 胜月太衍生物之設計 對於 Grb2 SH2 分子機制的探討中,以往研究所報告皆著重於包含 磷酸化 Tyr 之胜月太與 Grb2 SH2 之結合(42)。研究發現與 Grb2 SH2 最 理想的結合是一段直線形特別是含有 pY-X-N 序列的線形 peptide (43). ,其中 X 的位子以 pY+1 表示,是任一疏水性胺基酸。雖然 pTyr. 與 SH2 domain 有較佳的結合,但是其親水性卻限制了其成為抗癌試 劑的條件(37)。其後 1997 年 Oligino and Lung (44) 等人利用 phage display 的方式成功地找尋出不含磷酸化 Try 之胜月太 — G1,可阻斷 Grb2 與 SHC 的結合,IC50 為 10-25μM(44)。G1 peptide 由 11 個胺基酸 所構成,序列之尾端由兩個 Cys 形成雙硫鍵連接起來,形成一環形結 構。G1 的序列中有 -Y-E-N- 和 Grb2 SH2 結合之最理想序列 -pY-X-N相似,構形上亦有助於其與 SH2 domain 的結合。而 G1 胜月太中的 E 似乎可以彌補胜月太中 Tyr 缺乏磷酸根的不足(45),以分子的模式來說 明,E 是酸性胺基酸,其支鏈所帶的負電荷或許能夠與 Grb2 SH2 domain 中 pY 結合部位的 Arg67, Arg86 形成較強的結合(46)。另外有報導發現. 35.
(36) 一系列少於五個殘基的胜月太對於 SH2 domain 有相當緊密的結合(47)。 因此此項研究,依據胜月太設計原則並合併天然與非天然胺基酸設計 出一個較小且非磷酸化的胜月太衍生物:E - Y - A i b - N 1. 在 Y+1 的位子以 Aib 取代,Aib 是一非天然胺基酸(48),利用 Aib 的設計是試圖以局部的立體效應使整個 peptide 構形形成 弧度類似於 G1 peptide 的環形結構。 2. 在 Y-1 的位子放上 E 是期待 E 的側鍊上 COO-能取代 PO3-的功能 與 Grb2 SH2 結合。 另外,本研究也設計另外一個含磷酸化衍生物 E-pY-Aib-N,以比 較磷酸化與非磷酸化衍生物上的 pTyr 殘基是否增加胜月太與標的蛋白 質 Grb2 SH2 之特異性的結合。 本實驗中之胜月太衍生物利用固相合成法(Solid-Phase peptide synthesis, SPPS)所合成,合成之胜月太衍生物再應用 SPR 的技術以 BIAcore X 儀器評估其對 Grb2 SH2 domain 的抑制效力。. 36.
(37) 第三節 實驗原理 本實驗將合成之胜月太衍生物利用 SPR 的技術測試兩組-磷酸化與 非磷酸化胜月太衍生物對於抑制 Grb2 SH2 domain 與 SHC(pY)反應之 結構活性關係。 在第一章中已經說明 BIA 有著不需標定物以及可即時測得反應結 果的功能,因此運用 BIA 的特性從事研究。本實驗使用 SA chip,首 先將與 Grb2 SH2 結合相當強且經過生物素修飾過的 SHC(pY) (49)固定 於感應晶片上,形成一具有生物特異性的感應晶片用來篩選合成之胜 月太衍生物,一系列不同濃度的胜月太衍生物與 Grb2 SH2 混合之後,將 混合液注入 BIAcore 儀器中,偵測混合液與晶片表面 SHC(pY)的結合 情形。若混合物中的抑制物有抑制效應存在,則會先與 Grb2 SH2 作 用,競爭掉 Grb2 SH2 與 SHC(pY)的反應,此實驗目的是期望以競爭性 抑制的方法來達到阻斷訊息傳導的路徑。. 37.
(38) 第四節 實驗儀器、材料與方法 4 - 1 儀器: 1.BIAcore X,Pharmacia 公司 2.振動器(Votex),BoEco Germany 公司 3.乾浴加熱器,真興實業有限公司. 4 - 2 材料與試劑: 1. sensor chip SA 2. HBS buffer 以上材料、試劑均購自 Pharmacia 公司 3. 生物素鍵合修飾物之胜月太(Biotin SHC(pY)) ,購自 Quality control Biochemicals 公司 4. PBS buffer pH 7.4~7.51 5. Grb2 SH2 protein,由清華大學生命科學研究所程家維教授製備 6. 胜月太衍生物(E-Y-Aib-N 、E-pY-Aib-N),於龍鳳娣教授之實驗 室製備合成. 38.
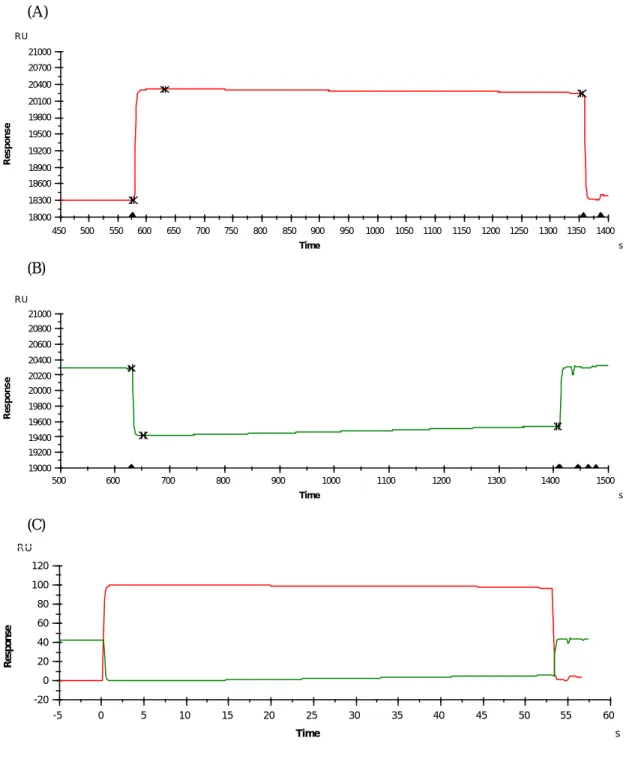
(39) 4 - 3 實驗方法 4 - 3 - 1 固定有 B i o t i n S H C ( p Y )之感應晶片製備 將 BIAcore 定溫於 25℃,且維持在恆定流速 2μl/min 的 HBS 緩 衝溶液中,再將經生物素修飾過的鍵合物 Biotin SHC(pY)注入感應 晶片,由感應圖測得晶片表面與未固定 SHC(pY)之 RU 值相比有 169.3 RU 的上升,即表示已獲得表面固定有 Biotin SHC (pY)之感應晶片(如 圖 3-1 所示) 4-3-2 固定有 Biotin SHC( pY) 之感應晶片與月生月太衍生物間結合反應 將 BIAcore 定溫於 25℃,且維持在恆定流速 5μl/min 的 PBS 緩 衝溶液中,做抑制效應實驗時,首先注入只含有 Grb2 SH2 protein 的溶液 30μl 做為對照組。實驗組則是將胜月太衍生物從原始濃度 2mM 做一系列連續稀釋,並使每一管的濃度為前一管的 1/3,每一管 30 μl,之後再將 Grb2 SH2 protein 30μl 與各種不同濃度之胜月太衍生 物(從最稀濃度的衍生物開始)用振動器混合均勻,並在 37℃乾浴 加熱器中培養一小時後,注入已固定有 Biotin SHC(pY)之感應晶片 中,偵測其反應情形,最後利用 BIAcore 電腦附設程式來執行與評估 其結合親合力之分析。於每次測試完畢,為了去除殘留於晶片上的蛋 白質或其他非特異性結合的物質必須注入 360mM HCl 清洗晶片表面, 使晶片經 HCl 的清洗獲得再生之起始表面,以重覆循環實驗之進行。. 39.
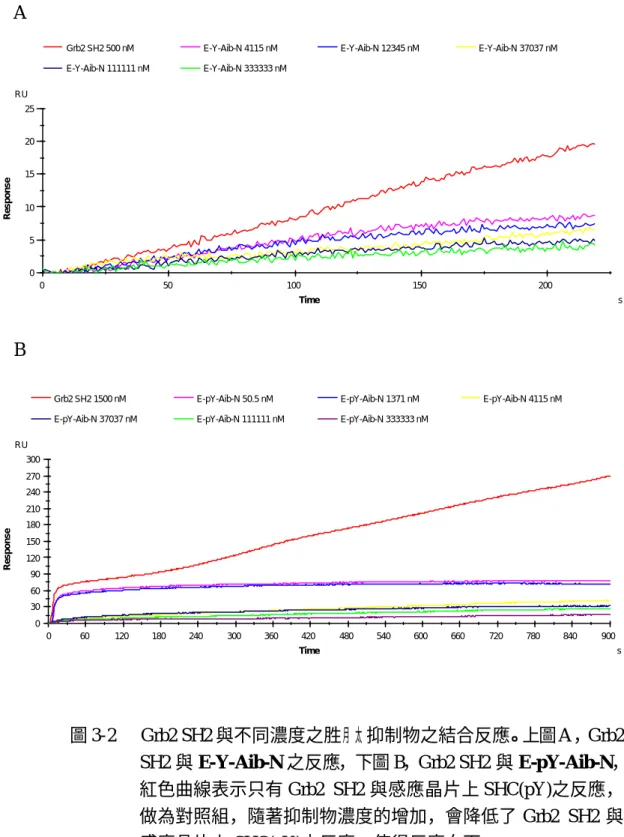
(40) 第五節. 實驗結果與討論. 發現固定有 Biotin SHC(pY)之感應晶片只與 Grb2 SH2 作用時,兩 者有一相當程度的結合反應(表 3-1、3-2) ,做為對照組數據;固定 有 Biotin SHC(pY)之感應晶片經分別注入混合液,混合液中包含有 Grb2 SH2 與不同濃度之胜月太衍生物(非磷酸化胜月太衍生物 E-Y-Aib-N 或磷酸化胜月太衍生物 E-pY-Aib-N)測試其反應,結果整理於表 3-1、 3-2 中,發現隨著加入胜月太衍生物濃度的增加 RU 值有下降的現象。 RU 百分率代表著胜月太衍生物對 Grb2 SH2 的抑制效應,百分比愈小表 示樣品越具明顯抑制 Grb2 SH2 與 SHC(pY)之作用,也就是說外加的胜 月太衍生物會先與 Grb2 SH2 結合,消耗部分 Grb2 SH2 之濃度,減少 了 Grb2 SH2 與感應晶片上 Biotin SHC (pY)的相互作用。另外,也可 以從 BIAcore Evaluation 分析軟體,描繪出每一胜月太衍生物隨著濃 度的上升會有著 RU 值向下的反應(圖 3-2)。 將合成之磷酸化與非磷酸化胜月太衍生物其抑制效應之實驗數據運 用 Microsoft Excel 軟體,並配合格線圖推算出胜月太衍生物的 IC50。 由表 3-2 的結果發現測試所用之磷酸化胜月太衍生物其濃度在 50.5 nM 時已足以造成 1500 nM 之 Grb2 SH2 蛋白質被抑制 73.2%,所以 IC50<50 nM,與之前研究報告結果一致 (42,43),可以說明包含 pTyr 胜 月太與 Grb2 SH2 有較佳的結合效果,但是 pTry 所攜帶之負電荷卻形. 40.
(41) 成一阻礙其進入細胞膜的障礙,如此將不能有效達到抑制 Grb2 SH2 與 pTry 之結合。非磷酸化胜月太衍生物雖可以克服此項困難,然而測 試結果其 IC50≒4.9~5.6 μM 較大,表示抑制效應不如磷酸化胜月太 衍生物,因此未來設計之胜月太衍生物應進一步加以修飾,以期研發 出對於 Grb2 SH2 的抑制效應較好之衍生物。 此實驗證明了可以利用 BIA 的 SPR 技術對於 Grb2 SH2 和胜月太衍 生物間的相互作用做分析探討,並且能應用以上的方法研究發展新 的、具有高效力以及專一性之 Grb2 SH2 衍生物。. 41.
(42) 表 3-1 Grb2 SH2 與胜月太抑制物 E-Y-Aib-N 之結合反應測試結果 E - Y-Aib-N Grb2 SH2 conc.(nM) (nM) 4115 500 12345 500 37037 500 111111 500 333333 500 Grb2 SH2 500 Protein only IC50 = 4.9~5.6 μM. RU 值. RU%. 11.7 7.5 7.1 6.8 4.9 22.1. 53 34 32 30.8 22.2 100. 註 1.Grb2 SH2 Protein only 之 RU 值代表只有 Grb2 SH2 與感應晶片上 SHC(pY)反應之值 註 2.RU%表示不同濃度之胜月太抑制物與 Grb2 SH2 反應後之 RU 值除 以 Grb2 SH2 protein only 反應之 RU 值 註 3.IC 50 表示胜月太抑制物 50%之抑制濃度 註 4. IC 50 之值是以 Microsoft Excel 配合格線圖推算而得. 表 3-2 Grb2 SH2 與胜月太抑制物 E-pY-Aib-N 之結合反應測試結果 E - pY-Aib-N conc.(nM) 50.5 1371 4115 37037 111111 333333 Grb2 SH2 Protein only IC50<50 nM. Grb2 SH2 ( nM) 1500 1500 1500 1500 1500 1500 1500. 註同上. 42. RU 值. RU%. 77.1 68.3 44.3 30.8 27.4 17.3 287.4. 26.8 23.8 15.4 10.7 9.5 6 100.
(43) RU 22000 21500. Response. 21000 20500 20000 19500 19000 0. 200. 400. 600. 800. 1000. 1200. Time. 圖 3-1 SHC(pY)固定於 SA 感應晶片之感應圖。注入經生物素修飾之 SHC(pY) 100 nM、30μl 於感應晶片上,由於 SA 感應晶片上之 streptavidin 會與生物素修飾物能有緊密的結合,所以可得到固定配 體 SHC(pY)之感應晶片。. 43. 1400 s.
(44) A Grb2 SH2 500 nM. E-Y-Aib-N 4115 nM. E-Y-Aib-N 111111 nM. E-Y-Aib-N 333333 nM. E-Y-Aib-N 12345 nM. E-Y-Aib-N 37037 nM. RU 25. Response. 20. 15. 10. 5. 0 0. 50. 100. 150. 200. Time. s. B Grb2 SH2 1500 nM. E-pY-Aib-N 50.5 nM. E-pY-Aib-N 1371 nM. E-pY-Aib-N 37037 nM. E-pY-Aib-N 111111 nM. E-pY-Aib-N 333333 nM. E-pY-Aib-N 4115 nM. RU 300 270 240. Response. 210 180 150 120 90 60 30 0 0. 60. 120. 180. 240. 300. 360. 420 Time. 圖 3-2. 480. 540. 600. 660. 720. 780. 840. 900 s. Grb2 SH2 與不同濃度之胜月太抑制物之結合反應。上圖 A ,Grb2 SH2 與 E-Y-Aib-N 之反應,下圖 B,Grb2 SH2 與 E-pY-Aib-N, 紅色曲線表示只有 Grb2 SH2 與感應晶片上 SHC(pY)之反應, 做為對照組,隨著抑制物濃度的增加,會降低了 Grb2 SH2 與 感應晶片上 SHC(pY)之反應,使得反應向下。. 44.
(45) 第四章 BIA 應用於 Glutamate mutase 之 MutS 次單元與輔脢 B12 間交互作用之探討. 第一節 研究動機與目的 維生素 B12 是所有維生素中唯一擁有微量元素 — 鈷(cobalt)的複 雜有機分子,Adenosylcobalamin(AdoCb1)是 B12 其中的一種輔脢型 式。AdoCbl 的結構(50)是以鈷元素為中心(如圖 4-1-A) ,具有 6 個配 位鍵,其中位於平面的 4 個鍵結是由 N 原子與中心鈷元素鍵結形成環 狀結構,此一環狀結構稱為 corrin 環,而另外兩個配位鍵則鍵結於鈷 元素之上和下方:位於鈷元素上方的配位基是 5’-deoxyadenosine,位 於鈷元素下方的配位基是自身結構 corrin 環中 D 環上的側鏈尾端的 dimethybenzimidizole,而此處是本實驗主要研究探討之重點。 Glutamate mutase酵素是第一個發現需要以 AdoCbl做為輔脢的例 子(51),它可以催化碳支鏈轉位的反應(52),這個酵素是由次單位 MutE 與次單位 MutS(53)所構成。MutE 是一個二聚體,分子量為 107 kDa(54 ); 次單位 MutS 則是為一個單體,分子量為 14.8 kDa(55)。MutE、MutS 與 AdoCbl 必須在三者皆存在的情況下才會結合(51,56),形成有功能性 的酵素。在三者的結合上發現 MutS 的 Histidin16 殘基會與 AdoCbl 中鈷元素的鍵結(57,58)(如圖 4-2) ,而此鍵結位也正是原始 AdoCbl 自. 45.
(46) 身結構側鍊尾端 dimethybezimidazole 與鈷元素之結合位。因此,本實 驗研究的目的是想利用 BIA 的 SPR 技術,觀察在無 MutE 存在的情況 下,AdoCbl 與 MutS 兩者在下列結合情形加以探討: 1.只有 AdoCbl 與 MutS 兩者存在的情況下的結合情形 2.AdoCbi (AdoCbl 的類似物)(如圖 4-1-B)與 MutS 的結合情形 3.AdoCbi 與 MutS 的三個變異蛋白:MutS-D14N (Asp 轉變為 Asn)、MutS-D14A(Asp 轉變為 Ala)、MutS-H16G(His 轉變 為 Gly)的結合情形 4.最後觀察在不同 pH 值下,AdoCbi與 MutS 及 MutS 的變異蛋白 對於結合能力上是否有所影響. 46.
(47) 第二節. MutS 及 MutS 變異蛋白的生產與純化. 2-1 儀器 : 1.. 高溫高壓滅菌釜,宏霖儀器股份有限公司 型號 HL340. 2.. 恆溫振盪培養箱,Firstek Scientific 型號 S300R. 3.. 高速離心機,美商貝克曼儀器有限公司 型號 J2MC. 4.. 超音波震盪器,MSI 型號 SONIPREP 150. 5.. 離子交換管柱(2.6×20-cm Q-Sepharose Fast Flow anion-exchange column),Pharmacia 股份有限公司. 6.. 膠體過濾管柱(2.6×90-cm Sephacry S-200-HR gel fittration column),Pharmacia 股份有限公司. 2-2 材料與試劑: 1.菌體(MutS、MutS mutations),由陳灝平教授提供 2. Ampicillin(amp),購自生工有限公司 3. Isopropylyphio-β-D-galactoside(IPTG),購自生工有限公司 4. 1.4-Dithiothreitol(DTT),購自生工有限公司 5. 硫酸銨,購自生工有限公司 6. 磷酸鉀緩衝液 (Potassium phosphate buffer) pH 7.0,購自默克公司 7. PM3 蛋白濃縮過濾膜,購自 Millipore 公司. 47.
(48) 2-3 實驗方法 (a)培養液(LB medium)的配製 取 50g tryptone、25g Yeast、50g NaCl與 2.5ml NaOH 加水至 5L, 攪拌均勻,分裝至 4 個體積 2L 的三角錐瓶中,使每一瓶中含有 1.2L 的培養液,將剩餘的 200ml 的培養液放置於體積 1L 的三角錐瓶中, 並將全數放入滅菌箱內,以 1.2 大氣壓、121℃滅菌 20 分鐘。. (b)菌體的培養 所有的培養液皆含 100μg/ml 的 Ampicillin,取菌液 200μl 接種 於有 5ml 培養液的試管內,放入 37℃、200 轉/min,振盪培養箱中培 養,隔夜培養後,取出試管中的菌液 2ml,接種於 200ml 的培養液內, 放回 37℃,振盪培養 4 小時,之後,再將 200ml 的菌液平均到入 4 個三角錐瓶,每瓶有 1.2L 的培養液內,培養至 OD 值達 0.6~0.8 時, 於每瓶中加入 0.6 mM IPTG 以誘導蛋白質的產生,再放回 37℃,振 盪培養 4 小時後,將已大量表現蛋白質的菌體以離心的方法(12000 xg,10 分鐘)收集。. (c)超音波震盪 將收集到的菌體以 50 mM 磷酸鉀緩衝液 pH 7.0 內含 5mM DTT 使其重新懸浮,並用玻璃棒儘量使大塊菌體溶解。使用超音波震盪. 48.
(49) 器,打破菌體,使菌體內的蛋白質流出。因此為避免因超音波震盪器 使用時產生的高熱造成蛋白質的變性,所以於每次打 1 分鐘後停頓 1~2 分鐘,重複 6~7 次後,離心(40000 xg,20 分鐘) ,取上清液,此 上清液為蛋白質粗萃取液。. (d)硫酸銨沉澱 將離心後的粗萃取液使其濃度到達 40%,即量測粗萃取液之體 積,加入硫酸胺晶體,離心(40000 xg,20 分鐘) ,取上清液;在加 入硫酸胺晶體時,需緩慢加入並持續加以攪拌,待硫酸胺晶體完全加 入後,再攪拌 15~20 分鐘,離心。若此時晶體還未完全溶解,再繼續 攪拌至完全溶解為止。量測上清液體積再加入硫酸胺晶體使其濃度到 達 80%,離心(40000 xg,20 分鐘) ,去上清液,此時蛋白質已被沉 澱下來。. (e)透析 先準備透析液 2L 的 1 mM 磷酸鉀緩衝液 pH 7.0 內含 1mM DTT 放入冰箱預冷,吸取少量透析液將經硫酸胺沉澱的粗蛋白質重新溶 解,倒入透析袋中放入 2L 的透析液內,透析一晚(overnight)。. (f)離子交換 離子交換管柱必須先以 10 mM 磷酸鉀緩衝液 pH 7.0 內含 1mM 49.
(50) DTT 平衡之。將已透析一晚的粗蛋白液離心(40000 xg,20 分鐘) , 移去不溶的沉澱物後,通入管柱。先以 10 mM磷酸鉀緩衝液 pH 7.0 內 含 1mM DTT 沖提 100ml,再改以濃度為 50mM 磷酸鉀緩衝液 pH 7.0 內含 1mM DTT 沖提 400ml ,以流速 2 ml/min,每 6ml 收集一管。並 以波長為 280nm 的 UV 光測量收集到的每一管溶液的 OD 值,以 MutS 為例(圖 4-3),找出主峰即為粗蛋白質所在,並以 SDS-PAGE 確定 之。 將含有粗蛋白質的溶液全數收集,以氮氣加壓的方式加以過濾濃 縮,將體積濃縮至 10~15ml,濃縮所使用的過濾膜為 PM3,可使分子 量小於 3 kDa 的物質通過。. (g)膠體過濾 膠體過濾管柱必須先以 50 mM 磷酸鉀緩衝液 pH 7.0 內含 1mM DTT 平衡之。將濃縮好的粗蛋白液通入管柱內,再以 50 mM 磷酸鉀 緩衝液 pH 7.0 內含 1mM DTT 以重力的方式沖提,將沖提出來的液 體以每 100 滴收集一管,並以波長 280nm 的 UV 光測量每一管溶液的 OD 值,以 MutS 為例(圖 4-4) ,其中的一支主峰即為純蛋白質所在, 並以 SDS-PAGE 確定之。 將含有純蛋白質的溶液全數收集,以氮氣加壓的方式加以過濾濃 縮,將體積濃縮至 10~15ml,濃縮所使用的過濾膜為 PM3,加入等體 50.
(51) 積的甘油混合均勻,即可放入-20℃冰箱內保存。 MutS 的吸光係數為 9380 cm-1M-1,可以此估算蛋白質的濃度。 MutS 以 及 MutS 的 三 種 突 變 蛋 白 : MutS-D14N、 MutS-D14A、 MutS-H16G 皆以相同的方法純化之(如圖 4-5)。. 51.
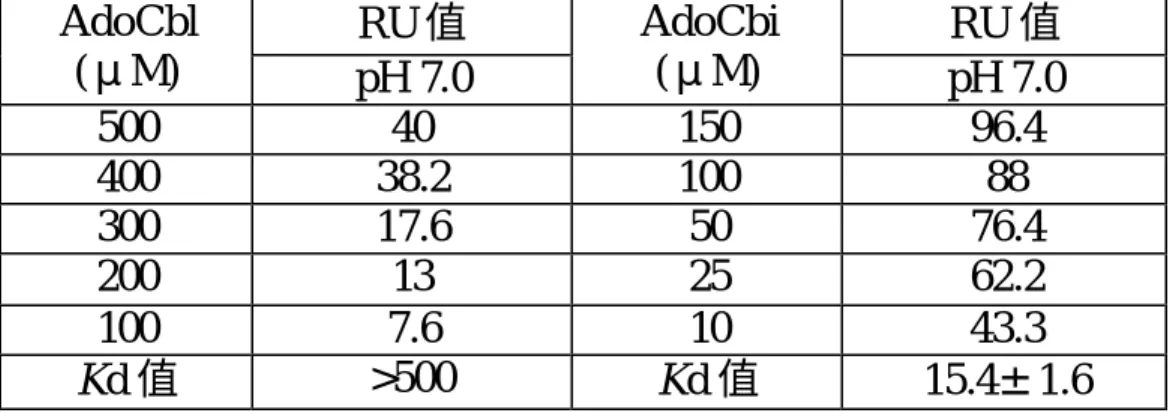
(52) 第三節 以 BIA 的 SPR 技術偵測 MutS 及 MutS 變異蛋白與 AdoCb1 及 AdoCbi 間之結合反應之研究 3-1 儀器: 1.BIAcoreX,Pharmacia 公司. 3-2 材料與試劑: 1.sensor chip CM5 2.HBS buffer 3.N-ethyl-N-(3-diethlaminopropyl) carbodimide (EDC) 4.N-hydroxy succinimide(NHS) 5.Ethanolamine hydrochloride 以上材料、試劑均構自 Pharmacia 公司 6.Adenosylcobalamin (AdoCb1) ,購自 Sigma 公司 7.Adenosylcobalamin analog (AdoCbi) ,由南京大學化學系陳慧蘭教 授合成 8.Tris 緩衝劑 pH 8.5,購自 USB 公司. 52.
(53) 3-3 實驗方法 3-3-1 將 MutS 固定於感應晶片 CM5 將 BIAcore定溫於 25℃,且維持在恆定流速 5μl/min 的 HBS buffer 中,再將比例為 1:1(volume/volume)的 0.05M NHS 和 0.2M EDC 混合液用 votex 混合均勻,注入感應晶片 7 分鐘,目的是為了使晶片 上面的 -COOH 基活化,完全活化後必須在 3 分鐘內注入 50mM 的 蛋白質(蛋白質以 50 mM 磷酸鉀緩衝液 pH 7.0 內含 1mM DTT buffer 稀釋) ,經 10 分鐘後即可獲得表層固定有蛋白質之感應晶片,此時可 視 RU 的上升值而決定是否需在注入蛋白質,否則就必須做覆蓋的動 作,即注入 0.1M Ethanolamine hydrochloride 7 分鐘來覆蓋住為與蛋白 質結合之具有活性的-COOH 基。每一種蛋白質皆以此法固定於感應 晶片上,如此即可獲得 4 片分別固定有 MutS、MutS-D14N、 MutS-D14A、MutS-H16G 之感應晶片。以 MutS 為例,如圖 4-6 所示。. 3-3-2 MutS 與 AdoCb1 之結合反應測試 將 BIAcore 定溫於 25℃,將流速設定為 5μl/min,以 50mM 磷酸 鉀緩衝液 PH 7.0 內含 1 mM DTT 沖提。此實驗必須在暗房下進行。 將 AdoCbl 以同一磷酸鉀緩衝液做連續稀釋(500, 400, 300, 200, 100 μM),從高濃度的 AdoCb1 開始注入至已固定有 MutS 之感應晶片 中,運用 BIAcore 即時監測並分析 AdoCb1 與 MutS 的結合情形。 53.
(54) 於每次測試完畢後並不需要注入任何再生溶液,只需運用 buffer 反覆沖洗即可恢復至原來的起始狀態。. 3-3-3 MutS 與 AdoCbi 之結合反應測試 方法同上,但將 AdoCb1 改成 AdoCbi,並以同一磷酸鉀緩衝液 pH 7.0 做連續稀釋(150, 100, 50, 25, 10μM),從高濃度的 AdoCbi 開始 注入至已固定有 MutS 之感應晶片中;再改將 BIAcore 維持在恆定流 速 5μl/min 的 pH=8.5 Tris 緩衝液 50 mM 內含 1mM DTT 中,並將另 一系列 AdoCbi以同一 Tris 緩衝液做連續稀釋(500, 400, 300, 200, 100 μM),也是從高濃度的 AdoCbi 開始注入至已固定有 MutS 之感應晶 片中,最後運用 BIAcore 即時監測並分析 AdoCbi 在不同濃度與不同 pH 值下與 MutS 的結合情形。. 3-3-4 MutS 變異蛋白與 AdoCbi 之結合反應測試 方法同上,將 AdoCbi 以同一磷酸鉀緩衝液 pH 7.0 與 Tris 緩衝液 pH 8.5 做兩組連續稀釋(400, 300, 200, 100, 50μM),從高濃度的 AdoCbi 開 始 分 別 注 入 已 固 定 有 MutS-D14N 、 MutS-D14A 、 MutS-H16G 之感應晶片中,運用 BIAcore 來監測並分析 AdoCbi 不同 濃度以及不同 pH 值下與 MutS 變異蛋白:MutS-D14N、MutS-D14A、 MutS-H16G 之間的結合情形。. 54.
(55) 第四節 實驗結果與討論 我們從 E.coli 中大量表現並純化 MutS 與 MutS 變異蛋白-D14N、 D14A、H16G,產生足夠的產量來對於其與 AdoCb1 以及 AdoCbi 間 結合性的相關研究。 MutE、MutS 與 AdoCb1 必須在三者皆存在的情況下,才能形成 酵素複合物- Glutamate mutase,即 MutE 與 MutS 的結合需要有 AdoCb1 的幫助(56),缺乏其中一者則另兩者將不會結合(51),或者結 合能力非常弱,從表 4-1 中證實了這樣的結果。MutS 與 AdoCb1 的結 合(圖 4-7)能力在缺乏 MutE 的情況下 Kd 值大於 500μM,但是當 MutS 與 AdoCbi 做結合測試時(圖 4-8) ,卻發現兩者的結合相對上是 較容易的,其 Kd 值 15.4 ±1.6μM(表 4-1)與先前 MutS 與 AdoCb1 的 Kd 值相比是它的 30 倍以上,所以 AdoCbi 在缺乏 corrin 環中 D 環 上側鍊尾端的 dimethybenzimidizole 的阻礙下,能順利且容易的與 MutS 鍵結,因而推測藉由 MutE 與 MutS 之間的交互作用能將 AdoCb1 的尾端移開,使得 MutS 與 AdoCb1 結合。至於 MutE 與 MutS 在結合 之 後 所 引 起 的 蛋 白 質 三 級 結 構 的 改 變 , 即 如 何 將 AdoCb1 的 dimethybenzimidizole 尾端移開,其原因有待探討。 當 MutS 與 AdoCbi 結 合 時 , MutS 上 的 His 殘 基 會 取 代 dimethybenzimidizole 而與鈷元素鍵結(57,59),且與 His 鄰近的殘基-Asp. 55.
(56) 會與 His 間形成氫鍵,此氫鍵的形成有助於穩定鈷元素與 His 的結合 (如圖 4-2)(60),這樣的結構:鈷-His-Asp 引起探討的興趣。因此本 實驗將 MutS 上的 His 替換成 Gly 即 MutS-H16G,Gly 是一個最簡單 結構的胺基酸,其側鍊只有一個氫原子,當測試 MutS-H16G 與 AdoCbi 兩者間的結合(圖 4-9)反應時從結果(表 4-2)發現測試所用之 AdoCbi 之最大濃度不足以有效測量其與 MutS-H16G 的結合能力,Kd > 400 μM,與 MutS 及 AdoCbi 結合之 Kd 值相比有 25 倍的增加,因此這樣 的結果證明缺乏 His 的 MutS 會嚴重影響 MutS 與 AdoCbi 之結合,所 以 His 有其存在的必要性。 另外,對於是否因 Asp 與 His 間的鍵結而增加穩定 His 與鈷元素 的結合之探討中將 MutS 上的 Asp 替換為 Gln、Ala 即 MutS-D14N 與 MutS-D14A;Gln 的結構與 Asp 相似而 Ala 與 Asp 的結構差異甚多, 但置換的兩者與 His 間皆不會有鍵結的產生,當測試 MutS-D14N、 MutS-D14A 與 AdoCbi 結合(圖 4-10、4-11)反應時從結果(表 4-2)中 得知兩者與 AdoCbi 的結合能力明顯下降很多,由於兩者 Kd 的誤差值 皆過大是沒辦法以數據清楚說明兩者在結構上對於 His 的影響,但是 整體看來,當 MutS 上的 Asp 因被置換,使得 His 與鈷元素間的結合 受影響進而降低 MutS 變異蛋白與 AdoCbi 的結合,因此仍然可以顯 露出 Asp 與 His 間的相互作用對於 His 與鈷元素間有穩定的效果。. 56.
(57) 本實驗亦嘗試了解 pH 值的改變對 AdoCbl 結合的影響,測試結果 如表 4-2 所示,MutS 和 MutS 變異蛋白與 AdoCbi的結合能力在 pH 7.0 時比 pH 8.5 佳,根據文獻(61)所載:Glutamate mutase 的最適反應 pH 值為 8.5,與本實驗觀察結果並不相符,其原因可能在於 MutE 存在 與否,整個酵素複合體是由 MutS、MutE 與 AdoCb1 三者的結合,而 AdoCb1 被 MutS 與 MutE 包夾其中,因此單獨 MutS 與 AdoCb1 之間 結合受緩衝溶液 pH 值影響應遠小於三者結合時受緩衝溶液之影響。 這個實驗證明了可以利用 BIA 的 SPR 技術建立分子結構與功能 性的相關研究,是一個相當實用且迅速的測試方法,不僅能監測分子 與分子間的結合,對於蛋白質中單個胺基酸的改變對蛋白質與其他分 子結合功能的影響也能做探討,因此能從以上的方法結果提供一個對 於蛋白質與蛋白質間相互作用以及蛋白質構形研究的新方向。. 57.
(58) 表 4-1 MutS 與 AdoCbl、AdoCbi 結合反應之測試結果. RU 值 pH 7.0 40 38.2 17.6 13 7.6 >500. AdoCbl (μM) 500 400 300 200 100 Kd 值. AdoCbi (μM) 150 100 50 25 10 Kd 值. RU 值 pH 7.0 96.4 88 76.4 62.2 43.3 15.4±1.6. 表 4-2 MutS、MutS 變異蛋白與 AdoCbi分別在 pH 7.0 以及 pH 8.5 結合反應 之測試結果. MutS AdoCbi (μM). RU 值. 150. pH7.0 pH8.5 31.8 12.8. 100. MutS-H16G MutS-D14N MutS-D14A AdoCbi (μM). RU 值. RU 值. RU 值. 400. pH7.0 pH8.5 pH7.0 pH8.5 pH7.0 pH8.5 42.3 29.3 187.7 102.7 100 65.5. 30.7 10.6. 300. 31.9 19.2 145.1 75.1 92.4 54.1. 50. 24.7. 7.7. 200. 28.8 13.5 121.9 64.1 84.7 47.5. 25. 19.2. 5.9. 100. 16.6 10.2. 80.3 42.7 57.1 34.8. 10. 9.6. 4.1. 50. 10.2. 63.1 25.3 45.5 25.4. Kd 值. 26.5 40.8 ± ± 2.6 12.6. 7.6. 241.6 365.6 99.5 133.2 Kd 值 >400 >400 ± ± ± ± 97.5 125.8 17.3 33.6. 註 1 Kd 值由 KakeidaGraph 軟體計算而得. 58.
(59) A. B OH HO O H. H. N. N. CONH2 H2NOC H2NOC. N. O. Co. N. NH. OH HO. N N. O. N N NH2 CONH2 CONH2. N. H. H. N. N. CONH2. N N N. N NH2 CONH2. H2NOC H2NOC. N. Co. N. O. O NH2. CONH2. O NH2. NH N. H O. HO P. O. H OH. O. -. O O. OH. AdoCbi. AdoCbl (coenzyme B12). 圖 4-1 維生素 B12 -AdoCbl 與維生素 B12 類似物-AdoCbi 之結構圖。圖 A 為維生素 B12 輔脢-AdoCb1 之結構;圖 B 為 AooCb1 類似物 AdoCbi 之結構,缺少 corrin 環中 D 環上之側鏈尾端 dimethybenzimidizole。. 59.
(60) OH HO O H. H. N. N. N. N NH2. E subunit (53.7 kDa). Co+3 N. His 16 N. S subunit (14 kDa). H O. O. Asp 14 N N. 圖 4-2 glutamate mutase 之結構圖,是由次單位 MutE、次單位 MutS 與維 生素 B12 輔脢-AdoCb1 三者結合而成,MutS 之 His 16 殘基會與 AdoCb1 之鈷元素鍵結,且 His16 與 Asp 14 之間有氫鍵的形成。. 60.
(61) 0.5. OD 280nm. 0.4. 0.3. 0.2. 0.1. 0 0. 10. 20. 30. 40. 50. 60. 70. 圖 4-3 離子交換之結果,以 MutS 為例。由波長 280 nm 之 UV 光測量每一 管經由緩衝液沖提出之溶液,測得 50~68 管為粗蛋白質所在並全數 收集之。. 0.8. OD 280nm ¬. 0.7 0.6 0.5 0.4 0.3 0.2 0.1 0 0. 1 0. 2 0. 3 0. 4 0. 5 0. 6 0. 7 0. 圖 4-4 膠體過濾之結果,以 MutS 為例。由波長 280 nm 之 UV 光測量每一 管經由緩衝液沖提出之溶液,發現一主峰即為純蛋白質之所在,將 54~59 管全數收集之。. 61.
(62) M.W.. 1. 2. 3. 4. 5. 6. ( kDa ). 97.4 66.2 57.5 45.0 36.0. 24.0 19.7/20.5. 14.4. 圖 4-5 MutS 蛋白質純化。每一步純化之結果以 SDS-PAGE 顯示之:Lane 1, 蛋白質 marker,其分子量標示在左邊;經 IPTG 誘導下,可以觀察 到在經誘導的萃取物中(Lane 3)和不經誘導的控制組(Lane 2) 比較,出現一個 14800 Da 的蛋白質產物;Lane 4,硫酸胺沉澱; Lane 5,離子交換;Lane 6,膠體過濾。. 62.
數據
+7
相關文件
IRB 編號 CE19168A-2 計畫主持人 林敬恒 計畫名稱 推動輸血與非類固醇抗發炎藥物不良反應之智慧醫療應用 審查意見
一年級學生對於【校園美感小 旅行】的學習活動,充滿著期待與 興奮,尤其請小朋友藉著肢體動作
而此時,對於相對成長率為 k 的族群,其滿足族群成長模型 的解為指數函數 Ce kt ,此時的 k 便是指數中時間 t
對於給定的一個 x 值,經過某一對應方式後得到「唯一」的 y 值,這種對應方式我們稱 為函數,其中 x 是自變數,y 是應變數。. 而在表
持續測定反應物濃度[A] t 隨時間t 之變化.. 化學網站版
活用建築物本身擁有的磁場特性進行定位 ,因此可用來解決 上述問題。利用實驗型App取得智慧型手機地磁場感應器的數據,接著
第一階段: 讓學生接觸不同的感官刺激 第二階段: 對感官刺激的改變有察覺反應 第三階段: 對感官刺激有一貫的反應..
All necessary information is alive in IRIS, and is contin- uously updated according to agreed procedures (PDCA) to support business processes Data Migration No analysis of