國立宜蘭大學生物技術研究所 碩士論文
Institute of Biotechnology National Ilan University
Master Thesis
注射 c-mos siRNA 對豬卵母細胞成熟、受精及發育的影響
The effects of injecting c-mos siRNA on maturation, fertilization and development of porcine oocyte
指導教授:陳銘正博士
Advisor:Ming-Cheng Chen, Ph. D.
研究生:朱建安 Advisee:Jian-An Ju
中華民國九十六年 七月
摘要
本 研 究 之 目 的 在 於 藉 由 顯 微 注 射 c-mos 小 干 擾 核 醣 核 酸 ( small interference RNA, siRNA)到豬卵丘卵母細胞複合體(cumulus-oocyte complexes, COCs),觀察其對卵母細胞成熟形態學、c-mos mRNA 表現量及隨後體外受精
(in vitro fertilization, IVF)或 ICSI(Intracytoplasmic sperm injection, ICSI)卵 受精與發育的影響。為了解正常卵母細胞成熟過程形態學及 c-mos mRNA 表現 量的變化,本試驗分別逢機選取成熟培養期間 0, 12, 24, 36 及 44 小時的卵母細 胞,進行 RT-realtime PCR 檢驗 c-mos RNA 表現量,並用位相差及螢光顯微鏡 術觀察其形態學變化。為避免顯微注射傷害卵母細胞,因此在注射前,NCSU-23 成熟培養液分別添加1 μg/ml、10 μg/ml的 cycloheximide,並培養 8 小時後進 行 卵 母 細 胞 的 穿 刺 ( penetration ), 再 培 養 44 小 時 , 比 較 兩 種 濃 度 的 cycloheximide 是否可以增加豬卵母細胞穿刺後的存活率。構築 c-mos siRNA 後,將 c-mos siRNA 注射到未成熟卵母細胞細胞質,成熟培養 44 小時,去除 卵丘細胞,繼續培養 16 小時。在培養 12 小時與 24 小時分別檢驗卵母細胞 核成熟及 c-mos 基因表現量。最後將已注射 c-mos siRNA 的卵母細胞分別進行 體外受精及精子顯微注射,IVF 卵母細胞培養 7 日,ICSI 的卵母細胞培養 16 小 時,分別觀察卵母細胞的受精與發育情形。結果顯示,生發泡的瓦解發生於成 熟培養 12-24 小時期間,24 小時之後成熟率開始逐漸上升,培養 44 小時達到 最高;c-mos mRNA 表現量在培養 12 小時達到最高,12 小時後便逐漸下降。
經由 1 μg/ml cycloheximide處理的豬卵母細胞存活率為 78.5 %,顯著高於對
照組的 36.9 %(p<0.05)。卵母細胞經 c-mos siRNA 注射後,不影響卵母細 胞成熟的過程,但是培養至 60 小時,有 57.5 %卵母細胞致活,且 c-mos 基因 表現量有下降的現象。而 IVF 之後 siRNA 注射組雄原核形成率為 49.5 %,與 僞注射對照組(28.6 %)比較有顯著差異(p < 0.05),且培養至 7 日,有 5 % 的胚,其分溝細胞數超過 10 細胞。ICSI 之後,注射 c-mos siRNA 的卵母細胞 致活率與雄原核形成率為 80.97 %與 22.57 %,顯著高於僞注射組者(64.57
%與 0 %)。綜合上述結果證明注射 c-mos siRNA 對於卵母細胞之成熟作用及 隨後之受精與發育能力,確實有顯著之影響效果。
英文摘要
The objective was to study c-mos small interference RNA(siRNA) by microinjecting to porcine cumulus-oocyte complexes(COCs)which influenced maturation morphology, c-mos mRNA expression quantity, fertilization and development of porcine oocytes after in vitro maturation(IVM), fertilization(IVF) or intracytoplasmic sperm injection(ICSI) . In order to understand the variation of normal oocyte maturation morphology and c-mos mRNA expression quantity, ovarian oocytes randomly selected and subjected to maturation in vitro for 0, 12, 24, 36, and 44 h respectively. Subsequently, these oocytes were subjected to examination of c-mos mRNA expression by RT- realtime PCR and their morphology by phase-contrast and fluorescence microscopy. Microinjection could damage the oocytes,so weadded 1 μg/mlor10 μg/mlcycloheximideto NCSU-23 maturation medium respectively and cultured the oocytes for 8 h before those were punctured. After 44 h of maturation culture in vitro, these oocytes were compared whether the two concentration cycloheximide treatment could increase the proportion of survival oocyte. The c-mos siRNA was injected directly into the cytoplasm of an oocyte. After 44 h of maturation culture, these oocytes were removed cumulus cell and cultured for another 16 h. These oocytes were examined the variation of nucleus maturation and c-mos mRNA quantity during the culture
siRNA were fertilized in vitro (IVF) or injected sperm (Intracytoplasmic sperm injection, ICSI) respectively. After fertilization, the oocytes were cultured for 7 day.
After ICSI, the oocytes were cultured for 16 h. I examined the variation of morphology during the culture period. The results showed that germinal vesicle breakdown occurred during the 12 to 24 h of culture, then the oocyte maturation rate were increased gradually after 24 h of culture, and reached the highest at 44 h.
The highest quantity of c-mos mRNA could attain at 12 h of IVM culture, then decreased gradually. The survival rate of oocytes via 1 μg/ml cycloheximide treatment(78.5 %)was significantly(p<0.05) higher than that of the control group(36.9 %).After injecting c-mos siRNA to oocytes, the process of maturation oocyte was not influenced, but c-mos gene expression declined, and 57.5 % oocytes were activated at 60 h of culture. After in vitro fertilization, the percentage of male pronucleus formation in oocytes that were injected c-mos siRNA(49.5 %)
was significantly(p<0.05)higher than that in the punctured oocytes(28.6 %).
Five percentage of fertilized oocytes that were injected c-mos siRNA developed to the 10 cells morula stage. After ICSI, The rates of activation(80.97 %) and male pronucleus formation(22.57 %) of oocytes that were injected c-mos siRNA were higher than those of punctured oocytes(64.57 %, 0 %).These results suggest that injecting c-mos siRNA to porcine oocytes can influence oocyte maturation, fertilization and development.
誌謝
時光飛逝,三年的研究所生活很快就過去了,能夠順利畢業,多虧了許多 幫助我的人,在此我必須感謝大家。
首先要感謝指導老師陳銘正博士不辭辛勞的教導,在關鍵的時刻引導我論 文的方向。感謝兩位口試委員鄭登貴博士、林佳靜博士特別撥空參與我的論文 口試,指導我修改論文初稿,並且提供寶貴的意見,無論是在撰寫論文或是口 試的過程,都獲益良多。感謝林育安老師實驗上的幫忙與配合。感謝畜產試驗 所宜蘭分所 real-time PCR 儀器的商借及蕭孟衿學姊的指導。感謝宜蘭縣肉品 市場及福昌豬場分別提供寶貴的母豬卵巢及公豬精液。
接著感謝同班同學兼飯友周宏達、林泳沖、耿念祖、丘后妍等人的鼓勵。
感謝研究生學弟沈偉仁於實驗上的幫忙,特別是精子顯微注射的部分。感謝大 學部學弟妹張俊瑄、邱昱凱、周佶平、彭鈺婷、陳建霖、張育京、曾聖倫、楊 雅琳、洪若綺、季冠丞、倪國偉、朱輔群、徐漢民、李文函、侯佳妤、簡志明 等人在實驗上的幫忙,以後我會懷念大家半夜去屠宰場採卵巢,一起奮鬥做實 驗的日子。
最後感謝家人與女友吳姿璉給予精神上的支持與鼓勵,讓我無後顧之憂,
全力衝刺,並且完成論文。
目錄
頁次 摘要……… I 英文摘要………..III 誌謝………...…………V 目錄………..………VI 圖次………..……….X 表次……….………XII 附次………...………XIII
壹、 前言………..………1
貳、 文獻檢討………..………2
一、 卵母細胞的成熟受精與發育………...………2
(一) 卵母細胞的成熟………..………2
(二) 受精作用………..………5
(三) 胚的發育………..……6
二、 訊息分子對於卵母細胞成熟、受精與發育的調控………7
(一) 濾泡環境中的訊息分子對卵母細胞成熟、受精與發育的調控………7
(二) 卵母細胞內訊息分子對成熟與受精的調控………..………8
1. 細胞內訊息分子對卵母細胞成熟的調控………..………8
2. 細胞內訊息分子對卵母細胞受精的調控………..………….…….10
(三) 細胞內影響卵母細胞的重要分子………10
1. MPF………..………..10
2. MAPK………..………..13
3. c-Mos………..………15
(一) c-Mos、MAPK 對卵母細胞成熟的影響………..………15
1. 影響卵母細胞第一次減數分裂的恢復………...………...16
2. 影響卵母細胞停頓在第二次減數分裂中期…………..………….……….16
三、 RNA 干擾用於卵母細胞之研究………17
(一) RNAi pathway………..………..19
(一) 干擾RNA 的類型及對卵母細胞的應用性……….……….21
1. 反義股RNA……….21
2. 長片段雙股RNA……….21
3. miRNA……….……….22
4. shRNA……….23
5. siRNA………...23
參、 材料與方法………26
一、 siRNA 的設計與製備………26
(一) 轉錄模板的製備………....27
(二) 雙股RNA的合成………....27
(三) siRNA的純化……….29
二、 豬卵母細胞體外成熟、受精與發育的培養………29
(一) 體外成熟………29
(二) 體外受精………....30
(三) 體外發育………....31
三、 顯微注射卵存活率提升試驗……….…………31
四、 c-mos siRNA 顯微注射………..………32
五、 精子顯微注射………...34
六、 形態學觀察……….………34
(一) Hoechst 33258 螢光染色……….………..34
(二) Lacmoid 染色………....35
七、 RNA 萃取………36
(一) 藥品配製………....36
1. Denature solution………..36
2. 2M Sodium acetate pH4.0(2M NaOAC)………36
(二) RNA 萃取流程………...36
八、 RT 與 realtime PCR……….………37
(一) RT合成cDNA……….………....37
(二) 即時定量PCR(realtime PCR)………...37
九、 試驗設計……….………39
(一) 豬卵母細胞成熟期間形態學及c-mos mRNA 表現量的變化………39
(二) cycloheximide 處理是否會增加被穿刺卵母細胞的存活率…………...40
(三) 注射c-mos siRNA 對豬卵母細胞成熟的影響……….………40
(四) 注射c-mos siRNA 對豬卵母細胞受精與發育的影響………...41
(五) 注射c-mos siRNA對豬卵母細胞精子顯微注射的影響………..41
肆、 結果………42
一、 豬卵母細胞成熟期間形態學及 c-mos mRNA 表現量的變化………….42
(一) 豬卵母細胞在成熟期間之形態學變化………....42
(二) 豬卵母細胞成熟期間c-mos mRNA 表現量的變化………47
二、 被穿刺卵母細胞存活率提升試驗………52
三、 注射 c-mos siRNA 對豬卵母細胞成熟的影響………56
四、 注射 c-mos siRNA 對豬卵母細胞受精與發育的影響………60
五、 注射 c-mos siRNA 對豬卵母細胞精子顯微注射的影響………68
伍、 討論………70
陸、 結論………..76
柒、 參考文獻………....………77
捌、 附錄………..……….83
圖次
頁次
圖 1. GV 與 MII 時期的卵母細胞。………3
圖 2. 非洲爪蟾蜍卵母細胞成熟期間訊息分子之間的關係。….………9
圖 3. 非洲爪蟾蜍卵母細胞受精期間訊息分子之間的關係。……...…………11
圖 4. MPF 於減數分裂期扮演的角色。………...………14
圖 5. RNAi 路徑。………20
圖 6. siRNA 構築流程。………28
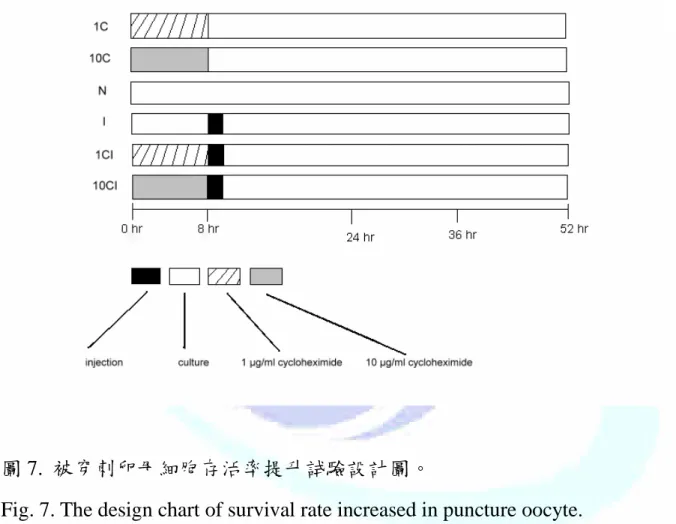
圖 7. 被穿刺卵母細胞存活率提升試驗設計圖。………...………33
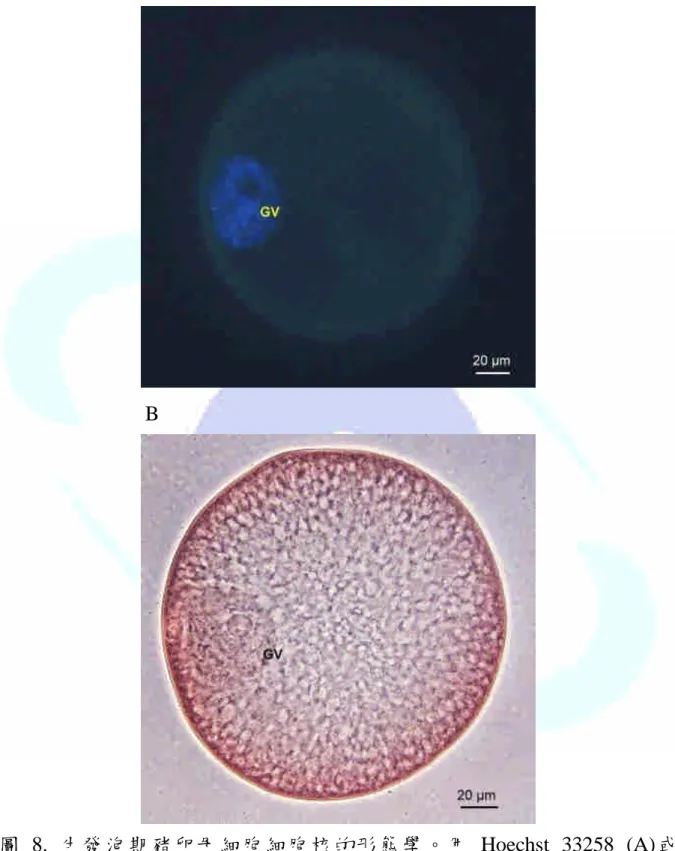
圖 8. 生發泡期豬卵母細胞細胞核的形態學。………..………43
圖 9. 生發泡瓦解期豬卵母細胞細胞核的形態學。………44 圖 10. 第一次減數分裂中期豬卵母細胞細胞核的形態學。………….………45
圖 11. 第二次減數分裂中期豬卵母細胞細胞核的形態學。………46
圖 12. 豬卵母細胞 0–44 小時培養期間細胞核的成熟。……….………….…48
圖 13. 即時定量RT-PCR β-actin 的增幅曲線與裂解曲線。…………..……49
圖 14. 即時定量RT-PCR c-mos 的增幅曲線與裂解曲線。………..……..50
圖 15. 卵母細胞成熟期間 c-mos 基因的 mRNA 表現量。………..51
圖 16. 死亡豬卵母細胞以 Hoechst 33258 或 lacmoid 染色的影像。……..……53
圖 17. cycloheximide 的處理對卵母細胞存活與成熟的影響。………54
圖 18. 以 4 % 含溴乙錠的電泳膠顯示 c-mos siRNA(21 bp)。…...………….57
圖 19. 注射 c-mos siRNA 對豬卵母細胞成熟 12 小時及 44 小時 c-mos 基因 表現的影響。………...……….……….…58 圖 20. 注射 c-mos siRNA 對豬卵母細胞成熟培養 12~44 hr 期間核成熟的影
響。……….………..……59 圖 21. 致活卵母細胞以 Hoechst 33258 或 lacmoid 染色的影像。……..………61 圖 22. 注射 c-mos siRNA 對卵母細胞致活的影響。……….…….……..…62 圖 23. 受精的卵母細胞以Hoechst 33258或lacmoid染色的影像。……….63 圖 24. 2細胞期的胚以Hoechst 33258或lacmoid染色的影像。………..64
表次
頁次
表 1. c-Mos 對於各物種 GVBD、MPF 活性及 MⅡ停頓的影響。…….…………18
表 2. 注射c-mos siRNA 對於豬卵母細胞受精的影響。……….……65
表 3. 注射c-mos siRNA 對於豬卵母細胞卵裂的影響。……….…………66
表 4. 注射c-mos siRNA 對於豬胚發育的影響。……….…………67
表 5. 注射c-mos siRNA對豬卵母細胞精子顯微注射的影響……….……69
附次
頁次
附錄 1. 抗生素生理鹽水。………..………..….………83
附錄 2. Dulbecco 磷酸緩衝鹽溶液(D-PBS)。………...………84
附錄 3. North Carolina State University- 23 培養液(NCSU-23)。….………85
附錄 4. 精子洗滌液。……….…86
附錄 5. 精子體外獲能培養液。……….………87
附錄 6. 精子體外受精培養液。……….………88
附錄 7. 胚培養液(NCSU-23+BSA)。………..………89
附錄 8. TL-HEPES 緩衝液。………..………90
壹、 前言
卵母細胞從生發泡(germinal vesicle, GV)到第二次減數分裂中期的成 熟過程中,參與的訊息傳導分子複雜,其中重要的因子包括 c-Mos 蛋白、
mitogen 活化蛋白因子(mitogen-activated protein factor, MAPK)及成熟促進 因子(maturation-promoting factor, MPF)等,且部份分子在豬卵母細胞成熟、
受精及發育所扮演的角色仍不清楚,因此發展一套能用來探討卵母細胞訊 息傳導過程的工具是重要的。2003 年 Ohashi et al.運用 c-mos 反義股
(antisense)RNA,以顯微注射的方式將其打入豬卵母細胞,藉此抑制 c-mos 基因表現,研究其在卵母細胞成熟期間所扮演的角色。此方式雖成功抑制 基因表現,但是反義股 RNA 若超過 30 bp,會活化蛋白激酶 R(protein kinase R, PKR),使真核轉譯起始因子 2α(eIF2α)被磷酸化而去活性,導致多種 基因無法表現,以此引發非特異性默化效應(non-specific silencing effects), 甚至造成細胞死亡;而小干擾 RNA(small interference RNA, siRNA)只有 21~25 bp,能避開此影響。因此本試驗之目的在於藉由顯微注射豬 c-mos siRNA 到未成熟豬卵母細胞,觀察其對卵母細胞成熟、受精及發育的影響。
貳、 文獻檢討 一、 卵母細胞的成熟、受精與發育
(一)卵母細胞的成熟
未成熟卵母細胞會分泌醣蛋白,在細胞膜表面形成一透明帶(zona pellucida),通常外圍圍著一群卵丘細胞(粒性細胞),卵丘與卵母細胞的結 合稱之為卵丘卵母細胞複合體(cumulus-oocyte complexes, COCs),卵母細 胞藉著細胞質突起,穿越透明帶,與卵丘細胞靠著間隙接合(gap junction)
連接,卵丘細胞以此提供許多因子,例如一些胺基酸與核甘酸,幫助卵母 細胞的成熟。卵母細胞的成熟一般乃指卵母細胞從第一次減數分裂前期到 第二次減數分裂中期的過程。大致分為兩個層次,分別是細胞核成熟
(nuclear maturation)及細胞質成熟(cytoplasm maturation)。
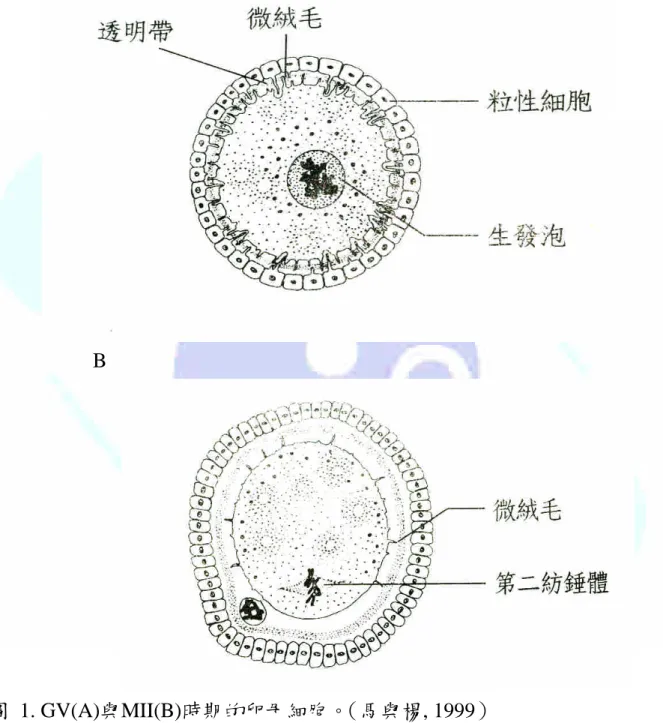
以形態學分析核的成熟,卵母細胞從母體出生到發情期之前,會從卵 原細胞發育到第一次減數分裂前期的雙帶期(diplotene)停止,又稱核網期
(dictyage stage),此時卵母細胞位於濾泡內,細胞內會形成一個大核,稱 之為生發泡(germinal vesicle, GV),染色體就位於此,如圖1-A所示,核網 期之卵母細胞,會合成大量的mRNA與rRNA,稱之為母源性RNA(maternal RNA),供成熟後的卵母細胞與受精後的胚使用。生發泡除了有染色體之 外,其內也含一些未知物質,對卵母細胞的成熟也是很重要的,這些物質 我們統稱生發泡質液(germinal vesicle materials)。據Sugiura et al.(2006)
A
B
圖 1. GV(A)與MII(B)時期的卵母細胞。(馬與楊, 1999)
Fig. 1. The oocytes in GV stage(A) and MII stage(B).
與Ogushi et al.(2005)之研究結果顯示,在豬卵母細胞發育過程中,生發 泡質液或核質會影響成熟促進因子(Maturation / M phase-promoting factor, MPF)中週期素(cyclin B)堆積的調控。除此之外,還會影響卵母細胞在受 精過程中雄原核的形成,因此其對於細胞核或細胞質的成熟都扮演重要的 角色。當母體進入發情期後,卵母細胞外的濾泡環境會受母體內激性腺素 刺激,如激濾泡素(follicle stimulating hormone, FSH) 及排卵素(luteinizing hormone, LH),產生一些特殊的訊息(一些類固醇內泌素),如:動情素
(estrogen)與助孕固酮(progesterone),造成第一次減數分裂恢復,生發 泡瓦解(germinal vesicle breakdown, GVBD),染色體開始濃縮。之後第一 極體(first polar body)排出,卵母細胞進入第二次減數分裂,並停頓在中 期(metaphase two, MⅡ;如圖1-B所示)。然而完成第二次減數分裂,第二 極體排出,是發生在受精之後。至於細胞質成熟主要是發生在受精之後,
卵母細胞內麩胱甘肽(glutathione)量增加,使精子內部之魚精蛋白被分解,
而 由 組 蛋 白 取 代 , 造 成 精 子 頭 部 膨 脹 現 象 , 此 時 精 子 開 始 去 濃 縮
(decondensation),經過4~7小時,親代之染色體(精子與卵母細胞的染色 體)會被明顯的膜圍繞,以此形成原核(pronuclei),而雄原核與雌原核相 比,是兩者中較大的。上述一連串反應乃是卵母細胞細胞質成熟的指標(Sun and Nagai, 2003)。
(二)受精作用
受精前精子必須經過獲能作用(capacitation),獲能作用就是使精子獲 得受精能力的作用。精子原屬於獲能狀態,但是在其經過附睪導管時,與 前列腺等腺體所提供的精漿接觸之後,其內的一些醣蛋白分子會覆蓋精子 頭部,使其暫時失去受精的能力,稱之為去獲能作用(decapacitation),此 也是讓精子延長受精能力的機制。未獲能的精子一旦通過母體陰道之後,
覆蓋於其頭部表面的醣蛋白受到雌性生殖道內環境因子的影響,開始剝 落,再次獲得受精能力。精子經過獲能作用之後,於受精時會產生頭巾反 應,此時精子頭部的膜會產生孔洞,釋出琉璃醣碳基酸酶(hyluronidase),
消化圍繞於COCs之琉璃醣碳基酸,使受精作用更容易進行。受精時卵母細 胞鈣離子會上升,導致細胞內皮質顆粒(cortical granule)的釋放,產生皮 質反應(cortical reaction),釋放一些酶,作用於透明帶,使其結構改變,
防 止 多 精 入 卵 的 發 生 。 皮 質 顆 粒 所 釋 放 的 酶 , 包 括 : protease 與 β-hexosaminedase B,前者可分解透明帶上之ZP2(zona pellucida);而 β-hexosaminedase B可分解ZP3上之接受體,使透明帶變性,不溶於頭巾素。
鈣離子的釋放除了會引起皮質反應之外,還會使CSF(cytostatic factor)與 MPF(maturation promoting factor)被破壞,使卵母細胞突破MⅡ期,完成 減數分裂。
(三)胚的發育
受精之後,受精卵開始進行有絲分裂,兩日內第一次卵裂(cleavage)
就會發生,進入到二細胞期。8-16 細胞時期發生緊壓作用(compaction)此 時胚的體積不會改變,而細胞數會越來越多,此等分裂之細胞又稱分溝細 胞 ( blastomere ), 七 日 內 會 經 由 緊 密 桑 椹 胚 發 育 形 成 腔 室 的 囊 胚
(blastocyst),此時細胞分為內細胞群(inner cell mass, ICM)與滋養層細胞
(trophectoderm cell)。卵母細胞於受精之後仍然使用母源性 mRNA,提供 發育所需的蛋白質,至於受精卵何時開始進行轉錄作用,在物種上是有差 異的,例如:小鼠為二細胞、豬為四細胞、人類為四至八細胞,牛與羊為 八至十六細胞。卵母細胞無論是細胞核或細胞質的成熟,在其細胞內或周 圍環境,從成熟、受精到發育的各階段,其過程都有許多分子參與,牽涉 到許多複雜的訊息傳導機制,有待我們去了解。以豬卵母細胞來說,先前 的研究大都著重於體外成熟(in vitro maturation, IVM)、體外受精(in vitro fertilization, IVF)及體外培養(in vitro culture, IVC)的系統建立,尋找最 適當的培養環境。對於豬卵母細胞訊息傳導的研究,直到近幾年分子生物 學領域越來越發達,研究細胞與分子之間關係的報告才越來越多,若對於 這些分子的功能與機制了解透徹,將有助於 IVM、IVF 與 IVC 系統的發展。
二、 訊息分子對於卵母細胞成熟、受精與發育的調控
(一) 濾泡環境中的訊息分子對卵母細胞成熟、受精與發育的調控
卵巢中濾泡的生長發育對於卵母細胞的成熟是很重要的,原始尚未發 育的濾泡被稱之為始基濾泡,(primordial follicle),當濾泡開始生長之初,
形成初級或腔前濾泡(primary or preantral follicle);之後,粒性細胞會增殖,
並分泌濾泡液,此時形成腔室,又稱次級或有腔濾泡(secondary or antral follicle);之後便逐漸生長為排卵前濾泡(preovulatory follicle)。濾泡環境 內影響卵母細胞成熟的因子很多,其中重要的因子有激濾泡素(follicle stimulation hormone, FSH)、排卵素(luteinizing hormone, LH)、動情素
(estrogens)及助孕固酮(progesterone)等。FSH 由腦垂腺前葉所分泌,
於卵巢中主要作用於濾泡內的粒性細胞。LH 也是由腦垂腺前葉所分泌,主 要作用於濾泡膜細胞與粒性細胞,於排卵前產生潮湧現象,促使卵母細胞 完成成熟階段,隨後發生排卵。
雌素二醇 17β(estradiol17β)與雌素酮(estrone)均為動情素,主要由 LH 刺激濾泡膜細胞所分泌,最後藉由 FSH 刺激粒性細胞,使雄性素進行 芳香化轉化為動情素。在有腔濾泡生長至排卵前濾泡期間,動情素會大量 產生,並且在排卵後的黃體階段維持一定的量,其主要功能在於能與 FSH 聯合刺激粒性細胞外層 LH 結合位的產生,此結合位的產生與濾泡轉向排卵 前濾泡有著密切的關係,除此之外,動情素在受精之後還能幫助子宮內膜
的增生。助孕固酮主要由 LH 刺激濾泡膜細胞與粒性細胞而分泌,可影響卵 母細胞 GVBD 的發生與 MⅡ的停頓,除此之外,於懷孕期間幫助子宮的維 持(馬與楊, 1999)。
(二)卵母細胞內訊息分子對成熟與受精的調控 1. 細胞內訊息分子對卵母細胞成熟的調控
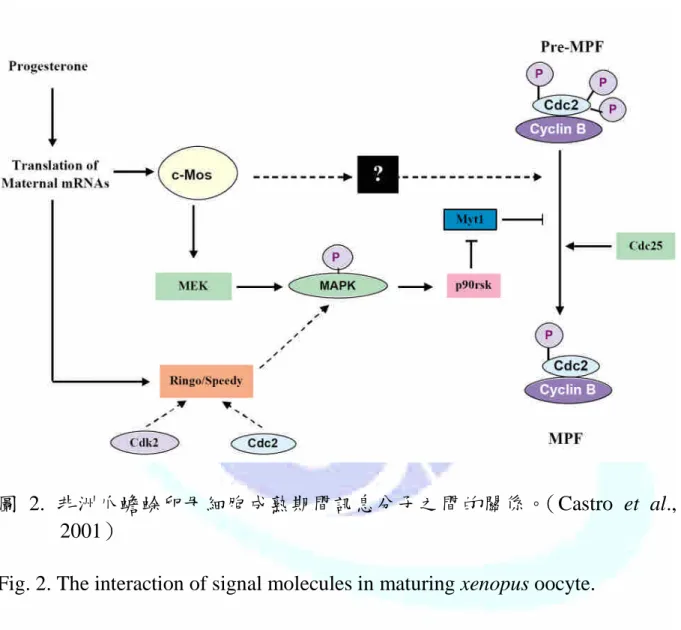
爪蟾蜍卵母細胞的成熟主要受到助孕固酮(progesterone)控制,助孕 固酮影響母源性的 mRNA 表現,此後分為兩條路徑如圖 2 所示,茲分述如 下:
(1)母源性 mRNA 表現 c-Mos 蛋白,此時 c-Mos 蛋白處於不穩定狀態,
被熱緊迫蛋白 90(heat shock protein 90, Hsp90)磷酸化之後才具有活性
(Schmitt and Nebreda, 2002)。有活性的 c-Mos 蛋白活化 Mitogen 活化蛋白 因子(Mitogen-activated protein factor, MAPK),造成 MAPK 磷酸化發生,
產生 90 KDa 核糖體 S6 蛋白激酶(90 KDa ribosome S6 protein Kinase, p90rsk),p90rsk 會抑制梅林轉錄因子 1(Myalin transcription facter 1, Myt1)
的產生。缺乏 Myt1 就無法有效抑制 preMPF 轉變為 MPF,因此卵母細胞可 以產生具有活性的 MPF。至於 c-Mos 會不會直接影響 pre MPF 轉變為 MPF,
目前尚無直接證據可以證明。
圖 2. 非洲爪蟾蜍卵母細胞成熟期間訊息分子之間的關係。(Castro et al., 2001)
Fig. 2. The interaction of signal molecules in maturing xenopus oocyte.
(2)母源性 mRNA 表現 Ringo/Speedy,配合細胞分裂蛋白激酶 2(cell
division protein kinase 2, Cdk2)及 Cdc2 的輔助,活化 MAPK,之後進入一 系列的反應,產生有功能的 MPF。卵母細胞內有足夠具有活性的 MPF,可 以刺激卵母細胞恢復減數分裂,發生 GVBD,最後停頓在第二次減數分裂 中期,完成卵母細胞核的成熟作用。
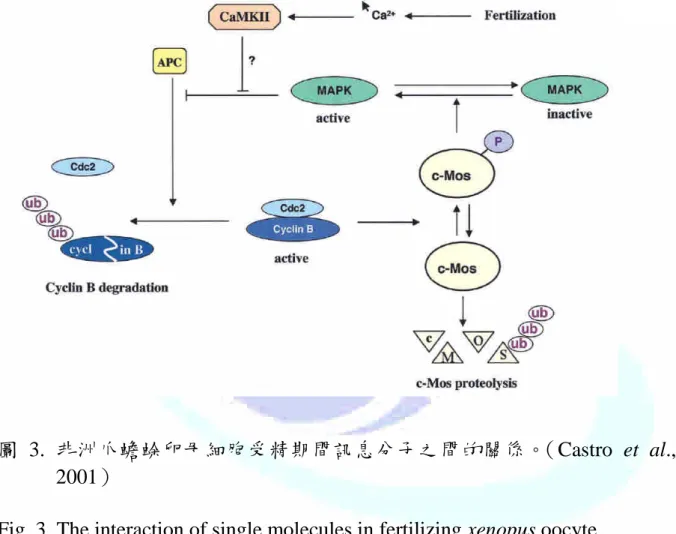
2. 細胞內訊息分子對卵母細胞受精的調控
如圖3所示,卵母細胞被受精之後,細胞內鈣離子濃度上升,導致 Ca2+-calmodulin kinase II(Ca2+MK II)被活化,藉此抑制MAPK的活性,使 APC(anaphase-promoting complex)無法被抑制,造成MPF被分解,MPF 一旦被分解,c-Mos除了不能進行磷酸化之外,已磷酸化的c-Mos將被去磷 酸化,最後所有的c-Mos都會被分解,MAPK也無法活化(Castro et al., 2001)。這一連串的過程將導致細胞週期的啟動,卵母細胞突破第二次減 數分裂中期,進入到後期。
(三)細胞內影響卵母細胞的重要分子
參與卵母細胞生長的訊息分子很多,而且複雜,茲以 MPF、MAPK 及 c-Mos 蛋白為例,說明他們在卵母細胞成熟、受精與發育期間所扮演的角 色。
1. MPF
Masui and Markert(1971)從Rana pipiens的蛙卵萃取出有活性的
圖 3. 非洲爪蟾蜍卵母細胞受精期間訊息分子之間的關係。(Castro et al., 2001)
Fig. 3. The interaction of single molecules in fertilizing xenopus oocyte.
細胞質液,將其注射到 G2 期未成熟的卵母細胞,能夠啟動卵母細胞的成 熟,他們將這種有活性的物質稱為成熟促進因子 MPF。MPF 由兩個次單位 蛋白質所構成,分別是細胞分裂控制蛋白 2(Cell division control protein 2, Cdc2)與細胞週期素 B(Cyclin B)。Cyclin B 於卵母細胞中有 cyclin B1 與 cyclin B2 兩種型式,卵母細胞的成熟作用主要由 cyclin B1 控制,而 clyclin B2 只 是扮演輔助的角色(Kuroda et al., 2004)。MPF 原處於磷酸化狀態,稱之為 前 MPF(pre MPF),必須要藉著 Cdc 25 的幫助,使其去磷酸化,成為有功 能的 MPF。在 Dai et al.(2000)報告指出,Cdc25 mRNA 轉譯作用的停頓,
會抑制 GVBD 及紡垂體形成。比較卵母細胞成熟期間 MPF 量的變化,發現 GVBD 發 生 時 , MPF 量 提 高 , 在 第 一 次 減 數 分 裂 後 期 - 末 期 時
(anaphase-telophase)下降,直到第二次減數分裂中期(MⅡ)才再度提升。
至於 MPF 在成熟期間的功能,主要是幫助卵母細胞由 G2 期進入減數分裂 期(Sun and Nagai, 2003),使其停頓在 MⅡ,如圖 4 所示。然而在受精時,
細胞內鈣離子的上升,引起 MPF 瓦解,致使卵母細胞越過 MⅡ期,完成減 數分裂。
在受精之後,受精卵進行卵裂,每當細胞要進行分裂時,MPF的活性 都會上升(Tunquist et al., 2003)。受精卵開始進行有絲分裂時,MPF在有絲 分裂的三個時期扮演不同的角色。在G1期時,MPF藉由磷酸化Rb蛋白,使 Rb蛋白無法抑制轉錄因子E2F,讓進入S期所需的蛋白質表現。在G2期時,
MPF 功 能 與 減 數 分 裂 一 樣 , 間 接 磷 酸 化 構 成 核 膜 的 重 要 蛋 白 質 lamine
(nuclear lamine),使lamins去聚合化(depolymerize),最後造成核膜瓦解。
MPF也會磷酸化染色體聚合蛋白質(chromosome-associated proteins),其中 包含組蛋白(histones)及其他染色體濃縮所需的蛋白質,驅動從G2期進入 M期時染色體的濃縮。當有絲分裂進入中期(Metaphase),姐妹染色分體以 cohesin蛋白連結,若要進一步由分裂中期近入到末期,則必須分解cohesin,
分解酶separin在此時擔任分解cohsin的工作。另一個蛋白securin則會抑制 separin的活性,使姐妹染色分體維持結合態。在分裂中期MPF的功能在於產 生後期控制複合體(anaphase-promoting complex),使其分解securin,最後 讓姐妹染色體分體分離,進入到後期(Becker et al., 2003)。
2. MAPK
MAPK是一種磷酸化酶,對於卵母細胞成熟和隨後胚的發育都扮演重 要的角色。在卵母細胞成熟過程中,MAPK由上游激酶c-Mos蛋白所控制,
在GVBD時期開始被活化,之後都保持相當高的活性,直到卵母細胞停頓在 MⅡ 期 。 MAPK 分 為 兩 型 , 分 別 是 胞 外 訊 息 調 控 激 酶 1 ( extracellular signal-regulated kinase 1, ERK1)及ERK2(Sun et al., 2001)。在非洲爪蟾蜍
(Xenopus)卵母細胞成熟期間,MAPK會活化MPF,導致GVBD發生,但 是在小鼠和海星這兩物種上,MPF的活化不需要MAPK的參與,因此MAPK 是否參與卵母細胞成熟期間減數分裂的恢復,有物種上的差異。當卵母細 胞有機會與精子完成受精作用,受精卵進步進行有絲分裂時,MAPK藉著
圖 4. MPF 於減數分裂期扮演的角色。
Fig. 4. The role of MPF in meiosis phase.
Ras 路徑調控轉錄因子,幫助細胞進行轉錄作用,促使細胞週期由G1期進 入到S期(Becker et al., 2003.)。
3. c-Mos蛋白
c-mos基因是一個原致癌基因(protooncogene),最早發現於鼠科的肉瘤 病毒(Moloney murine sarcoma virus),被認為是一個轉型基因(transforming gene)(Frankel and Fischinger, 1976 ; Vande Woude et al., 1980.)。Goldman et al.(1987)指出,c-Mos蛋白會特異性的表現在小鼠的雄性和雌性生殖細胞
(male and female germ cells)。於非洲爪蟾蜍,c-Mos 除了調控減數分裂的 起始(initiates)(Sagata et al., 1988)和過程(progression)(Kanki and Donoghue, 1991)外,也能活化細胞靜止因子(cytostatic factor, CSF),使減數分裂停 頓於MⅡ期,等待受精(Sagata et al., 1989),因此c-Mos在非洲爪蟾蜍卵的 成熟過程中扮演著重要的角色。但是在哺乳動物中,c-Mos的功能仍然是不 清楚,在c-mos基因剔除鼠的研究顯示,當c-Mos蛋白不存在時,MAPK不活 化,但是MPF仍然可以活化,而且GVBD仍然正常發生(Araki et al., 1996.), 顯然哺乳動物c-mos的作用機制與非洲爪蟾蜍不同。
(四)c-Mos、MAPK 對卵母細胞成熟的影響
除了小鼠之外,許多哺乳動物的卵母細胞,其成熟過程是否需要 c-Mos 與 MAPK 的調控,仍然是有爭議的。使用更新的技術來解決這疑問是迫切 需要的。Ohashi et al.(2003)使用 antisense RNA 干擾技術,配合顯微操作,
希望能解決這個問題。其以豬為模式,注射豬 c-mos 蛋白的訊息 RNA
(mRNA)或反義股 RNA(antisense RNA)到豬卵母細胞,檢測 c-Mos 在 卵母細胞成熟期間扮演的角色。在 c-Mos mRNA 注射到卵母細胞後,發現 MAPK 磷酸化提早發生,而且在培養 24 小時候 GVBD 比率比對照組高。
而注射 c-Mos 反義股 RNA 到卵母細胞,雖然在成熟期間可以完全抑制 MAPK 的磷酸化,並且影響 MPF 活性,但是不影響 GVBD 的發生。
MAPK 是否影響豬卵母細胞的成熟過程,我們可分成兩方面來探討:
1. 影響卵母細胞第一次減數分裂的恢復
如前所述,注射 c-mos 反義股 RNA 到豬卵母細胞,抑制了 MAPK 的 活性,但是不影響 GVBD 的發生。另有研究指出,在成熟培養液中添加 MAPK 的抑制劑 PD98059 及 U0126,可以抑制卵丘卵母細胞複合體及裸露 的卵母細胞 MAPK 的活性,也可抑制卵丘卵母細胞複合體 GVBD 的發生,
但是裸露的卵母細胞 GVBD 卻不被抑制 (Meinecke et al., 2003;Fan et al., 2003)。
2. 影響卵母細胞停頓在第二次減數分裂中期
進行第二次減數分裂中期的卵母細胞,高量的 MAPK 及 MPF 會促進細 胞靜止因子(Cytostatic factor, CSF)的活化,使卵母細胞再次停頓於 MII。
Fan et al. (2003)的研究指出,使用 U0126 抑制 MAPK 後,豬卵母細胞便 無法停頓在 MⅡ。Ohashi et al.(2003)研究顯示,將 c-mos 反義股 RNA 注
射到 GV 時期的豬卵母細胞,使 MAPK 不活化,部分的卵母細胞會從 M I 期 致活,其餘的卵母細胞則在 MⅡ期發生致活。
c-Mos 對 GVBD 及 MPF 活性的影響,有物種的差別,表 1 為 c-Mos 對 各物種的影響,顯示除了爪蟾蜍之外,大部分的脊椎動物卵母細胞 GVBD 的發生,不會受到 c-Mos 活化的影響。
三、RNA 干擾用於卵母細胞之研究
Napoli et al.(1990)首次在牽牛花(petunias)發現 RNA 干擾(RNA interference, RNAi)的現象,RNAi 為一種干擾基因表現的技術,主要目的 在於藉著抑制特定基因表現來探討此一基因之功能,並知道其對細胞或動 物個體的影響。對於細胞層面,RNAi 是一個探討訊息傳導的好方法;對於 動物個體層面來說,永久的抑制或短暫的抑制基因表現,都可以運用 RNAi 來達成。永久的抑制乃指,構築 RNA 干擾表現载體,直接將 DNA 送入宿 主,並插入染色體,俾造成宿主永久表現干擾 RNA。至於短暫的抑制乃是 直接將干擾 RNA 送入宿主,可在短期內得到抑制效果,但是干擾 RNA 很 快就被細胞內的酵素所分解,因此稱為短暫的抑制表現系統。干擾 RNA 大 致分為五類型,分別是反義股 RNA(antisense RNA)、長片段雙股 RNA
(long-double stranded RNA, long-dsRNA)、micro RNA(miRNA)、short hairpin RNA(shRNA)及小干擾 RNA(small interference RNA, siRNA)。
表 1. c-Mos 對於各物種卵母細胞成熟期間 GVBD、MPF 活性及 MⅡ停頓的 影響。
Table 1. The effects of c-Mos on GVBD, MPF activity and MⅡ arrest of oocytes maturation in each species.
物種 影響 GVBD 影響 MPF 活性 影響 MⅡ的停頓
豬 +* + +
鼠 - - ?
非洲爪蟾蜍 + + +
牛 + + ?
海星 - - ?
+:有影響、-:沒影響、*:非必要條件(Ohashi et al., 2003)
(一) RNAi pathway
無論是 antisense RNA、dsRNA、shRNA 及 siRNA,其干擾機制都與 RNAi 訊息傳導路徑(RNAi pathway)有關,如圖 5 所示。一些重要的因子 在 RNAi pathway 扮演關鍵性的角色,如:Dicer、RNA 誘導默化複合體
(RNA-induced silencing complex, RISC)、RNA-dependent RNA polymerase
(RdRP)等。
Antisense RNA 與鵠的 sense RNA 雜交,形成 dsRNA,之後便進入 RNAi pathway,此時,Dicer 將扮演重要的角色。Dicer 具有 RNase III 酵素的功 能,藉著兩種蛋白因子 RDE-1 與 RDE-4 的輔助,及 ATP 的能量供給,使 dsRNA 裂解為 siRNA。之後 RISC 會找到被裂解的 si RNA,並黏附於反義 股端,RISC 具有 ATP-dependent helicase 的活性,能將 siRNA 解旋成單股。
RISC 也具有 RNase 的活性,當形成 RISC - 短片段反義股 RNA 複合體
(RISC-small antisense RNA complex)後,會找到標的基因之 mRNA,與之 結合,並分解鵠的 mRNA。
某些物種,如:真菌、植物及一些無脊椎動物等,在其 RNAi pathway 中 具有 RdRP。當 dsRNA 裂解成 siRNA,RISC 黏附於 RNA 反義股端,將 siRNA 裂解成單股,此時反義股片段會與鹄的 mRNA 結合,此片段如同引子的作 用,使 RdRP 黏附於此區,合成新的 dsRNA,進行一次新的 RNAi pathway,
提高鵠的基因的默化作用。
圖 5. RNAi 路徑。(Bantounas et al., 2004) Fig. 5. RNAi Pathway.
(二)干擾 RNA 的類型及對卵母細胞的應用性 1. 反義股 RNA
反義股 RNA 為最早用來執行 RNAi 技術的類型,1984 年 Izant 等人首 先使用反義股 RNA 抑制胸腺嘧啶激酶基因的表現。反義股 RNA 的作用機 制在於,藉著反義股 RNA 與標的基因的意義股 RNA 雜交,形成雙股 RNA,
以此抑制鵠的基因的表現。由於反義股 RNA 是單股 RNA,難以保存且容 易被細胞內的 RNase 分解,是五種干擾 RNA 中效果最差的一種。至於在哺 乳動物卵母細胞反義股 RNA 技術的應用,Ohashi et al.(2003)顯微注射豬 c-mos 蛋白的訊息 RNA(mRNA)或反義股 RNA(antisense RNA)到豬卵 母細胞,藉著促進或抑制 c-mos 基因的表現,研究 c-Mos 蛋白對於豬卵母 細胞的影響。
2. 長片段雙股 RNA
Long-dsRNA 長 度 都 大 於 200 bp , Fire et al. ( 1998 ) 首 次 運 用 Long-dsRNA於RNAi技術,成功的干擾了線蟲(Caenorhabditis elegans)基 因的表現。之後,其他的物種也被證實可使用long-dsRNA干擾基因表現,
例如:一些植物、原生動物、線蟲及昆蟲,此種dsRNA的干擾機制在植物 中被稱為轉錄後基因默化(posttranscriptional gene silencing, PTGS),在這些 物種的基因默化研究中,證實了雙股RNA作為默化基因的工具比反義股 RNA來的有效率(Sharp, 2001)。至於在哺乳動物卵母細胞,Paradis et al.
(2003)將long-dsRNA用於牛卵母細胞上,顯微注射cyclin B1 dsRNA到牛 卵母細胞,發現能降低cyclin B1 mRNA及蛋白質的表現量。
3. miRNA
microRNA(miRNA)由 Lee et al. (1993)所發現,但是 2000 年之後才 被重視,生物體內就存有 miRNA 基因,有些基因位於染色體中較纖細
(fragil)的部位,有些處於 primary mRNA 的 intron 中。在人類與小鼠的基 因組 DNA 中,約有 200-300 個 miRNA 基因(Lim et al., 2003),除此之外,
在果蠅、線蟲等物種中發現,miRNA 參與基因表現的調控。起初 miRNA 由細胞核內表現而來,為一髮夾結構的 RNA(pre-miRNA),是一個 70 nt 的 RNAs,包含有 1-4 nt 突出端(overhands),25-30 bp 的莖(stem),莖上 方形成一小環(small loop)。pre-miRNA 輸送至細胞質後,經過 Dicer 的加 工把 pre-miRNA 環狀的部分去除,形成雙股的 miRNA,之後 Dicer 將 miRNA 分離成單股,並與 RISC 結合,RISC 具有 RNase 的活性,RISC -單股 miRNA 複合體會找到鹄的基因之 mRNA,與之結合(Lee et al., 2003, Yi et al., 2003)。miRNA 與 RNAi pathway 抑制基因表現的機制不同,Hutvagner et al.
(2002)於線蟲的研究指出,miRNA 的序列與鵠的 mRNA 的序列不完全互 補,因此 miRNA 不會分解鵠的基因的 mRNA,但是仍有默化基因的作用。
若人工重組與鵠的基因序列完全互補的 miRNA,則會以 RNAi pathway 的 方式分解鵠的基因的 mRNA,可見 miRNA 另有機制可默化鵠的基因(Zeng
。miRNA 的默化機制,在大部份的植物,
miRNA-RISC 複合體可將與其配對的 mRNA 互補位分解,使 mRNA 結構斷 裂,無法進行轉譯作用。在大部分的動物則是藉由 miRNA-RISC 複合體抑 制鵠的基因蛋白質的合成。無論是動物、植物或酵母菌,miRNA-RISC 複 合體也可能使鵠的基因甲基化,達到默化的效果(Carrington et al. 2003)。
4. shRNA
起初設計 shRNA 的 cDNA,以質體或病毒載體構築 RNA 干擾表現系 統,用微脂體轉染、電穿孔或病毒感染的方式,將其轉型進入宿主基因組 DNA 內,使 shRNA 永久表現,以達到長期抑制基因表現的目的。shRNA 為一髮夾結構的 RNA,經過 Dicer 的催化把 shRNA 的環切除,形成短片段 的雙股 RNA,之後 RISC 會黏附於反義股端,RISC 具有 ATP-dependent helicase 的活性,能將 RNA 解旋成單股。RISC 也具有 RNase 的活性,反 義股端短片段單股 RNA-RISC 複合體會與鵠的 mRNA 上的互補序列結合,
並分解鵠的 mRNA。至於 shRNA 於哺乳動物的應用,Abbas-Terki et al.
(2002)於哺乳動物細胞中,使用 shRNA,成功的抑制外源綠色螢光蛋白
(enhanced green fluorescent protein, EGFP)基因表現。
5. siRNA
當雙股 RNA(dsRNA)超過 30 個鹼基對時,會啟動非專一性干擾系統
( interferon system, IFN),IFN 在體內扮演著對抗病毒感染的角色,藉此 抑制胞內轉譯作用。當 dsRNA 與雙股 RNA 結合蛋白(dsRNA binding protein)結合,會誘導 IFN 系統啟動,使蛋白激酶 R(protein kinase R)磷
酸化真核啟始因子2α(eukaryoticinitiation factor2α,eIF2α),eIF2α便失去 活性,以此非特異性的抑制蛋白質合成,導致細胞死亡(Matsumoto et al., 2005)。經過持續的研究改良,最近已發展出短片段的 RNA,除可以以避開 上述 IFN 的機制外,仍然具有抑制基因表現的特性。這種短片段 RNA 又稱 小干擾 RNA,其結構是小的雙股 RNA,長度大約 21-25 個核醣核酸,兩股 的3’端具有 2-3 個鹼基的突出(overhang)。Caplen et al.(2001)指出,siRNA 能抑制不同物種特定基因表現,如:無脊椎動物的 elegans 和脊椎動物的人 類及小鼠。除此之外,已經成功用於植物、果蠅及線蟲等物種(Bantounas et al., 2004),在哺乳動物卵母細胞方面,Lisa(2005)報告指出,其將 Gpr3
siRNA 顯微注射打入小鼠未成熟卵母細胞中,成功抑制 Gpr3 基因的表現。
可見 siRNA 能廣泛用於各物種。
siRNA 與其餘四種干擾 RNA 比較,發現 siRNA、antisense RNA 與 long-dsRNA 屬短暫抑制基因表現的系統,antisense RNA 是單股 RNA 容易 被分解,antisnse RNA 與 long-dsRNA 鹼基對的數量超過 30 bp,有造成非 特異性抑制的風險,而 siRNA 鹼基對小於 30 bp,可避開 IFN 系統所引發的 問題。miRNA 基因默化機制與 siRNA 不同,miRNA 抑制基因的轉譯作用,
而不是將 mRNA 降解,因此無法使用 RT-PCR 檢測出 miRNA 抑制基因表 現的效率,且 miRNA 不像 siRNA 可以自行設計,必須從該物種之基因組 DNA 搜尋而來。以 siRNA 與 shRNA 比較,shRNA 經過 Dicer 修飾後與 siRNA
極為相似,shRNA 的表現由核內的轉殖基因進行轉錄作用,要有較長的反 應時間,適用於需要長期或永久抑制基因變現的試驗,然而 siRNA 由體外 合成,直接送入細胞質中,因此可以馬上產生抑制的效果,適合用於短期,
且需要快速達到抑制效果的試驗。siRNA 迅速而有效率的抑制基因,適合 用於研究卵或胚生長過程中,細胞內分子間訊息傳導的變化。以豬卵母細 胞為例,從 GV 期到成熟的 MII 期只需兩天的時間,在這段期間內若要抑 制某分子基因的表現,並觀察其對於卵母細胞造成的影響,則需要迅速而 有效率的工具,siRNA 是最好的選擇。雖然將 siRNA 技術用於研究豬卵母 細胞成熟、受精與發育的研究目前尚無人發表,但是在其他的物種上,包 括多種哺乳動物已證實是可行的,因此建立 siRNA 技術運用於研究豬卵母 細胞的研究平台勢在必行,這也將是未來研究的趨勢。
参、材料與方法 一、 siRNA 的設計與製備
豬 c-mos 基 因 序 列 由 美 國 國 家 衛 生 研 究 院 NCBI 網 站
(http://www.ncbi.nlm.nih.gov/)搜尋而來, 其序號為X78318,序列總長為 2052 bp,其mRNA序列由226到1900,長度約1674 bp,其間沒有內顯子 (intron) 。 將 其 序 列 置 於 Ambion 網 站 (http://www.ambion.com/techlib /misc/siRNA_finder.html/)搜尋c-mos siRNA的鵠的序列(target sequence),得 到4組鵠的序列為:
5’-AAGTGTCTCAAGTATTCCCTG-3’、 5’-AAGAAACTGGAGGACATCATC-3’、 5’-AAGCATTTGTCTTTGTTGCTG-3’、 5’-AAATCTAGTGGTGTCTCTCCT-3’
,分別位於第930 bp、1326 bp、1457bp、1621 bp。之後分別設計siRNA模板
( template ), 有 反 義 股 模 版 和 意 義 股 模 板 兩 組 , 長 度 為 29 個 寡 核 苷 酸
(ologonucleotide),其5’端有八個寡核苷酸的領導序列(leader sequence),
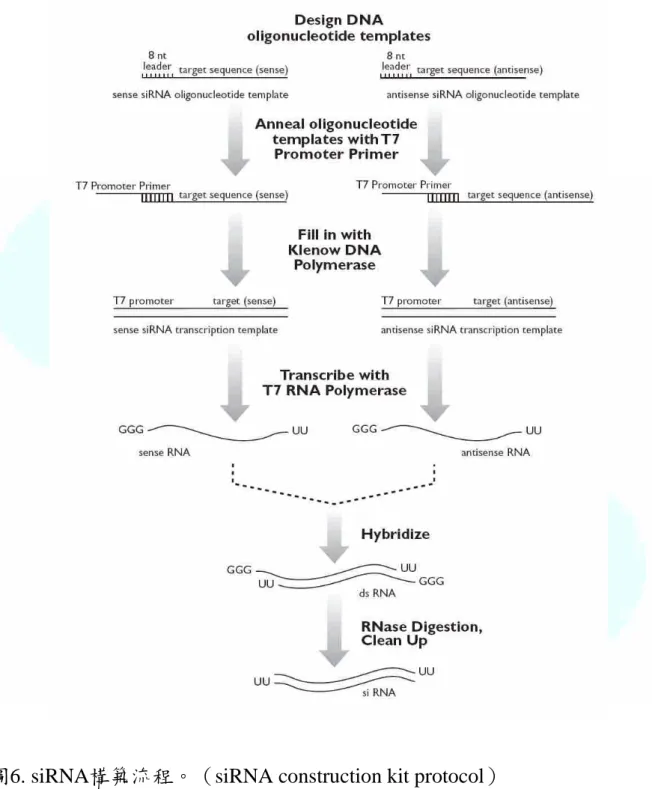
為5’-CCTGTCTC-3’,後面分別接著意義股與反義股的鵠的序列。siRNA合成 與純化採用siRNA構築商業套組(Silencer siRNA construction kit, Ambion, U.S.A.),前述領導序列的功能在於與T7啟動子引子(T7 promoter primer)結 合, 之後添加Klenow DNA 聚合酶,使模板變為雙股DNA,再加入T7 RNA
聚合酶,結合T7啟動子順利在體外(in vitro)進行轉錄作用,合成意義股與 反義股RNA,並使兩股RNA結合,產生短片段的雙股RNA,也就是siRNA,
整個siRNA製備流程如圖6所示。
實際製備siRNA的流程如下:
(一)轉錄模板的製備
首先必須調整siRNA模板的濃度,用去核酸酶水(nuclease-free water)
把反義股及意義股siRNA模板的濃度調整至100 μM。之後將T7 promoter primer與siRNA模板進行雜交,此時分成兩管,每管分別加入2μlT7 promoter primer、6μlDNA hybridizebuffer及2 μl 反義股或意義股siRNA模板於200μl PCR tube中混勻,使用聚合酶連鎖反應器將混合物加熱至70℃維持5分鐘,再 降至室溫等待5分鐘。5分鐘後,兩管分別加入 2 μl 10× klenow reaction buffer、2 μl 10× dNTP mix、4 μl nuclease-free water及2 μl klnow DNA polymerase並混勻,置於37℃培養箱(2720 thermal cycler, Applied Biosystems, Singapore )中培養30分鐘,雙股的DNA模板便製備完成。
(二)雙股RNA的合成
將4 μl去核酸酶水、10 μl2×NTP mix、2 μl10× T7 reaction buffer、2 μlT7 enzyme mix、反義股或意義股的雙股DNA模板分別加入兩管PCR tube中混 勻,於37℃培養箱中培養兩個小時,之後將兩管混合成一管,於37℃培養 箱中隔夜培養。
圖6. siRNA構築流程。(siRNA construction kit protocol)
Fig. 6. siRNA construction procedures.
(三)siRNA的純化
取6 μldigestion buffer、48.5 μl去核酸酶水、3 μlRNase及4 μlDNase加 到雙股RNA的混合液體中,混合均勻後置於37℃培養箱中培養2小時。將混 合液置入1.5 ml 離心管中並加入400 μlsiRNA binding buffer,室溫培養5分 鐘,此時先將去核酸酶水75℃預熱。將過濾匣(filter cartridge)放入2 ml 離心管中,把100 μlsiRNA wash buffer與siRNA混合液加到過濾匣中,10000 rpm離心1分鐘,去除過濾液,加入500 μlsiRNA wash buffer,同樣的離心 10000 rpm 一分鐘,之後再重複上述步驟一次。將過濾液丟棄,換上新的2 ml 離心管,加入100 μl先前75℃預熱的去核酸水,室溫等待兩分鐘後12000 rpm 離心兩分鐘,離心下來液體即為siRNA。之後進行4%agarose gel/ 0.5× TBE 電泳分離確認,並用核酸分光光度計(Biotech Photometer UV-1101, WPA, U.K.)測定RNA濃度。
二、 豬卵母細胞體外成熟、受精與發育的培養
(一)體外成熟
於屠宰場取得雌性肉豬的卵巢,置於含有50 μg/ml Penicillin G與60 μ g/ml Streptomycin的生理鹽水(附錄1)中,一小時內帶回。於室溫下卵巢 浸漬於D-PBS(Dulbecco’sphosphatebuffered saline)操作液中(附錄2),於 解剖顯微鏡(SZ-3060, Olympus, Japan)下操作,將血水擠出,選擇卵巢上 3~5 mm的濾泡,使用解剖刀片逐一將其刺破,並使用刀背將卵丘卵母細胞
複合體(cumulus-oocyte complexes, COCs)擠出,於解剖顯微鏡下選取含有 緻密細胞質,且卵丘緊密包覆於卵的COCs,收集於D-PBS中。將COCs用含 有5 IU/ml排卵素(luteinizing hormone, LH)、2.5 μg/ml激濾泡素(follicle stimulating hormone FSH)、20 ng/ml表皮生長因子(epithelium growth factor, EGF)、非必須胺基酸(non-essential amino acid)、10%豬濾泡液(porcine follicular fluid, PFF)、100 μg/mlcystein之NCSU-23成熟培養液清洗三次(附 錄3),並置於NCSU-23成熟培養液,於二氧化碳培養箱39℃ 、5 %CO2下 培養44小時。
(二)體外受精
取5ml靜置16小時以上的稀釋精液加入5 ml精子洗滌液(附錄4)於15 ml 離心管中,小心混勻,離心3分鐘(500 rpm)。從混勻精液中取5 ml上層液 加入5 ml精子洗滌液,混勻後離心3分鐘(2000 rpm)。之後將所有上層液丟 棄,留下沉澱物於離心管中,加入10 ml精子洗滌液,與沉澱物混勻後離心3 分鐘(2000 rpm)。移除上層液,加入2 ml豬精子體外獲能培養液(附錄5),
將沉澱物混勻後於位相差顯微鏡(BX-50, Olympus, Japan)下計算精子濃 度,並將濃度調整至2×108cell/ml,置於37℃二氧化碳培養箱中等待受精。
受精前將已成熟卵母細胞的卵丘去除,放置於含有1900 μl豬精子體外受精 培養液(附錄6)之培養皿中,並同時取2×108cell/ml的精液100 μl,加入900 μl的受精培養液,將其稀釋成2×107 cell/ml。最後取 100 μl2×107 cell/ml獲
能精液,將其放入含有成熟卵母細胞之受精培養液中,精子最終濃度為2×106 cell/ml,最後將含有成熟卵母細胞與精子的培養皿放入二氧化碳培養箱
(39℃、 5%CO2)中培養6小時,完成體外受精。
(三)體外發育
精子與卵母細胞共同培養6小時後,去除精子,用胚培養液(附錄7)
繼續培養,每兩天換液,繼續培養10 hr可觀察雄原核與雌原核,培養兩天 可觀察卵裂,培養七天觀察細胞數。
三、 顯微注射卵存活率提升試驗
Paradis et al. (2005)發現在卵母細胞注射前,經由cycloheximide的藥物 處理,會增加牛卵母細胞的存活率,降低注射對於卵母細胞所造成的傷害,
但是在豬這個物種上,沒有相關的研究。本試驗在注射前,卵母細胞先培 養在添加cycloheximide的培養液中8小時,研究其對豬卵母細胞的影響。使 用微電腦可程式拉針器(Tlaming/Brown Micropipetter Puller Model P-97, Sutter Instrument CO., U.S.A.)與斷燒器(Micro Forge MF-900, Narishige, Japan)將顯微注射holding pipette製作成外徑約130 μm,內徑約20 μm;
injection pipette尖端小於0.1 μm。於倒立顯微鏡顯微操作系統(IX 71, Olympus, Japan)下進行穿刺的動作,穿刺後於39℃、5 % CO2的培養箱中 成熟培養44小時,進行形態學觀察。試驗分成六組,如圖七所示,分別是 未添加cycloheximide且未穿刺的對照組(N)、添加1 μg/mlcycloheximide且
未穿刺的實驗組(1C)、添加10 μg/ml cycloheximide且未穿刺的實驗組
( 10C )、 未 添 加 cycloheximide 且 穿 刺 的 對 照 組 ( I )、 添 加 1 μg/ml cycloheximide且穿刺的實驗組(1CI)及添加10 μg/mlcycloheximide八小時 後穿刺的實驗組(10CI)。
四、 c-mos siRNA 顯微注射
Mehlmann et al. (2002)報告指出,若鼠卵內的siRNA濃度為50 nM,對 抑制基因表現有最好的效果。因此本試驗將siRNA於豬卵母細胞內的濃度設 為50 nM,豬卵母細胞半徑約為75 μm,估算其體積約為1324 pl,而本試驗 將顯微注射量設為10 pl,兩者相差132倍,經過計算siRNA注射的濃度約為 6.6 μM。未成熟卵丘卵母細胞複合體經由1 μg/mlcycloheximide處理8小時之 後,進行顯微注射siRNA打到卵母細胞細胞質中的顯微注射,製作顯微注射 的holding pipette與injection pipette(方式如前所述),首先將4組si RNA混合 在一起,經由TL-HEPES(附錄8)稀釋,每組siRNA濃度調整至6.6 μM。卵 丘卵母細胞複合體於TL-HEPES 中洗3次,將其置於含有TL-HEPES的注射 盤中等待注射,同時取稀釋完成的siRNA混合液10 μl,滴在注射盤上,並蓋 上礦物油,便可使用顯微注射系統進行注射,每顆卵母細胞注射10 pl ,於 卵內最終濃度為50 nM。注射完成後,將卵丘卵母細胞複合體於成熟培養液 中洗三次,最後置於成熟培養液中,於二氧化碳培養箱(39℃、 5% CO2) 成 熟培養44小時。
圖 7. 被穿刺卵母細胞存活率提升試驗設計圖。
Fig. 7. The design chart of survival rate increased in puncture oocyte.
五、 精子顯微注射
取 5 ml 隔夜稀釋精液加入 5 ml 精子洗滌液於 15 ml 離心管中,小心混 勻,離心 3 分鐘(500 rpm)。從混勻精液中取 5 ml 上層液加入 5 ml 精子洗 滌液,混勻後離心三分鐘(2000 rpm)。之後將所有上層液丟棄,留下沉澱 物於離心管中,加入 10 ml 精子洗滌液,與沉澱物混勻後離心 3 分鐘(2000 rpm)。移除上層液,加入 2 ml 豬精子體外獲能培養液,之後將精子濃度調 整成 2×105cell/ml,同時將成熟培養後的 COCs 去除卵丘,待注射用。使用 拉針器與斷燒器將顯微注射 holding pipette 製作成外徑約 130 μm,內徑約 20 μm,injection pipette 內徑約 8 μm。設定完成後便進行注射的動作,將精 液與 PVP 注射液(附錄 9)混合,最終精子濃度為 1×105cell/ml, 以 injection pipette 吸取精子,使用壓電脈衝顯微操作儀(piezo micro meter PMAS-CT150, Prime Tech, Japan)將精子注射入成熟卵母細胞的細胞質。注射完成後,將 已注射的卵母細胞置於胚培養液中培養 16 小時。
六、 卵母細胞的形態學觀察
觀察卵母細胞形態學變化使用兩種染劑,分別是 Hoechst 33258 與 Lacmoid。
(一)Hoechst 33258 螢光染色
Hoechst 33258(Sigma b-2883)激發波長為 365 nm,放射波長為 465 00 μg/ml(溶於 PBS),Hoechst 33258 能將染
色質或染色體染色,可判斷卵母細胞的發育情形。進行卵母細胞染色前,
先將10 μl濃縮液加到 990 μlPBS中,於 39 ℃ 二氧化碳培養箱下回溫,回 溫後將其滴在培養皿上,每滴50 μl,並蓋上礦物油。將欲染色的卵母細胞 取出,於解剖顯微鏡下操作,將其置於 50 μlHoechst 33258 培養液,一滴 放十顆卵母細胞,並於 39 ℃ 5 % CO2 二氧化碳培養箱內培養 15 分鐘,
之後將已染色的卵母細胞取出,置於不含 Hoechst 33258 的 PBS 中,於 39 ℃、
5 % CO2 的二氧化碳培養箱內退染 15 分鐘,最後將卵母細胞固定於玻片 上,用螢光顯微鏡觀察,螢光濾鏡型號選擇 WU(Olympus)。
(二)Lacmoid 染色
Lacmoid 染劑能將染色質或染色體染色,在位相差顯微鏡下能判斷卵母 細胞的發育情形,其作用濃度為 10 mg/ml,必須溶於 45%冰醋酸,因此配 製 Lacmoid 染劑時,取 1 g Lacmoid 置於燒杯內,加入 45 ml 冰醋酸與 55 ml 滅菌水,蓋上錶玻璃,用加熱攪拌器(Stirrer/Hot Plat, Corning, U.S.A.)加 熱,煮沸 30 分鐘後,等待冷卻,用濾紙過濾,最後置於棕色瓶內保存,即 完成 Lacmoid 染劑的配製。
卵母細胞的染色處理是在解剖顯微鏡下操作,將卵母細胞取出,固定 於玻片上,並且封蠟(蠟:凡士林=1:1),之後置於酒精-冰醋酸固定液(酒 精:冰醋酸=3:1)中浸泡 48 小時。2 日後即可用 Lacmoid 染色,於位相 差顯微鏡下觀察。
七、 RNA 萃取
(一)藥品配製 1. Denature solution
將 250 g Guanidine thiocyanate 溶於 293 ml DEPC(diethylpyrocarbonate)
水中,加入 17.6 ml 之 0.75 M Sodium citrate(pH7.0)、26.4 ml 10%sarcosyl,
之後於 60~65℃水浴槽中加熱攪拌待其溶解,即得 pre-denaturing sol. (可在 室溫中保存半年) 。取 50ml 分裝成一管,保存於室溫中,使用前每管添加 0.36 ml 14.4 M 2-mercaptoethanol,即得 Denature solution。
2. 2M Sodium acetate pH4.0(2M NaOAC)
取 16.42 g Sodium acetate 1H‧ 2O 加入 40 ml DEPC 水,加入 35 ml Glaciail acetic acid(冰醋酸 99.8%),使用 pH 測定儀(PH Meter F-51, Horiba, Japan)
調整 pH 值到 4.0,最後加 DEPC 水至 100 ml 再高壓滅菌。
(二)RNA 萃取流程
將 100 μlDenaturesolution加入 1.5 ml 離心管內,取卵母細胞溶在 100 μl Denature solution中(若要保存可先凍在-80℃冰箱),加入 20 μl 2M NaOAC、100 μlPhenol(pH 4.5)、及40 μlChloroform(Chloroform:isoamyl alchohol=49:1),混勻後存放於 4℃作用 15 分鐘,之後於高速冷凍離心 機(High speed Refrigerated Centrifuge 6500, Kubota, Japan)4℃離心 12000 rpm 25 分鐘。取上層液 100 μl放入另一新 1.5 ml 離心管,加入 100 μl
5 μlglycogen(20 mg/ml),混勻後存放於-20℃待 30 分鐘,
之後 4℃離心 12000 rpm 30 分鐘,去除上清液留下沉澱物,加入 100 μl75
%酒精,4℃離心 12000 rpm 20 分鐘,去除上清液留下沉澱物,加入 100 μl 75%酒精,4℃離心 12000 rpm 10 分鐘,最後將上清液去除,沉澱物風乾後 儲存於-80℃,或加入適量 DEPC 水進行逆轉錄(reverse transcription, RT)
作用。
八、 RT 與 realtime PCR
(一) RT 合成 cDNA
本 試 驗 採 用 商 業 化 套 組 (Applied Biosystems high-Capacity cDNA Archive Kit, U. K.)進行 RT。首先取 35.5 μl 豬卵母細胞 RNA 置入 PCR tube 中,加入5 μl10× RT buffer、2 μl25× dNTP mixture、5μl10× Random primer 及2.5 μlMultiScribeRT enzyme,混合均勻後於聚合酶連鎖反應器進行逆轉 錄反應,條件溫度為 25℃ 作用 10 分鐘,之後 37 ℃作用 2 小時,即得 cDNA。將其存放於-20℃冰箱或直接進行 PCR 或即時定量反應。
(二) 即時定量 PCR(realtime PCR)
本試驗使用相對定量的方式來比較試驗組與對照組之間 c-mos 基因表 現量的差別,使用的引子分別從 c-mos 與 β-actin 的基因序列中選取,β-actin 基因乃是要當作基因表現量的基準值,俾能測得實驗組與對照組之間 c-mos 基因表現量的差別。β-actin 的基因序列是從美國國家衛生研究院 NCBI 網 站(http://www.ncbi.nlm.nih.gov/)搜尋而來, 其序號為 AJ312193,片段長
度為 601 bp,設計的引子位在 415~496 bp 之間,長度為 81 bp。至於 c-mos 引子位於其基因序列 767~838 bp 之間,長度為 71 bp。兩組引子取得後用滅 菌水稀釋,將引子濃度調整成1 μM。
realtime PCR 反應使用 Applied Biosystems SYBR green PCR Master Mix,取 20μlcDNA加到 realtime PCR 反應管(Applied Biosystems Optical Tubes)內,並加入 25 μlSYBR green PCR MasterMix、reverse primer 與 forward primer 各 2.5 μl,之後蓋上反應蓋(Applied Biosystems Optical Caps),置於即時定量聚合酶連鎖反應器(7300 Real-Time PCR System, Applied Biosystems, U.S.A.),反應條件為 94℃ 10分鐘,進入 40 次的循環
(94℃30秒→60 ℃ 1 分鐘),之後進行 Melting Curve(dissociation curve)
分析,此分析系統可藉由溫度的緩慢上升,產生雙股 DNA 裂解與結合的反 應,藉此得知產物的純淨度(degree of purity),分析反應產物是否為單一產 物或有其他片段干擾。完成後便可取得反應管內的螢光信號到達設定的閥 值時所經歷的循環數 - Ct(Threshold cycle)值,之後利用下列公式計算試 驗組與對照組的相對訂量比值。
1. △CtA=(對照組 c-mos 基因表現量 Ct 值)-(對照組 β-actin 基因表現 量 Ct 值)
2. △CtB=(試驗組 c-mos 基因表現量 Ct 值)-(試驗組 β-actin 基因表現 量 Ct 值)
3.△△ =Ct △CtA-△CtB 4. ratio=2△△Ct
最後所得之 2△△Ct即是相對定量的比值。
九、 試驗設計
本試驗分成五部份,首先探討正常卵母細胞在成熟過程中形態學的變 化及 c-mos mRNA 表現量的變化。為避免顯微注射傷害卵母細胞,因此第 二部份試驗在於探討卵母細胞注射前,經由 cycloheximide 處理是否會增加 其存活率。第三部份則是將未成熟卵母細胞注射 c-mos siRNA,觀察對卵母 細胞成熟的影響。第四部份同樣是將 c-mos siRNA 注射到未成熟卵母細胞 並進行成熟培養,觀察對卵母細胞受精與發育的影響。第五部份將 c-mos siRNA 注射到未成熟卵母細胞並進行成熟培養,之後進行精子顯微注射,
最後觀察形態學變化。
(一)豬卵母細胞成熟期間形態學及 c-mos mRNA 表現量的變化
收集卵丘卵母細胞複合體後,進行 44 小時成熟培養,於成熟培養期間 逢機選取培養期為 0、12、24、36 及 44 小時的卵母細胞,每期選取 10 顆 卵母細胞萃取其 RNA,使用 realtime PCR((SYBR Green )技術觀察 c-mos mRNA 的表現量變化。同時每期所選取的卵母細胞用 lacmoid 或 Hoechst 33258 染色於螢光位相差顯微鏡下觀察其形態學的變化。試驗重複三次,形 態學變化採用卡方測驗及葉氏連續校正進行統計分析,至於 c-mos mRNA
表現量則採用 SAS 套裝軟體的 GLM(Generalized linear model procedure)
模式進行統計分析。
(二)cycloheximide 處理對穿刺卵母細胞存活率的影響
收 集 卵 丘 卵 母 細 胞 複 合 體 於 額 外 添 加 1 μg/ml 或 10 μg/ml cycloheximide 的 NCSU-23 成熟培養液培養 8 小時 ,之後使用顯微注射技 術進行卵母細胞的穿刺動作,並使用不含 cycloheximide 的成熟培養液繼續 培養 44 小時,最後固定並使用 lacmoid 染色或 Hoechst 33258 螢光染色,在 螢光位相差顯微鏡下觀察其形態學變化。以上試驗重複三次,形態學變化 採 用 卡 方 測 驗 及 葉 氏 連 續 校 正 進 行 統 計 分 析 ( test of chi square and Yates’correction forcontinuty)。
(三)注射 c-mos siRNA 對豬卵母細胞成熟的影響
收集卵丘卵母細胞複合體後,經由 1 μg/mlcycloheximide 處理 8 小時,
之後利用顯微操作技術將 10 pl c-mos siRNAs mix 注射到卵母細胞細胞質 中,用成熟培養液繼續培養 44 小時,再換到胚培養液繼續培養 16 小時(觀 察其是否會致活)。在注射後培養期間逢機選取 12、24、36、44 及 60 小時 的卵母細胞,固定並使用 lacmoid 染色或 Hoechst 33258 螢光染色,在螢光 位相差顯微鏡下觀察其形態學變化。並選取注射後培養 12 小時及 44 小時 的卵母細胞,萃取 RNA,使用 realtime PCR(SYBR Green )技術測量 c-mos( mRNA 的表現量變化。以上試驗重複三次,形態學變化採用卡方測驗及葉
氏連續校正進行統計分析,至於 c-mos mRNA 表現量則採用 SAS 套裝軟體 的 GLM(Generalized linear model procedure)模式進行統計分析。
(四)注射 c-mos siRNA 對豬卵母細胞受精與發育的影響
收集卵丘卵母細胞複合體,用 cycloheximide 處理 8 小時,利用顯微操 作技術將 10 pl c-mos siRNAs mix 注射到卵母細胞細胞質中,之後成熟培養 44 小時,進行受精六小時,最後使用胚培養液將受精後的卵母細胞培養 7 日。選擇受精後培養期間 10 小時、2 日及 7 日,分別用 lacmoid 染色或 Hoechst 33258 螢光染色,並用螢光位相差顯微鏡觀察其受精、卵裂及分溝細胞數等 變化。以上試驗重複三次,形態學變化採用卡方測驗及葉氏連續校正進行 統計分析。
(五)注射 c-mos siRNA 對豬卵母細胞精子顯微注射的影響
收集卵丘卵母細胞複合體,用 cycloheximide 處理 8 小時,利用顯微操 作技術將10 ρlc-mos siRNAs mix 注射到卵母細胞細胞質中,之後成熟培養 44 小時,進行精子顯微注射,繼續培養 16 小時,最後卵母細胞用 lacmoid 染色或 Hoechst 33258 螢光染色,並用螢光位相差顯微鏡觀察其受精。以上 試驗重複三次,形態學變化採用卡方測驗及葉氏連續校正進行統計分析。
肆、結果
一、豬卵母細胞成熟期間形態學及 c-mos mRNA 表現量的變化
在研究注射 c-mos siRNA 對於豬卵母細胞成熟的影響之前,我們必須 了解正常卵母細胞在成熟期間形態學及 c-mos mRNA 表現量的變化。
(一)豬卵母細胞在成熟期間之形態學變化
首先收集卵丘卵母細胞複合體後,進行 44 小時成熟培養,於成熟培養 期間分別選取已成熟培養 0、12、24、36 及 44 小時的卵母細胞,應用 lacmoid 或 Hoechst 33258 染色,於螢光位相差顯微鏡下觀察,判斷其核成熟情形,
即觀察卵母細胞的細胞核是否處於 GV、GVBD、MI 或 MII 等狀態,GV 時 期之卵母細胞,可以看到明顯的大核(圖 8);GVBD 發生時的卵母細胞,
可以看到核膜已經瓦解,且染色體已是濃縮的狀態(圖 9);MI 時期的卵母 細胞,可以看到分散的染色體(圖 10);MII 時期已達成熟狀態的卵母細胞,
可以看到明顯的極體與染色體(圖 11)。而生發泡的瓦解率與卵母細胞的成 熟率是判斷卵母細胞從未成熟到成熟之間變化的指標。生發泡瓦解乃指卵 母細胞細胞核膜瓦解,代表其恢復減數分裂。0 小時的卵母細胞都處於 GV 階段,12 小時者,有 25.5%卵母細胞已發生 GVBD,培養 24 小時達到 78.4
%,培養 36 小時之後有 92.6%的卵母細胞跨越了 GV 期。卵母細胞的成熟 率乃指卵母細胞到達第二次減數分裂中期(MII)的比例,當培養 0、12 與 24 小時,還沒有任何卵母細胞到達此時期,直到培養 36 小時,才有 45.4%的
A
B
圖 8. 生發泡期豬卵母細胞細胞核的形態學。用 Hoechst 33258 (A)或 Lacmoid(B)染色。
Fig. 8. Nuclear morphology of pig oocytes in stage of germinal vesicle. Oocytes panel A were stained with Hoechst33258, and Lacmoid(B).
A
B
圖 9. 生發泡瓦解期豬卵母細胞細胞核的形態學。用 Hoechst 33258 (A)或 Lacmoid(B)染色。
Fig. 9. Nuclear morphology of pig oocytes in stage of germinal vesicle breakdown. Oocytes panel A were stained with Hoechst33258, and Lacmoid(B).
A
B
圖 10. 第一次減數分裂中期豬卵母細胞細胞核的形態學。用 Hoechst 33258 (A)或 Lacmoid(B)染色。
Fig. 10. Nuclear morphology of pig oocytes in stage of metaphase I. Oocytes panel A were stained with Hoechst33258, and Lacmoid(B).
A
B
圖 11. 第二次減數分裂中期豬卵母細胞細胞核的形態學。用 Hoechst 33258 (A)或 Lacmoid(B)染色。
Fig. 11. Nuclear morphology of pig oocytes in stege of metaphase II. Oocytes panel A were stained with Hoechst33258, and Lacmoid(B).
卵母細胞到達 MII 期,培養 44 小時,有 76.37%的卵母細胞到達 MII 期。
圖 12 顯示,GVBD 是在培養期間 12-24 小時之間發生,在 24 小時之後才 開始有卵母細胞陸續到達成熟階段,44 小時卵母細胞的成熟率可達 76%。
(二)豬卵母細胞成熟期間 c-mos mRNA 表現量的變化
收集卵丘卵母細胞複合體後,進行 44 小時成熟培養,於成熟培養期間 分別選取已成熟培養 0、12、24、36 及 44 小時的卵母細胞,每期取十顆卵 母細胞萃取 RNA,經逆轉錄作用後以 realtime PCR 技術分析 c-mos 基因 mRNA 的表現量。以 SYBR green 系統執行 realtime PCR 對於 PCR 產物的 純淨度非常重要,任何雜分子的存在都會影響到定量的準確性,因此在 PCR 增幅結束後執行 Melting Curve(dissociation curve)分析是必要的。圖 13 與圖 14 分別為 c-mos 與 β-actin 增幅後之增幅曲線與裂解曲線圖,可看出 β-actin 所測得之 Ct 值約為 22.5,c-mos 則是在 21~23 之間,無論是 c-mos 或β-actin 的裂解曲線皆為單一曲線。可見 PCR 產物純淨度很高,且無雜片 段。取得試驗結果之 Ct 值後,進一步進行 c-mos mRNA 的相對定量比較,
將未培養(0 小時)的卵母細胞所測得 c-mos mRNA 相對定量常數設為 100,
經計算比較培養 12 小時卵母細胞的相對定量常數平均值為 135.6,培養 24 小時者的相對定量常數平均值為 120.1,培養 36 小時者的相對定量常數平 均值為 102.3,培養 44 小時者的相對定量常數平均值為 63.3(圖 15)。豬卵 母細胞在培養 12 小時,其 c-mos mRNA 表現量就已達到高峰,之後便逐漸