行政院國家科學委員會專題研究計畫 期中進度報告
雙叉桿菌具轉半乳糖作用β-半乳醣
及其應用於半乳糖
寡醣合成之研究(2/3)
計畫類別: 個別型計畫 計畫編號: NSC92-2313-B-002-075- 執行期間: 92 年 08 月 01 日至 93 年 07 月 31 日 執行單位: 國立臺灣大學食品科技研究所 計畫主持人: 周正俊 計畫參與人員: 徐志安 李宜欣 報告類型: 精簡報告 處理方式: 本計畫可公開查詢中 華 民 國 93 年 5 月 26 日
行政院國家科學委員會專題研究計畫執行進度報告
雙叉桿菌具轉半乳糖作用
β
-半乳糖苷酶及其應用於半乳糖寡醣
合成之研究(2/3)
計畫編號:NSC92-2313-B-002-075
執行期限:92 年 8 月 1 日至 93 年 7 月 31 日
報告日期:93 年 5 月 31 日
主持人:周正俊 國立台灣大學食品科技研究所
一、中文摘要 本研究利用發酵槽(5L)培養 B. longum CCRC 15708 進行β-galactosidase 之生產, 探討培養溫度及培養液 pH 值對於菌體之 生長及β-galactosidase 產生之影響。並對 B. longum CCRC 15708 之β-galactosidase 進 行純化,探討其一些之理化特性。初步結 果顯示,培養溫度及培養液 pH 值均會影響 所試菌種在發酵槽中β-galactosidase 之產 量。於 32℃及培養液初始 pH 值為 6.5 下, 培養 12 小時後,可得較高(12.1 U/mL)之β-galactosidase 產量。以 Q sepharose fast flow 陰離子交換樹酯層析及 Superose 6 膠 體過濾層析作β-galactosidase 之部份純化 後,經 native-PAGE 分析,顯示 B. longum CCRC 15708 之β-galactosidase 之分子量約 為 323 kDa;同時,其酵素作用之最適反應 溫度及 pH 值則分別為 50℃及 7.0。 關鍵字:半乳糖苷酶,雙叉桿菌, 轉半乳糖 作用 二、緣由與目的
β-galactosidase 亦稱為 lactase (E. C. 3.2.1.23),可水解一分子之乳糖並產生一分 子之葡萄糖及半乳糖,β-galactosidase 轉化 乳糖成為半乳糖寡醣之作用機制乃當此酵 素與乳糖作用時,先將乳糖之β-1,4 糖苷鍵 切斷,並與半乳糖形成一酵素複合體,若 有帶羥基之分子靠近此複合體時,即會發 生鍵結轉移作用,故當靠近之分子為醣 類,即會成為一新的醣苷鍵,而形成寡醣
(Prenosil et al. 1987);此外,β-galactosidase 之理化特性會隨不同之菌株來源而有所不 同,Hung 及 Lee (2002)將來自 B. infantis HL96 之β-galactosidase 進行純化後發現, 其酵素分子量大小為 470 kDa,酵素作用最 適反應溫度及 pH 值分別為 60℃及 7.5;
Lactobacillus crispatus 之β-galactosidase 最 適反應溫度及 pH 值分別為 45℃及 6.5 (Kim and Rajagopal, 2000);Nagy 等 (2001) 則 指 出 Penicillium chrysogenum 之 β-galactosidase 分子量大小為 270 kDa,酵 素反應最適溫度為 27 至 37℃,且最適反應 pH 值為 4 至 5。 雙叉桿菌具有益生菌(probiotics)之生 理功能,如可維持腸道內正常微生物族 群、減少腸道內有害物質、預防大腸癌、 降低血液中膽固醇及脂質含量等重要生理 活性 (Berg 1998)。一些研究指出,此類菌 株 可 產 生 α- 及 β-galactosidase , 其 中 β-galactosidase 除可將乳糖分解成為葡萄 糖及半乳糖外,亦可將半乳糖作為接受 者,利用帶有之羥基與其他醣類結合,如 乳糖,進行轉半乳糖作用,生成半乳糖寡 醣 之寡醣類物質(Prenosil et al. 1987)。 吾 人 先 前曾篩選比較不同雙叉桿菌 β-galactosidase 之產生而發現,在所試之菌 株中以 B. longum CCRC 15708 產生之 β-galactosidase 最高,且針對其最適培養基 組成進行探討。在本研究中乃以 B. longum CCRC 15708 為試驗菌株,進一步以 5L 發 酵槽進行β-galactosidase 之生產,探討培養 溫度及培養液初始 pH 值等操作變數,對於 菌株之生長以及β-galactosidase 生產的影
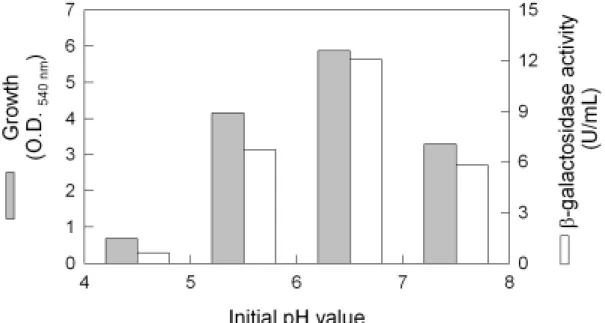
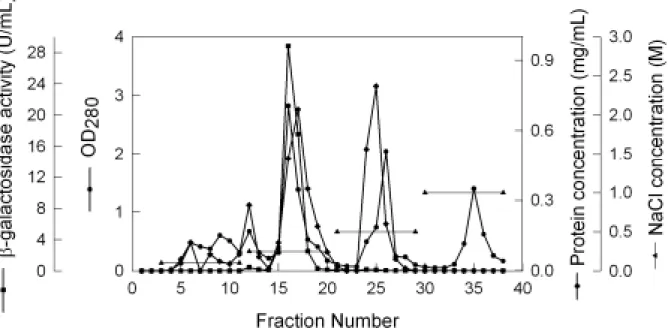
響。此外,並對β-galactosidase 進行純化, 探討其相關之理化特性。 三、結果與討論 1.培養溫度對於 B. longum CCRC 15708 生 長及β-galactosidase 活性之影響 以 發 酵 槽 (5L)在不同溫度下培養 B. longum CCRC 15708 經 12 小時後,試驗菌 株之生長及β-galactosidase 活性如圖一所 示。培養溫度為 37℃時,菌體之生長情形 最好,其濁度(OD540)達 6.58,其次是 32 及 42℃,而在 27℃下培養則生長最差。然而, β-galactosidase 酵素活性則以在 32℃為培 養溫度時,活性最高(13.2 U/mL),隨著培 養溫度之增加,β-galactosidase 活性亦隨之 降 低 , 當 培 養 溫 度 為 42 ℃ 時 , β-galactosidase 之活性為 3.1 U/mL,約為以 32℃培養時所得活性之 23.7%;而培養溫 度降至 27℃時,β-galactosidase 活性亦會隨 之降低,酵素活性僅有 9.8 U/mL。 2.培養液初始 pH 值對於 B. longum CCRC 15708 生長及β-galactosidase 活性之影響 培養液初始 pH 值(4.5、5.5、6.5 和 7.5),對於 B. longum CCRC 15708 生長及 β-galactosidase 活性之影響,如圖二所示。 培養液之 pH 值為 6.5 時,菌體之生長 最佳,於培養 12 小時後,菌體濁度(OD540) 為 6.71。隨著培養液初始 pH 值增至 7.5 或 降至 4.5,菌體濁度亦會隨之下降。同時, 當培養液初始 pH 值為 6.5 時,則可獲得最 佳 之 β-galactosidase 酵 素 活 性 (12.1 U/mL),其次為 5.5,7.5 次之,4.5 最差。 3. B. longum CCRC 15708 之 β-galactosidase 之純化 Nagy 等 (2001) 以 硫 銨 沉 澱 、 DEAE-Sephadex chromatography 、 affinity chromatography 及 chromatoffocusing 純化 P. chrysogenum 之β-galactosidase,結果發 現其酵素分子量約為 270 kDa。 因此吾人利用不同之純化步驟,將 B. longum CCRC 15708 所 產 生 之 β-galactosidase 進行純化。首先菌體用超音 波破碎後離心,所得之粗酵素液進行 Q sepharose fast flow 陰離子交換樹酯層析, 結果如圖三所示,具β-galactosidase 活性部 份(管號 12-20)於 NaCl 濃度為 0.25 M 時被 沖洗出,收集β-galactosidase 活性較高部份 (管號 15-17),分析發現其比活性由粗抽液 的 10.8 U/mg 提高至 41.5 U/mg,倍數提高 3.9 倍(表一)。
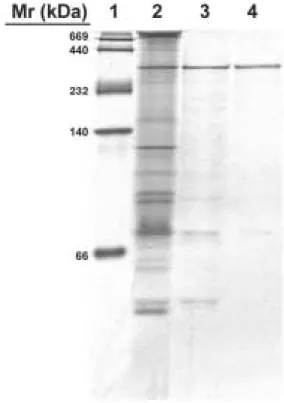
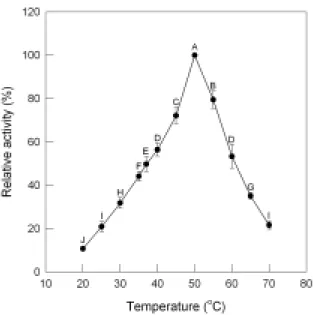
利用 Q sepharose fast flow 陰離子交換 樹酯層析所得之具活性部位以含 0.25 M NaCl 之 0.05 M 磷酸緩衝液(pH 6.5)進行透 析 24 小時後進行 Superose 6 膠體過濾層 析,結果如圖四所示。具β-galactosidase 活 性部份於管號 47-49 被沖洗出,收集所得 之β-galactosidase 比活性為 168.4 U/mg,純 化倍數達 15.7 倍,而回收率為 29.3%。 為了瞭解各純化步驟的效果,實驗中 利用 native-PAGE 電泳分析,結果如圖五 所示,當以 Q sepharose fast flow 陰離子交 換樹酯層析區分後,即可去除大部分之雜 蛋白,再經過 Superose 6 膠體過濾層析後 可以得到一個主要蛋白質片段,顯示這些 純化步驟可以確定已達到部份純化的結 果。同時與蛋白質標準品比較後,可推得 由 B. longum CCRC 15708 所 產 生 之 β-galactosidase 分子量約為 323 kDa。 4. B. longum CCRC 15708 之 β-galactosidase 最適反應溫度 B. longum CCRC 15708 之 β-galactosidase 經前述部份純化後,其最適 反應溫度之試驗結果如圖六所示。當反應 溫度為為 50℃時,β-galactosidase 之相對活 性最高,隨著反應溫度之上升(55-70℃)或 下降(45-20℃),β-galactosidase 之相對活性 均會快速地降低,此顯示本試驗菌株所產 生之β-galactosidase 最適反應溫度為 50℃。 5. B. longum CCRC 15708 之β-galactosidase 最適反應 pH 值 圖七為在不同 pH 下,β-galactosidase 所 呈 現 之 活 性 。 所 測 試 之 pH 值 中 (4.5-9.0) , B. longum CCRC 15708 之
β-galactosidase 最適反應 pH 值為 7.0,當 pH 值降低至 6.0 以下時,β-galactosidase 之活性會急劇地降低,pH 值為 4.5 時,酵 素之相對活性降至為 0%,反之,當反應 pH 值提高至 7.5 以上時,亦會有相似之情 形。 四、初步結論 在以 5L 發酵槽培養 B. longum CCRC 15708 產生之β-galactosidase 時,32℃及 6.5 分別為此菌株產生β-galactosidase 之最佳 培養溫度及 pH 值。經 Q sepharose fast flow 陰離子交換樹酯層析及 Superose 6 膠體過 濾 層 析 後 , 可 得 純 化 倍 數 為 15.7 倍 之 β-galactosidase,並經由 native-PAGE 分析 後 , 可 知 B. longum CCRC 15708 之 β-galactosidase 之分子量約為 323 kDa;同 時,其最適反應溫度及 pH 值則分別為 50 ℃及 7.0。 四、參考文獻
1. Berg RD. 1998. Probiotics, prebiotics or ‘conbiotics’? Trends Microbiol 6:89-92. 2. Kim JW, Rajagopal SN. 2000. Isolation
and characterization of β-galactosidase from Lactobacillus crispatus. Folia Microbiol 45:29-34.
3. Nagy Z, Kiss T, Szentirmai A, Biro S. 2001. β-Galactosidase of Penicillium
chrysogenum: Production, purification,
and characterization of the enzyme. Protein Expr Purif 21:24-29.
4. Prenosil JE, Stuker E, Bourne JR. 1987. Formation of oligosaccharides during enzymatic lactose: Part I: State of art. Biotechnol Bioeng 30:1019-1025.
5. Hung MN, Lee BH. 2002. Purification and characterization of β-galactosidase with transgalactosylation activity from
Bifidobacterium infantis HL96. Appl
Figure 1. Effect of cultivation temperature on the growth and production of β-galactosidase by
B. longum CCRC 15708. Operation conditions: agitation speed, 50 rpm; pH 6.5.
Figure 2. Effect of initial pH value on the growth and production of β-galactosidase by B.
longum CCRC 15708. Operation conditions: agitation speed, 50 rpm; temperature,
Figure 3. The elution profile of Q fast flow chromatography of β-galactosidase from B.
longum CCRC 15708. (), β-galactosidase activity; (z), OD280; (¡), protein concentration; (c), NaCl concentration.
Figure 4. The elution profile of Superose 6 gel filtration of β-galactosidase from B. longum CCRC 15708. (), β-galactosidase activity; (¡), protein concentration.
Table 1 Purification of β-galactosidase from B. longum CCRC 15708 Purification step Total protein
(mg) Total activity (U) Specific activity (U/mg) Purification Recovery factor (%) Crude extract 66.2 712.4 10.8 1.0 100.0 Q fast flow 12.2 506.0 41.5 3.9 71.0
Superose 6 gel filtration 1.2 209.1 168.4 15.7 29.3
Figure 5. The native-PAGE of β-galactosidase from B. longum CCRC 15708. Lane 1, marker proteins; lane 2, crude extract; lane 3, Q fast flow chromatography; lane 4, Superose 6.
Figure 6. Optimal temperature of the purified β-galactosidase using OPNG as substrate.
Figure 7. Optimal pH of the purified β-galactosidase using OPNG as substrate. The buffers used are citrate buffer (pH 4.5-6.0), Na-phosphate buffer (pH 6.5-8.0), and boric acid buffer (pH 9.0-9.5).