第六章 酵素
除了少數具催化活性的
RNA 酵素
「稱核糖
酶(Ribozyme) 」外,
酵素幾乎全是蛋白質。
生命過程是由無數的生化反應組成
,沒有酵素催化這些反應,即無法
維持生命的運作。
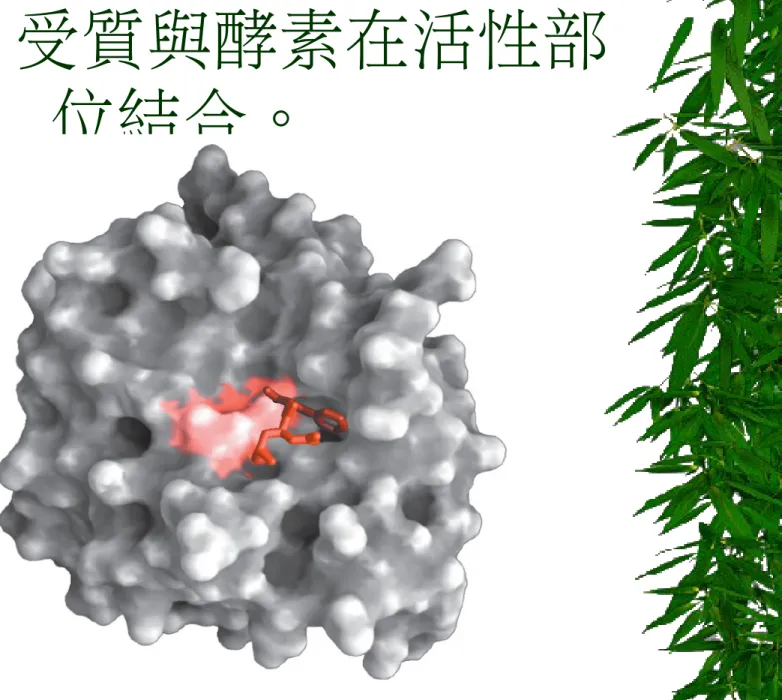
溶解酵素空間填充模式 溶解酵素 (lysozyme) ,是發 現於眼淚和唾液的酵素,靠著水解細胞壁的多醣而摧 毀某些細菌。在這個空間填充模式中,顯示多胜肽和 一個接合的多醣 ( 綠色 ) 片段在一起。
圖
6-1 受質與酵素在活性部
位結合。
A + B C
溫度升高或增加反應物濃度
時 A 與 B
兩種分子碰撞的機會增加,但並不是
所有的碰撞皆能導致化學反應,當碰
撞分子擁有促成一個化學反應發生的
最少能量
(activation energy:
稱活化能 ) 時,反應發生。
在生物體,升高反應溫度會破壞生
物結構而且細胞內的反應物濃度物
低,因此要加速生化反應,生物體
選擇酵素
(enzyme) 來克服面臨的
問題。
酵素具有數種特性
1 酵素的催化能力強
2 催化具高度的特異性,副產品
鮮少生成,與無機催化劑有顯著的
差異。
3 因為酵素結構複雜,酵素常具
有調控的功能。
酵素的作用
催化劑能增加化學反應的速率,但
本身的卻不變。其角色在降低化學
反應的活化能,換句話催化劑能供
反應走低活化能的途徑。
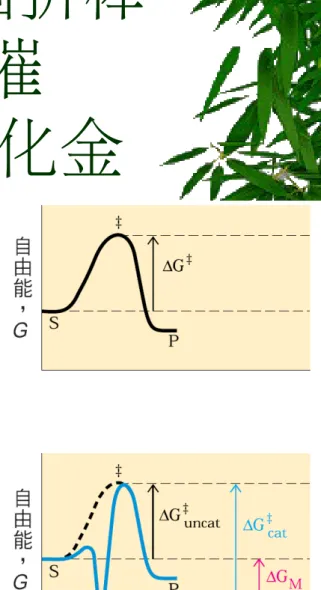
過渡狀態
(transition
state)
發生在兩個反應途徑的高峰處。生物反應時 ,過渡狀態發生在受質結合酵素時。蛋白催 化劑提供特殊的表面與反應物結合,一些酵 素修正它們結構形狀,進而降低活化能且形 成受質 (substrate) 的過渡狀態。 酵素能穩定過渡狀態,如此有利於反應的進 行,但酵素不能改變反應的平衡,但可加速 達到平衡狀態。圖
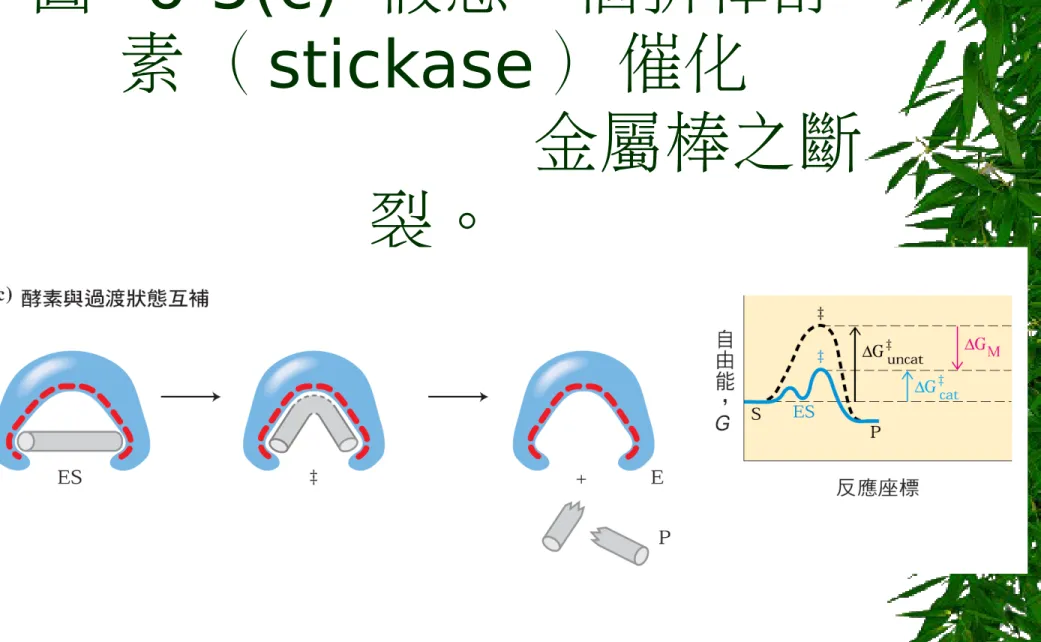
6-5(a)(b) 假想一個折棒
酵素(
stickase )催
化金
屬棒之斷裂。
圖
6-5(c) 假想一個折棒酵
素(
stickase )催化
金屬棒之斷
裂。
酵素分子皆含有獨特且複雜的結合表面 稱活化位置 (active site) ,反應 物分子稱 (substrate) ,能結合酵素 的活化位置。這些活化位置常位於大蛋 白質分子結構中的一個小的裂縫 (cleft) 或罅隙 (crevice) 。 活化位置並不一定是結合位置,有許多 胺基酸的 R 基會排在活化置參與催化的 過程。
一些酵素的催化活性是依靠活化位置上 的胺基酸與受質間的交互作。 一些酵素需要結合非蛋白質部分才具有 活性。這些酵素的輔因子 (cofactor) 可能是離子 ( 如 Mg2+ 、 Zn2+) 或複雜 的有機分子,如輔酶等。這些酵素的蛋 白質內不含輔因子稱 apoenzyme ,帶 上輔因子的酵素,稱 holoenzyme 。
酵素的分類
世界生化聯合會 (IUB) 建立了一套命名酵素的系 統。分 (E.C.A.X.X.X.), 其中 EC 是 enzyme commission ,而 A 的部分有六種主要的項目 1 Oxidoreductase: 氧化還原酶催化氧化還 原反應。 2 Transferase: 轉移酶催化轉移一個分子上 的基 (group) 至另一個分子上面。 3 Hydrolase: 水解酶催化鍵的斷裂,伴隨水 的加入。包含酯化酶、去磷酸酶、 peptidase 。 4 lyase: 溶解酶催化除去分子中的 (H2O 、 CO2 與 NH3) 形成雙鍵或加入這些基 (H2O 、 CO2 與 NH3 ) 至雙鍵上。如 decarboxylase 、 hydratase 與 deaminase 。 5 Isomerase: 異位酶催化數種型式的分子 (intramolecular rearrangement) Epimerases 催化不對稱碳的轉換。 Mutase 催 化分子內的功能基的轉換。 6 Ligase: 接合酶催化兩個受質分子形成共價 鍵。這些反應所需的能量常是 ATP 水解後供應。
酵素動力學
(Enzyme
Kinetics)
當 A 為受質和 P 為產物時, A→ P 反 應的初始速率 v0 為:
如果反應是 A + B P ,反應速 率依兩個反應濃度而改變,即 A 與 B 必 須碰撞才能形成產物者
Michaelis-Menten Kinetics
研究酵素催化速率最常用的模型是由
Leonor Michaelis
與 Maud
Menten
在 1913 年提出的 : 當受質
(substrate: S) 結合酵素於活化
位置時,會形成過渡狀態中間複合物
(ES) ,此時、受質被轉換成產物。
米契爾 -曼騰動力學
它的假設是 (1) 和 k3 比較時 k1;k2 是 可以忽略; (2) 在絕大部分反應中 ES 形成之速率要等於 ES 分解之速率 [ 後 者符合所謂的穩定狀態假設。
米契爾 - 曼騰方程式推導
k1[Ef][S] = k2[ES] + k3[ES] [Et] = [Ef] + [ES]
k1([Et]-[ES])[S] = (k2+k3)[ES] [ES] = k1[Et][S] / k1[S]+(k2+k3) v = k3[ES]
Vmax = k3[Et]
v = k1 { k3[Et][S] / k1[S]+(k2+k3) } Vmax[S]
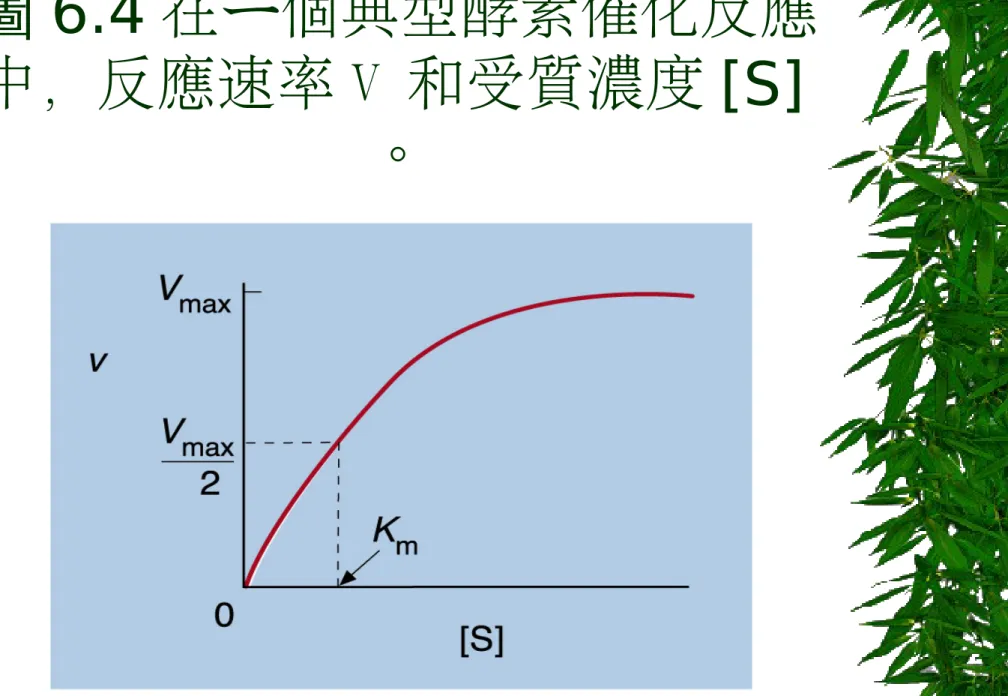
圖 6.4 在ㄧ個典型酵素催化反應
中,反應速率 V 和受質濃度
[S]
酵素動力學的參數
Vmax : 反應能達到的最大速率 kM : 是一個常數,稱米氏常數 (Michaelis constant) kM 越小,酵素與受質的親和力越大。 kM 越大,酵素與受質的親和力越小。 轉換率 :Turnover number (kcat)
在每個酵素作用下,受質每秒轉換成產 物數量的值。
酵素之轉變數 (turnover number) (kcat) 被定義為
酵素活性的定量
酵素活性的量度是以國際單位
「 international unit (I.U.)
,一個
I.U. 的定義成每分鐘產生 1
μmole 的產物。
專一活性
(Specific activity)
是用來表示酵素的純度的單位。定義
Lineweaver-Burk Plots
賴威弗 - 伯克圖
(Lineweaver-Burk Plots): 假如一個酵素遵
守 Michaelis-Meten
kinetics 模型 , 當受質濃度改變
時,經由初速的量取可以決定
km
與 Vmax 值。
Michaelis-Menten 方程式為 一種常用的轉換方式就是將 Michaelis-Menten 方程 式兩邊同時做倒數處理。方程式成為: 再將方程式右方的分子分開: 再簡化成: 此形式的 Michaelis-Menten 方程式稱為 ineweaver-Burk 方程式( Lineweaver-ineweaver-Burkequation )。 p.209 BOX 6-1 Michaelis-Menten 方程式的轉換型式:雙倒數繪圖
p.209
賴威佛 -伯克圖解
1/[S] 為 X 軸, 1/[V]
為 Y 軸
,畫出其線性的圖形。
km/Vmax 是其斜率,直線與 X 軸
相交的點為
– 1/km
,
Vmax
、 km 的值可由斜率與交會點
求出。
酵素的抑制
酵素活性能被一些抑制劑所抑制,研究 酵素抑制的機制具有實際的應用性。 1 臨床的治療應用 2 充當生化研究的工具。 抑制可能是 1 不可逆抑制 2 可逆抑制 而不可逆的抑制劑通常會與酵素分子形成共 價鍵,而形成共價鍵的胺基酸常位於活化位 置。 例如一些以硫醇基 (-SH) 為活化位置的酵素 ,常受到 iodoacetate 所抑制。 Glyceraldehyde-3-phosphate dehydrogenase (G3PD) 會與 iodoacetate 形成共價鍵,造成酵素失 去活性。
酵素抑制作用
Amoxicillin with clavulanic acid (Beta-lactamase inhibitor)
青黴素的機轉 : 1. 競爭性抑制細菌酵素 transpeptidase 2. 能作用在細菌 Penicillin-binding proteins, 抑制細菌細胞 壁的合成
NDM-1 superbugs
New Delhi
Metallo-beta-lactamase (NDM-1) is an
enzyme that makes bacteria
resistant to a broad range of
beta-lactam antibiotics
The most common bacteria that
make this enzyme are Gram negative such as
Escherichia coli and Klebsiella
pneumoniae ( 肺炎克雷白氏菌 ), but
the gene for NDM-1 can spread from one strain of bacteria to another by horizontal gene transfer.
可逆性抑制
當抑制劑能與酵素的結合是非共價鍵結 合時,它們彼此是可分離的。 可逆性的抑制可分成 : 1 競爭性 (competitive) 的抑制 2 非競爭性 (noncompetitive) 的抑 制 3 不競爭性 (uncompetitive) 的抑 制競爭性的抑制作用
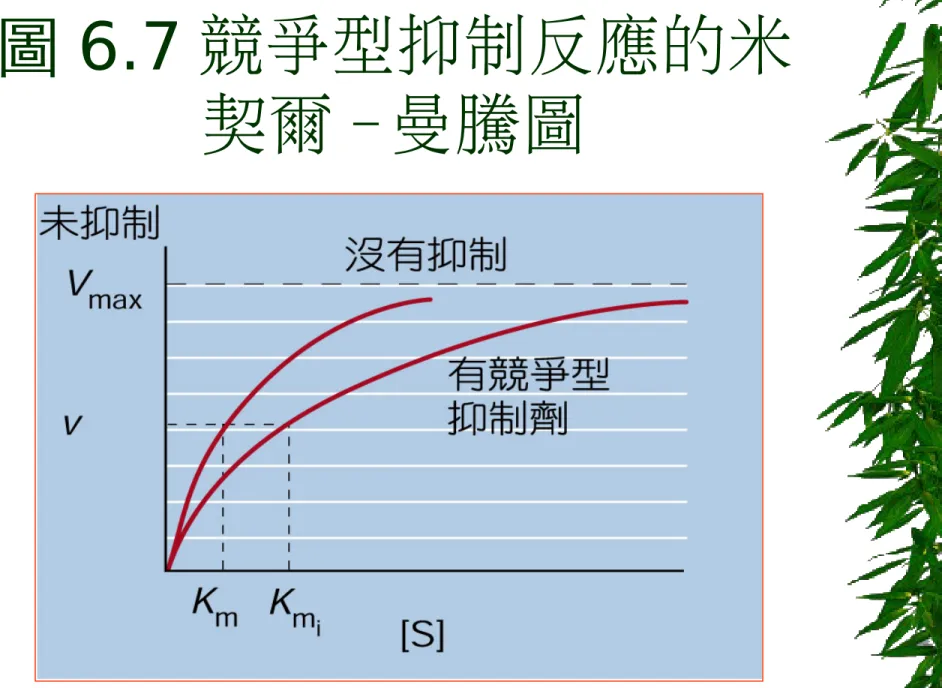
當抑制劑的結構與酵素專一性的受質結 構很類似時,因為它的結構很相似,因 此可競爭結合酵素的活化位置,形成酵 素與抑制劑的複合體。 由於抑制劑會佔據活化位置,且無助於 產物的生成,導致酵素的活性減少。 而競爭性的抑制劑抑制酵素活性可經由 受質濃度之增加而逆轉。圖 6.7 競爭型抑制反應的米
契爾 -曼騰圖
圖 6.11 酵素抑制反應的動力
分析
(a) 競爭型抑制反應。在 1/v 對 1/[S] 的圖中,存在不同濃 度的抑制劑相交於垂直軸相 同的 1/Vmax 點上。 因此當受質 (substrate) 的濃度很高 時,所有受質的活化位置皆充滿受質, 此時反應速率也可達到 Vmax 例如 : Succinate + FAD Furmarate + FADH2 此反應中相當出名的抑制劑 malonate ,是屬於競爭性抑制劑。
非競爭性抑制
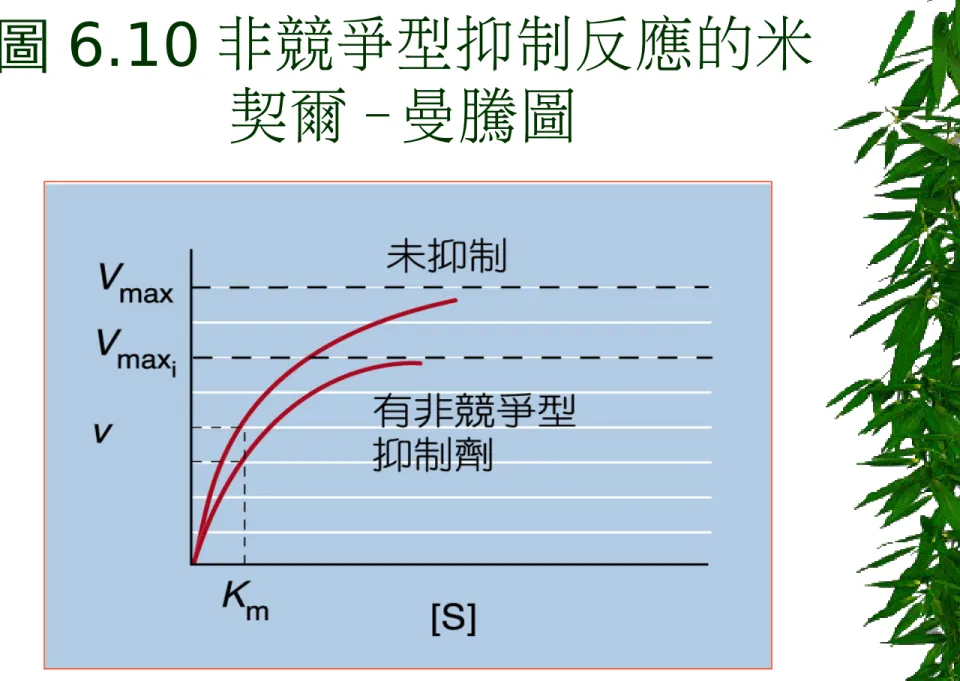
抑制劑結合酵素的位置不是活化位置時,會 導致 EI 與 EIS 的複合體的形式,此時抑制 劑與酵素結合能改變酵素的三度空間的結構 並抑制其反應。 例如 AMP 是一個 fructose-1,6-bisphosphatase 的非競爭性抑制劑,非競 爭性的抑制並不會因增加受質的濃度而可逆 。非競爭型抑制劑
(non-competitiveinhibitors)
圖 6.10 非競爭型抑制反應的米
契爾 -曼騰圖
圖 6.11 酵素抑制反應的動力
分析
(c) 非競爭型抑制反應。在 1/v 對 1/[S] 的圖中,存在 不同濃度的抑制劑,皆相 交於㈬平軸上的相同- 1/Km 點上。在非競爭型抑 制反應中 ES 和 EIS 的解 離常數倍假設維持相同。不競爭抑制
抑制劑只結合 ES( 酶與受質的複合物 ) ,而不結合非游離的酶。 加入更多的受質至反應中,結果增加反 應之速率,但無法達到無抑制作用時之 程度。 不競爭型抑制反應最常出現在酶結合不 只一個受質之反應。圖 6.11 酵素抑制反應的動力
分析
(b) 不競爭型抑制反應, 在 1/v 對 1/[S] 的圖中, 存在不同濃度的抑制劑, 在垂直軸及水平軸皆無交 於相同點上。酵素抑制的動力學分析
競爭性抑制與非競爭性的抑制很容易由雙 倒數圖 (double-reciprocal plots) 區別出來。 1 競爭性 (competitive) 的抑制 1/V=1/Vmax+kM(1+I/Ki)/Vmax(1/ [S]) 2 非競爭性 (noncompetitive) 的抑 制
1/V=1/Vmax(1+I/Ki)
酵素催化時溫度與
pH 的效應
溫度 : 溫度越高,反應速率越高。這是因為更 多的分子具有足夠的能量達到 transition state 。 酵素的反應速率會隨溫度增加,但因蛋 白質在高溫會變性,因此每一個酵素皆 有最大效能的溫度 (optimum temperature) 。圖 6.17 溫度對酵素活性之影
響
pH 值的影響
氫離子濃度以數種方式影響酵素 1 氫離子的濃度影響活化位置上胺基酸 的離子程度。 2 改變離子基的電荷可能影響酵素的三 度空間的結構。 pH 值劇烈的改變,常 導致酵素的變性。大部分的酵素僅能在 窄小的 pH 範圍具有活性。圖 6.18 pH 值對兩個酵素之
影響
動力學的研究給與酵素催化生化反應 的訊息相當少,一些技術常用於研究酵 素催化的機制。如 x- 射線繞射的結晶 學、化學修飾法與定點突變法等。 催化機制 : 雖然只有少數酵素機制被詳細的了解, 但卻有普遍的共通性。
酵素催化的詳細機制
以下是一個酵素的催化機制。
1 Chymotrypsin: chymotrypsin 是一個 27
kDa 的蛋白質,屬於 serine protease 家族的
一員。所有 serine protease 的活化位置皆含
一組特性的胺基酸 Ser 、 His 與 Asp 。
以 chymotrypsin 與其受質類似物共結晶的研究
中顯示, His57 、 Asp102 與 Ser195 這幾個胺
基酸是位於彼此接近的活化位置上。而活化位置上 的 serine 對於這族蛋白的催化活性機制至為重要 。
酵素催化作用的詳細機制
胰凝乳蛋白酶 (chymotrypsin)
圖
6
.1
9
胰
凝
乳
蛋
酶
作
用
可
能
的
機
制
圖 6.20 酒精去氫酶活化沒位置
的官能基群
酵素的調控
在活細胞中的酵素催化反應常呈現連續步驟型 的代謝途徑。每一個途徑是由一系列的催化步 驟組成。生物體已進化明智的機制來調控代謝 途徑。調控必需的理由如下 : 1 維持細胞的秩序 : 調控每一個途徑,產生維 持細胞結構與功能的物質且不致於浪費資源。 2 保存能量 : 當省則省,當用則用。 3 應付環境的變化 : 細胞能依照環境的所需, 增加或減少其反應速率。酵素催化中輔因子的角色
數種因素有助於酵素的催化。 1 金屬離子 : 生命體內重要的金屬分 成兩類 (1) 過渡金屬離子 (Fe2+ 與 Cu2+) (2) 鹼土族 :Ca Mg 過渡金屬最適合輔助催化反應,而鹼性金 屬雖然在生物體中扮演重要的角色,但罕 出現在輔助酵素功能上。輔酶
(Coenzyme)
Vitamine 此字源於波蘭生化學家 Casimir Funk 。在 1912 年,他從米殼中 純化出一種微量的有機營養物,此種物質可 阻止一種營養缺乏症 Beriberi (“ 腳氣病 ”一種神經退化症 ) 。因為這個因子 (factor) 具胺類 (amine) 特性,因此稱 此因子為 vitamine; 意思是這個胺類物質 是生命必需的。之後、其他微量且必需的有 機營養物陸陸續續被發現,因為並非都是胺 類,因此把尾字的 e 去掉成為 vitamin 。Nicotinamide
Vitamin are essential component of
coenzymes and enzyme prosthetic groups
Nicotinamide is the active group of the
coenzymes NAD+ and NADP+
Nicotinamide 具有兩個相同的
coenzymes(NAD+ 與 NADP+) 。這些
coenzymes 在生物體中具有氧化態 NAD+
圖 6.15 菸鹼醯胺腺嘌呤雙核苷酸
圖 6.15 菸鹼醯胺腺嘌呤雙核苷酸 b
Biochemical functions
Otto Warburg 首先純化出
glucose-6-phosphate dehydrogenase 之後証實
NADP+是其 Coenzyme
The nicotinamide component of these
coenzymes serves as the transient
intermediate carrier of a hydride ion (H- ) that is enzymatically removed from
a substrate molecule by the action of certain dehydrogenase.
Vitamin B
2(riboflavin)
Vitamin B2 (riboflavin) is a
component of the flavin nucleotides
Vitamin B2 或 riboflavin 首先是由牛奶
中分離出來, 1935 年由 Paul Karer 証 實其結構並合成出來。它具有深黃色是 由於帶有 isoalloxazine ring system 。隨 後再証實它具有兩形式的 coenzyme;
flavin mononucleotide (FMN) 與
Biochemical functions
They function is tightly bound
prosthetic groups of a class of dehydrogenases known as
flavoproteins or flavin dehydrogenase.
serves as a transient carrier of a pair
酵素的調控
調控代謝途徑是相當複雜的,調控的模式 具有四種方式 : 1 基因控制 (genetic control) 2 共價鍵修飾 (covalent modification) 3 異化調控 (allosteric regulation) 4 區隔性 (compartmentation) 。 1 基因控制 : 酵素的誘發 : 依據細胞代謝的需要而合成酵 素,能允許細胞對環境的改變作有效的反應 。 例如 : 大腸桿菌生長在葡萄糖的環境,當培 養基加入乳糖時,一開始並無法代謝乳糖。 當培養基中缺乏葡萄糖時,大腸桿菌開始利 用乳糖,乳糖相關的酵素合成被啟動。
2 共價修飾 : 一些會經由形成可逆性的活化型與失活型 酵素來調控其活性。數種酵素的共價修飾 形式會改變酵素的三度空間的結構並改變 其活性。肝醣磷酸化酶 (glycogen phosphorylase) 是催化肝醣分解的第 一個化學反應。許多荷爾蒙的作用是透過 磷酸化此酵素的 serine 的位置來活化。
數種酵素是以不活化的前驅物被產製與 儲存,稱 proenzyme 或 Zymogen 。 Zymogen 被轉換成活化的酵素,經由 不可逆的斷裂一個或數個 peptide bond 。例如 chymotrypsinogen 是 由胰臟生成後分泌至小腸,隨後由數個 步驟轉成活化形式。
圖 6.21 胰凝乳蛋白酶原的活化
作用
異化調控 :
細胞利用異化調控來有效的反應胞內狀 況的改變。異化酵素常受到數種
effector 作用。結合 effector 至 異化酵素能影響受質與酵素的結合。
圖 6.22 酵素催化反應之速率是
受受質濃度作用
圖
6
.2
3
回
饋
抑
制
作
用
區隔
(compartmentation)
在真核細胞中,生化代謝途徑常由
不同的胞器區隔出來。這些生理上
的區隔使得某些剛好相反的途徑變
得很好控制。例如脂肪的合成發生
在胞質中,而脂肪的分解反應卻發
生在粒線體。另外一些因子在特定
的胞器內具有較高的濃度。
酵素的技術在醫學上的應用
牛胃中得到的蛋白” rennin” 是一個
protease ,數千年來已用來產生起司 (cheese) 。
酵素應用在醫學上是源於 1954 年,研究者
發現, aspartate aminotransferase (GOT) 在心肌梗塞 (myocardial infraction) 患者的血 液中會升高。,接下來又發現肝臟損壞的病 人,血液中 GPT 會升高。之後酵素技術常用 於醫學的診斷與治療方面。

![圖 6.11 酵素抑制反應的動力 分析 (a) 競爭型抑制反應。在 1/v 對 1/[S] 的圖中,存在不同濃 度的抑制劑相交於垂直軸相 同的 1/V max 點上。](https://thumb-ap.123doks.com/thumbv2/9libinfo/7002973.2399/47.1080.61.1080.50.767/分析制反應在對圖中存在不同度的抑制劑相交於垂直軸相同的點上.webp)
![圖 6.11 酵素抑制反應的動力 分析 (c) 非競爭型抑制反應。在 1/v 對 1/[S] 的圖中,存在 不同濃度的抑制劑,皆相 交於㈬平軸上的相同 - 1/K m 點上。在非競爭型抑 制反應中 ES 和 EIS 的解 離常數倍假設維持相同。](https://thumb-ap.123doks.com/thumbv2/9libinfo/7002973.2399/52.1080.25.1080.46.755/存在濃度劑皆交於平軸上的相同點上在非競爭型抑制反應中和相同.webp)
![圖 6.11 酵素抑制反應的動力 分析 (b) 不競爭型抑制反應, 在 1/v 對 1/[S] 的圖中, 存在不同濃度的抑制劑, 在垂直軸及水平軸皆無交 於相同點上。](https://thumb-ap.123doks.com/thumbv2/9libinfo/7002973.2399/55.1080.57.1077.41.704/不競爭型抑制反應在對圖中存在不同濃度抑制直軸及水平軸點上.webp)