藥物開發和診斷開發的投資回報率之間的比較研究/以抗體藥物與抗體應用檢驗為例 - 政大學術集成
全文
(2) 0.
(3) 摘要 近幾年的生物技術逐漸成熟,讓全球的生技產業逐漸蓬勃發展,我國也不例 外地將其列為重點產業之一。然而在近期國際間主流的藥物大多為生物製藥,大 多是抗體以及重組蛋白的產品,而這些藥物主要都是利用找尋到人體的生物標誌 (biomarker)後所設計出來,因此從而衍生出個人化醫療藥物的新概念,隨之發展 出許多利用相同原理的檢測產品,因此探究此類檢測產品與藥品的生物技術的根 源,大多是同源的。而通常在發展新穎、創新技術的單位大多是學術研發單位, 在考慮商業化的方向時,到底該考慮那些因素?以抗體為例,是該發展成藥物, 還是該發展成體外檢測產品,會對於該技術而言有最佳成功率及最好的投資回 報? 本文就歷年來的雙方產業已有的文獻加以收集,並分析市場資訊及報酬率, 並利用現有的市場抗體 Herceptin 與伴隨藥物的分子檢測產品 Herceptest 為例子, 進行淨現值的運算。其中整理文獻結果發現:同樣是 10 年的 NPV,是以抗體藥 的 12.6 億美元較高 (分子檢測 10 年 NPV 為 1480 萬美元),但是雙方的投入的成 本相當懸殊,發展藥品的入需要的成本為 22.67 億美元,檢測產品只需要 4500 萬美元,相差相當懸殊。但 NPV/cost 還是以投資藥業來得高(0.56 vs. 0.32),其原 因主要來自於藥物發展是一個較成熟的市場,分子檢測產品是一個新的產品,仍 有許多層面的問題,如:付款者、醫生、相關利益關係供應商、產品信賴度等問 題,造成市場發展較為遲緩。 然而廠商是否該投入藥物產業或者是檢測產業,不應該僅只由獲利面來觀 看,而應由全面的檢視團隊的能力,利用「計畫決策衡量評分表(Project decision measure score sheet)」來對預投入的產品方向、疾病作評估,才能夠做出最適合 及最有可能成功的技術商業化方向。. 關鍵字:ROI、NPV、抗體藥物、體外檢測、分子檢測 i.
(4) Abstract. Most blockbuster medicine in recent years is biopharmaceutical, especially made for antibody and recombinant protein products. These products are designed from human biomarkers and they drive a new idea of “Personalized Medicine.” When scientists in a laboratory of universities or research institutes establish a novel antibody, what is the key factor to decide the way of commercialization? What is the best moneymaker to the investment, the therapeutic antibody or the vitro diagnostic? The topic is aiming at the expense and the ROI (return of investment) comparison between the development of antibody medicine and molecular diagnostic. The published papers and the market information are collected and analyzed the ROI of two different product directions by Net Present Value (NPV) and the costs. The therapeutic antibody, Herceptin, and its companion diagnostic products, Herceptest, are given as examples to calculate the NPV and the Internal Rate of Return (IRR); some results has been published: the ten-year NPV of antibody medicine is 1.26 billion, higher than 14.8 million, the NPV of molecular diagnostic. However, the cost of antibody medicine is 2.267 billion, much higher than the diagnostic, 45 million. The returning ratio of antibody medicine (NPV/cost=0.56) is also higher than diagnostic (0.32). The molecular diagnostic products might be novel for traditional diagnostic technology, and thus, the pharmacy business seems to be a better choice. Also, lots of challenges need to be overcome for diagnostic, such as payer coverage, physicians’ habits, relevant beneficial suppliers, and product reliabilities. They all slow down the market to grow. The ROI cannot be the only factor for a company to decide the program practicability. The operational team should be evaluated comprehensively in the first place, and then use “Project Decision Measure Score Sheet” to measure the targeted. ii.
(5) product and disease is highly advised and believed to be helpful for the commercialization.. Key word: ROI, NPV, antibody medicine, IVD, molecular diagnostic. iii.
(6) 目錄 摘要................................................................................................................................. i Abstract .......................................................................................................................... ii 圖目錄........................................................................................................................... vi 表目錄......................................................................................................................... viii 第一章 緒論 ................................................................................................................. 1 第一節 研究動機與目的...................................................................................... 1 第二節. 研究問題................................................................................................ 3. 第三節 研究範圍.................................................................................................. 6 第四節. 論文架構................................................................................................ 8. 第二章 相關名詞與技術介紹 ..................................................................................... 9 第一節. 抗體藥物相關介紹 ........................................................................... 9. 一、. 抗體定義........................................................................................ 9. 二、. 單株抗體原理與目前技術發展.................................................. 11. 第二節. 抗體體外檢測應用相關介紹 ......................................................... 13. 一、抗體技術成熟的應用於:.................................................................. 15 二、抗體技術應用於新興領域:.............................................................. 16 第三章 文獻與市場資料蒐集 ................................................................................... 18 第一節. 理論文獻蒐集 ................................................................................. 18. 一、. 投資回報...................................................................................... 18. 二、. 藥物發展與體外檢測發展.......................................................... 22. 三、. 賽局理論...................................................................................... 32. 第二節. 市場資料蒐集 ................................................................................. 42. 一、. 抗體藥物市場.............................................................................. 42. 二、. 抗體於體外診斷市場應用.......................................................... 45. iv.
(7) 第四章 數據分析結果與討論 ................................................................................... 47 第一節. 抗體技術於藥物發展與體外檢測技術發展之投資回報率 ......... 47. 一、. 抗體藥物...................................................................................... 47. 二、. 抗體應用之體外檢測.................................................................. 47. 三、. 以抗腫瘤藥物以及伴隨檢測(分子檢測)為模型計算 ............... 48. 第二節. 伴隨檢測獲利遲緩的背後因素討論 ............................................. 57. 第三節. 伴隨檢測市場上的賽局困局與可能的解決方式 ......................... 59. 一、賽局的困境:...................................................................................... 59 二、可能的解決方式:.............................................................................. 60 第四節. 台灣廠商狀況與可行的著力點 ..................................................... 62. 一、. 抗體藥物...................................................................................... 65. 二、. 抗體檢測應用:分子檢測,台灣廠商以基因序列產品為主.. 68. 三、. 台灣廠商未來可能的利基.......................................................... 69. 第五章 結論與建議 ................................................................................................... 72 參考資料:.................................................................................................................. 83 附錄 A. Herceptin 抗體藥物預估現值計算模型 .................................................... 91 附錄 B. Herceptest 分子檢測預估現值計算模型................................................... 93. v.
(8) 圖目錄 圖 1-1 論文架構圖 .................................................................................................... 8 圖 2-1 血球與淋巴細胞的來源分類 ....................................................................... 10 圖 2-2 記憶 B 細胞製造抗體途徑 ......................................................................... 11 圖 2-3 Kohler G 和 Milstein 法利用骨髓瘤融合製造單株抗體 ............................ 12 圖 2-4 單株抗體的種類 .......................................................................................... 13 圖 2-5 全球 IVD 產品市場比例 ............................................................................... 14 圖 2-6 消費者對個人化檢測產品的期待 ............................................................... 15 圖 3-1 藥物產品與檢測產品發展模型說明 ........................................................... 23 圖 3-2 每一個新藥上市所需花費之資本成本 ....................................................... 24 圖 3-3 小分子藥物與生物藥物 10 年 NPV 計算.................................................... 25 圖 3-4 新藥研發臨床轉移率(29) ............................................................................. 26 圖 3-5 傳統藥物與生物藥物上市平均各階段所需時間 ....................................... 27 圖 3-6 新藥研發主要臨床與上市等待期所需時間變化 ...................................... 27 圖 3-7 新藥上市平均年數量(每 5 年區間),包含:優先程序和標準程序 ........ 28 圖 3-8 IVD 產品開發流程與試劑外 IVD 產品分類審核流程 ................................ 29 圖 3-9 分子檢測平均產品開發成本與 NPV 的估算,以及開發所需時間的關係 ........................................................................................................................... 31 圖 3-10 全球抗體藥物銷售(資料來源 ITIS 2009,MarketResearch.com 2013) . 42 圖 3-11 生物藥物平均發展所需成本(a)與投入時間(b)....................................... 44 圖 3-12 生物製藥實際銷售量歷史平均資料與預估(a)及生物製藥的投資與輸出 獲利假設模型(b) .............................................................................................. 45 圖 3-13 分子檢測市場 2002~2012 市場成長與區域分布(49; 50) ........................... 46 圖 4-1 Herceptin 25 年現值(PV)呈現模型 .............................................................. 55. vi.
(9) 圖 4-2 Herceptest 25 年現值(PV)呈現模型 ............................................................ 56 圖 5-1 技術商業化使用「計畫決策衡量評分表」流程 .................................. …73. vii.
(10) 表目錄 表 3-1 新藥開發成本統整 ....................................................................................... 24 表 3-2 賽局的基本元素 ...................................................................................... 32~33 表 3-3 賽局形式的分類 ............................................................................................ 33 表 3-4 賽局類型 .................................................................................................. 37~40 表 4-1 基本假設參數與假設說明(此部分以癌症抗體用藥與伴隨檢測為計算例 子) ....................................................................................................................... 54 表 4-2 全球抗體藥物前 10 大銷售之癌症用藥上市、專利、預估 Max Peak sales 整理 .................................................................................................................... 55 表 4-3 台灣 IVD 產品出口值 .............................................................................. 63~64 表 4-4 台灣投入抗體藥物廠商 .......................................................................... 65~67 表 4-4 台灣抗體應用於分子診斷廠商 .................................................................... 68 表 5-1 針對乳癌做 PIVO-8、PIVO-24 技術的計畫決策評量評分表 .................. 766 表 5-2 針對大腸直腸癌做 PIVO-8、PIVO-24 技術的計畫決策評量評分表 ....... 799 表 5-3 針對卵巢癌做 PIVO-8、PIVO-24 技術的計畫決策評量評分表 ................. 81. viii.
(11) 第一章 緒論 第一節 研究動機與目的. 民國 98 年行政院,規劃「台灣生技起飛鑽石行動方案」,雖然其中重要的台 灣生技創投基金 TMF 募資在 2012 年面臨破局,但全球生技基金的表現仍然是績 效最佳(1),在全球金融海嘯後,也唯有生醫製藥產業不太受到影響,持續的穩定 成長,而根據 2012 年我國出版的生技白皮書中指出,全球生技市場在各國積極推 動醫療改革政策之下,市場規模穩健成長,尤其生技藥品被視為推升全球藥品市 場成長的動力來源之一。依據 EvaluatePharma 的調查報告顯示,全球前 100 大暢 銷品牌藥,生技藥品的占有率已由 2002 年的 15%,上升到 2010 年的 31%,預估 到 2016 年將達到 48%,顯示生技藥品未來深具市場爆發力(2)。除此之外,國外各 大藥廠也積極整併檢測公司,積極地成為健全的 Health care 的公司,例如 2012 年全球最大藥廠 Pfizer 在 2010 年收購 Synbiotics Corp 獸醫檢驗公司(3),並且積極 地與 Agilent 科技公司所屬的檢驗公司 Dako 合作開發在人類醫藥上的體外診斷產 品的開發(4),為了就是要成為一個全方位的 Health care 的公司,當然除了 Pfizer 之外,前 10 大藥廠中的 Roche、Abbot 也不例外,都積極的整合自己的藥務部門 以及診斷部門,積極地成為更全方位的 Health care 藥廠,以因應未來個人化醫療 的來臨與需求,以及積極的開伴隨生物藥品的分子診斷產品,增加兩方領域的獲 利。 自從 1973 年 Herbert Boyer 和 Stanley Cohen 發明基因重組(recombinant DNA) 技術,該技術可以說是現代生物技術產業的起源(5),至此之後生物技術的不斷演 進,不論是基因工程技術、發酵技術、重組蛋白質技術以及純化技術持續成熟, 使得原本再以小分子為主流的藥物市場,開始出現大分子藥物的問市,其中抗體 工程技術應用於人用檢測及醫藥開發的部分,更是因為其高度專一性,漸漸成為 市場的主流,不僅只在藥物市場受到歡迎,也在檢驗產品上有很多的應用性。在 1.
(12) 藥物上面,自 1986 年抗體問世以來,截至 2010 年 6 月為止,共有 29 項抗體藥物 於美國核准上市,並逐漸由一種適應症擴充至多種適應症,因此市場急遽成長 2009 年市場值達 355 億美元,佔生技藥品中的比重 32.5%,佔整體藥物比重的 4.2%(6)。 而在檢驗產品的應用方面,抗體最早被應用的廠品技術類別為免役化學的體外檢 驗,該市場已趨於成熟,在 2009 年市場為 138.8 億美元,受金融海嘯影響,2009 年僅微幅成長 0.6%,除此之外還可以被應用在免疫組織染色、臨床化學檢驗、定 點照護檢驗(POCT, Point-of-care Testing),而其 2009 年應用於檢測市場的大略總值 約略有 206.1 億美元,也是不容小覷(7)。 然而以全球所發行的藥物趨勢來看,就 2006~2010 的全球上市的生技新藥來 看,有 25 個全新的藥物,而至 2010 年全球也有 58 個通過的生技藥品,其中 30 項為賀爾蒙生長分子或相關調節分子而單株抗體占了 13 項產品,比率大約是 22%(8),但是由於單株抗體它的的高結合專一性質,除了被利用於治療傳染疾病、 癌症,也常被拿來用於診斷產品的技術應用,因此它的技術滲透程度相對其他的 生物分子而言也來得相對的廣泛。然而就 2012 年美國上市的新藥,2012 年共核准 了高達 39 件新藥上市許可,遠高於 20 年來的平均值 30 件。通過的新藥中,癌症 新藥就佔了 13 件(33%) ,較 2011 年的 22%大幅提升,而通過的新藥中有 6 件是生 技藥品,其中一半是抗體用藥,可以見到,抗體藥物已經成為市場上的主流。而 其伴隨的抗體檢測的藥物伴隨檢測(companion diagnostic)也因為近幾年的 Biomarker 的發現隨之成長,由市場報導中可以得知,其中的檢測開發廠商 Dako 與大型藥廠 (Roche、Abbot)很多的合作案,大多是抗體藥物與標靶藥物的伴隨檢測開發案。 由於本身的現在工作,就是在標靶與抗體相關的研發單位,對於台灣生技產 業的角色,以及台灣研發單位投入產業,該在世界生技產業中扮演哪一個環節, 常會在心中自問?就台灣的資本與資源有限的情況下,我們的技術與人力素養, 雖然不會輸給國外的先進國家,但是問資金大小,問人力數量,問資源多寡,我 們沒有大藥廠來得資源充沛,在發展產業的時候,是否更該考量技術的投資效率 與回報能力?更集中資源的往最有效發展的方向發展?因此開始思考:以一個研 2.
(13) 發團隊、研發單位的角度而言,當一個抗體技術被開發出來之後,它到底該被導 向於製藥產業還是醫療產業中的分子診斷的應用?因為當開發藥物時,它所需經 歷的路程,就必須經歷臨床前的 IND 的數據申請,以及經歷臨床一期二期三期的 漫長試驗才能上市,所需花費的時間與金錢都非一般公司所能承受,然而倘若是 發展分子檢測的體外診斷,就須經由繁複的漫長的臨床前與臨床三期試驗,而只 須經由臨床病人檢體的收集與安全性的檢測與設計正確性的確認,相對的時間與 發展較為短暫,但是何種才是對該技術是最有利的發展?而對於研發團隊而言, 技術授權的效率考量與權衡也是件重要的事情,因此希望本研究論文能夠給研究 團隊一個開發投資即回報關鍵因素的討論及大致上的方向。. 第二節. 研究問題. 探究檢測與藥物的基礎技術根源,有時候其實是一樣的,例如:為 Roche 每年創造 56 億美元收益的 Herceptin,在 2000 年 Roche 併購 Genentech 之前, Genentech 就和一間檢測公司—Dako 合作開發一個快速的組織診斷產品— HercepTest,該產品做為 Herceptin 的用藥前的一個檢測指南,而主要就是利用 Herceptin 的辨識區域,快速地達到檢測病人組織是否為 HER2 Recepor 過度表現 的目的,作為 Herceptin 藥物使用前的篩檢。然而其後 Roche 收購 Genentech 後,在與 Dako 合作,於 2013 年 2 月 15 日獲得 FDA 核准上市 IQISH,作為標準 篩檢方法,檢測速度一比一般檢測需要半天時間,縮短為只需要 2 小時(9;. 11). ,. 而雙方廠商使用的技術根源是同源的,也互相希望利用彼此的產品來拉抬各自 市場產品的使用。然而就早期新穎技術知識的發現,通常都發生在較為單純的 學術研發單位,然而單就技術與知識發源的研發單位,在資源與資金有限的情 況下,應該選擇何種商業化發展方向,而在選擇時該考慮那些因子?一般而言, 除了研究者的研究慣性之外,通常還來自於未來接洽技術轉移的廠商的多寡與 3.
(14) 態度,就台灣的生技產業的廠商,資本與資源有限的情況下來看,將技術與知 識做最有效的利用與投資,可能是最好的狀態。然而以新穎的抗體為例,在研 發單位或學術單位將它發展出來之後,抗體技術本身並不局限於發展藥物或者 是發展體外檢測相關產品(除了本身抗體辨識功能侷限導向除外),然而投入抗 體藥物的發展,其要求的資金高、時間攏長、不確定風險較高;相反的,投入 體外檢測,要求的發展時間較短,不需通過長期的不確定性高的人體臨床試驗, 但也是需要一定量的臨床檢體數量的收集與獲得,以及有效的檢測設計,確定 正反應的檢測與檢體有正相關的關聯,其產品必須通過相關法規單位(FDA)檢驗 認定其符合宣稱效果,才能上市,除此之外還需接受市場接受度與普及度的問 題考驗,影響著未來收益回收度的速率。因此就一個資源有限的研究單位而言, 在抗體技術發展初期都是同樣的知識基礎的情況下,應該集中資源發展藥物事 業或者檢測事業,究竟該先選擇哪種方向及領域去做,或者就合作的廠商而言, 應該選擇什麼樣子研發團隊商品化方向參與投資? 因此本文想要探究的就是以抗體技術為例,在技術初期的發展都有相同的 知識基礎,發展至後期不同領域的產品時卻會有不同的市場的表現,因此究竟 在初期資源有限的研發單位,應該在選擇事業領域時,考量那些因素?首先探 討在技術投入在發展抗體藥物,以及抗體技術為主的抗體分子檢測產品,何項 領域的產品事業它的技術投資回報率較高?將其當作抗體技術商業化過程中的 一項重要指標,除此之外,也必須依照不同的研發團隊的能力,考量除了投資 回報率的其他因素,來增加投入剛項產業與事業產品的發展的成功可能性。然 而本論文還會就目前分子檢測市場最主要價值鏈市場:美國市場,分析其市場 的現狀的問題點在哪,並試著尋找該市場可能解決的困局的方式。另外還會試 著討論台灣廠商在美國為主的價值鏈上可能找得到的利基點,與可能的發展方 式。. 4.
(15) 預研究問題: 1. 以研發與學術單位為考量基礎,並以抗體技術為例,究竟是以發展抗體 藥物的投資回報率較高,還是以發展抗體分子檢測技術相關事業較高? 2. 影響美國抗體藥物與伴隨分子檢測市場發展的背後因素有那些? 3. 分析與探討美國抗體藥物與伴隨分子檢測市場發展的市場困局,可能的 解決方法有哪些? 4. 台灣研究團隊或廠商能在美國藥物與檢測的價值鏈上獲取那塊價值與借 鏡?. 5.
(16) 第三節 研究範圍. 本論文的研究範圍: 一、抗體藥物: 抗體藥物市場是以 2009 年全球市場值為例,且分析報導數據是否接近,引 用的報導資料儘量使用 IMS、Visiongain 等大型 database 之資料來源,並以學術 論文分析研究為依據,分析開發每一個藥物的成本結構,以及市場上 4 大會計公 司的財務報導發表的數據佐證為主,來做為成本結構的主要的依據。 Hercpetin 的銷售數據則引用 2000~2012 年的實體市場銷售數據。 二 、抗體應用體外檢測—分子檢測: 抗體應用著體外檢測的種類繁多,本次討論的應用主要著重在於分子檢測 (molecular diagnostic)的產品中,然而此類的產品目前最常應用的部分就是在於伴 隨藥物檢測的伴隨檢測(companion diagnostic) 1,通常和抗體是同源的技術,以及 類似的技術片段加以改良與應用,因此本次論文討論中主要就是以分析此塊市場 的資訊為主,主要也是蒐集 2009 年的分子檢測市場的總值,以及經由論文研究 預估出來的分子檢測公司的發展一項產品的成本,作為依據來做為探討依據。而 文中模擬計算的例子則是以Herceptin的伴隨檢測產品Herceptest為例子。. 1. 伴隨檢測(companion diagnostic),通常是伴隨著經由生物標誌(biomarker)所找尋出來之生物藥. 品的檢測產品,這些藥品比較常見的有抗體以及針對生物標誌的重組蛋白藥品,伴隨檢測產品通 常就是用來篩檢病人是否具有這些 biomarker 或者是該病人的基因序列是否適合某項藥物的療 程。 6.
(17) 三、市場狀況: 主要探討的是美國醫療體制狀況,由於分子檢測的體外檢測市場也以美國市 場較為成熟,主要因為其健康保健團體較歐洲龐大且完全,合作的醫院以及醫檢 單位也較多,因此本處探討的市場一條體制狀況主要以美國的體制狀況為主,讓 台灣的廠商了解機會點為何處?. 四、研究計算之假設: 本研究以研究單位的出發點,並以抗體技術為主要計算考慮主體,因此在研 究學術單位資源較為有限的情況下,預先假設欲發展的方向為抗體藥物以及伴隨 分子檢測兩大方向,而此兩項產品的事業發展基礎,都假設為有相同的知識基礎, 彼此的發展為各自獨立的發展方向、並不互相互補,以方便在計算時,可以有較 清楚的侷限,但實際市場上,可能兩項事業領域的產品會有互相影響的互補效應, 本研究中先不加以討論。. 五、美國市場問題與背後因素之研究 關於本研究所探討美國市場的抗體藥物與藥物伴隨分子檢測事業之間的關 聯性與廠商關聯主要是參考 IVD Technology 網路雜誌(http://www.ivdtechnology. com/)的幾篇產業文章內容 (12-15) ,並分析 PWC、Evalutepharm 與 McKinsey& Company 在 2013 年與 2010 對於美國生醫產業所做的產業分析報告(16-18),以及根 據 Jim Kling 於 2007 發表於 EMBO reports 的學術論文,所提及的數家檢測廠商的 現狀(19),來探討目前美國市場上所存在的問題與困局大致上有哪些現象,並加以 利用賽局理論的分類加以闡述,在依照各困局的狀況設想可能的解決方式,並在 後面收集分析台灣抗體檢測與生技發展的廠商,設想在美國現有的市場狀況下可 能有的發展方針。. 7.
(18) 第四節. 論文架構. 本論文總共有五個章節,其整體架構主要是先行於網路上以及市場上蒐集大 量的外部市場資訊,了解大致上的市場走向與發展動向後,並先就產業中相關的 技術與名詞先給予定義與解釋,在蒐集學術文獻與學術分析文件討論成本結構與 投資結構,利用實際市場外部資訊,綜合理論模型與成本做概略的模擬試算分析, 了解大致上技術在兩種產品領域的投資回報率,以及造成這樣結果可能的原因有 哪些,並思考相關法規與背後相關可能廠商的利害關係,試著給予建議,並在最 後給予結論。 本研究流程與論文架構如圖 1-1 所示: 外部市場資料蒐集. 第一章. 第二章. • 研究動機、目的、問題與研究架構. • 相關名詞與技術之介紹:抗體藥物應用與檢測技術應用. • 投資回報率計算相關文獻討論 • 賽局理論文獻討論 第三章 • 藥物開發與檢測開發文獻探討 • 外部市場數據與文獻數據整理抗體藥物與體外投資回報率結果 • 伴隨檢測獲利遲緩的背後因素討論 第四章 • 伴隨檢測市場上的賽局困局與可能的解決方式 • 台灣廠商狀況與可行著力點. 第五章. • 結論與建議. 圖 1-1 論文架構圖(資料來源:本文整理) 8.
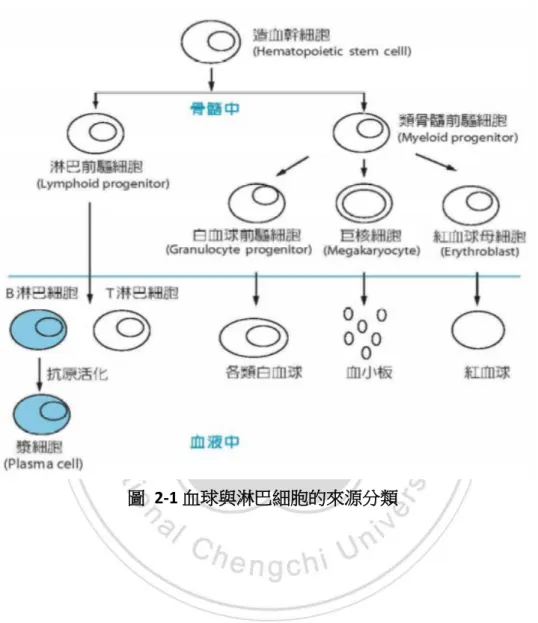
(19) 第二章 相關名詞與技術介紹 第一節 抗體藥物相關介紹. 一、. 抗體定義 抗體是身體的免疫系統為對抗外來物質(抗原,如細菌和病毒)而產生的一. 種蛋白質復合體,而身體利用產生抗體對於這些外來物質有抵抗的能力,也有辨 識外來物質的能力,並結合抗原起特定的反應使得抗原失去活性。 然而抗體主要是由身體中的 B 淋巴細胞(B lymphocyte,見 圖 2-1 血球分類 與來源解說)結合抗原後,幫手 T 細胞(helper T cell)會與其結合,幫助增殖分 化為漿細胞,漿細胞會再產生蛋白質,該蛋白質就是抗體,而抗體主要存於血清 等液體中,能與相應抗原作特異性的結合,產生中和的作用,而達到免疫的功能, 而活化後的漿細胞會轉化為記憶 B 細胞(memory B cell)存於血液中;當人體接 受到第二次感染時,抗原與幫手 T 細胞結合後活化了體內的記憶 B 細胞(memory B cell)轉化成為漿細胞進而製造抗體,見圖 2-2。當體內的 B 細胞遇到抗原時, 會被活化,而 B 細胞內部細胞質會利用吞噬進去的抗原片段進行辨識,以及細胞 核進行基因重組,合成特定的抗體以對抗一個抗原的決定簇(epitope),每類 B 細胞辨識一個抗原決定簇,因此正常血液中,就會有多種 B 細胞所產生的不同抗 體來對抗同一種抗原,此產生對抗同一種抗原的抗體就稱為多株抗體(Polyclonal antibody) ,通常會存在於血清(serum)之內.因此如果能夠選出一個被活化後 的B細胞,製造一種專一抗體的漿細胞進行培養,就可以從中獲得單純指針對一 種決定簇的單株抗體(monoclonal antibody)。 多株抗體可以辨識抗原不同的決定簇,其抗體主要負責辨識抗原的區域的氨 基酸序列也會因此有所不同,因此不同的 B 細胞生產出來的抗體,就會有不同的 辨識標靶特異性,結合能力與中和能力也就會有所不同,相反的源於同一個 B 9.
(20) 細胞對於該抗原就會產生相同的氨基酸序列抗體,俱有相同靶性能力的特異型抗 體,就會稱之為單株抗體,然而在醫學與藥物上大多都會使用這些單株抗體來作 後續的應用。. 圖 2-1 血球與淋巴細胞的來源分類. 10.
(21) 圖 2-2 記憶 B 細胞製造抗體途徑. 二、. 單株抗體原理與目前技術發展 每一個 B 淋巴細胞會生產一種具有辨識單一抗原決定簇,但是正常被活化後. 的 B 細胞有一定的壽命,不可能不斷的生長。而骨髓瘤(myeloma)是從細胞轉變 來的腫瘤細胞,是自然生成的,可以不斷分裂增生,進行細胞培養。但要 B 細胞 自己轉變成骨髓瘤,機率非常的低,除此之外,無法確認這樣隨機產生的的骨髓 瘤產生的抗體是針對和種抗原,也很難知道這樣的骨髓瘤有無其他的變異。 Kohler G 和 Milstein 在 1975 年發表了生產單株抗體的融合瘤技術,該技術是 利用聚乙稀二醇(Polyethylene Glycol, PEG),將特定抗原處理的 B 細胞及不產生 抗體的骨髓瘤融合成融合瘤(21; 22),此一技術突破,對於生技產業影響重大,因為. 11.
(22) 融合瘤可以向骨髓瘤一般持續的生長分裂,並針對已知抗原生產特定的單一抗體, 而主要的過程如圖 2-3,過程大致如下:首先將有興趣的抗原(或抗原片段)打入 老鼠體內,再從老鼠體內取出脾臟純化出 B 細胞後,經由 PEG 處理,再與骨隨 瘤產生融合瘤,經由培養基挑選出融合成功的融合瘤,再利用原本的抗原再去挑 選出所要的單株抗體。. 圖 2-3 Kohler G 和 Milstein 法利用骨髓瘤融合製造單株抗體. 然而隨著生物科技的發展,科學家對於基因操控以及生物分子了解越來越 多後,逐漸演變成可以操控的細胞生物工程,將原本 Kohler G 和 Milstein 所生 產的來自於老鼠的鼠源單株抗體(murine antibody),進行改造優化。由於原本 Kohler G 和 Milstein 所生產的抗體,是一個老鼠來源的產物,作為藥物使用在人 身上,人體會將其視為一個外來物質,很容易產生人體對抗它的抗體的排斥反 應,因此後來經由逐漸的技術改良,利用基因與細胞工程的方式,生產出的抗. 12.
(23) 體只有保留辨識抗原區域為鼠源的人鼠嵌合抗體(chimeric antibody),以及取代 更多鼠源區域的人源化抗體(humanized antibody),甚至可以利用改良的嗜菌體 方法,再以基因工程方式生產全人類的抗體(human antibody),來降低作為單株 抗體藥物時的人體的不良免疫源性,圖 2-4。. 圖 2-4 單株抗體的種類. 第二節. 抗體體外檢測應用相關介紹. 現代的醫療行為,疾病的檢測與診斷從技術與產品實施面來看可以分為體內 (in vivo)診斷以及體外(in vitro)診斷兩大類。體內診斷的技術市面上的產品目前大 多以造影技術為主,例如有:X-ray、電腦斷層掃描、核磁共振造影(MRI)、與核 子醫學造影(nuclear imaging)、血管攝影(Angiography)等技術。而相對的體外診斷 (in vitro diagnostic,簡稱 IVD)則是利用病人的血液、尿液、糞便、分泌物或組織 樣本等檢體做非直接侵入式的檢查(5; 24)。 根據美國食品暨醫藥管理局(FDA)與我國醫療器材查驗登記審查準則第九條 對體外診斷產品之定義為:「以外診斷(in vitro diagnostic, IVD)產品,係指蒐集、 準備及檢查取自人體之檢體,作為診斷疾病或其他狀況(含健康狀況之決定),用 13.
(24) 以治癒、緩和、治療或預防疾病或其後遺症,而使用之診斷試劑、儀器與系統之 醫療器材」,表示體外診斷產品涵蓋體外診斷用醫療儀器及試劑與耗材之總和 (25). 。 然而 IVD 產品依照檢驗標的與技術學理的差異,大致上可以區分為:臨床化. 學檢驗、免疫檢驗、自我血糖檢驗、定點照護檢驗(Point-of-care Testing,簡稱 POCT)、 分子診斷、血液學檢驗、微生物檢驗、組織診斷、凝血檢驗等類別,各類別產品 在 2010 年時,佔全球 IVD 市場的比例如圖 2-5(24)。而抗體技術在 IVD 產業中廣泛 的被應用,主要是因為其具有辨識特定抗源之特性,且與抗原結合具高度專一性, 因此可以利用來偵測是否有想要知道的抗原存在,成為免疫試劑與抗體應用的 IVD 產品發展的基本原理。. 圖 2-5 全球 IVD 產品市場比例(24) 抗體於IVD產業的應用大致上有較為成熟的產品部份,以及新興領域的應用 兩大方面;在已有較多產品的成熟的應用大致上為:(1)免疫化學檢驗,(2) 定點 照護檢驗(Point-of-care Testing,簡稱POCT),(3)組織診斷;新興領域的應用有:(1) 生物標誌(Biomarker),(2)個人化醫療檢測(personalized medicine),(3)感染性疾病. 14.
(25) 快速檢測. (24). ,消費者對於上述產品的期待有不同程度的期待與成長,見圖 2-6,. 其中在於新興領域應用的生物標誌與個人化醫療檢測方面,大多產品方向都趨向 於癌症檢測(Cancer testing)與治療診斷(Companion Diagnostic,治療後的持續診斷 追蹤產品),以及個人化醫療所重視的藥物基因體學檢測. 2. (pharmacogenomics. test)(24)。. 圖 2-6 消費者對個人化檢測產品的期待 一、抗體技術成熟的應用於:. (1)免疫化學檢驗,係利用抗體與抗原結合所產生的免疫專一性反應,來定 性或定量檢體中的抗原或抗體,是發展最久的技術,市場趨於成熟,醫院常用的 醫檢試劑,通常都與檢驗大廠的儀器搭配,除此之外還有實驗用的市場也是免疫 化學檢驗市場的一塊。. 2. 藥物基因體學檢測 (pharmacogenomics test),主要的產品大多是屬於分子檢測的產品,主要是. 利用病人的基因序列、核酸、蛋白質體學(proteomics,即一整群的蛋白質做群組的分析學)的分 析,檢視病人適合的藥物與不適合的藥物,或者在哪種藥物中的療效反應最良好的一種測試,主 要也是分子檢測應用最重要的一部分。 15.
(26) (2)定點照護檢驗(POCT),其產品就是隨即能在護理區域或者病人身旁即時檢 測得知結果的產品,這可以帶給醫療團隊很大的便利性,可以更快的做出臨床判 斷與決策。然而產品就是利用抗體的高專一性的技術,並利用免疫檢測、臨床化 學與導入新興的分子診斷之原理(例如:生物標誌 Biomarker)進行設計。在抗體上 技術上的應用的產品涵蓋:糖尿病管控之糖化血色素(HbAlc)檢驗、心臟標誌物檢 測、癌症篩檢與藥物濫用檢測(24)。 (3)組織診斷,主要是利用取自病患組織切片或抹片,作為病理診斷依據, 也是目前最常被利用來對各種癌症確診的黃金準則。而組織診斷的產品分為分析 前與常規染色檢測以及進階染色檢測兩大塊,而利用到抗體的技術的部分主要為 進階染色檢測的部分,進階染色檢測包含利用抗體結合特異性的免疫組織染色技 術(immunohistochemical test,簡稱 IHC),以及利用核酸結合技術的原位雜交(in situ hybridization,簡稱 ISH),此兩種組織診斷技術都通稱為分子診斷技術,可以 利用此種技術將癌細胞進行良性惡性分析、分型、分期的臨床判斷(24)。 二、抗體技術應用於新興領域: (1)生物標誌(Biomarker),即是分子診斷所主要利用的作用機轉於分子層面研 究與分析生物程序。依照美國 FDA 的定義,生物標誌泛指可以利用生物分析方 式來測量正常人生理反應、疾病發展過程、藥物生理反應及藥物安全性等,同時 可提供臨床決策依據之生物特徵,其涵蓋代謝 DNA 生物標誌、RNA 生物標誌、 蛋白質生物標誌及代謝物生物標誌,生物標誌所接漏之生理及病理意義,成為製 藥產業、生技產業以及 IVD 產品開發重要標的(24; 27)。而抗體的技術應用大致上是 利用於蛋白質生物標誌與代謝物生物標誌的相關產品上,蛋白質生物標誌大致上 必須由病人的檢體中取得,大致上是用來鑑定疾病的存在與否,而用在疾病發生 之前的產品目前還在發展中,主要是提供疾病的傾向預測(例如心臟病)以及藥物 基因體學檢測依據(24;. 28). 。而代謝物生物標誌只要提供個體的表現型(phenotype) 16.
(27) 之資訊,主要提供個體除了遺傳基因先天因素,在藥物、飲食、環境等因子環境 影響下,所造成的不同的個體生物代謝反應,可以做為用藥以及糖尿病飲食控制 的重要資訊。 (2)個人化醫療檢測(personalized medicine),可以涵蓋三個層面:(A)預測試驗 (predict test),(B)預後試驗(prognostic test),(C)藥物基因體測試(pharmacogenetics test);(A)預測試驗,主要是預測病患對治療之反應,鑑別出對藥物治療有效或無 效之病患之篩選,作為對藥物使用前的檢測工具。(B)預後測試,提供疾病發展 之預測,也就是未來疾病的走向以及可能的發展預估,作為醫療決策的判斷。(C) 藥物基因體測試,則是藉由研究藥物反應及各體基因差異之間關連性預測藥物不 良反應之發生作為藥物使用技樣評估工具,此部分的產品目前則是以基因序列產 品為主,利用抗體結合技術的蛋白質序列產品則較少。而以抗體技術作為個人化 醫療的檢測,並與藥物基因體學較相關的產品最有名的就是 Genentech 的藥物 Herceptin 所搭配檢測產品的 Herceptest (由 Dako 公司開發),主要是因為乳癌患 者大約只有 25~30%會過度表現 Herceptin 的標的(target)HER2 receptor,因此 FDA 也建議選用 Herceptin 治療前須先執行 HER2 蛋白表現之檢測(29)。 (3)感染性疾病快速檢測,主要是近年來人口增加與全球暖化,流行病大幅 增加,尤其是 2009 年新流感 H1N1 大流行,流感病毒的快速檢測試劑,也就跟 著蓬勃發展,而抗體技術是最常應用在這一塊領域的產品上,通常都會利用試劑 搭配快速的讀取機—免疫分析儀或快速檢測儀的使用。然而在流感發生後,眾多 廠商都看準此一商機,其中以 Quidel Corporation 一家美國上市公司所發展的 QuickVue® Influenza A+B test 可以在 10 分鐘內,透過擦拭鼻腔測出流感,在 2009 年爆發新流感後,淨收入達 1490 萬美元,較前年同一期成長 217%,可見市場的 需求度熱烈。. 17.
(28) 第三章 文獻與市場資料蒐集 第一節 理論文獻蒐集. 一、投資回報 投資回報率(ROI,Return Of Investment)是指通過投資而應返回的價值, 企業從一項投資性商業活動的投資中得到的經濟回報。它涵蓋了企業的獲利目標。 利潤和投入的經營所必備的財產相關,因為管理人員必須通過投資和現有財產獲 得利潤。對一項技術要能夠商品化,內部對其技術持續長期的投資是必然的,但 是這些投資要能夠在未來為公司帶來有效的利潤回報,才能彌補投資所投入的資 金。而以投資回報率可以綜合的看整體公司投入該項技術的為公司帶來的盈利能 力,是一項快速的評斷方式,而相關的技術投資利潤率,更可以當作公司對技術 投資組合的判斷,在公司資源許可下做最充沛的搭配。 ROI=. 投資收益−投資成本 投資成本. × 100%. 以長期投資而論,將每年的投資收益減去每年的投資成本,與投資總成本相除的 比例,就是 ROI。 而投資回報率(ROI)的優點是可以簡單地提供企業主,作為衡量投資效益 的一個好的指標參數,但缺點是該指標卻沒有表露出其他的投資資訊在內,包含 投資期的長短、投資時期的風險因子等。因此在參考此指標之外,應該還需考量 不同投資案中的投資組合,所花費的時間因素以及其他相關投資時期的投資風險 因子,更應需考量該技術投資組合中的人員構成、技術智財布局等相關的其他因 子。 而企業在考量投資組合效益,會以投資回報率的指標做為參考基準,另一種 較簡化的方式則是利用淨現值(Net present value)的方法(30),來看技術投資的未來 所產生的現金流,此種方法是利用折現的現金流(DCF,discounted cash flow)為核 心之分析方法,通常是一項投資所產生的未來現金流的折現值與項目投資成本之 18.
(29) 間的差值,也就是評價一個技術投資能在未來產生的現金流量的多寡。而這種方 式會考慮到各種時期的現金流量訊息,也就是企業對於技術或產品的投資組合, 在未來各時期的現金流的轉換折現的現值的總和,與現在投入的現金流的差異值, 因此可以由現金流的大小來看投資案的可行性,相較而言較為簡化。然而企業在 每個時期對於產品組合作出的不同的資金投入,會影響到產出的投資效應,因此 利用折現率的計算方式,將每一時期的投資金額,透過投資組合風險的考量轉換, 將他折現成未來的現金價值,如此一來就可以直接轉換成未來的現值,做為未來 的價值考量。 而每一期的資金投入都利用此種方式折現回它們的現值(PV,present value), 而淨現值(NPV,Net present value)就是所有現值的總和。 PV =. 𝐶𝑡 (1 + 𝛾)𝑡. t: 現金流投入的時間, Ct:第 t 期的現金流 γ:折現率. 淨現值可以表示為: 凈現值=未來報酬總現值 減去 建設投資總額. NPV(i, N) = ∑𝑁 𝑡=1. 𝐶𝑡. (1+𝛾)𝑡. − 𝐶0. 如果將初始投資額看做第 0 年的現金流量,同. 時考慮到(1 + r)o = 1,則上式可以變換為:. NPV(i, N) = ∑𝑁 𝑡=0. 𝐶𝑡. (1+𝛾)𝑡. 而其中重要的參數折現率γ (discount rate),一般是使用加權平均資金成本(WACC, Weighted Average Cost of Capital)來當作一家企業的投資組合的折現率,但也會有 人會加入一切風險因子來做適當的調整。然而 WACC 可由下列式子計算出來:. 其中 D 是總負債,E 是股東權益總額,Ke 是股權成本,Kd 是債務成本。(31). 19.
(30) 然而在藥物的技術投入上,折現率一般則是使用資本成本率(COC,cost of capital), 因為藥物的投資,通常都是個非常長期的資金投入,而且資金是個不確定的風險 花費,因此在投入成本與時間上以及環境風險上是有很大的關連性,因此對於成 本的投入與未來的報酬,可以利用 Capital Asset Pricing Model (CAPM)的骨架來表 示與估計之: COC = 𝑅𝑓 + 𝛽𝑎𝑎𝑎𝑎𝑎 �𝑅𝑀 − 𝑅𝑓 �. 其中 Rf 為無風險的回報率,通常和政府債卷回報率有關,而�𝑅𝑀 − 𝑅𝑓 �就代表著 投資風險對無風險的溢酬,𝛽𝑎𝑎𝑎𝑎𝑎 是 CAMP 模型的資產系統風險係數;舉例來說, Aris I. Baras 在 2012 年,一篇發表於 Nature Reviews Drug Discovery 關於計算藥物 發展的風險與溢酬的文章(32)中提及:2009/12/31 日時,10 年期的國債利率為 3.85. 就 當 作 Rf 的 值 ( 由 US department of treasury bonds 網 站 ) , RM 則 取 NYSE/AMEX/NASDAQ 計 算 30 天 的 平 均 獲 利 而 其 與 債 卷 的 差 值 就 為 溢 酬 �𝑅𝑀 − 𝑅𝑓 �,7.01%。𝛽𝑎𝑎𝑎𝑎𝑎 是用以度量一項資產系統風險的指針,是用來衡量一. 種證券或一個投資組合相對總體市場的波動性(volatility)的一種風險評估工具。. 也就是說,如果一個股票的價格和市場的價格波動性是一致的,那麼這個股票的 Beta 值就是 1。如果一個股票的 Beta 是 1.5,就意味著當市場上升 10%時,該股 票價格則上升 15%;而市場下降 10%時,股票的價格亦會下降 15%。而該係數是 由統計分析同一時期市場每天的收益情況以及單個股票每天的價格收益來計算 出的。1972 年,經濟學家費歇爾·布萊克 (Fischer Black)、邁倫·斯科爾斯(Myron Scholes)等在他們發表的論文《資本資產定價模型:實例研究》中,通過研究 1931 年到 1965 年紐約證券交易所股票價格的變動,證實了股票投資組合的收益率和 它們的 Beta 間存在著線形關係,當 Beta 值處於較高位置時,投資者便會因為股 份的風險高,而會相應提升股票的預期回報率,舉個例子,如果一個股票的 Beta 值是 2.0,無風險回報率是 3%,市場回報率(Market Return)是 7%,那麼市場溢價 (Equity Market Premium) 就是 4%(7%-3%),股票風險溢價(Risk Premium)為 8%. 20.
(31) (2X4%,用 Beta 值乘市場溢價) ,那麼股票的預期回報率則為 11%(8%+3%, 即 股票的風險溢價加上無風險回報率)。(33) 而利用此法估算出來的 COC 當作是折現率(discount rate),進行對於投資方案的 評估,當對一項技術(藥物技術)投入初期成本之後,在持續投入後期成本,利用 折現的方式估算出未來的現值價值,當淨現值: •. 淨現值≥0 方案可行;. •. 淨現值<0 方案不可行;. •. 淨現值均>0 凈現值最大的方案為最優方案。 然而值得注意的是,NPV 的值並不考量投資的效益,因為即使在未來有相. 同的 NPV 值,也必須考慮其投資技術所花費的投入成本,舉例來說,兩個為期 10 年的技術投資都為 100USD 但是其中一項的初期折現投入成本為 100,000USD, 另一項可能僅有 1,000USD 因此以投資的產生效益來說會以投入 1,000USD 在 10 年內就能產生 100USD 的效能較大。 而另一個與 NPV 有關常用的指標數據則為:內部報酬率(IRR,Internal Rate of Return),是指能夠使未來現金流入量的現值,等於未來現金流出量的現值之折現 率,或者是使投資方案凈現值為 0 的折現率,也就是使得 NPV 為 0 的報酬率。 而內部報酬率是一種「相對指標」,在一定程度上反映一個投資項目投資效率高 低,越高的 IRR 值代表該投資項目越值得投資。倘若假設,一開始的前期投入的 投資金額是一樣的,越高的 IRR 的產品組合投資,則是該企業應該選擇的最佳策 略。 •. 在前期投入資金類似的時候,IRR 越高表示該投資項目的投資組合越值得投 資。. •. 當前期投資金額不同時,IRR 越高雖然表示該投資項目內部投資效益較佳, 兩方案間比較意義不大,因為必需考量不同方案上初期投入金額多寡的差異 (即投資金額比例問題,有可能 A 方案初期投入金額是 B 方案的 100 倍,但. 21.
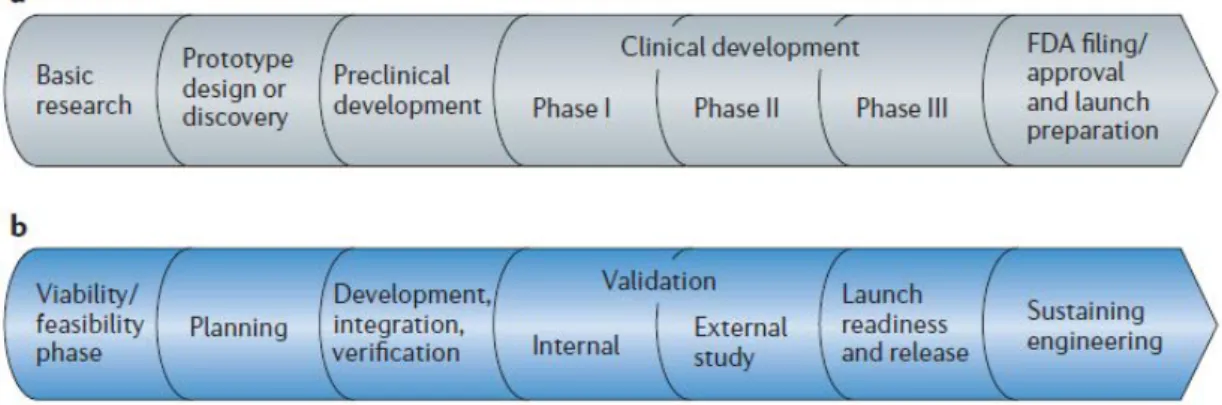
(32) 是 A 方案的 IRR 卻較高,不能說 A 方案是最好的投資,因為要看資源是否足 夠做這樣的事情與效率問題)。. 二、藥物發展與體外檢測發展 藥物醫療產業的發展,是在一個高度資金投入與法規管制的環境下建立的, 通常藥品或者是相關的醫療產品、檢測產品都是需要經由相關單位的審理許可或 登記之後才能在市面上販售,而且部分商品販售期間還須受到相關執業人員的管 理,尤其是處方藥品,需要相關的主管單位發與適應症的藥證,才能在該適應症 上開放給專業醫療人員給予病人使用。然而體外的檢測產品雖然也是同樣的管制 產品,但相對藥品而言,則是比較寬鬆,流程與速度也較藥物審查來得快速。. A. 藥物發展過程 藥物的發展過程通常非常的漫長,一般而言分成幾個時期:1.基礎研究, 2.藥物雛型設計與發現,3.臨床前數據建立、臨床研究申請 IND (Investigational New Drug),4.臨床研究:Phase I、IIa, IIb、IIIa, IIIb,5.新藥上市申請 (NDA,New Drug Application)與 FDA 審查準備,整體時間通常需要花費約需 18~20 年的時間。 相反的,體外檢測產品,大致上也是分成 5 個時期,但是這些時期大多是專注於 檢測產品技術上的修正與微調,真正影響變動性的因子較少:1.研發時期(變動時 期,此時期在發展找尋可行的技術與 biomarker),2.產品計畫與設計,3.建立、 累積、驗證產品的正確度,4. FDA 內部與外部驗證,5.上市與發表、後續持續的 研發與改進(34)。見圖 3-1 藥物產品與檢測產品發展模型說明。. 22.
(33) 圖 3-1 藥物產品與檢測產品發展模型說明(34) (a)藥物產品發展過程,(b)檢測產品發展過程 然而針對藥物開發所做的投入成本與回收的研究有很多,其中以 Joseph A Dimasi 所做的研究較為完整,在 2003 年發表於 Journal of Health Economics 的一 篇文章中,針對上市的新藥做平均的成本上的分析,以 2000 年當時的幣值來計 算,一個小分子新藥的研發所需的現金投入(out-of-pocket cost)需要 4.03 億美元, 以 11%地當時折算率計算,痛過 FDA 上市則需花資本成本約 8.02 億美元。而隨 著市場與技術的發展,隨後除了小分子新藥的上市之外,隨著出現的是大分子的 生物性藥物,如蛋白質藥物以及抗體藥物等,Joseph A Dimasi 隨著在 2007 年於 Manage. Decis. Econ. 發表探討小分子藥物與生物藥物的花費成本的差別,以及所 需平均發展的時間是否有所差距,而該文獻表示,生物製藥平均通過一個生物性 藥物所需的現金支出成本為 5.59 億美元,其中在前臨床時期的研究現金成本就 需要花費 1.98 億美元,而在臨床試驗開發的花費更高達 3.61 億美元;在考慮時 間成本以及投資組合的折現率折現估算(利用 CAMP 模型估算 COC 為折現率),開 發一個生物性藥物到上市,花費在 R&D 的資本成本上就需要 12.41 億美元(2005 年幣值),其中臨床前的部分為 6.15 億美元,臨床試驗開發部分為 6.25 億美元, 然而與他在 2003 年發表的傳統小分子藥物的花費成本經過成長率換算後,上市 一個新的小分子藥物所需花費的研發現金支出成本(Out-of-pocket)為 6.72 億美元, 再經由時間因素考慮的折算率折算(CAMP 模型),其上市一個小分子藥物所需. 23.
(34) R&D 的資本成本為 13.18 億美元,見圖 3-2 每一個新藥上市所需花費之資本成 本。. 圖 3-2 每一個新藥上市所需花費之資本成本 而 2010 年時另一位作者 Steven M. Paul 在 Nature Reviews Drug Discovery 上也 發表了新的整體上市新藥的成本分析數據(35),加入了 Dimasi 作者沒有使用的部 分風險參數,如:cycle times(和失敗率有關),因此評估出來的成本比 Dimasi 高, 現金成本為 8.73 億美元,資本成本大約為 17.78 億美元,見表 3-1。 Paul 2010. DiMasi 2003. Model outputs Out of pocket Capitalized. DiMasi 2007 Pharma. Biopharm. Gilbert 2003. Adams 2006. $873 $1,778. $403 $802. $672 $1,381. $559 $1,241. n/a 1,700. n/a $868. 11.7%. 21.5%. 21.5%. 30.2%. 11~12%. 24%. 11%. 11%. 11%. 11.5%. Key Assumptions P(TS)(clinical approval success rate) Cost of capital. 表 3-1 新藥開發成本統整(35) 24. 11%.
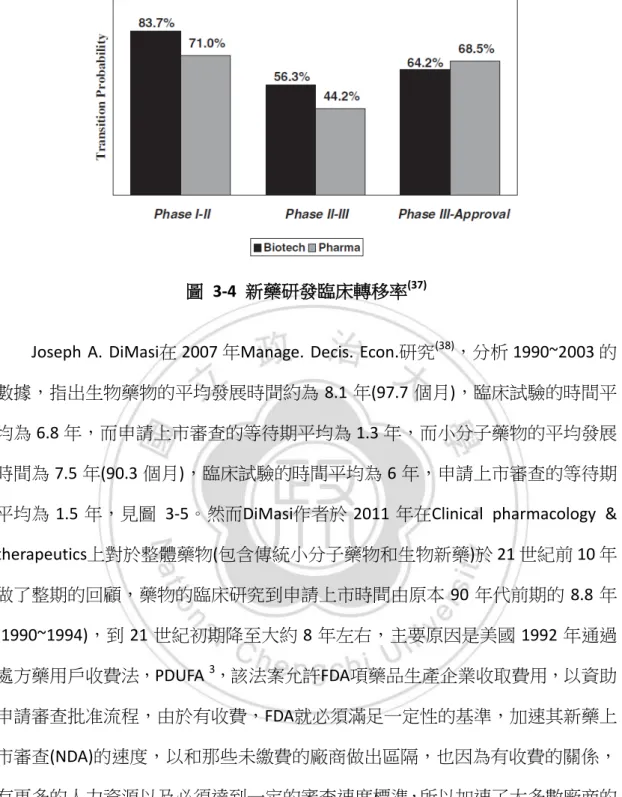
(35) 除此之外生物藥物成本的估計部分,在 Eric David 於 2009 發表於 Nature Reviews Drug Discovery 的文章中(36),為了計算淨現值(NPV)的值也有提及小分子藥物的 R&D 成本約為 17.51 億美元,生物藥物為 22.67 億美元,都較前幾位作者的成本 高,文章中僅交代是參考 Dimasi 發表於 Tuff Center for Drug Discovery 2006 年的 報告以及數間廠商的訪問,並無交代計算方式與詳細方法。見圖 3-3。. 圖 3-3 小分子藥物與生物藥物 10 年 NPV 計算(36) (a)小分子藥物 NPV 計算模型 (b)生物分子 NPV 計算模型(提及 R&D 花費於首年處). 而以投入計畫的數量(藥物種類)與每個時期所剩的計畫數量,來計算每個時期 的轉移率,生物性製藥公司在初期的臨床試驗它的成功轉移率高達八成,關鍵的 二期臨床試驗轉移至三期臨床試驗也較傳統的製藥公司藥物來得高出一成左右 的轉移率,可能的原因是在於,生物性製藥先導入了生物標誌的設計,因此在臨 床上的選擇與設計上可以選擇性的知道適合標誌病人,提高成功的轉移率,因此 生物性藥物整體的成功率為 30.2%,傳統的小分子藥物的成功率為 21.5%,見圖 3-4 新藥研發臨床轉移率。 25.
(36) 圖 3-4 新藥研發臨床轉移率(37) Joseph A. DiMasi在 2007 年Manage. Decis. Econ.研究(38),分析 1990~2003 的 數據,指出生物藥物的平均發展時間約為 8.1 年(97.7 個月),臨床試驗的時間平 均為 6.8 年,而申請上市審查的等待期平均為 1.3 年,而小分子藥物的平均發展 時間為 7.5 年(90.3 個月),臨床試驗的時間平均為 6 年,申請上市審查的等待期 平均為 1.5 年,見圖 3-5。然而DiMasi作者於 2011 年在Clinical pharmacology & therapeutics上對於整體藥物(包含傳統小分子藥物和生物新藥)於 21 世紀前 10 年 做了整期的回顧,藥物的臨床研究到申請上市時間由原本 90 年代前期的 8.8 年 (1990~1994),到 21 世紀初期降至大約 8 年左右,主要原因是美國 1992 年通過 處方藥用戶收費法,PDUFA 3,該法案允許FDA項藥品生產企業收取費用,以資助 申請審查批准流程,由於有收費,FDA就必須滿足一定性的基準,加速其新藥上 市審查(NDA)的速度,以和那些未繳費的廠商做出區隔,也因為有收費的關係, 有更多的人力資源以及必須達到一定的審查速度標準,所以加速了大多數廠商的 上市等待時期,約從 1980~1984 年的 2.8 年等待期,到 2005~2009 年的等待期降 為只需 1.2 年,大幅縮減了等待上市的NDA申請時間,而臨床試驗的時間則是沒 有太多的變化,見圖 3-6 (39)。. 3. PDUFA,Prescription Drug Use Fee Act 26.
(37) 圖 3-5 傳統藥物與生物藥物上市平均各階段所需時間(38) (RR:上市申請等待期間). 圖 3-6 新藥研發主要臨床與上市等待期所需時間變化(39). 而在每年通過新藥(NME)的數量上有下降的趨勢,以 2000 年以來,以 4 年區間 的年平均通過數量來觀察,由 2000-2004 年的 30 件到 2005-2009 的 20.2 件,見 圖 3-7 (包含優先審查程序以及標準審查程序)(39)。. 27.
(38) 圖 3-7 新藥上市平均年數量(每 5 年區間),包含:優先程序和標準程序(39). B. 體外檢測發展過程 如圖 3-1 過程所示,體外檢測產品的開發過程與藥物發展過程所需受到 FDA 審核的部分較少,主要的部分都在於設計產品的反應與檢體的正連結,與 反應確校的確定,是否能夠與疾病有正確的連結與反應,好讓觀察者與判讀 者能夠利用產品可以得知診斷結果,而 FDA 除了安全性之外,主要也是要審 核這些部分。因此整個產品的開發流程可以以圖 3-8 所示表達開發過程與整個 體外檢驗產品的分類,體外檢驗產品在美國是屬於美國醫療器材法官的管 理。. 28.
(39) 圖 3-8 IVD 產品開發流程與試劑外 IVD 產品分類審核流程 一般而言體外檢測產品可以分為實驗分析試劑與體外檢驗產品,而檢驗 實驗試劑,則依照CLIA 4修正法案規定的臨床試劑規範審查,將其註冊為ASR 5試 劑。 而除了實驗分析試劑之外的體外檢測產品,依據不同風險程度等級(Class I、II、III)進行不同的管理 6,(1)Class I:對身體可能傷害性小的商品:此部分 4. CLIA: Clinical Laboratory Improvement Amendment,臨床實驗趕進修正法案. 5. Analyte-specfic reagent,特殊分析試劑. 6. 所有的 Class I、II、III 級醫療器材業者都必須符合一般管制的要求,其包括工廠註冊、產品列名、. 遵守標示的法令規定(屬於 21 CFR Part 801、809、812) 、上市前通告 510 (k)之審查、GMP(Good 29.
(40) 的商品只需向FDA直接的商品註冊即可,並在FDA上作設備的表列,並標註是 符合GMP設計等規範、標示、儲存、服務等基本規定 4;(2)Class II:大多數IVD 產品是屬於此部分,需經由上市前的呈報與通知FDA做審查,FDA需依照美國 食品藥品衛生管理法 510(k)規定審查基本流程、以及其產品是否符合其產品設 計所宣稱之性能,以及是否有達到設計的跡象可以使用;(3)Class III:新穎測 試產品,在市場上屬於新的技術,必須連結臨床資料,因此必須向FDA申請 PMA 7程序,必須合乎 510(k)法案 8,提出 90 天前上市前申請之審核,並證明 產品的安全性、確校、性能與臨床數據。 對於分子檢測的產品而言,由於技術是屬於較為新穎的技術,產品大多必 需和臨床的數據做連結與設計,產品必需要確定是否真實和設計上和臨床診斷上 有真實上的的數據顯著連結,才能夠證實產品是有效的產品,因此在產品分類上 是屬於 Class III 的分類,必須申請 PMA 程序的審查,而通常 PMA 的審查程序至 少都會花上 1 年的時間,來確定廠商的臨床實驗數據與產品數據的性能是否正確, 再加上上市前的 510(k)上市前審核,還約需 90 天的時間,平均的 FDA 的等待時 間也和藥物的審查(快速審查的等待期),相差不多。 然而在廠商成本與發展時間的探討上,主要的文獻並不多,最主要的文獻是 Jerel C Davis 2009 年發表在 Nature Review Drug Discovery上的文章(40),以XDx與. Manufacturing Practices)之實行。 7. Pre-market approval process 上市前核可程序,必須合乎 510(K)法案,由於是新穎的技術,必須. 在上市前審核臨床的資料是否和所設計的檢驗技術的資料分析是有正相關的連結,以防止上市的 產品是無效產品 8. 510(k)法案,任何人或製造商若要將醫療器材產品(Class I,II,III)行銷到美國,除部分免 510(k). 品項及無須進行上市前核准(Premarket Approval, PMA)外,都必須在進口美國至少 90 天前向美 國食品藥品管理局(U.S.Food and Drug Administration,簡稱 FDA)提出上市前通知(Premarket Notification,PMN ) 申 請 , 取 得 輸 入 許 可 ( 510(k) Clearance Letter )。 Premarket Notification, 510(k):510(k)是向 FDA 提出的上市前申請文件,目的是證明申請 510(k)的醫療器材不需進行上市 前核准(PMA)且與已合法上市之產品具相同安全性及有效性,此即實質相等性(substantially equivalent)。 30.
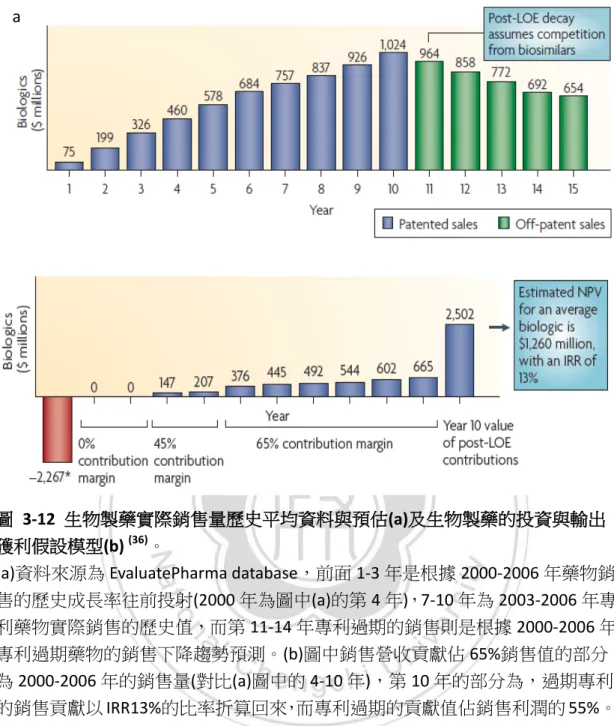
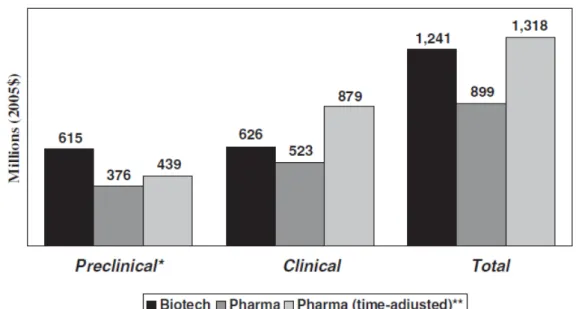
(41) Oncotype Dx兩間公司的實際銷售與成本結構為基底,假設要成立一間新的分子 檢測公司”Representative P&L”,去推算與估計投入技術的淨現值(NPV)是多少,其 中產業的毛利率(margin gross)為 50~70%,discount rate (COC 9)為 15%,而投入發 展一個分子檢測產品的平均資本成本為 4000~5000 萬美元(取中間值為 4500 萬 元),平均 10 年的折現值NPV為 1480 萬元,然而經由估算,倘若產品上市的時間 延遲 1 年,則NPV會減少 1000 萬美元。而分子檢測產品在市場上能夠達到良好 的市場覆蓋率(payor coverage)以及醫師的取代傳統的檢測技術方法,大約分別約 需時 6 年以及 5~8 年的時間,這些payor使用率以及醫師的使用率會影響到NPV 的值,見圖 3-9。. 圖 3-9 分子檢測平均產品開發成本與 NPV 的估算,以及開發所需時間的關係. 9. COC:Cost of capital 資本成本 31.
(42) 三、賽局理論 Game Theory 的奠基,是由 Von Neumann 與 Morgenstern 二人在 1944 年所 著 Theory of Games and Economic Behavior 一書。他們將賽局分為規範性賽局 (rule-based games),與自由式賽局(freewheeling games)之兩類,前者參賽的規則 明確且參賽者的各種反應是可以預知的,但後者沒有明確的規則限制,參賽者互 動可有較大的變化空間。一般而言,商業競爭經常同時兼具兩種賽局的特性,但 以自由式賽局的思維比較容易創造雙贏的機會。然而賽局理論都被廣泛的應用在 很多方面,從下棋、撲克等遊戲,直到許多不被認為是遊戲的各種社會的、經濟 的、政治的、和軍事的衝突等面向都可以被應用來思考,從參與決策的決策者(賽 局者,player),以及每個參與者都有明確的偏好順序(preference),以及每個賽局 結果的得益(pay-off),而構成賽局的因素有(41):. 賽局理論的元素 說明 參賽者(Playters)單人和多人,人類和自然 行動或規則 (Actions參賽者可應用的行動及行動的順序、次數 or Rules) 訊息結構分類: • 完全(perfect)訊 息:訊息集合為單一節點, 所有訊息皆為 共同資訊(無私有資訊),無同時行動 • 確定(certain)訊息 :參賽者隨機做決策後 , ”自然 ”不行 動 訊息(Information) • 充分(complete)訊息 :每位參賽者均曉得賽局之所有基本 元素(參賽者、行動集合、報酬函數) • 對稱(symmetric)訊息:所有參賽者之訊息分割均相同 策略(Strategies) 參賽者由其擁有的訊息集,選擇該執行的行動集合 報酬(Payoffs) 參賽者在賽局結束時所能得到的報酬 結果(Outcomes) Outcomes = action + payoff. 32.
(43) 把對方之決策視為既定,自己再做決策,包括每位參賽者在給定其 他參賽者的最佳策略下,所選擇之策略組合。即當參賽者之預期與 策略都不再修正時,則賽局達到平衡。(最佳策略參賽者可以得 到最高報酬之策略,而且參賽者不會有其他策略之動機) 平衡或解答 (Equilibrium or solution). 常出現的平衡包括以下四種: ﹒Nash 平衡:訊息充分之靜態平衡 ﹒貝氏Nash 平衡:訊息不充分之靜態平衡 ﹒子賽局之完全平衡:訊息充分之動態平衡 ﹒完全貝氏平衡:訊息不充分之動態平衡. 資料來源:陳嘉慧(2003) 交通大學碩士論文 表 3-2 賽局的基本元素(41). 一般的賽局理論依賽局基本元素作為賽局分的變數,將每一種賽局元素組合而成 的賽局型式歸納如下:. 賽局. 時. 資訊 參賽者. 變數. 報酬. 行動規則. 間. 策略. 平衡. 結構. 靜. 零合/. 次序/. 非零合. 同時. Nash 平衡. 完全. 人數 態. 確定. 賽局. 單一/ 貝氏Nash 平衡 混合/. 形式 動 完全理性 態. 對稱/. 有 限 (單 次. 充分. 行為 子賽局完全平衡. /有限理性 非對稱 多)/次無窮 對稱. 資料來源:李秀玉. (1999)國立交通大學論文 表 3-3 賽局形式的分類(42; 43). 33. 完全貝氏平衡.
(44) 一、依據時間特性分類: . 靜態賽局:參賽者在動作時,彼此看不到對方之行動. . 動態賽局:參賽者在動作時,有機會觀察先行動者的動作. 二、依據參賽者特性分類: . 人數:參賽者人數,二人或多人,多人重複賽局較無法對背叛者進 行報復行動,對合作者進行示好行動;. . 完全理性:參賽者的行動是經過深思熟慮,不會犯錯,知道賽局正 確答案;. . 有限理性:參賽者的行動是需要時間學習,而且會犯錯。. 三、依據報酬特性分類: . 零合賽局:指負的一方所輸之報酬,正好等於勝的一方所獲之報酬, 雙方總和所為零或一定值;. . 非零合賽局:指所有參賽者之報酬總和必不為零,二人非零合賽局 是指賽雙方可能獲某種程之利益,或皆發生某種程度之損失,或一 方為得,另一方為失,但二者之得與失之報酬並不相等。. 四、依據行動規則特性分類 . 次序賽局:參賽者採取的行動,由衡量先行動者的行動所決定;. . 同時賽局:參賽雙方必須同時採取行動,不能預先知道對手的動作, 僅能以有限資訊評估後果,決定最佳行動;. . 有限賽局:有限賽局為各參賽者之可用策略為有限個,單次賽局無 34.
(45) 報復與合作行動考慮; . 無窮賽局:無窮賽局為各參賽者有無限個策略可使用,此種賽局常 發生於策略為一連續變數之情況,例如以時間為決策變數者,或以 資源分配多寡為策略者。. 五、依據資訊結構特性分類 . 完全訊息賽局與不完全訊息賽局:於賽局中,完全訊息結構是嚴格的訊 息假設,每個訊息都只有單一結點(singleton node),參賽者在任何時候 都知道於賽局樹(Game tree)中某結點上做決策。此賽局不允許同時行動, 且所有參賽者都可察到自然之行動,亦即賽局所有訊息都是共同資訊 (common knowledge),否則為不完全訊息賽局,亦即至少有一個參賽者 具有私有資訊 (private information),任何一不充份訊息賽局或非對稱訊 息賽局都是不完全訊息賽局;. . 確定訊息賽局與不確定訊息賽局:確定訊息賽局中,每位參賽者隨機採 取行動,自然並不會先行採取行動,假如不同時行採取行動,則此確定 訊息賽局相同於完全訊息賽局;充份訊息賽局與不充份訊息賽局:每位 參賽者對於賽局中之所有要素,包括參賽者、行動集、報酬矩陣等,都 十分清楚,稱為充份訊息賽局,亦即賽局構成之要素並所有參賽者都知 道的普通知識(common knowledge)時,即為不充份訊息賽局。由於不充 份訊息賽局在數學上無法得出均衡解,故由 Harsanyi 在 1967 年提出引 進自然參賽者觀念,可將不充分訊息賽局轉變為不完全賽局,如此即可 得均衡解,此為著名的貝氏方法(Bayesian Approach)﹕參賽者對其未知變 數賦予主觀機率分配,然後以此機率分配來計算所採取的策略的期望報 酬,而目標則為採取最佳策略使期望報酬最大;. 35.
(46) . 對稱訊息賽局與非對稱訊息賽局:參賽者在採取行動的結點或終點的訊 息集與其他參賽者所擁有之訊息集都相同﹕對稱訊息賽局中可以由自 然先隨機行動或與參賽者同時行動,但每位參賽者並?有比任何其他參 賽者擁有更多之訊息,於非對稱訊息賽局,參賽者擁有私人訊息(private information)(即參賽者之訊息分割不同於其他參賽者,而且所擁有之訊息 結構不會比其參賽者差)。. 六、依據策略特性分類 . 單一(pure)策略:完整描述參賽者該如何選擇最佳策略. . 混合(mixed)策略:為單一策略集合中之機率分配,但其隨機化 須在賽局開始前決定,賽局過程不得改變. . 行為(behavior)策略:類似混合策略,但其隨機化以在參賽過程 中改變. 七、依據平衡型式分類 . Nash 平衡:訊息充份之靜態平衡. . 貝氏 Nash 平衡:訊息不充份之靜態平衡. . 子賽局完全平衡:訊息充份之動態平衡. . 完全貝氏平衡:訊息不充份之動態平衡. 然而通常在商業交易上,買賣雙方交易通常為了要讓交易更容易達到雙方的 目的與需求,通常都會進行議價(Bargaining)與談判(Negotiation)的過程。然而這些 過程通常都會帶有利益考量與商業威脅等多方權衡,而造成許多的不確定性,再 加上雙方的資訊的不對等性,以及報酬的不對稱性,會影響到議價與談判的平衡 結果,大的廠商議價力較大談判力以及威脅力較強,容易影響最終平衡向其靠攏。 36.
(47) 根據賽局理論學家麥肯(Roger McCain)的說法,成功的可能就在於「原則上,只要 各方能夠達到一個合作解(cooperative solution),任何非定和的賽局(non-constant sum game)都可能轉換成雙贏的賽局」(37; 44; 45),因此當商業環境中陷入僵局困境時, 最常出現的方式就是彼此協商談判與議價,來達到彼此的一個合作解。 經濟學家通常是以賽局理論 (Game theory) 來進行分析與探討。在賽局理論 中,假設理性決策者在面對不確定的情況下,嘗試以預測其他人的策略作為制訂 自己最佳策略的依據,藉以尋求自己最大的報酬或效用。此外,參賽者本身的滿 意度與期望報酬也是決定議價均衡的最主要因素,唯有瞭解參賽者本身的期望, 才能明確地揣摩參賽者的議價策略。 然而技術相關的交易通常是經由長時間的交涉與交換內容,與商業經營,以 抗體經營為例,往往是隱含了許多的病人資訊與生產 know-how 等,因此決策通 常需要經由長時間的掌握資訊與分析判斷,或者有很多層面的利益影響與關係影 響到平衡,並做出決策然後影響下一步動作,下表整理動態行為的賽局形式:. 賽局型式. 說明. 零合賽局. 指負的一方所輸之報酬,正好等於勝的一方所獲得之報酬,雙方總和所 得為零成一定值。. 單一交易賽局 某一賽局之參賽者只參加一次賽局,其所握有的資訊必須依據現有資訊 分析可能報酬而做出決策。 重複賽局. 某一參賽者重複參與相同賽局, 前次所作的策略會影響下階段賽局的決 策。. 合作賽局. 合作賽局存在一種制度,可以使參賽者對協議的遵守產生約束. 37.
(48) 膽小鬼賽局. 此賽局之均衡為一方選擇讓開, 另一方選擇不讓開策略 ,此處不確定的 是由哪位參賽者選擇讓開策略; 哪位參賽者選擇不讓開策略。因此,參 加之雙方常會採取虛張聲勢等行為策略,希望能令對方恐懼而閃避。. 共有財的悲劇 群體中不同組的人之間,不斷上演囚犯困境的情形 搭便車. 是一種共有財的悲劇的變形有人占用公用資源卻一點也貢獻,也就是商 業上佔用大多數資源,而顧享其成,而不努力付出資源。. 自願者困境賽 必須有人為團體犧牲,否則就是團體皆輸,但每個人都希望別人去犧牲, 局. 商場上大家都希望別人讓利,或者退出市場,因此容易變成僵局。. 兩性戰爭的賽 兩人有不同的偏好,像是丈夫想看棒球,太太想看電影,但重點是雙方 局(英雄賽局) 都希望能有對方陪伴,而不是各自去做喜歡的事情 獵鹿賽局. 只要團隊中的成員合作就很有可能在一場高風險、高報酬的行動中致 勝;但如果某個人不合作而脫隊行事,則它一定能得到報酬只是報酬會 低一些。. 主導者賽局. 參賽之雙方相互爭奪握有主導權 。當參賽者本身握有主導權時,而對方 處於合作之地位時,所獲得之收益為最大(但主導者之報酬微高於合作 者)。當雙方同時爭奪主導權時,則收益為最小。. 消耗戰賽局. 二人連續重複賽局,特色是當有人放棄時,賽局即結束 。其中賽局每一 階段的報酬均是負值,而放棄者報酬為零,? 一位則可得到正值報酬。. 立即報復賽局 初期採取合作策略,當對手選擇背叛時,我方亦選擇背叛策略,當對手 選擇合作策略時,我方亦選擇合作策略;此賽局當立即報復策略所獲得 之利益為最大。 商譽效果賽局 當參賽者重複參與相同賽局,而想藉由某種賽局的商譽來彰顥對手的決 策,當參賽者對其他參賽者的類型,以及對此類型期望的訊息均充分時, 大多數參賽者會傾向商譽效果的。. 38.
(49) 雇傭關係賽局 勞工必須決定是否接受雇主之肩用、之後由雇主決定是否剝削員工,唯 有雇主不剝削員工時,員工才答應受雇,但雇主因剝削員工而得到最大 收益。 如果雇主承諾不剝削員工,而員工也願意受聘,則主偏雙方之收益都會 提昇,若一開始時,雇主擁有良好之信譽不剝削員工,只要其不剝削員 工,就能繼續擁有良好信譽,但若雇主曾剝削員工,其就變為信譽不良, 此種訊息印象將永遠無法改變。雇主長期所建立之信譽比短期剝削員工 之利益更好價值,因此即使於最後一期,擁有良好信譽之雇主仍然不會 選擇剝削員工利益。 單方向商譽效 當參賽者是單方長期的參賽者,商譽效果是可以存在且非常有利的。此 果賽局. 單方參賽者的策略空間與報酬與其他參賽者是不對稱的,常出現的應用 有產品品質(買方的買或不買、賣方品質高低)、進入障礙(既有廠商 的態度、進入廠商進入與否)、借貨(借方還債與呆帳、貨方之借款與 否)等問題。. 訊息完全之蜈 由於訊息完全,故應用倒推法可得出賽局雙方會在第一局即以獲利了結 蚣賽局. 的方式。. 訊息不完全之 當訊息結構為訊息不完全時,便由自然(隨機化)先決定參賽者乙為合 蜈蚣賽局. 作傾向或背叛傾向者。只要甲不確定乙是哪種類型的人,乙也知道甲不 確定,乙便有機會利用此不確定性以進行謀利。. 39.
數據

Outline
相關文件
S08176 王輝明 一個亞太區、非隨機、開放性、第二期臨床試驗,用以評 估讓 KRAS 基因野生型的轉移性大腸直腸癌病患使用單
IRB 編號 CE19168A-2 計畫主持人 林敬恒 計畫名稱 推動輸血與非類固醇抗發炎藥物不良反應之智慧醫療應用 審查意見
病歷號 主診斷 藥品5碼 BLOOD WBC執行日 就醫流水號 次診斷1 藥品成份名 BLOOD WBC檢驗值 性別 次診斷2 藥品商品名 HGB執行日. 出生日期 次診斷3 藥品開立日期時間
Promote project learning, mathematical modeling, and problem-based learning to strengthen the ability to integrate and apply knowledge and skills, and make. calculated
Report to the class what you have found out about the causes of the social problem identified (i.e. what the causes are, and how details and examples are given to
These are quite light states with masses in the 10 GeV to 20 GeV range and they have very small Yukawa couplings (implying that higgs to higgs pair chain decays are probable)..
行為評估:收集護理病歷、身 體檢查、糞便性、實驗室檢查 (大便標本收集)、診斷性檢查 等資料.
舉例: 中一以隨筆一作前測診斷,發現 學生的描寫多欠具體清晰.