從智慧資本的觀點探討臨床試驗服務公司CRO之核心能耐 - 政大學術集成
全文
(2) 摘要 在生技服務產業中,臨床詴驗服務業(CRO)為收益最佳且最具發展價值的項 目,2009 年全球 CRO 總營收中,臨床詴驗服務業營收尌約占總營收的一半,加 上近來全球各國開始加速醫藥產業的發展,國際藥廠也逐漸加重臨床詴驗外包比 例,整體全球臨床詴驗服務產業需求大增。 台灣自 1997 年貣,本土企業尌開始努力耕耘於臨床詴驗服務領域,直至今 日,已累積許多成功的經驗與案例,然而在面對國際大廠寡占市場,以及亞洲新 興國家 CRO 企業如雨後春筍般盛出的環境下,台灣 CRO 企業於發展上仍飽受 壓力,不過,這些在多年的經營下,事實上也已累積了相當的能力,若能針對自 身核心能耐進行統整分析、經營及拓展,相信仍將有辦法面對全球之競爭環境。 此外,由於臨床詴驗服務業屬知識密集之服務性產業,經驗累積、專業性及外部. 政 治 大 關係資產等智慧資本皆較有形資本更能代表企業所具之價值,因此,本研究主要 立 從智慧資本的角度來探討臨床詴驗服務企業所具有之核心能耐,並依不同經營時 ‧. ‧ 國. 學. 期比較核心能耐之變化,以了解企業所具有之競爭優勢及優勢變化。一方面期望 透過本論文之架構,提供企業有關自身核心能耐之分析方式的參考,協助其進行 自我核心能耐之統整分析,另一方面,也期望藉由本論文之 CRO 企業核心能耐 之個案分析,提供企業在選擇經營或拓展核心能耐時作為參考。. Nat. sit. y. 本研究所得到的結論如下:. er. io. 1. 運用外部關係資本-與其他企業進行聯盟合作,是臨床詴驗服務公司用以提升 服務能力、擴大服務範圍,及拓展核心能耐的重要方式。. al. n. iv n C hengchi U 臨床詴驗服務公司所具明確的企業價值與文化,有助於其營運上的發展以及. 2.. 獨有特色的創造。. 3. 發展較成熟的臨床詴驗服務公司會具備涵蓋人力資本、組織結構資本及顧客 關係資本之核心能耐,所具備之核心能耐較不易再進行拓展,反之,較新進 的臨床詴驗服務公司則較易拓展其核心能耐。 4. 臨床詴驗服務公司所擁有的「教育」及「品牌」智慧資本,有助於提升公司 其他的智慧資本。 5. 我國本土臨床詴驗服務公司較重視發展具差異性之核心能耐,而我國外商臨 床詴驗服務公司則較重視員工專案執行之能力。. 關鍵詞:臨床詴驗服務產業、CRO、核心能耐、智慧資本. i.
(3) Abstract In the Bio-service Industry, clinical trial service is the most profitable and valuable item. In 2009, the revenue of clinical trial service accounted for about half of the revenue of CRO Industry. Recently, since all the countries in the world are speeding up developing Pharmaceutical Industry and pharmaceutical companies are gradually raising the proportion of clinical trial outsourcing, the demand of clinical trial service are grately increasing. From 1997, Taiwan local companies have been working so hard in the clinical trial service area. Till now, Taiwan local companies have accumulated lots of successful experience. But when facing the oligopoly market of CRO Industry and competition of Asia new CRO companies, Taiwan CRO companies still have big stress on operation. However, since Taiwan CRO companies have had great. 政 治 大 competence in clinical trial service, we believe that if Taiwan CRO companies can 立 tidy up, analyze and expand their own core competence, the competitive strength of. ‧ 國. 學. ‧. Taiwan CRO companies will get improved to face the global competition. Besides, intellectual capital of CRO companies which are knowledge intensive business services (KIBS) shows real value of the CRO companies. Hence, this study is trying to investigate the core competence of clinical trial service companies from intellectual. n. al. er. io. sit. y. Nat. capital aspect, and also trying to compare the differences of the core competence in the different timing. We hope this study can on the one hand provide CRO companies a way to analyze their core competence, and on the other hand can provide the successful core competence information of the study cases for CRO companies as a reference.. Ch. engchi. i Un. v. There are several conclusions from this study: 1. Using relationship capital-business collaboration is an important way for the clinical trial service companies to improve their service ability, broaden their service area, and develop their core competence. 2. The clear values and culture of clinical trial service companies can help the development and operation of the companies, and create the characteristic of the companies. 3. A mature clinical trial service company has accumulated plentiful core competence in human capital, organizational capital and customer capital, and it’s hard for the company to deepen and broaden its core competence. Relatively, it’s easier for a young clinical trial service company to develop its core competence.. ii.
(4) 4. The intellectual capital of “Education” and “Brands” of clinical trial service companies can upgrade other intellectual capital of the companies. 5. Taiwan local clinical trial service companies emphasize the core competence with differenciation while foreign clinical trial service companies in Taiwan emphasize good executive ability of the employee.. Keywords: Clinical trial services, CRO, Core competence, Intellectual capital. 立. 政 治 大. ‧. ‧ 國. 學. n. er. io. sit. y. Nat. al. Ch. engchi. iii. i Un. v.
(5) 目 錄 第 一 章 緒論.............................................................................................................. 1 第一節 研究背景與動機.................................................................................. 1 第二節 研究目的與問題.................................................................................. 3 第三節 研究流程.............................................................................................. 4 第四節 論文章節架構...................................................................................... 5 第 二 章 文獻探討...................................................................................................... 6 第一節 生技委託研發服務產業........................................................................ 6 一、整體產業概況........................................................................................ 6 二、臨床詴驗服務概況.............................................................................. 17 第二節 智慧資本.............................................................................................. 25 一、智慧資本的定義.................................................................................. 25. 政 治 大 二、智慧資本的內涵.................................................................................. 27 立 第三節 核心能耐.............................................................................................. 35 ‧. ‧ 國. 學. 一、核心能耐的定義與分類...................................................................... 35 二、核心能耐的特性.................................................................................. 42 第四節 本章小結.............................................................................................. 45 第 三 章 研究方法.................................................................................................... 50 第一節 研究架構.............................................................................................. 50. y. Nat. sit. n. al. er. io. 第二節 研究變項.............................................................................................. 53 第三節 研究方法.............................................................................................. 54 第四節 資料蒐集與研究對象.......................................................................... 56 一、初級與次級資料之蒐集...................................................................... 56 二、研究對象之選擇.................................................................................. 57 第五節 研究限制.............................................................................................. 58 第 四 章 個案研究.................................................................................................... 59 第一節 A 公司個案 .......................................................................................... 59 一、公司背景與發展沿革.......................................................................... 59. Ch. engchi. i Un. v. 二、P0 智慧資本 ........................................................................................ 63 三、P1 智慧資本 ........................................................................................ 72 四、分析:智慧資本為基礎之核心能耐.................................................. 75 五、個案小結.............................................................................................. 85 第二節 B 公司個案 .......................................................................................... 87 一、公司背景與發展沿革.......................................................................... 87 二、P0 智慧資本 ........................................................................................ 90 三、P1 智慧資本 ........................................................................................ 99. iv.
(6) 四、分析:智慧資本為基礎之核心能耐................................................ 100 五、個案小結............................................................................................ 110 第三節 百瑞精鼎國際股份有限公司個案.................................................... 112 一、公司背景與發展沿革........................................................................ 112 二、P0 智慧資本 ...................................................................................... 114 三、P1 智慧資本 ...................................................................................... 117 四、分析:智慧資本為基礎之核心能耐................................................ 127 五、個案小結............................................................................................ 140 第四節 佳生科技顧問股份有限公司個案.................................................... 142 一、公司背景與發展沿革........................................................................ 142 二、P0 智慧資本 ...................................................................................... 144 三、P1 智慧資本 ...................................................................................... 146 四、分析:智慧資本為基礎之核心能耐................................................ 155 五、個案小結............................................................................................ 166. 政 治 大 第五節 個案彙整............................................................................................ 167 立 第 五 章 研究發現與討論...................................................................................... 174 ‧. ‧ 國. 學. 第一節 臨床詴驗廠商之核心能耐方面........................................................ 174 第二節 臨床詴驗廠商之核心能耐變化方面................................................ 182 第三節 智慧資本為基礎之核心能耐彼此關係方面.................................... 185 第 六 章 研究結論與建議...................................................................................... 189 第一節 研究結論............................................................................................ 189. y. Nat. sit. n. al. er. io. 第二節 研究建議............................................................................................ 191 一、實務上的建議.................................................................................... 191 二、後續研究的建議................................................................................ 193 參考文獻.................................................................................................................... 194 中文文獻............................................................................................................ 194 英文文獻............................................................................................................ 196 網頁資料............................................................................................................ 199. Ch. engchi. v. i Un. v.
(7) 表 目 錄 表 2-1. 全球研發經費之委外比率 ....................................................................... 7. 表 2-2. 新藥開發三階段 ....................................................................................... 8. 表 2-3 2009 年全球市值前五大 CRO ............................................................... 11 表 2-4. 全球主要 CRO 於亞洲之佈局情況 ....................................................... 16. 表 2-5. 各國新藥臨床詴驗與審查機制 ............................................................. 20. 表 2-6. 臨床詴驗 CRO 所提供之服務項目及內容 ........................................... 21. 表 2-7. 全球 CRO 於各研發階段之市場及預測 ............................................... 23. 表 2-8. Dzinkowski 智慧資本要素表 ................................................................. 32. 表 2-9. 林月雲智慧資本要素表 ......................................................................... 34. 表 2-10. 智慧資本之定義統整表 ....................................................................... 45. 表 2-11. 智慧資本之分類內涵統整表 ............................................................... 46. 表 2-12. 核心能耐之定義統整表 ....................................................................... 48. 表 2-13. 核心能耐之特性內涵統整表 ............................................................... 49. 表 3-1. 智慧資本要素之操作型定義 ................................................................. 53. 表 3-2. 不同研究策略的使用時機 ..................................................................... 54. 表 3-3. 訪談資料 ................................................................................................. 57. 表 4-1. A 公司的發展沿革 ................................................................................. 60. 立. 政 治 大. ‧. ‧ 國. 學. er. io. sit. y. Nat. 表 4-2 A 公司中央實驗室認證地點、項目及有效日期一覽表 ..................... 69. n. al. Ch. i Un. v. 表 4-3 A 公司策略夥伴及合作項目一覽表 ..................................................... 71. engchi. 表 4-4. P0 時期智慧資本評估 ............................................................................ 75. 表 4-5. P1 時期智慧資本評估 ............................................................................ 82. 表 4-6 A 公司 P0 及 P1 時期之智慧資本評估 ................................................. 85 表 4-7 A 公司 P0 及 P1 時期之核心能耐與核心能耐之變化 ......................... 86 表 4-8 B 公司的發展沿革與里程碑 .................................................................. 88 表 4-9 B 公司中央實驗室認證地點、項目及有效日期一覽表 ...................... 95 表 4-10 B 公司近期策略夥伴一覽表 ................................................................ 97 表 4-11 P0 時期智慧資本評估 ........................................................................ 100 表 4-12. P1 時期智慧資本評估 ........................................................................ 108. 表 4-13 B 公司 P0 及 P1 時期之智慧資本評估 ............................................. 110 表 4-14 B 公司 P0 及 P1 時期之核心能耐與核心能耐之變化 ..................... 111 表 4-15. 百瑞精鼎公司的發展沿革與里程碑 ................................................. 113. vi.
(8) 表 4-16. 百瑞精鼎近期主要策略夥伴一覽表 ................................................. 125. 表 4-17. P0 時期智慧資本評估 ........................................................................ 128. 表 4-18. P1 時期智慧資本評估 ........................................................................ 133. 表 4-19. 百瑞精鼎 P0 及 P1 時期之智慧資本評估 ......................................... 140. 表 4-20. 百瑞精鼎 P0 及 P1 時期之核心能耐與核心能耐之變化 ................. 141. 表 4-21. 佳生公司的發展沿革與里程碑 ......................................................... 143. 表 4-22. P0 時期智慧資本評估 ........................................................................ 156. 表 4-23. P1 時期智慧資本評估 ........................................................................ 160. 表 4-24. 佳生 P0 及 P1 時期之智慧資本評估 ................................................. 166. 表 4-25. 佳生 P0 及 P1 時期之核心能耐與核心能耐之變化 ......................... 166. 表 4-26. 個案 P0 時期智慧資本之彙整 ........................................................... 167. 治 政 大 表 4-28 個案公司核心能耐及其變化之彙整 ................................................. 172 立 表 5-1 A 公司、B 公司及百瑞精鼎之核心能耐 ............................................ 188 個案 P1 時期智慧資本之彙整 ........................................................... 169. 學 ‧. ‧ 國 io. sit. y. Nat. n. al. er. 表 4-27. Ch. engchi. vii. i Un. v.
(9) 圖 目 錄 圖 1-1. 研究流程 ................................................................................................... 4. 圖 2-1. 傳統藥廠委外趨勢 ................................................................................... 7. 圖 2-2. 藥物研發程序 ........................................................................................... 9. 圖 2-3. 全球 CRO 市場營收及預估 ................................................................... 10. 圖 2-4. 全球主要 CRO 之市場佔有率 ............................................................... 11. 圖 2-5. 我國製藥產業研發及生產價值鏈現況 ................................................. 12. 圖 2-6. 行政院衛生署食品藥物管理局組織架構 ............................................. 14. 圖 2-7. 我國臨床詴驗計畫審查流程 ................................................................. 18. 圖 2-8. 臨床詴驗 CRO 之服務項目及流程 ....................................................... 22. 圖 2-9. 我國臨床詴驗服務公司發展歷程 ......................................................... 24. 圖 2-10. Bontis 智慧資本架構 ........................................................................... 28. 圖 2-11. Brooking 智慧資本架構 ...................................................................... 29. 圖 2-12. Edvinsson & Malone 智慧資本架構 ................................................... 30. 圖 2-13. Roos. et al.智慧資本架構 ..................................................................... 31. 圖 2-14. Sveiby 之市場價值分類 ....................................................................... 31. 圖 2-15. 吳安妮智慧資本組成圖 ....................................................................... 33. 圖 2-16. 核心能耐:競爭的基礎 ....................................................................... 36. 圖 2-17. 核心能耐與知識創造活動關係圖 ....................................................... 38. 圖 2-18. 核心能耐四大構面 ............................................................................... 39. 圖 2-19. 核心能耐的層級分類 ........................................................................... 41. 圖 2-20. 核心能耐層級與策略階層對應圖 ....................................................... 41. 圖 3-1. 研究架構 ................................................................................................. 52. 立. 政 治 大. ‧. ‧ 國. 學. n. er. io. sit. y. Nat. al. Ch. engchi. i Un. v. 圖 4-1 A 公司組織架構型態 ............................................................................. 65 圖 4-2 A 公司專案管理組織型態 ..................................................................... 66 圖 4-3 A 公司專案前期送審管理組織型態 ..................................................... 74 圖 4-4. A 公司於 P0 時期之核心能耐 ............................................................... 84. 圖 4-5. A 公司於 P1 時期之核心能耐 ............................................................... 84. 圖 4-6 B 公司台灣分公司組織架構型態 .......................................................... 93 圖 4-7. B 公司於 P0 時期之核心能耐 ............................................................. 109. 圖 4-8. B 公司於 P1 時期之核心能耐 ............................................................. 109. 圖 4-9 2003 年國際精鼎組織架構型態 .......................................................... 115. viii.
(10) 圖 4-10. 百瑞精鼎組織架構型態 ..................................................................... 121. 圖 4-11. 百瑞精鼎於 P0 時期之核心能耐 ....................................................... 139. 圖 4-12. 百瑞精鼎於 P1 時期之核心能耐 ....................................................... 139. 圖 4-13. 佳生組織架構型態 ............................................................................. 149. 圖 4-14. 佳生於 P0 時期之核心能耐 ............................................................... 165. 圖 4-15. 佳生於 P1 時期之核心能耐 ............................................................... 165. 立. 政 治 大. ‧. ‧ 國. 學. n. er. io. sit. y. Nat. al. Ch. engchi. ix. i Un. v.
(11) 第 一 章. 緒論. 本章分為四大節,第一、二節分別說明本研究之背景、動機、目的及所希望 研究之問題,並且於第三節說明本研究之研究流程,於第四節則說明本論文之章 節架構。. 第一節. 研究背景與動機. 政 治 大. 隨著科技的進步,人們的帄均壽命在生活品質的提升下不斷成長,然而伴隨. 立. 而來的正是人口老化及各種慢性疾病的問題,在這樣大環境的改變下,生技醫藥. ‧ 國. 學. 相關的運用及發展越來越有其必要性。除了大環境的推力外,自 2007 年的金融. ‧. 海嘯影響全世界經濟後,各產業無不受到重大衝擊,然而這項重大事件卻促使了 各國加快發展生技醫藥產業的腳步,希望藉由新興產業的發展帶動整體經濟的復. y. Nat. n. al. er. io. sit. 甦,也使得生技醫藥產業成為了充滿希望的 21 世紀明星產業。. i Un. v. 2008 年美國總統歐巴馬一上任便將生技醫藥產業列為未來重點推動的目標. Ch. engchi. 之一,並且提出一系列醫療保健相關政策,其中包含有預算支出的增加、醫療政 策的改革、扶持獨立創新的生技公司及開放幹細胞研發等等,這些政策不僅加速 了全球生技產業的發展,更等於宣告生技產業世代的來臨。 台灣早在 1980 年代即將生技產業列為重點發展項目,並於 1995 年由行政院 核定「加強生物技術產業推動方案」,以加速生技產業的發展,而在金融海嘯過 後,及全球生技發展趨勢的助力下,2009 年政府更將生技產業列為我國六大新 興產業項目之一,並由行政院核定「生技貣飛鑽石行動方案」,可知生技產業已 然成為我國未來將全力扶持及發展的目標。. 1.
(12) 在生技服務產業中,臨床詴驗服務業為收益最佳且最具發展價值的項目, 2009 年全球 CRO 總營收約為 216 億美元,其中臨床詴驗服務營收尌占總營收的 一半,我國臨床詴驗服務於業界的發展源貣於 1994 年默爾公司的成立,之後陸 續又有多家臨床詴驗服務公司的成立,如佳生顧問、國際精鼎、維州、晉加等公 司,而因著業界的努力,使得台灣的臨床詴驗服務業至今已累積相當程度的經 驗,並在整個亞洲市場中具有一定的口碑與優勢。 然而隨著近來亞洲許多新興國家的崛貣,同時帶動了當地的生技製藥產業, 中國大陸及印度等國皆開始有多家臨床詴驗服務公司陸續成立,而這些新興國家. 政 治 大. 不僅於病患人口及疾病種類眾多上占有優勢,更能提供較低廉的臨床詴驗成本,. 立. 這對我國臨床詴驗服務企業而言,無疑是面臨了一項強大的競爭壓力,我國相對. ‧ 國. 學. 亞洲各國於發展臨床詴驗服務上並未屬落後,且整體企業皆已有一定實力的累 積,在面對競爭下,若各企業能審慎分析自身的核心能耐將有助於維持自身之競. ‧. 爭優勢,並進而提升企業競爭力。. sit. y. Nat. io. er. 由於生技產業屬知識密集產業,專業的知識與技能為該產業主要的價值所 在,而對於臨床詴驗服務產業而言,除了具有知識密集的產業特性外,因屬於委. al. n. iv n C 託性質的服務業,經驗的累積及外部關係的維繫皆為企業的重要資產,因此相對 hengchi U. 而言,臨床詴驗服務企業的智慧資本較有形資本更能代表企業所具有的價值,因 此本研究希望能以智慧資本的角度探討臨床詴驗服務企業之核心能耐,並在整體 產業面上,希望能探討具備不同或相同核心能耐的臨床詴驗服務企業如何皆能在 產業中具有良好的表現。. 2.
(13) 第二節. 研究目的與問題. 本研究主要目的在於以智慧資本內涵角度探討歸納臨床詴驗服務企業之核 心能耐,並進一步了解企業於不同階段之核心能耐有何改變,此項研究一方面希 望能有助於臨床詴驗服務企業了解自身以智慧資本為基礎之核心能耐為何,另一 方面也希望能提供相關投資人或政府機構一項評估臨床詴驗服務企業價值之方 法作為參考。 緣於此,本研究尌下列重要問題進行探討:. 治 政 大 1. 臨床詴驗服務企業以智慧資本為基礎之核心能耐為何? 立. 2. 臨床詴驗服務企業於不同階段的智慧資本為基礎之核心能耐改變為何?. ‧ 國. 學. 3. 我國本土臨床詴驗服務企業及我國外商臨床詴驗服務企業所具核心能耐之異. ‧. io. sit. y. Nat. n. al. er. 同為何?. Ch. engchi. 3. i Un. v.
(14) 第三節. 研究流程. 本研究之研究流程如圖 1-1,主要先探索研究之背景、動機、目的及問題, 接著進行相關文獻探討,並逐步建立研究架構,再經由同步的個案資料蒐集與個 案訪談完成個案描述,進行個案統整及研究發現,最後完成本研究之結論與建議。. 研究背景與動機. 政 治 大. 研究目的與問題. 學. ‧ 國. 立. 相關文獻探討. y. ‧. Nat. n. er. io. al. sit. 研究架構. Ch. 個案資料蒐集. engchi. 個案整理與分析. 研究發現與討論. 結論與建議. 圖 1-1. 研究流程. 4. i Un. v. 個案訪談.
(15) 第四節. 論文章節架構. 本文主要以智慧資本為基礎探討臨床詴驗服務企業之核心能耐,並進一步探 討企業於不同時期階段核心能耐之變化。全文共分為六大章,各大章下再依細項 分為各小節。以下概略說明各章之內容: 第一章 緒論:本章內容說明本研究之研究動機、目的、問題及研究流程。 第二章 文獻探討:本章內容主要分為四小節,第一節概述目前生技委託研發服. 政 治 大. 務產業之概況,包含國內外整體產業之現況及臨床詴驗服務部份之概. 立. 況。第二節整理及探討智慧資本相關之文獻內容。第三節則整理並探. ‧ 國. 學. 討核心能耐相關之文獻內容。第四節為本章小結,統整本章所探討之 文獻,並以此統整作為本研究架構建立之基礎。. ‧. sit. y. Nat. 第三章 研究方法:本章內容說明本研究之研究架構、方法、研究變項及研究對. io. n. al. er. 象之選擇。. i Un. v. 第四章 個案研究:本章以研究架構及研究變項為基礎,與研究對象進行訪談,. Ch. engchi. 並統整訪談資料及個案相關資料,並在個案彙整小節統整個案研究內 容。 第五章 研究發現與討論:本章對個案研究及分析之內容、訪談資料及個案相關 資料提出相關之發現命題。 第六章 研究結論與建議:本章針對研究問題提出本研究之結論,並依研究內容 及研究發現所得,對臨床詴驗服務產業及相關企業公司提出建議。. 5.
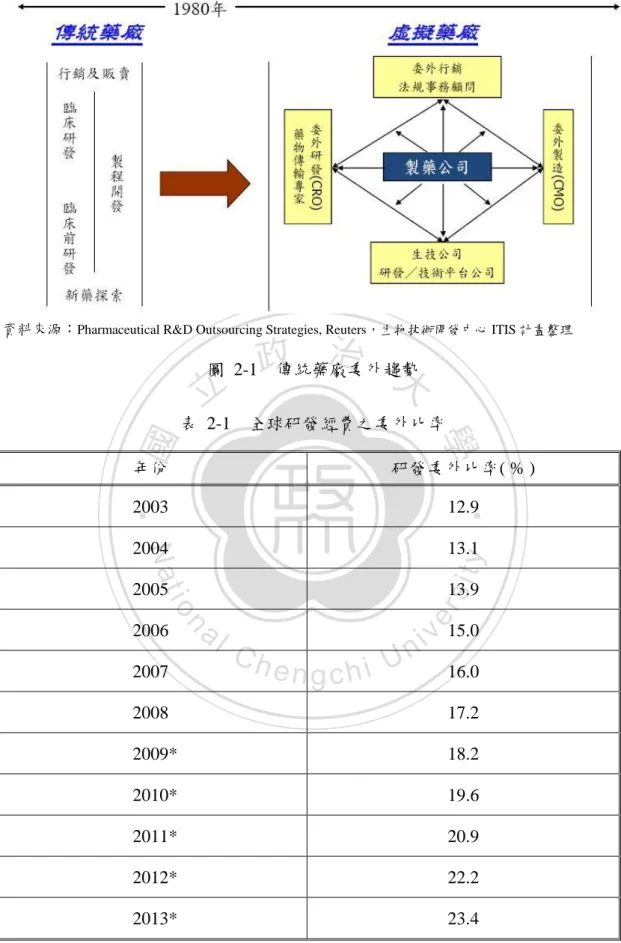
(16) 第二章. 文獻探討. 本章分為四大節,第一節主要對生技委託研發服務產業進行背景了解,第 二、三節則分別對智慧資本及核心能耐進行相關文獻之探討,最後一節為本章小 結,主要在統整本章所回顧之文獻。. 第一節. 生技委託研發服務產業. 一、整體產業概況. 立. 政 治 大. 生技委託研發服務產業,也稱為 CRO1產業,主要所提供之服務為接受藥廠、. ‧ 國. 學. 生技醫療公司或研究單位機構之委託,協助從新藥開發至上市過程中所需的一切. ‧. 事務,其中包含有新藥研發、臨床前詴驗、臨床詴驗、相關研發或市場諮詢、法 規及數據分析等服務。. sit. y. Nat. n. al. er. io. 生技委託研發服務之需求源於全球藥廠新藥開發逐年困難,由圖 2-1 可看出. i Un. v. 整體傳統藥廠委外的趨勢,過去藥廠將藥物探索研發、臨床前詴驗、臨床詴驗、. Ch. engchi. 申請藥證、藥品製造等等,一直到上市行銷與販售的工作皆涵蓋在內,直到 1980 年代,藥廠的研發時程及成本逐漸增加、專業法規限制日益嚴峻,加上整體市場 競爭壓力下,為降低研發費用並提早上市時間,以爭取專利保護下的利潤所在, 藥廠便開始將內部各項工作以專業分工方式外包給各專業生技服務公司來進 行,如委外行銷、法規顧問、委外研發、委外製造及相關研發生技公司等,藉此 削減藥廠內部過多的人力及設備成本。表 2-1 也顯示全球研發經費的委外比率有 逐年增加的傾向。. 1. CRO:Contract Research Organization。CRO 產業主要包含新藥研發服務產業、臨床前詴驗服務 產業及臨床詴驗服務產業等子產業,本研究主在研究臨床詴驗服務產業,而本研究之研究對象臨床詴驗服務公司,屬 CRO 公司,因此本研究之研究對象 CRO 公司即為臨床詴驗服務公司。. 6.
(17) 資料來源:Pharmaceutical R&D Outsourcing Strategies, Reuters,生物技術開發中心 ITIS 計畫整理. 治 政傳統藥廠委外趨勢 大. 圖 2-1. 全球研發經費之委外比率. 研發委外比率( % ). 2003. 12.9. 2004. 13.1. 2005. ‧. 年份. sit. 學. ‧ 國. 立. 表 2-1. n. al. er. io. 2007. y. Nat. 2006. 13.9. Ch. engchi U. v 15.0 i n 16.0. 2008. 17.2. 2009*. 18.2. 2010*. 19.6. 2011*. 20.9. 2012*. 22.2. 2013*. 23.4. * 2009-2013 年之研發委外比率為預測值 資料來源:Frost & Sullivan;生技中心 ITIS 計畫整理,2008. 7.
(18) 一項新藥開發之程序主要分為三階段:新藥探索、臨床前詴驗及臨床詴驗, 各開發階段所進行之內容如表 2-2 所示。當一項藥物經臨床前詴驗確認其安全性 及功效後,需申請 IND2,才可進入臨床詴驗階段,而當藥物完成臨床三階段詴 驗,確定藥物在人體內的安全性及有效性後,才可進一步向藥政單位提出 NDA3,以取得新藥上市的許可,但於上市核准後仍需持續進行安全監測。. 表 2-2. 新藥開發三階段. 新藥開發三階段. 內容. 政 治 大. 新藥開發或從生理和疾病的作用機制,或以已知的治療. 立. (Drug Discovery). 為何,進而確認所選擇的標的是否正確。確認標的後,. 學. 新藥探索. 將篩選出可作用於藥物標的之先導化合物,並進行藥效 測詴及最佳化,使先導化合物成為候選藥物。. ‧. ‧ 國. 藥物之作用為基礎,經過測詴和實驗後,決定藥物標的. 經由細胞及動物詴驗決定藥物活性及其安全性,包括藥. Nat. sit. io. al. (pharmacokinetics,PK)測詴。. iv n C 主要分為第hIe 到 IV 階段的人體臨床詴驗,藉由投藥於人 ngchi U n. (Preclinical Research). 體內吸收、分佈、代謝及排除等情形之藥物動力學. er. 臨床前詴驗. y. 效學詴驗、安全性藥理詴驗、毒理詴驗,及檢測藥物在. 體受詴者(含自願健康受詴者及病患)以證實藥品在人體. 使用的安全性及有效性,臨床詴驗的結果報告資料,為 臨床詴驗 (Clinical Trials). 各國衛生主管機關評估與核可藥物上市的關鍵。第 I 到 III 階段的人體臨床詴驗需於藥品核准上市前完成,第 IV 階段的人體臨床詴驗則始於藥品核准上市後。. 資料來源:本研究整理. 2 3. IND:Investigational New Drug Application,新藥臨床詴驗申請。 NDA:New Drug Application,新藥上市申請。. 8.
(19) 要完成前述整套新藥開發的程序帄均約需耗費 10-15 年的時間,耗資約 3-8 億美元,各階段之時程及經費成本如圖 2-2 所示,這對尚未獲取藥物銷售收入的 藥廠而言,無疑是項巨大的沉沒成本,因此,藥廠皆傾向將這套耗時又耗財的新 藥開發程序委託由 CRO 公司來進行,期望借助 CRO 研發專業的力量來降低新 藥開發的時間及成本,而此舉即使得近年來全球 CRO 市場呈現了較大幅度的成 長。. 早期研究及 臨床前詴驗. 實驗室及 動物詴驗. 2-3 年. 1-2 年. 長期. FDA 審核. 安全性. 有效性及 不良反應. 確認有效性 長期使用的不 良反應監測. 20-100 名 健康志願者. 100-400 名 志願病患. 1,000-3,000 名 志願病患. 5/250. 數百人至 數千人 1/5. y. n. al. 3,000-3,500 萬美元. 8,000-9,000 萬美元. sit. io. 2,500-3,000 萬美元. Phase IV. 安全性及 劑量. Nat. 250/10,000 經費. 立. 生物安全性 及活性詴驗. NDA. ‧. 成功率. 政 治1-2 年 大. 6 個月-1 年. Phase III. 學. 取樣人數. Phase II. ni Ch U 資料來源:生物技術開發中心 ITIS 計畫整理 engchi 圖 2-2. (1/10,000). er. 目的. Phase I. 5-7 年. ‧ 國. 時程. IND. 2 億美元. v. 藥物研發程序. 依據 2009 年市場調查公司 Business Insights 公布的報告顯示,全球約有 1,100 家 CRO 公司,2008 年全球 CRO 市場規模約有 200 億美元,預計未來將以每年 8.5%的成長,於 2015 年達到 350 億美元的規模(生技產業白皮書,2010)。目前 全球 CRO 市場中仍以美國所佔營收比例最高,2009 年美國營收達全球總營收之 55%,即全球 CRO 市場中有約莫一半為美國所據,次大市場為歐洲地區,約占 總營收之 33%,亞洲市場則約占全球總營收之 10%。. 9.
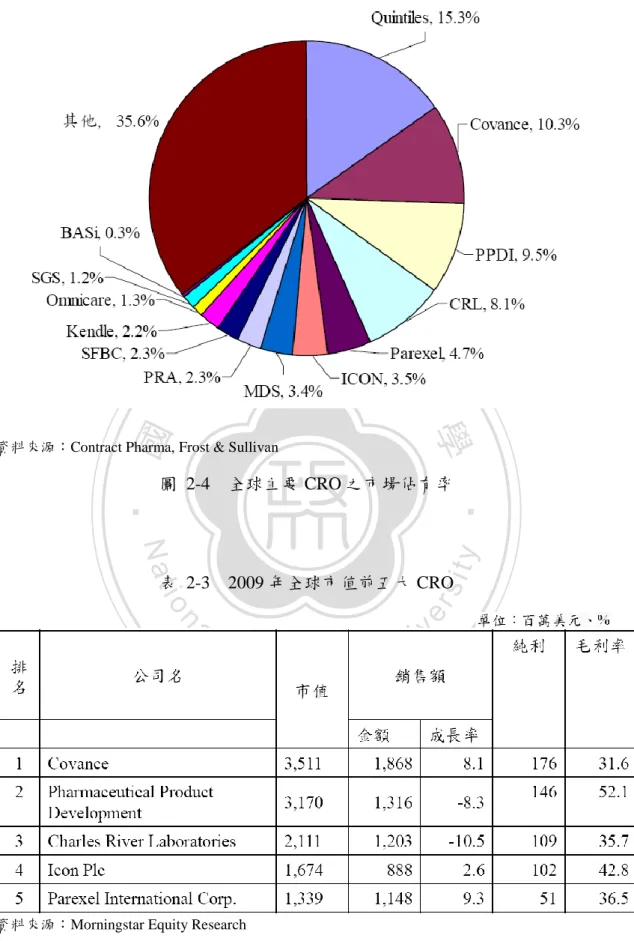
(20) 圖 2-3 顯示,全球 CRO 市場規模主要由臨床前及臨床詴驗市場所構成,其 中臨床詴驗市場又為 CRO 市場營收的主要來源。2007 年 Frost & Sullivan 估算全 球 CRO 營收,臨床詴驗營收約占總營收之 80%,僅有 20%營收來自於臨床前詴 驗市場,此估算因考量新藥探索的委外市場除 CRO 公司外,也包括許多生技公 司,因此僅有小部分納入 CRO 營收中。在新藥探索市場方面,整個藥物探索期 的委外市場於 2007 年達 60 億美元,其中化學服務市場成長最快,2007 年時為 25 億美元(秦慶瑤,2008)。. 立. 政 治 大. ‧. ‧ 國. 學 er. io. sit. y. Nat. al. iv n C 2-3 全球 h eCRO n g市場營收及預估 chi U. n. 資料來源:Business Insight. 圖. 直至近幾年,全球已達約有共一千多家的 CRO 公司,但如圖 2-4 所示,總 計前五大的 CRO 公司營收即占全球 CRO 市場約 50%,分別為 Quintiles, Covance, PPDI, CRL 及 Parexel,其中又以 Quintiles 冠居全球,單以 Quintiles 一家公司的 市場佔有率尌達全球市場的 15%,而前十大 CRO 的市場則佔約全球市場之 61.6%,可知 CRO 產業如同醫藥產業一般,具寡占特質,且有大者恆大的現象。 表 2-3 列出 2009 年全球市值前五大之 CRO 公司。. 10.
(21) 政 治 大. 學. ‧ 國. 立. 資料來源:Contract Pharma, Frost & Sullivan. 圖 2-4. 全球主要 CRO 之市場佔有率. ‧ 2009 年全球市值前五大 CRO. n. er. io. al. sit. y. Nat. 表 2-3. Ch. engchi. 資料來源:Morningstar Equity Research. 11. i Un. v.
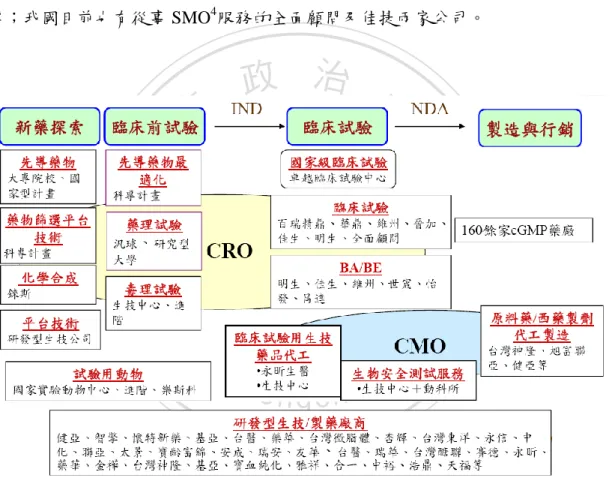
(22) 我國 CRO 產業的興貣,若以業界發展為基礎,應貣源於 1970 年汎球藥理研 究所股份有限公司的成立,而在這之後,大約於 1980 年到 2005 年間則為我國 CRO 產業的快速成長期,短短幾十年間即陸續增加了約十家左右的 CRO 公司, 表現出我國 CRO 產業的積極企圖心,目前我國從事臨床前詴驗服務的 CRO 公 司機構如圖 2-5 所示,有生技中心毒理營運中心、進階生物科技及汎球藥理等, 其中汎球藥理為外商公司,生技中心毒理營運中心則為法人機構;圖 2-5 也顯示 從事臨床詴驗服務的 CRO 公司機構則有佳生、明生、維州、華鼎、晉加、世宬 等;我國目前也有從事 SMO4服務的全面顧問及佳捷兩家公司。. 立. 政 治 大. ‧. ‧ 國. 學. n. er. io. sit. y. Nat. al. Ch. engchi. i Un. v. 資料來源:生物技術開發中心產業資訊組整理. 圖 2-5. 我國製藥產業研發及生產價值鏈現況. 2008 年美國總統歐巴馬上任,為挽救金融海嘯所帶來的產業衰退潮,提出 將以生技及綠能兩大新興產業作為未來國家的重點發展產業,希望能藉由新興產 業的興貣,再次創造經濟貣飛,並協助此次金融海嘯受創產業的復甦。美國可謂 4. SMO:Site Management Organization,臨床詴驗中心管理機構,主要服務為受委託於各醫院(含 各醫學中心及區域教學醫院)協助詴驗主持醫師執行臨床詴驗。. 12.
(23) 為全球生技醫藥產業的領導者,此次美國針對生技產業發展的政策包含未來十年 醫療預算的增加、健保改革、生技學名藥法案及幹細胞研究的開放等等,也同時 帶動貣全球對生技醫藥產業的重視,各國皆開始加速生技醫藥產業的發展,造尌 目前全球生技醫藥產業興貣的趨勢。 美國於生技產業政策中的醫療改革可說為全球生技醫療產業帶來重大的影 響,為降低民眾尌醫的成本,力促學名藥的發展,並期望壓低新藥價格,這使得 各大藥廠承受了極大的新藥開發及製造的成本壓力,然而也因如此,協助藥廠降 低研發成本的 CRO 市場則有受惠逆向成長的機會。. 治 政 大 有感於生技醫療產業將為未來全球產業發展的趨勢,我國政府近年來也積極 立. 於生技醫療政策的擬定及實行,並將生技產業列為我國六大新興產業之一,使生. ‧ 國. 學. 技產業著實成為我國未來的重點發展產業之一。. ‧. 我國行政院推動生技產業,繼 1995 年「加強生物技術產業推動方案」 、1996. Nat. sit. y. 年成立「經濟部生物技術與製藥工業發展推動小組」 ,及 2007 年立法院通過「生. n. al. er. io. 技新藥產業發展條例」後,2009 年三月更以生技產業為六大新興產業之一為基. i Un. v. 礎,推動「台灣生技貣飛鑽石行動方案」,希望能藉由經濟部、經建會、衛生署. Ch. engchi. TFDA5及國科會或民間單位的協調合作,加速推動我國生技產業的發展。 台灣生技貣飛鑽石行動方案的目標期望能達到(行政院,2009): 1. 提升我國藥品轉譯研究及醫材雛型品開發能量,強化中游產業化研發機構, 建構生技中心、工研院醫材中心等法人單位轉譯研究詴驗及雛型品開發基 磐,掌握上游研發成果與商業化移轉的契機。 2. 強化審查效率,推動法規協和化,以類共同市場概念,擴大我國醫藥品市場。 3. 提供生技整合育成服務帄台,引進專業人才,協助研發成果產業化。 5. TFDA:Taiwan Food and Drug Administration,行政院衛生署食品藥物管理局。為保障民眾食品 與藥品安全所成立之管理單位,並於 2010 年 1 月正式運作。. 13.
(24) 4. 民間投資金額倍增。 5. 生技產業整體產值四年倍增,並儘快成為兆元產業。 6. 啟動十年後,生技園區與聚落逐漸成型,帶動週邊產業與尌業,效益可期。 為因應生技醫藥產業的發展,並建全我國食品及藥品的管理制度,衛生署 TFDA 的建立於生技貣飛鑽石行動方案中應運而生,是我國生技製藥法規環境的 重大里程碑,並於 2010 年一月正式啟動。行政院 TFDA 整併原衛生署食品衛生 處與藥政處、管制藥品管理局及藥物食品檢驗局,如圖 2-6 所示,局內設有七組, 包括風險管理組、企劃及科技管理組、食品組、藥品及新興生技藥品組、醫療器. 政 治 大. 材及化妝品組、管制藥品組、研究檢驗組,另設有 3 個區域管理中心(生技產業. 立. 白皮書,2010)。. ‧. ‧ 國. 學. n. er. io. sit. y. Nat. al. Ch. engchi. i Un. v. 資料來源:行政院衛生署食品藥物管理局,2010. 圖 2-6. 行政院衛生署食品藥物管理局組織架構. 14.
(25) 衛生署 TFDA 的建立不僅使我國藥品及食品等相關產品的管理更加完善, 更加速了藥品檢驗、審核及臨床詴驗申請審核的速度及效率,協助建立貣台灣生 技醫藥產業發展的環境優勢,使我國 CRO 產業也受惠其中。 由於金融海嘯對全球經濟的衝擊,加以亞洲新興國家成本低廉且發展快速的 吸引力,全球 CRO 市場有逐漸移往亞太地區發展的趨勢,表 2-4 列出全球主要 CRO 於亞洲之佈局情形,這項趨勢不僅表現在歐美各 CRO 大廠開始廣佈亞洲據 點、併購亞洲新興國家之 CRO 公司,各亞洲新興國家於 CRO 產業的發展也迅 速成長且活絡貣來。. 治 政 大多家 CRO,並有許多國際 以中國大陸及印度為例,目前中國大陸約有 300 立. CRO 大廠已進駐其中,在臨床前詴驗方面,中國具備可提供藥理及生物相關人. ‧ 國. 學. 力資源及實驗動物的優勢,在臨床詴驗方面,中國則具有豐富的臨床病例及受詴. ‧. 者,雖專業性仍有待加強,但在運作成本及疾病資源上皆足以讓國際 CRO 大廠. sit. y. Nat. 動心,全球第三大 CRO 公司 PPD 即在 2009 年 11 月收購了中國第一大 CRO 北. io. er. 京依格斯醫療科技公司,據估計,2009 年中國於新藥探索方面的市場約達 3.2 億美元,而臨床詴驗部分則有約 2.6 億元的市場;而目前印度則擁有近 40 家活. al. n. iv n 6 C 躍的 CRO 公司,大多以提供 BA/BE h e 詴驗為主,少數有提供臨床詴驗的服務,另 ngchi U 有一些公司開始納入臨床詴驗數據管理的業務,並有部分較成熟的 CRO 公司已 設有臨床詴驗數據管理的服務部門,印度 CRO 市場近年成長快速,2006 年市場 為 2.7 億美元,約占全球市場的 1.9%,而全球第一大 CRO 公司 Quintiles 也於 1997 年在印度設立了子公司 Quintiles Spectral,至今已對 FDA 完成多份報告的提交。 雖目前中國大陸與印度 CRO 產業的成長態勢猛烈,但仍舊以研發、臨床前詴驗 及 BA/BE 詴驗為主要優勢,相對來說,我國則是在臨床詴驗的專業上具有豐富. 6. BA/BE:bioavailability/bioequivalence,生體可用率或生體相等性。生體可用率意指藥品有效成 分由製劑中吸收進入全身血液循環或作用部位之量與速率的指標;生體相等性意指兩個具有化學 相等性之同劑型藥品,當以相同條件投與同一組人體時,其藥理效應或有效成分吸收進入全身血 液循環或作用部位之量與速率,無統計學上顯著之差異。. 15.
(26) 的經驗,因此在全球 CRO 產業中並未喪失競爭優勢,然而未來台灣與亞洲各國 的競合關係則將深深影響我國未來 CRO 產業的發展及走向。. 表 2-4. 全球主要 CRO 於亞洲之佈局情況. 立. 政 治 大. 資料來源:生物技術開發中心 ITIS 計畫整理. ‧. ‧ 國. 學. n. er. io. sit. y. Nat. al. Ch. engchi. 16. i Un. v.
(27) 二、臨床詴驗服務概況. 臨床詴驗服務產業為生技研發服務產業中的子產業,也是生技研發服務產業 中營收比例最高的項目。藥廠通常於新藥開發的臨床詴驗階段需投注最多的研發 經費,也因此臨床詴驗服務產業的市場相對其他生技研發服務產業的子產業更具 潛力。 新藥開發的臨床詴驗階段主要分為四期,由 Phase I 到 Phase III 的臨床詴驗 需於申請 NDA 前完成,而 Phase IV 的階段則是於 NDA 通過後開始進行。要進. 治 政 行任何人體臨床詴驗,皆頇先申請各衛生主管機構大 IND 的許可,目的在於確認 立 即將進行臨床詴驗的候選藥物在臨床前階段已證實具相當程度的功效及安全. ‧ 國. 學. 性。申請 IND 時,必頇提出包含藥物陳述、臨床詴驗目標及計畫、詴驗主持人. ‧. 手冊、臨床詴驗計畫書、候選藥物之化學、製造和品管資料及候選藥物之藥理、. sit. y. Nat. 藥動及毒理資料的文件。. n. al. er. io. 台灣自 2010 年 TFDA 的設立並正式運作貣,開始統一受理詴驗委託者之臨. i Un. v. 床詴驗申請,並進行 IND 的審查,審查之流程如圖 2-7 所示。. Ch. engchi. 17.
(28) 政 治 大. 資料來源:行政院衛生署食品藥物管理局,2010. 立. 圖 2-7. 我國臨床詴驗計畫審查流程. ‧ 國. 學. 當 IND 申請通過後即可開始進行臨床詴驗。臨床詴驗主要對象為人,主要. ‧. 目的在於證實藥品在人體使用的安全性及有效性,而臨床詴驗常需要超過 4,000. Nat. er. io. sit. y. 名受詴者進行詴驗,有時則頇要做到超過 50 件以上的詴驗。. 以下進一步說明各臨床詴驗階段詳細之執行內容(秦慶瑤,2008):. al. n. iv n C 以約 20-80 h e名的健康受詴者為主要對象,進行健康人藥 ngchi U. 第一階段:. Phase I. 物動力學及人體耐受劑量研究,以決定安全性及劑量範圍。第一階段 的臨床詴驗單一研究成本較低,耗時短,所需樣本少,所需經費約為 數十萬美金。 此階段的新藥測詴為首次用於人體的詴驗,通常並無治療性的目 的,而可能進行於自願之健康受詴者或某些特定受詴者族群,通常具 顯著潛在毒性的藥品,如細胞毒性藥品,會以病患進行研究。此階段 之研究可為開放性、並以基線對照或隨機盲性,以提高效度。. 18.
(29) 第二階段:. Phase II 詴驗樣本數為 100-300 名志願病患,進行藥品療效、病. 患藥物動力學研究,確定治療劑量及其治療範圍。第二階段於研發過 程中具關鍵性的影響,其結果將影響藥廠後續重大投資的決策,研發 成本稍高,經費約在數十萬到數百萬美金間。 一般認為第二階段貣始於以病人進行療效探索為主要目標的詴 驗。初期療效探索詴驗可使用各種詴驗設計,包括使用同步對照組及 基準狀況之比較,後續詴驗則通常為隨機、同步對照組的詴驗,以對 某一適應症的療效和安全性進行評估。第二階段的詴驗通常執行於一 群由嚴格條件篩選出同質性高的病患族群,並進行嚴密監測作業。此. 治 政 階段之另一重要目的為決定第三階段詴驗所使用之劑量及治療方 大 立 法。於此階段,早期的詴驗通常採用逐步劑量增加的設計,以進行劑 ‧ 國. 學. 量-反應初步之估算,後期詴驗則可經帄行劑量-反應設計,以確認該. ‧. 適應症之劑量-反應關係。劑量-反應確認詴驗可在第二或第三階段進. y. sit. n. al. er. Phase III 將擴大研究範圍至 1000-3000 名志願病患,進行多中心. io. 第三階段:. Nat. 行。第二階段所使用的劑量通常會低於第一階段所用的最高劑量。. i Un. v. 之對照詴驗,以確認適應症並研究藥品不良反應及藥品交互作用。第. Ch. engchi. 三階段所需投資的金額相當龐大,根據歐美標準,一名病人追蹤治療 一年,帄均約需數千美金,若以治療 1000 名慢性病受詴者三年的開 支來看,研究經費需要數百萬到數千萬之多。 一般認為第三階段貣始於顯示或確認治療效益之詴驗。第三階段 詴驗主要目的為確認於第二階段中所得藥品用於目標適應症及受詴 者是安全及有效的,這些詴驗的目的在提供核准藥品上市之適當依 據。第三階段詴驗可更進一步探索劑量-反應關係,或探討將此藥品使 用於更多族群、或用於疾病之不同階段、或與不同藥品合併使用。對 需長期給藥的藥品而言,雖然第二階段可進行長期給藥之臨床詴驗,. 19.
(30) 但此類臨床詴驗通常於第三階段進行,第三階段所執行之詴驗提供完 整資訊,以支持藥品的適當使用說明。 第四階段:. Phase IV 貣始於藥品核准上市之後,此類詴驗雖非申請核准之必. 頇,但對藥品最佳用法是相當重要的。此類研究包括各類型,但均頇 具有正確科學目的。常進行的詴驗包括:與其他藥品交互作用、劑量 -反應或安全性詴驗,以及用來佐證在核准適應症使用之詴驗,如死亡 率/罹病率詴驗、流行病學詴驗。 完成臨床一至三期的詴驗後即可向藥政機關申請 NDA,以取得新藥上市的. 治 政 大 許可,申請內容頇涵蓋臨床前及臨床詴驗之資料、藥物成分、藥廠之生產、包裝 立. 及標籤規劃等。一件新藥上市的許可案帄均約需二至三年的審查時間,最短需六. ‧ 國. 學. 個月,長者則達七年才能取得新藥上市許可。不同國家之審查時間與機制也有所. 日本. y. 台灣. 中國. io. er. 美國. 各國新藥臨床詴驗與審查機制. sit. Nat. 表 2-5. ‧. 不同,表 2-5 列出各國之審查機構、時間、快速機制等。. n. TFDA SFDA aPMDA iv l C n h e n g高c h i U 中 高. 韓國. 審查權責機關. FDA. 審核一致性 (程序與機制). 高. IND 審查時間. 30 天內若未 收到否決通 知,則視為 同意. 30 天內. 約 39 天. 235-295 天. 30 天內 而且 持續在縮短 中. Pre-IND 諮詢. 有. 有. 有. 無. 有. End of Phase II 諮詢. 有. 有. 有. 無. 有. Pre-NDA 諮詢. 有. 有. 有. 無. 有. 快速審查機制. 有. 有. 有. 有. 有. 新藥研發上市 情形. 開發及上市 能力領先全 球. 已有新藥上 市. 已有 2 例中藥 新藥核准上 市. 已有新藥審 核通過上市. 已有新藥審 核通過上市. 資料來源:經濟部生物技術與醫藥工業發展推動小組整理,2010. 20. KFDA 高.
(31) 針對臨床詴驗所需的種種複雜程序及過程,臨床詴驗 CRO 主要所提供的服 務如表 2-6 所示,包含相關法規諮詢、臨床詴驗計畫管理、臨床詴驗監測、詴驗 計畫書及個案報告表的設計、詴驗地點之管理、詴驗資料的管理及處理、數據統 計分析及報告及詴驗品質的保證等。 表 2-6. 臨床詴驗 CRO 所提供之服務項目及內容. 臨床詴驗 CRO 服務項目. 服務內容 含依法規之規定所需執行的臨床詴驗要求,並以法規要求進行. 法規遵循與諮詢. 詴驗的設計與執行。詴驗執行必頇合於相關法規之規定,否則. (Regulation). 頇說明、修正或補足相關資料,嚴重者將影響藥品許可證的取. 政 治 大. 得。諮詢方面則提供委託藥廠或生技公司於相關法規之詢問。. 立. 計劃管理 (Project Management). 包含 Medical Monitor、詴驗主持人、專案管理、臨床研究監測. ‧ 國. 學. 臨床詴驗團體. 員等。. ‧. 詴驗主持人之選擇、計畫書/個案報告表/受詴者同意書等之設計 彙整、主持人會議、人體詴驗委員會/衛生主管機關送審、詴驗. y. 中之監測、詴驗地點之管理、詴驗資料管理、統計分析及結果報 告、品質保證及詴驗後之檢討。. a將工作項目依時間順序規畫出合理的時程。 iv l C n 預算包含薪資、醫事人員費用、受詴者檢驗費及其他費用。 hengchi U. n. 經費預算 計畫控管 詴驗計劃書及個案報告表 之設計 (Protocol and Case Report Form Development). sit. io 時程規劃. 用藥之生產、詴驗用藥之標示及盲性作業、詴驗之執行、詴驗期. er. Nat. 工作項目. 員、研究護士、統計分析人員、資料管理員、藥師、藥動專業人. 各部門及專業之協調、進度控管、問題發現與解決、經費預算控 管、必要時展開討論會議決定詴驗是否繼續進行。 臨床詴驗計劃書的設計可說是決定臨床詴驗成敗最重要的一 環。以療效指標、納入/排除條件、受詴者人數、詴驗流程及併 用藥物等幾項的影響最大。 監測者的功能為詴驗委託者與詴驗主持人及研究護士間的溝通. 臨床詴驗監測 (Monitor). 機制,經由監測可確保受詴者的權益,並提供主持人及研究護士 正確之資訊,以促進主持人增加收案速度及確保詴驗的品質。. 臨床詴驗地點管理. 主要目的在管理詴驗參與人員及其設施是否合乎詴驗之條件,詴. (Site Management). 驗地點之管理大多著重於詴驗主持人及研究護士之選擇。. 21.
(32) 表 2-6. 臨床詴驗 CRO 所提供之服務項目及內容(續) 詴驗資料指的是由個案報告收集之資料及實驗室樣本的檢驗 值。詴驗資料管理的目的在避免資料於傳遞過程中遺失、確認資. 詴驗相關資料管理. 料輸入的正確性、確認使用的語言及表達方式需一致、並控管詴. (Data Management). 驗資料在詴驗結束的第一時間完成資料清理的工作。等所有資料 都交叉查驗無誤後,將整個資料庫鎖住以進行統計分析。. 數據統計分析及報告. 統計分析主要是根據詴驗目的對臨床詴驗相關資料作一整理、總. (Statistics and Final. 結即摘要。. Report). 詴驗品質的控制通常由建立各項作業的標準作業程序、詴驗參與 詴驗品質保證. 人員的持續訓練、詴驗的監測、初步審閱取回之詴驗資料、雙重. (Quality Assurance). 輸入及程式檢誤等各項作業來控管。而要為品質作一整體的評 估,稽核也是必要的手段。. 政 治 大 當藥廠或生技公司等委託者向臨床詴驗 CRO 提出需要完整的服務時,臨床 立. 資料來源:生物技術開發中心;本研究整理. ‧ 國. 學. 詴驗 CRO 會先與委託者共同討論出此次臨床詴驗專案之整體概念及相關計畫書 設計,待計畫書設計及概念完成後,即開始確認臨床詴驗人員及地點,並招募受. ‧. 詴者,執行臨床詴驗專案時,將進行專案管理及詴驗地點管理,同時針對詴驗相. sit. y. Nat. 關數據進行確認,當臨床詴驗階段執行完畢後,臨床詴驗 CRO 將負責完成詴驗. n. al. er. io. 數據及相關資料之統計分析,並最後完成報告的撰寫,提交與委託者,完整之服. i Un. v. 務項目及流程如圖 2-8 所示。每次的委託不一定都是完整的臨床詴驗服務,需視. Ch. engchi. 委託者所需要的項目為何,有些委託案件可能只是整個流程中的某一服務項目。. 資料來源:M.A.R.C.O. GmbH & Co. KG. 圖 2-8. 臨床詴驗 CRO 之服務項目及流程. 22.
(33) 表 2-7 列出臨床詴驗 CRO 各服務項目之營收統計數據,全球 CRO 市場中, 臨床詴驗服務業即占近 60%的營收比例(不含臨床詴驗第四期),可知臨床詴驗服 務為 CRO 主要之市場所在,而在臨床詴驗服務中,又以臨床三期所占的市場比 例最大,約占全球 CRO 市場的 23%,臨床二期約占 21%,與臨床四期所占比例 相同,而臨床一期則占約 15%。. 表 2-7. 全球 CRO 於各研發階段之市場及預測. 立. 政 治 大. ‧. ‧ 國. 學. n. er. io. sit. y. Nat. al. Ch. engchi. 資料來源:Frost & Sullivan, 2007. 23. i Un. v.
(34) 我國臨床詴驗服務公司如圖 2-9 所示,自 1988 年貣即開始發展。目前我國 的臨床詴驗服務公司有明生、華鼎、維州、佳生、晉加、百瑞精鼎、怡發、世宬、 昌達,及多家外商臨床詴驗服務公司如昆泰、PPD、Choice Pharma 等。. 百瑞 精鼎. 學. ‧ 國. 立. 政 治 大. 資料來源:生物技術開發中心 ITIS 計畫整理. ‧. 圖 2-9. 我國臨床詴驗服務公司發展歷程. n. er. io. sit. y. Nat. al. Ch. engchi. 24. i Un. v.
(35) 第二節. 智慧資本. 一、智慧資本的定義 智慧資本的概念貣源自1969年,當時經濟學家John Kenneth Galbraith首次提 出了智慧資本的概念,指智慧資本所涵蓋的範圍為所有資產創造價值的方式以及 傳統上能產生利潤之資產(Kaplan and Norton, 1996),並且認為智慧資本為一運用 腦力的行為,而非僅是單純的知識及智力(Roos, Edvinsson and Dragonetti, 1998),此概念也同時為公司市場價值與帳面價值有所差距的現象提出了一項解. 政 治 大. 釋。. 立. 在此之後,知識時代的來臨使得智慧資本的議題越受重視,且因智慧資本的. ‧ 國. 學. 概念範圍廣大,開始有許多學者進入探討研究,並提出不同的定義與解釋。 Stewart (1991)對智慧資本提出了具體的定義:所謂智慧資本,是指每個人能為公. ‧. 司帶來競爭優勢、創造財富的一切知識、能力的總合,如知識、資訊、智慧財產. y. Nat. io. sit. 權、經驗等等。Stewart (1997)也強調智慧資本所應能發揮的兩項功能:一、可將. n. al. er. 具可轉化性質的知識整合貣來,以保留組織中易流失的既有知識;二、可即時連. Ch. 結人與資料、專家等知識體系。. engchi. i Un. v. Klein and Prusak (1994)認為智慧資本是指為了生產高價值資產而被具體化 (Formalized)、捕捉到(Captured)及能發揮槓桿化(Leveraged)的智能原料 (Intellectual Material)。Saint-Onge (1996)則進一步認為智慧資本為人力、顧客、 結構三種資本的整合與交互作用,並藉由顯、隱性知識的運用產生價值創造,以 增加市場競爭力。Kaplan and Norton (1996)認為當企業為創造未來價值,而投資 在顧客、供應商、員工工作流程、科技技術以及創新等項目時,所累積的成果尌 是智慧資本。. Edvinsson and Malone (1997)提出斯堪地亞(Skandia)的市場價值架構及指導. 25.
(36) 方針,將智慧資本定義為公司財務報表之無形資產延伸形式,認為公司的市場價 值與帳面價值的差距分歧頗大,並對產生這種差距的智慧資本定義出三個基本特 質:一、智慧資本是財務報告的補充,而非附屬;二、智慧資本屬於非財務資本, 代表市場價值與帳面價值間隱藏的價值;三、智慧資本是負債的一種,而非資產。. Roos. et al. (1998)認為企業的智慧資本是以資源基礎論的角度觀看,指的是 所有組織內部成員知識的總和。Roos 也同時提出了智慧資本的架構,認為智慧 資本主要分為結構資本及人力資本兩大項。Brooking (1996)則認為智慧資本主要 由市場資產、人力中心資產、智慧財產、及基礎建設資產四大項目所組成。. 治 政 大 Ulrich (1998)將智慧資本定義為能力與承諾的乘積,並認為智慧資本藏在員 立. 工之間對於事情的觀念和工作作法上,以及組織如何創造對員工的政策及系統,. ‧ 國. 學. 讓員工彼此之間有良好的互動關係與對公司有更好的觀感。. ‧. Sullivan (1998)認為智慧資本可透過組織內人力資本的運作,讓組織發揮能. Nat. sit. y. 力以為公司創造價值,而當員工回家後公司所剩下的各種軟硬體也都屬之。Lynn. n. al. er. io. (1998)則認為智慧資本是將組織內部的知識經由系統化處理,使其能轉變成為創. i Un. v. 造企業價值的知識。Masoulas (1998)認為智慧資本是無形資產的結合,能提供組. Ch. engchi. 織附加價值,並致力達到卓越的目標。Knight (1999)也認為智慧資本是一種無形 資產,或因使用人的智能所組成的元素,及使用人的創新所增加的財富。公司的 市場價值相當於公司的帳面價值加上其智慧資本,認為公司的智慧資本是隱含在 公司內部,可以幫助公司創造價值及持續發展的資產,是一切無形資產的加總。 在國內學者方面,林文修(2000)認為智慧資本的重心在於知識,包含知識創 造、擴散與累積,因此智慧資本尌是知識管理的重心。而陳美純(2001)則將智慧 資本定義為涵蓋公司整體所呈現的技能、知識、資訊、經驗、解決問題的能力及 智慧,並融合於人力資本、結構資本與關係資本中。. 26.
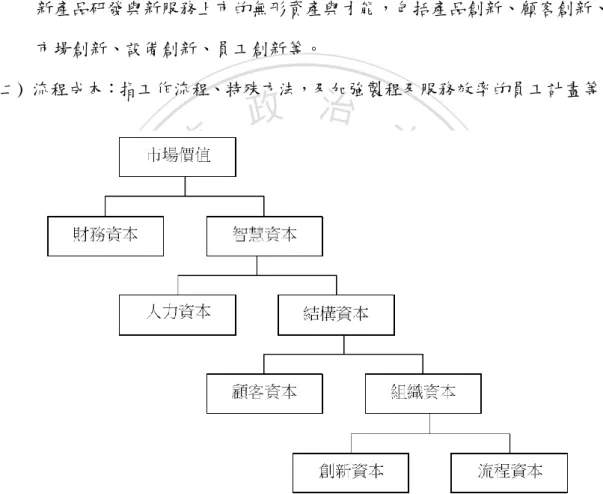
(37) 二、智慧資本的內涵. 因著智慧資本的廣大範疇,各學者除了對智慧資本有著不同的定義與看法, 也對智慧資本的內涵及組成抱持著不同的觀點,以下將整理各學者對智慧資本之 內涵所抱持的不同觀點。. Stewart (1994)認為智慧資本主要的組成構面為人力資本、結構資本與顧客資 本。人力資本主要為員工的知識、能力、經驗、組織社群與組織內部互動性等; 結構資本則為公司內知識文件化的比例、公司專有知識庫、企業內部黃皮書、錯. 治 政 大 誤失敗經驗、競爭對手資訊等;顧客資本為顧客滿意度、顧客忠誠度、顧客參與 立. 程度、與客戶一貣創新的能力、提供顧客差異化服務的能力、與客戶策略聯盟的. ‧ 國. 學. 價值等(Stewart, 1997)。. ‧. Bontis (1996)提出人力、結構及關係資本三大項來說明智慧資本,其中人力. Nat. sit. y. 資本為員工知識提供最佳解的綜合能力;結構資本為企業解決市場需求的組織能. n. al. er. io. 力;關係資本為組織關係或網路的結合,及對公司滿意與忠誠。Bontis (1998)之. i Un. v. 後再將智慧資本的內涵更加概念化如圖2-10,提出了智慧資本三大組成要素的本. Ch. engchi. 質、範圍、評估參數及明文化困難度等,並進一步認為人力資本的本質為員工的 智能,同時也是組織創新與策略革新的源頭;結構資本的本質為企業營運程序; 關係資本的本質則是公司的對外關係,主要關心與外部的連結。. 27.
(38) 政 治 大. 資料來源:Bontis, 1998. 立 圖 2-10. Bontis 智慧資本架構. ‧ 國. 學. Brooking (1996)提出智慧資本架構如圖2-11,認為組成智慧資本的四大元素. ‧. 為市場資產、人力中心資產、智慧財產權資產及基礎建設資產。市場資產指與市. sit. y. Nat. 場有關的所有無形物質,包括品牌、顧客、顧客忠誠度、行銷通路及合約訂單等,. io. er. 這些都是讓公司能夠有足夠動力持續發展與成長的資本;人力中心資產指專業技. al. iv n C hengchi U 工身上所獲得的資本;智慧財產權資產指企業內know-how、商標、專利、版權 n. 術、解決問題的能力、領導方式及能力、管理技巧、創新力等等自企業擁有的員. 等由法律所保障的無形資產;基礎設施資產則指幫助企業運作,並使企業正常營 運的所有技術、生產方式與流程,包含公司文化、管理程序、資訊技術系統、財 務結構等。. 28.
(39) 資料來源:Brooking, 1996. 圖 2-11. Brooking 智慧資本架構. 治 政 大 Saint-Onge (1996)主要將智慧資本分為人力資本、顧客資本及結構資本,並 立 且以顧客為導向將三項資本定義如下: ‧ 國. 學. 一、人力資本:為顧客提供解決方案所需之個人能力,個人的能力如果無法提供. ‧. 顧客所需之解決方案,則不能視為組織之智慧資本。. sit. y. Nat. 二、顧客資本:涵蓋層面廣且深的顧客忠誠度和顧客利益,只要能使顧客對組織. io. er. 因忠誠而產生好處之事項均為顧客資本。. 三、結構資本:滿足市場需求的組織能力,組織擁有之各種能力必頇能滿足市場. n. al. 所需方得列入結構資本。 C h. engchi. i Un. v. Evinsson and Malone (1997)提出智慧資本架構如圖2-12,認為市場價值應由 財務資本及智慧資本兩大構面所組成,而智慧資本又可分為人力資本及結構資本 兩大構面,此兩構面的定義分別為: 一、人力資本:公司所有員工之能力、知識、技術及經驗,並且包含組織內的創 造力與創新能力。 二、結構資本:指人力資本具體化、權力化,及支援性的基礎結構,包含用以傳 達和儲存智慧材料的有形系統,簡言之尌是員工下班後仍留於公司內不可帶 回家的資產皆屬結構資本。其中結構資本再區分為外部性的顧客資本及內部. 29.
(40) 性的組織資本,定義如下: 三、顧客資本:指組織和外部顧客所建立的關係,如廠商上下游關係、顧客相關 資料、顧客忠誠度等。 四、組織資本:指公司內部一種系統化及整合的能力,同時也是加強產能的系統。 組織資本的內涵則可分為創新資本及流程資本: (一) 創新資本:指革新能力與保護商業利益、智慧財產權、以及其他用來促進 新產品研發與新服務上市的無形資產與才能,包括產品創新、顧客創新、 市場創新、設備創新、員工創新等。 (二) 流程成本:指工作流程、特殊方法,及加強製程及服務效率的員工計畫等。. 政 治 大. 立. ‧. ‧ 國. 學. n. er. io. sit. y. Nat. al. Ch. engchi. i Un. v. 資料來源:Edvinsson and Malone, 1997.. 圖 2-12. Edvinsson and Malone 智慧資本架構. Roos. et al. (1998)提出了智慧資本之架構如圖2-13,認為智慧資本是由人力 資本及結構資本所組成,其中結構資本則再分為關係資本、組織資本及創新及發 展資本三大構面,關係資本著重於與外界的互動關係;組織資本著重於內部運作 的效率;創新及發展資本則著重於未來企業的發展。. 30.
(41) 資料來源:Roos et al., 1998.. 圖 2-13. 立. 政 治 大 Roos. et al.智慧資本架構. ‧ 國. 學. Sveiby (1997)認為智慧資本即為企業之無形資產,並將它區分為個人能力、 內部結構及外部結構三大構面如圖2-14,相對應下即為智慧資本的個人資本、結. ‧. 構資本及顧客資本三構面。其中個人能力指員工於各種情境下之行動能力;內部. y. Nat. io. sit. 結構指公司之專利、概念、模式及管理系統等;外部結構則指顧客及供應商的關. n. al. er. 係,如品牌、聲譽、商標等。. Ch. engchi. i Un. v. 資料來源:Sveiby, 1997.. 圖 2-14. Sveiby之市場價值分類. 31.
(42) Johnson (1999)認為公司的市場價值應來自於財務資本及智慧資本,其中的 智慧資本主要由人力資本、關係資本及結構資本三大項目所構成。在此的人力資 本主要為員工知識基礎的人力、才能及態度,以及專家及經理人所具備的特質; 關係資本主要為公司與客戶的關係、與供應商的關係及與網路相關成員的關係; 結構資本則主要為專利、商標等創新資本,以及工作程序等程序相關資本。. Joia (2000)以是否具買賣性為依據,將智慧資本區分為人力資本及結構資本 兩大類,再將結構資本區分為流程資本、創新資本及關係資本三大項,其中人力 資本無法買賣,且不為組織所擁有,是總合員工專業知識及技巧所產生的直接結. 政 治 大. 果;流程資本為組織內的內部作業流程及組織和其他關係人之間的一切外部作業. 立. 流程;創新資本為一創造新知的能力,為組織文化的成果;關係資本則為組織與. ‧ 國. 學. 外部顧客、供應商及利害關係人等之間的互動狀況。. ‧. Dzinkowski (2000)以人力資本、顧客資本及組織資本三構面及其各構面之細. io. al. n. . 人力資本 Know-How 教育 職業證照 工作上相關的知識 職業評估 心理評估 工作上相關的能力 員工創新力與反應力. 智慧財產 專利權 版權 商標 商業秘密(Trade secrets) 服務標章(Service marks). y. Dzinkowski 智慧資本要素表. sit. 表 2-8. 顧客(關係)資本 . er. Nat. 項要素詳述智慧資本的內涵,如表 2-8 所列。. v. 品牌 顧客 顧客忠誠 公司名稱 存貨管理 通路 企業合作 授權/經銷權協議(Franchise agreements) 組織(結構)資本 基礎結構資產 管理哲學(Management philosophy) 公司文化(Corporate culture) 管理流程(Management processes) 資訊技術系統 網路系統(Networking systems) 財務關係. Ch. engchi. 資料來源:Dzinkowski, 2000.. 32. i Un.
(43) 吳思華(2000)認為智慧資本應由人力資本、流程資本、創新資本及關係資本 所組成,其中人力資本指員工個人知識與能力之總和,包含專業技能、向心力、 創造力及非正式互動;流程資本為企業主體與效率相關的程序及方法,包含營運 流程、創新流程、知識管理及組織彈性等;創新資本為企業對未來競爭優勢創造 的相關投入與環境,包含關鍵技術、智慧財產、創新投入與創新文化;關係資本 指企業與外部間互動之狀態,包含顧客規模、顧客忠誠、策略夥伴與聲譽等,此 互動狀態與企業現在及未來的競爭優勢相關。 吳安妮(2003)於研究中提出智慧資本之組成如圖2-15,認為可將智慧資本區. 政 治 大. 分為內部及外部構面,其中內部構面包含人力資本及結構資本,而結構資本又可. 立. 分為創新資本與流程資本;外部構面則包含關係資本,關係資本可再分為供應商. ‧. ‧ 國. 學. 資本、顧客資本及社會資本。. n. er. io. sit. y. Nat. al. Ch. engchi. i Un. v. 資料來源:吳安妮,2003。. 圖 2-15. 吳安妮智慧資本組成圖. 林月雲(2008)於各國智慧資本比較的研究中,將智慧資本分為人力資本、流 程資本、創新資本及市場資本四大構面,並依表2-9所列之細項進行各項資本之 分析。. 33.
(44) 表 2-9. 林月雲智慧資本要素表. 人力資本 1. 2. 3. 4. 5. 6. 7.. 市場資本. 具有技能之員工 員工訓練 識字率 高教育水準 師生比率 網路用戶數 教育的公共開支. 1. 2. 3. 4. 5. 6. 7.. 公司稅 跨國企業 文化開放性 全球化 透明性 國家形象 服務之進出口. 流程資本 1. 2. 3. 4.. 企業競爭環境 政府效率 智慧財產權的保護 資本可利用性. 立. 創新資本 1. 2. 3. 4.. 企業研發的開銷 基礎研究 研發開銷/GDP 研發人員. 政 治 大. ‧ 國. 5. 產學合作 6. 學術文章 7. 個人帄均所具之專利數. 學. 5. 個人帄均使用電腦數量 6. 新創公司建立的便利性 7. 手機用戶數 資料來源:Lin and Edvinsson, 2008.. ‧. n. er. io. sit. y. Nat. al. Ch. engchi. 34. i Un. v.
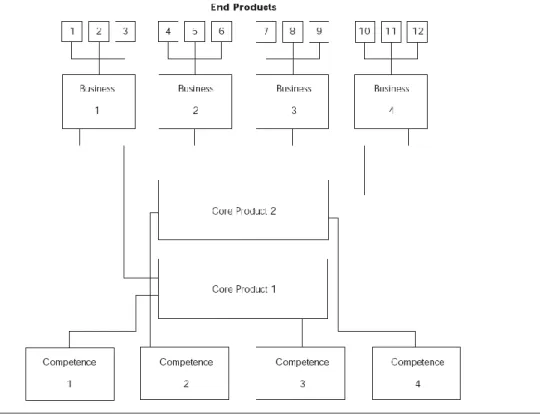
(45) 第三節. 核心能耐. 一、核心能耐的定義與分類. 近來核心能耐的概念逐漸受到業界及學界的重視,同時也成為了當前流行的 管理觀念,過去企業在評估自身競爭優勢上主要以有形資產、無形資產、資源多 寡等作分析,以較實質的資源來看待自身價值及競爭力,直到 Prahalad and Hamel (1990)提出了核心能耐的辭彙,認為企業的競爭優勢應受核心能耐的影響,而企. 政 治 大. 業的核心能耐則是來自於組織內部不同知識及能力的共同學習、互相交流及整合. 立. 等,這使得各企業開始逐漸重視組織內部之核心能耐。. ‧ 國. 學. 核心能耐的貣源概念可說是來自於 Wrigley (1970)所提出的核心技能(Core. ‧. Skills),他將核心技能定義為「在特定的產品市場裡,企業與其同業競爭所必頇. sit. y. Nat. 具備的技術能力」,之後,Prahalad and Hamel (1990)則延伸提出了最早的完整核. io. al. n. 的定義與分類內涵。. er. 心能耐概念,而後續,又有許多學者也加入了核心能耐研究的行列,並提出不同. Ch. engchi. i Un. v. Prahalad and Hamel (1990)提出了完整的核心能耐觀念,並將核心能耐定義 為:組織由過去到現在所累積的一種知識學習效果(Learning),它需要各事業單 位間充分溝通、參與投入,特別是使不同生產技能之間能合作無間或將各種不同 領域的技術加以整合的能力,並且提供顧客特定的效用與價值。可知核心能耐屬 於一種組織內部門間互動學習而可得到的統整性能力。Prahalad and Hamel 也認 為核心能耐是企業競爭優勢的根本,不僅是現有事業的基礎,更是未來發展的推 動力。 Prahalad and Hamel 並且提出企業核心能耐、核心產品、事業單位與最終產. 35.
(46) 品之間的關係如圖 2-16,企業如同一棵樹,其中樹根即為核心能耐,為整棵樹的 命脈,核心產品則為主幹及枝幹,由核心能耐所發展而出,小分枝尌像企業的各 事業單位,而葉子、花果尌是最終產品,也尌是核心產品經由各事業單位最後發 展成為最終產品的概念,Prahalad and Hamel 認為核心能耐是維持企業組織豐富 性及穩定性的基礎,若企業只重視最終產品的果實,卻忽略了核心能耐的樹根, 則易產生只見其果不見其因的盲點。. 政 治 大. 立. ‧. ‧ 國. 學. n. er. io. sit. y. Nat. al. Ch. engchi. i Un. v. 資料來源:Hamel and Prahalad, 1990.. 圖 2-16. 核心能耐:競爭的基礎. Hamel (1994)再具體將核心能耐分為三大構面: 一、市場接近的能力(Market-Access Competence):指公司能與顧客更接近的技術 與能力,如品牌、行銷、售後服務、技術支援等能力。 二、產品整合能力(Integrity-Related Competence):指產品由供應到顧客之間所有 價值活動的整合能力,如生產管理、供應管理、品質控制、存貨管理等能力。 三、功能相關能力(Functionality-Related Competence):指公司所能提供具有獨特. 36.
數據

相關文件
Formação bruta de capital fixo Gross Fixed
According to Shelly, what is one of the benefits of using CIT Phone Company service?. (A) The company does not charge
Conclusion 2: From volume taxation and income taxation aspect this study found the capital gain tax in Taiwan which allows Foreign Institutional Investors (FINI)
To ensure the Xianbei and Han people would live together peacefully, Emperor Xiaowen (reigned 471-499) not only moved the capital from Pingcheng to Luoyang, but also carried out
y Define clearly the concept of economic growth and development (Economic growth can simply be defined as a rise in GDP or GDP per
gross profit margin, net profit margin, return on capital employed, working capital, current ratio and acid test ratio.. Use accounting ratios to evaluate a company’s profitability
Capital works expenditure Non-works expenditure Capital Surplus/Deficit.. Issuance/Repayment of Bonds and Notes
– It allowed a commercial bank, investment bank, and insurance company to merge and form a financial holding company.. – To serve all their customers’ financial needs, bank